Method Article
Insan kök hücresinde M hücre benzeri hücrelerin kaynaklı farklılaşma-türev ıleal Enteroid Monolayers
Bu Makalede
Özet
Bu protokol, insan kök hücresi türeyen ileal monolayerlerde M hücrelerinin farklılaşmasını ve gelişimini değerlendirmek için yöntemleri nasıl açıklar.
Özet
Bağırsak fonksiyonunun M (Mikrokat) hücreleri, apikal lümeninden antijen taşıması için, bağışıklık hücrelerinin ikamet ettikleri ve bu nedenle bağırsak içinde mukozal bağışıklık katkısı olan, altta yatan Peyer 'ın yamalarına ve lamina propria 'ya. M hücrelerinin bağırsak içinde nasıl ayırt edilebilmesi ve M hücrelerinin antijen alımı moleküler mekanizmalarının tam olarak anlaşılması eksiktir. Çünkü M hücreleri bağırsak hücrelerinde nadir bir nüfus ve M hücreleri için in vitro modeller sağlam değildir çünkü. Bağırsağın kendini yenileyen kök hücre kültürü sisteminin keşfi, enteroidler olarak adlandırılan, M hücrelerini kültür için yeni olanaklar sağlamıştır. Onlar, kadeh hücreleri, Paneth hücreleri, enteroendokrin hücreler ve enteranosit dahil olmak üzere bağırsak bulunan birçok ana hücre türlerine ayırt edilebilir çünkü enteroids standart kültürlü hücre hatları üzerinde avantajlı. Sitokin RANKL M hücre geliştirme esastır, ve RANKL ve TNF-α ek Kültür Medya M hücrelere ayırt etmek için ileal enteroids hücrelerin bir alt kümesini teşvik. Aşağıdaki protokol, insan ileal enteroidler kullanılarak bağırsak transwell epitelyal polarize tek tabakalı sistemi M hücrelerinin farklılaşma için bir yöntem açıklanmaktadır. Bu yöntem M hücre geliştirme ve fonksiyon etüdüne uygulanabilir.
Giriş
M (Mikrokat) hücreler, öncelikle folikül ilişkili epitelyum (FAE) küçük lenfoid bölgelerde bağırsaktaki Peyer 'ın yamalar1olarak adlandırılan bulunan özel bağırsak epiteli hücreler vardır. M hücreleri kısa düzensiz apikal mikrovilluslar var ve derin kendi bazolateral tarafında epitelinde, hangi bağışıklık hücrelerinin kendi hücre gövdesine yakından ikamet sağlar2. Bu benzersiz morfoloji, M hücrelerinin bağırsak apikal lümeninden antijen örneklenmesi ve doğrudan altta yatan bağışıklık hücrelerine teslim edilmesini sağlar2. Bu şekilde, M hücreleri bağırsak bağışıklık gözetimi için önemlidir ama ayrıca lamina propria giriş için patojenler tarafından istismar edilebilir1,2,3,4,5, 6,7.
M hücrelerinin çalışma çeşitli faktörler tarafından engellenmiştir. İlk olarak, M hücreleri fare ve insan bağırsak8düşük frekanslı bulunur. Kültürlü hücreler sistemlerinde, M hücre benzeri hücreler, fare Peyer yamaları veya b hücreli lenfoma hücre çizgisinin b lenfositleri ile birlikte bir polarize adenokarsinom hücre hattı, Caco-2, Co-kültürü ile ayırt etmek için indüklenen edilmiştir, k. b9,10 . Bu, M hücre işaretleyicilerini ifade eden caco-2 hücrelerinin bir alt kümesini oluşturmaktadır, polarize epitelyum içinde bir antijen ve UEA-1,9,10. (Bu işaretçileri de bağırsak dokularında kadeh hücrelerinde ifade edilir, bu nedenle günümüzde daha az sıklıkla kesin M hücre işaretçileri olarak kullanılır11,12.) Bu caco-2-M hücre sistemi partikül alımı ve bakteri translokasyon incelemek için kullanılmıştır13,14. Ancak, Caco-2 hücreleri, Caco-2 hücrelerinin farklı kaynaklarının Labs15' in farklı fenotürlerini görüntüleyecek olan, büyük bir bağırsak adenokarsinomunun kurulan bir hücre çizgidir. Ayrıca, onlar şu anda bilinen m hücre işaretçileri GP2 ve spıb16ifadesi eksikliği olarak, tam olarak gerçek m hücrelerinin transkripsiyon düzeylerini özetlemek olmayabilir. Bu nedenle, M hücresi geliştirme ve fonksiyonlarını incelemek için ek ve daha fizyolojik olarak ilgili kültür modelleri gereklidir.
Son on yıl içinde, bağırsaktaki enteroid-türev model sistemlerinin alanı, insan bağırsak biyopsisinden elde edilen bağırsak kök hücrelerinin kültürde kendini yayabilir ve kendi kendine yenileyebildiği ilk keşfinden hızla ileri ilerliyor 17 , 18. önemlisi, büyüme medyadan faktörler teşvik kök hücresi kaldırılması bu kök hücre kültürleri bağırsak18bulunan birçok hücre türlerine ayırt etmek için izin verir. Ayrıca, son çalışmalar bağırsak içinde M hücre gelişimi rankl-Rank sinyalizasyon önemini göstermektedir19,20. Rank reseptörü, bağırsaktaki epitelyal habercisi hücrelerinin üzerine ifade edilen reseptörlerin TNF ailesinin bir üyesidir19 iken rankl (rank reseptör ligand) Peyer 's yamalar stromal hücreler tarafından serbest bırakılır20. İleal enteroidlerde bulunan epitelyal hücre türleri rankl üretemez, ileal enteroid kültürlerde M hücre farklılaşma rankl kültür medyası21,22ilavesi ile indüklenen olabilir. TNFα 'nın kültür ortamına eklenmesi, ileal enteroids23' te M hücresi gelişimini desteklemeye yardımcı olur. Burada, insan ileal enteroidlerden elde edilen bağırsak monolayerlerinde M hücrelerinin farklılaşmasını tetikleyen yöntemler açıklanmaktadır. Yöntemlerimiz aşağıdaki protokoller21,22,23değişiklikleri kısmen dayanır.
Protokol
Burada açıklanan tüm yöntemler Tufts Üniversitesi ıBC ve ıRB tarafından onaylanmıştır.
1. Insan Ileal Enteroid türevi Monolayerlerin M hücre farklılaşma inducing
Not: Bu protokol insan dokusu biyopsisinden elde edilen ileal enteroidleri kullanır. Lütfen bu hücrelerin18,24' ün nasıl büyümesine ve geçişine ilişkin yöntemler için yayımlanan protokollere bakın. Monolayerlerin geliştirilmesi için aşağıdaki yöntemler Zou ve al.24' ten uyarlanmıştır. Ileal enteroid türev kültürlerde M hücrelerinin İndükleme yöntemleri önceki raporlardan21,22,23' e uyarlanmıştır. Tüm çalışmalar steril bir doku kültürü kaputu içinde gerçekleştirilir ve inküler gösterildiği gibi başlık veya doku kültürü kuluçte vardır. Ileal enteroid monolayers ve çeşitli Medias hazırlamak için gerekli malzeme tablosuna bakın.
- 4-10 gün boyunca ekstrasellüler matriks (ECM) (bkz. malzeme tablosu) (Şekil 1), iç büyüme oranlarına bağlı olarak, transwells üzerine tohumlama yapmadan önce ileal enteroidler büyütün.
- Kaplama transwell membranlar
- 24 kuyu plakasında istenilen sayıda transwells yerleştirin ve iki oda sistemi oluşturma.
- Dilüt ECM 25-kat soğuk steril fosfat-tamponlu tuzlu (PBS) ve eklemek 100 μL soğuk seyreltilmiş solüsyon her üst odaya membran üzerine.
Not: ECM ve seyreltilmiş ECM çözeltisi, eklenmeden hemen önce buzda tutulmalıdır. - 24 kuyu plakasını kapak ile Kapla ve plakayı 37 °C ' de bir doku kültürü kuluçinörüne yerleştirin, membranda ECM katılaşma izni vermek için 2 h.
- 2 saat sonra, plakayı kuluçsa ve bir doku kültürü kaputu yerleştirin. Steril Cımbız kullanarak, kalan çözümü yavaşça kaldırmak için her transwell 'i ters çevirin. Hücreler toplanırken membranların kapakta açık olarak hava kurutmasına izin verin (Steps 1.3.1-1.3.11).
- İleal enteroidlerin tek hücrelere dağılılması
- İleal enteroidlerin plakasını kuluçgandan çıkarın ve kültür medyasını vakum aspirasyonu veya pipet ile yavaşça çıkarın.
Not: Yaklaşık 100 sağlıklı kistler içeren ileal enteroidlerin bir kuyusu 1,5-2 kuyuları tohum için yeterlidir. - 500 μL buz soğuk 0,5 mM etylenediaminetetraasetic asit (EDTA) eklemek ECM 'de askıya alınan her iyi ıleal enteroidleri içeren ECM kırmak için. ECM 'yi kırmak için 500 μL olarak ayarlanmış bir P1000 pipettör ile güçlü bir şekilde yukarı ve aşağı pipet yapın, böylece ileal enteroidleri çözüme bırakmaktır. ECM 'nin kesilmesi için, pipetleme işleminden sonra, plakası 4 °C ' de 30 dakika boyunca güçlü bir şekilde sallayın.
- Her iyi 15 mL konik borular içine çözüm toplayın.
Not: Optimum tek hücreli toplama için 15 mL konik tüp başına 10 kuyuya kadar toplayın. - 140 x g ve 4 °c ' de 5 dk. Pelet için santrifüjdeki hücreleri Pelet görünür ama kolayca yerinden edilebilir, bu yüzden yavaşça vakum aspirasyon veya bir pipet ile süpernatant çıkarın.
Not: Pelet ve hücrelerin kaybı hakkında endişe varsa, bir pipet kullanın ve ayrı bir tüp içinde süpernatant kaydedin. - Sıkı kavşak bağlantıları sindirmek ve tek hücrelere ileal enteroidler kırmak için, 500 μL Oda sıcaklığı tripsin içinde Pelet yeniden pelletini adım 1.3.3 toplanan her 5 kuyular başına. Bir P1000 kullanarak, pipet yukarı ve aşağı kümeleri disaggregate ve 5 dk veya daha az için bir 37 °C su banyosunda tüpler inkübe.
Not: Optimizasyonun, hücrelerin kırılması için gerekli süreyi belirlemek için gerekli olan zaman, onlar öleceği noktaya trypsinized değil. Hücre tripsin tedavi sonra uygulanabilir olduğundan emin olmak için adım 1.3.9 Trypan mavi kullanın. - 500 başına% 10 fetal Sığır serum (FBS) ile 1 mL gelişmiş DMEM/F12 ekleyin tripsin inaktive etmek için mg
- 500 μL 'de bir P1000 seti ile yukarı ve aşağı pipet, konik tüpün yan tarafına karşı en az 50 kez, kalan kümeleri tek hücrelere daha fazla parçala.
- Bir 50 mL konik üzerinde bir 40 μm hücre süzgeci yerleştirin ve 1 mL gelişmiş DMEM/F12 ile 10% FBS hücre süzgeci ıslak ekleyin. Tek hücreli süspansiyonu 15 mL 'den süzgecin üzerine pipet yapın. % 10 FBS ile 1 mL gelişmiş DMEM/F12 ile süzgeci yıkayın.
- 50 mL konik yeni bir 15 mL konik tüp içine hücre süzgeci geçti hücreleri aktarın. Santrifüjleme adımında 1.3.10, hücresel Pelet 15 ml konik tüpte daha kolay görülecektir. Bir hemokytometer kullanarak hücreleri saymak. Hücrelerin hala canlı olduğunu doğrulamak için tripan mavisi kullanın. Tipik olarak, >% 95 canlılığı gözlenmektedir.
- Hücreleri sayarken, yeni 15 mL tüpteki hücreleri Santrifüjüne 400 x g ve oda sıcaklığında 5 dk. hücre Pelet görünür olmalıdır. Dikkatlice bir pipet ile süpernatant kaldırmak, yine Pelet yerinden olur durumda süpernatant tasarruf.
- 10 μM Y-27632 ile tamamlayıcı modifiye komple büyüme medya25 (mcmgf + medya) hazırlayın. 2,5 x 105 hücreli/200 ΜL 'de MCMGF + ' da pelletli hücreler resuspend. Hücre tohumlama numarasını en iyi duruma getirme hakkında tartışmada açıklamalar bakın.
Not: MCMGF + medya gelişmiş DMEM/F12 ile 75% L-Wnt3a Klima medya,% 10 R-spondin Klima medya, 5% noggin Klima medya, 1x B27 takviyesi, 1x N2 Supplement, 1 mM N-asetilsistein, 50 ng/mL fare rekombinant EGF, 500 nM A-8301, 10 nM [Leu15]-gastrin ı, 10 mM HEPES, 2 mM GlutaMAX, ve 1x penisilin/streptomisin (opsiyonel). - 1,2 adımda hazırlanan ECM kaplı membranların göz tarafından değerlendirildiği şekilde tamamen kurutulduğundan emin olun. Üst odası 200 μL MCMGF + ile yıkayın. Her üst odaya 200 μL hücre çözeltisi ekleyin.
- Her alt odaya 10 μM Y-27632 ile 700 μL MCMGF + ekleyin. Plakayı 5% CO2Ile 37 °c ' lik doku kültürü küvatörün içine yerleştirin.
- Büyüme 1 gün sonra, üst odasından medya çıkarın ve 200 μL taze MCMGF + ile yerine, birden fazla hücre katmanlarının büyümesini önlemek için.
- İleal enteroidlerin plakasını kuluçgandan çıkarın ve kültür medyasını vakum aspirasyonu veya pipet ile yavaşça çıkarın.
- Orta değiştirme
- Bir kez monolayers ~ 80% konfluent, genellikle gün 1-3 sonrası tohumlama arasında, kontrol kuyuları için farklılaşma medya (DM) ile bazolateral medya yerine (daha fazla ayrıntı için adım 1.4.2 bakın) veya m hücre indüksiyon kuyuları için m hücre medya (daha fazla ayrıntı için adım 1.4.3 bakın). Her iki koşul için üst odada bulunan medyayı DM ile değiştirin.
Not: DM% 5 noggin Klima medya ile gelişmiş DMEM/F12 olduğunu, 1x B27 takviyesi, 1x N2 Supplement, 1 mM N-asetilsistein, 50 ng/mL fare rekombinant EGF, 500 nM A-8301, 10 nM [Leu15]-gastrin ı, 10 mM HEPES tampon, 2 mM GlutaMAX, ve 1x penisilin/streptomisin (opsiyonel ). M hücreli medya DM 200 ng/mL RANKL ve 50 ng/mL TNFα ile desteklenmektedir. - M hücreleri içermeyen kontrol kuyuları için, üst odaya 200 μL DM ve alt odaya 700 μL DM ekleyin.
- M hücrelerini teşvik etmek için, üst odasına 200 μL DM ve alt odaya 700 μL M hücreli medya ekleyin.
- Medyayı her 2 günde bir değiştirin. Kontrol kuyuları için, üst ve alt odalarında DM değiştirin. M hücre kuyuları için, alt odasında üst oda ve M hücre medyasında DM değiştirin.
Not: Gün 7 Post Cell-tohumlama, M hücreleri tam monolayers indüklenir.
- Bir kez monolayers ~ 80% konfluent, genellikle gün 1-3 sonrası tohumlama arasında, kontrol kuyuları için farklılaşma medya (DM) ile bazolateral medya yerine (daha fazla ayrıntı için adım 1.4.2 bakın) veya m hücre indüksiyon kuyuları için m hücre medya (daha fazla ayrıntı için adım 1.4.3 bakın). Her iki koşul için üst odada bulunan medyayı DM ile değiştirin.
2. qRT-PCR ile M hücresi farklılaşmasını doğrulama
Not: Steril bir RNAse-Free tezgah alanında aşağıdaki işi gerçekleştirin. QRT-PCR için tercih edilen malzemelerin listesi için malzeme tablosuna bakın.
- Üst ve alt odalardan medyayı çıkarın ve 300 μL oda sıcaklığında PBS ile üst odası 2x hafifçe yıkayın.
- Her üst odaya 300 μL Trizol ekleyin. Oda sıcaklığında 5 dakika boyunca inkübe.
DIKKAT: üreticinin talimatında belirtildiği gibi cilt ile temas önlemek için Trizol kullanırken eldiven ve göz koruması kullanın. - Bu arada, her iyi için mikrosantrifüjlü tüpler etiket ve her tüp için 700 μL Trizol ekleyin.
- Bir P1000 ile hafifçe yukarı ve aşağı 3x pipetleme ile hücre homojenliği toplayın ve ilgili mikrosantrifüj tüp içine içeriği aktarın. 5 s için Vortex karışımı.
- Örnekleri oda sıcaklığında ilave 3 dakika tutun. Sonra-80 °C ' ye kadar bir aya kadar saklayın.
- RNA yalıtımı, DNase tedavisi, Ters transkripsiyon ve qRT-PCR reaksiyonları için standart qRT-PCR metodolojisi takip edin. Malzeme tablosundaprimer listeye bakın.
3. Immünofluorescence tarafından M hücresi farklılaşmasını doğrulama
Not: Membranlar ıslak kalması için plakanın alt odasını her zaman PBS ile dolu tutun. Bu prosedür Bench üzerinde gerçekleştirilir. İmmünofluorescence için tercih edilen malzemelerin listesi için malzeme tablosunu görün.
- Üst odadan medyayı çıkarın ve 300 μL oda sıcaklığında PBS ile hafifçe 2x yıkayın. 100 μL Oda sıcaklığının 4% PFA cinsinden üst odasına ekleyin. Folyo ile plaka kapağı ve oda sıcaklığında 25 dakika stand izin. % 4 PFA kaldırın.
Dikkat: % 4 PFA tehlikeli kimyasal atık olarak düzgün bir şekilde bertaraf edilmelidir. - Üst odası 3x, 300 μL oda sıcaklığında PBS ile yıkayın. Bu noktada örnekler, boyama işleminden bir ay önce 4 °C ' de kalabilir. Bir kez lekelenmiş, örnekleri en iyi kalitede görüntüler için bir hafta içinde görselleştirilmelidir.
- Monolayerleri 100 μL,% 5 ' lik Sığır serum albumin (BSA) ile PBS 'de 30 dakika boyunca, oda sıcaklığında karanlık olarak çözülür.
- 1:100 bir seyreltme PBS 1% BSA içinde GP2 primer antikor solüsyonu hazırlayın. Ekle 100 μL başına iyi. Karanlıkta oda sıcaklığında 1 saat için leke. Çözümü kaldırın.
Not: M hücrelerinin optimum birincil GP2 yüzey boyama geçirgen olmadan elde edilir çünkü GP2 için birincil leke önce monolayers geçirmez etmeyin. - 300 μL oda sıcaklığında PBS ile üst odası 3x kez yıkayın.
- 1:200 de floresan etiketli keçi Anti-fare IgG ikincil leke solüsyonu hazırlayın, PBS 'de 1:100 ve DAPı 'de% 1 BSA + 0,1% Triton ' da khalloidin. Ekle 100 μL başına iyi. Karanlıkta oda sıcaklığında 30 dakika leke.
Not: Triton, uygun phalloidin lekesi için bu adımda hücreleri nüfuz etmek için ikincil leke çözüme eklenir. - 300 μL PBS ile 3 kat yıkayın.
- Cam kaydırağa 5 μL damla montaj çözeltisi (malzeme tablosu) yerleştirin. 24 kuyu plakasını ve tersine çevirme iyi çıkarın. Dikkatle bir neşter kullanarak kuyunda membran kesti. Membranı, cam slayttaki montaj çözeltisinin damlacığına dönük hücrelerle yerleştirin. Membranın üst ve ortasına 10 μL montaj çözeltisi ekleyin ve cam kaydırağı ile lamel magazini arasındaki membranı mühürlemek için üstüne bir lamel magazini yerleştirin.
- 24 saat boyunca karanlıkta oda sıcaklığında slaytları kurutun. 1 hafta sonrası boyama içinde Konfokal mikroskop üzerinde lekeli slaytlar görüntülenmesi gerekir.
Sonuçlar
ECM 'de yetiştirilen Ileal enteroidler, ıleal enteroid kültürler için ve monolayerlerde kullanım için kalite kontrol aracı olarak göreli sağlık durumu ve farklılaşma durumları için görsel olarak ve QRT-PCR tarafından analiz edilir. ECM 'de yetiştirilen farklılaşılmış ileal enteroidler, birçok kök hücrenin varlığını gösteren, morfolojide net ve kistik görünür (Şekil 1a). Zamanla, büyüme medyasında yetiştirilen farklılaştırılmış ileal enteroidler bazı kistik görünecektir ve bazı opak görünür bir ara fenotip alabilir (Şekil 1B). Sıklıkla, farklılaşmış örneklerimiz şekil 1ayerine şekil 1B 'de gösterilenlere benzer. Bu ara kültürler, enterocayt işaretçisinin ifadesiyle ölçülen daha fazla farklılaşmış enteranosit içerir, Sükraz isomaltaz (sı), ve muhtemelen lümendeki ölü enteranosit ekstrüzyonu yoğun görünüşlerine katkıda bulunur. Ileal enteroidler bu ara durumda tek tabakalı gelişimi için kullanılabilir, ancak kültürlerde bulunan bağırsak kök hücrelerinin miktarının düşük olabilir ve bazı farklılaşan hücre türleri mevcut olabilir akılda tutulması gereken (örneğin, QRT-PCR bkz Şekil 2' deki Şekil 1B 'ye benzeyen ECM 'de yetiştirilen farklılaşılmış örneklerdeki seviyeleri). Karşılaştırmalı olarak, ECM 'de 5 + gün boyunca farklılaşma medyaları ile kültürlü ileal enteroidler, bu morfolojiye uygun şekilde koyu ve lobüler ve kültürler, tohumlama monolayerleri için iyi bir aday değildir (Şekil 1C).
Kök hücreli genler ve bağırsak hücresi farklılaşma genlerinin ifadesi, QRT-PCR tarafından ECM 'de yetiştirilen ileal enteroidlerin sağlık durumunu değerlendirmek için başka bir yol ve bir kez transwells üzerinde monolayers olarak seribaşı farklılaşma yetenekleri analiz edilebilir. Bir kök hücre geni ifadesi, LGR5, bir enterocayt geni, sı, bir kadeh hücre geni, MUC2, ve bir Paneth hücre geni, Lyz, ECM 'de yetiştirilen farklılaşmış ileal enteroid kültürler arasında karşılaştırılır ve ileal farklılaşmış RANKL/TNFα varlığı veya yokluğunda enteroid monolayers (Şekil 2). Değerler deneyler arasında farklılık gösterirken, LGR5 ifadesi, monolayers18,26farklılaşması sonrasında azalmalıdır. LGR5 ifadesi genellikle Rankl ve TNFα olmadan farklılaşan ileal monolayerlerin 7. Tersine, belirli hücre türlerinin farklılaşma işaretçileri ifadesi, böyle sı ve MUC2, farklılaşma sonra artış18. Lyz ifadesi genellikle Kültürlerimizin farklılaşması sonrasında azalır. Eğer monolayerler yapmak için kullanılan ileal enteroid kültürler Figure 1adaha Şekil 1B gibi görünüyor, intestinal farklılaşma işaretçileri artar bu ilk kültürler heterojen çünkü farklılaşma sonra mütevazı olabilir bağırsak hücresi türleri ve daha yüksek bazal düzeyine sahip si ve MUC2. Ancak, monolayerlerin farklılaşma hala LGR5 ifade ve mikroskopi (aşağıya bakınız) kaybı ile değerlendirilir oluşur. Ayrıca, RANKL ve TNFα farklılaşma medyasını eklenmesi LGR5 ifadesinin kaybını azaltır (Şekil 2). Paralel olarak, ifade sı ve MUC2 biraz farklılaşmış durumda daha düşük Rankl ve TNFα rağmen onların seviyeleri farklılaşmış durumun üzerinde artar.
Monolayerlerde m hücresi farklılaşması hem qRT-PCR hem de immünofluoresesans ile hücre yüzeyi glikoprotein 2 (GP2) ve transkripsiyon faktörü Spıb21dahil olmak üzere iki M hücreli spesifik Marker kullanılarak belirlenir. GP2 ve SPıB Ifadesi Rankl ve TNFα varlığında ileal enteroid türevi monolayerlerinde updüzenlenmiş ve Rankl olmayan ve TNFα tedavi örneklerinde algılanmıyor (Şekil 3). Bu işaretçileri ifadesi de küçük bağırsak dokusu bir parçası normalleştirilmiş olabilir22, eğer varsa. Bu, bu M hücre işaretleyicilerinin kat değişikine, bu işaretçilerin hiçbir ifadesine sahip olmayan monolayerleri kontrol etmek yerine M hücrelerine sahip olan dokuya göre karşılaştırılmasına izin verir ve bir laboratuvardaki deneyler arasında standardizasyon sağlar. M hücreleri Ayrıca immünofluorescence tarafından GP2 yüzey ifadesi ile algılanır (Şekil 4). Tipik olarak, bir confluent monolayer içinde, 1 ila 5 M hücreleri, RANKL ve TNFα (Şekil 4a-D) ile tedavi edilen örneklere 6 ile 8 sonrası tohumlama sırasında belirli bir mikroskop alanında 40X büyütmede gözlenir. Tedavi edilmemiş örneklerde hiçbir GP2 ifadesi görülür (Şekil 4E). Bir phalloidin prob ile kaplanmış XZ düzleminin ortogonal görünümü, M hücrelerinin (Şekil 4F-G) apikal yüzeyinde her hücre ve GP2 ifade çevreleyen aktin yapıları gösterir. Bu model, insan bağırsak1,2,8' de bulunan M hücrelerinin düşük frekansını geri atar. Daha fazla çalışma için M hücrelerini arındırmak ve izole etmek için, M hücreleri GP2 yüzey ifadesi kullanılarak lekelenebilir ve GP2 + hücreler için FACS kullanılarak sıralanır.
M hücreleri bağlamak ve epitel altında ikamet eden immün hücrelere intestinal lümenden antijen taşıma2. Bağırsak içinde üretilen salgı IgA bakterilere bağlanır ve mikropların taşınması kolaylaştırmak için M hücrelerinin apikal yüzeyine bağlayabilirsiniz27,28. Bu modelde geliştirilen M hücrelerinin IgA bağlamak mümkün olup olmadığını belirlemek için, insan serumu GA üst odasına eklenir, bağlamak için izin 1 h, ve sonra monolayers immünofluorescence analizi için hazırlanmıştır. M hücrelerinde IgA varlığı insan serum IgA ağır zincir tanıyan bir Fluor konjuge ikincil antikor kullanılarak görselleştirildi. M hücreleri IgA ile 1 h için tedavi edilen IgA apikal yüzeye bağlı (Şekil 5A), ancak kontrol kuyularında m hücreleri sadece Ilga için ikincil antikor ile tedavi edildi ancak algılanamayan sinyal var (Şekil 5B). Ayrıca, IgA özellikle M hücrelerinin apikal yüzeyine bağlar ve herhangi bir hücre GP2 yüzey leke eksik bağlı bulunamadı. Ayrıca, M hücrelerinin apikal yüzeyinde karakteristik olarak daha kısa yoğun aksini vardır2. Bu modelde M hücresi morfolojisi analiz etmek için, ileal enteroid türevi monolayers 7 gün boyunca yetiştirilen ve phalloidin kullanarak F-actin immünofluorescence analizi için hasat. Aktin piksel yoğunluğunun ölçümleri, m hücreleri ve ımagej yazılımı (Şekil 6a) kullanarak her m hücresine doğrudan bitişik olan m olmayan hücreler için hesaplanır. Bu modelde GP2 + M hücrelerinde actin yoğunluğu azalır ve Şekil 6B'de temsili bir görüntü gösterilir. Genel olarak, bu ileal enteroid türetilen Tek tabakalı modelinde geliştirilen M hücreleri karakteristik gen ifadesi, Morfoloji ve insan bağırsak m hücrelerinin bazı m hücre fonksiyonları, IgA bağlayıcı gibi.
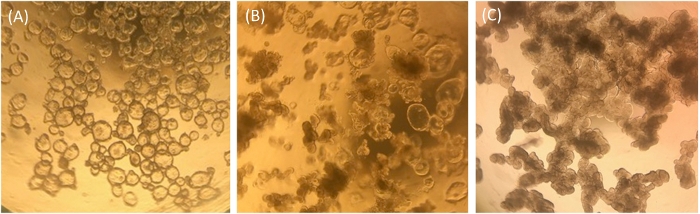
Resim 1: ECM 'de insan ileal enteroidlerin temsili morfolojisi bir hafta sonrası bölünmesi. (A) net ve kistik farklılaşılmış ileal enteroidler. (B) bazı kistik ileal enteroidler ve bazı opak lobüler ileal enteroidler ile ara fenotip. (C) koyu ve lobüler farklılaşılmış ileal enteroidler. Bir iPhone7 kamera kullanarak 4X büyütme ile optik ışık mikroskobu objektifi ile çekilen görüntüler. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
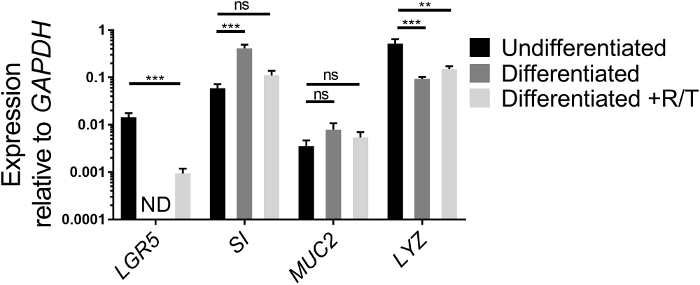
Şekil 2: ECM 'de yetiştirilen veya monolayers olarak ayırt edilen insan ileal enteroidlerin kök hücresi ve farklılaşma Işaretlerinin göreli ifadesi. Ileal enteroidler ECM 'de 7 gün boyunca yetiştirildiler (farklılaşmaz) ya da (ayırt edilmemiş) ya da RANKL ve TNFα (Diferententli + R/T) ile yetişkin ve ayırt edilir. Ileal enteroid kültürler veya monolayers RNA ekstraksiyon için Trizol hasat edildi. Gen ifadesi qRT-PCR tarafından belirlendi ve Gapdh'ye göre ifade edilir. Veriler, koşul başına ileal enteroids veya monolayers 3 bağımsız kuyuların ortalamasıdır. Hata çubukları SEM. ND algılanmıyor gösterir. İstatistiksel önem, Dunnett 'in farklılaşmadan karşılaştırıldığında birden fazla karşılaştırmalar testi ile tek yönlü ANOVA kullanarak günlük dönüştürülmüş değerler üzerinde belirlendi. * * p < 0,01, * * * p < 0,001 lütfen buraya tıklayarak bu figürün daha büyük bir versiyonunu görüntüleyebilirsiniz.
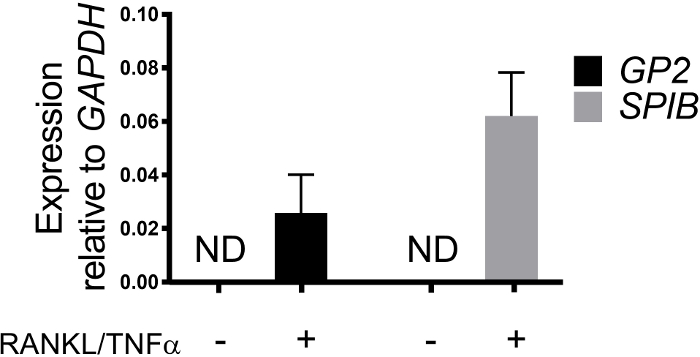
Şekil 3: insan ileal enteroid türevi monolayerlerden M hücresinin spesifik işaretçileri GP2 ve spib göreli ifadesi. Rankl/TNFα tedavi edilmiş ve tedavi edilmemiş insan ileal enteroid türevi monolayer, 7 gün sonrası tohumlama SONRASıNDA RNA ekstraksiyonu Için Trizol 'da hasat edildi. Gen ifadesi qRT-PCR tarafından belirlendi ve Gapdh'ye göre ifade edilir. Veri, koşul başına 6 bağımsız monolayer ortalamasıdır. Hata çubukları SEM. ND algılanmıyor gösterir. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
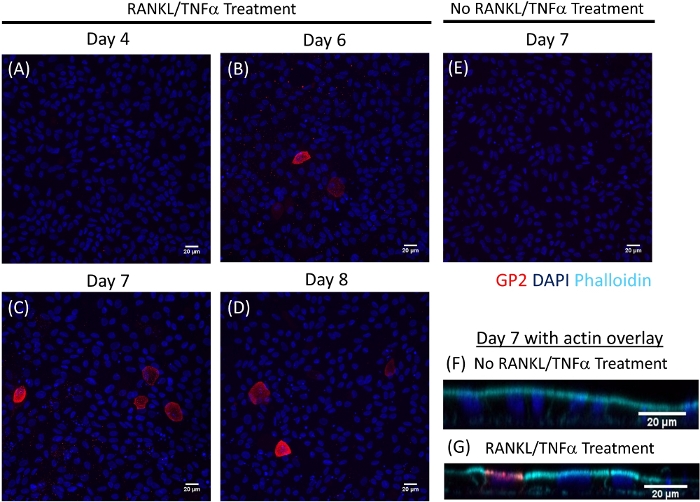
Şekil 4: zaman içinde insan ileal enteroid türevi monolayerlerde M hücrelerinde yüzey GP2 Ifade Immünofluorescence. RANKL/TNFα tedavi edilen ve tedavi edilmeyen insan ileal enteroid türevi monolayerler% 4 PFA 'da düzeltildi ve çeşitli belirtilen günlerde tohumlama sonrası immünofluoresesans için lekelenmiştir. Görseller ımagej yazılımı kullanılarak incelenmiştir. DAPı = mavi; Glikoprotein 2 (GP2) = kırmızı. (A-D) RANKL/TNFα çeşitli günlerde tohumlama sonrası tedavi edilen monolayerler. (E) 7 gün sonrası tohumlama yapılarak işlenmiş olmayan tek tabakalı. (F-G) F-actin için phalloidin prob ile günde 7 sonrası tohumlu monolayers ortogonal XZ düzlem. Phalloidin = mavi. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
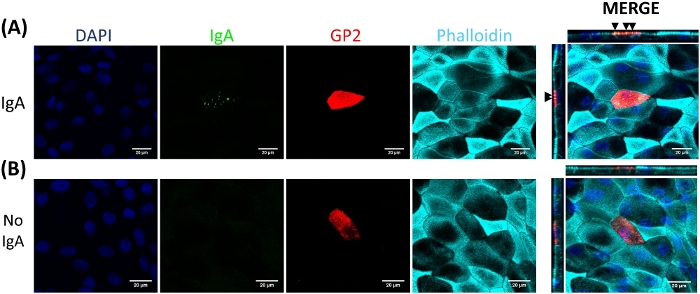
Şekil 5: IgA özellikle M hücrelerinin apikal yüzeyine bağlar. RANKL/TNFα-tedavi edilen insan ileal enteroid türevi monolayers 7 gün boyunca büyüdü ve daha sonra (A) 1 h veya (B) sadece PBS Ile sahte tedavi (No IgA kontrolü) için 10 μg insan serumu ile tedavi edildi. 1 h sonra, monolayers 2x PBS yıkanmış,% 4 PFA,% 0,1 TritonX-100 ile geçirgen ve immünofluorescence için lekelenmiş. Görseller ımagej yazılımı kullanılarak incelenmiştir ve 3 bağımsız deneyin temsilcisidir. DAPı = mavi; Glikoprotein 2 (GP2) = kırmızı; Antikor insan serum IgA = yeşil; Phalloidin = mavi. Siyah oklar M hücre apikal yüzeyine bağlı IgA belirtmek. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
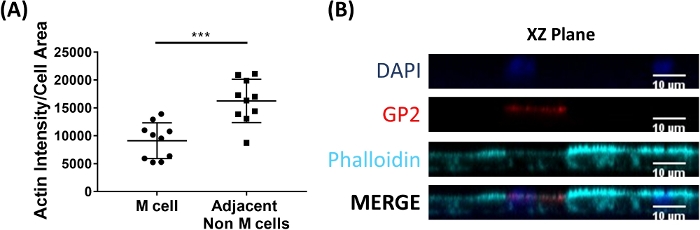
Şekil 6: m hücreleri bitişik olmayan m hücrelerine kıyasla akinin yoğunluğunu azalttı. RANKL/TNFα-işlenmiş insan ileal enteroid türevi monolayers 7 gün boyunca büyüdü ve sonra% 4 PFA sabit ve immünofluorescence için lekelenmiş. (A) ımagej kullanarak, GP2 + M hücreleri FreeHand seçim aracı kullanılarak özetlenmiştir ve alan ve entegre yoğunluk ölçümleri Phalloidin kanalında alınmıştır. Aynı analiz daha sonra M hücresini komşu olan her bitişik olmayan M hücresi için tamamlanmıştır. RAW entegre yoğunluk normalleştirme için her hücrenin alanı tarafından bölünmüştür. Her M hücresi için bitişik her M olmayan hücre için Ortalama entegre yoğunluk/alan hesaplanır. Görseller 3 bağımsız deneyden analiz edildi; Her nokta bir M hücresi veya komşu hücrelerin ortalamasıdır. Hata çubukları SD gösterir. Istatistiksel önem, eşleştirilmiş t testi kullanılarak günlük dönüştürülmüş değerlere göre belirlenmiştir. p = 0,0001 (B) A. görüntülerden XZ düzleminin temsili görüntüsü ımagej yazılımı kullanılarak incelendi. DAPı = mavi; Glikoprotein 2 (GP2) = kırmızı; Phalloidin = mavi. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
Tartışmalar
Önemli bağırsak hücresi türlerine ve M hücrelerine doğru ayırt eden monolayers geliştirmek için, çeşitli faktörlerin farkında olmak önemlidir. Ileal enteroidler, ayırt edilemez olan ECM kültürlerinden hasat edilmelidir ve yüksek Lgr5 + kök hücrelerine sahiptir. Görsel olarak, ECM kültürlerinde ileal enteroidlerin çoğunluğu karanlık ve multilobular olmamalıdır ve bu kültürlerde QRT-PCR analizi ile LGR5 ifadesi tespit edilmelidir. Nitelikli medyanın kalite kontrolü, farklılaşmaz kültürlerin zamanla yayılması için gereklidir ve üretilen her bir toplu ortam için tamamlanmalıdır. Bazı ECM kültürlerinde yeni bir medya grubu test ederek ve ileal enteroidlerin morfolojisini bir hafta boyunca önceki bir medya grubu ile karşılaştırarak kalite kontrolü tamamlanabilir. LGR5 ifade, önceki toplu iş ile karşılaştırıldığında medyanın yeni toplu içinde yetiştirilen ileal enteroid kültürlerde nispeten benzer kalmalı.
Monolayers olarak tohumlama için ileal enteroidlerin hazırlanması sırasında, tek hücrelere ileal enteroidleri kırmak için tripsin ile inkübasyon sonrası hücre çözeltisi şiddetle pipet önemlidir. Hücre kümeleri, monolayers için seribaşı çok katmanlı oluşumuna yol açabilir. Buna ek olarak, elde edilen her bireysel ileal enteroid hattı için bir tek tabakalı oluşturmak için gereken hücre sayısını ampirik olarak belirlemek esastır. Tipik olarak, bu değer 2,5 x 105 – 5,0 x 105 hücreli/kuyu arasında değişebilir, ancak kültürlerde kistik olmayan ileal enteroidlere kistik derecesine bağlıdır ve her bir ileal enteroid hattı için değişir. Deneyimlerden daha az kistik görünen ECM 'de yetiştirilen ileal enteroidler, monolayerlere ulaşmak için daha yüksek hücre tohumlama yoğunluğu gerektirir. Yavaşça yukarı ve aşağı 2-3 kez medya pipetleme ve taze büyüme medya ile yerine tarafından büyüme 1 gün sonra üst odası yıkamak için tavsiye edilir. Bu işlem, çok katmanlı oluşumu olasılığını azaltan diğer hücrelerin üstüne indi hücreleri dislodges. Monolayerler ~ 80% confluent, genellikle 2 sonrası tohumlama oluşur, iyi M hücre farklılaşma elde yardımcı olur zaman büyüme medyadan M hücre ortamına üst odasında medya geçiş. M hücresi indüksiyon sırasında üst odasına rankl/TNFα ilavesi Tek tabakalı başına m hücrelerinin daha fazla sayıda gelişimine yol açmaz ve bu nedenle üst oda medyadan bırakılabilirler. Bu protokolde M hücresi gelişimini etkilemeden farklı Gözenek boyutlarının transwells kullanılabilir; Ancak, hücre tohumlama yoğunluğu daha büyük gözenek boyutları olanlar için optimize edilmelidir. Kollajen IV, belirli uygulamalar için daha uygun olabilir transwells veya iyi plakalar için bir Bodrum membran protein kaplama olarak ECM yerine olabilir.
Ileal enteroid türevi monolayers transkuyu üzerinde tanımlanan apikal ve bazolateral yüzeylerin oluşturulması için izin veren bir iki oda sistemi sağlar, 4-5 farklı türde epitelyal bağırsak hücrelerinin her biri üzerinde yüzey işaretçileri ifade polarize olabilir bağırsak içinde bulunan göreli yan. Parçacıklar, bulaşıcı ajanlar veya diğer hücre tipleri gibi her iki tarafa da ek faktörler eklenebilir. Ancak, bazı sınırlamalar bugüne kadar kalır. Açıklandığı gibi, bu sistem fizyolojik akış, bağırsak kasılmaları ve bağırsak içerikleri bulunmayan statik bir sistemdir. Ayrıca, villus-Crypt mimarisi düz bir monolayer oluşumu ile kaybolur. Bu sistemler Peyer 'ın yama bölgelerinin, bağışıklık hücrelerinin ve stromal hücrelerinden yoksun. M hücrelerinin altında yakın ikamet eden bağışıklık ve stromal hücrelerin eksikliği, bu sistemde gözlemlenmez invaginasyonlar etkiler ve diğer fizyolojik işleyişi araştırma önemli bir gelecek alanıdır. Bu protokol 96-kuyu plakasına veya çok iyi plaka biçimine adapte edilebilir. 96-kuyu plakasını ECM ile kaplamanın ve ileal enteroidlerden tek hücrelerle tohumlama prosedürü, transwells ile aynı kalır. Monolayers elde etmek için gerekli hücre tohumlama yoğunluğu titrasyon yapılmalıdır, ancak genellikle 1,0 x 105 – 3,0 x 105 hücreler/iyi bir 96-iyi plaka formatında değişmektedir. M hücreleri, monolayers% 80 confluent genellikle gün 1-3 ilk hücre tohumlama yoğunluğu bağlı olarak M hücre medya ile büyüme medya değiştirerek indüklenir.
M hücrelerini ileal enteroidler içinde vitro olarak ayıran bu yöntem, Caco-2 yöntemi üzerinde önemli geliştirmeler sağlar. İleal enteroidler primer hücrelerdir ve sistemde en az 4-5 epitelyal hücre çeşidi bulunmaktadır. Ayrıca, farklı insanlardan elde edilen ileal enteroid çizgiler, genetik veya hastalık durumunun M hücresi gelişimini ve davranışlarını nasıl etkilediğini araştırmak için incelenebilir. M hücre farklılaşma sırasında ileal enteroidlerin ek manipülasyon m hücre öncüsü hücreleri karakterize dahil olmak üzere M hücre gelişimi daha iyi bir anlayış sağlayacaktır. Son olarak, m hücreli phagositoz ve transytosis molekül mekanizmaları hala tamamen anlaşılır değildir bu yana3,29, bu model çalışma ve M hücreleri tarafından antijen ve parçacık alımı görselleştirmek için fırsat sağlar.
Açıklamalar
Yazarların ifşa etmesi gereken hiçbir şey yok.
Teşekkürler
Bu çalışma Dr Isberg (Tufts Üniversitesi Tıp Fakültesi) ve Dr kaplan (Tufts Üniversitesi) NıAıD U19AI131126 tarafından desteklenmektedir; (JM proje 2 lideri) ve NıAıD R21AI128093 JM olduğunu. ACF kısmen NIAıD T32AI007077 tarafından destekleniyordu. SEB ve MKE NIAıD U19AI116497-05 tarafından destekleniyor. Mecsas laboratuvarının üyelerine, NG laboratuvarına ve Tufts Üniversitesi Tıp Fakültesi 'nde Dr. Isberg 'e yararlı tartışmalar için teşekkür ederiz. Konfoksel görüntüleme beyin bilimi araştırma Için Tufts merkezi 'nde yapıldı, P30 NS047243.
Malzemeler
| Name | Company | Catalog Number | Comments |
| [Leu15]-Gastrin I | Sigma-Aldrich | G9145 | MCMGF+ and DM ingredient Solvent: PBS Stock Concentration: 10 µM Final Concentration: 10 nM |
| 0.5 M EDTA | Invitrogen | 15575020 | For breaking up ECM Solvent: PBS Stock Concentration: 0.5 M Final Concentration: 0.5 mM |
| 40 µm cell strainer | Corning | 352340 | For excluding clumps from single cells Solvent: Stock Concentration: Final Concentration: |
| A-8301 | Sigma-Aldrich | SML0788-5MG | MCMGF+ and DM ingredient Solvent: DMSO Stock Concentration: 500 µM Final Concentration: 500 nM |
| Advanced DMEM/F12 | Invitrogen | 12634-028 | MCMGF+ and DM Basal medium Solvent: Stock Concentration: Final Concentration: |
| Alexa Fluor 594 goat anti-mouse IgG | Thermo Fisher | A-11005 | For secondary stain Solvent: Stock Concentration: Final Concentration: 1:200 |
| Alexa Fluor 647 Phalloidin | Invitrogen | A22287 | Optional secondary stain for F-actin Solvent: Stock Concentration: Final Concentration: 1:100 |
| B27 Supplement | Invitrogen | 17504-044 | MCMGF+ and DM ingredient Solvent: Stock Concentration: 50x Final Concentration: 1x |
| Bovine Serum Albumin | Chem-Impex | 00535 | 5% for blocking solution Solvent: PBS Stock Concentration: Final Concentration: 0.01 |
| Chloroform | Fisher Scientific | C298-500 | For RNA isolation Solvent: Stock Concentration: Final Concentration: |
| Circle coverslips | Thomas Scientific | 1157B50 | For mounting membrane on glass slide Solvent: Stock Concentration: Final Concentration: |
| DAPI (4′,6-diamidino-2-phenylindole) | Thermo Fisher | 62247 | For secondary stain Solvent: PBS Stock Concentration: 100x Final Concentration: 1x |
| DEPC Treated RNAse free H2O | Fisher Scientific | BP561-1 | For RNA isolation Solvent: Stock Concentration: Final Concentration: |
| DNA Removal Kit | Invitrogen | AM1906 | For RNA isolation Solvent: Stock Concentration: Final Concentration: |
| Ethyl Alcohol, 200 proof | Sigma Aldrich | EX0276-4 | For RNA isolation Solvent: Stock Concentration: Final Concentration: |
| Feather Scalpels | VWR | 100499-580 | For cutting membrane from transwells Solvent: Stock Concentration: Final Concentration: |
| Fetal Bovine Serum (FBS) | Gibco | 26140079 | For inactivating trypsin Solvent: Advanced DMEM/F12 Stock Concentration: 1 Final Concentration: 0.1 |
| Glass slides | Mercedes Scientific | MER 7200/90/WH | For mounting membrane on glass slide Solvent: Stock Concentration: Final Concentration: |
| GlutaMAX | Invitrogen | 35050-061 | MCMGF+ and DM ingredient Solvent: Stock Concentration: 200 mM Final Concentration: 2 mM |
| GP2 Antibody | MBL International | D277-3 | Surface stain for M cells Solvent: Stock Concentration: Final Concentration: 1:100 |
| HEPES | Invitrogen | 15630-080 | MCMGF+ and DM ingredient Solvent: Stock Concentration: 1 M Final Concentration: 10 mM |
| Human Serum IgA | Lee BioSolutions | 340-12-1 | For functional analysis of M cells Solvent: PBS Stock Concentration: 1 mg/mL Final Concentration: 10 µg |
| L-Wnt3a conditioned media | Cell line from ATCC | CRL-2647 | Refer to ATCC Product Sheet for L Wnt3A (ATCC CRL2647) for conditioned media protocol; MCMGF+ ingredient Solvent: Stock Concentration: Final Concentration: 75% in MCMGF+ 0% in DM |
| Matrigel, GFR, phenol free | Corning | 356231 | Extracellular Matrix (ECM) Solvent: Stock Concentration: Final Concentration: |
| Mouse recombinant EGF | Invitrogen | PMG8043 | MCMGF+ and DM ingredient Solvent: PBS Stock Concentration: 50 µg/mL Final Concentration: 50 ng/mL |
| N2 Supplement | Invitrogen | 17502-048 | MCMGF+ and DM ingredient Solvent: Stock Concentration: 100x Final Concentration: 1x |
| N-acetylcysteine | Sigma-Aldrich | A9165-5G | MCMGF+ and DM ingredient Solvent: H2O Stock Concentration: 500 mM Final Concentration: 1 mM |
| Noggin conditioned media | Cell line gift from Dr. Gijs van den Brink (University of Amsterdam) | Ref 30 for conditioned media protocol; MCMGF+ and DM Ingredient Solvent: Stock Concentration: Final Concentration: 5% in MCMGF+ 5% in DM | |
| Paraformaldehyde (PFA) | MP Biomedicals | 2199983 | For fixing monolayers Solvent: PBS Stock Concentration: 0.16 Final Concentration: 0.04 |
| PBS, -Mg, -Ca | Corning | MT21040CV | Solvent for 0.5 mM EDTA Solvent: Stock Concentration: Final Concentration: |
| Penicillin/Streptomycin | Invitrogen | 15140-122 | Optional ingredient of MCMGF+ and DM Solvent: Stock Concentration: 100x Final Concentration: 1x |
| Prolong Gold | Invitrogen | P36930 | Antifade mounting solution Solvent: Stock Concentration: Final Concentration: |
| Qiagen RNeasy Kit | Qiagen | 74106 | For RNA isolation Solvent: Stock Concentration: Final Concentration: |
| Recombinant human RANKL | Peprotech | 310-01 | Used to induce M cells Solvent: H2O Stock Concentration: 0.1 mg/mL Final Concentration: 200 ng/mL |
| Recombinant murine TNFa | Peprotech | 315-01A | Used to induce M cells Solvent: H2O Stock Concentration: 5 mg/mL Final Concentration: 50 ng/mL |
| R-spondin conditioned media | Cell line from Trevigen | 3710-001-01 | Refer to Trevigen Cultrex Rspo1 Cells product manual (HA-R-Spondin1 293T cell line) for conditioned media protocol; MCMGF+ Ingredient Solvent: Stock Concentration: Final Concentration: 10% in MCMGF+ 0% in DM |
| Secondary anti-human IgA antibody | Jackson Immuno Research | 109-545-011 | For secondary stain Solvent: Stock Concentration: Final Concentration: 1:200 |
| Super Script IV Reverse Transcriptase | Thermo Fisher | 18091200 | For conversion of RNA to DNA Solvent: Stock Concentration: Final Concentration: |
| Transwell inserts, 24 well-sized | Greiner Bio-One | 662641 | 0.4 µm pore size Solvent: Stock Concentration: Final Concentration: |
| TritonX-100 | Sigma-Aldrich | T8787 | Not required during GP2 primary stain Solvent: 1% BSA Stock Concentration: Final Concentration: 0.001 |
| TRIzol | Invitrogen | 15596018 | For RNA isolation Solvent: Stock Concentration: Final Concentration: |
| TrypLE Express | Invitrogen | 12605010 | Trypsin for breaking up enteroids into single cells Solvent: Stock Concentration: Final Concentration: |
| Y-27632 | Sigma-Aldrich | Y-0503 | MCMGF+ ingredient on day 0 Solvent: H2O Stock Concentration: 5 mM Final Concentration: 10 µM |
| GAPDH forward primer | CATGAGAAGTATGACAACAGCCT | ||
| GAPDH reverse primer | AGTCCTTCCACGATACCAAAGT | ||
| GP2 forward primer | CAATGTGCCTACCCACTGGA | ||
| GP2 reverse primer | ATGGCACCCACATACAGCAC | ||
| LYZ forward primer | CGCTACTGGTGTAATGATGG | ||
| LYZ reverse primer | TTTGCACAAGCTACAGCATC | ||
| MUC2 forward primer | ATGCCCTTGCGTCCATAACA | ||
| MUC2 reverse primer | AGGAGCAGTGTCCGTCAAAG | ||
| SI forward primer | TCCAGCTACTACTCGTGTGAC | ||
| SI reverse primer | CCCTCTGTTGGGAATTGTTCTG | ||
| SPIB forward primer | CAGCAGCCGCTTTTAGCCAC | ||
| SPIB reverse primer | GCATATGCCGGGGGAACC | ||
| LGR5 forward primer | TCAGTCAGCTGCTCCCGAAT | ||
| LGR5 reverse primer | CGTTTCCCGCAAGACGTAAC |
Referanslar
- Kraehenbuhl, J. P., Neutra, M. R. Epithelial M cells: differentiation and function. Annual Review of Cell and Developmental Biology. 16, 301-332 (2000).
- Neutra, M. R., Frey, A., Kraehenbuhl, J. P. Epithelial M cells: gateways for mucosal infection and immunization. Cell. 86 (3), 345-348 (1996).
- Nakamura, Y., Kimura, S., Hase, K. M. cell-dependent antigen uptake on follicle-associated epithelium for mucosal immune surveillance. Inflammation and Regeneration. 38, 15(2018).
- Clark, M. A., Hirst, B. H., Jepson, M. A. M-cell surface beta1 integrin expression and invasin-mediated targeting of Yersinia pseudotuberculosis to mouse Peyer's patch M cells. Infection and Immunity. 66 (3), 1237-1243 (1998).
- Jensen, V. B., Harty, J. T., Jones, B. D. Interactions of the invasive pathogens Salmonella typhimurium, Listeria monocytogenes, and Shigella flexneri with M cells and murine Peyer's patches. Infection and Immunity. 66 (8), 3758-3766 (1998).
- Jones, B. D., Ghori, N., Falkow, S. Salmonella typhimurium initiates murine infection by penetrating and destroying the specialized epithelial M cells of the Peyer's patches. Journal of Experimental Medicine. 180 (1), 15-23 (1994).
- Marra, A., Isberg, R. R. Invasin-dependent and invasin-independent pathways for translocation of Yersinia pseudotuberculosis across the Peyer's patch intestinal epithelium. Infection and Immunity. 65 (8), 3412-3421 (1997).
- Ohno, H. Intestinal M cells. Journal of Biochemistry. 159 (2), 151-160 (2016).
- Kerneis, S., Bogdanova, A., Kraehenbuhl, J. P., Pringault, E. Conversion by Peyer's patch lymphocytes of human enterocytes into M cells that transport bacteria. Science. 277 (5328), 949-952 (1997).
- Gullberg, E., et al. Expression of specific markers and particle transport in a new human intestinal M-cell model. Biochemical and Biophysical Research Communications. 279 (3), 808-813 (2000).
- Giannasca, P. J., Giannasca, K. T., Leichtner, A. M., Neutra, M. R. Human intestinal M cells display the sialyl Lewis A antigen. Infection and Immunity. 67 (2), 946-953 (1999).
- Jang, M. H., et al. Intestinal villous M cells: an antigen entry site in the mucosal epithelium. Proceedings of the National Academy of Sciences of the United States of America. 101 (16), 6110-6115 (2004).
- Beloqui, A., Brayden, D. J., Artursson, P., Preat, V., des Rieux, A. A human intestinal M-cell-like model for investigating particle, antigen and microorganism translocation. Nature Protocols. 12 (7), 1387-1399 (2017).
- Martinez-Argudo, I., Jepson, M. A. Salmonella translocates across an in vitro M cell model independently of SPI-1 and SPI-2. Microbiology. 154 (Pt 12), 3887-3894 (2008).
- Lee, J. B., et al. Quantitative analysis of lab-to-lab variability in Caco-2 permeability assays. European Journal of Pharmaceutics and Biopharmaceutics. 114, 38-42 (2017).
- Mabbott, N. A., Donaldson, D. S., Ohno, H., Williams, I. R., Mahajan, A. Microfold (M) cells: important immunosurveillance posts in the intestinal epithelium. Mucosal Immunology. 6 (4), 666-677 (2013).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Knoop, K. A., et al. RANKL is necessary and sufficient to initiate development of antigen-sampling M cells in the intestinal epithelium. Journal of Immunology. 183 (9), 5738-5747 (2009).
- Taylor, R. T., et al. Lymphotoxin-independent expression of TNF-related activation-induced cytokine by stromal cells in cryptopatches, isolated lymphoid follicles, and Peyer's patches. Journal of Immunology. 178 (9), 5659-5667 (2007).
- de Lau, W., et al. Peyer's patch M cells derived from Lgr5(+) stem cells require SpiB and are induced by RankL in cultured "miniguts". Molecular and Cellular Biology. 32 (18), 3639-3647 (2012).
- Rouch, J. D., et al. Development of Functional Microfold (M) Cells from Intestinal Stem Cells in Primary Human Enteroids. PloS One. 11 (1), e0148216(2016).
- Wood, M. B., Rios, D., Williams, I. R. TNF-alpha augments RANKL-dependent intestinal M cell differentiation in enteroid cultures. American Journal of Physiology: Cell Physiology. 311 (3), C498-C507 (2016).
- Zou, W. Y., et al. Human Intestinal Enteroids: New Models to Study Gastrointestinal Virus Infections. Methods in Molecular Biology. , (2017).
- Kozuka, K., et al. Development and Characterization of a Human and Mouse Intestinal Epithelial Cell Monolayer Platform. Stem Cell Reports. 9 (6), 1976-1990 (2017).
- Barker, N., et al. Identification of stem cells in small intestine and colon by marker gene Lgr5. Nature. 449 (7165), 1003-1007 (2007).
- Mantis, N. J., et al. Selective adherence of IgA to murine Peyer's patch M cells: evidence for a novel IgA receptor. Journal of Immunology. 169 (4), 1844-1851 (2002).
- Rios, D., et al. Antigen sampling by intestinal M cells is the principal pathway initiating mucosal IgA production to commensal enteric bacteria. Mucosal Immunology. 9 (4), 907-916 (2016).
- Miller, H., Zhang, J., Kuolee, R., Patel, G. B., Chen, W. Intestinal M cells: the fallible sentinels? World Journal of Gastroenterology. 13 (10), 1477-1486 (2007).
- Heijmans, J., et al. ER stress causes rapid loss of intestinal epithelial stemness through activation of the unfolded protein response. Cell Reports. 3 (4), 1128-1139 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır