Method Article
Différenciation induite des cellules m Cell-like dans les monocouches entéroïdes ileal dérivées de cellules souches humaines
Dans cet article
Résumé
Ce protocole décrit comment induire la différenciation des cellules M dans les monocouches ileal dérivés de cellules souches humaines et des méthodes pour évaluer leur développement.
Résumé
M (microfold) cellules de la fonction intestinale pour transporter l'antigène de l'apenaque lumen aux taches sous-jacentes Peyer et lamina propria où les cellules immunitaires résident et contribuent donc à l'immunité muqueuse dans l'intestin. Il manque une compréhension complète de la façon dont les cellules M se différencient dans l'intestin ainsi que les mécanismes moléculaires de l'apport d'antigènes par les cellules M. C'est parce que les cellules M sont une population rare de cellules dans l'intestin et parce que les modèles in vitro pour les cellules M ne sont pas robustes. La découverte d'un système de culture auto-renouvellement des cellules souches de l'intestin, appelé entéroïdes, a fourni de nouvelles possibilités pour la culture des cellules M. Les entéroïdes sont avantageux par rapport aux lignées cellulaires cultivées standard, car ils peuvent être différenciés en plusieurs types de cellules majeures trouvés dans l'intestin, y compris les cellules de gobelet, les cellules paneth, les cellules entéroendocrines et les entéroocytes. La cytokine RANKL est essentielle dans le développement des cellules M, et l'ajout de RANKL et de TNF-M d'être des médias culturels favorise un sous-ensemble de cellules issues d'entéroïdes iléaux pour se différencier en cellules M. Le protocole suivant décrit une méthode pour la différenciation des cellules de M dans un système de monocouche polarisé épithélial de transwell de l'intestin utilisant les entéroïdes ileal humains. Cette méthode peut être appliquée à l'étude du développement et de la fonction des cellules M.
Introduction
Les cellules M (microfold) sont des cellules épithéliales intestinales spécialisées trouvées principalement dans l'épithélium associé au follicule (FAE) de l'intestin susfuge de petites régions lymphoïdes appelées patchs de Peyer1. Les cellules M ont de courts microvilli apaïques irréguliers et sont profondément invaginated sur leur côté basolatéral, qui permet aux cellules immunitaires de résider étroitement à leur corps cellulaire2. Cette morphologie unique permet aux cellules M d'échantillonner l'antigène du lumen apical de l'intestin et de le livrer directement aux cellules immunitaires sous-jacentes2. De cette façon, les cellules M sont importantes pour la surveillance immunitaire dans l'intestin, mais peuvent également être exploitées par des agents pathogènes pour l'entrée dans la lamina propria1,2,3,4,5, 6,7.
L'étude des cellules M a été entravée par plusieurs facteurs. Tout d'abord, les cellules M se trouvent à basse fréquence dans la souris et l'intestin humain8. Dans les systèmes de cellules cultivées, les cellules M-comme les cellules ont été induites pour différencier en co-congturing une ligne polarisée de cellules d'adénocarcinome, Caco-2, avec des lymphocytes B des corrections de la souris Peyer ou la ligne de cellules de lymphome de cellules De cellules B, Raji B9,10 . Il en résulte un sous-ensemble de cellules Caco-2 qui expriment les marqueurs de cellules M Sialyl Lewis A antigène et UEA-1 dans l'épithélium polarisé9,10. (Ces marqueurs sont également exprimés sur les cellules de gobelet dans les tissus intestinaux, de sorte que de nos jours sont moins fréquemment utilisés comme marqueurs cellulaires M définitifs11,12.) Ce système cellulaire Caco-2-M a été utilisé pour étudier l'utilisation des particules et la translocation des bactéries13,14. Cependant, les cellules Caco-2 sont une lignée cellulaire établie à partir d'un grand adénocarcinome intestinal avec le facteur de confusion que différentes sources de cellules Caco-2 afficher différents phénotypes parmi les laboratoires15. En outre, ils peuvent ne pas récapituler complètement les niveaux de transcription des vraies cellules M, car ils manquent d'expression des marqueurs de cellules M actuellement connus GP2 et SpiB16. Par conséquent, des modèles de culture supplémentaires et plus physiologiquement pertinents sont nécessaires pour être en mesure d'étudier le développement et les fonctions des cellules M.
Au cours des dix dernières années, le domaine des systèmes modèles dérivés de l'entéroïde de l'intestin a rapidement progressé depuis la découverte initiale que les cellules souches intestinales dérivées de la biopsie intestinale humaine pourraient s'auto-propager et se renouveler en culture 17 Annonces , 18. Fait important, l'élimination des facteurs de promotion des cellules souches du support de croissance permet à ces cultures de cellules souches de se différencier en différents types de cellules trouvés dans l'intestin18. En outre, des travaux récents suggèrent l'importance de la signalisation RANKL-RANK dans le développement des cellules M dans l'intestin19,20. Le récepteur RANK est un membre de la famille Des récepteurs TNF qui s'exprime sur les cellules précurseurs épithéliales dans l'intestin19 tandis que RANKL (ligand récepteur RANK) est libéré par les cellules stromales des patchs du Peyer20. Puisque les types épithélial de cellules présents dans les entéroïdes iléaux ne produisent pas RANKL, la différenciation de cellules de M dans les cultures entéroïdes ileal peut être induite par l'addition de RANKL au média de culture21,22. L'inclusion de TNF dans les médias culturels aide à soutenir le développement des cellules M dans les entéroïdes ileal23. Ici, nous décrivons les méthodes pour induire la différenciation des cellules de M dans les monocouches intestinaux dérivés des entéroïdes ileal humains. Nos méthodes sont basées en partie sur les modifications des protocoles suivants21,22,23.
Protocole
Toutes les méthodes décrites ici ont été approuvées par le BAC et la CISR de l'Université Tufts.
1. Induire la différenciation des cellules M chez les monocouches entéroïdes
REMARQUE: Ce protocole utilise des entéroïdes iléaux dérivés de la biopsie des tissus humains. S'il vous plaît se référer à des protocoles publiés pour les méthodes sur la façon de croître et de passage de ces cellules18,24. Les méthodes suivantes pour développer des monocouches ont été adaptées de Zou et coll.24. Les méthodes d'induire les cellules M dans les cultures entéroïdes ileal ont été adaptées des rapports précédents21,22,23. Tout le travail est effectué dans une hotte stérile de culture de tissu et les incubations sont dans le capot ou l'incubateur de culture de tissu comme indiqué. Voir Tableau des matériaux nécessaires pour préparer les monocouches entéroïdes ileal et divers médias.
- Cultivez des entéroïdes iléaux pendant 4-10 jours dans la matrice extracellulaire (ECM) (voir tableau des matériaux) (figure 1), selon leurs taux de croissance intrinsèques, avant d'ensemencer sur les transwells.
- Membranes transwell de revêtement
- Placez le nombre désiré de transwells dans une plaque de 24 puits créant un système à deux chambres.
- Diluer eCM 25 fois dans la saline stérile froide tamponnée de phosphate (PBS) et ajouter 100 L de solution diluée à froid dans chaque chambre supérieure sur la membrane.
REMARQUE: La solution ECM et ECM diluée doit être maintenue sur la glace jusqu'à l'ajout immédiat. - Couvrir la plaque de 24 puits avec le couvercle et placer la plaque dans un incubateur de culture tissulaire à 37 oC pendant 2 h pour permettre la solidification de l'ECM sur la membrane.
- Après 2 h, retirer la plaque de l'incubateur et la placer dans une hotte de culture tissulaire. À l'aide d'une pince stérile, inverser chaque transwell pour enlever délicatement la solution restante. Laissez les membranes sécher à l'air dans le capot avec le couvercle ouvert pendant que les cellules sont recueillies (Étapes 1.3.1- 1.3.11).
- Dissociation des entéroïdes iléaux en cellules individuelles
- Retirez la plaque d'entéroïdes iléaux de l'incubateur et retirez délicatement le support culturel de chaque puits par aspiration sous vide ou avec une pipette.
REMARQUE: Un puits d'entéroïdes iléaux contenant environ 100 kystes sains est suffisant pour semer 1,5-2 puits. - Ajouter 500 l'acide éthylènetetacetic (EDTA) de 500 ll d'acide éthylènediaminetetraacetic (EDTA) à chaque puits contenant des entéroïdes iléaux suspendus dans l'ECM pour briser l'ECM. Pipette de haut en bas vigoureusement avec un pipettor P1000 réglé à 500 L pour briser ECM libérant ainsi des entéroïdes ileal dans la solution. Pour améliorer la dissolution de l'ECM, après la tuyauterie, secouer la plaque vigoureusement à 4 oC pendant 30 min.
- Recueillir la solution de chaque puits dans des tubes coniques de 15 ml.
REMARQUE: Recueillir jusqu'à 10 puits par tube conique de 15 ml pour une collecte optimale à cellule unique. - Pelleter les cellules dans une centrifugeuse à 140 x g et 4 oC pendant 5 min. Pellet doit être visible, mais peut facilement être délogé, afin d'enlever lentement le supernatant par aspiration sous vide ou avec une pipette.
REMARQUE: En cas de perte de granulés et de cellules, utilisez une pipette et enregistrez le supernatant dans un tube séparé. - Pour digérer les liaisons de jonction serrées et décomposer les entéroïdes iléaux en cellules simples, suspendez la pastille dans 500 ll de trypsine à température ambiante pour chaque 5 puits collectés à l'étape 1.3.3. À l'aide d'un P1000, pipette de haut en bas pour désagréger les amas et couver les tubes dans un bain d'eau de 37 oC pendant 5 min ou moins.
REMARQUE: L'optimisation est nécessaire pour déterminer la quantité appropriée de temps nécessaire pour incuber les tubes de sorte que les cellules sont brisées mais pas sur-trypsinized au point qu'ils meurent. Utilisez Trypan bleu dans l'étape 1.3.9 pour s'assurer que les cellules sont viables après le traitement de la trypsine. - Ajouter 1 ml de DMEM/F12 avancé avec 10% de sérum bovin fœtal (SF) par 500 l de trypsine pour inactiver la trypsine.
- Pipette de haut en bas avec un P1000 réglé à 500 L au moins 50 fois contre le côté du tube conique pour désagréger davantage les amas restants en cellules simples.
- Placez une passoire cellulaire de 40 m sur une carte conique de 50 ml et ajoutez 1 ml de DMEM/F12 avancé avec 10 % de FBS pour mouiller la passoire cellulaire. Pipette la suspension à cellule unique de la conique de 15 ml sur la passoire. Laver la passoire avec 1 ml de DMEM/F12 avancé avec 10% DE FBS.
- Transférer les cellules qui sont passées par la passoire cellulaire de la conique de 50 ml dans un nouveau tube conique de 15 ml. Pendant l'étape de centrifugation 1.3.10, le granule cellulaire sera plus facilement vu dans un tube conique de 15 ml. Comptez les cellules à l'aide d'un hémocytomètre. Utilisez Trypan bleu pour vérifier que les cellules sont toujours en vie. En règle générale, la viabilité de l'indice des 95 % est observée.
- En comptant les cellules, centrifuger les cellules dans le nouveau tube de 15 ml à 400 x g et la température ambiante pendant 5 min. Le granule cellulaire doit être visible. Retirez soigneusement le supernatant à l'aide d'une pipette, en sauvant à nouveau le supernatant au cas où la pastille se délogerait.
- Préparer les supports de croissance complets modifiés25 (médias MCMGFMD) complétés par 10 M Y-27632. Resuspendre les cellules granulées à 2,5 x 105 cellules/200 l dans MCMGFMD. Voir les remarques en discussion sur l'optimisation du nombre d'ensemencement des cellules.
REMARQUE: Les médias MCMGFMD sont Des médias d'advanced DMEM/F12 avec 75 % de supports conditionnés L-Wnt3a, 10% R-spondin support conditionné, 5% Noggin médias conditionnés, 1x B27 Supplément, 1x N2 Supplément, 1 mM N-acetylcysté, 50 ng/mL souris recombinant EGF, 500 nM A-8301, 10 nM [Leu15]-Gastrin I, 10 mM HEPES, 2 mM GlutaMAX et 1x Pénicilline/Streptomycine (facultatif). - Assurez-vous que les membranes recouvertes d'ECM préparées à l'étape 1.2 ont été entièrement séchées, selon l'évaluation par l'œil. Laver la chambre haute avec 200 l de MCMGFMD. Ajouter 200 l de solution cellulaire dans chaque chambre supérieure.
- Ajouter 700 l de MCMGFMD avec 10 M Y-27632 à chaque chambre inférieure. Placer la plaque dans un incubateur de culturetissulaire de 37 oC avec 5 % de CO 2.
- Après 1 jour de croissance, retirez les supports de la chambre haute et remplacez-les par 200 L de MCMGFMD frais, afin d'éviter la croissance de plusieurs couches cellulaires.
- Retirez la plaque d'entéroïdes iléaux de l'incubateur et retirez délicatement le support culturel de chaque puits par aspiration sous vide ou avec une pipette.
- Remplacement du milieu
- Une fois que les monocouches sont des confluents de 80 %, habituellement entre les jours 1-3 après l'ensemencement, remplacez les médias basolatéral par des supports de différenciation (DM) pour les puits de contrôle (voir l'étape 1.4.2 pour plus de détails) ou avec le support cellulaire M pour les puits d'induction des cellules M (voir l'étape 1.4.3 pour plus de détails). Remplacer les médias de la Chambre haute par DM pour les deux conditions.
REMARQUE: DM est Advanced DMEM/F12 avec 5% de médias conditionnés Noggin, 1x Supplément B27, 1x N2 Supplément, 1 mM N-acetylcysteine, 50 ng/mL souris recombinant EGF, 500 nM A-8301, 10 nM [Leu15]-Gastrin I, 10 mM HEPES Buffer, 2 mM GlutaMAX, et 1x Penicillin/Streptomycin (facultatif ). Le média cellulaire M est complété par 200 ng/mL RANKL et 50 ng/mL TNFMD. - Pour les puits de contrôle qui ne doivent pas contenir de cellules M, ajouter 200 L de DM à la chambre supérieure et 700 L DM à la chambre inférieure.
- Pour induire les cellules M, ajouter 200 L de DM à la chambre supérieure et 700 'L de m'un de support cellulaire à la chambre inférieure.
- Remplacez les médias tous les 2 jours. Pour les puits de contrôle, remplacez DM dans les chambres supérieures et inférieures. Pour les puits de cellules M, remplacez DM dans la chambre haute et les supports de cellule M dans la chambre basse.
REMARQUE: Au jour 7 après l'ensemencement cellulaire, les cellules M sont entièrement induites dans les monocouches.
- Une fois que les monocouches sont des confluents de 80 %, habituellement entre les jours 1-3 après l'ensemencement, remplacez les médias basolatéral par des supports de différenciation (DM) pour les puits de contrôle (voir l'étape 1.4.2 pour plus de détails) ou avec le support cellulaire M pour les puits d'induction des cellules M (voir l'étape 1.4.3 pour plus de détails). Remplacer les médias de la Chambre haute par DM pour les deux conditions.
2. Vérification de la différenciation des cellules M par qRT-PCR
REMARQUE: Effectuer le travail suivant dans un espace de banc stérile sans RNAse. Voir Tableau des matériaux pour une liste de matériaux préférés pour qRT-PCR.
- Retirez le support des chambres supérieures et inférieures et lavez la chambre supérieure 2x doucement à l'intérieur de 300 l'une de LA de PBS à température ambiante.
- Ajouter 300 l de Trizol à chaque chambre supérieure. Incuber à température ambiante pendant 5 min.
CAUTION: Portez des gants et une protection oculaire lorsque vous utilisez le Trizol pour éviter tout contact avec la peau, comme l'indiquent les instructions du fabricant. - Pendant ce temps, étiquetez les tubes de microcentrifuge pour chaque puits et ajoutez 700 l de Trizol à chaque tube.
- Recueillir l'homogénéisation cellulaire en pipetting de haut en bas 3x doucement avec un P1000 et transférer le contenu dans le tube microcentrifuge correspondant. Vortex pour 5 s à mélanger.
- Conserver les échantillons à température ambiante pendant 3 min supplémentaires. Ensuite, entreposez-le à -80 oC jusqu'à un mois.
- Suivez la méthodologie qRT-PCR standard pour l'isolement de l'ARN, le traitement DNase, la transcription inverse et les réactions qRT-PCR. Reportez-vous à la liste des amorces dans tableau des matériaux.
3. Vérification de la différenciation des cellules M par immunofluorescence
REMARQUE: Gardez toujours la chambre inférieure de la plaque remplie de PBS afin que les membranes restent humides. Cette procédure est effectuée sur le banc. Voir Tableau des matériaux pour une liste de matériaux préférés pour l'immunofluorescence.
- Retirer le support de la chambre haute et laver 2x doucement avec 300 ll de PBS à température ambiante. Ajouter 100 ll de température ambiante 4% PFA en PBS à la chambre supérieure. Couvrir la plaque de papier d'aluminium et laisser reposer 25 min à température ambiante. Supprimer 4% DE PFA.
CAUTION : 4 % de PFA doivent être éliminés correctement en tant que déchets chimiques dangereux. - Laver la chambre supérieure 3x avec 300 lde de PBS à température ambiante. À ce stade, les échantillons peuvent rester à 4 oC jusqu'à un mois avant la coloration. Une fois tachés, les échantillons doivent être visualisés dans une semaine pour les images de meilleure qualité.
- Incuber les monocouches avec 100 oL de 5% d'albumine bovine (BSA) dissous en PBS pendant 30 min dans l'obscurité à température ambiante pour bloquer les monocouches.
- Préparer la solution d'anticorps primaire GP2 en 1% BSA dans PBS à une dilution de 1:100. Ajouter 100 l par puits. Tache pendant 1 h à température ambiante dans l'obscurité. Retirez la solution.
REMARQUE: Ne perméabize les monocouches avant la tache primaire pour GP2 se produit parce que la coloration primaire optimale de surface de GP2 des cellules M est réalisée sans perméabilisation. - Laver la chambre supérieure 3 fois avec 300 ll de PBS à température ambiante.
- Préparer la solution de tache secondaire de la chèvre fluorescente étiquetée anti-souris IgG à 1:200, phalloidin à 1:100 et DAPI dans 1% BSA 0.1% triton dans PBS. Ajouter 100 l par puits. Tache pendant 30 min à température ambiante dans l'obscurité.
REMARQUE: Triton est ajouté à la solution de tache secondaire pour perméabilize les cellules pendant cette étape pour la tache appropriée de phalloidin. - Laver 3x avec 300 L PBS.
- Placer une goutte de 5 ll de solution de montage (Table of Materials) sur une lame de verre. Retirer le puits de la plaque de 24 puits et l'inverser. Couper soigneusement la membrane du puits à l'aide d'un scalpel. Placez la membrane avec les cellules orientées vers le haut sur la gouttelette de la solution de montage sur la glissière de verre. Ajouter 10 l de solution de montage sur le dessus et le centre de la membrane et placer un bordereau sur le dessus pour sceller la membrane entre la glissière de verre et la glissière de couverture.
- Sécher les glissières à température ambiante dans l'obscurité pendant 24 h. Les lames tachées doivent être visualisées au microscope confocal dans une semaine après la coloration.
Résultats
Les entéroïdes ileal cultivés en ECM sont analysés visuellement et par qRT-PCR pour leur état de santé relatif et leurs états de différenciation comme moyen de contrôle de la qualité pour les cultures entéroïdes ileal et pour une utilisation dans les monocouches. Les entéroïdes ileal indifférenciés cultivés en ECM semblent clairs et cystiques dans la morphologie, ce qui indique la présence de nombreuses cellules souches (figure 1A). Au fil du temps, les entéroïdes ileal indifférenciés cultivés dans les milieuis de croissance peuvent prendre un phénotype intermédiaire où certains apparaîtront kystiques et d'autres semblent opaques (figure 1B). Fréquemment, nos échantillons indifférenciés ressemblent à ceux de la figure 1B plutôt que de la figure 1A. Ces cultures intermédiaires contiennent des entéroocytes plus différenciés en phase terminale, mesurés par l'expression du marqueur entéroocyte, l'isomaltase sucrase (SI), et les entéroocytes morts probablement extrudés dans le lumen contribuent à leur apparence dense. Les entéroïdes ileal peuvent être utilisés dans cet état intermédiaire pour le développement de monocouches, mais il faut garder à l'esprit que la quantité de cellules souches intestinales présentes dans les cultures peut être faible, et certains types de cellules différenciées peuvent être présents (par exemple, voir qRT-PCR dans des échantillons indifférenciés cultivés en ECM ressemblant à la figure 1B de la figure 2). À titre de comparaison, les entéroïdes illéaux cultivés avec des supports de différenciation en ECM pendant plus de 5 jours apparaîtront uniformément obscurcis et lobulaires et les cultures avec cette morphologie ne sont pas de bons candidats pour l'ensemencement des monocouches (Figure 1C).
L'expression des gènes des cellules souches et des gènes de la différenciation des cellules intestinales peut être analysée par qRT-PCR comme un autre moyen d'évaluer l'état de santé des entéroïdes iléaux cultivés en ECM et leurs capacités de différenciation une fois ensemencées comme monocouches sur les transwells. L'expression d'un gène de cellules souches, LGR5, un gène entéroocyte, SI, un gène de cellules de gobelet, MUC2, et un gène de cellules de Paneth, LYZ,est comparée entre les cultures entéroïdes ileal indifférenciées cultivées dans ECM et différenciées ileal monocouches entéroïdes en présence ou en absence de RANKL/TNFMD (Figure 2). Bien que les valeurs puissent différer d'une expérience à l'autre, l'expression de LGR5 devrait diminuer après la différenciation des monocouches18,26. L'expression LGR5 n'est généralement pas détectée dans les monocouches ileal différenciées sans RANKL et TNFMD avant le jour 7. Inversement, l'expression des marqueurs de différenciation de types de cellules spécifiques, tels que SI et MUC2, augmentent après différenciation18. L'expression de LYZ diminue généralement après la différenciation dans nos cultures. Si les cultures entéroïdes iléales utilisées pour faire ressembler les monocouches ressemblent plus à la figure 1B qu'à la figure 1A,l'augmentation des marqueurs de différenciation intestinale peut être modeste après différenciation parce que ces cultures initiales sont hétérogènes dans les types de cellules intestinales et ont un niveau basal plus élevé de SI et MUC2. Cependant, la différenciation dans les monocouches se produit toujours comme évaluée par la perte de l'expression de LGR5 et de la microscopie (voir ci-dessous). De plus, l'ajout de RANKL et de TNFMD aux supports de différenciation réduit la perte d'expression LGR5 (figure 2). En parallèle, l'expression de SI et muC2 sont légèrement inférieures à celles de l'état différencié sans RANKL et TNFMD, bien que leurs niveaux augmentent au-dessus de l'état indifférencié.
La différenciation des cellules M dans les monocouches est déterminée à la fois par qRT-PCR et immunofluorescence à l'aide de deux marqueurs spécifiques des cellules M, y compris la glycoprotéine de surface cellulaire 2 (GP2) et le facteur de transcription SpiB21. L'expression du GP2 et du SPIB est régulée dans les monocouches ileal dérivées de l'entéroïde en présence de RANKL et de TNMD et n'est pas détectée dans les échantillons non traités par LE RANKL et le TNMD (figure 3). L'expression de ces marqueurs peut également être normalisée à un morceau de tissu intestinal grêle22,si disponible. Cela permet de comparer le pli de ces marqueurs cellulaires M aux tissus qui ont des cellules M plutôt que de contrôler les monocouches qui n'ont aucune expression de ces marqueurs et permet la normalisation entre les expériences dans un laboratoire. Les cellules M sont également détectées par l'expression de surface du GP2 par immunofluorescence (figure 4). Typiquement, dans une monocouche confluente, des cellules de 1 à 5 M sont observées dans un champ de microscope donné à un grossissement de 40X par jours 6 à 8 post-ensemencement dans des échantillons traités avec RANKL et TNMD (Figure 4A-D). Aucune expression GP2 n'est visible dans les échantillons non traités (figure 4E). La vue orthogonale du plan XZ recouverte d'une sonde phalloidin montre les structures d'actine entourant chaque cellule et l'expression GP2 sur la surface apicale des cellules M (Figure 4F-G). Ce modèle récapitule la basse fréquence des cellules M trouvées dans l'intestin humain1,2,8. Pour purifier et isoler les cellules M pour une étude plus approfondie, les cellules M peuvent être tachées à l'aide de l'expression de surface GP2 et triées à l'aide de FACS pour les cellules GP2.
Les cellules M se lient et transportent l'antigène du lumen intestinal aux cellules immunitaires résidant sous l'épithélium2. L'IgA sécréteur produit dans l'intestin se lie aux bactéries et peut se lier à la surface aconique des cellules M pour faciliter le transport des microbes27,28. Pour déterminer si les cellules M développées dans ce modèle sont capables de se lier à IgA, le sérum humain IgA est ajouté à la chambre supérieure, autorisé à se lier pendant 1 h, puis les monocouches sont préparés pour l'analyse d'immunofluorescence. La présence d'IgA sur les cellules M est visualisée à l'aide d'un anticorps secondaire conjugué au fluor qui reconnaît la chaîne lourde du sérum humain IgA. Les cellules M traitées avec IgA pendant 1 h ont igA lié à la surface apaïque (Figure 5A), tandis que les cellules M dans les puits témoins qui ont seulement été traités avec l'anticorps secondaire à IgA n'ont pas de signal détectable (Figure 5B). En outre, IgA se lie spécifiquement à la surface apicale des cellules M et n'est pas trouvé lié à toutes les cellules dépourvues de tache de surface GP2. En outre, les cellules M ont caractéristiquement plus courte actine dense sur leur surface apical2. Pour analyser la morphologie de cellules de M dans ce modèle, les monocouches entéroïdes-dérivés d'ilesont sont cultivées pendant 7 jours et moissonneuses pour l'analyse d'immunofluorescence de F-actin utilisant le phalloidin. Les mesures de l'intensité du pixel d'actine sont calculées pour les cellules M et pour les cellules non M qui sont directement adjacentes à chaque cellule M à l'aide du logiciel ImageJ (Figure 6A). L'intensité de l'actine est réduite sur les cellules GP2 M dans ce modèle et une image représentative est montrée dans la figure 6B. Dans l'ensemble, les cellules M développées dans ce modèle de monocouche entéroïde ileal ont l'expression génétique caractéristique, la morphologie et certaines fonctions de cellules M des cellules M intestinales humaines, telles que la liaison à L'IgA.
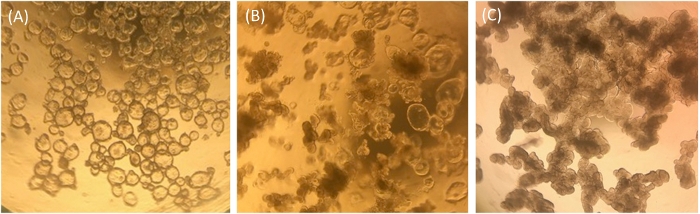
Figure 1 : Morphologie représentative des entéroïdes ileal humains en ECM une semaine après le fractionnement. (A) Entéroïdes ileal sinissous clairs et cystiques indifférenciés. (B) Phénotype intermédiaire avec certains entéroïdes iléoïdes kystiques et certains entéroïdes illéoïdes lobulaires opaques. (C) Entéroïdes ileal différenciés foncés et lobulaires. Images prises à travers l'objectif d'un microscope à lumière optique à grossissement 4x à l'aide d'un appareil photo iPhone7. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
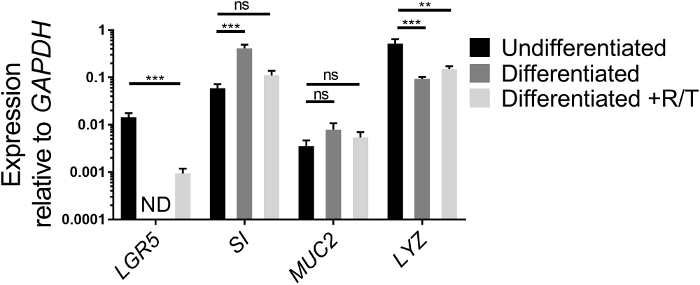
Figure 2 : Expression relative des cellules souches et marqueurs de différenciation des entéroïdes iléoïdes humains cultivés en ECM ou différenciés en monocouches. Les entéroïdes ileal ont été cultivés pendant 7 jours en ECM (Indifférencié) ou cultivés et différenciés en monocouches sans (différencié) ou avec RANKL et TNF (Différenciés R/T). Des cultures d'entéroïdes ileal ou des monocouches ont été récoltées dans Trizol pour l'extraction d'ARN. L'expression génique a été déterminée par qRT-PCR et est exprimée par rapport à GAPDH. Les données sont en moyenne de 3 puits indépendants d'entéroïdes ileal ou de monocouches par condition. Les barres d'erreur indiquent que SEM. ND n'est pas détecté. L'importance statistique a été déterminée sur les valeurs transformées en journaux à l'aide d'ANOVA à sens unique avec le test de comparaisons multiples de Dunnett comparant à l'Indifférencié. P 'lt; 0.01, 'p 'lt; 0.001 S'il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
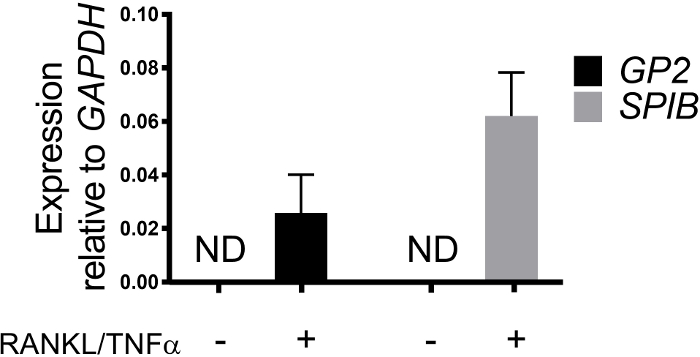
Figure 3 : Expression relative des marqueurs spécifiques aux cellules M GP2 et SPIB à partir de monocouches ileales humaines dérivées de l'entéroïde. Des monocouches irénoïdes ileoïdes humaines traitées et non traitées de RANKL/TNMD ont été récoltées dans le Trizol pour l'extraction d'ARN après 7 jours après l'ensemencement. L'expression génique a été déterminée par qRT-PCR et est exprimée par rapport à GAPDH. Les données sont en moyenne de 6 monocouches indépendants par condition. Les barres d'erreur indiquent que SEM. ND n'est pas détecté. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
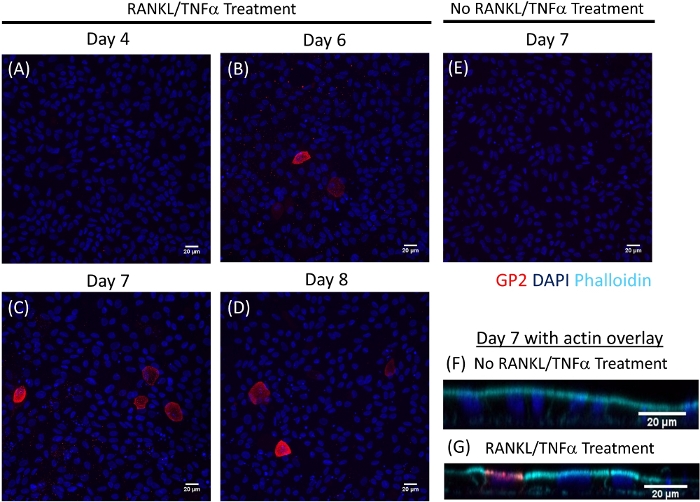
Figure 4 : Immunofluorescence de l'expression GP2 de surface sur des cellules de M dans les monocouches entéroïdes-dérivés humains au fil du temps. Les monocouches irédoïdes ileoïdes humaines traitées et non traitées de RANKL/TNMD ont été fixées dans 4 % de PFA et tachées pour immunofluorescence sur divers jours indiqués après l'ensemencement. Les images ont été analysées à l'aide du logiciel ImageJ. DAPI - Bleu; Glycoprotéine 2 (GP2) - Rouge. (A-D) Les monocouches traités par RANKL/TNMD à divers jours après l'ensemencement. (E) Monocouche non traitée récoltée au jour 7 après l'ensemencement. (F-G) Avion orthogonale XZ des monocouches au jour 7 post-ensemencement recouvert de sonde de phalloidin pour F-actin. Phalloidin et Cyan. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
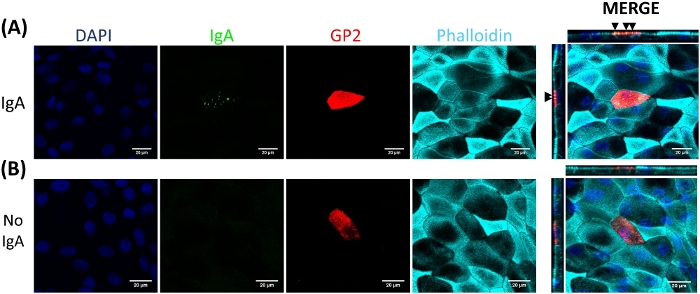
Figure 5 : L'IgA se lie spécifiquement à la surface apicale des cellules M. Les monocouches ileoïdes ileoïdes traitées par RANKL/TNFont ont été cultivées pendant 7 jours, puis (A) ont été traitées avec 10 g de sérum humain IgA pendant 1 h ou (B) traité avec PBS seulement (aucun contrôle IgA). Après 1 h, des monocouches ont été lavées 2x dans PBS, ont été fixées dans le PFA de 4%, perméabilisées avec 0.1% TritonX-100, et souillées pour l'immunofluorescence. Les images ont été analysées à l'aide du logiciel ImageJ et sont représentatives de 3 expériences indépendantes. DAPI - Bleu; Glycoprotéine 2 (GP2) - Rouge; Anticorps au sérum humain IgA - Vert; Phalloidin et Cyan. Les flèches noires dénotent igA lié à la surface apicale de la cellule M. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
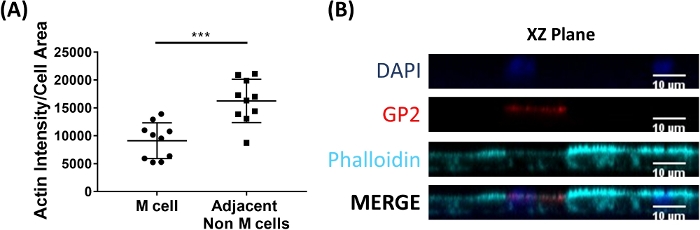
Figure 6 : Les cellules M ont réduit l'intensité de l'actine par rapport aux cellules adjacentes non M. Les monocouches ileoïdes ileoïdes humains traitées par RANKL/TNMD ont été cultivées pendant 7 jours, puis fixées en 4 % de PFA et ont été tachées pour l'immunofluorescence. (A) À l'aide d'ImageJ, les cellules GP2M ont été décrites à l'aide de l'outil de sélection à main levée et des mesures de la zone et de la densité intégrée ont été prises dans le canal Phalloidin. La même analyse a ensuite été effectuée pour chaque cellule adjacente non M qui se trouve à côté de la cellule M. La densité intégrée brute a été divisée par la zone de chaque cellule individuelle pour la normalisation. La densité/zone intégrée moyenne a été calculée pour chaque cellule non M adjacente pour chaque cellule M. Les images ont été analysées à partir de 3 expériences indépendantes; chaque point est une cellule M ou une moyenne des cellules voisines. Les barres d'erreur indiquent SD. L'importance statistique a été déterminée sur les valeurs transformées en journal à l'aide d'un test T apparié. p - 0,0001 (B) Image représentative de XZ Plane de l'intrigue dans A. Les images ont été analysées à l'aide du logiciel ImageJ. DAPI - Bleu; Glycoprotéine 2 (GP2) - Rouge; Phalloidin et Cyan. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
Pour développer des monocouches qui se différencient correctement dans les principaux types de cellules intestinales et les cellules M, il est essentiel d'être conscient de plusieurs facteurs. Les entéroïdes iléaux doivent être récoltés dans des cultures ECM qui sont indifférenciées et qui ont une forte proportion de cellules souches Lgr5MD. Visuellement, la majorité des entéroïdes iléaux dans les cultures d'ECM ne devraient pas être obscurcis et multilobulaires, et l'expression de LGR5 devrait être détectée dans ces cultures par l'analyse qRT-PCR. Le contrôle de la qualité des supports conditionnés est essentiel à la propagation de cultures indifférenciées au fil du temps et doit être complété pour chaque lot de supports conditionnés qui est produit. Le contrôle de la qualité peut être complété en testant un nouveau lot de médias sur certaines cultures ECM et en comparant la morphologie des entéroïdes iléaux à un lot précédent de médias au cours d'une semaine. L'expression LGR5 devrait rester relativement similaire dans les cultures entéroïdes ileales cultivées dans le nouveau lot de médias par rapport au lot précédent.
Pendant la préparation des entéroïdes iléaux pour l'ensemencement en tant que monocouches, il est important de pipette vigoureusement la solution cellulaire après l'incubation avec la trypsine pour briser les entéroïdes iléaux en cellules simples. Les amas cellulaires peuvent entraîner une formation multicouche lorsqu'ils sont ensemencés pour les monocouches. En outre, il est essentiel de déterminer empiriquement le nombre de cellules nécessaires pour former une monocouche pour chaque lignée entéroïde ileal individuelle qui est obtenue. Typiquement, cette valeur peut varier de 2,5 x 105 - 5,0 x 105 cellules/bien, mais dépend du degré d'entéroïdes ileal systiques à non-kystiques dans les cultures et varie pour chaque lignée entéroïde ileal individuelle. D'expérience, les entéroïdes iléaux cultivés en ECM qui semblent moins cystiques nécessitent une densité d'ensemencement cellulaire plus élevée pour atteindre des monocouches. Il est conseillé de laver la chambre haute après 1 jour de croissance en pipetting doucement les médias de haut en bas 2-3 fois et en remplaçant par des supports de croissance frais. Ce processus déloge les cellules qui ont atterri sur d'autres cellules réduisant la probabilité de formation multicouche. Le passage des médias de la chambre haute des supports de croissance aux supports cellulaires M lorsque les monocouches sont des confluents de 80 %, qui se produit habituellement au jour 2 après l'ensemencement, aide à obtenir une bonne différenciation des cellules M. L'ajout de RANKL/TNFMD à la chambre supérieure pendant l'induction de la cellule M ne conduit pas au développement d'un plus grand nombre de cellules M par monocouche et peut donc être laissé hors du support de la chambre supérieure. Des transpuits de tailles de pores variables peuvent être utilisés dans ce protocole sans affecter le développement des cellules M; cependant, la densité d'ensemencement des cellules doit être optimisée pour ceux qui ont de plus grandes tailles de pores. Le collagène IV peut être substitué à l'ECM comme revêtement de protéine de membrane de sous-sol pour les transwells ou les plaques de puits qui peuvent être mieux adaptées à certaines applications.
Les monocouches ileal entéroïdes sur les transwells fournissent un système à deux chambres qui permet la création de surfaces apical et basolatérales définies de telle sorte que les 4-5 différents types de cellules intestinales épithéliales peuvent se polariser pour exprimer des marqueurs de surface sur chaque par rapport à celle trouvée dans l'intestin. D'autres facteurs peuvent être ajoutés à l'un ou l'autre côté tels que les particules, les agents infectieux, ou d'autres types de cellules. Toutefois, à ce jour, certaines limites subsistent. Comme décrit, ce système est un système statique qui manque de flux physiologique, contractions intestinales, et le contenu intestinal. En outre, l'architecture villus-crypt est perdue par la formation d'un monocouche plat. Ces systèmes n'ont pas les régions patch de Peyer, les cellules immunitaires et les cellules stromales. Si le manque des cellules immunitaires et stromales résidant étroitement sous les cellules de M affecte les invaginations qui ne sont pas observées dans ce système et d'autres fonctionnement physiologique est un secteur futur important d'investigation. Ce protocole peut être adapté à une plaque de 96 puits ou à un format de plaque multi-puits. La procédure pour enrober la plaque de 96 puits avec eCM et l'ensemencement avec des cellules simples des entéroïdes iléaux reste la même que pour les transwells. La titration de la densité d'ensemencement cellulaire requise pour obtenir des monocouches doit être effectuée, mais elle varie généralement de 1,0 x 105 à 3,0 x 10 cellules/puits dans un format de plaque de 96 puits. Les cellules M sont induites en remplaçant le support de croissance par le support cellulaire M lorsque les monocouches sont 80% confluents généralement par les jours 1-3 en fonction de la densité initiale de l'ensemencement cellulaire.
Cette méthode de différenciation des cellules M des entéroïdes ileal in vitro apporte des améliorations significatives par-dessus la méthode Caco-2. Les entéroïdes iléaux sont des cellules primaires et au moins 4-5 types de cellules épithéliales sont présents dans le système. En outre, les lignées entéroïdes iléales dérivées de différentes personnes peuvent être étudiées pour étudier comment la génétique ou l'état de la maladie influencent le développement et le comportement des cellules M. La manipulation additionnelle des entéroïdes iléaux pendant la différenciation de cellules de M permettra une meilleure compréhension du développement de cellules de M comprenant caractérisant des cellules de Cellules de M cellules de cellules. Enfin, puisque les mécanismes moléculaires de la phagocytose des cellules M et de la transcytose ne sont pas encore complètement compris3,29, ce modèle offre la possibilité d'étudier et de visualiser l'apport d'antigène et de particules par les cellules M.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Ce travail a été soutenu par NIAID U19AI131126 au Dr Isberg (Tufts University School of Medicine) et au Dr Kaplan (Tufts University); (JM est le leader du projet 2) et NIAID R21AI128093 à JM. ACF a été soutenu en partie par NIAID T32AI007077. SEB et MKE ont reçu le soutien de NIAID U19AI116497-05. Nous remercions les membres du laboratoire Mecsas, du laboratoire Ng et du Dr Isberg de l'École de médecine de l'Université Tufts pour leurs discussions utiles. L'imagerie confocale a été réalisée au Tufts Center for Neuroscience Research, P30 NS047243.
matériels
| Name | Company | Catalog Number | Comments |
| [Leu15]-Gastrin I | Sigma-Aldrich | G9145 | MCMGF+ and DM ingredient Solvent: PBS Stock Concentration: 10 µM Final Concentration: 10 nM |
| 0.5 M EDTA | Invitrogen | 15575020 | For breaking up ECM Solvent: PBS Stock Concentration: 0.5 M Final Concentration: 0.5 mM |
| 40 µm cell strainer | Corning | 352340 | For excluding clumps from single cells Solvent: Stock Concentration: Final Concentration: |
| A-8301 | Sigma-Aldrich | SML0788-5MG | MCMGF+ and DM ingredient Solvent: DMSO Stock Concentration: 500 µM Final Concentration: 500 nM |
| Advanced DMEM/F12 | Invitrogen | 12634-028 | MCMGF+ and DM Basal medium Solvent: Stock Concentration: Final Concentration: |
| Alexa Fluor 594 goat anti-mouse IgG | Thermo Fisher | A-11005 | For secondary stain Solvent: Stock Concentration: Final Concentration: 1:200 |
| Alexa Fluor 647 Phalloidin | Invitrogen | A22287 | Optional secondary stain for F-actin Solvent: Stock Concentration: Final Concentration: 1:100 |
| B27 Supplement | Invitrogen | 17504-044 | MCMGF+ and DM ingredient Solvent: Stock Concentration: 50x Final Concentration: 1x |
| Bovine Serum Albumin | Chem-Impex | 00535 | 5% for blocking solution Solvent: PBS Stock Concentration: Final Concentration: 0.01 |
| Chloroform | Fisher Scientific | C298-500 | For RNA isolation Solvent: Stock Concentration: Final Concentration: |
| Circle coverslips | Thomas Scientific | 1157B50 | For mounting membrane on glass slide Solvent: Stock Concentration: Final Concentration: |
| DAPI (4′,6-diamidino-2-phenylindole) | Thermo Fisher | 62247 | For secondary stain Solvent: PBS Stock Concentration: 100x Final Concentration: 1x |
| DEPC Treated RNAse free H2O | Fisher Scientific | BP561-1 | For RNA isolation Solvent: Stock Concentration: Final Concentration: |
| DNA Removal Kit | Invitrogen | AM1906 | For RNA isolation Solvent: Stock Concentration: Final Concentration: |
| Ethyl Alcohol, 200 proof | Sigma Aldrich | EX0276-4 | For RNA isolation Solvent: Stock Concentration: Final Concentration: |
| Feather Scalpels | VWR | 100499-580 | For cutting membrane from transwells Solvent: Stock Concentration: Final Concentration: |
| Fetal Bovine Serum (FBS) | Gibco | 26140079 | For inactivating trypsin Solvent: Advanced DMEM/F12 Stock Concentration: 1 Final Concentration: 0.1 |
| Glass slides | Mercedes Scientific | MER 7200/90/WH | For mounting membrane on glass slide Solvent: Stock Concentration: Final Concentration: |
| GlutaMAX | Invitrogen | 35050-061 | MCMGF+ and DM ingredient Solvent: Stock Concentration: 200 mM Final Concentration: 2 mM |
| GP2 Antibody | MBL International | D277-3 | Surface stain for M cells Solvent: Stock Concentration: Final Concentration: 1:100 |
| HEPES | Invitrogen | 15630-080 | MCMGF+ and DM ingredient Solvent: Stock Concentration: 1 M Final Concentration: 10 mM |
| Human Serum IgA | Lee BioSolutions | 340-12-1 | For functional analysis of M cells Solvent: PBS Stock Concentration: 1 mg/mL Final Concentration: 10 µg |
| L-Wnt3a conditioned media | Cell line from ATCC | CRL-2647 | Refer to ATCC Product Sheet for L Wnt3A (ATCC CRL2647) for conditioned media protocol; MCMGF+ ingredient Solvent: Stock Concentration: Final Concentration: 75% in MCMGF+ 0% in DM |
| Matrigel, GFR, phenol free | Corning | 356231 | Extracellular Matrix (ECM) Solvent: Stock Concentration: Final Concentration: |
| Mouse recombinant EGF | Invitrogen | PMG8043 | MCMGF+ and DM ingredient Solvent: PBS Stock Concentration: 50 µg/mL Final Concentration: 50 ng/mL |
| N2 Supplement | Invitrogen | 17502-048 | MCMGF+ and DM ingredient Solvent: Stock Concentration: 100x Final Concentration: 1x |
| N-acetylcysteine | Sigma-Aldrich | A9165-5G | MCMGF+ and DM ingredient Solvent: H2O Stock Concentration: 500 mM Final Concentration: 1 mM |
| Noggin conditioned media | Cell line gift from Dr. Gijs van den Brink (University of Amsterdam) | Ref 30 for conditioned media protocol; MCMGF+ and DM Ingredient Solvent: Stock Concentration: Final Concentration: 5% in MCMGF+ 5% in DM | |
| Paraformaldehyde (PFA) | MP Biomedicals | 2199983 | For fixing monolayers Solvent: PBS Stock Concentration: 0.16 Final Concentration: 0.04 |
| PBS, -Mg, -Ca | Corning | MT21040CV | Solvent for 0.5 mM EDTA Solvent: Stock Concentration: Final Concentration: |
| Penicillin/Streptomycin | Invitrogen | 15140-122 | Optional ingredient of MCMGF+ and DM Solvent: Stock Concentration: 100x Final Concentration: 1x |
| Prolong Gold | Invitrogen | P36930 | Antifade mounting solution Solvent: Stock Concentration: Final Concentration: |
| Qiagen RNeasy Kit | Qiagen | 74106 | For RNA isolation Solvent: Stock Concentration: Final Concentration: |
| Recombinant human RANKL | Peprotech | 310-01 | Used to induce M cells Solvent: H2O Stock Concentration: 0.1 mg/mL Final Concentration: 200 ng/mL |
| Recombinant murine TNFa | Peprotech | 315-01A | Used to induce M cells Solvent: H2O Stock Concentration: 5 mg/mL Final Concentration: 50 ng/mL |
| R-spondin conditioned media | Cell line from Trevigen | 3710-001-01 | Refer to Trevigen Cultrex Rspo1 Cells product manual (HA-R-Spondin1 293T cell line) for conditioned media protocol; MCMGF+ Ingredient Solvent: Stock Concentration: Final Concentration: 10% in MCMGF+ 0% in DM |
| Secondary anti-human IgA antibody | Jackson Immuno Research | 109-545-011 | For secondary stain Solvent: Stock Concentration: Final Concentration: 1:200 |
| Super Script IV Reverse Transcriptase | Thermo Fisher | 18091200 | For conversion of RNA to DNA Solvent: Stock Concentration: Final Concentration: |
| Transwell inserts, 24 well-sized | Greiner Bio-One | 662641 | 0.4 µm pore size Solvent: Stock Concentration: Final Concentration: |
| TritonX-100 | Sigma-Aldrich | T8787 | Not required during GP2 primary stain Solvent: 1% BSA Stock Concentration: Final Concentration: 0.001 |
| TRIzol | Invitrogen | 15596018 | For RNA isolation Solvent: Stock Concentration: Final Concentration: |
| TrypLE Express | Invitrogen | 12605010 | Trypsin for breaking up enteroids into single cells Solvent: Stock Concentration: Final Concentration: |
| Y-27632 | Sigma-Aldrich | Y-0503 | MCMGF+ ingredient on day 0 Solvent: H2O Stock Concentration: 5 mM Final Concentration: 10 µM |
| GAPDH forward primer | CATGAGAAGTATGACAACAGCCT | ||
| GAPDH reverse primer | AGTCCTTCCACGATACCAAAGT | ||
| GP2 forward primer | CAATGTGCCTACCCACTGGA | ||
| GP2 reverse primer | ATGGCACCCACATACAGCAC | ||
| LYZ forward primer | CGCTACTGGTGTAATGATGG | ||
| LYZ reverse primer | TTTGCACAAGCTACAGCATC | ||
| MUC2 forward primer | ATGCCCTTGCGTCCATAACA | ||
| MUC2 reverse primer | AGGAGCAGTGTCCGTCAAAG | ||
| SI forward primer | TCCAGCTACTACTCGTGTGAC | ||
| SI reverse primer | CCCTCTGTTGGGAATTGTTCTG | ||
| SPIB forward primer | CAGCAGCCGCTTTTAGCCAC | ||
| SPIB reverse primer | GCATATGCCGGGGGAACC | ||
| LGR5 forward primer | TCAGTCAGCTGCTCCCGAAT | ||
| LGR5 reverse primer | CGTTTCCCGCAAGACGTAAC |
Références
- Kraehenbuhl, J. P., Neutra, M. R. Epithelial M cells: differentiation and function. Annual Review of Cell and Developmental Biology. 16, 301-332 (2000).
- Neutra, M. R., Frey, A., Kraehenbuhl, J. P. Epithelial M cells: gateways for mucosal infection and immunization. Cell. 86 (3), 345-348 (1996).
- Nakamura, Y., Kimura, S., Hase, K. M. cell-dependent antigen uptake on follicle-associated epithelium for mucosal immune surveillance. Inflammation and Regeneration. 38, 15(2018).
- Clark, M. A., Hirst, B. H., Jepson, M. A. M-cell surface beta1 integrin expression and invasin-mediated targeting of Yersinia pseudotuberculosis to mouse Peyer's patch M cells. Infection and Immunity. 66 (3), 1237-1243 (1998).
- Jensen, V. B., Harty, J. T., Jones, B. D. Interactions of the invasive pathogens Salmonella typhimurium, Listeria monocytogenes, and Shigella flexneri with M cells and murine Peyer's patches. Infection and Immunity. 66 (8), 3758-3766 (1998).
- Jones, B. D., Ghori, N., Falkow, S. Salmonella typhimurium initiates murine infection by penetrating and destroying the specialized epithelial M cells of the Peyer's patches. Journal of Experimental Medicine. 180 (1), 15-23 (1994).
- Marra, A., Isberg, R. R. Invasin-dependent and invasin-independent pathways for translocation of Yersinia pseudotuberculosis across the Peyer's patch intestinal epithelium. Infection and Immunity. 65 (8), 3412-3421 (1997).
- Ohno, H. Intestinal M cells. Journal of Biochemistry. 159 (2), 151-160 (2016).
- Kerneis, S., Bogdanova, A., Kraehenbuhl, J. P., Pringault, E. Conversion by Peyer's patch lymphocytes of human enterocytes into M cells that transport bacteria. Science. 277 (5328), 949-952 (1997).
- Gullberg, E., et al. Expression of specific markers and particle transport in a new human intestinal M-cell model. Biochemical and Biophysical Research Communications. 279 (3), 808-813 (2000).
- Giannasca, P. J., Giannasca, K. T., Leichtner, A. M., Neutra, M. R. Human intestinal M cells display the sialyl Lewis A antigen. Infection and Immunity. 67 (2), 946-953 (1999).
- Jang, M. H., et al. Intestinal villous M cells: an antigen entry site in the mucosal epithelium. Proceedings of the National Academy of Sciences of the United States of America. 101 (16), 6110-6115 (2004).
- Beloqui, A., Brayden, D. J., Artursson, P., Preat, V., des Rieux, A. A human intestinal M-cell-like model for investigating particle, antigen and microorganism translocation. Nature Protocols. 12 (7), 1387-1399 (2017).
- Martinez-Argudo, I., Jepson, M. A. Salmonella translocates across an in vitro M cell model independently of SPI-1 and SPI-2. Microbiology. 154 (Pt 12), 3887-3894 (2008).
- Lee, J. B., et al. Quantitative analysis of lab-to-lab variability in Caco-2 permeability assays. European Journal of Pharmaceutics and Biopharmaceutics. 114, 38-42 (2017).
- Mabbott, N. A., Donaldson, D. S., Ohno, H., Williams, I. R., Mahajan, A. Microfold (M) cells: important immunosurveillance posts in the intestinal epithelium. Mucosal Immunology. 6 (4), 666-677 (2013).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Knoop, K. A., et al. RANKL is necessary and sufficient to initiate development of antigen-sampling M cells in the intestinal epithelium. Journal of Immunology. 183 (9), 5738-5747 (2009).
- Taylor, R. T., et al. Lymphotoxin-independent expression of TNF-related activation-induced cytokine by stromal cells in cryptopatches, isolated lymphoid follicles, and Peyer's patches. Journal of Immunology. 178 (9), 5659-5667 (2007).
- de Lau, W., et al. Peyer's patch M cells derived from Lgr5(+) stem cells require SpiB and are induced by RankL in cultured "miniguts". Molecular and Cellular Biology. 32 (18), 3639-3647 (2012).
- Rouch, J. D., et al. Development of Functional Microfold (M) Cells from Intestinal Stem Cells in Primary Human Enteroids. PloS One. 11 (1), e0148216(2016).
- Wood, M. B., Rios, D., Williams, I. R. TNF-alpha augments RANKL-dependent intestinal M cell differentiation in enteroid cultures. American Journal of Physiology: Cell Physiology. 311 (3), C498-C507 (2016).
- Zou, W. Y., et al. Human Intestinal Enteroids: New Models to Study Gastrointestinal Virus Infections. Methods in Molecular Biology. , (2017).
- Kozuka, K., et al. Development and Characterization of a Human and Mouse Intestinal Epithelial Cell Monolayer Platform. Stem Cell Reports. 9 (6), 1976-1990 (2017).
- Barker, N., et al. Identification of stem cells in small intestine and colon by marker gene Lgr5. Nature. 449 (7165), 1003-1007 (2007).
- Mantis, N. J., et al. Selective adherence of IgA to murine Peyer's patch M cells: evidence for a novel IgA receptor. Journal of Immunology. 169 (4), 1844-1851 (2002).
- Rios, D., et al. Antigen sampling by intestinal M cells is the principal pathway initiating mucosal IgA production to commensal enteric bacteria. Mucosal Immunology. 9 (4), 907-916 (2016).
- Miller, H., Zhang, J., Kuolee, R., Patel, G. B., Chen, W. Intestinal M cells: the fallible sentinels? World Journal of Gastroenterology. 13 (10), 1477-1486 (2007).
- Heijmans, J., et al. ER stress causes rapid loss of intestinal epithelial stemness through activation of the unfolded protein response. Cell Reports. 3 (4), 1128-1139 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon