Method Article
トリマーエピトーププレゼンテーションを必要とするワクチンに対する大腸菌の自己組織化タンパク質ナノ粒子の産生
要約
ここでは、ワクチン開発に使用する自己組織化タンパク質ナノ粒子(SAPN)の精製、再折りたたみ、および特性評価について詳しく説明します。
要約
自己組織化タンパク質ナノ粒子(SAPN)は、反復抗原ディスプレイとして機能し、異なる感染症に対する幅広いワクチンの開発に使用できます。この記事では、三重コンフォメーションで抗原を提示できる6らせん束(SHB)アセンブリを含むSAPNコアを生成する方法を示します。大腸菌系におけるSHB-SAPNの発現と、必要なタンパク質精製工程について述べる。残留細菌リポ多糖を低減するイソプロパノール洗浄工程を盛り込んだ。タンパク質同一性および純度の指標として、タンパク質はウェスタンブロット分析において公知のモノクローナル抗体と反応した。再折りたたみ後、粒子の大きさは予想範囲(20~100nm)に入り、動的光散乱、ナノ粒子追跡解析、透過電子顕微鏡によって確認されました。ここで説明する方法論は SHB-SAPN 用に最適化されていますが、わずかな変更しか加え付けることができない他の SAPN コンストラクトに適用できます。この方法はまた、ヒトワクチン用のGMP製造のための大規模な生産に容易に移用可能である。
概要
従来のワクチン開発は不活性化または減衰病原体に焦点を当ててきたが、現代のワクチンの焦点はサブユニットワクチン1に向かってシフトしている。このアプローチは、より標的を絞った反応、および潜在的により有効なワクチン候補につながる可能性があります。しかし、主な欠点の1つは、サブユニットワクチンが全生物のような微粒子ではなく、免疫原性2の低下をもたらす可能性があることです。反復抗原表示システムとしてのナノ粒子は、標的サブユニットワクチンアプローチと生物全体の粒子性の両方の利点を持つことができる1,3.
既存のタイプのナノワクチンの中で、合理的に設計されたタンパク質アセンブリは、ネイティブ様の立体構造1、4で抗原の複数のコピーを潜在的に提示できるワクチン候補の設計と開発を可能にします。 、5,6.これらのタンパク質アセンブリの一例は、自己組織化タンパク質ナノ粒子(SAPN)7である。SAPN はコイルコイルドメインに基づいており、伝統的に大腸菌8で表現されています。SAPNワクチン候補は、マラリア、SARS、インフルエンザ、トキソプラズマ症、HIV-1 9、10、11、12、13などの様々な疾患に対して開発されています。,14歳,15歳,16歳,17歳,18歳,19.各SAPN候補の設計は対象の病原体に固有ですが、生産、精製、および折りたたみ技術は一般的に広く適用可能です。
私たちの現在の関心の一つは、効果的なHIV-1ワクチンです。RV144では、適度な有効性を示したHIV-1ワクチンの唯一の第III相臨床試験において、感染リスクの低減は、エンベロープタンパク質20、21のV1V2ループに対するIgG抗体と相関していた。この領域のネイティブライクなトリメプレゼンテーションは、保護免疫原性22にとって重要であると考えられている。V1V2ループを可能な限りネイティブ状の立体構造に近づけるため、HIV-1エンベロープポストフュージョン後6らせリックバンドル(SHB)を含む原理SAPNワクチン候補を開発し、V1V2ループを正しいコンフォメーション9に提示しました。.この候補は、HIV-1エンベロープタンパク質に対する既知のモノクローナル抗体によって認識された。V1V2-SHB-SAPNで免疫したマウスはV1V2特異的抗体を挙げ、最も重要なことは、gp70 V1V2に結合し、正しい立体構造エピトープ9である。SHB-SAPNコアは、HIV-1 V1V2ループのキャリアとしての役割を超えた他の機能を持つことができます。ここでは、SHB-SAPNコアの式、精製、再折りたたみ、検証の詳細な方法論について説明します。配列選択、ナノ粒子設計、分子クローニング、および大腸菌の形質転換は、前述の9である。
プロトコル
1.大腸菌BL21(DE3)におけるSHB-SAPNタンパク質の発現
- メーカーの指示に従って、2L無菌ガラスアーレンマイヤーフラスコに培地中の成分Aと5mLの成分Bを95mL混合してください(材料の表を参照)。100 μg/mL の最終濃度にアンピシリンを追加します。
- 以前に確立されたグリセロールストック培養から大腸菌でメディアを接種します。30°Cで培養し、毎分200回転(rpm)で48時間振ります。
注:使用した大腸菌BL21(DE3)ストックは、SHB-SAPN遺伝子を有するアンピシリン耐性発現ベクター23を含んでいた。メディアの一般的なプロトコルは37°Cで24時間のインキュベーションを推奨していますが、30°Cでのインキュベーションの48hはSHB-SAPNに対して高い収率を与えました。 - 培養物を2本の50mL円錐管に移します。4°Cの固定角度ローターで10分間4,000 x gでチューブを遠心分離します。上清を取り出し、ペレットを保存して細胞を収穫します。
注:細胞ペレットは、使用するまですぐに処理するか、-80°Cで凍結することができます。
2. 超音波処理による大腸菌BL21(DE3)の分解
注:還元剤として少なくとも30分間250°Cで焼いた非ピロゲンプラスチック製品とガラス製品を使用してください。表示された抗原にS-S結合が含まれている場合、このプロトコル中にTCEPがバッファーに必要です。SHB-SAPN コアのみの場合、バッファー内に TCEP が存在することは必須ではありません。
- イミダゾールフリーバッファー(8M尿素、50mMリン酸ナトリウムモノベーシック、20mMトリスベース、5mM TCEP)pH 8.0(5 N NaOHで調整)を調製し、0.22 μm真空ボトルろ過ユニットを使用して濾過します。
- 1つの50 mL円錐管にイミダゾールフリーバッファーの40 mLでペレット化した細胞(ステップ1.3から)を再中断します。150 Wの超音波処理出力で5分間(超音波処理の4s、残りの6s)氷上のプローブで再懸濁した細胞を超音波処理します。
- 固定角ローターで25分間、4°Cで29,000 x gで細胞リサート(40mL)を遠心分離し、透明な上清を生成します。上清を150mLの無菌フラスコに移し、ペレットを捨てます。イミダゾールフリーバッファーを用いて上清を100mLに希釈する(後に「サンプル」と呼ばれるプロトコルで)。
注:この希釈ステップは、カラムのリサートロード中にFPLCシステム圧力が高くなりすぎないようにするために必要です。
3. ヒスカラムを用いたタンパク質精製
注:このプロトコルはFPLC装置を使用して行われましたが、重力の流れに適応することができます。
- 以下のバッファを準備し、0.22 μm真空ボトルろ過ユニットを使用してそれらをフィルタリング: (i) イミダゾールフリーバッファ「バッファーA」(8M尿素、50mMリン酸ナトリウムモノベーシック、20 mMトリスベース、5 mM TCEP)pH 8.0;(ii) 500 mM イミダゾールバッファー 「バッファーB」(8M尿素、50mMリン酸ナトリウムモノベーシック、20mMトリスベース、5mM TCEP、500mMイミダゾール) pH 8.0;(iii) イソプロパノール洗浄 (20 mMトリス, 60% イソプロパノール) pH 8.0.
注:各バッファのpHを5N NaOHで調整した。 - 主の列を平衡化する。
注: ラボスケールの生産では、このプロトコルは 5 mL のプリパックされた His 列を使用しますが、より大きなサイズのカラムを使用できます。- FPLC ソフトウェアを開き、[新しい方法]オプションをクリックします。[メソッド設定]メニューがすぐに開きます。列位置のドロップダウン メニューの下で、C1ポート 3を選択します。
- [技術による表示]ドロップダウン メニューでアフィニティを選択します。列タイプのドロップダウンメニューでは、他の、ヒストラップHP、5 mLを選択します。列の容積および圧力箱は自動的に適切な値に設定される。
- [メソッドのアウトライン]ボタンをクリックします。フェーズライブラリポップアップメニューから次のボタンをドラッグします:平衡化、サンプルアプリケーション、カラムウォッシュ、および溶出は、その正確な順序で矢印の横にあります。フェーズライブラリメニューを閉じます。
- 平衡ボタンをクリックします。表に示す値は、「初期バッファーB」(4%)、「最終バッファーB」(4%)、「ボリューム(CV)」5である必要があります。
- [サンプルアプリケーション] ボックスをクリックします。サンプルローディングボックスで、サンプルポンプ付きのカラムにサンプルを注入するためのラジオボタンをクリックします。[メソッド設定から流量を使用] ボックスの横にあるボックスが、システム ポンプ ボックスを使用したサンプルインジェクションでチェックされていることを確認します。画面の右側にある音量ボックスの横にある値を20 mLに変更します。
- コラムの洗浄ボタンをクリックします。表に示す値は、「初期バッファーB」(4%)、「最終バッファーB」(4%)、「ボリューム(CV)」5である必要があります。分数収集スキームの横にある [有効にする] ボックスをクリックします。
- 溶出ボタンをクリックします。表に示す値は、「初期バッファー B」0%、「最終バッファー B」100%、および「ボリューム (CV)」5) である必要があります。分数収集スキームの横にある [有効にする] ボックスをクリックします。[方法設定から分数サイズを使用] をクリック解除し、下の入力ボックスで分数サイズを 4 mL に調整します。
- ソフトウェアの上部にある[保存]ボタンをクリックします。ファイルに「平衡」という名前を付けます。
- 5 mL の事前梱包済みの His カラムを FPLC の対応する列ポート 3 に接続します。ポンプAとポンプBチューブの両方だけでなく、サンプルポンプチューブは、0.22 μm濾過脱イオン水に配置する必要があります。平衡化プログラムを実行します。
- ポンプAとポンプBの両方をイミダゾールフリーバッファ(バッファA)に入れ、平衡化プロトコルを再度実行します。
- サンプルをカラムに結合し、タンパク質を精製します。
- FPLC ソフトウェアを開き、[新しい方法]オプションをクリックします。[メソッド設定]メニューがすぐに開きます。列位置のドロップダウン メニューの下で、C1ポート 3を選択します。[技術による表示]ドロップダウン メニューでアフィニティを選択します。列タイプのドロップダウンメニューでは、他の、ヒストラップHP、5 mLを選択します。列の容積および圧力箱は自動的に適切な値に設定される。
- [メソッドのアウトライン]ボタンをクリックします。フェーズライブラリポップアップメニューからボタンをドラッグします:平衡化、サンプルアプリケーション、カラムウォッシュ(ウォッシュ1)、カラムウォッシュ(ウォッシュ2)、カラムウォッシュ(ウォッシュ3)、および矢印の横の溶出正確な順序。フェーズライブラリメニューを閉じます。
- 均衡ボタンをクリックします。表に示す値は、「初期バッファーB」4%、「最終バッファーB」4%、「ボリューム(CV)」5である必要があります。
- [サンプルアプリケーション] ボックスをクリックします。サンプルローディングボックスで、サンプルポンプ付きのカラム上のサンプルのラジオボタンをクリックします。[メソッド設定から流量を使用] ボックスの横にあるボックスが、システム ポンプ ボックスを使用したサンプルインジェクションでチェックされていることを確認します。
- 画面右側の音量ボックスの横で、値を 100 mL に変更します。分数収集スキームの横にある [有効にする] ボタンをクリックします。[方法設定] ボックスから [分数サイズを使用] をクリック解除し、分数サイズを 4 mL に変更します。
- 最初の列の洗浄ボタン(ウォッシュ1)をクリックします。表に示す値は、「初期バッファー B」4%、「最終バッファー B」4%、「ボリューム(CV)」10) である必要があります。分数収集スキームの横にある [有効にする] ボックスをクリックします。[方法設定から分数サイズを使用] をクリック解除し、分数サイズを 4 mL に変更します。
- 2列目の洗浄ボタン(ウォッシュ2)をクリックします。表に示す値は、「初期バッファー B」0%、「最終バッファー B」0%、「ボリューム(CV)」5) である必要があります。分数収集スキームの横にある [有効にする] ボックスをクリックします。[方法設定から分数サイズを使用] をクリック解除し、分数サイズを 4 mL に変更します。
- 3列目の洗浄ボタン(ウォッシュ3)をクリックします。表に示す値は、「初期バッファー B」0%、「最終バッファー B」0%、「ボリューム(CV)」5) である必要があります。分数収集スキームの横にある [有効にする] をクリックします。[方法設定] ボックスから [分数サイズを使用] をクリック解除し、分数サイズを 4 mL に変更します。
- [溶出]ボタンをクリックします。表の右にある情報をクリックし、表示されるメニューで [削除] ステップをクリックします。アイソクラティック グラデーション ボタンをテーブルの上に 2 回ドラッグして、2 つのエントリが表示されます。
- 最初のエントリの値は、「初期バッファー B」30%、"最終バッファー B" 30%、および "ボリューム (CV)" 10 を読み取る必要があります。2 番目のエントリの値は、「初期バッファー B」100%、"最終バッファー B" 100%、および "ボリューム (CV)" 10 を読み取る必要があります。分数収集スキームの横にある [有効にする] ボタンをクリックします。[メソッド設定から分数サイズを使用する]の横にあるボックスをクリックします。
- ソフトウェアの上部にある [名前を付けて保存]ボタンをクリックします。ファイルに"浄化"という名前を付けます。ポンプBチューブは500 mMイミダゾールバッファに配置する必要がありますが、FPLCのチューブはイミダゾールフリー洗浄バッファーに入れるべきです。サンプルポンプチューブは、100 mLサンプルに配置する必要があります。
- 「精製」プログラムを実行し、60%のイソプロパノールが必要な時間を待ちます(ウォッシュ2)。プログラムを一時停止し、イミダゾールフリーウォッシュから60%イソプロパノール洗浄にポンプAチューブを移動します。プログラムを再起動します。
- イソプロパノールステップが完了したら、プログラムをもう一度一時停止し、ポンプAチューブをイミダゾールフリーの洗浄バッファーに戻します。浄化プログラムを再起動します (残りの実行は自動化されます)。
4. SDS-PAGEによる純度評価とタンパク質同定
- (i)フロースルー(主のカラムに結合しなかった細胞溶化物)、(ii)ウォッシュ1、(iii)ウォッシュ3(60%イソプロパノール洗浄)、および(iv)洗浄3に対応するすべての画分を別々の50mL円錐管に組み合わせます。溶出ステップから2 mL分画を組み合わせないようにしてください。
- プールされた各画分と溶出ステップから15μLを0.5mLマイクロ遠心管に2x Laemmliサンプルバッファーで混合し、95°Cで10分間変性させます。
- タンパク質が変性する間、1xトリスグリシンSDS-PAGEランニングバッファーに3つの汚れのない4〜20%プレキャストポリアクリルアミドゲルを有するゲル走行装置をセットアップする。
- 最初のウェルに分子量マーカーの8 μLをロードし、ゲルの他のウェルに変性サンプルの30 μLをロードします。染料の前部がゲルの底に当たるまで200Vでゲルを実行します(約30分)。装置からゲルを取り出し、脱イオン水で簡単にすすいでください。染色のないイメージングシステムを使用して、すぐにゲルを画像化します。
- 正しいサイズ(18.07 kDa)のタンパク質バンドを含む分数を特定します。これらすべての分数をプールします。
5. ウェスタンブロットによるタンパク質同定
- His特異的抗体(抗6x HisTag)およびSHB特異的抗体(167-D-IV)を用いてウェスタンブロットを実行し、精製された全長タンパク質を同一性にする。抗6x HisTag抗体は、タンパク質のN終所を認識し、167-D-IV抗体は、全長タンパク質の存在を実証するC終所を認識する。
- (i)フロースルー、(ii)ウォッシュ1、(iii)ウォッシュ2(60%イソプロパノール洗浄)、(iv)ウォッシュ3、および280nmの吸光度で分光計器を用いて溶出工程からのすべての分画を決定する。これらの各群のイミダゾールフリーバッファーの15 μLに100ngのタンパク質を含む希釈物を生成する。
- サンプルの各15 μLに2x Laemmliサンプルバッファーの15 μLを追加し、ステップ4.1のようにそれらを変性します。脱伝が完了したら、すべてのタンパク質を確実に転移させるためにチューブをスピンダウンします。
- サンプルと染色前のマーカーを、汚れのない4~20%プレキャストポリアクリルアミドゲルにロードします。色素の前部がゲルの底に達するまで200Vで電気泳動を実行します。
- ゲルが走っている間、TBS-Tの1L(20 mMトリス、150mM NaCl、0.1%トゥエン20)とTBS-Tで5%の非脂肪牛乳の200mLを作ります。
- ウェスタンブロット転写システムを使用して、タンパク質をニトロセルロース膜に転写します。組み立て済みの転送スタックを使用し、その上にゲルを配置します。7分間25Vで実行するようにシステムをセットアップします。
注:後続のすべてのステップは、室温(RT)で100 rpmに設定された軌道シェーカー上で実行されます。 - 転送が完了したら、TBS-Tで2回10分間ブロットを洗浄します。
- TBS-Tで5%の非脂肪牛乳でニトロセルロース膜(ブロット)を少なくとも1時間ブロックし、TBS-Tで2回10分間洗浄します。
- 一次167-D-IVおよび抗6x HisTag抗体をTBS-T(ストックAb)で1mg/mLに希釈する。TBS-Tの20mLを含む2つの異なるチューブにストック167-D-IVの2μLと4μLのストック抗6x HisTag抗体を添加することにより、167-D-IV 10,000倍および抗6倍HisTag 5,000倍のストックアブを希釈する。一次抗体の総量20mLを各ブロットに1つずつ加え、1時間ブロットをTBS-Tで2回10分間洗浄します。
- TBS-Tの20mLでアルカリホスファターゼと結合したマウス抗ヒト二次抗体の1mg/mLの希釈4μL(1:5,000希釈)。ヤギ抗マウス二次抗体の1mg/mLの希釈4 μLをTBS-Tの20mLでアルカリホスファターゼと結合した(1:5,000希釈)。対応するブロットに二次抗体を追加します。
注:抗ヒト二次抗体は167-Dに結合し、抗マウスは抗6x HisTagに結合する。TBS-Tで2回10分間ブロットを洗浄します。 - ブロットを覆うのに十分なBCIP/NBTアルカリホスファターゼ基板を加えます。バンドが現れるまで約10分間ブロットを開発します。冷たい水道水でブロットを洗い流し、フラットベッドスキャナでスキャンする前に乾燥させます。
6. SHB-SAPNの折りたたみ
- プールされたタンパク質(合計10\u201220 mL)を透析カセットを遮断し、8M尿素、20mMトリス、5%グリセロール、5mM TCEP pH 8.5(一晩18\u201226°C)に透析します。
- 透析バッファー内の尿素濃度を2時間毎に2Mずつ段階的に減少させることにより、試料から尿素をゆっくりと透析させる。尿素濃度2Mで、透析装置を4°Cに移動します(この工程から透析バッファーにTCEPを使用しないでください)。120 mM尿素、20 mMトリス、5%グリセロール、pH 8.5を一晩4°Cに透析して再折りたたみを完了します。
- 再折り畳まれたタンパク質(SHB-SAPN)を透析カセットから取り除きます。0.22 μm ポリビニリジンフッ化物(PVDF)シリンジファイラーを使用してSHB-SAPNをフィルタリングします。アリコートSHB-SAPNを無菌チューブに入れ、-80°Cで凍結し、その後の分析のためにRTで少なくとも100 μLを残します。
7. サイズと外観による粒子の検証
- 動的光散乱(DLS)
- SHB-SAPNの平均粒径を次のパラメータで測定する:材料としてタンパク質を選択し、120 mM尿素、20 mMトリス、5%グリセロール25°Cの複雑なバッファーを作成し、分析のために使い捨てキュベットを選択し、自動選択測定、5回の実行に設定します。
- 使い捨てキュベットにSHB-SAPNの45 μLを追加し、緑色の矢印をクリックしてソフトウェアを実行します。読み出しのパーセンテージ ボリュームを選択します。
- ナノ粒子追跡解析(NTA)
- 再折りたたみバッファーでサンプルを 1:20 で希釈します。希釈したサンプルを10mL作ります。
- 3 mLシリンジを使用して、NTA計測器を再折りたたみバッファーでフラッシュし、約1.5mLのサンプルをロードして機器を平衡させます。分析には、サンプルの残りの部分を使用します。
- [SOP] タブをクリックして、NTA ソフトウェアに新しいSOPを作成します。タブの下でキャプチャの数を3に変更し、キャプチャ時間を30sに変更し、画面の左側にあるオートフォーカスボタンを押してサンプルをフォーカスします。機械の側面にある手動フォーカスノブを使用して、フォーカスを微調整します。
- システムがシリンジを使用して少量のサンプルを読み込むプロンプトが表示された場合は、作成した SOP を実行します。システムがすべてのキャプチャを取得すると、自動的に分析画面が表示されます。検出限界バーをスライドさせて、すべての実際のパーティクルに赤い十字が印が付いられるようにします。実行分析ボタンを押すと、解析が自動的に開始されます。
- 透過電子顕微鏡(TEM)
- グロー放電フォームバー/カーボン400メッシュ銅TEMサポートフィルム。
- 0.075 mg/mL濃度で3 μLのサンプルをグリッドに30sのウィックオフフィルターペーパーを使用して液体を取り除きます。
- 3 μLの脱イオン水でグリッドを3回洗い、毎回フィルターペーパーで水を拭き取ります。
- 支持フィルムに0.5%のウラニル酢酸の3 μLを加え、30s.ウィックの大部分の酢酸を取り除き、表面に薄いフィルムを残します。透過型電子顕微鏡で画像を撮る前に、サンプルを乾燥させます。
- TEM上の80 kVのイメージサンプル。
8. 運動性リムルスアメーボサイトリザート(LAL)アッセイを用いてサンプル中のエンドトキシンレベルの決定
- キットとサンプルを冷蔵庫から取り出し、RTに平衡化します。
- このアッセイを行うには、ヒートブロックを備えたプレートリーダーと、37°Cで405nmの波長で40の読み取りのためのサンプルを読み取る能力が必要です。ウェルが 150 s ごとに読み取られるようにプログラム テンプレートを作成して、始点を識別します (OD は最初の読み取りと比較して 0.2 増加します)。
- PBSでの免疫用量濃度にサンプルを希釈する。
注:再折りたたみバッファーのpHは、LALアッセイの範囲外です。PBSのサンプルの希釈は許容範囲にpHを置く。 - 50 EU/mLを生成する分析証明書によって決定されるエンドトキシンフリーLAL水の適切な体積でコントロールエンドトキシンを再中断します。積極的にエンドトキシンの完全な再懸濁を確保するために15分間バイアルを渦。
- 50 EU から 0.005 EU/mL の範囲のガラスバイアルの 10 倍のシリアル希釈を事前に形成することにより、エンドトキシン標準曲線を生成します。希釈ごとに、LAL水の0.9 mLに前の希釈の0.1 mLを追加します。1分間の組み合わせ後に激しく渦。
- 標準曲線希釈と SHB-SAPN サンプルを 96 ウェルプレートに複製して追加します。重複時にもLAL水を負のコントロールとして使用してください。プレートを37°Cで15分間前置きします。
- インキュベーションの終わりに向かって、LAL水の2.6 mLでアッセイ試薬バイアルを再中断します。血清学的なピペットと内容を穏やかに混合する。
- 96ウェルプレートの各ウェルに100μLのアッセイ試薬を加えます。プレートをプレートリーダーに素早く移動し、ステップ8.2で書かれたプログラムテンプレートを実行します。
- プログラムが完了したら、コントロールの対数値と始点時刻のログ値を使用して標準曲線を生成します。この曲線から生成された式を使用して、サンプル中のエンドトキシン濃度を計算します。
結果
ここに示す完全に組み立てられたSHB-SAPNは、モノマーの60コピーを含む粒子に折りたたむと予測されるタンパク質配列(図1A)に基づいて構築されています(図1B)。図2は、SHB-SAPNコアの生産、精製、同定の方法の概要を説明します。SHB-SAPNコアの遺伝子配列を有するpPep-T発現ベクターを含有するグリセロールストック由来の大腸菌をBL21(DE3)大腸菌に誘導した。細菌細胞は、脱育および減少条件下で正常に増殖し、ライズした。
総細胞液質は、Ni2+カラムを用いてFPLCによるSHB-SAPNモノマーを精製するために使用された(図3A)。FPLCクロマトグラフは、タンパク質が150mMと500mMイミダゾールの両方でタンパク質をタンパク質でた出したことを示しています(図3A)。クロマトグラムはまた、イソプロパノール洗浄およびイミダゾールフリー洗浄に対応する185 mLおよび210 mLの総容積で2つの他のピークを示す。組換えタンパク質の分画および純度は、勾配SDS-PAGEゲルによって同定された(図3B)。目的のタンパク質は、主に分数68\u201279(278\u2012300 mL総容積)に位置していた。これらの分数は、さらなる分析のために組み合わされた。抗HIS抗体(N末端)および167-D-IV抗体(C末端)を有するウェスタンブロットは、プールされた画分が実際に目的のタンパク質であることを示した(図4A,B)。これらのブロットはまた、SHB-SAPNマルチマーの存在を実証した。以前の洗い流しおよび溶出画画は、より高濃度の多量化タンパク質を含む傾向があり、したがって除外された。
目的とするタンパク質モノマーを含むサンプルを透析により完全に組み立てられたSHB-SAPNに折りたたんだ。粒子サイズ分布は、DLSおよびナノ粒子追跡解析により決定した(図5A,B)。DLSは、NTAシステムが81nmの平均サイズを測定しながら、Z平均流体力学直径67nmの粒子を同定しました。わずかなサイズの違いは、粒子サイズの技術によるが、両方の分析からのサイズは20\u2012100 nm8、24、25の予想範囲内であった。SHB-S/S/S/S/S/SINはTEMによって可視化され、画像は2つの粒子サイジング技術から得られたサイズ分布を有する整形した個々の粒子を示した(図5C)。
タンパク質の精製中に、カラムをイソプロパノールで洗浄し、最終SHB-SAPN産物におけるLPS汚染を減少させる。エンドトキシンレベルが免疫に許容できるかどうかを確認するために、イソプロパノール洗浄工程の有無にかかわらず精製したSHB-SAPNサンプル中のLPSの濃度を運動性LALアッセイによって決定した。その結果、イソプロパノール洗浄はエンドトキシンレベルを>0.25 EU/μgからSHB-SAPNタンパク質の0.010 EU/μgに減少させたことが示された(表1)。
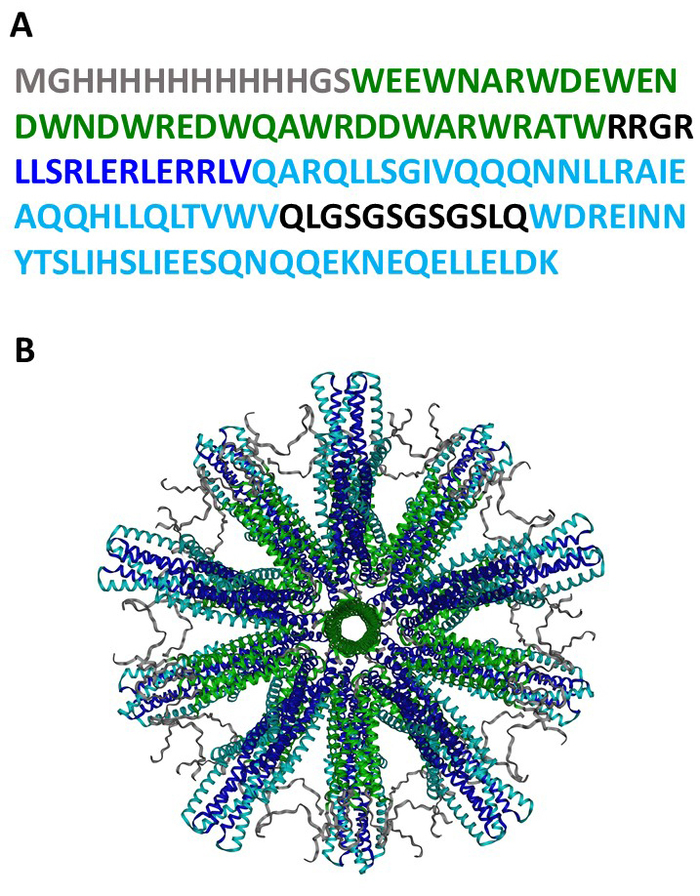
図1:SHB-SAPNタンパク質配列および構造。(A) SHB-SAPNモノマーのアミノ酸配列。(B) 60個のタンパク質モノマーからなる完全に組み立てられたSHB-SAPNコアの構造のコンピュータモデル。アミノ酸配列の配色: グレー = HisTag;緑 = ペンタマー;ダークブルー=デノボ設計トリマー;水色 = 6らせん束。この図のより大きなバージョンを表示するには、ここをクリックしてください。
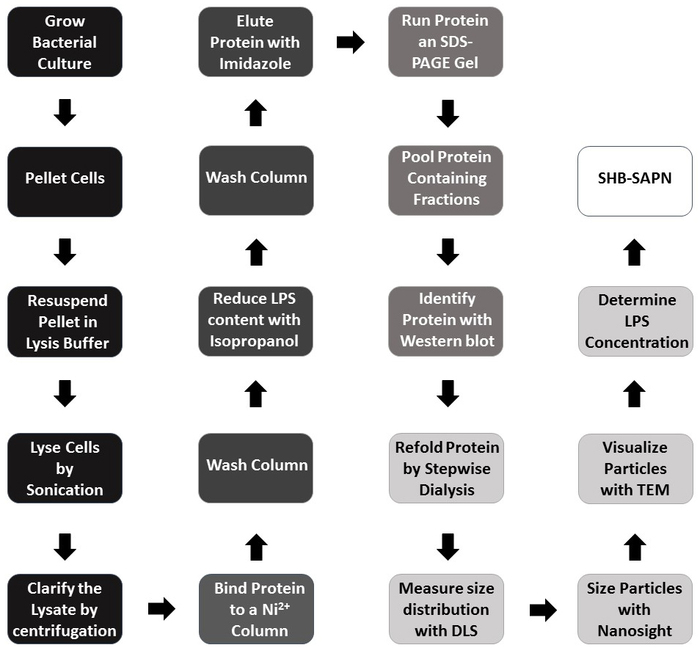
図2: のフローチャートSHB-SAPN 生産のためのプロトコル。配色: 黒 =大腸菌中のタンパク質モノマーの発現;ダークグレー= モノマー精製;ミディアムグレー = モノマー識別;ライトグレー = 折り返しとキャラクタライゼーション;白 = 完全に組み立てられた SHB-SAPN 製品。ダークグレーとミディアムグレーで標識されたステップでは、タンパク質は、伝型および減少条件下にあります。この図のより大きなバージョンを表示するには、ここをクリックしてください。
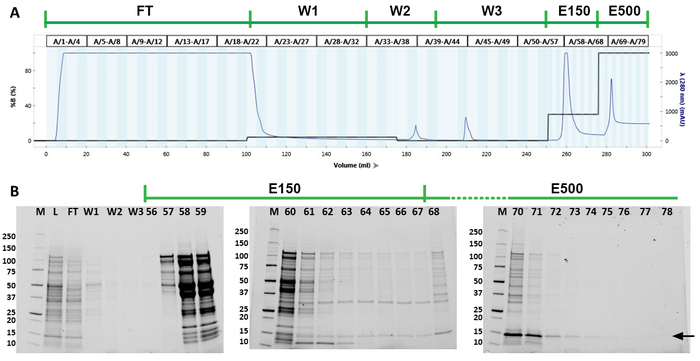
図3:SHB-SAPNモノマーのタンパク質精製(A)FPLC精製からのクロマトグラフ。クロマトグラムの上の緑色の線は、精製工程を示す。クロマトグラム中の青い線は、280nm波長での画分の光学密度を表す。黒線は、精製の各段階で使用されたバッファーB(8M尿素、20mMトリス、50mMリン酸ナトリウムモノベーシック、5mM TCEP、500mMイミダゾール、pH8.5)の何パーセントを示す。(B) 溶解物(L)、フロースルー(FT)、第1洗浄(W1)、イソプロパノール洗浄(W2)、第3洗浄(W3)、および150mMイミダゾール(E150)および500mMイミダゾール(E500)からの個々の分画からのプールされた画分のSDS-PAGEゲル浄化。第1レーン(M)の分子マーカーは、10~250 kDaのバンドを識別します。標的タンパク質は黒い矢印で示される。この図のより大きなバージョンを表示するには、ここをクリックしてください。
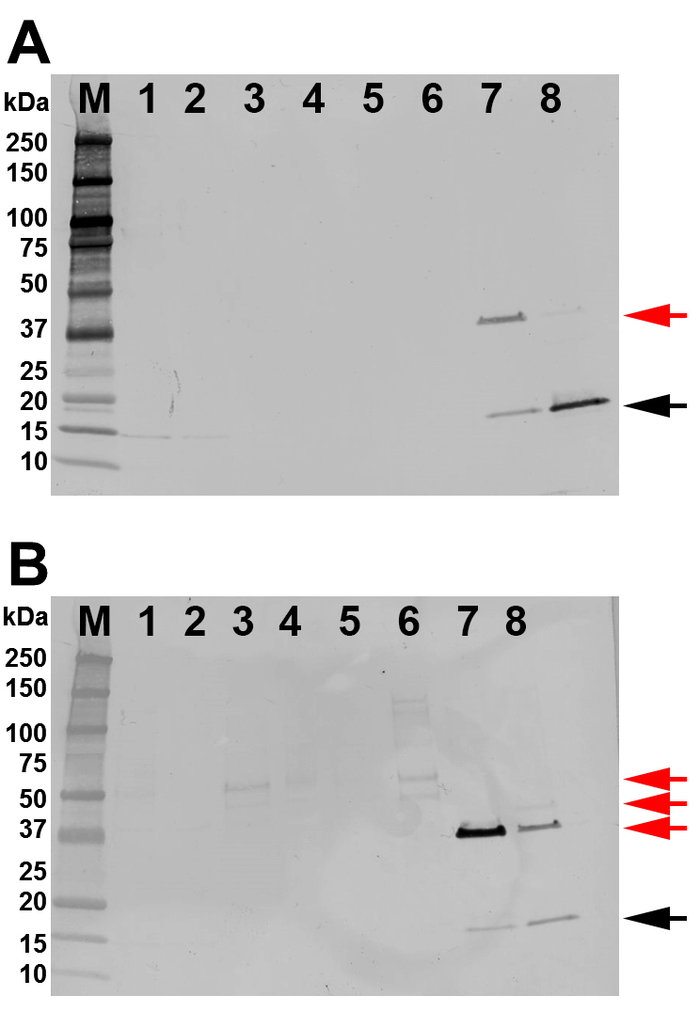
図4:ウェスタンブロットによるタンパク質の同定。すべてのレーンには100 ngのタンパク質が搭載されています。(A) 抗6xヒスタッグを持つウェスタンブロットの結果。(B) 167-D-IV HIV-1モノクローナル抗体を用いたウェスタンブロットの結果。レーンには、M = 分子量マーカーというラベルが付けられます。1 = リサート;2 = フロースルー;3 = 最初の洗浄;4 = イソプロパノール洗浄(第2洗浄);5 = 3回目の洗浄;6 = プールされた体積分率 56\u201261 (最初の溶出ピーク)、7 = プールされた体積ファクション 62\u201267 (2 つのピークの間)、8 = プールされた体積分率 68\u201278 (2 番目の溶出ピーク)。単量体SHB-SAPNバンドとして期待されるバンドサイズが18.07 kDaの標的タンパク質は、黒い矢印で示されます。レーン 7 および 8 の余分なバンディングは、SHB-SAPN (赤い矢印) のダイマー、トリマー、およびマルチマーです。この図のより大きなバージョンを表示するには、ここをクリックしてください。
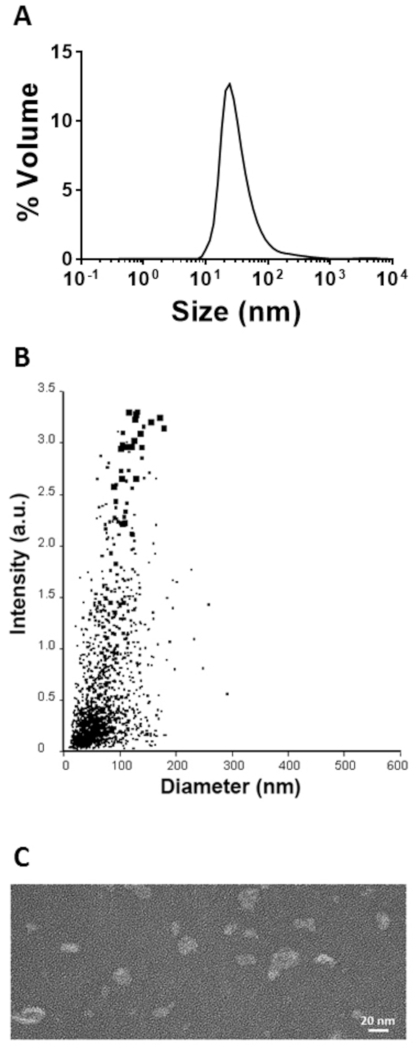
図5:折り返されたSHB-SAPNの特性を説明する。(A)DLSによって決定される粒度分布。(B)ナノ粒子トラッキング(系)によって決定される粒子径。(C) TEMによるSHB-SAPN粒子の可視化この図のより大きなバージョンを表示するには、ここをクリックしてください。
| サンプル | エンドトキシン (EU/mL) | エンドトキシン (EU/μg のタンパク質) |
| イソプロパノールウォッシュ付きSAPN | 2.02 | 0.01 |
| イソプロパノールウォッシュなしSAPN | >50 | >0.25 |
| 負のコントロール | 検出レベル以下 | N/a |
表1:再折りたたみSHB-SHB-S/SNSのエンドトキシンレベル。イソプロパノール洗浄の有無にかかわらず精製したSHB-SAPNサンプル中のエンドトキシンレベルは、エンドトキシン単位/mLおよびエンドトキシン単位/μgの両方をSHB-SAPNタンパク質として提示した。
ディスカッション
ナノテクノロジーは、サブユニットワクチン開発のための多くの利点とソリューションを提供します。ナノワクチンは、免疫原性を増加させる宿主免疫系に微粒子として抗原を繰り返し提示することができる26.ナノワクチンには多くの種類がありますが、デノボ設計タンパク質で構成されたものがワクチン開発1の最強のアプローチであると考えています。それらは宿主タンパク質に対する配列相同性なしで設計され、低い生産コストおよび高いプロダクト収率を提供している間、原生様の立体構造に近い関心の抗原を提示することができる。このアプローチの主な例は、複数の感染症に対するワクチンに適用した SAPN 技術7.HIV-1ワクチン開発の難しさに対処し、我々は効果的にネイティブのような三体化コンフォメーション9でV1V2抗原を提示するためにユニークなSHB-SAPNコアを設計しました。多くのワクチン標的、特にウイルス性疾患に対しては、トリマー27として存在する。この現象は、SAPN設計がサブユニットワクチンの開発に大きな影響を及ぼすことを示しています。
この方法では、大腸菌発現システムでSHB-SNSを生成する方法を示す。タンパク質の高収率(培養量約6mg/100mL)を発現した。タンパク質は10個のヒスチジンを含み、Ni2+カラムを用いた固定化金属親和性クロマトグラフィーを用いて容易に精製した。His-Tagのこの長さは、最も高いタンパク質収率に最適であることがわかった。精製されたタンパク質は、N末端HisTagとC末端ヘプタド繰り返しの両方の存在によって示されるように、設計されたタンパク質の全長を含んでいた。広く受け入れられている技術を活用し、SHB-SAPNコアの表現、生産、特性評価に最適化しました。新しいタンパク質エピトープを含むSAPNの開発中に全長タンパク質の産生が欠如している場合は、宿主細胞における遺伝子の発現問題を示している可能性がある。それが起こる場合、遺伝子および発現システムは再設計され、記載されたプロトコルに合わせなければならない。超音波処理時間または強度の修飾はまた、予測される全長タンパク質の濃度を増加させる可能性がある。
再折り畳まれた粒子は、DLSおよびナノ粒子追跡分析によって決定される予想サイズ範囲(20〜100nm)8、24、25であった。これらの結果は、TEMを用いてさらに確認した。このステップに問題がある場合は、通常、再折りたたみバッファーのpHまたはイオン強度に問題があるためです。粒子サイジング技術で大きなサイズの粒子が検出されると、凝集を示し、リフォールディングバッファのpHを増加させることによって回避することができる。粒子がDLSによって検出されない場合は、タンパク質の濃度を確認し、バッファーのpHを確認します。DLSの最終的なタンパク質濃度は、少なくとも100 μg/mLでなければなりません。濃度が問題でない場合は、小さな、不完全に形成された粒子の存在を示し、その濃度はpHを減少させることによって減少させることができる。あるいは、塩化ナトリウム濃度は、不要なサイズの粒子の存在を最小限に抑えるために最適な範囲に調整することができる。
最後に、精製時にイソプロパノール洗浄工程を用いることで、注射用製品の体重5EU/kgの上限を下回るSAPNの0.01 EU/μgまで、宿主大腸菌からの汚染LPSを0.01EU/μgに低減することができました。28.このレベルは、Q 列とも呼ばれるアニオン交換列を使用することでさらに低下できます。高レベルのエンドトキシンがまだ存在する場合は、バッファー調製に使用されたすべての材料を確認してください。この方法では、デピロゲン化ガラス製品とエンドトキシンフリープラスチック製品のみを使用することを忘れないでください。
これらの結果は、臨床前の予防接種研究に用いられるSHB-SAPNコアの製造方法の開発に成功したことを示している。わずかな変更しか加え付けることができないこの方法は、目的の抗原が添加されたときにSHB-SAPNの精製に適用することができる。この方法を出発点として使用する大きな変更の 1 つは、溶出ステップです。異なるタンパク質は、実験的に決定しなければならない異なるイミダゾール濃度で溶出する。もう 1 つの大きな違いは、再折りたたみバッファーの組成です。最適化には、異なるpH条件とイオン強度をテストする必要があります。
将来の作業を考慮して、SHB-SAPN の人間のアプリケーションを可能にするために必要なわずかな変更は 2 つだけです。第1は、ヒト29におけるアンピシリンアレルギーによる発現ベクターをカナマイシン耐性選択マーカーに変更する必要があることです。人間が使用するタンパク質製造のもう一つの主要な要件は、動物製品フリーメディアでSHB-SAPNを製造することです。小規模な研究は、すでに植物ベースの媒体でタンパク質の合理的な収量を示しました。ここで提示された作業は、マラリアワクチン候補、FMP01416で実証されているように、究極のGMP生産のために簡単にスケーラブルです。この大規模なFMP014-SAPN生産には、最終製品からLPSおよびNi2+コンテンツをさらに削減するためのアニオン交換と陽イオン交換ステップの両方が含まれていました。この細菌発現SAPNは、今後のフェーズ1/2a臨床試験のために既にスケールアップされています。
開示事項
表明された見解は著者のものであり、米陸軍や国防総省の立場を表すものと解釈されるべきではない。ピーター・ブルクハルトは、アルファ-OペプチドAGと呼ばれる会社に興味を持っており、技術に関する特許を持っています。他の著者は、本稿で提示される主題に関する金銭的利害関係を有する会社との提携または財政的関与を持っていません。
謝辞
この研究は、ヘンリー・M・ジャクソン軍事医学振興財団と米国国防総省との間の協力協定(W81XWH-11-2-0174)によって支えられました。抗HIV-1 gp41 mAb 167-D IV抗体は、NIHエイズ試薬プログラムを通じてスーザン・ゾラ・パズナー博士から受け取りました。
資料
| Name | Company | Catalog Number | Comments |
| 10x Tris/Glycine/SDS | BioRad | 1610732 | 1 L |
| 2-Mercaptoethanol | BioRad | 1610710 | 25 mL |
| 2-propanol | Fisher | BP26181 | 4 L |
| 2x Laemmli Sample Buffer | BioRad | 1610737 | 30 mL |
| 40ul Cuvette Pack of 100 with Stoppers | Malvern Panalytical | ZEN0040 | 100 pack |
| 4–20% Mini-PROTEAN TGX Precast Protein Gels, 10-well, 30 µl | BioRad | 4561093 | 10 pack |
| Ampicillin | Fisher | BP1760-25 | 25 g |
| Anti-6X His tag antibody [HIS.H8] | AbCam | ab18184 | 100 mg |
| Anti-HIV-1 gp41 Monoclonal (167-D IV) | AIDS Reagent Repository | 11681 | 100 mg |
| BCIP/NBT Substrate, Solution | Southern Biotech | 0302-01 | 100 mL |
| Corning Disposable Vacuum Filter/Storage Systems | Fisher | 09-761-108 | A variety of sizes |
| Formvar/Carbon 400 mesh, Copper approx. grid hole size: 42µm | Ted Pella, Inc | 01754-F | 25 pack |
| GE Healthcare 5 mL HisTrap HP Prepacked Columns | GE HealthCare | 45-000-325 | 5 pack |
| Glycerol | Fisher | BP229-4 | 4 L |
| Goat Anti-Mouse IgG H&L (Alkaline Phosphatase) | ABCam | ab97020 | 1 mg |
| Imidazole | Fisher | O3196-500 | 500 g |
| Instant NonFat Dry Milk | Quality Biological | A614-1003 | 10 pack |
| Kinetic-QCL Kinetic Chormogenic LAL Assay | Lonza Walkersville | 50650U | 192 Test Kit |
| LAL Reagent Grade Multi-well Plates | Lonza Walkersville | 25-340 | 1 plate |
| Magic Media E. coli Expression Medium | ThermoFisher | K6803 | 1 L |
| MilliporeSigma Millex Sterile Syringe 0.22 mm Filters | Millipore | SLGV033RB | 250 pack |
| Mouse Anti-Human IgG Fc-AP | Southern Biotech | 9040-04 | 1.0 mL |
| One Shot BL21 Star (DE3) Chemically Competent E. coli | ThermoFisher | C601003 | 20 vials |
| Precision Plus Protein Unstained Protein Standards, Strep-tagged recombinant, | BioRad | 1610363 | 1 mL |
| Slide-A-Lyzer Dialysis Cassettes, 10K MWCO, 12 mL | ThermoFisher | 66810 | 8 pack |
| Sodium Chloride | Fisher | BP358-212 | 2.5 kg |
| Sodium Phosphate Monobasic | Fisher | BP329-500 | 500 g |
| Tris Base | Fisher | BP152-1 | 1 kg |
| Tris-(2-carboxyethyl)phosphine hydrochloride | Biosynth International | C-1818 | 100 g |
| Uranyl Acetate, Reagent, A.C.S | Electron Micoscopy Services | 541-09-3 | 25 g |
| Urea | Fisher | BP169-500 | 2.5 kg |
| Whatman qualitative filter paper | Sigma Aldrich | WHA10010155 | pack of 500 |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| ChromLab Software ver 4 | BioRad | 12009390 | Software |
| Epoch 2 Microplate Spectrophotometer | BioTek | EPOCH2 | Plate Reader |
| Fiberlite F14-14 x 50cy Fixed-Angle Rotor | ThermoFisher | 096-145075 | Rotor |
| Gel Doc EZ Gel Documentation System | BioRad | 1708270 | Gel Imager for Stain free Gels |
| JEOL TEM | JEOL | 1400 | Transmission Electron Microscope |
| Mini-PROTEAN Tetra Vertical Electrophoresis Cell for Mini Precast Gels | BioRad | 1658004 | To run gels |
| NanoDrop One Microvolume UV-Vis Spectrophotometer | ThermoFisher | ND-ONE-W | For Protein Concentration |
| NanoSight NS300 | Malvern Panalytical | Particle Sizing | |
| NanoSight NTA software NTA | Malvern Panalytical | Particle Sizing | |
| New Brunswick Innova 44/44R | Eppendorf | M1282-0000 | Incubator/Shaker |
| NGC Quest 10 Chromatography System | BioRad | 7880001 | FPLC to aid in protein purification |
| PELCO easiGlow Glow Discharge Cleaning System | Ted Pella, INC | 91000S | To clean grids |
| PowerPac Universal Power Supply | BioRad | 1645070 | To run gels |
| Rocker Shaker | Daigger | EF5536A | For Western |
| Sonifer 450 | Branson | also known as 096-145075 | Sonicator |
| Thermo Scientific Sorvall LYNX 4000 Superspeed Centrifuge | ThermoFisher | 75-006-580 | Centrifuge |
| Trans-Blot Turbo Mini Nitrocellulose Transfer Packs | BioRad | 1704158 | For Western |
| Trans-Blot Turbo Transfer System | BioRad | 1704150 | For Western |
| Vortex-Genie 2 | Daigger | EF3030A | Vortex |
| Zetasizer Nano ZS | Malvern Panalytical | Particle Sizing | |
| Zetasizer Software | Malvern Panalytical | Particle Sizing |
参考文献
- Karch, C. P., Burkhard, P. Vaccine technologies: From whole organisms to rationally designed protein assemblies. Biochemical Pharmacology. 120, 1-14 (2016).
- Snapper, C. M. Distinct Immunologic Properties of Soluble Versus Particulate Antigens. Frontiers in Immunology. 9, 598(2018).
- Kelly, H. G., Kent, S. J., Wheatley, A. K. Immunological basis for enhanced immunity of nanoparticle vaccines. Expert Review of Vaccines. , 1-12 (2019).
- Yeates, T. O. Geometric Principles for Designing Highly Symmetric Self-Assembling Protein Nanomaterials. Annual Review of Biophysics. 46, 23-42 (2017).
- Marcandalli, J., et al. Induction of Potent Neutralizing Antibody Responses by a Designed Protein Nanoparticle Vaccine for Respiratory Syncytial Virus. Cell. 176 (6), 1420-1431 (2019).
- Ross, J. F., et al. Decorating Self-Assembled Peptide Cages with Proteins. ACS Nano. 11 (8), 7901-7914 (2017).
- Karch, C. P., Matyas, G. R., Burkhard, P., Beck, Z. Self-Assembling Protein Nanoparticles: implications for HIV-1 vaccine development. Nanomedicine (Lond). 13 (17), 2121-2125 (2018).
- Raman, S., Machaidze, G., Lustig, A., Aebi, U., Burkhard, P. Structure-based design of peptides that self-assemble into regular polyhedral nanoparticles). Nanomedicine. 2 (2), 95-102 (2006).
- Karch, C. P., et al. Design and characterization of a self-assembling protein nanoparticle displaying HIV-1 Env V1V2 loop in a native-like trimeric conformation as vaccine antigen. Nanomedicine. , (2018).
- Karch, C. P., et al. The use of a P. falciparum specific coiled-coil domain to construct a self-assembling protein nanoparticle vaccine to prevent malaria. Journal of Nanobiotechnology. 15 (1), 62(2017).
- Li, J., et al. A self-adjuvanted nanoparticle based vaccine against infectious bronchitis virus. PLoS One. 13 (9), e0203771(2018).
- Wahome, N., et al. Conformation-specific display of 4E10 and 2F5 epitopes on self-assembling protein nanoparticles as a potential HIV vaccine. Chemical Biology & Drug Design. 80 (3), 349-357 (2012).
- El Bissati, K., et al. Effectiveness of a novel immunogenic nanoparticle platform for Toxoplasma peptide vaccine in HLA transgenic mice. Vaccine. 32 (26), 3243-3248 (2014).
- Kaba, S. A., et al. A nonadjuvanted polypeptide nanoparticle vaccine confers long-lasting protection against rodent malaria. Journal of Immunology. 183 (11), 7268-7277 (2009).
- Kaba, S. A., et al. Protective antibody and CD8+ T-cell responses to the Plasmodium falciparum circumsporozoite protein induced by a nanoparticle vaccine. PLoS One. 7 (10), e48304(2012).
- Seth, L., et al. Development of a self-assembling protein nanoparticle vaccine targeting Plasmodium falciparum Circumsporozoite Protein delivered in three Army Liposome Formulation adjuvants. Vaccine. 35 (41), 5448-5454 (2017).
- Kaba, S. A., et al. Self-assembling protein nanoparticles with built-in flagellin domains increases protective efficacy of a Plasmodium falciparum based vaccine. Vaccine. 36 (6), 906-914 (2018).
- El Bissati, K., et al. Protein nanovaccine confers robust immunity against Toxoplasma. NPJ Vaccines. 2, 24(2017).
- Karch, C. P., et al. Vaccination with self-adjuvanted protein nanoparticles provides protection against lethal influenza challenge. Nanomedicine. 13 (1), 241-251 (2017).
- Haynes, B. F., et al. Immune-correlates analysis of an HIV-1 vaccine efficacy trial. New England Journal of Medicine. 366 (14), 1275-1286 (2012).
- Rerks-Ngarm, S., et al. Vaccination with ALVAC and AIDSVAX to prevent HIV-1 infection in Thailand. New England Journal of Medicine. 361 (23), 2209-2220 (2009).
- O' Connell, R. J., Kim, J. H., Excler, J. L. The HIV-1 gp120 V1V2 loop: structure, function and importance for vaccine development. Expert Review of Vaccines. 13 (12), 1489-1500 (2014).
- Babapoor, S., et al. A Novel Vaccine Using Nanoparticle Platform to Present Immunogenic M2e against Avian Influenza Infection. Influenza Research and Treatment. 2011, 126794(2011).
- Indelicato, G., Burkhard, P., Twarock, R. Classification of self-assembling protein nanoparticle architectures for applications in vaccine design. Royal Society Open Science. 4 (4), 161092(2017).
- Indelicato, G., et al. Principles Governing the Self-Assembly of Coiled-Coil Protein Nanoparticles. Biophysical Journal. 110 (3), 646-660 (2016).
- Doll, T. A., Raman, S., Dey, R., Burkhard, P. Nanoscale assemblies and their biomedical applications. Journal of the Royal Society Interface. 10 (80), 20120740(2013).
- Rey, F. A., Lok, S. M. Common Features of Enveloped Viruses and Implications for Immunogen Design for Next-Generation Vaccines. Cell. 172 (6), 1319-1334 (2018).
- Bacterial Endotoxins. United States Pharmacopeia (USP). , Ch. 85 (2011).
- Points to Consider (PTC) in the Characterization of Cell Lines Used to Produce Biologicals. , Food and Drug Adminstration. Maryland. Available from: https://www.fda.gov/media/76255/download (1993).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved