Method Article
センシング用途のための無機構造のDNA折り紙媒介基板ナノパターニング
要約
ここでは、DNA折り紙形状を誘導テンプレートとして用いて基質上に離散的で正確な無機ナノ構造を作成するプロトコルについて述べた。この方法は、透明基板(サファイア)上にプラズモニックゴールド弓形アンテナを作成することによって実証されています。
要約
構造DNAナノテクノロジーは、DNAを建設材料として使用してボトムアップから構築するための実行可能なルートを提供します。最も一般的なDNAナノファブリケーション技術はDNA折り紙と呼ばれ、ナノメートルレベルの精度で正確で汎用性の高い構造のハイスループット合成を可能にします。ここでは、ボトムアップDNA折り紙と従来用のトップダウンリソグラフィ法アプローチを組み合わせることにより、DNA折り紙の空間情報を金属ナノ構造に伝達する方法を示す。これにより、選択した基板上に1ステップで数十億個の小さなナノ構造を作製することができます。この方法は、ボウタイDNA折り紙を使用して、窒化ケイ素またはサファイア基板上に金属弓形のアンテナ構造を作成するために実証されています。この方法は、折り紙堆積基板の上に酸化ケイ素層の選択的成長に依存し、したがって、リソグラフィステップに続くパターニングマスクをもたらす。これらのナノ構造を装備した表面は、分子センサ(例えば、表面強化ラマン分光法(SERS))として、および小さな特徴サイズ(サブ10nm)に起因する可視波長範囲の様々な他の光学用途で使用することができます。技術は、方法論的な変更を通じて他の材料に拡張することができます。したがって、得られる光学的に活性な表面は、メタマテリアルおよびメタサーフェスの開発に使用される可能性があります。
概要
構造DNAナノテクノロジーは、近年1、2の間に急速に進化し、この分野で最も影響力のある開発は間違いなくDNA折り紙3、4の発明であった。DNA折り紙技術は、正確な構造特徴3、4を持つ事実上あらゆるナノ形状の製造を可能にします。この強力な方法は、(サブ)ナノメートルの正確な空間配置とカーボンナノチューブ5、金属ナノ粒子6、7、8などの他のナノオブジェクトの固定で使用することができます。9, 酵素/タンパク質10,11,12,13および治療材料14,15,16,17.重要なのは、これらの構造は単に静的であるだけでなく、動的な方法で動作するようにプログラムすることもできます18,19.DNA折り紙の無数のアプリケーションは、薬物送達20、21、22から分子エレクトロニクス/プラズモニクス5、23、24まで及びます。 25と材料科学26、27から新規イメージングおよびキャリブレーション技術28まで。
上記のアプリケーションに加えて、DNA折り紙形状の極端な空間分解能は、ナノパターニングおよび繊細なナノスケールリソグラフィ29、30で利用することができる。このプロトコルは、DNA折り紙テンプレートを用いて基質上に離散的で正確な無機ナノ構造を作成するためのリソグラフィ法について説明する。これらのテンプレートは、様々な形状および大量31で効率的に製造することができ、大スケール32で選択された基板に楽に堆積することができる。これらの特性により、一般的に使用されるのではなく、電子ビームリソグラフィやその他の走査ベースのナノファブリケーション技術とは対照的に、1ステップで数十億個のナノ構造の高度に並列化することができます。
ここで、製造プロセスは、窒化ケイ素およびサファイア基板上に金弓状の構造を作成することによって実証される。言い換えれば、DNA折り紙の空間情報は完全に金属ナノ構造に転送される。ここで論じるように、この技術は、選択された弓状DNA折り紙構造に限定されない。さらに、系統的な改変により、この技術は、メタサーフェス33の製造に向けて道を開く異なる金属および基板に拡張することができる。
DNA折り紙媒介加工でパターン化された表面は、汎用性の高いセンサとして機能する場合があります。例えば、それらは表面増強されたラマン分光法(SERS)で使用することができる。個々のナノ形状の小さな寸法の結果として、作成された表面は、可視波長範囲で光学およびプラズモニックアプリケーションでの使用を見つけることができます。
プロトコル
1. DNA折り紙のデザイン
注:このプロトコルでは、ナノパターニングプロセスは、2次元(2D)弓状DNA折り紙構造(図1)34を用いて説明される。新しい DNA 折り紙の形状を設計するには、以下のガイドラインに従ってください。
- caDNAno35を使用してDNA折り紙の所望の形状と必要な主食鎖配列を設計します。平らな単層折り紙を作成するには、caDNAnoの正方形格子オプションを使用し、設計のいくつかのベースをスキップしてクロスオーバー間隔を手動で調整し(図1と補足caDNAnoファイルを参照)、結果として生じる構造的なねじれを除去します。正方形格子パッキング36、37から。
- ポリT(8 nt)の突出部を含む鎖で各DNAらせんの端を伸ばす;これにより、ブラントエンドベーススタッキングインタラクション(図1および補足caDNAnoファイル)を介してオブジェクトのマルチメライゼーションが防止されます。
- 設計の計算解析を実行します。CanDo38,39は、DNA折り紙の3次元(3D)形状および構造剛性を予測するために使用することができる。CanDoは、ツイスト補正に必要なベーススキップの数を反復化し、それに応じて設計を調整するのにも便利なツールです。
- caDNAnoでは、好ましい足場の長さを選択し、構造を折りたたむのに必要なステープルストランドを生成します。蝶ネクタイ構造には、7249 nt長いM13mp18足場と205個のユニークなステープルストが使用されます(補足caDNAnoファイルを参照)。
注:DNA折り紙構造40、41、42、43を設計するために利用可能な他の計算ツールもあります。選択したツール/ソフトウェアに応じて、他のシミュレーションツールも43、44を使用することができます。
2. DNA折り紙の組み立て
- 弓の構造に必要なすべてのオリゴヌクレオチド(合計205ステープル)34を混合することにより、ステープルストランドのストックを作ります。オリゴヌクレオチドは、すべて同じ初期濃度(例えば、RNase自由水中の100μM)を有する必要があります。
- M13mp18足場ストランド(タイプp7249、100nM)の20μLを混合することにより、0.2 mL PCLチューブで100 μL量のDNA折り紙折りたたみ反応混合物を調べ、各ストランドが500nM(これは10xモルの過剰を生み出す)のステープルストック溶液の40 μLを調作する。足場に)および2.5x折りたたみバッファー(FOB)の40 μL。FOBはトリスを含む - 酢酸 - エチレンディアミンテトラセチン酸 (EDTA) バッファー (TAE) MgCl2を補充.FOB成分濃度については、表1を参照してください。
- 90°Cから27°Cまでのサーモサイクラー中の反応混合物をアニールする。表 2 に示す熱折りたたみランプを使用します。
3. DNA折り紙の精製
注:ステープルストランドの過剰な量は、非破壊ポリ(エチレングリコール)(PEG)精製方法を使用してDNA折り紙溶液から除去することができます。プロトコルはStahlら45から適応される。
- 組み立てられたDNA折り紙構造の200 μLを希釈し、1x FOBの600 μL(表1参照)を使用して、800 μLの開始体積を得ます。
- 希釈されたDNA折り紙溶液1:1とPEG沈殿バッファー(15%PEG 8000(w/v)、1x TAE、505 mM NaCl)を混ぜ、前後にピペッティングして十分に混ぜます。
- 14,000 x gおよび室温で30分間混合物を遠心分離する。
- ピペットを使用して上清を慎重に取り除きます。
- 1x FOBの200 μLを追加し、ピペッティングによって穏やかに混合します。1x FOBの異なる量はまた、所望のDNA折り紙濃度を得るために添加することができる。
- DNA折り紙構造(チューブの底部に小さな透明ペレット)をリジス化するために、室温で一晩PEG精製DNA折り紙構造をインキュベートします。
- UV/Vis分光光度計を用いて波長260nmの吸光度を測定することにより、PEG精製後のDNA折り紙濃度を推定する。計算6の場合は、ビールランバート法と消滅係数1.1∙108 M-1 cm-1を使用します。PEG精製後の典型的なDNA折り紙濃度は15〜20nMである。
- PEG精製DNA折り紙構造を4°Cに保存します。DNA折り紙構造は通常数ヶ月間安定しているので、大量のストックを後で使用するために準備することができます。
注:ステープルストランドの過剰量は、スピン濾過47、レートゾーン遠心分離48およびアガロースゲル抽出49などの他の精製技術46を用いて除去することもできる。DNA折り紙構造は、種々の緩衝液50において安定であり、必要に応じて、スピン濾過51を介してPEG精製後に記憶媒体を変更することができる。
4. アガロースゲル電気泳動
注:折りたたみの品質と余分なステープルストランドの除去は、アガロースゲル電気泳動を使用して確認することができます。
- アーレンマイヤーフラスコにアガロース1gと1x TAEの45mLを加えて、約2%(w/v)のアガロースゲルを調調します。アガロースが完全に溶解し、透明な溶液が生成されるまで、電子レンジで混合物を加熱します。
- フラスコが触れるのが快適になるまで、流水の下で溶液を冷却します(50-60°C)。
- 溶液に110mM MgCl2および40 μLのエチジウム臭化溶液(0.58mgmL-1)の5mLを加え、混合物を穏やかに振ります。
注意:臭化エチジウムは、潜在的な発癌物質であり、注意して取り扱う必要があります。 - ゲル鋳造トレイをセットアップし、液体アガロースを鋳造トレイに注ぎます。ゲルを室温で少なくとも30分間固化させます。
- 鋳造トレイからゲルを取り出し、ゲル電気泳動室に入れます。チャンバーを実行バッファ(11 mM MgCl2で1x TAE)で充填します。
- サンプル溶液の5μLあたり6倍ゲルローディング色素の1 μLを追加し、十分に混ぜます。サンプル溶液の所望量を慎重に別々のゲルポケットに入れて、サンプルをロードします。
- アガロースゲルを95Vの一定電圧で45分間実行し、ゲルへの熱損傷を避けるために、氷浴の上にゲル電気泳動室を保管してください。
- ゲルイメージングシステムを用いて紫外線下のゲルを可視化する(図2A)。
5. 基板調製 (図 3A)
注: 以下の手順はすべて、SiO2の拡張を除き、クリーン ルーム内で実行されます (ステップ 9)。このプロセスが基板からすべての残留物を除去するのに十分でない場合は、洗浄ステップを標準的なピラニア溶液ベースの洗浄で置き換えることもできます。
- 基板として使用するウエハから7mm x 7mmのチップを切ります。SiNの場合は、シリコンソー、ダイヤモンドカッターペン、または同様の実装を使用します。ダイシングサファイア(Al2O3)は、特殊なツールや鋸刃が必要になります。チップサイズは正確である必要はありません。
- チップを掃除する
- 熱いアセトン(52°Cに加熱されたアセトン)とガラスにダイスチップを浸し、少なくとも15分間加熱しておきます。
- 彼らはまだ熱いアセトン浴中に、機械的に任意の残留フィルムを除去するために綿棒でチップをこする。
- ピンセットを使用して、熱いアセトンからチップを持ち上げ、洗濯ボトルを使用して室温アセトンで洗い流します。
- イソプロパノールとガラスにチップを浸し、2分間超音波。
- ピンセットでイソプロパノールからチップを持ち上げ、すぐに乾燥させ、窒素の流れを十分に使用します。ピンセットで覆われた領域が適切に乾燥せず、接触領域に残留物やその他の汚染が残る可能性があるため、チップの側面と端をタッチして保持するだけです。最良の結果を得るためには、できるだけ高い流れを使用し、チップ表面を流れ方向に平行に保持します。
- チップは、後で使用するために、クリーンルーム内の覆われた容器に保管してください。
6. 非晶質シリコン(a-Si)層のプラズマ増強化学蒸着(PECVD)(図3B)
- チップをPECVD装置に入れておきます。
- アモルファスシリコン(a-Si)の約50nmを成長させる堆積パラメータを設定します。正確な設定は、機器のモデルとキャリブレーションによって異なります。ここで使用するパラメータについては、表 3を参照してください。a-Si 堆積プログラムを実行して、レイヤーを拡張します。
- 加工後、標準的なクリーンルームの状態で覆われた容器にチップを保管してください。
7. a-Si層の酸素プラズマ処理(図3B)
注:このステップは、基板表面がわずかに負に帯電し、親水性にするので、DNA折り紙構造は、後で追加のマグネシウムイオンの助けを借りて表面に効果的に吸着することができます。
- 反応性イオンエッチング(RIE)装置にチップを入します。
- 酸素プラズマを生成するエッチングパラメータを設定します。繰り返しますが、正確な設定は機器のモデルとキャリブレーションによって異なります。ここで使用するパラメータについては、表 3を参照してください。酸素プラズマ治療プログラムを実行します。
- 治療の効果が急速に悪化するように、すぐに次のステップに進みます。典型的には、基板は、プラズマ処理後30分以内に使用されるべきである。
8. DNA折り紙の堆積 (図 3C)
- 折りたたまれた/精製されたDNA折り紙溶液(〜20 nM)の5 μLを1x FOBの4 μLおよび1M MgCl2の1μLと混合して蒸着用のDNA折り紙混合物を調出す。得られた溶液は、〜10 nM DNA折り紙とMg2+のおよそ100 mMを含む。
- 酸素プラズマ処理チップにDNA折り紙混合物の10μLを堆積させ、室温で5分間覆ったインキュベートを行います。カバーは意図しない乾燥を防ぎ、後で余分な塩およびDNA折り紙の構造を取除くのを助ける。
- インキュベーション後、まず100μLの蒸留水(例えば、MilliQ)をチップ上にピペッティングして表面を洗浄します。チップの中心に触れないように、ピペットで水を数回前後にすすいでください。ピペットで表面から水のほとんどを取り除きます。これにより、適切に吸着した折り紙のみが表面に残ります。
- この洗浄サイクル(ステップ8.3)を3~4回繰り返します。
- 洗浄後、窒素の流れですぐにサンプルを乾燥させます。これを基板調製での乾燥と同じ方法で行います(ステップ5)。サンプルを可能な限り完全に乾燥することが重要です。
注:堆積構造体の密度およびしたがって金属ナノ構造の密度は、堆積溶液中のDNA折り紙およびMg2+の濃度を調整することによって修飾することができる。Mg2+濃度が高いほどDNA折り紙の接着性が向上し、密度が高くなりますが、最終的にはDNA折り紙構造の凝集も引き起こします。したがって、主にDNA折り紙濃度を最初に調整する必要があります。
9. SiO2マスクの成長 (図 3D)
注:このステップは、クリーンルームの外で実行することができます。次のバージョンでは、負のトーンパターンが生成されますが、代わりに正のトーンパターンを生成するためにプロセスを変更することが可能です。SiO2の成長プロセスは、Surwade et al.52から適応され、著者53によってさらに開発され、最終的にこのプロトコル用に最適化された。
- シール可能なデシケータ(1.5 L)、デシケータ内部に収まるペトリ皿(オプション)、デシケータ内部のプラットホームとして機能できる穿施されたプレートを取ります。
- 100gのシリカゲルを取り、ペトリ皿または直接デシケータで蒸留水の30グラムと混ぜます。この工程は、シリカゲルが安定化するように、少なくとも24時間前に行う。
注:これは、デシケータ内の湿度を制御するために使用され、したがって、SiO2フィルムの成長率と形態も制御します。湿度が高いほど、速度が高くなり、構造が粗くなります。あるいは、シリカゲルは、気候試験室で硬化させることができる。 - シリカゲルをデシケータに入れ、穿施されたプレートで分離します。
- 吸着したDNA折り紙と、テトラエチルオルソシリケート(TEOS)の10 mLの開いたバイアルと、25%の水酸化アンモニウム(NH4OH)の10mLの別のバイアルを、穿開されたプラットフォーム上に配置します。サンプルの近くと反対側にバイアルを設定します。好ましくは、フラスココルクまたは同様の平らな台座を使用して、プラットフォームからわずかにチップを上げます。
注意:NH4OHとTEOSの両方が皮膚接触の場合に有害であり、その蒸気は、目と呼吸器官の両方に刺激を引き起こす可能性があります。換気の良い場所で使用し、保護手袋、目の保護、保護衣具を着用してください。 - チャンバーを密閉し、室温で20時間インキュベートします。これにより、DNA折り紙構造が見つからない領域にSiO2膜が成長し、DNA折り紙の形をした穴を持つ10-20nmパターンマスクが作成されます(図4)。
- インキュベーション後にチャンバーからサンプルを取り出します。屋根付きのコンテナに保管します。ここで処理を一時停止できます。使用済みのTEOSおよびNH4OHを廃棄する。シリカゲルのバッチは、使用の間にデシケータ内に密封され、2〜3週間以内に使用される場合、2〜3回使用することができます。
10. SiO2およびa-Siの反応性イオンエッチング(RIE)(図3E)
- 反応性イオンエッチング(RIE)装置にチップを入します。
- SiO 2マスクの穴の下の a-Si 層を明らかにするために、SiO2のエッチング パラメータのみをエッチングパラメータを設定します。正確な設定は、個々の機器に対して実験的に決定する必要があります。ここで使用するパラメータを表 3に示します。対方対性SiO2プラズマエッチングプログラムを実行します。
- 50 nm a-Si 層を貫通するエッチング パラメータを設定します。ここで使用するパラメータは、表 3に再び示されています。等方性a-Siプラズマエッチングプログラムを実行します。
- RIE機器からサンプルを取り外し、カバーされた保管を行います。ここで処理を再度中断できます。
11. 金属の物理的な蒸着(PVD)(図3F)
- チップをPVD機器の蒸発室に積み込みます。
- ターゲット メタルを選択します。まず、粘着金属を選択します。ここで、クロム(Cr)の2nmが用いられる。
- ターゲットマテリアルと厚さの厚さ制御プログラムを設定します。制御方法は計測器に依存します。ここでは、水晶マイクロバランス(QCM)を用いる。測定された厚さは、ターゲット材料密度とZ係数によって調整され、デバイスと各ターゲット材料に固有の実験的に決定されたツーリング係数によって補正する必要があります。
- 電子ビームを開始し、ビームをターゲットに合わせ、0.05 nm/sの堆積速度に達するまでビーム電流を増加させる。2 nm の最終的な厚さに達するまで蒸発します。
- チャンバーを通気したり、プロセスを中断することなく、2番目のターゲット金属(例えば金)を選択します。中断または通気は、接着剤金属が酸化を開始し、接着剤としてのその使いやすさを低下させることができます。
- 手順 11.3 から 11.4 を繰り返します。20nmに達するまで蒸発する。これは、22 nmの全高を持つSiO2マスク穴を通してDNA折り紙形の金属構造を作成します。
- チャンバーを通し、サンプルを除去します。
- サンプルがカバーされている場合は、ここで処理を一時停止できます。
12. フッ化水素酸(HF)を使用したリフトオフ(図3G)
- 適切なプラスチック容器に50%HFベースのエトチャント溶液を注ぎます。HClはサンプル中のCrをエッチングするので、混合物にHClを使用しないでください。
注意:HFは非常に腐食性であり、重度の刺激および火傷を引き起こし、皮膚接触または吸入した場合に致命的なことができます。保護エプロン、耐薬品性手袋とフェイスバイザー、またはそれ以外の場合は完全な化学的保護を備えた専用のヒュームフードまたは換気されたウェットベンチでのみHFを使用してください。 - HFベースのエチャントにサンプルを浸し、プラスチックピンセットで静かにかき混ぜます。
- SiO2層が完全にエッチングされ、金属層が取り外されるのを待ちます。時間は、マスク穴の密度に応じて顕著に異なります。穴の数が多いほど、より速いエッチングに変換されます。金属層が剥がれにくい場合は、5~10sの短い超音波処理を使用できます。
- 金属フィルムが取り出されたら、二重蒸留水とイソプロパノールでサンプルをすすいでください。
- すす後、基板調製の指示と同じ方法で窒素流で試料を乾燥させる(ステップ5)。形成されたナノ構造体を破壊する可能性があるため、ピンセットがチップセンターと接触しないようにしてください。
注:サンプルはここで保存され、処理が中断することができます。
13. 残りのa-SiのRIE (図3H)
- 反応性イオンエッチング(RIE)装置にチップを入します。
- a-Si のすべての 50 nm を完全に除去するためのエッチング パラメータを設定します。パラメータはステップ10と同じでもかまいますが、エッチング時間(40s)を少し長くすると、すべてのa-Siを確実に除去できます。ここで使用するパラメータについては、表 3を参照してください。 等方性 a-Si プラズマエッチング プログラムを実行して、残りの a-Si を削除します。
- RIE機器からサンプルを取り外し、カバーされた保管を行います。これでサンプル処理は終了します。
14. 原子力顕微鏡(AFM)
注:原子力顕微鏡と走査型電子顕微鏡は、フィルムの成長とパターニングの成功を監視するだけでなく、折り畳まれたDNA折り紙構造を画像化するために使用することができます(図2B,C)。手順 5 ~ 13 の処理済みサンプルをイメージした場合は、次のサンプル調製手順をスキップできます。
- AFMのサンプル調製
- 折りたたまれたDNA折り紙を画像化するには、マイカ基板のチップを取ります。
- 粘着剤を使用して、ミカチップをガラス顕微鏡スライドに取り付けます。
- 約0.4nMの濃度に〜20nM DNA折り紙ストックを1x FOBで50回希釈することにより、DNA折り紙溶液の10 μLを調出します。希釈は、基板の過密化を防止するために行われる。
- マイカシートの最上層を弱いテープで剥がし、新たに裂けた荷電の表面を得ます。
- 希釈したDNA折り紙溶液を切断マイカに堆積させ、室温で1分間覆われたサンプルをインキュベートします。
- インキュベーション後、ピペットを使用して蒸留水の100 μLで表面を3〜4回洗浄します。これにより、適切に吸着した折り紙のみが表面に残ります。
- マイカ表面に蒸留水を100μL堆積させます。
- テーブルの顕微鏡スライドを傾けて鋭くタップし、水の大部分を取り外します。
- この洗浄サイクルを3~4回繰り返します。
- 洗浄直後に窒素の流れでサンプルを十分に乾燥させます。サンプルはAFMイメージ投射の準備ができている。
- DNA折り紙サンプルまたは処理されたチップをAFMに入れ、スキャンを実行します。1-10 μmのスキャンサイズは、構造を適切に解決するのに適しています。
15. 走査電子顕微鏡(SEM)
- サンプルを SEM に配置します。加工チップは、次の方法で使用できます(さらなるサンプル調製は必要ありません)。
- 加速度電圧を選択します。サンプル基板(Al2O3またはSiN)は絶縁体であるため、低電圧(5~10kV)を使用して充電効果を低減します。
- 関心のある領域をスキャンします。スキャン時間を最小限に抑え、充電を減らし、汚染の堆積を避けます。
結果
ボウタイDNA折り紙のデザインとその構造の詳細の概略図を図1に示します。アガロースゲル電気泳動とAFMは、DNA折り紙の折りたたみとPEG精製の品質を分析するために使用されます(図2)。ナノリソグラフィーステップのプロセスフローを図3に示します。SiO2マスクの成長後の代表的なAFM画像を図4に示します(このステップは図3Dに示しています)が、最終的な金属ナノ構造体のSEM画像を図5に示します(このステップは図5に示されています(このステップは図5に示されています。図 3H)。図6は、弓ネクタイDNA折り紙によってテンプレート化された金属ナノ構造体の光学的機能を示す。
| 折りたたみバッファー(FOB)成分濃度 [mM] | |||||
| トリス | 酢酸 | Edta | 塩化マグネシウム | 博士 | |
| 2.5x フォブ | 100 | 47.5 | 2.5 | 31.25 | ~8,3 |
| 1xフォブ | 40 | 19 | 1 | 12.5 | ~8,3 |
表1:折りたたみバッファー(FOB)の組成。
| 温度範囲[oC] | 冷却速度 |
| 90-70 | -0.2 °C / 8 s |
| 70-60 | -0.1 °C / 8 s |
| 60-27 | -0.1 °C / 2 s |
| 12 | 停止するまで保留 |
表2:蝶ネクタイ折り紙折りたたみのためのサーマルランプ。アニーリング後、折り紙はプログラムが手動で停止するまで12°Cに保存されます。
| PECVD パラメータと RIE パラメータ | ||||||
| ガス | ガスの流れ [sccm] | 室内圧力 [mTorr] | RFパワー [W] | 温度[oC] | 継続時間 [s] | |
| a-Si の PECVD | 5% SiH4で N2 | 500 | 1000 | 15 | 250 | 90 |
| O2プラズマ処理 | O2 | 50 | 40 | 200 | 30 | 1200 |
| SiO2のRIE | CHF3 | 25 | ||||
| Ar | 25 | 30 | 100 | 25 | 10-22 | |
| a-Si の RIE | O2 | 8 | ||||
| SF6 | 100 | 90 | 50 | 30 | 35 | |
| 残りの a-Si の RIE | O2 | 8 | ||||
| SF6 | 100 | 90 | 50 | 30 | 35-40 |
表3:プラズマ増強化学蒸着(PECVD)および反応性イオンエッチング(RIE)のプロセスパラメータ。これらのデバイスのプロセスパラメータは、個々の機器に固有であり、使用時に適応する必要がある場合があります。
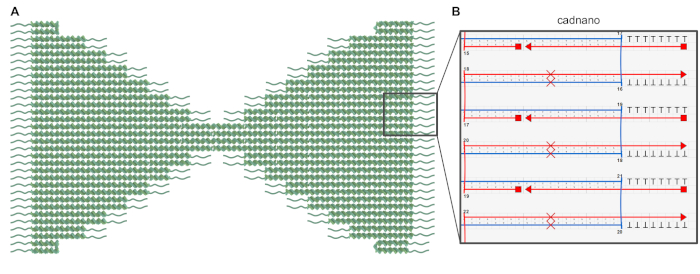
図1:蝶ネクタイDNA折り紙のデザイン。(A)コア構造が二重ヘリックスで表示され、ポリTオーバーハングが波線で描かれている弓折り紙の概略図。(B)caDNAnoソフトウェアの蝶ネクタイ折り紙デザインの一部のスクリーンショット。赤い十字は、ツイスト補正のためにスキップするベースペアを示し、T8-オーバーハングは、鈍いエンドのベーススタッキングを防ぐために追加されます。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図2:弓ネクタイDNA折り紙構造の特徴付け。(A)ポリ(エチレングリコール)(PEG)精製前後の弓構造のアガロースゲル電気泳動。7249ヌクレオチド長い足場が参照として使用される。(B)浄化前の蝶ネクタイ構造の原子力顕微鏡(AFM)画像。(C)PEG精製後の蝶ネクタイ構造のAFM画像。この図のより大きなバージョンを表示するには、ここをクリックしてください。
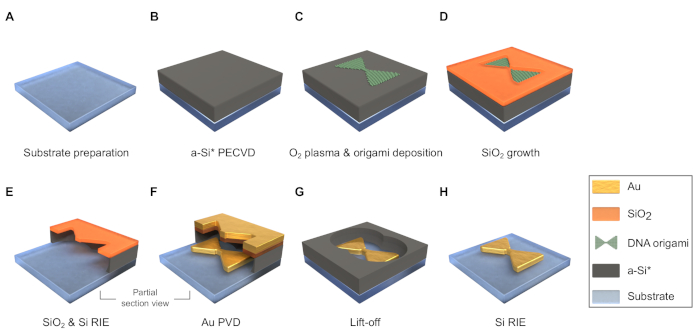
図3:製造工程フローのスキーム(寸法はスケールではない)。(A)基板をサイコロと清掃します。(B)プラズマ増強化学蒸着(PECVD)によりa-Si層を堆積させます。*a-Siの下に追加の犠牲層を採用し、HF.(C)以外のエッチングでリフトオフを可能にし、試料表面をO2プラズマで処理し、DNA折り紙を堆積させることができます。(D)SiO2マスクをデシケータで成長させる。(E)SiO2の薄い層をエッチングし、その下のa-Siを通して反応性イオンエッチング(RIE)を行う。(F)物理的な蒸着(PVD)によりマスクを通して金属を堆積する。(G)HF.(H)RIE によって残りの a-Si を取り外します。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図4:DNA折り紙形パターンを持つSiO2フィルムの代表的なAFM画像。 (A)10 μm x 10 μmの走査面積は、パターン形成の高い収率を示す。(B)近い 3 μm x 3 μm スキャンは、SiO2フィルム内の正確な個々のパターンを示します。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図5:構造的に異なるDNA折り紙でテンプレート化された金属ナノ構造の代表的な走査型電子顕微鏡(SEM)画像。(A)十字型DNA折り紙、すなわち、いわゆるシーマンタイル折り紙54。(B)ボウタイアンテナ。(C)キラルダブルL(CDL)構造。インセットは、150 nm x 150 nm のボックスサイズを持つ個々の構造を示します。正確な構造の製造収率は、弓折り紙の場合は最大76%、ここで表示される他の構造については~50%である。この図は、Shen et al.34から適応および変更されています。この図は著者の許可を得て再現され、2018年アメリカ科学振興協会によって出版されました。この図のより大きなバージョンを表示するには、ここをクリックしてください。
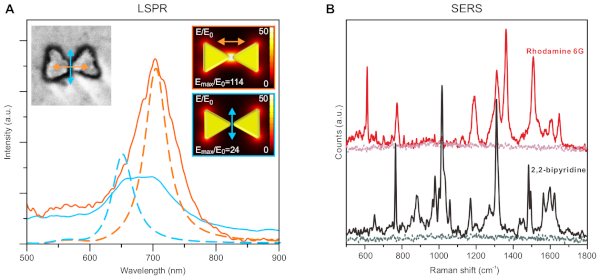
図6:得られたナノ構造の代表的な光学的/機能的特性。(A)異なる偏光(オレンジ色と青色でコード化された色)を持つ個々の金弓構造の局所的な表面プラズモン共鳴(LSPR)の測定値。実線はスペクトルを測定し、破線はシミュレーション結果です。インセットは、測定されたパーティクル(左)とシミュレーションに使用するモデル(右)のSEMイメージを示します。(B)表面強化ラマン分光法(SERS)のローダミン6Gと2,2-ビピリジンを弓ナノ構造で覆われた表面で測定した。各サンプルのベースラインは、ナノ構造体が存在しなかったときにシグナルレベルを示す。この図は、Shen et al.34から適応および変更されています。この図は著者の許可を得て再現され、2018年アメリカ科学振興協会によって出版されました。この図のより大きなバージョンを表示するには、ここをクリックしてください。

補足ファイル1:CaDNAnoファイルここをクリックしてこのファイルをダウンロードしてください。

補足ファイル2:m13mp18シーケンスこのファイルをダウンロードするにはここをクリックしてください。
補足ファイル3:ステープルストランドシーケンスこのファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
プロトコルは生産されたナノ構造の形の大きい自由そして正確さを提供する。DNA折り紙の設計を変えることで、金属ナノ構造の形状を制御することができます。金属構造の最終的な、正確な形状は、マスク成長工程(ステップ9)によってさらに決定され、マスクエッチング(ステップ10)によってより少ない程度に対向性ではない場合。マスクの成長時間が十分に延長されると、マスクの穴が閉じ始めます。これは、弓折り紙の三角形を分離したShen et al.34で示されているように、いくつかの構造の最も薄い特徴を省略し、ギャップサイズを制御するために使用することができます(図5B)。逆に、より薄い形状は、酸化物の成長時間を短縮することによってより良く保存することができる。これは、使用する折り紙の設計を変更するだけでなく、SiO2フィルムの成長を調整することによっても、図6に表示される光学特性を調整することが可能であることを意味します。
マスクの厚さが大幅に変更された場合は、その変更も SiO2 RIE ステップに反映する必要があります。SiO2の非常に薄い層だけがマスク穴を通してかろうじて突き刺すためにエッチング(2-5 nm)する必要があります。これは、プロセス全体の中で最も敏感で重要な部分です。エッチング時間は非常に短く、わずか10〜20sなので、新しい機器を最初に試みたときに正確な設定を実験的に決定する必要があります。これは、一部の SiO2が a-Si エッチング中にエッチングされる場合も同様です。エッチングされたSiO2の範囲は、使用されるa-Siエッチングパラメータ、機器、さらには個々の機器のキャリブレーションの選択性によって決定されます。これら2つのプロセスの間にSiO2層全体をエッチングしないように注意する必要があります。
もう一つの敏感なステップは、SiO2の成長です。成長プロセスは、チャンバー湿度と使用されるTEOSの現在の活性の両方に依存します。TEOSは空気から水を吸着すると劣化し、経年とともに効果が低下します。これは、化学物質の適切な貯蔵を行っても、数ヶ月以内に著しく遅く、制御不能な成長率として現れる可能性があります。34得られたSiO2層が意図したよりも薄い場合、これは室内湿度ではなくTEOSに問題を示す可能性がある。湿度が低いと、成長率が低くなりフィルムが薄くなることもありますが、得られるフィルムも通常よりも滑らかでなければなりません。一方、粗粒状の粗い層は、逆に高湿度の問題を示します。
また、2つの要件を持つ他の自由に選択された基板上でこのプロトコルを実行することも可能です:それは、HFエッチング(ステップ12)とPECVDの200-300°C温度の両方を許容しなければなりません(ステップ6)。より感度の高い基板を使用すれば、a-SiのPECVDの温度を安全に100°Cに下げることができますが、プロトコルに正確に従えばHFは避けられません。HF を回避するには、追加の犠牲層の適用が必要になります。HFエッチングの要件が除去された場合、このプロトコルは、基板材料および金属のより広い選択と互換性を持つようになります。
このプロトコルは、一般的に使用され、堅牢なマイクロファブリケーションプロセスで構成されているので、小さな特徴サイズと複雑な金属形状が望まれる他のマイクロファブリケーションプロトコルの任意の数と組み合わせることができます。近い将来、特に低コストのDNA折り紙量産31の来て、この方法は、インターフェイスベースのナノフォトニクスとプラズモニクス55のための一般的な使用とハイスループットナノパターニングの両方を容易にする可能性があります55.
開示事項
著者は何も開示していない。
謝辞
この研究は、フィンランドアカデミー(プロジェクト286845、308578、303804、267497)、ジェーンとアトス・エルッコ財団、シグリッド・ジュセリウス財団によって支援されました。この研究は、フィンランド・アカデミー・オブ・エクセレンス・プログラム(2014-2019)の下で行われました。我々は、アアルト大学バイオエコノミー施設及びオタナノナノナノナノナノナノ(Aalto-NMC)およびマイクロノバナノファブリケーションセンターによる施設及び技術支援の提供を認める。
資料
| Name | Company | Catalog Number | Comments |
| Acetone | Honeywell | 40289H | Semiconductor grade ULSI, ≥ 99.5 % |
| Agarose | Fisher Bioreagents | 1036603 | Low-EEO, multi-purpose and molecular biology grade |
| Ammonium hydroxide | Fisher Chemical | 10652251 | 25 % ammonia solution, Certified AR for Analysis, d = 0.91 |
| BRANSON 5510 | Branson | Ultrasonic bath | |
| Dimension Icon | Bruker | Atomic force microscope | |
| Electron-beam evaporator IM-9912 | Instrumentti Mattila | Evaporator for PVD | |
| Ethidium bromide | Sigma Aldrich | E8751 | Fluorescent dye for DNA staining |
| Eon Microplate spectrophotometer | BioTek | UV/Vis spectrophotometer used for DNA origami concentration measurements | |
| Gel Doc XR+ Documentation System | BioRad | Gel imaging system | |
| Gel Loading Dye, Blue (6×) | New England Biolabs | B7021S | Bromophenol blue-based loading dye for agarose gel electrophoresis |
| G-storm GS1 Thermal cycler | Gene Technologies | ||
| HBR 4 | IKA | Heating bath | |
| Hydrofluoric acid | Honeywell | 40213H | Semiconductor grade, 49.5-50.5 % |
| Isopropanol | Honeywell | 40301H | Semiconductor grade VLSI, ≥ 99.8 % |
| Magnesium chloride | Sigma Aldrich | M8266 | Anhydrous, ≥ 98 % |
| Mini-Sub Cell GT Horizontal Electrophoresis System | BioRad | ||
| Plasmalab 80+ PECVD | Oxford Instruments | PECVD system | |
| Plasmalab 80+ RIE | Oxford Instruments | RIE system | |
| Poly(ethylene glycol) | Sigma Aldrich | 89510 | BioUltra, 8,000 |
| PowerPac HC High-Current Power Supply | BioRad | ||
| Sapphire substrate (Al2O3) | University Wafer | Thickness: 430 μm, Polish: DSP, Size: 50.8 mm | |
| Sigma VP | Zeiss | Scanning electron microscope | |
| Silica gel | Merck | 1019691000 | With indicator (orange gel), granulate ~1-3 mm |
| Single-stranded Scaffold DNA, type p7249 | Tilibit Nanosystems | At 100 nM concentration | |
| Sodium chloride | Sigma Aldrich | S9888 | ACS reagent, ≥ 99.0 % |
| Staple strands (oligonucleotides) | Integrated DNA Technologies | Sequences can be ordered e.g. at 100 micromolar in Rnase-free water | |
| TAE buffer (50×) pH 8.0 | VWR Chemicals | 444125D | Electran Electrophoresis grade |
| Take3 micro-volume plate | BioTek | Used for DNA origami concentration measurements | |
| Tetraethyl orthosilicate | Sigma Aldrich | 86578 | ≥ 99.0 % (GC) |
参考文献
- Seeman, N. C., Sleiman, H. F. DNA nanotechnology. Nature Reviews Materials. 3 (1), 17068 (2017).
- Linko, V., Dietz, H. The enabled state of DNA nanotechnology. Current Opinion in Biotechnology. 24 (4), 555-561 (2013).
- Rothemund, P. W. K. Folding DNA to create nanoscale shapes and patterns. Nature. 440 (7082), 297-302 (2006).
- Hong, F., Zhang, F., Liu, Y., Yan, H. DNA Origami: Scaffolds for Creating Higher Order Structures. Chemical Reviews. 117 (20), 12584-12640 (2017).
- Maune, H. T., et al. Self-assembly of carbon nanotubes into two-dimensional geometries using DNA origami templates. Nature Nanotechnology. 5 (1), 61-66 (2010).
- Hung, A. M., et al. Large-area spatially ordered arrays of gold nanoparticles directed by lithographically confined DNA origami. Nature Nanotechnology. 5 (2), 121-126 (2010).
- Kuzyk, A., et al. DNA-based self-assembly of chiral plasmonic nanostructures with tailored optical response. Nature. 483 (7389), 311-314 (2012).
- Zhang, T., et al. 3D DNA Origami Crystals. Advanced Materials. 30 (28), 1800273 (2018).
- Julin, S., et al. DNA origami directed 3D nanoparticle superlattice via electrostatic assembly. Nanoscale. 11 (10), 4546-4551 (2019).
- Fu, J., Liu, M., Liu, Y., Yan, H. Spatially-Interactive Biomolecular Networks Organized by Nucleic Acid Nanostructures. Accounts of Chemical Research. 45 (8), 1215-1226 (2012).
- Linko, V., et al. DNA-based enzyme reactors and systems. Nanomaterials. 6 (8), 139 (2015).
- Ramakrishnan, S., Subramaniam, S., Stewart, A. F., Grundmeier, G., Keller, A. Regular Nanoscale Protein Patterns via Directed Adsorption through Self-Assembled DNA Origami Masks. ACS Applied Materials & Interfaces. 8 (45), 31239-31247 (2016).
- Grossi, G., Jaekel, A., Andersen, E. S., Saccà, B. Enzyme-functionalized DNA nanostructures as tools for organizing and controlling enzymatic reactions. MRS Bulletin. 42 (12), 920-924 (2017).
- Douglas, S. M., Bachelet, I., Church, G. M. A logic-gated nanorobot for targeted transport of molecular payloads. Science. 335 (6070), 831-834 (2012).
- Li, S., et al. A DNA nanorobot functions as a cancer therapeutic in response to a molecular trigger in vivo. Nature Biotechnology. 36 (3), 258-264 (2018).
- Zhao, Y. -. X., et al. DNA origami delivery system for cancer therapy with tunable release properties. ACS Nano. 6 (10), 8684-8691 (2014).
- Kollmann, F., et al. Superstructure-Dependent Loading of DNA Origami Nanostructures with a Groove-Binding Drug. ACS Omega. 3 (8), 9441-9448 (2018).
- Zhang, D. Y., Seelig, G. Dynamic DNA nanotechnology using strand-displacement reactions. Nature Chemistry. 3 (2), 103-113 (2011).
- Ijäs, H., Nummelin, S., Shen, B., Kostiainen, M. A., Linko, V. Dynamic DNA Origami Devices: from Strand-Displacement Reactions to External-Stimuli Responsive Systems. International Journal of Molecular Sciences. 19 (7), 2114 (2018).
- Li, J., Fan, C., Pei, H., Shi, J., Huang, Q. Smart Drug Delivery Nanocarriers with Self-Assembled DNA Nanostructures. Advanced Materials. 25 (32), 4386-4396 (2013).
- Linko, V., Ora, A., Kostiainen, M. A. DNA Nanostructures as Smart Drug-Delivery Vehicles and Molecular Devices. Trends in Biotechnology. 33 (10), 586-594 (2015).
- Jiang, Q., Liu, S., Liu, J., Wang, Z. G., Ding, B. Rationally Designed DNA-Origami Nanomaterials for Drug Delivery In Vivo. Advanced Materials. , (2018).
- Shen, B., Linko, V., Dietz, H., Toppari, J. J. Dielectrophoretic trapping of multilayer DNA origami nanostructures and DNA origami-induced local destruction of silicon dioxide. Electrophoresis. 36 (2), 255-262 (2015).
- Kuzyk, A., Jungmann, R., Acuna, G. P., Liu, N. DNA Origami Route for Nanophotonics. ACS Photonics. 5 (4), 1151-1163 (2018).
- Liu, N., Liedl, T. DNA-Assembled Advanced Plasmonic Architectures. Chemical Reviews. 118 (6), 3032-3053 (2018).
- Bathe, M., Rothemund, M. DNA Nanotechnology: A Foundation for Programmable Nanoscale Materials. MRS Bulletin. 42 (12), 882-888 (2017).
- Pilo-Pais, M., Acuna, G. P., Tinnefeld, P., Liedl, T. Sculpting light by arranging optical components with DNA nanostructures. MRS Bulletin. 42 (12), 936-942 (2017).
- Graugnard, E., Hughes, W. L., Jungmann, R., Kostiainen, M. A., Linko, V. Nanometrology and super-resolution imaging with DNA. MRS Bulletin. 42 (12), 951-959 (2017).
- Zhong, J., et al. Metallized DNA nanolithography for encoding and transferring spatial information for graphene patterning. Nature Communications. 4, 1663 (2013).
- Zhang, G., Surwade, S. P., Zhou, F., Liu, H. DNA nanostructure meets nanofabrication. Chemical Society Reviews. 42 (7), 2488-2496 (2013).
- Praetorius, F., Kick, B., Behler, K. L., Honemann, M. N., Weuster-Botz, D., Dietz, H. Biotechnological mass production of DNA origami. Nature. 552 (7683), 84-87 (2017).
- Linko, V., et al. One-step large-scale deposition of salt-free DNA origami nanostructures. Scientific Reports. 5, 15634 (2015).
- Arbabi, A., Horie, Y., Bagheri, M., Faraon, A. Dielectric metasurfaces for complete control of phase and polarization with subwavelength spatial resolution and high transmission. Nature Nanotechnology. 10 (11), 937-943 (2015).
- Shen, B., et al. Plasmonic nanostructures through DNA-assisted lithography. Science Advances. 4 (2), (2018).
- Douglas, S. M., et al. Rapid prototyping of 3D DNA-origami shapes with caDNAno. Nucleic Acids Research. 37 (26), 5001-5006 (2009).
- Ke, Y., et al. Multilayer DNA Origami Packed on a Square Lattice. Journal of the American Chemical Society. 131 (43), 15903-15908 (2009).
- Dietz, H., Douglas, S. M., Shih, W. M. Folding DNA into twisted and curved nanoscale shapes. Science. 325 (5941), 725-730 (2009).
- Castro, C. E., et al. A primer to scaffolded DNA origami. Nature Methods. 8 (3), 221-229 (2011).
- Kim, D. -. N., Kilchherr, F., Dietz, H., Bathe, M. Quantitative prediction of 3D solution shape and flexibility of nucleic acid nanostructures. Nucleic Acids Research. 40 (7), 2862-2868 (2011).
- Benson, E., et al. DNA rendering of polyhedral meshes at the nanoscale. Nature. 523 (7561), 441-444 (2015).
- Veneziano, R., et al. Designer nanoscale DNA assemblies programmed from the top down. Science. 352 (6923), 1534 (2016).
- Linko, V., Kostiainen, M. A. Automated design of DNA origami. Nature Biotechnology. 34 (8), 826-827 (2016).
- Nummelin, S., Kommeri, J., Kostiainen, M. A., Linko, V. Evolution of Structural DNA Nanotechnology. Advanced Materials. 30 (24), 1703721 (2018).
- Maffeo, C., Yoo, J., Aksimentiev, A. De novo reconstruction of DNA origami structures through atomistic molecular dynamics simulation. Nucleic Acids Research. 44 (7), 3013-3019 (2016).
- Stahl, E., Martin, T. G., Praetorius, F., Dietz, H. Facile and Scalable Preparation of Pure and Dense DNA Origami Solutions. Angewandte Chemie International Edition. 53 (47), 12735-12740 (2014).
- Shaw, A., Benson, E., Högberg, B. Purification of Functionalized DNA Origami Nanostructures. ACS Nano. 9 (5), 4968-4975 (2015).
- Kuzyk, A., Yurke, B., Toppari, J. J., Linko, V., Törmä, P. Dielectrophoretic Trapping of DNA Origami. Small. 4 (4), 447-450 (2008).
- Lin, C., Perrault, S. D., Kwak, M., Graf, F., Shih, W. M. Purification of DNA-origami nanostructures by rate-zonal centrifugation. Nucleic Acids Research. 41 (2), 40 (2013).
- Douglas, S. M., et al. Self-assembly of DNA into nanoscale three-dimensional shapes. Nature. 459 (7245), 414-418 (2009).
- Ramakrishnan, S., Ijäs, H., Linko, V., Keller, A. Structural stability of DNA origami nanostructures under application-specific conditions. Computational and Structural Biotechnology Journal. 16, 342-349 (2018).
- Kielar, C., et al. On the Stability of DNA Origami Nanostructures in Low-Magnesium Buffers. Angewandte Chemie International Edition. 57 (30), 9470-9474 (2018).
- Surwade, S. P., et al. Nanoscale growth and patterning of inorganic oxides using DNA nanostructure templates. Journal of the American Chemical Society. 135 (18), 6778-6781 (2013).
- Shen, B., Linko, V., Tapio, K., Kostiainen, M. A., Toppari, J. J. Custom-shaped metal nanostructures based on DNA origami silhouettes. Nanoscale. 7 (26), 11267-11272 (2015).
- Liu, W., Zhong, H., Wang, R., Seeman, N. C. Crystalline Two-Dimensional DNA-Origami Arrays. Angewandte Chemie International Edition. 50 (1), 264-267 (2011).
- Shen, B., Kostiainen, M. A., Linko, V. DNA Origami Nanophotonics and Plasmonics at Interfaces. Langmuir. 34 (49), 14911-14920 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved