Method Article
DNA origami-mediada substrato Nanopatterning de estruturas inorgânicas para aplicações de sensoriamento
Neste Artigo
Resumo
Aqui, descrevemos um protocolo para criar nanoestruturas inorgânicas discretas e precisas em substratos usando formas de DNA origami como modelos orientadores. O método é demonstrado através da criação de antenas de ouro plasmônicas em forma de bowtie em um substrato transparente (safira).
Resumo
A nanotecnologia de DNA estrutural fornece uma rota viável para a construção do bottom-up usando o DNA como material de construção. A técnica de nanofabricação de DNA mais comum é chamada de DNA origami, e permite a síntese de alta produtividade de estruturas precisas e altamente versáteis com precisão de nível nanômetro. Aqui, mostra-se como a informação espacial do origami de DNA pode ser transferida para nanoestruturas metálicas, combinando o origami de DNA bottom-up com as abordagens de litografia de cima para baixo convencionalmente usado. Isso permite a fabricação de bilhões de nanoestruturas minúsculas em um passo para substratos selecionados. O método é demonstrado usando origami de DNA bowtie para criar estruturas metálicas em forma de antena bowtie em substratos de nitreto de silício ou safira. O método baseia-se no crescimento seletivo de uma camada de óxido de silício em cima do substrato de deposição de origami, resultando assim em uma máscara de padronização para seguir etapas litográficas. Estas superfícies nanostructure-equipadas podem mais ser usadas como sensores moleculars (por exemplo, Espectroscopia Raman superfície-realçada (SERS)) e em várias outras aplicações óticas na escala visível do comprimento de onda devido aos tamanhos pequenos da característica (secundário-10 nanômetro). A técnica pode ser estendida a outros materiais através de modificações metodológicas; Conseqüentemente, as superfícies opticamente ativas resultantes podem encontrar o uso no desenvolvimento de metamateriais e de metasurfaces.
Introdução
A nanotecnologia de DNA estrutural evoluiu rapidamentedurante a década recente1,2, eo desenvolvimento mais influente no campo tem sido, semdúvida, ainvenção do DNA origami3,4. A técnica de DNA origami permite a fabricação de praticamente qualquer nanoforma com características estruturais precisas3,4. Este método poderoso pode ser usado em (sub) nanômetro-arranjo espacial preciso e ancoragem de outros nano-objetos, tais como nanotubos de carbono5, nanopartículas de metal6,7,8, 9, enzimas/proteínas10,11,12,13 e materiais terapêuticos14,15,16,17 . É importante ressaltar que essas estruturas não são meramente estáticas, mas também podem ser programadas para atuar de forma dinâmica18,19. As inúmeras aplicações de DNA origami variam de entrega de drogas20,21,22 a eletrônica molecular/plasmonics5,23,24, 25 e da ciência dos materiais26,27 às técnicas novas da imagem latente e da calibração28.
Além das aplicações mencionadas acima, a resolução espacial extrema das formas DNA origami poderia ser aproveitado em aspectos e delicada litografia nanoescala29,30. Este protocolo descreve um método de litografia para a criação de nanoestruturas inorgânicas discretas e precisas em substratos usando modelos de DNA origami. Estes moldes podem eficientemente ser produzidos em várias formas e em grandes quantidades31, e depositados sem esforço em carcaças escolhidas em escalas grandes32. Estas propriedades permitem uma fabricação altamente paralela de bilhões de nanoestruturas em uma etapa em oposição à litografia de feixe de elétrons comumente usada, mas bastante lenta ou outras técnicas de nanofabricação baseadas em digitalização.
Nisto, o processo de fabricação é demonstrado pela criação de estruturas em forma de bowtie ouro em nitreto de silício e substratos de safira; em outras palavras, a informação espacial do DNA origami é transferida para nanoestruturas totalmente metálicas. Como discutido aqui, a técnica não se limita à estrutura selecionada do origami do ADN do bowtie desde que o método permite o uso de virtualmente toda a forma do origami do ADN. Além disso, com modificações metódicas, a técnica pode ser estendida a diferentes metais e substratos pavimentando o caminho para a fabricação de superfícies33.
As superfícies padronizadas com o DNA de fabricação mediada por origami podem servir como sensores versáteis; por exemplo, podem ser usados na Espectroscopia Raman superfície-realçada (SERS). Como resultado das pequenas dimensões das nanoformas individuais, as superfícies criadas podem encontrar usos em aplicações ópticas e plasmonicas na faixa de comprimento de onda visível.
Protocolo
1. Design de DNA origami
Nota: neste protocolo, um processo aspectos é descrito usando uma estrutura bidimensional do origami do ADN do bowtie (2D) (Figura 1)34. Para projetar uma nova forma de DNA origami, siga as orientações abaixo:
- Projetar a forma desejada e as seqüências de fio de grampo necessário do DNA origami usando caDNAno35. Para produzir um origami liso, Single-Layer, empregar a opção quadrada da estrutura de caDNAno e ajustar manualmente o afastamento do cruzamento saltando algumas bases no projeto (veja Figura 1 e o arquivo suplementar de caDNAno) para remover a torção estrutural resultando da embalagem quadrada36da estrutura,37.
- Estender as extremidades de cada hélice de DNA com fios contendo poli-T (8 NT) balanços; Isso impedirá a multimerização dos objetos por meio de interações de empilhamento de base sem corte (Figura 1 e arquivo de caDNAno suplementar).
- Execute uma análise computacional do projeto. O CanDo38,39 pode ser usado para prever a forma tridimensional (3D) e a rigidez estrutural do origami do ADN. O CanDo também é uma ferramenta útil para iterar o número de saltos de base necessários para correção de torção e para ajustar o design de acordo.
- No caDNAno, escolha o comprimento de andaime preferido e gere as vertentes de grampo necessárias para dobrar a estrutura. Para o bowtie estrutura, o 7249 NT longo M13mp18 andaime e 205 único grampo vertentes são utilizados (ver o suplementar caDNAno arquivo).
Nota: há também outras ferramentas computacionais disponíveis para projetar estruturas de DNA origami40,41,42,43. Dependendo da ferramenta/software escolhida, outras ferramentas de simulação também podem ser usadas43,44.
2. montagem de DNA origami
- Faça o estoque de vertentes do grampo misturando quantidades iguais de todos os oligonucleotídeos necessários para a estrutura do bowtie (no total 205 grampos)34. Os oligonucleotídeos devem todos ter a mesma concentração inicial (por exemplo, 100 μm na água livre de RNase).
- Prepare a mistura de reacção de dobramento do origami do ADN em 100 quantidades do μL em um tubo do PCR de 0,2 mL misturando 20 μL da costa do andaime M13mp18 (tipo p7249, em 100 nanômetro), 40 μL da solução do estoque de grampo, onde cada costa está em 500 nanômetro (que rende o excesso do molar do ~ 10x dos grampos comparados para o andaime) e 40 μL de tampão dobrável de 2,5 x (FOB). O FOB contem o tampão do ácido Tris-acético-ethylenediaminetetraacético (EDTA) (TAE) suplementado com o MgCl2. Ver tabela 1 para as concentrações dos componentes FOB.
- Anneal a mistura da reação em um termociclador de 90 ° c a 27 ° c. Utilize a rampa de dobradura térmica apresentada na tabela 2.
3. purificação de DNA origami
Nota: a quantidade excessiva de fios de grampo pode ser removida da solução de origami de DNA usando um método de purificação poli (etileno glicol) (PEG) não destrutivo. O protocolo é adaptado de Stahl et al.45.
- Diluir 200 μL de estruturas de origami de DNA montadas com 600 μL de 1x FOB (ver tabela 1) para obter um volume inicial de 800 μl.
- Misture a solução de origami de DNA diluído 1:1 com 800 μL de tampão de precipitação PEG (15% PEG 8000 (w/v), 1x TAE, 505 mM NaCl) e misture bem com pipetagem para frente e para trás.
- Centrifugue a mistura durante 30 min a 14.000 x g e temperatura ambiente.
- Retire cuidadosamente o sobrenadante utilizando uma pipeta.
- Adicionar 200 μL de 1x FOB e misturar suavemente com pipetagem. Uma quantidade diferente de 1x FOB pode igualmente ser adicionada para obter a concentração desejada do origami do ADN.
- Para redissolver as estruturas de DNA origami (pequena pelota transparente na parte inferior do tubo), incubar o PEG purificada DNA origami estruturas durante a noite na temperatura ambiente.
- Estimar a concentração de DNA origami após a purificação de PEG medindo a absorvância em um comprimento de onda de 260 nm usando um espectrofotômetro UV/VIS. Use a lei Beer-Lambert e um coeficiente de extinção de 1,1 ∙ 108 M-1 cm-1 para o cálculo6. A concentração típica do origami do ADN após a purificação do PEG é 15-20 nanômetro.
- Armazene as estruturas de origami de DNA purificada PEG a 4 ° c. As estruturas do origami do ADN são geralmente estáveis por meses assim que as grandes quantidades de estoque podem ser preparadas para um uso mais atrasado.
Nota: a quantidade excessiva de vertentes de grampo também pode ser removida usando outras técnicas de purificação46, tais como spin-filtração47, taxa de centrifugação zonal48 e extração de gel de agarose49. As estruturas do origami do ADN são estáveis em uma variedade de soluções do amortecedor50, e se necessário, o meio de armazenamento pode ser mudado após a purificação do Peg através da filtração da rotação51.
4. electroforese do gel do agarose
Nota: a qualidade da dobradura e a remoção de vertentes excedentes do grampo podem ser verificadas usando a electroforese do gel do agarose.
- Prepare um gel de agarose ~ 2% (w/v) adicionando 1 g de agarose e 45 mL de 1x TAE a um balão de Erlenmeyer. Aqueça a mistura em um microondas até que o agarose é completamente dissolvido, e uma solução clara é produzida.
- Resfriar a solução água corrente até que o balão seja confortável de tocar (50 – 60 ° c).
- Adicionar 5 ml de 110 mm MgCl2 e 40 μL de solução de brometo de etídio (0,58 mg ml-1) à solução e agitar suavemente a mistura.
PRECAUÇÃO: o brometo de ethidium é um potencial carcinógeno e deve ser manuseado com cuidado. - Configurar a bandeja de fundição de gel e despeje o agarose líquido na bandeja de fundição. Deixe o gel solidificar à temperatura ambiente durante pelo menos 30 min.
- Retire o gel da bandeja de fundição e coloque-o em uma câmara de eletroforese de gel. Encha a câmara com o tampão Running (1x TAE com 11 milímetros MgCl2).
- Adicione 1 μL de corante de carregamento de gel 6x por 5 μL de solução de amostra e misture cuidadosamente. Carregue as amostras introduzindo cuidadosamente a quantidade desejada de soluções de amostra em bolsos de gel separados.
- Execute o gel do agarose em uma tensão constante de 95 V por 45 min. Mantenha a câmara da electroforese do gel em um banho de gelo para o funcionamento para evitar dano do calor ao gel.
- Visualize o gel luz ultravioleta usando um sistema de imagem de gel (Figura 2a).
5. preparação do substrato (Figura 3A)
Nota: as etapas a seguir são todas executadas dentro de uma sala limpa, exceto para o crescimento SiO2 (etapa 9). As etapas da limpeza podem igualmente ser substituídas com uma limpeza padrão da piranha-solução baseada se este processo não é bastante para remover todos os resíduos do substrato.
- Corte 7 mm x 7 mm chips de uma bolacha para ser usado como substrato. Para o SiN, use uma serra do silicone, uma pena do cortador do diamante ou um implemento similar. Corte de safira (Al2O3) exigirá uma ferramenta especializada ou lâmina de serra. O tamanho da microplaqueta não precisa de ser exato.
- Limpando as fichas.
- Mergulhe os chips em cubos em um copo com acetona quente (acetona aquecida a 52 ° c) e mantê-los aquecidos por pelo menos 15 min. dependendo da limpeza inicial do substrato, um tempo mais longo pode ser necessário.
- Enquanto eles ainda estão no banho de acetona quente, esfregue suavemente os chips com um cotonete de algodão para remover mecanicamente quaisquer filmes de resíduos.
- Usando pinças, levante as fichas da acetona quente e use uma garrafa de lavagem para enxágüe-los com acetona temperatura ambiente.
- Mergulhe as batatas fritas em um copo com isopropanol e ultrasonicate por 2 min.
- Retire os chips do isopropanol com pinças e seque-os imediatamente e completamente usando um fluxo de nitrogênio. Apenas toque e segure os lados e bordas dos chips, como áreas cobertas pela pinça não vai secar corretamente, deixando potencialmente resíduos e outras contaminações em áreas de contato. Para obter os melhores resultados, use o maior fluxo possível e segure as superfícies de cavacos paralelas à direção do fluxo.
- Armazene os chips em um recipiente coberto dentro da sala limpa para uso posterior.
6. deposição de vapor químico reforçada com plasma (PECVD) da camada de silício amorfo (a-si) (Figura 3B)
- Coloque as fichas no equipamento PECVD.
- Configurar os parâmetros de deposição para crescer cerca de 50 nm de silício amorfo (a-si). As configurações exatas variam de acordo com o modelo e calibração do equipamento. Consulte a tabela 3 para os parâmetros usados aqui. Execute o programa de deposição a-si para aumentar a camada.
- Após o processamento, armazene os chips em um recipiente coberto em condições padrão de sala limpa.
7. tratamento plasma de oxigénio da camada a-si (Figura 3B)
Nota: este passo vai fazer a superfície do substrato ligeiramente carregada negativamente e hidrófilo, de modo que as estruturas de DNA origami pode ser mais tarde efetivamente adsorto à superfície com a ajuda de íons de magnésio adicionais.
- Coloque as fichas no equipamento de gravura de íon reactivo (rie).
- Configure os parâmetros de condicionamento para gerar plasma de oxigênio. Novamente, as configurações exatas variam de acordo com o modelo de equipamento e calibração. Consulte a tabela 3 para os parâmetros usados aqui. Executar o programa de tratamento de plasma de oxigênio.
- Continue para a próxima etapa imediatamente, pois os efeitos do tratamento irão deteriorar-se rapidamente. Tipicamente, os substratos devem ser usados dentro dos próximos 30 minutos após o tratamento com plasma.
8. deposição de DNA origami (Figura 3C)
- Prepare uma mistura de DNA origami para deposição por mistura de 5 μL de solução de origami de DNA dobrado/purificada (~ 20 nM) com 4 μL de 1x FOB e 1 μL de 1 M MgCl2. A solução resultante contém ~ 10 nM DNA origami e cerca de 100 mM de mg2 +.
- Deposite 10 μL da mistura de DNA origami em um chip tratado com plasma de oxigênio e incubar coberto por 5 min à temperatura ambiente. Cobrindo impede a secagem involuntante e auxilia na remoção de sal estranho e estruturas de DNA origami mais tarde.
- Após a incubação, lave a superfície introduzindo primeiro 100 μL de água destilada (por exemplo, MilliQ) no chip. Enxague a água para trás e para frente algumas vezes com a pipeta, evitando tocar no centro do chip. Retire a maior parte da água da superfície com a pipeta. Isso faz com que apenas o origami corretamente adsorvido para permanecer na superfície.
- Repita este ciclo de lavagem (passos 8,3) 3 a 4 vezes.
- Após a lavagem, seque a amostra imediatamente com um fluxo de nitrogênio. Faça isso da mesma forma que a secagem na preparação do substrato (etapa 5). É importante secar a amostra o mais minuciosamente possível.
Nota: a densidade das estruturas depositadas e, portanto, a densidade das nanoestruturas metálicas podem ser modificadas ajustando a concentração de DNA origami e mg2 + na solução de deposição. Maior mg2 + concentração melhora a adesão de DNA origami e, portanto, aumenta a densidade, mas acabará por também causar aglomeração das estruturas de DNA origami. Assim, primeiramente a concentração do origami do ADN deve ser ajustada primeiramente.
9. crescimento da máscara de SiO2 (Figura 3D)
Nota: esta etapa pode ser executada fora da sala de limpeza. A versão a seguir produzirá um padrão de Tom negativo, mas é possível modificar o processo para produzir um padrão de tom positivo em vez disso. O processo de crescimento SiO2 é adaptado de surwade et al.52, desenvolvido mais pelos autores53, e finalmente otimizado para este protocolo.
- Pegue um dessecador selável (1,5 L), uma placa de Petri que se encaixa dentro do dessecador (opcional) e uma chapa perfurada que pode funcionar como uma plataforma dentro do dessecador.
- Tomar 100 g de gel de sílica e misturá-lo com 30 g de água destilada no prato de Petri ou diretamente no dessecador. Faça este passo de preferência pelo menos 24 h de antecedência para permitir que o gel de sílica se estabilize.
Nota: isso é usado para controlar a umidade dentro do dessecador e, portanto, também a taxa de crescimento e morfologia do filme SiO2 . Maior umidade resulta em maior taxa e estrutura mais grosseira. Alternativamente, o gel de sílica pode ser curado em uma câmara de teste climática. - Coloque o gel de sílica no dessecador e separe-o com a chapa perfurada.
- Posicione os chips com origami de DNA adsorto, bem como um frasco aberto de (fresco) 10 mL de ortosilicato de tetraetil (TEOS) e outro frasco de 10 mL de hidróxido de amónio 25% (NH4Oh) no dessecador, na plataforma perfurada. Ajuste os frascos para injetáveis perto e em lados opostos das amostras. De preferência use uma rolha de balão ou um pedestal plano semelhante para elevar ligeiramente as fichas da plataforma.
Cuidado: tanto NH4Oh e TEOS são prejudiciais em caso de contato com a pele e seus vapores podem causar irritação tanto para os olhos e órgãos respiratórios. Use em uma área bem ventilada e use luvas protetoras, proteção ocular e roupas protetoras. - Selar a câmara e incubar por 20 horas à temperatura ambiente. Isso vai crescer um filme SiO2 nas áreas onde as estruturas de DNA origami não estão localizadas, criando uma máscara padronizada de 10-20 nm com buracos em forma de origami de DNA (Figura 4).
- Retire as amostras da câmara após a incubação. Armazene em um contêiner coberto. O processamento pode ser pausado aqui. Elimine o TEOS e o NH4Oh. O lote do gel de silicone pode ser usado 2-3 vezes se é mantido selado dentro do exsicador entre usos e usado dentro de 2-3 semanas.
10. gravura reactivo do íon (rie) de sio2 e a-si (Figura 3e)
- Coloque as fichas no equipamento de gravura de íon reactivo (rie).
- Configurar os parâmetros de condicionamento para apenas etch 2-5 Nm de SiO2 a fim de revelar a camada de a-si abaixo dos furos na máscara sio2 . As configurações exatas devem ser determinadas experimentalmente para o equipamento individual. Os parâmetros aqui utilizados são apresentados na tabela 3. Execute o programa anisotrópico sio2 plasma gravura.
- Configure os parâmetros de condicionamento para perfurar através da camada a-si de 50 nm. Os parâmetros aqui utilizados são novamente apresentados na tabela 3. Execute o programa isotrópico a-si plasma gravura.
- Remova amostras do equipamento RIE e armazene-as cobertas. O processamento pode ser novamente suspenso aqui.
11. deposição física de vapor (PVD) de metais (Figura 3F)
- Coloque as fichas na câmara de evaporação do instrumento PVD.
- Escolha um metal alvo. Primeiro, escolha um metal adesivo. Aqui, 2 nm de cromo (CR) é usado.
- Configurar o programa de controle de espessura para o material de destino e espessura. O método de controle é dependente do instrumento. Aqui, um microbalança de cristal de quartzo (QCM) é usado. A espessura medida é ajustada pela densidade do material alvo e pelo fator Z e precisa ser corrigida por um fator de ferramental determinado experimentalmente, que é específico para o dispositivo e para cada material alvo.
- Inicie o feixe de elétrons, alinhe o feixe ao alvo e aumente a corrente do feixe até que uma taxa de deposição de 0, 5 Nm/s seja atingida. Evate até atingir uma espessura final de 2 nm.
- Escolha um segundo metal alvo (por exemplo, ouro) sem ventilar a câmara ou interromper o processo. Interrupções ou ventilação permitirá que o metal adesivo para começar a oxidar e diminuir a sua usabilidade como um adesivo.
- Repita as etapas 11,3 a 11,4. Evate até 20 nm é atingido. Isso criará uma estrutura metálica em forma de origami de DNA através dos furos de máscara SiO2 com uma altura total de 22 nm.
- Ventilar a câmara e remover amostras.
- O processamento pode ser pausado aqui se as amostras forem armazenadas cobertas.
12. lift-off com ácido fluorídrico (HF) (Figura 3G)
- Despeje 50% de solução de Etchant baseada em HF em um recipiente de plástico adequado. Nenhum HCl deve ser usado para a mistura, desde que o HCl etch o CR na amostra.
Cuidado: HF é extremamente corrosivo, provoca irritação grave e queimaduras e pode ser fatal no contato com a pele ou se inalado. Use o HF somente em uma capa dedicada das emanações ou em um banco molhado ventilado com um avental protetor, umas luvas resistentes químicas e uma viseira da cara, ou de outra maneira proteção química cheia. - Mergulhe as amostras no Etchant com base em HF e mexa suavemente com pinças plásticas.
- Aguarde a camada SiO2 para gravar completamente e a camada metálica para desanexar. O tempo variará visivelmente dependendo da densidade dos furos da máscara. Um maior número de furos irá traduzir para a gravura mais rápida. Se a camada de metal é difícil de descascar, ultrasonication breve para 5 a 10 s pode ser usado.
- Uma vez que o filme de metal se destaca, enxágüe as amostras com água dupla-destilada e isopropanol.
- Após enxaguar, seque as amostras com um fluxo de nitrogênio da mesma forma como instruído para a preparação do substrato (etapa 5). Evite o contato das pinças com o centro de chips, pois isso pode destruir as nanoestruturas formadas.
Nota: as amostras podem ser armazenadas e o processamento suspenso aqui.
13. RIE de a-si remanescente (Figura 3H)
- Coloque as fichas no equipamento de gravura de íon reactivo (rie).
- Configurar os parâmetros de condicionamento para a remoção completa de todos os 50 nm de a-si. Os parâmetros podem ser os mesmos que na etapa 10, mas um tempo de condicionamento ligeiramente mais longo (40 s) pode ser usado para assegurar a remoção de todos os a-si. Consulte a tabela 3 para os parâmetros usados aqui. Execute o programa de condicionamento de plasma isotrópico a-si para remover o a-si restante.
- Remova amostras do equipamento RIE e armazene-as cobertas. Isso concluirá o processamento da amostra.
14. microscopia de força atômica (AFM)
Nota: microscopia de força atômica e microscopia eletrônica de varredura pode ser usado para monitorar o sucesso do crescimento do filme e padronização, bem como a imagem dobrada DNA origami estruturas (Figura 2B, C). A seguinte etapa de preparação de exemplo pode ser ignorada se amostras processadas de etapas 5-13 são imaged.
- Preparação da amostra para AFM
- Para a imagem do origami de DNA dobrado, pegue um chip de substrato de mica.
- Prenda a microplaqueta de mica a uma corrediça de vidro do microscópio usando um adesivo.
- Prepare 10 μL de solução de origami de DNA diluindo o estoque de origami de DNA de ~ 20 nM 50 vezes em 1x FOB para uma concentração de aproximadamente 0,4 nM. A diluição é efectuada a fim de evitar a sobrelotação do substrato.
- Descasque a camada superior da folha de mica fora com fita fraca para obter uma superfície recentemente clivada, carregada.
- Deposite a solução de origami de DNA diluída na mica recém-clivada e incubar a amostra coberta por 1 min à temperatura ambiente.
- Após a incubação, lave a superfície 3-4 vezes com 100 μL de água destilada usando uma pipeta. Isso faz com que apenas o origami corretamente adsorvido para permanecer na superfície.
- Deposite 100 μL de água destilada na superfície de mica.
- Incline e bata agudamente a corrediça do microscópio na tabela para separar a maioria da água.
- Repita este ciclo de lavagem 3-4 vezes.
- Seque a amostra cuidadosamente com um fluxo de nitrogênio imediatamente após a lavagem. A amostra está então pronta para a imagem latente de AFM.
- Coloque as amostras de DNA origami ou os chips processados em um AFM e realizar varreduras. Um tamanho de digitalização de 1-10 μm é adequado para resolver adequadamente as estruturas.
15. microscopia eletrônica de varredura (SEM)
- Coloque as amostras em um SEM. As microplaquetas processadas podem ser usadas como são (uma preparação mais adicional da amostra não é precisada).
- Escolha a tensão de aceleração. Use baixas tensões (5-10 kV) para reduzir os efeitos de carga, uma vez que o substrato da amostra (Al2o3 ou Sin) é um isolador.
- Digitalizar quaisquer áreas de interesse. Minimize os tempos de digitalização para reduzir o carregamento e evitar a deposição de contaminação.
Resultados
Uma figura esquemática do desenho de origami de DNA bowtie e seus detalhes estruturais são mostrados na Figura 1. A eletroforese em gel de agarose e AFM são usadas para analisar a dobradura do DNA origami e a qualidade da purificação de PEG (Figura 2). O fluxo de processo das etapas da Nanolitografia é exibido na Figura 3. Imagens representativas do AFM após o crescimento da máscara de SiO2 são mostrados na Figura 4 (esta etapa é descrita na Figura 3D), enquanto as imagens de sem das nanoestruturas metálicas finais podem ser observadas na Figura 5 (esta etapa é descrita em Figura 3H). A Figura 6 demonstra a funcionalidade óptica das nanoestruturas metálicas modelo pelo origami do ADN do bowtie.
| Concentrações do componente tampão dobrável (FOB) [mM] | |||||
| Tris | Ácido acético | Edta | Cloreto de magnésio | Ph | |
| 2.5 x FOB | 100 | 47,5 | 2,5 | 31,25 | ~ 8, 3 |
| 1x FOB | 40 | 19 | 1 | 12,5 | ~ 8, 3 |
Tabela 1: composição do tampão dobrável (FOB).
| Faixa de temperatura [oC] | Taxa de resfriamento |
| 90-70 | -0,2 ° c/8 s |
| 70-60 | -0,1 ° c/8 s |
| 60-27 | -0,1 ° c/2 s |
| 12 | Segure até parar |
Tabela 2: rampa térmica para o dobramento de origami bowtie. Após o recozimento, o origami será armazenado em 12 oC até que o programa é parado manualmente.
| Parâmetros PECVD e RIE | ||||||
| Gás | Fluxo de gás [SCCM] | Pressão da câmara [mTorr] | Potência de RF [W] | Temperatura [oC] | Duração [s] | |
| PECVD de a-si | 5% SiH4 em N2 | 500 | 1000 | 15 | 250 | 90 |
| O2 tratamento de plasma | O2 | 50 | 40 | 200 | 30 | 1200 |
| RIE de SiO2 | CHF3 % | 25 | ||||
| Ar | 25 | 30 | 100 | 25 | 10-22 | |
| RIE de a-si | O2 | 8 | ||||
| SF6 | 100 | 90 | 50 | 30 | 35 | |
| RIE de a-si restante | O2 | 8 | ||||
| SF6 | 100 | 90 | 50 | 30 | 35-40 |
Tabela 3: parâmetros de processo para deposição de vapor químico reforçada com plasma (PECVD) e gravura de íons reativos (rie). Os parâmetros de processo para estes dispositivos são específicos para instrumentos individuais e podem necessitar de ser adaptados quando utilizados.
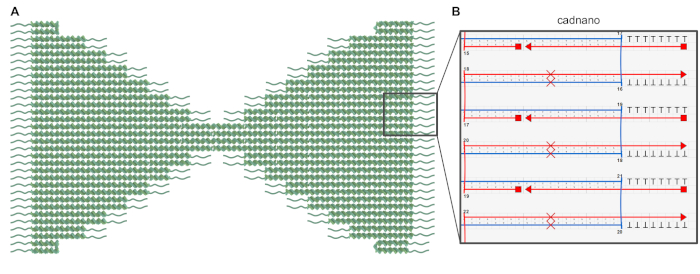
Figura 1: desenho do origami de DNA bowtie. (A) representação esquemática do projeto de origami bowtie em que a estrutura do núcleo é mostrada como Hélices duplas e os polyt-overpendências são representados como linhas onduladas. (B) screenshot de uma parte do projeto bowtie origami no software caDNAno. As cruzes vermelhas denotam o par de base pulando para a correção de torção, e o T8-balanços são adicionados para evitar Blunt-end base-empilhamento. Por favor clique aqui para ver uma versão maior desta figura.

Figura 2: caracterização da estrutura de origami de DNA bowtie. (A) electroforese do gel do agarose da estrutura do bowtie antes e depois da purificação poli (do etileno glicol) (PEG). O andaime longo dos nucleotídeos 7249 é usado como a referência. (B) imagem da microscopia de força atômica (AFM) das estruturas do bowtie antes da purificação. (C) imagem AFM das estruturas do bowtie após a purificação do Peg. Por favor clique aqui para ver uma versão maior desta figura.
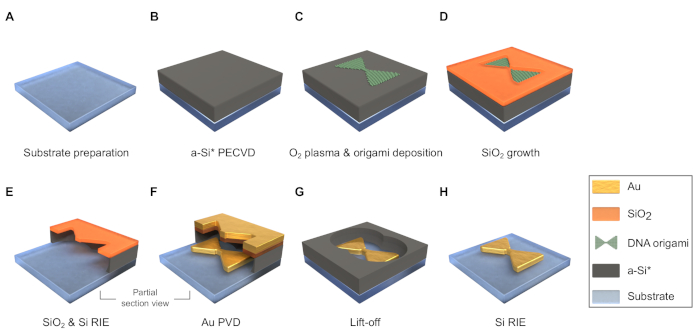
Figura 3: esquema do fluxo do processo de fabricação (as dimensões não estão em escala). (A) dados e limpe o substrato. (B) depositar uma camada de a-si por deposição de vapor químico reforçada por plasma (PECVD). * É possível empregar uma camada sacrificial adicional o a-si para permitir o lift-off com o Etchant à excepção do HF. (C) trate a superfície da amostra com o2 plasma e deposite o origami do ADN nele. (D) cresça a máscara de sio2 no desiccator. (E) etch uma camada fina de sio2 e através do a-si debaixo dele por gravura íon reactivo (rie). (F) depositar metal através da máscara por deposição de vapor físico (PVD). (G) lift-off com HF. (H) Retire os restantes a-si por Rie. Por favor clique aqui para ver uma versão maior desta figura.

Figura 4: imagens representativas de AFM de filme sio2 com o padrão em forma de origami de DNA. (A) a área de digitalização de 10 μm x 10 μm demonstra o alto rendimento da formação do padrão. (B) uma varredura mais próxima de 3 μm x 3 μm mostra os padrões individuais precisos no filme sio2 . Por favor clique aqui para ver uma versão maior desta figura.

Figura 5: microscopia eletrônica de varredura representativa (sem) imagens de nanoestruturas metálicas modelo com origami de DNA estruturalmente diferente. (A) origami de DNA em forma de Cruz, ou seja, o chamado Seeman telha origami54. (B) antenas bowtie. (C) estruturas chiral Double-l (CDL). Os Insets mostram estruturas individuais com tamanhos de caixa de 150 nm x 150 nm. O rendimento de fabricação de estruturas exatas é de até 76% para o origami bowtie e ~ 50% para as outras estruturas exibidas aqui34. Este número foi adaptado e modificado de Shen et al.34. A figura é reproduzida com a permissão dos autores e publicada pela Associação Americana para o avanço da ciência, 2018. Por favor clique aqui para ver uma versão maior desta figura.
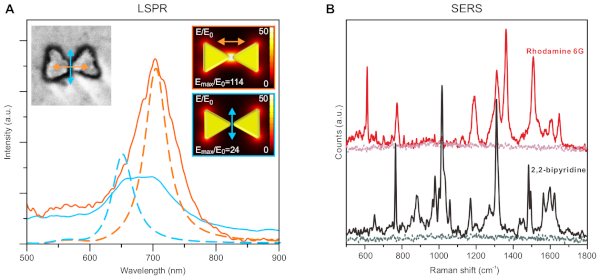
Figura 6: propriedades ópticas/funcionais representativas das nanoestruturas resultantes. (A) medidas de ressonância de Plasmon de superfície localizadas (lspr) de uma estrutura de bowtie de ouro individual com diferentes polarizações (cor codificada como laranja e azul). As linhas sólidas são medidos espectros e as linhas tracejadas são resultados de simulação. Os Insets mostram a imagem de SEM da partícula medida (esquerda) e o modelo usado para a simulação (direita). (B) Espectroscopia Raman de superfície reforçada (Sers) de rodamina 6G e 2, 2-bipiridina medida em uma superfície coberta com nanoestruturas de bowtie. A linha de base de cada amostra mostra o nível de sinal quando as nanoestruturas estavam ausentes. Este número foi adaptado e modificado de Shen et al.34. A figura é reproduzida com a permissão dos autores e publicada pela Associação Americana para o avanço da ciência, 2018. Por favor clique aqui para ver uma versão maior desta figura.

Arquivo suplementar 1: arquivo CaDNAno por favor clique aqui para baixar este arquivo.

Arquivo suplementar 2: m13mp18 seqüência por favor clique aqui para baixar este arquivo.
Arquivo suplementar 3: seqüência de vertente grampo por favor clique aqui para baixar este arquivo.
Discussão
O protocolo proporciona grande liberdade e precisão na forma de nanoestruturas produzidas. Mudando o projeto do origami do ADN, a forma das nanoestruturas do metal pode ser controlada. A forma final, exata das estruturas metálicas é determinada adicionalmente pela etapa de crescimento da máscara (etapa 9) e em um grau menor pelo condicionamento da máscara (etapa 10) se não deve ser anisotropic. Se o tempo de crescimento da máscara for estendido o suficiente, os furos na máscara começarão a crescer. Isso pode ser usado para omitir as características mais finas de algumas estruturas e tamanhos de Gap de controle, como demonstrado em Shen et al.34 com triângulos separados do origami bowtie (figuras 5b). Inversamente, formas mais finas podem ser melhor preservadas encurtando o tempo de crescimento do óxido. Isso significa que é possível ajustar as propriedades ópticas exibidas na Figura 6, não apenas mudando o design de origami usado, mas também ajustando o crescimento do filme sio2 .
Se a espessura da máscara for alterada significativamente, essa alteração também deve ser refletida na etapa SiO2 rie. Somente uma camada muito fina de SiO2 deve ser gravada (2-5 nanômetro) para perfurar mal através dos furos da máscara. Esta é a parte mais sensível e crucial de todo o processo. Uma vez que o tempo de condicionamento é extremamente curto, apenas 10-20 s, as configurações exatas devem ser experimentalmente determinadas quando a primeira tentativa com novos equipamentos. Isto é igualmente verdadeiro para a etapa 10,4 porque algum SiO2 é gravado igualmente durante o condicionamento a-si. A extensão do SiO2 gravado é determinada pela seletividade dos parâmetros de a-si etch usados, equipamentos e até mesmo calibrações de equipamentos individuais. Deve-se tomar cuidado para não gravar fora toda a camada SiO2 durante estes dois processos.
Outro passo sensível é o crescimento do SiO2 . O processo de crescimento depende tanto da umidade da câmara como da atividade atual do TEOS utilizado. TEOS degrada como ele adsorvem a água do ar, fazendo com que ele se torne menos eficaz com a idade. Isso pode se manifestar como uma taxa de crescimento significativamente mais lenta e menos controlável dentro de meses, mesmo com o armazenamento adequado do produto químico. 34 se a camada de sio2 resultante for mais fina do que a pretendida, isto pode indicar um problema com TEOS em vez da humidade da câmara. Enquanto uma umidade mais baixa também pode resultar em menor taxa de crescimento e filme mais fino, o filme resultante também deve ser mais suave do que o normal. Enquanto isso, uma camada grosseira e áspera seria, inversamente, indicar um problema com alta umidade.
Também é possível executar este protocolo em qualquer outro substrato livremente escolhido com dois requisitos: deve tolerar tanto a gravura HF (passo 12) e as temperaturas de 200-300 ° c de PECVD (passo 6). A temperatura pode ser abaixada com segurança a 100 ° c para o PECVD de a-si se um substrato mais sensível é usado, mas a HF não pode ser evitada se o protocolo é seguido exatamente como descrito. Para contornar a IC, seria necessária a aplicação de uma camada sacrificial adicional. Se a exigência da gravura do HF é removida, este protocolo tornar-se-ia compatível com uma seleção mais larga de materiais e de metais da carcaça.
Como este protocolo consiste em processos de micro e nanofabricação comumente usados e robustos, ele pode ser combinado com qualquer número de outros protocolos de microfabricação, onde são desejados tamanhos de recursos pequenos e formas de metal complexas. Em um futuro próximo, especialmente com a vinda de baixo custo de DNA origami massa-produção31, há potencial para este método para facilitar o uso geral e aspectos de alta taxa de transferência para nanofotônica baseado em interface e plasmónicos55 .
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado pela Academia da Finlândia (projetos 286845, 308578, 303804, 267497), a Fundação Jane e Aatos Erkko, e a Fundação Sigrid Jusélius. Este trabalho foi realizado no âmbito do programa de centros de excelência da Academia da Finlândia (2014 – 2019). Reconhecemos o fornecimento de instalações e suporte técnico pelas instalações da Universidade Aalto bioeconomia e OtaNano-centro de Nanomicroscopia (Aalto-NMC) e Micronova Nanofabrication Center.
Materiais
| Name | Company | Catalog Number | Comments |
| Acetone | Honeywell | 40289H | Semiconductor grade ULSI, ≥ 99.5 % |
| Agarose | Fisher Bioreagents | 1036603 | Low-EEO, multi-purpose and molecular biology grade |
| Ammonium hydroxide | Fisher Chemical | 10652251 | 25 % ammonia solution, Certified AR for Analysis, d = 0.91 |
| BRANSON 5510 | Branson | Ultrasonic bath | |
| Dimension Icon | Bruker | Atomic force microscope | |
| Electron-beam evaporator IM-9912 | Instrumentti Mattila | Evaporator for PVD | |
| Ethidium bromide | Sigma Aldrich | E8751 | Fluorescent dye for DNA staining |
| Eon Microplate spectrophotometer | BioTek | UV/Vis spectrophotometer used for DNA origami concentration measurements | |
| Gel Doc XR+ Documentation System | BioRad | Gel imaging system | |
| Gel Loading Dye, Blue (6×) | New England Biolabs | B7021S | Bromophenol blue-based loading dye for agarose gel electrophoresis |
| G-storm GS1 Thermal cycler | Gene Technologies | ||
| HBR 4 | IKA | Heating bath | |
| Hydrofluoric acid | Honeywell | 40213H | Semiconductor grade, 49.5-50.5 % |
| Isopropanol | Honeywell | 40301H | Semiconductor grade VLSI, ≥ 99.8 % |
| Magnesium chloride | Sigma Aldrich | M8266 | Anhydrous, ≥ 98 % |
| Mini-Sub Cell GT Horizontal Electrophoresis System | BioRad | ||
| Plasmalab 80+ PECVD | Oxford Instruments | PECVD system | |
| Plasmalab 80+ RIE | Oxford Instruments | RIE system | |
| Poly(ethylene glycol) | Sigma Aldrich | 89510 | BioUltra, 8,000 |
| PowerPac HC High-Current Power Supply | BioRad | ||
| Sapphire substrate (Al2O3) | University Wafer | Thickness: 430 μm, Polish: DSP, Size: 50.8 mm | |
| Sigma VP | Zeiss | Scanning electron microscope | |
| Silica gel | Merck | 1019691000 | With indicator (orange gel), granulate ~1-3 mm |
| Single-stranded Scaffold DNA, type p7249 | Tilibit Nanosystems | At 100 nM concentration | |
| Sodium chloride | Sigma Aldrich | S9888 | ACS reagent, ≥ 99.0 % |
| Staple strands (oligonucleotides) | Integrated DNA Technologies | Sequences can be ordered e.g. at 100 micromolar in Rnase-free water | |
| TAE buffer (50×) pH 8.0 | VWR Chemicals | 444125D | Electran Electrophoresis grade |
| Take3 micro-volume plate | BioTek | Used for DNA origami concentration measurements | |
| Tetraethyl orthosilicate | Sigma Aldrich | 86578 | ≥ 99.0 % (GC) |
Referências
- Seeman, N. C., Sleiman, H. F. DNA nanotechnology. Nature Reviews Materials. 3 (1), 17068 (2017).
- Linko, V., Dietz, H. The enabled state of DNA nanotechnology. Current Opinion in Biotechnology. 24 (4), 555-561 (2013).
- Rothemund, P. W. K. Folding DNA to create nanoscale shapes and patterns. Nature. 440 (7082), 297-302 (2006).
- Hong, F., Zhang, F., Liu, Y., Yan, H. DNA Origami: Scaffolds for Creating Higher Order Structures. Chemical Reviews. 117 (20), 12584-12640 (2017).
- Maune, H. T., et al. Self-assembly of carbon nanotubes into two-dimensional geometries using DNA origami templates. Nature Nanotechnology. 5 (1), 61-66 (2010).
- Hung, A. M., et al. Large-area spatially ordered arrays of gold nanoparticles directed by lithographically confined DNA origami. Nature Nanotechnology. 5 (2), 121-126 (2010).
- Kuzyk, A., et al. DNA-based self-assembly of chiral plasmonic nanostructures with tailored optical response. Nature. 483 (7389), 311-314 (2012).
- Zhang, T., et al. 3D DNA Origami Crystals. Advanced Materials. 30 (28), 1800273 (2018).
- Julin, S., et al. DNA origami directed 3D nanoparticle superlattice via electrostatic assembly. Nanoscale. 11 (10), 4546-4551 (2019).
- Fu, J., Liu, M., Liu, Y., Yan, H. Spatially-Interactive Biomolecular Networks Organized by Nucleic Acid Nanostructures. Accounts of Chemical Research. 45 (8), 1215-1226 (2012).
- Linko, V., et al. DNA-based enzyme reactors and systems. Nanomaterials. 6 (8), 139 (2015).
- Ramakrishnan, S., Subramaniam, S., Stewart, A. F., Grundmeier, G., Keller, A. Regular Nanoscale Protein Patterns via Directed Adsorption through Self-Assembled DNA Origami Masks. ACS Applied Materials & Interfaces. 8 (45), 31239-31247 (2016).
- Grossi, G., Jaekel, A., Andersen, E. S., Saccà, B. Enzyme-functionalized DNA nanostructures as tools for organizing and controlling enzymatic reactions. MRS Bulletin. 42 (12), 920-924 (2017).
- Douglas, S. M., Bachelet, I., Church, G. M. A logic-gated nanorobot for targeted transport of molecular payloads. Science. 335 (6070), 831-834 (2012).
- Li, S., et al. A DNA nanorobot functions as a cancer therapeutic in response to a molecular trigger in vivo. Nature Biotechnology. 36 (3), 258-264 (2018).
- Zhao, Y. -. X., et al. DNA origami delivery system for cancer therapy with tunable release properties. ACS Nano. 6 (10), 8684-8691 (2014).
- Kollmann, F., et al. Superstructure-Dependent Loading of DNA Origami Nanostructures with a Groove-Binding Drug. ACS Omega. 3 (8), 9441-9448 (2018).
- Zhang, D. Y., Seelig, G. Dynamic DNA nanotechnology using strand-displacement reactions. Nature Chemistry. 3 (2), 103-113 (2011).
- Ijäs, H., Nummelin, S., Shen, B., Kostiainen, M. A., Linko, V. Dynamic DNA Origami Devices: from Strand-Displacement Reactions to External-Stimuli Responsive Systems. International Journal of Molecular Sciences. 19 (7), 2114 (2018).
- Li, J., Fan, C., Pei, H., Shi, J., Huang, Q. Smart Drug Delivery Nanocarriers with Self-Assembled DNA Nanostructures. Advanced Materials. 25 (32), 4386-4396 (2013).
- Linko, V., Ora, A., Kostiainen, M. A. DNA Nanostructures as Smart Drug-Delivery Vehicles and Molecular Devices. Trends in Biotechnology. 33 (10), 586-594 (2015).
- Jiang, Q., Liu, S., Liu, J., Wang, Z. G., Ding, B. Rationally Designed DNA-Origami Nanomaterials for Drug Delivery In Vivo. Advanced Materials. , (2018).
- Shen, B., Linko, V., Dietz, H., Toppari, J. J. Dielectrophoretic trapping of multilayer DNA origami nanostructures and DNA origami-induced local destruction of silicon dioxide. Electrophoresis. 36 (2), 255-262 (2015).
- Kuzyk, A., Jungmann, R., Acuna, G. P., Liu, N. DNA Origami Route for Nanophotonics. ACS Photonics. 5 (4), 1151-1163 (2018).
- Liu, N., Liedl, T. DNA-Assembled Advanced Plasmonic Architectures. Chemical Reviews. 118 (6), 3032-3053 (2018).
- Bathe, M., Rothemund, M. DNA Nanotechnology: A Foundation for Programmable Nanoscale Materials. MRS Bulletin. 42 (12), 882-888 (2017).
- Pilo-Pais, M., Acuna, G. P., Tinnefeld, P., Liedl, T. Sculpting light by arranging optical components with DNA nanostructures. MRS Bulletin. 42 (12), 936-942 (2017).
- Graugnard, E., Hughes, W. L., Jungmann, R., Kostiainen, M. A., Linko, V. Nanometrology and super-resolution imaging with DNA. MRS Bulletin. 42 (12), 951-959 (2017).
- Zhong, J., et al. Metallized DNA nanolithography for encoding and transferring spatial information for graphene patterning. Nature Communications. 4, 1663 (2013).
- Zhang, G., Surwade, S. P., Zhou, F., Liu, H. DNA nanostructure meets nanofabrication. Chemical Society Reviews. 42 (7), 2488-2496 (2013).
- Praetorius, F., Kick, B., Behler, K. L., Honemann, M. N., Weuster-Botz, D., Dietz, H. Biotechnological mass production of DNA origami. Nature. 552 (7683), 84-87 (2017).
- Linko, V., et al. One-step large-scale deposition of salt-free DNA origami nanostructures. Scientific Reports. 5, 15634 (2015).
- Arbabi, A., Horie, Y., Bagheri, M., Faraon, A. Dielectric metasurfaces for complete control of phase and polarization with subwavelength spatial resolution and high transmission. Nature Nanotechnology. 10 (11), 937-943 (2015).
- Shen, B., et al. Plasmonic nanostructures through DNA-assisted lithography. Science Advances. 4 (2), (2018).
- Douglas, S. M., et al. Rapid prototyping of 3D DNA-origami shapes with caDNAno. Nucleic Acids Research. 37 (26), 5001-5006 (2009).
- Ke, Y., et al. Multilayer DNA Origami Packed on a Square Lattice. Journal of the American Chemical Society. 131 (43), 15903-15908 (2009).
- Dietz, H., Douglas, S. M., Shih, W. M. Folding DNA into twisted and curved nanoscale shapes. Science. 325 (5941), 725-730 (2009).
- Castro, C. E., et al. A primer to scaffolded DNA origami. Nature Methods. 8 (3), 221-229 (2011).
- Kim, D. -. N., Kilchherr, F., Dietz, H., Bathe, M. Quantitative prediction of 3D solution shape and flexibility of nucleic acid nanostructures. Nucleic Acids Research. 40 (7), 2862-2868 (2011).
- Benson, E., et al. DNA rendering of polyhedral meshes at the nanoscale. Nature. 523 (7561), 441-444 (2015).
- Veneziano, R., et al. Designer nanoscale DNA assemblies programmed from the top down. Science. 352 (6923), 1534 (2016).
- Linko, V., Kostiainen, M. A. Automated design of DNA origami. Nature Biotechnology. 34 (8), 826-827 (2016).
- Nummelin, S., Kommeri, J., Kostiainen, M. A., Linko, V. Evolution of Structural DNA Nanotechnology. Advanced Materials. 30 (24), 1703721 (2018).
- Maffeo, C., Yoo, J., Aksimentiev, A. De novo reconstruction of DNA origami structures through atomistic molecular dynamics simulation. Nucleic Acids Research. 44 (7), 3013-3019 (2016).
- Stahl, E., Martin, T. G., Praetorius, F., Dietz, H. Facile and Scalable Preparation of Pure and Dense DNA Origami Solutions. Angewandte Chemie International Edition. 53 (47), 12735-12740 (2014).
- Shaw, A., Benson, E., Högberg, B. Purification of Functionalized DNA Origami Nanostructures. ACS Nano. 9 (5), 4968-4975 (2015).
- Kuzyk, A., Yurke, B., Toppari, J. J., Linko, V., Törmä, P. Dielectrophoretic Trapping of DNA Origami. Small. 4 (4), 447-450 (2008).
- Lin, C., Perrault, S. D., Kwak, M., Graf, F., Shih, W. M. Purification of DNA-origami nanostructures by rate-zonal centrifugation. Nucleic Acids Research. 41 (2), 40 (2013).
- Douglas, S. M., et al. Self-assembly of DNA into nanoscale three-dimensional shapes. Nature. 459 (7245), 414-418 (2009).
- Ramakrishnan, S., Ijäs, H., Linko, V., Keller, A. Structural stability of DNA origami nanostructures under application-specific conditions. Computational and Structural Biotechnology Journal. 16, 342-349 (2018).
- Kielar, C., et al. On the Stability of DNA Origami Nanostructures in Low-Magnesium Buffers. Angewandte Chemie International Edition. 57 (30), 9470-9474 (2018).
- Surwade, S. P., et al. Nanoscale growth and patterning of inorganic oxides using DNA nanostructure templates. Journal of the American Chemical Society. 135 (18), 6778-6781 (2013).
- Shen, B., Linko, V., Tapio, K., Kostiainen, M. A., Toppari, J. J. Custom-shaped metal nanostructures based on DNA origami silhouettes. Nanoscale. 7 (26), 11267-11272 (2015).
- Liu, W., Zhong, H., Wang, R., Seeman, N. C. Crystalline Two-Dimensional DNA-Origami Arrays. Angewandte Chemie International Edition. 50 (1), 264-267 (2011).
- Shen, B., Kostiainen, M. A., Linko, V. DNA Origami Nanophotonics and Plasmonics at Interfaces. Langmuir. 34 (49), 14911-14920 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados