Method Article
マウスマクロファージ・ケモタクシスのタイムラプスイメージング
要約
ここでは、C5a勾配を化学戦術補体で画像マウス常駐腹膜マクロファージにタイムラプス、位相コントラスト顕微鏡を用いた方法について説明する。プロトコルは、他の免疫細胞に拡張することができます。
要約
化学勾配に沿った細胞の受容体媒介誘導であるのに対し、ケモカイン症は化学物質によるランダムな細胞運動の刺激である。ケモキネシスとケモタクシスは、免疫細胞の動員と展開の基本です。例えば、ケモカイン(化学戦術サイトカイン)は、循環性好中球および単球を炎症の血管外部位に迅速にリクルートすることができる。化学誘起受容体は、Gタンパク質共役受容体の大家族に属する。化学誘起剤(すなわち、リガンド)がGタンパク質共役受容体シグナル伝達を介して細胞を直接移動する勾配は、まだ完全には理解されていない。免疫学の分野では、好中球は、体外での走気学を研究するための一般的なモデル細胞です。ここでは、従来より研究が困難であったマウス常駐マクロファージに合わせたリアルタイム2次元(2D)気道化アッセイについて説明します。マクロファージは、2D表面上で〜1μm/分のゆっくりとしたペースで移動し、好中球やジクチオステリウム・ディスコジドムよりもポイントソース移行アッセイ(例えば、化学誘引剤で満たされたマイクロピペットの先端に向かって移動する)にはあまり適していません。広く使用されているトランスウェルアッセイは、異なる物質の化学戦術活性を研究するのに有用であるが、細胞の形態、速度、または化学戦術ナビゲーションに関する情報を提供しない。ここでは、細胞速度と化学戦術効率の定量化を可能にし、トランスデューサ、シグナル経路、および気体のエフェクターを描写するプラットフォームを提供するタイムラプス顕微鏡ベースのマクロファージ化学体系アッセイについて説明する。
概要
免疫細胞は、典型的には、アメーブ様式の,2D表面上で1回に1回移動する、これは、前部の突出、インテグリン媒介細胞接着、および後部の後退の繰り返しサイクルを伴う。前提条件となるステップはセル偏光で、セルは前後の端部3を形成します。化学療法は、Gタンパク質共役受容体による化学誘引物質の検出と、膜固定ヘテロトリメリックGタンパク質および小さな単量体Gタンパク質、ならびにリン脂質結合グアニンヌクレオチド交換因子(GIF)4,5によって媒介される複雑なシグナル伝達4,5ネットワークから始まる。Cdc42およびRacサブファミリーのRho GTPasesの活性化は、前方6およびRhoサブファミリーのメンバー、特にRhoAで突起を誘発し、後部55,77の収縮を活性化する。3次元(3D)環境では、インテグリンは白血球の移動に対して大部分が冗長であり、RhoAは狭い通路8を通して細胞を圧迫するためにより重要になるが、Cdc42またはRac誘発Arp2/3活性化は、化学戦術ステアリング99、1010にとって依然として重要である。
免疫細胞は、特に組織損傷、病原体の侵入、および炎症の設定において、異なる化学誘引物質に直面する可能性があります。食細胞補体C3aおよびC5a上で発現される内因性化学誘引物質は、補体カスケードの活性化によって急速に生成され、そして補体C3aおよびC5a受容体によって認識される。同様に、壊死細胞は、ホルミルペプチド受容体を介して食細胞をリクルートし、これはミトコンドリア由来のペプチドと同様に細菌由来のホルミルペプチド11を認識する。免疫細胞はまた、ホメオシンの両方の間に免疫細胞の人身売買の調節に関与する化学誘引ペプチドの大家族であるケモカインのGタンパク質結合受容体を発現する。ケモカインは、最初の2つのシステイン(C)残基の間隔に応じて4つのグループに分類されます:C、CC、CXC、およびCX3Cサイトカイン、Xはアミノ酸です。したがって、生体内免疫細胞は、非常に複雑な空間的および時間的な信号に適切に応答する必要があり、走性の研究は困難な作業になります。以下は、生体内イメージングアプローチから始まった、走性の簡単な歴史を提供します。
白血球の化学薬は1888年12年にさかのぼり、眼科医のテオドール・カール・グスタフ・レーバーが、白血球の指向性移動と、真菌性(真菌)角膜炎のモデルにおける炎症部位の蓄積を明確に説明した。リーバーは、病原体由来物質による過剰な白血球の引力は、同じ13年にメチニコフ(メッチニコフとも呼ばれる)によって説明されていた食作用による有害な微生物の排除にとって重要であることを強調した。1920年代には、クラークとクラーク14(15),15によっても実験が行われ、オタマジャクシの透明性を利用して、クロトンオイル14または他の刺激物15によって誘発された無菌炎症が15原因で白血球が血管に付着し、続いて下垂体(経内皮移動)および刺激剤に向かって組織空間を迅速に移動することが示された。ジャン・コマンドン16によって開発されたマイクロシネマトグラフィー法を用いたインビトロ実験は、白血球が細菌17のような粒子状の化学誘引物質源に向かって移行することを示した。当時、化学戦術因子の分子同一性は不明であった。1960年代、スティーブン・ボイデン18は、可溶性物質の化学戦術活性を研究する技術が欠けていることを認識しました。彼は、その後ボイデンチャンバーとして知られている部屋を考案し、2つのコンパートメントを濾紙膜で分離しました。細胞懸濁液は上部コンパートメントに加え、被検物質は両方のコンパートメントまたは下部コンパートメントにのみ追加されます。インキュベーション期間の後、フィルター膜を除去し、細胞を固定して染色します。フィルター膜を横切って低いウェルに向かって移動する細胞の数を、両方のコンパートメントの被検物質と比較することによって、どちらのコンパートメントでも、または下部のコンパートメント内でのみ、化学戦術活性を決定することができる。トランスウェルアッセイは、現在でも人気があり、定義された細孔サイズと密度19、20,20を有する異なるポリカーボネート膜の使用を含む様々な方法で変更されています。トランスウェルアッセイの大きな欠点は、細胞の移動を直接可視化することは現実的ではなく、膜を横切る移動経路は通常、免疫細胞の直径を超えないということです。
サリー・H・ジグモンドは、蛍光色素を用いた勾配形成と細胞形態の両方の可視化を可能にする化学顔軸チャンバー21を開発した。チャンバーは、2つの平行な線形ウェルを備えたプレキシガラス(アクリル)スライドで構成され、それぞれ体積は〜100 μLで、スライドの上面より3〜10μm下の1mm幅のブリッジで区切られています。細胞で播種されたカバースリップは反転され、それが2つの井戸にまたがるようにスライドに置かれる。井戸の1つに化学誘引剤を添加した後、橋を渡る急な化学誘引勾配が形成され、通常は30〜90分以内に、ジグモンド室のヒト多形核白血球(顆粒球)が化学誘引剤に向かって観察される。ジグモンド室のバリエーションは、ダン22とインソール23チャンバーを含む報告されており、どちらも1mm幅の橋で分離された2つの井戸に配置された細胞で播種されたカバースリップを使用しています。ダンチャンバーは円形の橋で区切られた同心円の井戸で構成されていますが、インソール室はジグモンド室とより密接に関連していますが、0.5mmと1mmの2つの異なる幅の橋を提供します。新しい気化チャンバーを、μ-スライド・ケモタクシスと呼び、プラスチック射出成形によって製造した、Zemgelら24.この気胸室は、長さ2mm、高さ70μmの1mm幅チャネルで隔てられた2つの40μL貯留層から構成されています。チャンバの底部は、1.5号ガラスカバースリップ24と同じ厚さと光学特性を有するガス透過性の薄いプラスチックシートによって形成される。ここでは、μ-Slide Chemotaxisチャンバーを用いて、マウス常駐腹膜マクロファージの移動を化学戦術(補数C5a)勾配で最大14時間可視化する気胸アッセイについて説明する。
プロトコル
プロトコルは、私たちの地元の研究倫理委員会のガイドラインだけでなく、動物ケアガイドラインに従います。
注: 図 1は、走気軸アッセイのワークフローを示しています。
1. 前詰め化学療法スライド
-
20 mM 4-(2-hydroキイェチル)-1-ピペラジネタンスルホン酸(1-ピペラジネタンスルホン酸を含む重炭酸塩フリーRPMI 1640培地からなる、修正されたRPMI 1640 HEPES培地を使用して、1つまたは2つの長い長さの接続チャネルを1mm幅および2mmの長さの接続チャネルに予め充填する( HEPES、10%の熱不活化ウシ胎児血清(FBS)、ペニシリン(100 U/mL)およびストレプトマイシン(100μg/mL)などの抗生物質、100xペニシリン/ストレプトマイシンを希釈して調製し、 1 μg/mL リポ多糖(大腸菌由来)とトール様受容体4リガンドをクリックしてセルをアクティブにします。
- 気胸スライド(図2A)を円形(直径10cm)の細胞培養皿に入れ、両方とも37°Cに予熱し、加熱された(37°C)アルミニウムブロックに皿をセットする。ポート 1 と 4 にプラグを挿入します (図 2B)。
注:37°Cに維持され、層流フードの内部に置かれるアルミニウムブロックは、化学軸チャンバを準備するのに有用である。理想的には、加熱されたブロックは、50 mLチューブや2 mLマイクロ遠心チューブなどの様々なチューブ用の平坦な作業領域とウェルを提供する必要があります。 - 10~200 μL ピペットチップを使用して、15 μLの変更されたRPMI 1640 HEPES培地を充填ポート3に入金します(図2B)。次に、ボリュームを15 μLに設定し、(2~20 μL)ピペットのコントロールボタンを押下した後、ピペットチップをポート2に挿入し、適度に速い速度で15μLを吸引します(図2B)。これにより、1 mm x 2 mm 接続チャネル(観測エリア)と、2 つの隣接する供給チャネル(それぞれ中央観測エリアとポート 2 とポート 2 とポート 3 の間)が事前に埋め込まれます。ポート2と3にキャップを付けます。
- 予め充填した後、37 °Cの乾燥したCO2-freeインキュベーター内の閉じた湿度チャンバーに保管されたラックに、ケモタクシススライドを置きます。
注:正しいピペットチップを使用して、走顔軸スライドを充填することが重要です。充填口の上部にベベリングピペットチップウェッジ、一般的に使用される尖ったピペットチップは、充填ポートに深く挿入することができ、流体への抵抗を大幅に増加させることができます。
- 気胸スライド(図2A)を円形(直径10cm)の細胞培養皿に入れ、両方とも37°Cに予熱し、加熱された(37°C)アルミニウムブロックに皿をセットする。ポート 1 と 4 にプラグを挿入します (図 2B)。
2. マウス居住者の腹膜マクロファージの分離
- 揮発性麻酔薬イゾフルラン(>5%空気中)または二酸化炭素25を高濃度にして、3〜4ヶ月のマウスを犠牲にし、その後に頸部脱臼を行います。げっ歯類の右反射の喪失は、ヒト26における意識喪失と相関する。水中の80%エタノールでマウスの腹部をきれいにし、鈍い先端と外科用はさみを使用して1〜2センチの正中皮膚切開を行います。皮膚を剥がして、下の腹壁を露出させます。
- 24Gプラスチックカテーテルを腹腔に挿入します。5 mL プラスチックシリンジを使用して、Ca2+およびMg2+を使用せずに、2 x 4.5 mL 氷冷ハンクの緩衝塩溶液(HBSS)を使用して空洞を洗浄します。シリンジに約0.5mLの残留HBSSを残し、誤ってカテーテルの先端に組織を吸い込むことができます。
- 溶けた媒体(通常は合計8~8.5mL)を14mLポリプロピレン丸底管に移します。室温で6.5分間300×ggでチューブを遠心します。
注:丸底管は上清を完全にデカントすることを可能にし、細胞の束を減らす。 - 上清を捨てて、腹膜細胞(通常、マウス当たり約4 x 106細胞)を200μLのRPMI 1640 HEPES培地で再懸濁します。細胞懸濁液1:20のサンプルを希釈し、ノイバウアー改善計数チャンバーなどの計数装置を使用して細胞を計数する。次に、細胞懸濁液を10 x 106細胞/mLの最終濃度まで希釈し、加熱されたアルミニウムブロックを使用して37°Cの丸底2 mLポリプロピレンマイクロ遠心分離管の細胞を維持します(ステップ1.1.1の注を参照)。
3. 腹膜細胞を化学療法スライドに播種する
- 細胞懸濁液をピペットボリュームを100 μL(または懸濁液の半分)に設定して5倍にピペット化した後、細胞懸濁液の10μLをケモタキシチャンバのポート3に静かに堆積させる(図2C)。ピペットチップをポート2に入れ、セルのサスペンションを接続チャネルにゆっくりと引き込みます(図2C)。細胞懸濁液が導入されるとすぐに、ポート1と4のプラグを取り外し、細胞懸濁液の流れを阻止するのに役立ちます。4 つの充填ポートすべてにキャップを配置します。
- すべての気胸室に対してステップ3.1を繰り返します。小さな反転顕微鏡と10倍位相対向対物レンズを使用して、気化スライドに不要な気泡がないか検査します。
- 腹膜細胞を播種したケモタクシススライドを湿度チャンバーの湿度チャンバーに37°Cで2~3時間置きます。
4. 貯水池を充填し、化学誘引剤を追加
- 反転顕微鏡を使用して、観察領域(2つの40 μLリザーバをつなぐチャネル)を検査します。
注:この段階では、細胞密度は貯留槽を充填した後よりも高くなり、弱接着性の細胞は、主にCD19+細胞(B1細胞)が充填手順の間に観察領域から洗浄されることになるからである(図2C-E)。 - 充填ポート1と2にプラグを差し込みます(図2D)。充填ポート3が媒体で上部に充填され、気泡がないことを確認します。必要に応じて、不要な気泡を取り除くために滅菌27Gシリンジ針を使用してください。
- 10~100 μLの体積機械的ピペットを使用して、RPMI 1640 HEPES培地を吸引して、ピペットチップを充填ポート3に入れる。ピペットのボリューム設定リングを使用して、1~2分後に媒体が充填ポート4の上部に到達するように、ゆっくりと着実に媒体を貯水池に注入します(図2D)。
- 2番目の貯水池を満たします。ポート 1 からプラグを移動し、ゆっくりとポート 3 に挿入します (図 2D)。次に、50μLの吸気液を加えたRPMI 1640 HEPES培地を吸引し、ピペットチップを充填ポート4に入れる。10~100 μLのボリュームピペットのボリューム設定リングを使用して、1~2分後に媒体が充填ポート1の上部に到達するように、ゆっくりと着実に媒体を第2の貯水池に注入します(図2D)。
- 495 μLの変更されたRPMI 1640 HEPES培地を(ラウンドボトム)2 mLマイクロ遠心分離チューブに入れ、5 μLのパテントブルーV(ストック溶液:リン酸緩衝生理食塩水[PBS])を加え、濃度形成の視覚的指標として使用される青色色素です。短い渦によって混ぜる。組み換えマウス補数C5a(ストック溶液:0.1%ウシ血清アルブミンを用いたPBSで50μg/mL)を加え、短いボルテックスで混合します。
- 15 μLの青色をデポジットし、C5a含有培地を充填ポート1(図3A)に入水し、ポート上部の浅いくぼみが中程度のフリーであることを確認した後(それ以外の場合はドロップが波及する可能性があります)。
- 充填ポート4に10~200μLのピペットチップを挿入し、10~100μLの体積ピペットのボリューム設定リングをゆっくりと安定して回転させ、C5a含有媒体を反対側の貯水池に引き込みます(図3B)。空気は充填ポート1の短い垂直列に入り始めます。流体と空気のインターフェイスが垂直列の中間になるまで空気を引き込み、ゆっくりとポートにプラグを挿入します。
- もう一方の手でピペットをポート4から静かに持ち上げて、スライドが所定の位置に固定されていることを確認します。最後に、ゆっくりとポート4を接続します(図3B)。
- 反転顕微鏡で、走気軸スライドを点検します。
注:観察領域内の残りの付着細胞は、主にマクロファージであるべきである。これは、蛍光タグ付き抗F4/80抗体(F4/80はマウスマクロファージの特定マーカー)を用いて確認することができる。B細胞は、蛍光タグ付き抗CD19抗体およびF4/80-/CD19-青色蛍-光核酸染色を用いて検出できる(図4)。-
5. タイムラプスによるマクロファージ移行のイメージング、位相コントラスト顕微鏡
- ステージインキュベーターを装着した反転顕微鏡のステージ上に、走像スライドを置きます。温度を37°Cに保ちます。
- 10x位相対比対物レンズを使用して1mm x 2mmの観察領域を画像化し、マクロファージラメリポディアに焦点を当てます:薄いシート状の膜突起。2分ごとに1フレームのレートで14時間の画像をキャプチャします。
6. タイムラプス画像の解析
- ImageJ用に、自動画像解析ソフトウェアまたはファブリス・P・コーデレール製の手動追跡プラグインを使用して、タイムラプス、位相コントラスト画像を解析します。
注:自動追跡プログラムは、タイムラプス、位相コントラスト、蛍光顕微鏡で画像化された細胞を解析するために使用できます。例えば、Cordelièresららによって製造されたJavaベースのソフトウェアiTrack4Uは、入力としてタイムラプス、位相コントラスト、または蛍光画像を使用して、自動細胞追跡および分析に使用することができる。手動追跡はより時間がかかりますが、ImageJプラグインマニュアル追跡によって生成されたトラックを直接インポートし、ImageJプラグインChemotaxisと移行ツール28、29,29によって自動的に分析することができます。
結果
マウス腹膜マクロファージのタイムラプスビデオ顕微鏡に用いられる気道化スライドの模式図を、化学戦術勾配で移動する図2Aに示す。スライドには3つのケモタシク室があり、それぞれに4つの充填ポートがあります。ポートは、スライドの上に示すプラグを使用して個別に閉じることができます。あるいは、非シールキャップを抜いたポートの上に置き、無菌性を維持することもできます。ポート1と4を差し込んだ後、ポート2と3の間の観測領域(2つの貯水池をつなぐ1mm幅x 2mmの長さx70 μmの高いチャネル)を、ポート3に15μLの落下を入れ、ポート2に2〜20μLの体積ピペットを吸引することによって、媒体で事前充填することができます(図2B)。マウス常駐腹膜細胞(10 x 106細胞/mL)の懸濁液を、10μLの懸濁液をポート3に入れ、ポート2でゆっくりと吸引することによって観察領域に播種した(図2C)。10x対物レンズを用いた位相対比顕微鏡で採取した観察領域に播種された細胞の典型的な画像を図2Cに示す。2~3時間のインキュベーション後、走気軸スライドは徐々に培地で満たされていました(図2D)。ポート 1 とポート 2 を接続した後、ポート 4 から出てくるまで、ポート 3 を介してメディアをゆっくりと注入しました。次に、プラグをポート 1 からポート 3 に切り替え、次にポート 4 を介して 2 番目のリザーバーをゆっくりと注入して、ポート 1 に出現するまで埋め込みます。この段階では、観察領域内の細胞を反転顕微鏡を用いて再検査した(図2E)。画像を(図2C)と後(図2E)の貯留槽の充填を比較することにより、細胞の3分の2までが観察領域から洗い流されていた。一般的に、弱接着性CD19+細胞(B1細胞)を洗い流し、残りの細胞は主にF4/80+細胞(マクロファージ)であった。+これは、各細胞型を蛍光標識特異的抗体で標識した後の蛍光顕微鏡法によって実証された(図4)。図4Aにおいて、新たに単離されたマウス存在性腹膜細胞を緑色蛍光蛍光フルオロフォア共役抗F4/80抗体および赤色蛍光フルオロフォア共役抗CD19抗体で標識し、細胞の核を青色の核酸染色で標識した。F4/80はマウスマクロファージ30の特定マーカーであり、CD19はB細胞マーカーである。図4Bは、F4/80+細胞を、走心房の観察領域で回転ディスク共焦点顕微鏡で画像化した。+細胞は、タイムラプス、位相対向顕微鏡によって記録された一晩の気胸測定の後に標識した。
補体C5a(化学誘引剤)は、ポート2と3を差し込んだ後、0.54 μg/mL(組換えマウス)補体C5aおよび10μg/mL特許ブルーVを充填ポート1(図3A)に入れる媒体の15μLの低下を2つの貯蔵所の1つに導入した。化学誘起媒体は、ポート4を介してピペットでゆっくりと吸引することによってゆっくりと貯水池に引き込まれた。図3Bは、15μLの滴をリザーバに引き出した後の青色色素の拡散を示す。特許Blue Vは、化学誘引拡散の間接視覚指標として使用された。補体C5a分子は、特許ブルーV(9.0 kDa対0.57kDa)の分子よりもかなり大きく、よりゆっくりと拡散します。リザーバー内で補体C5aを拡散した後、その濃度は~0.2μg/mL(15μL/40 μL[貯留体積]x 0.54 μg/mL=0.2 μg/mL)、〜22.5nMに相当した。3時間後に観測領域を横切って緩やかに急勾配が形成され、増加し続け、約12時間31で最大に達した。図3Cは、化学誘引剤を添加した後、6〜12時間の間に、補数C5a勾配で移行するマクロファージの移動トラックを示しています。y-FMI(y-forward移行指数;範囲:-1~+1)およびx-FMIとして指標化された細胞速度および化学戦術効率は、個々のマクロファージの移動プロットから計算した(図3D)。図3Dは、各移行トラックの始点を、ボックスプロットの下のX= 0とY = 0に正規化した後に生成されるマイグレーションプロットも示しています。移行プロットのインセットは、各移行トラックに対してy-FMIがどのように計算されたかを示しています。
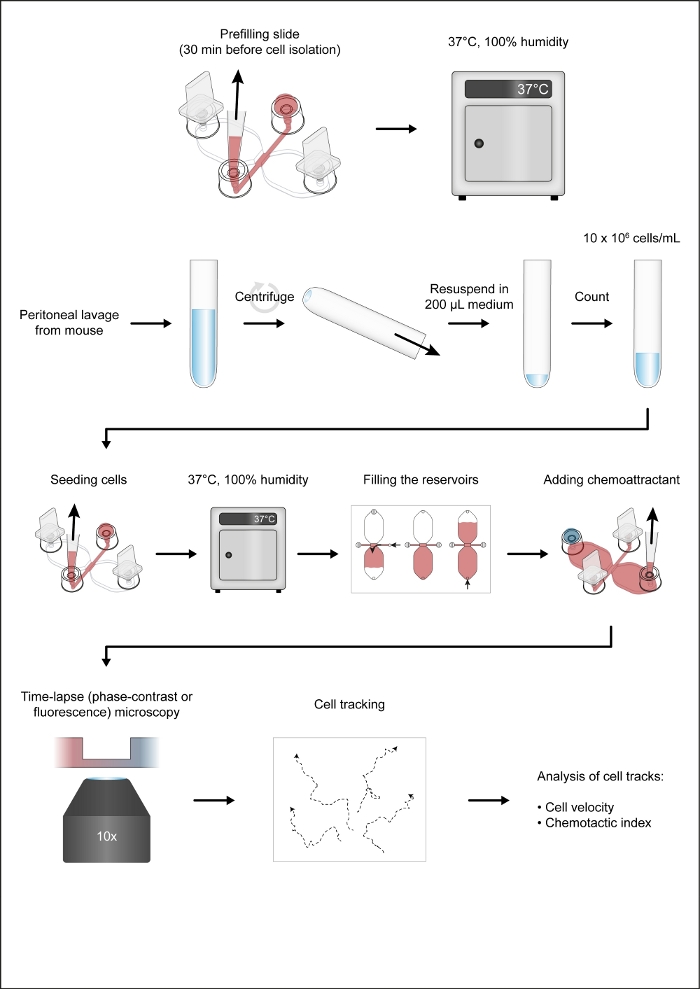
図1:走化アッセイのワークフローこの図の大きなバージョンを表示するには、ここをクリックしてください。

図2:走顔軸スライドの取り扱い(A) 4つのプラグと4つのキャップを備えた、走気軸スライドの3Dビュー。スライドには3つのケモタクシスチャンバーが含まれており、それぞれ1mm x 2mmチャネルで接続された2つの40 μL貯留層で構成され、高さは70μmで、観測領域と呼ばれます。(B) 接続チャネルは両端でポート 2 と 3 を満たすまで拡張されます。充填ポート1と4にプラグを挿入した後、観測領域は、ポート3に媒体の滴を塗布し、ポート2で10〜200 μLのピペットチップで吸引することによって、中(赤)で事前充填されました。続いて、37°Cでスライドをインキュベートし、細胞懸濁液を調製する前に、ポート2および3にキャップを塗布した。(C)化学誘引性勾配が形成された観察領域には、ポート3でマウス常駐腹膜細胞を10μL滴下し、ポート2でゆっくりと吸引することによりマクロファージを播種した。スライドは、37°Cの湿度室で2〜3時間インキュベートしました。右に示す位相コントラスト画像は、10x対物レンズを介して得られ、2時間37°Cで播種およびインキュベーションした腹膜細胞を示し、スケールバー=500μm(D)Chemotaxisチャンバーは、ポート1と2を差し込んで媒体で満たされ、ポート3を介して徐々に媒体を注入してポート4に出現するまで注入した。D20~100 μLのボリュームピペットのボリューム設定リングを回すことで、ゆっくりと安定した充填を実現できます。最初のリザーバを充填した後、第2の貯留所はポート2および3を差し込むことによって満たされ、ポート1に現れるまでゆっくりとポート4で媒体を注入することができる。(E)2つの貯留層を充填した後に上図(C)に示した同じ観察領域の位相対比像。スケールバー = 500 μm. イライアスホーンが提供するグラフィック要素。この図の大きなバージョンを表示するには、ここをクリックしてください。

図3:化学療法アッセイ。(A)化学誘引剤は、0.54 μg/mL補数C5aおよび10μg/mLパテントブルーVを含む培地の15μL低下を充填ポート1に塗布し、続いて吸引ポート4で遅くして、気化チャンバーの2つの貯留層のうちの1つに導入した。(B)最初は、貯水池に引き込まれた後、青色の化学誘引性含有媒体は、大まかに反転した落下形状を有し、その後、ゆっくりと貯留層全体に拡散した。(C) 化学誘引剤を貯水池の1つに導入した後、6~12時間の間に化学誘引体(補数C5a)勾配で移動するマクロファージの移動トラック。グラデーションの方向は右側に示されます。各移行トラックの終わりは、塗りつぶされた円で示されます。(D) 速度の Blox プロット、x-FMI (x-forward 移行インデックス) および y-FMI (y-forward 移行インデックス) -1 から +1 までの化学戦術効率の指標。データは、25のマクロファージ移行トラックの分析によって得られた。6時間を超える少なくとも1つの細胞幅の変位を示す観察領域の下半分のマクロファージを、分析のために無作為に選択した。以下は、始点を X = 0 および Y = 0 に正規化した後のマイグレーショントラックのプロットです。この気化指数(y-FMI)は、図示のように、Y軸(d)に沿った正味変位を、累積された移動経路の長さ(l)で割って算出した。イライアス・ホーンが提供するパネルAとBのグラフィック要素。この図の大きなバージョンを表示するには、ここをクリックしてください。
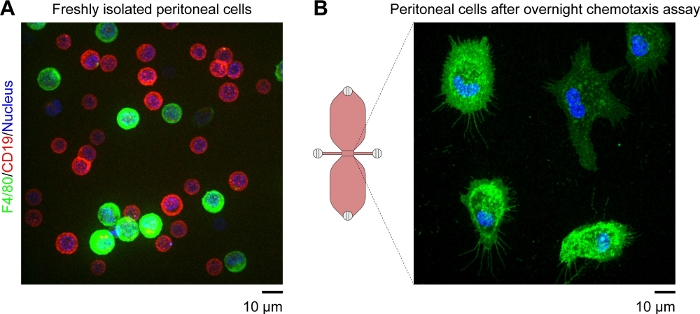
図4:ディスク共焦点顕微鏡を紡糸した生きたマウス常駐腹膜細胞の蛍光画像。(A)緑色蛍光抗F4/80(マクロファージマーカー)抗体、赤色蛍光抗CD19(B細胞マーカー)抗体、および青色蛍光核酸染色で標識された、新たに単離したマウス腹膜細胞の拡張焦点像(全てのZ面の最も明るい点合合い)スケールバー=10μm(B)F4/80+細胞のスナップショット(単一のZ+面)は、一晩の気胸アッセイの後に採取した顔軸チャンバの観察領域内で。B細胞は緑色蛍光抗F4/80抗体と青色蛍光核酸染色で標識した。補体C5a及びパテントブルーV勾配を細胞標識法によって洗い流した、これは、この気化チャンバの概略図における上部貯留部が青色でない理由を説明する。スケールバー = 10 μm. イライアスホーンが提供するグラフィック要素。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
インビタルイメージングは19世紀にさかのぼり、自然環境における生きている免疫細胞の行動を研究する手段を提供します。しかし、今日の高度な顕微鏡や遺伝的手法を用いても、生体内の特定の化学誘引物質に対する細胞の反応を研究することは困難です。この問題を回避するために、Boyden18は1960年代にトランスウェルアッセイを開発しましたが、これらの終点アッセイは細胞が実際に化学誘引物質に移行する方法を視覚化しておらず、ケモキネシスを区別することが困難になり、化学キュー32によるランダムな移動を刺激し、化学的刺激物の高濃度に向かって移動します33.この問題は、橋を持つ様々な開放室を設計することによって解決されました, 通常1ミリメートル幅, 2つの貯水池の間に位置し、対物レンズ21、22、23,22,23でアクセス可能です。付着細胞を播種した反転カバースリップを適用すると、チャンバーを閉じ、貯水池の1つに加えた化学誘引剤が橋を横切って反対側の貯水池に拡散し、濃度勾配が生じます。ここでは、同じ原理を使用して、4つの充填ポートを備えた閉じたチャンバーを使用して、走気化アッセイについて説明します。このシステムとタイムラプス、位相コントラスト顕微鏡を用いて、我々は、C5aの勾配31、34、35、36,34,35の化学戦術補体で移動するマウス常駐腹膜マクロファージを画像化するアッセイを36開発した。このアッセイは、ノックアウトマウスモデルと組み合わせることで、マクロファージ形態、運動性、および化学,体質31、34、35、36、37,34における様々なRho GTPasesおよび運動タンパク質の役割の調査に役立つ。36,37,35我々はまた、このアプローチを用い、2D表面または3Dコラーゲン型Iマトリックス38で移動するヒト末梢血単球を画像化する。さらに、このアッセイは、条件付きで不死化骨髄前駆細胞39,40,40に由来するマウス骨髄由来マクロファージまたはマクロファージに適している。我々は以前に骨髄細胞を培養し、マクロファージ34を得るためにルアーアダプターとポリテトラフルオロエチレン(PTFE)バッグを使用しました。PTFEバッグの利点は、袋を氷の上に20〜30分間置いた後、細胞を容易に再懸濁して使用できるということです。このアプローチは、不要な気泡をその後(可変的な成功で)洗い流すことができるという利点を有し、予め浸された観察領域はピペットによって細胞懸濁液の遅い導入を可能にする。しかし、事前充填は、培地が部分的に隣接する貯水池の一方または両方に流れ込む可能性を高め、観察領域を越えて細胞の播種を促進する。あるいは、細胞懸濁液を乾燥観察領域に直接配管することができるが、不要な気泡は後で排出することができない。
マウスの腹膜腔には、F4/80+マクロファージおよび(より小さい)CD19+B細胞の2つの主要な集団+が含まれ、約1:2の比率で(図4A)。+これら2つの細胞集団は腹腔細胞の95%以上を占めるが、残りのF4/80-/CD19細胞は通常、CD11c+細胞(樹状細胞)または-CD3+細胞(T細胞)として+同定することができる。弱く付着したB細胞は、リザーバを培地で充填する際に観察領域から洗い流される(図2)。2つの貯水池のいずれかに化学誘引剤を添加した後、タイムラプス、位相コントラスト顕微鏡を使用して、進化する化学誘引勾配で移動する残りの細胞(マクロファージ)を画像化することができます。観察領域における補体C5a勾配の形成は、一方の貯蔵所から他方への拡散を介して、同様の分子量を有する蛍光色素を用いてシミュレートすることができる。組換えマウス補体C5a(予測分子量、9.0 kDa)の代用として優れた、デキストラン(10kDa)31に蛍光標識されている。31共焦点顕微鏡を用いて、狭いチャネル(観察領域)の2つの貯留層を結ぶ狭いチャネル(観察領域)を異なる時間点で一定の間隔および濃度プロファイルで測定することができ、24,3131をプロットすることができる。24化学誘引剤媒体に非蛍光性青色色素(Patent Blue V)を日常的に添加し、拡散と勾配形成の便利な視覚指標を提供しています。15 μLの青、化学誘起剤含有培地を貯水池に導入してから1時間以内に、貯留層は均一に青色に見え、フィックの拡散法則によれば、貯水池を結ぶ狭い観察領域に勾配が形成される(図3B)。溶質(青い染料または化学誘引剤)が均一に分布するために数日が必要です。
蛍光顕微鏡は、蛍光標識された細胞をバックグラウンドから容易に区別できるため、自動細胞追跡の利点を提供する位相対比顕微鏡の代用が可能です。もう一つの利点は、免疫細胞の特定の集団が蛍光抗体で表面マーカーを標識した後に選択的に追跡できることである。この手法を用い、ヒト末梢血CD14+細胞(単球)を化学戦術fMLP(N-ホルミルメチオニン-ロイシル-フェニルアラニン)勾配38で遊走する画像化に用いた。同様に、蛍光抗F4/80抗体は、化学戦術補体C5a勾配で遊走するマウスマクロファージを画像化するために使用することができる。光毒性は、蛍光イメージング41を用いるという潜在的な欠点である。これは、より長い波長で励起された蛍光色素を使用し、培地に抗酸化物質を添加することを含む様々な手段42によって減少させることができる。あるいは、標識された細胞は、蛍光顕微鏡によって最初に同定され、その後、タイムラプス、位相コントラスト顕微鏡によって画像化することができた。しかし、実際には、〜1μm/min(マクロファージ)や〜4μm/min(単球)のような適度に低い速度で移動する細胞は、微小間隔で蛍光顕微鏡で断続的に画像化することができ、これは十分に許容される38である。我々は、以前に3D化学軸アッセイ38、43のためにここで説明する蛍光顕微鏡と気化スライドを43使用した。この場合、両方のリザーバが、コラーゲン型I型を含む培地に浮遊する蛍光標識細胞を観察領域にゆっくりとピペットする直前に、培地および15μLの化学誘引物質含有培地を1つの貯留槽に引き込んだ。この手順の難しい部分は、酸性溶液に濃縮されたコラーゲンタイプIの取り扱いです。コラーゲン溶液のpHは、細胞懸濁液と氷冷コラーゲン溶液を混合する前にアルカリ溶液を添加して中和する必要があります。37°Cでインキュベーターにコラーゲン細胞混合物を移す、コラーゲン重合を開始します。インキュベーション中、スライドは長い軸の周りをゆっくりと回転させ、細胞がX軸、Y軸、Z軸方向に均等に分布したまま、コラーゲンがゲルに重合するようにします。3Dの化学療法アッセイに適した関連の閉じた気化スライドは、4つのプラグの代わりに6つのプラグを備え、最近29を説明した。このシステムは、各貯水池が単一のポートではなく2つの充填ポートを有するため、各貯蔵所を独立して充填する前に、コラーゲン細胞混合物を観察領域に導入することを可能にする。
要約すると、6時間以上にわたって化学戦術勾配でナビゲートする細胞の可視化を可能にするリアルタイムの走化アッセイについて述べた。ここでは、炎症性疾患において主要な役割を果たすが、好中球やジクチオステリウムアメーバのようなより速い移動細胞と比較してリアルタイムの化学式アッセイで過小評価されているマクロファージに焦点を当てています。
開示事項
著者らは開示するものは何もない。
謝辞
この研究は、DFG(ドイツ・フォルシュングスゲマイヌシャフト)からの助成金(HA 3271/3-2)によって支えられた。
資料
| Name | Company | Catalog Number | Comments |
| µ-Slide (anodized aluminium) rack | Ibidi, Martinsried, Germany | 80003 | Autoclavable stackable rack for channel slides |
| µ-Slide Chemotaxis 2D (chemotaxis slide) | Ibidi, Martinsried, Germany | 80306 | Slide containing chemotaxis chambers (tissue culture treated) |
| 100x penicillin/streptomycin | Thermo Fisher Scientific | 15140122 | Used as supplement for RPMI 1640 media |
| 10-100 µL pipette with volume control ring | Eppendorf | 3123000047 | Eppendorf Research plus pipette |
| 10-200 µL pipette tips | Greiner Bio-One International | 739261 | Pipette tips with beveled tips (96 pieces per rack: sterile) |
| 14 mL polypropylene round bottom tubes | BD Falcon | 352059 | Used to collect peritoneal cells |
| 14-bit Hamamatsu C9100-50 Electron Multiplying-Charged Couple Device (EM-CCD) peltier-cooled camera | Hamamatsu Photonics Inc., Japan | EM-CCD camera of the spinning disk confocal microscope system | |
| 2-20 µL pipette with volume control ring | Eppendorf | 3123000039 | Eppendorf Research plus pipette |
| 24 G plastic catheter | B Braun Mesungen AG, Germany | 4254503-01 | Used for peritoneal lavage |
| 405 nm solid state laser, 50 mW | Perkin Elmer, Rodgau, Germany | Laser (405 nm) source of spinning disk confocal microscope system | |
| 488 nm solid state laser, 50 mW | Perkin Elmer, Rodgau, Germany | Laser (488 nm) source of spinning disk confocal microscope system | |
| 561 nm solid state laser, 50 mW | Perkin Elmer, Rodgau, Germany | Laser (561 nm) source of spinning disk confocal microscope system | |
| Alexa Fluor 488-conjugated rat (IgG2a) monoclonal (clone BM8) anti-mouse F4/80 antibody | Thermo Fisher Scientific | MF48020 | Mouse macrophage marker and plasma membrane label |
| Alexa Fluor 594-conjugated rat (IgG2a) monoclonal (clone 6D5) anti-mouse CD19 antibody | BioLegend | 115552 | Mouse B cell marker |
| C-Chip disposable (improved Neubauer) hemocytometer | NanoEnTek (distributed by VWR International) | 631-1098 | Used to count cells |
| CSU-X1 spinning disk scanner | Yokogawa Electric Corporation, Japan | Nipkow spinning disk unit | |
| Hank’s buffered salt solution without Ca2+ and Mg2+ | Thermo Fisher Scientific | 14170120 | Used for peritoneal lavage |
| Heat-inactivated fetal bovine serum | Thermo Fisher Scientific | 10082139 | Used as supplement for RPMI 1640 media |
| Hoechst 34580 | Thermo Fisher Scientific | H21486 | Cell permeable, blue fluorescent nucleic acid stain |
| ImageJ (image processing and analysis in Java) | National Institutes of Health (NIH) | Image analysis software | |
| Lipopolysaccharides from Escherichia coliO111:B4 | Sigma-Aldrich | L4391-1MG | Toll-like receptor 4 ligand |
| Nikon Eclipse Ti inverse microscope | Nikon, Japan | Inverted microscope | |
| Patent Blue V, sodium salt | Sigma-Aldrich | 21605-10G | Blue-colored dye used as visual indicator of gradient formation |
| Recombinant mouse complement C5a protein | R&D Systems | 2150-C5-025 | Chemoattractant for mouse macrophages |
| RPMI 1640 medium containing 20 mM Hepes | Sigma-Aldrich | R7388 | Basis medium for assays |
| UltraVIEW Vox 3D live cell imaging system + Volocity software | Perkin Elmer, Rodgau, Germany | Spinning disk confocal microscope system | |
| Zeiss LSM 510 + Axiovision software | Carl Zeiss Microscopy, Oberkochen, Germany | Confocal laser scanning microscope (LSM) adapted for phase-contrast microscopy |
参考文献
- Lammermann, T., Germain, R. N. The multiple faces of leukocyte interstitial migration. Seminars in Immunopathology. 36, 227-251 (2014).
- Lammermann, T., Sixt, M. Mechanical modes of 'amoeboid' cell migration. Current Opinion in Cell Biology. 21, 636-644 (2009).
- Woodham, E. F., Machesky, L. M. Polarised cell migration: intrinsic and extrinsic drivers. Current Opinion in Cell Biology. 30, 25-32 (2014).
- Devreotes, P. N., et al. Excitable Signal Transduction Networks in Directed Cell Migration. Annual Review of Cell and Developmental Biology. 33, 103-125 (2017).
- Kamp, M. E., Liu, Y., Kortholt, A. Function and Regulation of Heterotrimeric G Proteins during Chemotaxis. International Journal of Molecular Sciences. 17 (1), 90 (2016).
- Miao, Y., et al. Wave patterns organize cellular protrusions and control cortical dynamics. Molecular Systems Biology. 15, 8585 (2019).
- Ridley, A. J., et al. Cell migration: integrating signals from front to back. Science. 302, 1704-1709 (2003).
- Lammermann, T., et al. Rapid leukocyte migration by integrin-independent flowing and squeezing. Nature. 453, 51-55 (2008).
- Mullins, R. D., Heuser, J. A., Pollard, T. D. The interaction of Arp2/3 complex with actin: nucleation, high affinity pointed end capping, and formation of branching networks of filaments. Proceedings of the National Academy of Sciences of the United States of America. 95, 6181-6186 (1998).
- Leithner, A., et al. Diversified actin protrusions promote environmental exploration but are dispensable for locomotion of leukocytes. Nature Cell Biology. 18, 1253-1259 (2016).
- McDonald, B., et al. Intravascular danger signals guide neutrophils to sites of sterile inflammation. Science. 330, 362-366 (2010).
- Leber, T. Ueber die Entstehung der Entzündung und die Wirkung der entzündungserregenden Schädlichkeiten. Fortschritte der Medizin. 6, 460-464 (1888).
- Tauber, A. I. Metchnikoff and the phagocytosis theory. Nature Reviews Molecular Cell Biology. 4, 897-901 (2003).
- Clark, E. R., Linton Clark, E. Reactions of cells in the tail of amphibian larvae to injected croton oil (aseptic inflammation). American Journal of Anatomy. 27, 221-254 (1920).
- Clark, E. R., Linton Clark, E. The reaction of living cells in the tadpole's tail toward starch, agar-agar, gelatin, and gum arabic. The Anatomical Record. 24, (1922).
- Comandon, J. Phagocytose in vitro des Hématozoaires du Calfat (enregistrement cinématographique). Comptes Rendus Hebdomadaires des Séances et Mémoires de la Société de Biologie. 69, 314-316 (1917).
- McCutcheon, M. Chemotaxis in leukocytes. Physiological Reviews. 26, 319-336 (1946).
- Boyden, S. The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes. The Journal of Experimental Medicine. 115, 453-466 (1962).
- Horwitz, D. A., Garrett, M. A. Use of leukocyte chemotaxis in vitro to assay mediators generated by immune reactions. I. Quantitation of mononuclear and polymorphonuclear leukocyte chemotaxis with polycarbonate (nuclepore) filters. Journal of Immunology. 106, 649-655 (1971).
- Bignold, L. P. A novel polycarbonate (Nuclepore) membrane demonstrates chemotaxis, unaffected by chemokinesis, of polymorphonuclear leukocytes in the Boyden chamber. Journal of Immunological Methods. 105, 275-280 (1987).
- Zigmond, S. H. Ability of polymorphonuclear leukocytes to orient in gradients of chemotactic factors. The Journal of Cell Biology. 75, 606-616 (1977).
- Zicha, D., Dunn, G. A., Brown, A. F. A new direct-viewing chemotaxis chamber. Journal of Cell Science. 99, 769-775 (1991).
- Muinonen-Martin, A. J., Veltman, D. M., Kalna, G., Insall, R. H. An improved chamber for direct visualisation of chemotaxis. PLoS One. 5, 15309 (2010).
- Zengel, P., et al. mu-Slide Chemotaxis: a new chamber for long-term chemotaxis studies. BMC Cell Biology. 12, 21 (2011).
- Valentim, A. M., Guedes, S. R., Pereira, A. M., Antunes, L. M. Euthanasia using gaseous agents in laboratory rodents. Lab Animal. 50, 241-253 (2016).
- Franks, N. P. General anaesthesia: from molecular targets to neuronal pathways of sleep and arousal. Nature Reviews. Neuroscience. 9, 370-386 (2008).
- Cordelieres, F. P., et al. Automated cell tracking and analysis in phase-contrast videos (iTrack4U): development of Java software based on combined mean-shift processes. PLoS One. 8, 81266 (2013).
- Zantl, R., Horn, E. Chemotaxis of slow migrating mammalian cells analysed by video microscopy. Methods in Molecular Biology. 769, 191-203 (2011).
- Biswenger, V., et al. Characterization of EGF-guided MDA-MB-231 cell chemotaxis in vitro using a physiological and highly sensitive assay system. PLoS One. 13, 0203040 (2018).
- Austyn, J. M., Gordon, S. F4/80, a monoclonal antibody directed specifically against the mouse macrophage. European Journal of Immunology. 11, 805-815 (1981).
- Hanley, P. J., et al. Motorized RhoGAP myosin IXb (Myo9b) controls cell shape and motility. Proceedings of the National Academy of Sciences of the United States of America. 107, 12145-12150 (2010).
- Wilkinson, P. C. Cell Locomotion and Chemotaxis: Basic Concepts and Methodological Approaches. Methods. 10, 74-81 (1996).
- Pfeffer, W. Locomotorische Richtungsbewegungen durch chemische Reize. Untersuchungen aus dem Botanischen Institut zu Tübingen. 1, 363 (1884).
- Konigs, V., et al. Mouse macrophages completely lacking Rho subfamily GTPases (RhoA, RhoB, and RhoC) have severe lamellipodial retraction defects, but robust chemotactic navigation and altered motility. The Journal of Biological Chemistry. 289, 30772-30784 (2014).
- Horsthemke, M., et al. Multiple roles of filopodial dynamics in particle capture and phagocytosis and phenotypes of Cdc42 and Myo10 deletion. The Journal of Biological Chemistry. 292, 7258-7273 (2017).
- Bachg, A. C., et al. Phenotypic analysis of Myo10 knockout (Myo10(tm2/tm2)) mice lacking full-length (motorized) but not brain-specific headless myosin X. Scientific Reports. 9, 597 (2019).
- Horsthemke, M., et al. A novel isoform of myosin 18A (Myo18Agamma) is an essential sarcomeric protein in mouse heart. The Journal of Biological Chemistry. 294, 7202-7218 (2019).
- Bzymek, R., et al. Real-time two- and three-dimensional imaging of monocyte motility and navigation on planar surfaces and in collagen matrices: roles of Rho. Scientific Reports. 6, 25016 (2016).
- Wang, G. G., et al. Quantitative production of macrophages or neutrophils ex vivo using conditional Hoxb8. Nature Methods. 3, 287-293 (2006).
- Gran, S., et al. Imaging, myeloid precursor immortalization, and genome editing for defining mechanisms of leukocyte recruitment in vivo. Theranostics. 8, 2407-2423 (2018).
- Magidson, V., Khodjakov, A. Circumventing photodamage in live-cell microscopy. Methods in Cell Biology. 114, 545-560 (2013).
- Icha, J., Weber, M., Waters, J. C., Norden, C. Phototoxicity in live fluorescence microscopy, and how to avoid it. BioEssays : News and Reviews in Molecular, Cellular and Developmental Biology. 39 (8), 1700003 (2017).
- Isfort, K., et al. Real-time imaging reveals that P2Y2 and P2Y12 receptor agonists are not chemoattractants and macrophage chemotaxis to complement C5a is phosphatidylinositol 3-kinase (PI3K)- and p38 mitogen-activated protein kinase (MAPK)-independent. The Journal of Biological Chemistry. 286, 44776-44787 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved