Method Article
마우스 대식세포 화학의 시간 경과 화상 진찰
요약
여기에서 우리는 화학 전술 보완 C5a 구배를 이미지 마우스 상주 복막 대식세포에 시간 경과, 위상 대조 현미경 검사법을 사용하여 방법을 설명합니다. 프로토콜은 그밖 면역 세포로 확장될 수 있습니다.
초록
화학변균은 화학적 구배를 따라 세포의 수용체 매개 지도인 반면, 케모키네스는 화학물질에 의한 무작위 세포 운동성의 자극이다. 케모키네스와 화학변균은 면역 세포의 동원 과 배치에 대한 기본입니다. 예를 들어, 화학요법 (화학 적 사이토 카인)은 염증의 외혈관 부위에 순환 호중구와 단핵구를 빠르게 모집 할 수 있습니다. 화학 유력 제 수용 체 G 단백질 결합 된 수용 체의 큰 가족에 속한다. 화학적 유저제(즉, 리간드) 그라데이션이 G 단백질 결합 수용체 신호화를 통한 직접 세포 이동은 아직 완전히 이해되지 않는다. 면역학 분야에서 호중구는 시험관 내 화학 택시를 연구하기위한 인기있는 모델 세포입니다. 여기에서 우리는 마우스 상주 대식세포에 맞춘 실시간 2차원 (2D) 화학변세포 분석법을 기술합니다, 이는 전통적으로 공부하기 더 어려웠습니다. 대식세포는 2D 표면에서 ~1 μm/min의 느린 속도로 이동하고 호중구 또는 Dictyostelium discoideum보다포인트 소스 이동 분석 (예를 들어, 화학 유저제로 채워진 마이크로 파이펫의 끝으로 이동)에 덜 적합합니다. 널리 사용되는 Transwell 어소시에이션은 다른 물질의 화학 활성을 연구하는 데 유용하지만 세포 형태, 속도 또는 화학 적 탐색에 대한 정보를 제공하지 않습니다. 여기에서 우리는 세포 속도 및 화학 적 효율성의 정량화를 허용하고 트랜스듀서, 신호 경로 및 화학 요법의 이펙터를 묘사하는 플랫폼을 제공하는 시간 경과 현미경 검사법 기반 대식세포 화학 요법 을 설명합니다.
서문
면역 세포는 전형적으로 아메바디드방식으로2D 표면상에서 개별적으로 이동하며, 이는 전방의 돌출, 인테그린 매개 세포 부착 및 후방의 후퇴를 반복하는 주기를 수반한다.,2 전제 조건 단계는 세포가 전면및 후면 끝3을형성하는 세포 편광입니다. 화학변색은 G 단백질 결합 수용체에 의한 화학유약체 검출과 막 고정된 이종성 G 단백질및 작은 단조체 G 단백질뿐만 아니라 인지질 결합 구아닌 뉴클레오티드 교환 인자(GEFs)4,,5에의해 매개되는 복잡한 신호 네트워크로 시작된다. Cdc42 및 Rac 하위 패밀리의 로 GTPases의 활성화는 전방6및 로 소가족, 특히 RhoA의 구성원에서 돌출을 유도하고,후방5,7의수축을 활성화한다. 3차원(3D) 환경에서, 인테그린은 백혈구 이동을 위해 대체로 중복되고 RhoA는 좁은 통로8을통해 세포를 압박하는 데 더 중요해지는 반면, Cdc42- 또는 Rac-유도9Arp2/3 활성화는 화학조향9,,10에대해 여전히 중요하다.
면역 세포는 다른 화학 물질에 직면할 수 있습니다., 특히 조직 손상의 설정에서, 병원 체 침략, 그리고 염증. 식세포에 발현된 내인성 화학유채는 C3a 및 C5a를 보완하고, 보체 캐스케이드의 활성화에 의해 빠르게 생성되고, C3a 및 C5a 수용체를 보완함으로써 인식된다. 유사하게, 괴사 세포는 미토콘드리아 유래뿐만 아니라 박테리아 유래 포르밀펩티드(11)를인식하는 포밀 펩티드 수용체를 통해 식세포를 모집한다. 면역 세포는 또한 화학에 대 한 G 단백질 결합 된 수용 체를 표현, 항상성 및 염증 동안 면역 세포 인신 매매의 조절에 관여 하는 화학 유력 펩 티 드의 큰 가족. 케모카인은 처음 두 개의 시스테인 (C) 잔기의 간격에 따라 4 개의 그룹으로 분류 됩니다: C, CC, CXC, 그리고 CX3C 사이토 카인, 어디 X는 아미노산. 따라서 생체 내 면역 세포는 매우 복잡한 공간 및 시간적 신호에 적절하게 반응하여 화학 요법연구를 어려운 과제로 삼을 필요가 있습니다. 아래에서 우리는 intravital 화상 진찰 접근으로 시작된 화학요법의 간략한 역사를 제공합니다.
백혈구 화학 요법의 연구는 1888년 12년으로 거슬러 올라갑니다. Leber는 병원균 유래 물질에 의한 과잉 백혈구의 매력이 같은 10 년10년 초에 Metchnikoff (Metschnikoff라고도 함)에 의해 설명 된 식세포증을 통해 유해한 미생물을 제거하는 데 중요하다고 강조했습니다. 생체 내 실험은 또한 클라크와 클라크 에 의해 1920 년대에 수행되었다14,,15,누가 올챙이의 투명성을 활용하고 크로톤 오일에 의해 유도 된 멸균 염증을 보여 주었다14 또는 다른 자극제15 혈관에 부착 백혈구 발생, 투이페데시스 에 의해 다음 (transendothelialalilial) 및 조직 공간을 통해 급속한 이동. Jean Comandon16에 의해 개발된 마이크로시네마토그래피 방법을 이용한 시험관내 실험은 백혈구가 박테리아17과같은 미립자 화학유저물 공급원으로 이동하는 것을 보여주었다. 그 당시, 화학 전술 요인의 분자 정체성은 알려지지 않았습니다. 1960 년대에, 스티븐 보이든18 수용 성 물질의 화학 활성을 연구 하는 기술이 부족 했다 인식. 그는 이후 보이든 챔버로 알려진 챔버를 고안했으며, 두 개의 구획이 필터 종이 멤브레인으로 분리되었습니다. 세포 현탁액은 상부 구획에 추가되고 시험 물질은 두 구획 또는 하부 구획에만 추가됩니다. 잠복기 후, 필터 멤브레인이 제거되고 세포가 고정되고 염색됩니다. 필터 막을 가로질러 이동하는 세포 의 수를 두 구획의 시험 물질과 함께 하부 웰쪽으로 이동시키는 방법을 비교함으로써, 구획에서, 또는 하부 구획에서만, 화학 전술 활성을 결정할 수 있습니다. Transwell 어소시에이스는 오늘날에도 여전히 인기가 있으며 정의된 기공 크기와 밀도가 다른 폴리 카보네이트 멤브레인의 사용을 포함하여 다양한 방법으로 변형되어19,,20. Transwell 통종의 주요 단점은 직접 세포 마이그레이션 및 막을 가로 질러 이동 경로 면역 세포의 직경을 초과 하지 않는 시각화 하는 비실용적이 다.
샐리 H. 지그몬드는 형광 염료를 사용하여 그라데이션 형성과 세포 형태 모두를 시각화 할 수있는 화학 요법 챔버21을 개발했습니다. 챔버는 두 개의 평행 선형 웰이있는 플렉시 유리 (아크릴) 슬라이드로 구성되며, 각각 ~ 100 μL의 부피를 가지며 슬라이드의 상부 평면 아래 1mm 폭 의 다리 3-10 μm으로 구분됩니다. 세포로 시드 된 커버 슬립은 반전되어 두 개의 우물에 걸쳐 있도록 슬라이드에 놓습니다. 우물 중 하나에 화학 흡입제를 첨가 한 후, 다리를 가로 지르는 가파른 화학 적 구배 형태는 일반적으로 30-90 분 이내에 지그몬드 챔버의 인간 다형성 핵 백혈구 (과립구)가 화학 흡입제를 향하도록 관찰됩니다. 지그몬드 챔버의 변형은 던(22)과 Insall23 챔버를 포함하여 보고되었으며, 둘 다 1mm 폭의 다리로 분리 된 두 개의 우물에 배치 된 세포로 시드 된 커버 슬립을 사용합니다. 던 챔버는 원형 브리지로 분리 된 동심 우물로 구성되어 있으며 Insall 챔버는 지그몬드 챔버와 더 밀접하게 관련되어 있지만 0.5 mm및 1mm의 두 개의 서로 다른 폭의 다리를 제공합니다. 새로운 화학 변균 챔버, μ-Slide 화학 요법이라고하고 플라스틱 사출 성형에 의해 제조, Zemgel 등24에의해 설명되었다. 화학 전염 챔버는 길이 2mm와 높이 70 μm의 1mm 폭 채널로 분리 된 두 개의 40 μL 저수지로 구성됩니다. 챔버의 바닥은 No. 1.5 유리 커버 슬립(24)의두께 및 광학 적 특성과 동일한 가스 투과성, 얇은 플라스틱 시트에 의해 형성된다. 여기서 우리는 μ-Slide 화학요법 챔버를 사용하여 화학전술(complement C5a) 구배에서 최대 14시간 동안 마우스 상주 복막 대식세포의 이동을 시각화하는 화학동선증 을 기술한다.
프로토콜
이 프로토콜은 지역 연구 윤리 위원회의 지침과 동물 관리 지침을 따릅니다.
참고: 도 1은 화학변성 분석의 워크플로우를 나타낸다.
1. 화학 택시 슬라이드를 미리 채우기
-
변형된 RPMI 1640 HEPES 배지를 사용하여 1mm 너비 및 2mm 길이의 연결 채널을 1mm 너비및 2mm 길이의 연결 채널을 미리 채우고, 중탄산염이 없는 RPMI 1640 배지로 구성되어 있으며, 20mMM 4-(2-하이드록세틸)-1-피페라진에탄에설포닉 산 (HEPES), 10% 열 불활성화 태아 소 혈청 (FBS), 페니실린 (100 U / mL) 및 스트렙토 마이신 (100 μg / mL)과 같은 항생제, 100 x 페니실린 / 연쇄상 구균을 희석하여 제조, 및 1 μg/mL 리포폴리사카라이드(대장균에서), 그리고 통행료와 같은 수용체 4 리간드 사용 E. coli 을 클릭하여 셀을 활성화합니다.
- 화학탁증 슬라이드(그림2A)를원형(직경 10cm) 세포 배양 접시에 넣고, 둘 다 37°C로 예열하고, 접시를 가열된(37°C) 알루미늄 블록 에 놓는다. 포트 1과 4에 플러그를 삽입합니다(그림2B).
참고: 37°C에서 유지되고 층류 후드 내부에 배치된 알루미늄 블록은 화학탁증 챔버를 제조하는데 유용하다. 이상적으로, 가열 된 블록은 50 mL 튜브 및 2 mL 미세 원심 분리튜브와 같은 다양한 튜브에 대한 평평한 작업 영역과 우물을 제공해야합니다. - 경정맥 팁이 있는 10-200 μL 파이펫 팁을 사용하여, 변형된 RPMI 1640 HEPES 배지의 15 μL을 충전 포트3(그림 2B)에침전시킨다. 다음으로, 부피가 여전히 15 μL로 설정되고(2-20 μL 볼륨) 피펫의 제어 버튼을 누르면, 파이펫 팁을 포트 2에 삽입하고 적당히 빠른 속도로 15 μL을 흡인합니다(그림2B). 이것은 1mm x 2mm 연결 채널 (관찰 영역)뿐만 아니라 두 개의 측면 공급 채널 (중앙 관측 영역과 포트 2 및 3 사이)을 각각 채웁니다. 캡으로 충전 포트 2와 3을 덮습니다.
- 프리필 후, 화학탁증 슬라이드를 37°C에서 건조하고 CO2-free인큐베이터 내의 밀폐된 습도 챔버에 보관된 랙에 놓습니다.
참고: 화학 전염 슬라이드를 채우기 위해 올바른 파이펫 팁을 사용하는 것이 중요합니다. 베벨 피펫 팁은 충전 포트의 상단에 쐐기를 박는 반면, 일반적으로 사용되는 뾰족한 파이펫 팁은 충전 포트에 더 깊이 삽입할 수 있으며 유체 흐름에 대한 저항성을 크게 증가시킬 수 있습니다.
- 화학탁증 슬라이드(그림2A)를원형(직경 10cm) 세포 배양 접시에 넣고, 둘 다 37°C로 예열하고, 접시를 가열된(37°C) 알루미늄 블록 에 놓는다. 포트 1과 4에 플러그를 삽입합니다(그림2B).
2. 마우스 상주 맥막 대식세포의 격리
- 휘발성 마취 이소플루란(공기 중 5%) 또는 이산화탄소25의고농도를 사용하여 3-4개월 된 마우스를 희생한 다음 자궁 경부 탈구를 수행합니다. 설치류에서 권리 반사의 손실은인간26의의식 상실과 상관 관계가 있습니다. 물에 80 % 에탄올로 마우스의 복부를 청소한 다음 무딘 팁으로 수술 가위를 사용하여 1-2cm 미드 라인 피부 절개를합니다. 피부를 벗겨 내어 근본적인 복벽을 드러냅니다.
- 복강 내에 24G 플라스틱 카테터를 삽입합니다. 5 mL 플라스틱 주사기를 사용하여 Ca2+ 및 Mg2 +없이 2 x 4.5 mL 얼음 차가운 행크의 완충 염액 (HBSS)을 사용하여 공동을 세척하십시오. 카테터 의 끝에 실수로 흡입 된 조직이 추방 될 수 있도록 주사기에 잔류 HBSS의 약 0.5 mL을 둡니다.
- 용암 배지(일반적으로 8-8.5 mL)를 총 14mL 폴리프로필렌 원형 바닥 튜브로 옮김. 실온에서 6.5 분 동안 300 x g의 튜브를 원심 분리합니다.
참고: 둥근 바닥 튜브는 상급자가 완전히 디캔팅될 수 있게 하고 세포 응집을 감소시킵니다. - 상온액을 폐기하고 변형된 RPMI 1640 HEPES 배지의 200 μL에서 복막 세포(전형적으로 ~4 x 106 세포)를 재중단시킨다. 세포 현탁액의 샘플을 1:20희석하고 Neubauer 개선카운팅 챔버와 같은 계수 장치를 사용하여 세포를 계수한다. 다음으로, 세포 현탁액을 10 x 10 6 세포/mL의 최종 농도로 희석하고 가열된 알루미늄 블록을 사용하여 37°C에서 둥근 바닥 2 mL 폴리프로필렌 미세원원지 튜브에서 세포를 유지한다(1.1.1단계의 참고 참조).6
3. 화학 변증 슬라이드에 후막 세포를 파종
- 셀 서스펜션을 100 μL(또는 현탁액의 절반)으로 설정된 피펫 부피로 5배 상하로 파이펫을 피펫한 후, 세포 현탁액의 10 μL을 화학탁증 챔버의 포트 3내로 부드럽게 증착한다(도2C). 파이펫 팁을 포트 2에 넣고 셀 서스펜션을 연결 채널로 천천히그립니다(그림 2C). 셀 서스펜션이 도입되자마자 포트 1과 4의 플러그를 제거하여 셀 서스펜션의 흐름을 체포하는 데 도움이 됩니다. 4개의 충전 포트모두에 캡을 놓습니다.
- 모든 화학 요법 챔버에 대해 3.1 단계를 반복하십시오. 작은 거꾸로 된 현미경과 10 배 위상 대비 대물 렌즈를 사용하여 화학 택시 슬라이드에서 원치 않는 기포가 있는지 검사하십시오.
- 2-3 시간 동안 37 °C의 습도 챔버에 후막 세포로 씨를 뿌린 화학 변세균 슬라이드를 놓습니다.
4. 저수지 채우기 및 화학력 첨가
- 반전된 현미경을 사용하여 관측 영역(두 개의 40 μL 저장소를 연결하는 채널)을 검사합니다.
참고: 이 단계에서, 세포 밀도는 저수지를 채운 후보다 높을 것이고, 약한 부착 세포, 주로 CD19+ 세포 (B1 세포)가 충진 절차 동안 관찰 영역 밖으로 세척되기 때문이다(도 2C-E). - 충전 포트 1과 2에 플러그를 배치합니다(그림2D). 충전 포트 3이 중간 및 기포가없는 상단에 채워져 있는지 확인하십시오. 필요한 경우 멸균 27G 주사기 바늘을 사용하여 원치 않는 기포를 빼내소하십시오.
- 10-100 μL 부피 기계식 파이펫을 사용하여, 개질된 RPMI 1640 HEPES 배지의 흡인 ~60 μL을 사용하여 파이펫 팁을 충전 포트 3에 놓습니다. 파이펫의 체적 설정 링을 사용하여 매개체가 1-2분 후에 충전 포트 4의 상단에 도달하도록 저장소에 매체를 천천히 꾸준히 주입합니다(그림2D).
- 두 번째 저장소를 채웁니다. 포트 1에서 플러그를 이동하고 포트3(그림 2D)에천천히 삽입합니다. 다음으로, 개질된 RPMI 1640 HEPES 배지의 흡인 ~50 μL을 충전 포트 4에 피펫 팁을 놓는다. 10-100 μL 볼륨 파이펫의 체적 설정 링을 사용하여 매질이 1-2분 후에 충전 포트 1의 상단에 도달하도록 두 번째 저장소에 매질을 천천히 꾸준히 주입합니다(그림2D).
- 수정된 RPMI 1640 HEPES 배지 495 μL을 (둥근 바닥) 2 mL 미세원심지 튜브에 넣고 5 μL의 특허 블루 V(스톡 솔루션: 인산완충 식염수[PBS])에 5 μL을 첨가하고, 농도 구배 형성의 시각적 지표로 사용되는 청색 염료를 첨가한다. 간단한 소용돌이로 섞으세요. 재조합 마우스 보체 C5a (스톡 솔루션 : 0.1 % 소 혈청 알부민으로 PBS에서 50 μg / mL)를 추가하고 간단한 소용돌이로 혼합하십시오.
- 청색의 15 μL을 예금하고, C5a 함유 배지를 충전 포트1(그림 3A)에보완하고, 포트 상단의 얕은 우울증이 중간 자유인지 확인한 후(그렇지 않으면 드롭이 유출될 수 있음).
- 충전 포트 4에 10-200 μL 파이펫 팁을 삽입하고 10-100 μL 볼륨 파이펫의 볼륨 설정 링을 천천히 꾸준히 회전하여 파란색의 방울을 그리고 C5a 함유 매체를 반대 쪽 저장소로 보완합니다(그림3B). 공기는 포트 1을 채우는 짧은 수직 열에 들어가기 시작합니다. 유체-공기 인터페이스가 수직 기둥의 중간이 될 때까지 공기를 끌어인 다음 포트에 플러그를 천천히 삽입합니다.
- 다른 손으로 는 슬라이드가 제자리에 고정된 상태로 유지되도록 포트 4에서 파이펫을 부드럽게 들어 올립니다. 마지막으로 포트4(그림 3B)를천천히 연결합니다.
- 거꾸로 된 현미경에 화학 택시 슬라이드를 검사합니다.
참고: 관찰 영역에 있는 나머지 부착 세포는 우세하게 대식세포이어야 합니다. 이는 형광 태그가 있는 항 F4/80 항체를 사용하여 확인할 수 있습니다(F4/80은 마우스 대식세포에 대한 특정 마커임). B 세포는 형광 태그가 있는 항 CD19 항체 및 F4/80-/CD19-청색 형광 핵산 얼룩을 사용하여 세포를 검출할 수 있다(도4).--
5. 시간 경과에 의한 이미징 대식세포 이동, 위상 대비 현미경 검사법
- 무대 인큐베이터가 장착 된 반전 된 현미경의 무대에 화학 택시 슬라이드를 놓습니다. 온도를 37 °C로 유지합니다.
- 10x 위상 대비 대물렌즈를 사용하여 1mm x 2mm 관찰 영역을 이미지화하고 대식세포 라멜리포디아에 초점을 맞춥니다: 얇고 시트 같은 멤브레인 돌출부. 2분마다 1프레임의 속도로 14시간 동안 이미지를 캡처할 수 있습니다.
6. 타임랩스 이미지 분석
- ImageJ용 Fabrice P. Cordelières가 제작한 자동 이미지 분석 소프트웨어 또는 수동 추적 플러그인을 사용하여 시간 경과, 위상 대비 이미지를 분석합니다.
참고: 자동화된 추적 프로그램은 시간 경과, 위상 대비 또는 형광 현미경검사법으로 이미지된 세포를 분석하는 데 사용할 수 있습니다. 예를 들어, Cordelières 등27에서 생산된 Java 기반 소프트웨어 iTrack4U는 시간 경과, 위상 대비 또는 형광 이미지를 입력으로 사용하여 자동화된 셀 추적 및 분석에 사용할 수 있습니다. 수동 추적은 더 많은 시간이 소요되지만 ImageJ 플러그인 수동 추적에 의해 생성 된 트랙은 ImageJ 플러그인 화학 변사 및 마이그레이션 도구28,29에의해 직접 가져 와서 자동으로 분석 할 수 있습니다.
결과
화학구구이로 이동하는 마우스 복막 대식세포의 타임랩스 비디오 현미경 검사에 사용되는 화학탁증 슬라이드의 개략도는 도 2A에나타내고 있다. 슬라이드에는 3 개의 화학 변균 챔버가 있으며 각 챔버에는 4 개의 충전 포트가 있습니다. 슬라이드 위에 표시된 플러그를 사용하여 포트를 개별적으로 닫을 수 있습니다. 또는, 비밀봉 캡을 분리된 포트 위에 배치하여 멸균성을 유지할 수 있습니다. 포트 1과 4를 연결한 후 포트 2와 3 사이의 관측 영역(두 개의 저장소를 연결하는 1mm 폭 x 2mm 길이 x 70μm 높은 채널)은 포트 3에 15μL 드롭을 배치하고 포트 2에서 2-20μL 볼륨 파이펫을 접경하여 매체로 미리 채울 수있습니다(그림 2B). 마우스 상주 복막 세포(10 x 106 세포/mL)의 현탁액을 포트 3에 10 μL 의 현탁액 을 배치하고 포트 2에서 천천히 흡인하여 관찰 영역내로 시드하였다(도2C). 10x 대물렌즈를 이용하여 위상대비 현미경으로 촬영한 관찰 부위에 시드된 세포의 전형적인 이미지는 도 2C에도시되어 있다. 2-3 시간 동안 배양 한 후, 화학 탁증 슬라이드는 천천히 배지로 채워졌습니다(도 2D). 포트 1과 2를 연결한 후, 포디엄은 포트 3을 통해 서서히 주입되어 포트 4에서 나왔습니다. 다음으로, 플러그는 포트 1에서 포트 3으로 전환된 다음 두 번째 저장소는 포트 4를 통해 매질을 천천히 주입하여 포트 1에서 나타났습니다. 이 단계에서, 관찰 영역의 세포는 반전된 현미경을 사용하여 재검사하였다(도2E). (도2C)직전의 이미지를 비교함으로써(도2E)후 의 저장소를 채우고, 세포의 3분의 2까지 관찰 영역 밖으로 세척하였다. 일반적으로, 약하게 부착된CD19+ 세포(B1 세포)를 씻어내고 나머지 세포는 주로 F4/80+ 세포(대식세포)였다.+ 이것은 형광 표지된 특정 항체로 각 세포 모형을 표지한 후에 형광 현미경 검사법에 의해 입증되었습니다(그림 4). 도 4A에서,새로 단리된 마우스 상주 복막 세포를 녹색 형광형광-공액 항체 및 적색 형광 형광-공액 항체-CD19 항체로 표지하고, 세포의 핵을 청색 형광 핵산 염료로 표지하였다. F4/80은 마우스대식세포(30)에대한 특정 마커인 반면 CD19는 B 세포 마커이다. 도 4B는 화학탁증+ 챔버의 관찰 영역에서 디스크 공초점 현미경을 회전시킴으로써 이미지화된 F4/80+ 세포를 나타낸다. 세포는 시간 경과, 상 대비 현미경 검사법에 의해 기록된 하룻밤 화학요법 분석 후에 표지되었습니다.
보체 C5a(chemoattractant)는 포트 2 및 3을 연결한 후 C5a 및 10 μg/mL 특허 Blue V를 충전 포트1(그림 3A)에0.54 μg/mL(재조합 마우스)를 함유하는 배지의 15 μL 드롭을 배치함으로써 두 개의 저수지 중 하나에 도입되었다. 항만 4를 경유하여 피펫을 통해 느린 포부로 천천히 저수지로 유입된 화학적 배지. 도 3B는 15 μL 드롭을 저수지 내로 그린 후 청색 염료의 확산을 나타낸다. 특허 청색 V는 화학흡기 확산의 간접적인 시각적 지표로서 사용되었다. 보체 C5a 분자는 특허 블루 V (0.57 kDa 대 9.0 kDa)보다 상당히 크고 더 느리게 확산됩니다. 저수지에서 C5a를 보체로 확산한 후, 그 농도는 ~0.2 μg/mL(15 μL/40 μL [저수지 부피] x 0.54 μg/mL = ~22.5 nM에 해당함)이었다. 3시간 후 관찰 구역을 가로질러 완만한 가파른 그라데이션이 형성되었고 계속 증가하여 12시간31분경에 최대치에 도달했습니다. 도 3C는 화학유도제를 첨가한 후 6-12시간 사이에 보완C5a 구배에서 이동하는 대식세포의 이동 트랙을 나타낸다. 세포 속도 및 화학적 효율은, y-FMI(y-forward 마이그레이션 지수; 범위: -1 to +1) 및 x-FMI로 인덱싱되어, 개별 대식세포의 이동 플롯으로부터 계산되었다(그림3D). 그림 3D는 또한 각 마이그레이션 트랙의 시작점을 상자 플롯 아래의 X = 0 및 Y = 0으로 정규화한 후 생성된 마이그레이션 플롯을 보여 주는 것입니다. 마이그레이션 플롯의 인세트는 각 마이그레이션 트랙에 대해 y-FMI가 계산된 방법을 보여 주며, 이에 따라 y-FMI가 계산되었습니다.
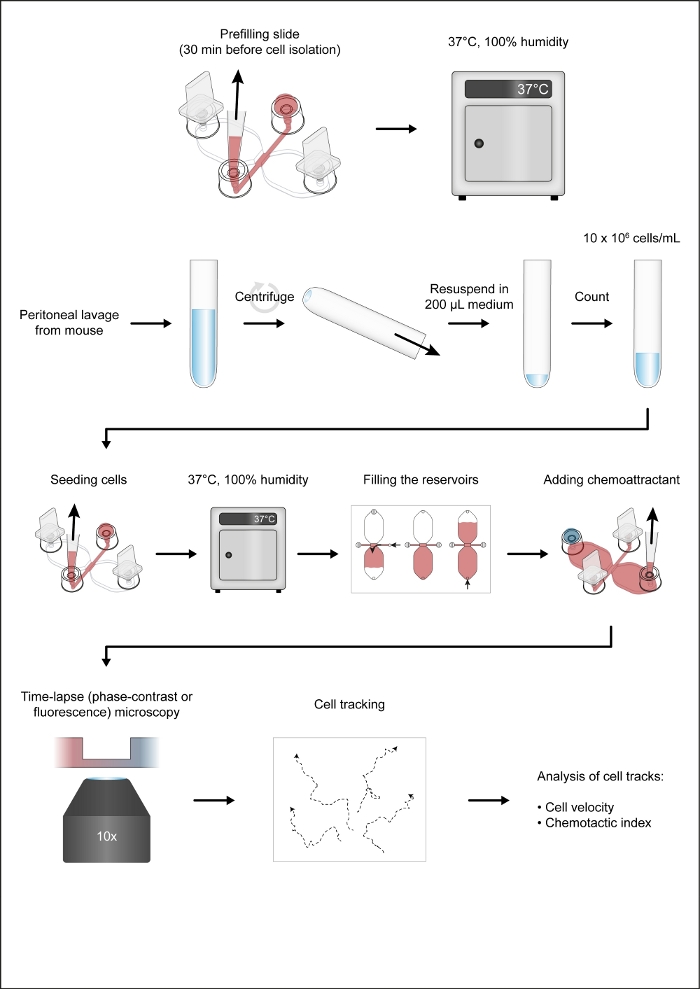
그림 1: 화학탁증 분석법의 워크플로우. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 화학 택시 슬라이드의 처리. (A)4개의 플러그와 4개의 캡이 있는 화학택시 슬라이드의 3D 뷰입니다. 슬라이드에는 3 개의 화학 택시 챔버가 포함되어 있으며, 각각은 1mm x 2mm 채널로 연결된 2 개의 40 μL 저장소로 구성되어 있으며, 이는 70 μm 높이이며 관찰 영역이라고 합니다. (B)연결 채널은 양쪽 끝에서 포트 2와 3을 채우는 것으로 확장됩니다. 충전 포트 1과 4에 플러그를 삽입한 후, 관측 영역은 중간 크기에서 포트 3에 한 방울을 적용하고 포트 2에서 10-200 μL 파이펫 팁으로 흡입하여 중간(빨간색)으로 미리 채워졌습니다. 이어서, 캡을 포트 2 및 3에 적용한 후 37°C에서 슬라이드를 인큐베이팅하고 세포 현탁액을 준비하였다. (C)화학적 구배가 형성된 관찰 영역은, 포트 3에서 마우스 상주 복막 세포의 10 μL 드롭을 적용하고 포트 2에서 천천히 흡인하여 대식세포로 시드하였다. 슬라이드를 37°C에서 2-3시간 동안 습도 챔버에서 배양하였다. 오른쪽에 도시된 위상 대비 이미지는, 10x 대물 렌즈를 통해 얻어진, 2시간 동안 37°C에서 파종 및 배양 후 복막D세포를 나타낸다. 20-100 μL 볼륨 파이펫의 볼륨 설정 링을 돌려 느리고 안정적인 충진을 달성할 수 있습니다. 첫 번째 저장소를 채운 후, 두 번째 저장소는 포트 2와 3을 연결하여 채워진 다음 포트 1에서 나타날 때까지 포트 4에서 천천히 매질을 주입할 수 있습니다. (e)두 개의 저장소를 채운 후 위에 표시된 동일한 관찰 영역의 위상 대비이미지(C). 배율 막대 = 500 μm. 엘리아스 혼이 제공하는 그래픽 요소. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 화학탁증 분석. (A)화학유고제는 0.54 μg/mL 보체 C5a 및 10 μg/mL 특허 Blue V를 포함하는 배지의 15 μL 드롭을 포트 1에 적용하고 포트 4에서 느린 포부를 적용하여 화학 탁증 챔버의 두 저장소 중 하나에 도입되었다. (B)처음에는 청색으로 유입된 후, 화학유역함유 배지는 대략 반탈하형을 가졌고, 이어서 서서히 저수지 전체에 확산되었다. (C)저수지 중 하나에 화학유채를 도입한 후 6~12시간 사이에 화학유채(+C5a) 구배에서 이동하는 대식세포의 이동 트랙. 그라데이션의 방향은 오른쪽에 표시됩니다. 각 마이그레이션 트랙의 끝은 채워진 원으로 표시됩니다. (D)속도, x-FMI(x-forward 마이그레이션 지수) 및 y-FMI(y-forward 마이그레이션 지수)의 블럭스 플롯은 -1에서 +1까지의 화학적 효율 지수입니다. 데이터는 25개의 대식세포 마이그레이션 트랙을 분석하여 얻었습니다. 관찰 영역의 하부에 있는 대식세포및 6시간 이상 적어도 하나의 세포 폭의 변위를 나타내는 대식세포는 분석을 위해 무작위로 선택되었다. 다음은 시작점을 X = 0 및 Y = 0으로 정규화한 후의 마이그레이션 트랙 플롯입니다. 화학전증 지수(y-FMI)는 Y축(d)을 따라 순 변위를 개략적으로 나타낸 바와 같이 이동 경로의 축적된 길이(l)로 나누어 계산하였다. 패널 A와 B의 그래픽 요소는 엘리아스 혼이 제공합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
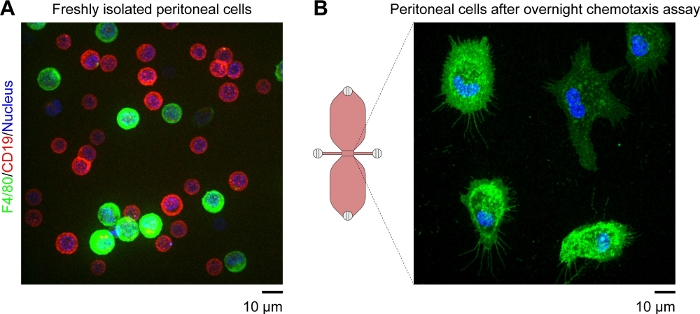
도 4: 디스크 공초점 현미경을 회전시킴으로써 수득된 살아있는 마우스 상주 복막 세포의 형광 이미지. (A)녹색 형광 방지 F4/80 (대식세포 마커) 항체, 적색 형광 항 CD19 (B 세포 마커) 항체 및 청색 형광 핵산 얼룩으로 표지된 갓 단리된 마우스 복막 세포의 확장 초점 이미지(모든 Z-평면의 가장 밝은 점 병합). 스케일 바 = 10 μm.(B)F4/80++ 세포(대식세포)의 스냅샷(single Z-plane)은 하룻밤 동안 화학탁증 분석 후 취해진 화학탁증 챔버의 관찰 영역이다. 세포는 녹색 형광 항체 F4/80 항체 및 청색 형광 핵산 얼룩으로 표지되었다. 보체 C5a 및 특허 블루 V 그라데이션은 세포 라벨링 절차에 의해 세척되었고, 이는 화학탁증 챔버의 회로도 도면에서 상부 저장소가 파란색이 아닌 이유를 설명합니다. 배율 막대 = 10 μm. 엘리아스 혼이 제공하는 그래픽 요소입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
Intravital 화상 진찰은 19 세기로 거슬러 올라가고 그들의 자연 환경에서 살아있는 면역 세포의 행동을 공부하는 수단을 제공합니다. 그러나, 오늘날의 고급 현미경 검사법 및 유전 기술로도 생체 내에서 특정 화학 물질에 대한 세포의 반응을 연구하기가 어렵습니다. 이 문제를 회피하기 위하여는, Boyden18는 1960년대에 Transwell 어셀을 개발했습니다, 그러나 이 종점 측정은 세포가 실제로 화학유역으로 이동하는 방법의 시각화를 제공하지 않았습니다, 화학 큐에 의하여 무작위로 이동을 자극하는 chemokinesis를 구별하는 것을 어렵게 하고, 화학 큐32에의하여 무작위 이동을 자극하고, 화학적 자극의 높은 농도를 향해33. 이러한 문제점은 교량이 있는 다양한 개방 챔버를 설계함으로써 해결되었으며, 전형적으로 1 mm 폭, 두 개의 저수지 사이에 위치하고 대물렌즈(21,,22,23)에23의해 접근가능하여 해결되었다. 거꾸로 커버 슬립을 적용, 부착 세포와 시드, 챔버를 닫고 화학 력은 반대 저수지에 다리를 가로 질러 확산 저수지 중 하나에 추가, 농도 구배를 생성. 여기에서 우리는 동일한 원리를 사용하여 그러나 4개의 충전 포트를 특징으로 하는 닫힌 챔버를 사용하여 화학선염 분석법을 기술합니다. 이 시스템과 시간 경과, 위상 대비 현미경 을 사용하여, 우리는 화학 적 보완 C5a 그라데이션31,,34,,35,,36에서이동 하는 마우스 상주 복막 대식 세포에 대한 분석법을 개발했다. 이 분석법은 녹아웃 마우스 모델과 결합되어 대식세포 형태, 운동성 및 화학요법31,,34,,,35,36,,37에서다양한 Rho GTPases 및 운동 단백질의 역할을 조사하는 데 중요한 역할을 입증했다. 우리는 또한 2D 표면 또는 3D 콜라겐 유형 I 매트릭스38에서이동하는 인간 말초 혈액 단핵구를 이미지화하기 위해 이 접근법을 사용하였다. 더욱이, 상기 분석은 조건부 불멸의 골수성 전구세포39,,40으로부터유래된 마우스 골수 유래 대식세포 또는 대식세포에 적합하다. 우리는 이전에 배양 골수 세포에 루어 어댑터와 폴리 테트라 플루오로 에틸렌 (PTFE) 가방을 사용하고 대식세포를 얻을34. PTFE 백의 장점은 세포를 쉽게 다시 중단하고 20-30 분 동안 얼음에 가방을 놓은 후 사용할 준비가 될 수 있다는 것입니다. 이러한 접근법은 원치 않는 기포가 이후에 플러시될 수 있다는 장점이 있으며(가변적 성공) 미리 흡수된 관측 영역은 파이펫팅에 의한 셀 현탁액의 느린 도입을 가능하게 한다. 그러나 프리필링은 매질이 측면 저장소 중 하나 또는 둘 다로 부분적으로 흐를 가능성을 증가시켜 관찰 영역을 넘어 세포의 시드를 촉진합니다. 또는, 셀 현탁액은 건조한 관측 영역으로 직접 파이펫을 할 수 있지만 원치 않는 기포는 이후에 추방될 수 없습니다.
마우스의 복막 구멍은 세포의 두 가지 주요 집단을 포함: F4/80+ 대식 세포 및 (작은) CD19+ B 세포, 약의 비율로 1:2(그림 4A). 이 2개의 세포 인구는 복강 세포의 95% 이상을 차지하는 반면, 나머지 F4/80-/CD19-세포는 일반적으로 CD11c+ 세포 (수지상 세포) 또는 CD3+ 세포 (T 세포)로 식별 될 수 있습니다. 약하게 부착된 B 세포는 배지로 저장소를 채우는 동안 관찰 영역 밖으로 세척된다(도2). 두 개의 저수지 중 하나에 화학 유저를 추가 한 후, 시간 경과, 위상 대비 현미경 검사법은 진화하는 화학 력 그라데이션에서 이동하는 나머지 세포 (대식세포)를 이미지화하는 데 사용할 수 있습니다. 한 저수지에서 다른 저수지로의 확산을 통해 관찰 영역에서 보완C5a 구배의 형성은 유사한 분자량을 가진 형광 염료를 사용하여 시뮬레이션할 수 있다. 재조합 마우스 보체 C5a(예측 분자량, 9.0 kDa)에 대한 좋은 대용품은 형광으로 표지된 덱젠(10 kDa)31이다. 공초점 현미경을 이용하여, 화학탁증 슬라이드의 두 개의 저장소를 연결하는 좁은 채널(observation area)에서형광 구배가 서로 다른 시점에서 고정 된 간격및 농도 프로파일로 측정될 수있다(24,,31). 우리는 정기적으로 비형광, 청색 염료 (특허 블루 V)를 화학 적 인 배지에 추가하여 확산 및 그라데이션 형성의 편리한 시각적 지표를 제공합니다. 15 μL의 청색, 화학유채 함유 배지를 저수지에 도입한 후 1시간 이내에, 저수지는 균일하게 파란색으로 나타나고, Fick의 확산 법칙에 따라, 그라데이션은 저수지를 연결하는 좁은 관측 구역을 가로질러 형성될것이다(그림 3B). 용질 (청색 염료 또는 화학 적)이 균일하게 분포되기 위해서는 며칠이 필요합니다.
형광 검사법은 형광 표지된 세포가 배경과 쉽게 구별될 수 있기 때문에 자동 세포 추적을 위한 이점을 제공하는 위상 대조 현미경 검사법을 대체할 수 있습니다. 또 다른 장점은 면역 세포의 특정 집단은 형광 항체로 표면 마커를 표지 한 후에 선택적으로 추적 될 수 있다는 것입니다. 우리는 인간 말초 혈액 CD14+ 세포 (단핵구)가 화학 전술 fMLP (N-formylmethionine-leucyl-phenylain) 그라데이션38에서이동하는 이미지인간 말초 혈액에 이 접근법을 사용했다. 유사하게, 형광 항 F4/80 항체는 화학적 보체 C5a 구배를 보완하는 마우스 대식세포를 이미지화하는데 사용될 수 있었다. 광독성은 형광이미징(41)을사용하는 잠재적 단점이다. 이는 더 긴 파장으로 흥분된 형광단을 사용하고 배지에 항산화제를 추가하는 것을 포함하여 다양한 수단42에의해 감소될 수 있다. 대안적으로, 표지된 세포는 처음에 형광 현미경 검사법에 의해 확인되고 시간 경과, 위상 대조 현미경 검사법에 의해 그 후에 심상될 수 있었습니다. 그러나 실제로, 세포는 ~ 1 μm / min (대식세포) 또는 ~ 4 μm / min (단핵구)과 같은 적당히 낮은 속도로 이동하는 세포는 분 간격으로 형광 현미경 검사법에 의해 간헐적으로 이미지 화 될 수 있으며, 이는38을잘 견딜 수 있습니다. 우리는 이전에 형광 현미경 검사법을 사용하고 3D 화학변성 검사법38,,43에대해 여기에 기술된 화학탁증 슬라이드를 사용했습니다. 이 때, 두 저수지 모두 배지 및 15 μL 화학유량 함유 배지로 미리 채워졌으며, 형광표지세포를 서서히 배관하기 직전에 저수지 중 하나에 끌어당기고 콜라겐 타입 I을 함유하는 배지에 매질하였다. 이 절차의 어려운 부분은 산성 용액에 농축된 콜라겐 유형 I의 취급입니다. 콜라겐 용액의 pH는 알칼리성 용액을 첨가하여 중화되어야 하며, 얼음-차가운 콜라겐 용액을 세포 현탁액과 혼합한다. 37°C에서 인큐베이터로 콜라겐 세포 혼합물을 전달하면 콜라겐 중합을 개시할 것이다. 배양 하는 동안, 슬라이드 는 천천히 그것의 긴 축 주위 회전 해야 세포는 X-, Y-및 Z 축 방향으로 균등 하 게 분포 유지 콜라겐 젤으로 중합 하는 동안. 3D 화학요법 에 적합한 관련 폐쇄된 화학전염 슬라이드는, 4개의 플러그 대신에 6개의 플러그를 가진, 최근에29를기술되었습니다. 이 시스템은 각 저수지에 단일 포트가 아닌 두 개의 충전 포트가 있기 때문에 각 측면 저장소를 독립적으로 채우기 전에 콜라겐 세포 혼합물을 관찰 영역으로 도입 할 수 있습니다.
요약하면, 우리는 6 시간 이상의 기간 동안 화학 전술 구배에서 탐색하는 세포의 시각화를 허용하는 실시간 화학 변사 분석법을 설명합니다. 여기서 우리는 염증성 질환에서 중요한 역할을 하지만 호중구 및 Dictyostelium 아메바와 같은 더 빠른 이동 세포에 비해 실시간 화학탁증 분석법에서 과소 대표된 대식세포에 초점을 맞추고 있다.
공개
저자는 공개 할 것이 없다.
감사의 말
이 작품은 DFG (도이치 포르충스게마인샤프트)의 보조금(HA 3271/3-2)에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| µ-Slide (anodized aluminium) rack | Ibidi, Martinsried, Germany | 80003 | Autoclavable stackable rack for channel slides |
| µ-Slide Chemotaxis 2D (chemotaxis slide) | Ibidi, Martinsried, Germany | 80306 | Slide containing chemotaxis chambers (tissue culture treated) |
| 100x penicillin/streptomycin | Thermo Fisher Scientific | 15140122 | Used as supplement for RPMI 1640 media |
| 10-100 µL pipette with volume control ring | Eppendorf | 3123000047 | Eppendorf Research plus pipette |
| 10-200 µL pipette tips | Greiner Bio-One International | 739261 | Pipette tips with beveled tips (96 pieces per rack: sterile) |
| 14 mL polypropylene round bottom tubes | BD Falcon | 352059 | Used to collect peritoneal cells |
| 14-bit Hamamatsu C9100-50 Electron Multiplying-Charged Couple Device (EM-CCD) peltier-cooled camera | Hamamatsu Photonics Inc., Japan | EM-CCD camera of the spinning disk confocal microscope system | |
| 2-20 µL pipette with volume control ring | Eppendorf | 3123000039 | Eppendorf Research plus pipette |
| 24 G plastic catheter | B Braun Mesungen AG, Germany | 4254503-01 | Used for peritoneal lavage |
| 405 nm solid state laser, 50 mW | Perkin Elmer, Rodgau, Germany | Laser (405 nm) source of spinning disk confocal microscope system | |
| 488 nm solid state laser, 50 mW | Perkin Elmer, Rodgau, Germany | Laser (488 nm) source of spinning disk confocal microscope system | |
| 561 nm solid state laser, 50 mW | Perkin Elmer, Rodgau, Germany | Laser (561 nm) source of spinning disk confocal microscope system | |
| Alexa Fluor 488-conjugated rat (IgG2a) monoclonal (clone BM8) anti-mouse F4/80 antibody | Thermo Fisher Scientific | MF48020 | Mouse macrophage marker and plasma membrane label |
| Alexa Fluor 594-conjugated rat (IgG2a) monoclonal (clone 6D5) anti-mouse CD19 antibody | BioLegend | 115552 | Mouse B cell marker |
| C-Chip disposable (improved Neubauer) hemocytometer | NanoEnTek (distributed by VWR International) | 631-1098 | Used to count cells |
| CSU-X1 spinning disk scanner | Yokogawa Electric Corporation, Japan | Nipkow spinning disk unit | |
| Hank’s buffered salt solution without Ca2+ and Mg2+ | Thermo Fisher Scientific | 14170120 | Used for peritoneal lavage |
| Heat-inactivated fetal bovine serum | Thermo Fisher Scientific | 10082139 | Used as supplement for RPMI 1640 media |
| Hoechst 34580 | Thermo Fisher Scientific | H21486 | Cell permeable, blue fluorescent nucleic acid stain |
| ImageJ (image processing and analysis in Java) | National Institutes of Health (NIH) | Image analysis software | |
| Lipopolysaccharides from Escherichia coliO111:B4 | Sigma-Aldrich | L4391-1MG | Toll-like receptor 4 ligand |
| Nikon Eclipse Ti inverse microscope | Nikon, Japan | Inverted microscope | |
| Patent Blue V, sodium salt | Sigma-Aldrich | 21605-10G | Blue-colored dye used as visual indicator of gradient formation |
| Recombinant mouse complement C5a protein | R&D Systems | 2150-C5-025 | Chemoattractant for mouse macrophages |
| RPMI 1640 medium containing 20 mM Hepes | Sigma-Aldrich | R7388 | Basis medium for assays |
| UltraVIEW Vox 3D live cell imaging system + Volocity software | Perkin Elmer, Rodgau, Germany | Spinning disk confocal microscope system | |
| Zeiss LSM 510 + Axiovision software | Carl Zeiss Microscopy, Oberkochen, Germany | Confocal laser scanning microscope (LSM) adapted for phase-contrast microscopy |
참고문헌
- Lammermann, T., Germain, R. N. The multiple faces of leukocyte interstitial migration. Seminars in Immunopathology. 36, 227-251 (2014).
- Lammermann, T., Sixt, M. Mechanical modes of 'amoeboid' cell migration. Current Opinion in Cell Biology. 21, 636-644 (2009).
- Woodham, E. F., Machesky, L. M. Polarised cell migration: intrinsic and extrinsic drivers. Current Opinion in Cell Biology. 30, 25-32 (2014).
- Devreotes, P. N., et al. Excitable Signal Transduction Networks in Directed Cell Migration. Annual Review of Cell and Developmental Biology. 33, 103-125 (2017).
- Kamp, M. E., Liu, Y., Kortholt, A. Function and Regulation of Heterotrimeric G Proteins during Chemotaxis. International Journal of Molecular Sciences. 17 (1), 90 (2016).
- Miao, Y., et al. Wave patterns organize cellular protrusions and control cortical dynamics. Molecular Systems Biology. 15, 8585 (2019).
- Ridley, A. J., et al. Cell migration: integrating signals from front to back. Science. 302, 1704-1709 (2003).
- Lammermann, T., et al. Rapid leukocyte migration by integrin-independent flowing and squeezing. Nature. 453, 51-55 (2008).
- Mullins, R. D., Heuser, J. A., Pollard, T. D. The interaction of Arp2/3 complex with actin: nucleation, high affinity pointed end capping, and formation of branching networks of filaments. Proceedings of the National Academy of Sciences of the United States of America. 95, 6181-6186 (1998).
- Leithner, A., et al. Diversified actin protrusions promote environmental exploration but are dispensable for locomotion of leukocytes. Nature Cell Biology. 18, 1253-1259 (2016).
- McDonald, B., et al. Intravascular danger signals guide neutrophils to sites of sterile inflammation. Science. 330, 362-366 (2010).
- Leber, T. Ueber die Entstehung der Entzündung und die Wirkung der entzündungserregenden Schädlichkeiten. Fortschritte der Medizin. 6, 460-464 (1888).
- Tauber, A. I. Metchnikoff and the phagocytosis theory. Nature Reviews Molecular Cell Biology. 4, 897-901 (2003).
- Clark, E. R., Linton Clark, E. Reactions of cells in the tail of amphibian larvae to injected croton oil (aseptic inflammation). American Journal of Anatomy. 27, 221-254 (1920).
- Clark, E. R., Linton Clark, E. The reaction of living cells in the tadpole's tail toward starch, agar-agar, gelatin, and gum arabic. The Anatomical Record. 24, (1922).
- Comandon, J. Phagocytose in vitro des Hématozoaires du Calfat (enregistrement cinématographique). Comptes Rendus Hebdomadaires des Séances et Mémoires de la Société de Biologie. 69, 314-316 (1917).
- McCutcheon, M. Chemotaxis in leukocytes. Physiological Reviews. 26, 319-336 (1946).
- Boyden, S. The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes. The Journal of Experimental Medicine. 115, 453-466 (1962).
- Horwitz, D. A., Garrett, M. A. Use of leukocyte chemotaxis in vitro to assay mediators generated by immune reactions. I. Quantitation of mononuclear and polymorphonuclear leukocyte chemotaxis with polycarbonate (nuclepore) filters. Journal of Immunology. 106, 649-655 (1971).
- Bignold, L. P. A novel polycarbonate (Nuclepore) membrane demonstrates chemotaxis, unaffected by chemokinesis, of polymorphonuclear leukocytes in the Boyden chamber. Journal of Immunological Methods. 105, 275-280 (1987).
- Zigmond, S. H. Ability of polymorphonuclear leukocytes to orient in gradients of chemotactic factors. The Journal of Cell Biology. 75, 606-616 (1977).
- Zicha, D., Dunn, G. A., Brown, A. F. A new direct-viewing chemotaxis chamber. Journal of Cell Science. 99, 769-775 (1991).
- Muinonen-Martin, A. J., Veltman, D. M., Kalna, G., Insall, R. H. An improved chamber for direct visualisation of chemotaxis. PLoS One. 5, 15309 (2010).
- Zengel, P., et al. mu-Slide Chemotaxis: a new chamber for long-term chemotaxis studies. BMC Cell Biology. 12, 21 (2011).
- Valentim, A. M., Guedes, S. R., Pereira, A. M., Antunes, L. M. Euthanasia using gaseous agents in laboratory rodents. Lab Animal. 50, 241-253 (2016).
- Franks, N. P. General anaesthesia: from molecular targets to neuronal pathways of sleep and arousal. Nature Reviews. Neuroscience. 9, 370-386 (2008).
- Cordelieres, F. P., et al. Automated cell tracking and analysis in phase-contrast videos (iTrack4U): development of Java software based on combined mean-shift processes. PLoS One. 8, 81266 (2013).
- Zantl, R., Horn, E. Chemotaxis of slow migrating mammalian cells analysed by video microscopy. Methods in Molecular Biology. 769, 191-203 (2011).
- Biswenger, V., et al. Characterization of EGF-guided MDA-MB-231 cell chemotaxis in vitro using a physiological and highly sensitive assay system. PLoS One. 13, 0203040 (2018).
- Austyn, J. M., Gordon, S. F4/80, a monoclonal antibody directed specifically against the mouse macrophage. European Journal of Immunology. 11, 805-815 (1981).
- Hanley, P. J., et al. Motorized RhoGAP myosin IXb (Myo9b) controls cell shape and motility. Proceedings of the National Academy of Sciences of the United States of America. 107, 12145-12150 (2010).
- Wilkinson, P. C. Cell Locomotion and Chemotaxis: Basic Concepts and Methodological Approaches. Methods. 10, 74-81 (1996).
- Pfeffer, W. Locomotorische Richtungsbewegungen durch chemische Reize. Untersuchungen aus dem Botanischen Institut zu Tübingen. 1, 363 (1884).
- Konigs, V., et al. Mouse macrophages completely lacking Rho subfamily GTPases (RhoA, RhoB, and RhoC) have severe lamellipodial retraction defects, but robust chemotactic navigation and altered motility. The Journal of Biological Chemistry. 289, 30772-30784 (2014).
- Horsthemke, M., et al. Multiple roles of filopodial dynamics in particle capture and phagocytosis and phenotypes of Cdc42 and Myo10 deletion. The Journal of Biological Chemistry. 292, 7258-7273 (2017).
- Bachg, A. C., et al. Phenotypic analysis of Myo10 knockout (Myo10(tm2/tm2)) mice lacking full-length (motorized) but not brain-specific headless myosin X. Scientific Reports. 9, 597 (2019).
- Horsthemke, M., et al. A novel isoform of myosin 18A (Myo18Agamma) is an essential sarcomeric protein in mouse heart. The Journal of Biological Chemistry. 294, 7202-7218 (2019).
- Bzymek, R., et al. Real-time two- and three-dimensional imaging of monocyte motility and navigation on planar surfaces and in collagen matrices: roles of Rho. Scientific Reports. 6, 25016 (2016).
- Wang, G. G., et al. Quantitative production of macrophages or neutrophils ex vivo using conditional Hoxb8. Nature Methods. 3, 287-293 (2006).
- Gran, S., et al. Imaging, myeloid precursor immortalization, and genome editing for defining mechanisms of leukocyte recruitment in vivo. Theranostics. 8, 2407-2423 (2018).
- Magidson, V., Khodjakov, A. Circumventing photodamage in live-cell microscopy. Methods in Cell Biology. 114, 545-560 (2013).
- Icha, J., Weber, M., Waters, J. C., Norden, C. Phototoxicity in live fluorescence microscopy, and how to avoid it. BioEssays : News and Reviews in Molecular, Cellular and Developmental Biology. 39 (8), 1700003 (2017).
- Isfort, K., et al. Real-time imaging reveals that P2Y2 and P2Y12 receptor agonists are not chemoattractants and macrophage chemotaxis to complement C5a is phosphatidylinositol 3-kinase (PI3K)- and p38 mitogen-activated protein kinase (MAPK)-independent. The Journal of Biological Chemistry. 286, 44776-44787 (2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유