Method Article
Imagem em lapso de tempo de Quimioterapia de Macrophage mouse
Neste Artigo
Resumo
Aqui descrevemos métodos usando microscopia de tempo-lapso, contraste de fase para macrófagos peritoneal residentes em camundongos em um gradiente c5a complementar quimático. Os protocolos podem ser estendidos a outras células imunes.
Resumo
Quimiotáxi é uma orientação mediada por receptores de células ao longo de um gradiente químico, enquanto a quimiocinese é a estimulação da motilidade celular aleatória por um produto químico. Quimiocinese e quimiotáxi são fundamentais para a mobilização e implantação de células imunes. Por exemplo, quimiocinas (citocinas quimiotáticas) podem rapidamente recrutar neutrófilos e monócitos circulantes para locais extravasculares de inflamação. Os receptores quimio-atratores pertencem à grande família de receptores acoplados à proteína G. Como os gradientes quimioatrativos (ou seja, ligantes) migração direta de células através da sinalização receptora acoplada à proteína G ainda não é totalmente compreendida. No campo da imunologia, os neutrófilos são células modelo populares para estudar quimiotáxi in vitro. Aqui descrevemos um ensaio de quimiotaxis bidimensionais em tempo real (2D) adaptado para macrófagos residentes em camundongos, que tradicionalmente têm sido mais difíceis de estudar. Os macrófagos movem-se a um ritmo lento de ~1 μm/min em uma superfície 2D e são menos adequados para ensaios de migração de fonte de ponto (por exemplo, migração para a ponta de uma micropipeta cheia de quimioa) do que neutrófilos ou Dictyostelium discoideum,que movem uma ordem de magnitude mais rapidamente. Ensaios transwell amplamente utilizados são úteis para estudar a atividade quimiotática de diferentes substâncias, mas não fornecem informações sobre morfologia celular, velocidade ou navegação quimiotática. Aqui descrevemos um ensaio de quimiosquim baseado em microscopia baseada em microscopia de lapso de tempo que permite quantificação da velocidade celular e eficiência quimiotática e fornece uma plataforma para delinear os transdutores, caminhos de sinal e efeitos de quimiotáxis.
Introdução
As células imunes normalmente migram singly em uma superfície 2D de forma ameboida1,2, que envolve ciclos repetidos de saliência da frente, adesão celular mediada por integrino e retração da parte traseira. Um passo pré-requisito é a polarização celular, na qual as células formam extremidades dianteiras e traseiras3. A quimiotaxis começa com a detecção de quimioatraçãopor receptores acoplados à proteína G e uma rede de sinalização complexa mediada por proteínas G heterocutéricas ancoradas por membranae pequenas proteínas G monóricas, bem como fatores de troca de nucleotídeos de guanina ligados à fosfolipípóide (GEFs)4,5. Ativação de Rho GTPases das subfamílias Cdc42 e Rac induzem saliências na frente6 e membros da subfamília Rho, especialmente RhoA, ativam a contração da traseira5,7. Em um ambiente tridimensional (3D), os integrinos são em grande parte redundantes para a migração de leucócitos e a RhoA torna-se mais importante para espremer células através de passagens estreitas8, enquanto a ativação arp2/3 induzida por Cingimento ou Rac permanece importante para a direção quimiotática9,10.
As células imunes podem enfrentar diferentes quimioatrativos, especialmente nos cenários de lesões teciduais, invasão de patógenos e inflamação. Os quimioatrativos endógenos expressos em farócitos complementam C3a e C5a, são rapidamente gerados pela ativação da cascata complementar, e são reconhecidos pelos receptores Complementar C3a e C5a. Da mesma forma, as células necróticas recrutam fagócitos através de receptores de peptídeos formyl, que reconhecem mitocôndrias derivadas, bem como peptídeos formirl derivados de bactérias11. As células imunes também expressam receptores acoplados à proteína G para quimiocinas, uma grande família de peptídeos quimioatrativos envolvidos na regulação do tráfico de células imunes durante a homeostase e inflamação. As quimiocinas são classificadas em quatro grupos, dependendo do espaçamento dos dois primeiros resíduos de cisteína (C): C, CC, CXC e CX3C citocinas, onde X é um aminoácido. Assim, as células imunes in vivo precisam responder adequadamente a sinais espaciais e temporais altamente complexos, tornando o estudo da quimiotaxis uma tarefa assustadora. Abaixo, fornecemos um breve histórico de quimiotáxis, que começou com abordagens de imagem intravital.
O estudo da quimiocida quimiotaxis data de 188812, quando o oftalmologista Theodor Karl Gustav Leber descreveu claramente a migração dirigida de leucócitos para, e o acúmulo em, locais de inflamação em um modelo de ceratite micótica (fúngica). Leber ressaltou que a atração de leucócitos em excesso por substâncias derivadas de patógenos é importante para a eliminação de microrganismos nocivos via fagocitose, que havia sido descrita por Metchnikoff (também conhecido como Metschnikoff) no início da mesma década13. Experimentos in vivo também foram realizados na década de 1920 por Clark e Clark14,15, que se aproveitaram da transparência dos girinos e mostraram que a inflamação estéril induzida pelo óleo de croton14 ou outros irritantes15 fez com que os leucócitos aderissem aos vasos sanguíneos, seguidos de diapedese (migração transendothelial) e migração rápida através dos espaços teciduais em direção ao irritante. Experimentos in vitro utilizando o método de microcinematografia desenvolvido por Jean Comandon16 mostraram que os leucócitos migraram para uma fonte quimiosódica particulada, como a bactéria17. Naquela época, as identidades moleculares dos fatores quimiotáticos eram desconhecidas. Na década de 1960, Stephen Boyden18 reconheceu que faltavam técnicas para estudar a atividade quimiotática de substâncias solúveis. Ele criou uma câmara, posteriormente conhecida como câmara de Boyden, com dois compartimentos separados por uma membrana de papel filtro. Uma suspensão celular é adicionada ao compartimento superior e a substância de ensaio é adicionada aos dois compartimentos ou apenas ao compartimento inferior. Após um período de incubação, a membrana do filtro é removida, e as células são fixas e manchadas. Comparando quantas células migram através da membrana do filtro em direção ao poço inferior com a substância de ensaio em ambos os compartimentos, em nenhum dos compartimentos, ou apenas no compartimento inferior, a atividade quimiotática pode ser determinada. Os ensaios transwell ainda são populares hoje em dia e foram modificados de várias formas, incluindo o uso de diferentes membranas de policarbonato com tamanhos e densidades poros definidos19,20. Uma grande desvantagem dos ensaios da Transwell é que é impraticável visualizar diretamente as células migrando e o caminho de migração através da membrana normalmente não excede o diâmetro de uma célula imune.
Sally H. Zigmond desenvolveu uma câmara de quimiotáxi21 que permitiu a visualização tanto da formação gradiente quanto da morfologia celular usando corantes fluorescentes. A câmara consiste em um deslizamento de plexiglass (acrílico) com dois poços lineares paralelos, cada um com um volume de ~100 μL, separadopor uma ponte de 1 mm de largura 3-10 μm abaixo do plano superior do slide. Um deslizamento de cobertura semeado com células é invertido e colocado sobre o escorregador de tal forma que abrange os dois poços. Após a adição de um quimioatrativo a um dos poços, um gradiente quimioatrativo íngreme se forma através da ponte, tipicamente dentro de 30-90 min. Leucócitos polimorfonuclears humanos (granulocitos) na câmara de Zigmond são observados orientando-se para o chemoattractant. Variações da câmara de Zigmond foram relatadas, incluindo as 23 câmaras Dunn22 e Insall23, ambas usando um deslizamento de cobertura semeado com células colocadas em dois poços separados por uma ponte de 1 mm de largura. A câmara de Dunn consiste em poços concêntricos separados por uma ponte circular, enquanto a câmara Insall está mais intimamente relacionada com a câmara de Zigmond, mas fornece pontes de duas larguras diferentes, 0,5 mm e 1 mm. Uma nova câmara de quimiotáxi, denominada μ-Slide Chemotaxis e fabricada por moldagem por injeção plástica, foi descrita por Zemgel et al.24. A câmara de quimiotáxi consiste em dois reservatórios de 40 μL separados por um canal de 1 mm de largura com comprimento de 2 mm e altura de 70 μm. A parte inferior da câmara é formada por uma folha de plástico permeável a gás com a mesma espessura e propriedades ópticas de um deslizamento de cobertura de vidro nº 1.524. Aqui descrevemos um ensaio de quimiotáxi usando a câmara μ-Slide Chemotaxis para visualizar a migração de macrófagos peritoneal residentes em camundongos por até 14 h em um gradiente quimiotático (complemento C5a).
Protocolo
Os protocolos seguem as diretrizes do nosso comitê local de ética em pesquisa, bem como as diretrizes de cuidados com os animais.
NOTA: A Figura 1 mostra um fluxo de trabalho do ensaio quimiotaxis.
1. Pré-enchimento de lâminas de quimiotáxi
-
Pré-enchimento dos canais de conexão de 1 mm de largura e 2 mm de comprimento de um ou dois slides de quimiotáxi usando o meio RPMI 1640 HEPES modificado, consistindo de meio RPMI 1640 livre de bicarbonato contendo 20 mM 4-(2-hidroxiyethyl)-1-piperazinesulfo Ácido nico (HEPES), soro bovino fetal inativado por calor (FBS) e antibióticos como penicilina (100 U/mL) e estreptomicina (100 μg/mL), preparados pela diluição de 100x penicilina/estreptomicina, e 1 μg/mL lipopolissacarídeo (de E. coli), e um receptor toll-like 4 ligand usado para ativar as células.
- Coloque um slide de quimiotaxis(Figura 2A)em um prato de cultura celular redondo (10 cm de diâmetro), ambos pré-aquecidos a 37 °C, e coloque o prato em um bloco de alumínio aquecido (37 °C). Insira os plugues nas portas 1 e 4 (Figura 2B).
NOTA: Um bloco de alumínio mantido a 37 °C e colocado dentro da capa de fluxo laminar é útil para a preparação de câmaras de quimiotáxi. Idealmente, o bloco aquecido deve fornecer uma área de trabalho plana e poços para vários tubos, como tubos de 50 mL e tubos de microcentrífuge de 2 mL. - Utilizando uma ponta de pipeta de 10-200 μL com uma ponta chanfrada chanfrada, deposite 15 μL de meio SI 1640 HEPES modificado na porta de enchimento 3(Figura 2B). Em seguida, com o volume ainda definido em 15 μL e o botão de controle da pipeta (volume de 2-20 μL) pressionado, insira a ponta da pipeta na porta 2 e aspire 15 μL a uma taxa moderadamente rápida(Figura 2B). Isso irá pré-preencher o canal de conexão de 1 mm x 2 mm (área de observação), bem como os dois canais de abastecimento de flanqueamento (entre a área de observação central e as portas 2 e 3, respectivamente). Cubra as portas de enchimento 2 e 3 com tampas.
- Após o pré-enchimento, coloque os deslizamentos de quimiotáxi em um rack mantido em uma câmara de umidade fechada dentro de uma incubadora seca e co2-freea 37 °C.
NOTA: É importante usar a ponta da pipeta correta para encher o slide de quimiotáxi. Uma ponta de pipeta chanta chanfrada na parte superior da porta de enchimento, enquanto as pontas de pipeta pontiagudas comumente usadas podem ser inseridas mais profundamente na porta de enchimento e podem aumentar muito a resistência ao fluxo de fluidos.
- Coloque um slide de quimiotaxis(Figura 2A)em um prato de cultura celular redondo (10 cm de diâmetro), ambos pré-aquecidos a 37 °C, e coloque o prato em um bloco de alumínio aquecido (37 °C). Insira os plugues nas portas 1 e 4 (Figura 2B).
2. Isolamento dos macrófagos peritoneais residentes em camundongos
- Sacrifique um rato de 3 a 4 meses de idade usando uma alta concentração do isoflurano anestésico volátil (>5% no ar) ou dióxido de carbono25, seguido de luxação cervical. A perda do reflexo de correção nos roedores se correlaciona com a perda de consciência em humanos26. Limpe o abdômen do rato com 80% de etanol na água e, em seguida, faça uma incisão de pele média de 1-2 cm usando uma tesoura cirúrgica com pontas cegas. Descasque a pele para expor a parede abdominal subjacente.
- Insira um cateter de plástico de 24 G na cavidade peritoneal. Usando uma seringa de plástico de 5 mL, lava a cavidade usando 2 x 4,5 mL de solução de sal tampão de Hank (HBSS), sem Ca2+ e Mg2+. Deixe cerca de 0,5 mL de HBSS residual na seringa para que o tecido inadvertidamente sugado para a ponta do cateter possa ser expelido.
- Transfira o meio lavado, tipicamente de 8-8,5 mL no total, para um tubo inferior redondo de polipropileno de 14 mL. Centrifugar o tubo a 300 x g por 6,5 min em temperatura ambiente.
NOTA: O tubo inferior redondo permite que o sobrenadante seja totalmente decantado e reduz o abramento celular. - Descarte o sobrenadante e resuspenda as células peritoneal (tipicamente ~4 x 106 células por rato) em 200 μL de meio RPMI 1640 HEPES modificado. Diluir uma amostra da suspensão celular 1:20 e usar um dispositivo de contagem, como uma câmara de contagem melhorada de Neubauer, para contar as células. Em seguida, diluir a suspensão celular para uma concentração final de 10 x 106 células/mL e manter as células em um tubo de micropropilerifuge de polipropileno de 2 mL a 37 °C usando um bloco de alumínio aquecido (ver NOTA na etapa 1.1.1).
3. Semeadeing de células peritoneais em slides de quimiotáxi
- Depois de pipetar a suspensão celular para cima e para baixo 5x com o volume da pipeta definido em 100 μL (ou a metade do volume de suspensão) para reduzir o abramento, deposite suavemente 10 μL da suspensão celular na porta 3 de uma câmara de quimiotáxi(Figura 2C). Coloque a ponta da pipeta na porta 2 e lentamente desenhe a suspensão celular no canal de conexão(Figura 2C). Assim que a suspensão celular for introduzida, remova os plugues nas portas 1 e 4, o que ajudará a prender o fluxo da suspensão celular. Coloque tampas em todas as quatro portas de enchimento.
- Repita o passo 3.1 para todas as câmaras de quimiotáxi. Usando um microscópio invertido pequeno e uma lente objetiva de contraste de fase de 10x, inspecione os slides de quimiotáxi para bolhas de ar indesejadas.
- Coloque os slides de quimiotáxi semeados com células peritoneais em uma câmara de umidade a 37 °C por 2-3 h.
4. Enchendo os reservatórios e adicionando quimioatrator
- Inspecione a área de observação (canal que conecta os dois reservatórios de 40 μL) usando um microscópio invertido.
NOTA: Nesta fase, a densidade celular será maior do que após o preenchimento dos reservatórios, pois as células fracamente aderentes, predominantemente CD19+ células (células B1), serão lavadas da área de observação durante o procedimento de enchimento (Figura 2C-E). - Coloque os plugues nas portas de enchimento 1 e 2 (Figura 2D). Certifique-se de que a porta de enchimento 3 está cheia até o topo com bolhas de ar médias e livres. Use uma agulha de seringa estéril de 27 G para desalojar bolhas de ar indesejadas, se necessário.
- Utilizando uma pipeta mecânica de volume de 10-100 μL, aspirar ~60 μL de meio HEPES RPMI 1640 modificado e colocar a ponta da pipeta na porta de enchimento 3. Use o anel de ajuste de volume da pipeta para injetar lentamente e de forma constante no reservatório de forma que o meio atinja o topo da porta de enchimento 4 após 1-2 min(Figura 2D).
- Encha o segundo reservatório. Mova o plugue da porta 1 e insira-o lentamente na porta 3 (Figura 2D). Em seguida, aspirar ~50 μL de meio HEPES RPMI 1640 modificado e colocar a ponta da pipeta na porta de enchimento 4. Use o anel de ajuste de volume da pipeta de volume de 10-100 μL para injetar deforma lenta e constantemente o meio no segundo reservatório, de forma que o meio atinja o topo da porta de enchimento 1 após 1-2 min(Figura 2D).
- Coloque 495 μL de meio RPMI 1640 HEPES modificado em um tubo de microcentrífuga de 2 mL (fundo redondo) de 2 mL e adicione 5 μL de Patente Azul V (solução de estoque: 10 mg/mL em soro tampão de fosfato [PBS]), um corantes azuis usados como indicador visual da formação gradiente de concentração. Misture por um breve vórtice. Adicione 5,4 μL de mouse recombinante complemente C5a (solução de estoque: 50 μg/mL em PBS com albumina de soro bovino de 0,1%) e misture por um breve vórtice.
- Deposite 15 μL de azul, complemente o meio contendo C5a na porta de enchimento 1 (Figura 3A),depois de certificar-se de que a depressão rasa na parte superior da porta é livre média (caso contrário, a gota pode transbordar).
- Insira uma ponta de pipeta de 10-200 μL na porta de enchimento 4 e gire lentamente e continuamente o anel de ajuste de volume da pipeta de volume de 10-100 μL para desenhar a gota de azul, complemente o meio contendo C5a no reservatório oposto(Figura 3B). O ar começará a entrar na pequena coluna vertical da porta de enchimento 1. Desenhe ar até que a interface fluido-ar esteja no meio do caminho na coluna vertical e, em seguida, insira lentamente um plugue na porta.
- Levante suavemente a pipeta da porta 4, usando a outra mão para garantir que o slide permaneça fixo no lugar. Finalmente, conecte lentamente a porta 4 (Figura 3B).
- Inspecione o deslizamento de quimiotáxi em um microscópio invertido.
NOTA: As células aderentes remanescentes na área de observação devem ser predominantemente macrófagos. Isso pode ser confirmado usando anticorpos anti-F4/80 com marcas fluorescentes (F4/80 é um marcador específico para macrófagos de camundongos). As células B podem ser identificadas usando anticorpos anti-CD19 fluorescentes e f4/80-/CD19- as células podem ser detectadas usando uma mancha de ácido nucleico fluorescente azul(Figura 4).
5. Migração de macrófagos de imagem por lapso de tempo, microscopia de contraste de fase
- Coloque um slide de quimiotáxi no palco de um microscópio invertido equipado com uma incubadora de palco. Mantenha a temperatura em 37 °C.
- Imagem da área de observação de 1 mm x 2 mm usando uma lente objetiva de contraste de fase de 10x e foco no macrófago lamellipodia: saliências finas, semelhantes a folhas de membrana. Capturar imagens por 14 h a uma taxa de 1 quadro a cada 2 min.
6. Análise de imagens com lapso de tempo
- Analise as imagens de tempo-lapso, de contraste de fase, utilizando o software automatizado de análise de imagens ou o plugin De rastreamento manual, produzido por Fabrice P. Cordelières, para ImageJ.
NOTA: Programas de rastreamento automatizados podem ser usados para analisar células com imagem por lapso de tempo, contraste de fase ou microscopia de fluorescência. Por exemplo, o software iTrack4U baseado em Java produzido por Cordelières et al.27 pode ser usado para rastreamento e análise de células automatizadas usando imagens de lapso de tempo, contraste de fase ou fluorescência como entrada. O rastreamento manual é mais demorado, mas as faixas geradas pelo plugin ImageJ Rastreamento Manual podem ser diretamente importadas e analisadas automaticamente pelo plugin ImageJ Chemotaxis e Migration Tool28,29.
Resultados
Um diagrama esquemático do slide de quimiotaxis usado para microscopia de vídeo em lapso de tempo de macrófagos peritoneal do rato migrando em um gradiente quimiotático é mostrado na Figura 2A. O slide contém três câmaras de quimiotáxi, cada uma com quatro portas de enchimento. As portas podem ser fechadas individualmente usando os plugues mostrados acima do slide. Alternativamente, uma tampa de não vedação pode ser colocada sobre uma porta desconectada para manter a esterilidade. Após a conexão das portas 1 e 4, a área de observação (1 mm de largura x 2 mm de comprimento x 70 μm de alta canal ligando os dois reservatórios) entre as portas 2 e 3 pode ser pré-preenchida com meio, colocando uma queda de 15 μL na porta 3 e aspirando com uma pipeta de volume de 2-20 μL na porta 2(Figura 2B). Uma suspensão das células peritoneal residentes do rato (10 x 106 células/mL) foi semeada na área de observação, colocando uma queda de suspensão de 10 μL na porta 3 e aspirando lentamente na porta 2 (Figura 2C). Uma imagem típica de células semeadas na área de observação tomada por microscopia de contraste de fase usando uma lente objetiva de 10x é mostrada na Figura 2C. Após a incubação por 2-3 h, o slide de quimiotáxi foi lentamente preenchido com médio(Figura 2D). Depois de ligar as portas 1 e 2, o meio foi lentamente injetado através da porta 3 até que emergiu da porta 4. Em seguida, o plugue foi trocado da porta 1 para a porta 3, e então o segundo reservatório foi preenchido por meio de injeção lenta via porta 4 até que emergiu no porto 1. Nesta fase, as células da área de observação foram reinspecionadas por meio de um microscópio invertido (Figura 2E). Comparando-se as imagens pouco antes (Figura 2C) e depois(Figura 2E) o enchimento dos reservatórios, até dois terços das células foram retiradas da área de observação. Geralmente, as células CD19+ (células B1) fracamente aderentes foram lavadas e as demais células eram predominantemente F4/80+ células (macrófagos). Isso foi demonstrado pela microscopia de fluorescência após rotular cada tipo de célula com anticorpos específicos rotulados fluorescentemente(Figura 4). Na Figura 4A,as células peritoneal residentes em camundongos recém-isoladas foram rotuladas com anticorpos anti-F4/80 fluorescentes fluorescentes verdes e anticorpos anti-CD19 fluorescentes vermelhos, e os núcleos das células foram rotulados com uma mancha de ácido nucleico fluorescente azul. F4/80 é um marcador específico para macrófagos de rato30, enquanto CD19 é um marcador de célula S. A figura 4B mostra células F4/80+ imagens por microscopia confocal de disco giratório na área de observação de uma câmara de quimiotáxi. As células foram rotuladas após um ensaio de quimiotáxi durante a noite registrado por microscopia de tempo-lapso, contraste de fase.
Complement O C5a (quimioa- atrator) foi introduzido em um dos dois reservatórios, colocando uma queda de 15 μL de meio contendo 0,54 μg/mL (mouse recombinante) complementar C5a e 10 μg/mL Patente Azul V na porta de enchimento 1 (Figura 3A) após a conexão das portas 2 e 3. O meio quimioatrativo foi lentamente atraído para o reservatório por aspiração lenta com uma pipeta via porto 4. A Figura 3B mostra a difusão do tinário azul depois de desenhar a queda de 15 μL em um reservatório. Patente Azul V foi utilizado como um indicador visual indireto de difusão quimiosalvador. As moléculas de Complement o C5a são consideravelmente maiores que as da Patente Azul V (9,0 kDa versus 0,57 kDa) e difusas mais lentamente. Após a difusão do complemento C5a no reservatório, sua concentração foi de ~0,2 μg/mL (15 μL/40 μL [volume do reservatório] x 0,54 μg/mL = 0,2 μg/mL), equivalente a ~22,5 nM. Um gradiente modestamente íngreme formou-se em toda a área de observação após 3h e continuou a aumentar, atingindo um máximo em torno de 12 h31. A Figura 3C mostra as faixas de migração de macrófagos migrando em um gradiente C5a complementar, entre 6-12 horas após a adição do quimioador. A velocidade celular e a eficiência quimiotática, indexadas como y-FMI (índice de migração y-forward; faixa: -1 a +1) e x-FMI, de macrófagos individuais foram calculadas a partir das parcelas migratórias(Figura 3D). A Figura 3D também mostra uma trama de migração produzida após a normalização do ponto de partida de cada faixa de migração para X = 0 e Y = 0 abaixo das parcelas da caixa. A entrada no gráfico de migração mostra como o y-FMI foi calculado para cada faixa de migração.
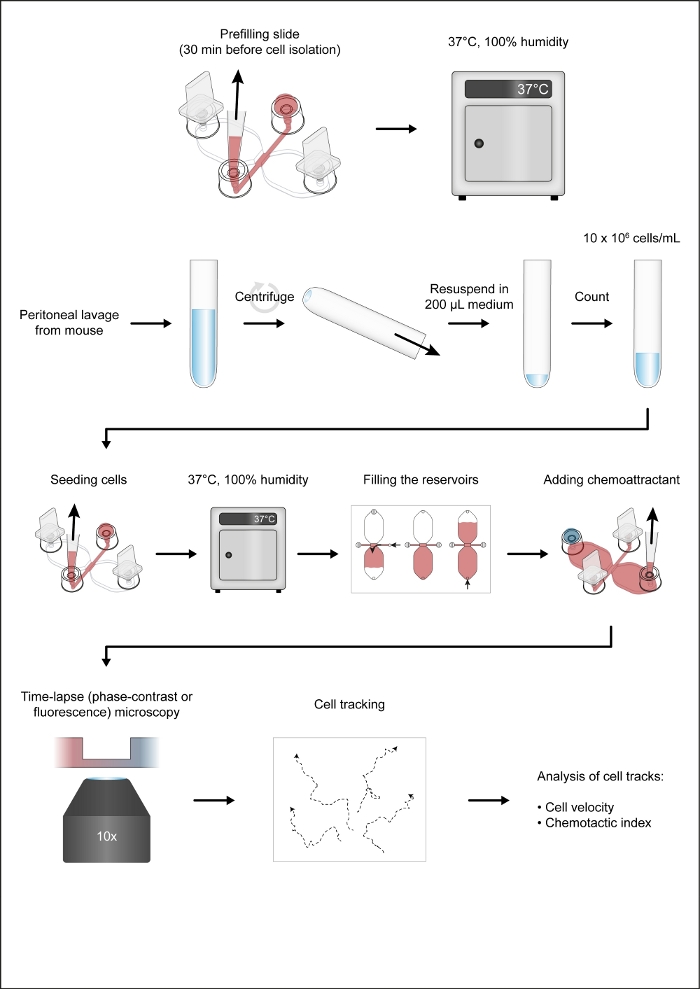
Figura 1: O fluxo de trabalho do ensaio quimiotaxis. Clique aqui para ver uma versão maior desta figura.

Figura 2: Manuseio de lâminas de quimiotaxis. (A)Uma visão 3D de um slide de quimiotaxis com quatro plugues e quatro tampas. O slide contém três câmaras de quimiotáxi, cada uma das quais consiste em dois reservatórios de 40 μL conectados por um canal de 1 mm x 2 mm, que tem 70 μm de altura, denominado área de observação. (B) O canal de conexão estende-se em ambas as extremidades para as portas de enchimento 2 e 3. Após inserir plugues nas portas de enchimento 1 e 4, a área de observação foi pré-preenchida com médio (vermelho) aplicando uma gota de médio para porta 3 e aspirando na porta 2 com uma ponta de pipeta de 10-200 μL. Posteriormente, as tampas foram aplicadas nas portas 2 e 3 antes de incubar o slide a 37 °C e preparar a suspensão celular. (C) A área de observação, onde o gradiente quimioatrativo se formou, foi semeada com macrófagos, aplicando uma queda de 10 μL de células peritoneal residentes em camundongos na porta 3 e aspirando lentamente na porta 2. O slide foi então incubado em uma câmara de umidade de 37 °C por 2-3 h. A imagem de contraste de fase mostrada à direita, obtida através de uma lente objetiva de 10x, mostra células peritoneais após a semeadura e incubação a 37 °C por 2 h. Barra de escala = 500 μm. (D) As câmaras de quimiotáxi foram preenchidas com meios de conexão 1 e 2 e, em seguida, lentamente injetando meio via porta 3 até que emergiu na porta 4. O enchimento lento e constante pode ser obtido girando o anel de ajuste de volume de uma pipeta de volume de 20-100 μL. Após encher o primeiro reservatório, o segundo reservatório pode ser preenchido por meio de conexão das portas 2 e 3 e, em seguida, lentamente injetando meio no porto 4 até que ele emerge no porto 1. (E) Imagem de contraste de fase da mesma área de observação mostrada acima(C)após o enchimento dos dois reservatórios. Barra de escala = 500 μm. Elementos gráficos fornecidos por Elias Horn. Clique aqui para ver uma versão maior desta figura.

Figura 3: Ensaio de quimiotaxis. (A) O chemoattractant foi introduzido em um dos dois reservatórios de uma câmara de quimiotáxi, aplicando uma queda de 15 μL de meio contendo 0,54 μg/mL complemento C5a e 10 μg/mL Patente Azul V para encher a porta 1, seguido de aspiração lenta na porta 4. (B) Inicialmente, após ser arrastado para o reservatório, o meio azul, contendo quimiotratores, tinha uma forma de gota aproximadamente invertida e, em seguida, lentamente difundida por todo o reservatório. (C) Faixas de migração de macrófagos migrando em um gradiente de quimioador (complemento C5a) entre 6-12 horas após a introdução de quimioatração em um dos reservatórios. A direção do gradiente é indicada à direita. O fim de cada faixa de migração é indicado por um círculo preenchido. (D) Plotações blox de velocidade, x-FMI (x-forward migration index) e y-FMI (índice de migração y-forward), um índice de eficiência quimiotática que varia de -1 a +1. Os dados foram obtidos por meio da análise de 25 faixas de migração de macrófagos. Macrófagos na metade inferior da área de observação e mostrando deslocamento de pelo menos uma largura celular acima de 6h foram selecionados aleatoriamente para análise. Abaixo está um gráfico de faixas de migração após a normalização do ponto de partida para X = 0 e Y = 0. O índice de quimiotáxis (y-FMI) foi calculado dividindo-se o deslocamento líquido ao longo do eixo Y (d) pelo comprimento acumulado (l) do caminho de migração, como demonstrado esquematicamente. Elementos gráficos nos painéis A e B fornecidos por Elias Horn. Clique aqui para ver uma versão maior desta figura.
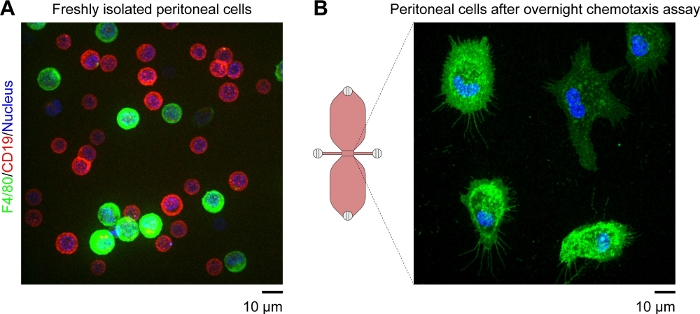
Figura 4: Imagens fluorescentes de células peritoneal residentes em camundongos vivas obtidas por microscopia confocal de disco giratório. (A) Imagem de foco estendida (mesclagem de ponto mais brilhante de todos os planos Z) de células peritoneal de camundongos recém-isoladas rotuladas com anticorpos anti-F4/80 verde fluorescentes (marcador de macrófagos), anticorpos anti-CD19 vermelhos fluorescentes (marcador de células B) e uma mancha de ácido nucleico fluorescente azul. Barra de escala = 10 μm.(B) Snapshot (plano Z único) de F4/80+ células (macrófagos) na área de observação de uma câmara de quimiotáxi tomada após um ensaio de quimiotáxi durante a noite. As células foram rotuladas com anticorpos anti-F4/80 fluorescentes verdes e uma mancha azul fluorescente de ácido nucleico. Os gradientes complemento C5a e Patente Azul V foram lavados pelo procedimento de rotulagem celular, o que explica por que o reservatório superior no diagrama esquemático da câmara de quimiotáxi não é azul. Barra de escala = 10 μm. Elemento gráfico fornecido por Elias Horn. Clique aqui para ver uma versão maior desta figura.
Discussão
A imagem intravital remonta ao século XIX e fornece um meio de estudar o comportamento das células imunes vivas em seu ambiente natural. No entanto, mesmo com a microscopia avançada de hoje e técnicas genéticas é difícil estudar a resposta das células a quimioatraçãodores específicos in vivo. Para contornar esse problema, Boyden18 desenvolveu ensaios transwell na década de 1960, mas esses ensaios de ponto final não forneceram visualização de como as células realmente migraram para a quimioatração, dificultando a distinção da quimiocinese, estimulando a migração aleatória por uma sugestão química32, e quimiotáxis, migração para maiores concentrações de estímulos químicos uns dos outros33. Esse problema foi resolvido com o desenho de várias câmaras abertas com uma ponte, tipicamente de 1 mm de largura, situada entre dois reservatórios e acessível por uma lente objetiva21,22,23. Aplicando um deslizamento de cobertura invertido, semeado com células aderentes, fecha as câmaras e o quimioaa atraiudor adicionado a um dos reservatórios difusos através da ponte para o reservatório oposto, criando um gradiente de concentração. Aqui descrevemos um ensaio de quimiotáxi usando o mesmo princípio, mas usando uma câmara fechada com quatro portas de enchimento. Utilizando este sistema e microscopia de contraste de fase, desenvolvemos um ensaio para macrófagos peritoneal residentes em camundongos que migram em um complemento quimiotático C5a gradiente31,,34,35,36. Este ensaio, combinado com modelos de camundongos knockout, mostrou-se fundamental na investigação dos papéis de vários Rho GTPases e proteínas motoras em morfologia, motilidade e quimiotáxi31,34,35,36,37. Também usamos essa abordagem para imagem de monócitos de sangue periféricos humanos migrando em uma superfície 2D ou em uma matriz de colágeno 3D tipo I38. Além disso, o ensaio é adequado para macrófagos ou macrófagos derivados da medula óssea do rato derivados de células precursoras de mieloide sinuosas39,40. Já usamos sacos de politetrafluoroetileno (PTFE) com adaptadores luer para cultivar células de medula óssea e obter macrófagos34. A vantagem dos sacos PTFE é que as células podem ser prontamente suspensas e prontas para uso depois de colocar o saco no gelo por 20-30 min. Note que pré-preenchemos a área de observação do slide de quimiotaxis antes de introduzir as células. Esta abordagem tem a vantagem de que bolhas de ar indesejadas podem ser posteriormente lavadas (com sucesso variável) e a área de observação presaaked permite a introdução lenta de uma suspensão celular por pipetting. O pré-enchimento, porém, aumenta a probabilidade de que o meio flua parcialmente em um ou ambos os reservatórios de flanqueamento, o que promoverá a semeação de células além da área de observação. Alternativamente, a suspensão celular pode ser diretamente encanada em uma área de observação seca, mas bolhas de ar indesejadas não podem ser posteriormente expelidas.
A cavidade peritoneal do camundongo contém duas populações principais de células: F4/80+ macrófagos e (menores) CD19+ Células B, numa razão de cerca de 1:2(Figura 4A). Essas duas populações celulares representam mais de 95% das células da cavidade peritoneal, enquanto as células F4/80-/CD19restantes geralmente podem ser identificadas como CD11c+ células (células dendríticas) ou CD3+ células (células T). As células B fracamente aderentes são lavadas da área de observação durante o enchimento dos reservatórios com o meio (Figura 2). Depois de adicionar quimioaqueem a um dos dois reservatórios, a microscopia de contraste de tempo pode ser usada para visualizar as células remanescentes (macrófagos) migrando em um gradiente quimioatrativo em evolução. A formação do gradiente complementar C5a na área de observação, através da difusão de um reservatório para o outro, pode ser simulada utilizando um corante fluorescente com peso molecular semelhante. Um bom substituto para o complemento do rato recombinante C5a (peso molecular previsto, 9,0 kDa) é fluorescentemente rotulado dextran (10 kDa)31. Utilizando-se microscopia confocal, o gradiente de fluorescência no canal estreito (área de observação) que conecta os dois reservatórios do escorregador de quimiotáxi pode ser medido em intervalos fixos e os perfis de concentração nos diferentes pontos de tempo podem ser plotados24,31. Rotineiramente adicionamos um corante azul não fluorescente (Patent Blue V) ao meio quimioatrativo para fornecer um indicador visual conveniente de difusão e formação gradiente. Dentro de 1h da introdução de 15 μL de meio azul, contendo quimiotratores em um reservatório, o reservatório parece uniformemente azul e, de acordo com as leis de difusão de Fick, um gradiente se formará através da estreita área de observação que liga os reservatórios(Figura 3B). Vários dias são necessários para que o soluto (corante azul ou quimioa) se torne uniformemente distribuído.
A microscopia de fluorescência pode ser substituída por microscopia de contraste de fase, que oferece vantagens para o rastreamento automatizado de células, pois células rotuladas fluorescentes podem ser facilmente distinguidas do fundo. Outra vantagem é que populações específicas de células imunes podem ser seletivamente rastreadas após rotular marcadores de superfície com anticorpos fluorescentes. Utilizou-se essa abordagem para imagem de sangue periférico humano CD14+ células (monócitos) migrando em um gradiente quimiotático fMLP (N-formylmethionine-leucyl-fenil-fenilanina)gradiente 38. Da mesma forma, anticorpos anti-F4/80 fluorescentes poderiam ser usados para imagem de macrófagos de camundongos migrando em um gradiente c5a complemento quimiotático. Fototoxicidade é uma desvantagem potencial do uso de imagens de fluorescência41. Isso pode ser reduzido por vários meios42, incluindo o uso de fluoróforos excitados com comprimentos de onda mais longos e a dição de antioxidantes ao meio. Alternativamente, as células rotuladas poderiam inicialmente ser identificadas por microscopia de fluorescência e posteriormente imagens por microscopia de tempo-lapso, contraste de fase. No entanto, na prática, as células que se movem a velocidades moderadamente baixas, como ~1 μm/min (macrófagos) ou ~4 μm/min (monócitos), podem ser imagens intermitentes por microscopia de fluorescência em intervalos de minutos, o que é bem tolerado38. Anteriormente, utilizou-se a microscopia de fluorescência e o slide de quimiotáxi descrito aqui para ensaios quimiotaxis 3D38,43. Neste caso, ambos os reservatórios foram pré-preenchidos com meio médio e 15 μL de quimio-contendo quimioadores foi arrastado para um dos reservatórios imediatamente antes de lentamente pipetar células fluorescentes rotuladas de fluorescente suspensas em meio contendo colágeno tipo I para a área de observação. A parte difícil deste procedimento é o manuseio do colágeno tipo I, que está concentrado em solução ácida. O pH da solução de colágeno precisa ser neutralizado pela adição de solução alcalina antes de misturar a solução de colágeno gelado com a suspensão celular. A transferência da mistura de colágeno-célula para uma incubadora a 37 °C iniciará a polimerização do colágeno. Durante a incubação, o slide deve ser lentamente girado em torno de seu eixo longo para que as células permaneçam distribuídas uniformemente nas direções do eixo X, Y e Z enquanto o colágeno polimeriza em um gel. Um slide de quimiotáxi fechado relacionado adequado para ensaios de quimiotáxi 3D, com seis plugues em vez de quatro plugues, foi recentemente descrito29. Este sistema permite que a mistura de colágeno-célula seja introduzida na área de observação antes de encher independentemente cada um dos reservatórios de flanqueamento, porque cada reservatório tem duas portas de enchimento, em vez de uma única porta.
Em resumo, descrevemos um ensaio quimiotaxis em tempo real que permite a visualização de células navegando em um gradiente quimiotático durante um período de 6 ou mais horas. Aqui nos concentramos em macrófagos, que desempenham papéis importantes em doenças inflamatórias, mas têm sido sub-representados em ensaios quimiotáxiem-se em tempo real em comparação com células móveis mais rápidas como neutrófilos e ameba de Dictyostelium.
Divulgações
Os autores não têm nada para revelar.
Agradecimentos
Este trabalho foi apoiado por uma subvenção (HA 3271/3-2) do DFG (Deutsche Forschungsgemeinschaft).
Materiais
| Name | Company | Catalog Number | Comments |
| µ-Slide (anodized aluminium) rack | Ibidi, Martinsried, Germany | 80003 | Autoclavable stackable rack for channel slides |
| µ-Slide Chemotaxis 2D (chemotaxis slide) | Ibidi, Martinsried, Germany | 80306 | Slide containing chemotaxis chambers (tissue culture treated) |
| 100x penicillin/streptomycin | Thermo Fisher Scientific | 15140122 | Used as supplement for RPMI 1640 media |
| 10-100 µL pipette with volume control ring | Eppendorf | 3123000047 | Eppendorf Research plus pipette |
| 10-200 µL pipette tips | Greiner Bio-One International | 739261 | Pipette tips with beveled tips (96 pieces per rack: sterile) |
| 14 mL polypropylene round bottom tubes | BD Falcon | 352059 | Used to collect peritoneal cells |
| 14-bit Hamamatsu C9100-50 Electron Multiplying-Charged Couple Device (EM-CCD) peltier-cooled camera | Hamamatsu Photonics Inc., Japan | EM-CCD camera of the spinning disk confocal microscope system | |
| 2-20 µL pipette with volume control ring | Eppendorf | 3123000039 | Eppendorf Research plus pipette |
| 24 G plastic catheter | B Braun Mesungen AG, Germany | 4254503-01 | Used for peritoneal lavage |
| 405 nm solid state laser, 50 mW | Perkin Elmer, Rodgau, Germany | Laser (405 nm) source of spinning disk confocal microscope system | |
| 488 nm solid state laser, 50 mW | Perkin Elmer, Rodgau, Germany | Laser (488 nm) source of spinning disk confocal microscope system | |
| 561 nm solid state laser, 50 mW | Perkin Elmer, Rodgau, Germany | Laser (561 nm) source of spinning disk confocal microscope system | |
| Alexa Fluor 488-conjugated rat (IgG2a) monoclonal (clone BM8) anti-mouse F4/80 antibody | Thermo Fisher Scientific | MF48020 | Mouse macrophage marker and plasma membrane label |
| Alexa Fluor 594-conjugated rat (IgG2a) monoclonal (clone 6D5) anti-mouse CD19 antibody | BioLegend | 115552 | Mouse B cell marker |
| C-Chip disposable (improved Neubauer) hemocytometer | NanoEnTek (distributed by VWR International) | 631-1098 | Used to count cells |
| CSU-X1 spinning disk scanner | Yokogawa Electric Corporation, Japan | Nipkow spinning disk unit | |
| Hank’s buffered salt solution without Ca2+ and Mg2+ | Thermo Fisher Scientific | 14170120 | Used for peritoneal lavage |
| Heat-inactivated fetal bovine serum | Thermo Fisher Scientific | 10082139 | Used as supplement for RPMI 1640 media |
| Hoechst 34580 | Thermo Fisher Scientific | H21486 | Cell permeable, blue fluorescent nucleic acid stain |
| ImageJ (image processing and analysis in Java) | National Institutes of Health (NIH) | Image analysis software | |
| Lipopolysaccharides from Escherichia coliO111:B4 | Sigma-Aldrich | L4391-1MG | Toll-like receptor 4 ligand |
| Nikon Eclipse Ti inverse microscope | Nikon, Japan | Inverted microscope | |
| Patent Blue V, sodium salt | Sigma-Aldrich | 21605-10G | Blue-colored dye used as visual indicator of gradient formation |
| Recombinant mouse complement C5a protein | R&D Systems | 2150-C5-025 | Chemoattractant for mouse macrophages |
| RPMI 1640 medium containing 20 mM Hepes | Sigma-Aldrich | R7388 | Basis medium for assays |
| UltraVIEW Vox 3D live cell imaging system + Volocity software | Perkin Elmer, Rodgau, Germany | Spinning disk confocal microscope system | |
| Zeiss LSM 510 + Axiovision software | Carl Zeiss Microscopy, Oberkochen, Germany | Confocal laser scanning microscope (LSM) adapted for phase-contrast microscopy |
Referências
- Lammermann, T., Germain, R. N. The multiple faces of leukocyte interstitial migration. Seminars in Immunopathology. 36, 227-251 (2014).
- Lammermann, T., Sixt, M. Mechanical modes of 'amoeboid' cell migration. Current Opinion in Cell Biology. 21, 636-644 (2009).
- Woodham, E. F., Machesky, L. M. Polarised cell migration: intrinsic and extrinsic drivers. Current Opinion in Cell Biology. 30, 25-32 (2014).
- Devreotes, P. N., et al. Excitable Signal Transduction Networks in Directed Cell Migration. Annual Review of Cell and Developmental Biology. 33, 103-125 (2017).
- Kamp, M. E., Liu, Y., Kortholt, A. Function and Regulation of Heterotrimeric G Proteins during Chemotaxis. International Journal of Molecular Sciences. 17 (1), 90(2016).
- Miao, Y., et al. Wave patterns organize cellular protrusions and control cortical dynamics. Molecular Systems Biology. 15, 8585(2019).
- Ridley, A. J., et al. Cell migration: integrating signals from front to back. Science. 302, 1704-1709 (2003).
- Lammermann, T., et al. Rapid leukocyte migration by integrin-independent flowing and squeezing. Nature. 453, 51-55 (2008).
- Mullins, R. D., Heuser, J. A., Pollard, T. D. The interaction of Arp2/3 complex with actin: nucleation, high affinity pointed end capping, and formation of branching networks of filaments. Proceedings of the National Academy of Sciences of the United States of America. 95, 6181-6186 (1998).
- Leithner, A., et al. Diversified actin protrusions promote environmental exploration but are dispensable for locomotion of leukocytes. Nature Cell Biology. 18, 1253-1259 (2016).
- McDonald, B., et al. Intravascular danger signals guide neutrophils to sites of sterile inflammation. Science. 330, 362-366 (2010).
- Leber, T. Ueber die Entstehung der Entzündung und die Wirkung der entzündungserregenden Schädlichkeiten. Fortschritte der Medizin. 6, 460-464 (1888).
- Tauber, A. I. Metchnikoff and the phagocytosis theory. Nature Reviews Molecular Cell Biology. 4, 897-901 (2003).
- Clark, E. R., Linton Clark, E. Reactions of cells in the tail of amphibian larvae to injected croton oil (aseptic inflammation). American Journal of Anatomy. 27, 221-254 (1920).
- Clark, E. R., Linton Clark, E. The reaction of living cells in the tadpole's tail toward starch, agar-agar, gelatin, and gum arabic. The Anatomical Record. 24, (1922).
- Comandon, J. Phagocytose in vitro des Hématozoaires du Calfat (enregistrement cinématographique). Comptes Rendus Hebdomadaires des Séances et Mémoires de la Société de Biologie. 69, 314-316 (1917).
- McCutcheon, M. Chemotaxis in leukocytes. Physiological Reviews. 26, 319-336 (1946).
- Boyden, S. The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes. The Journal of Experimental Medicine. 115, 453-466 (1962).
- Horwitz, D. A., Garrett, M. A. Use of leukocyte chemotaxis in vitro to assay mediators generated by immune reactions. I. Quantitation of mononuclear and polymorphonuclear leukocyte chemotaxis with polycarbonate (nuclepore) filters. Journal of Immunology. 106, 649-655 (1971).
- Bignold, L. P. A novel polycarbonate (Nuclepore) membrane demonstrates chemotaxis, unaffected by chemokinesis, of polymorphonuclear leukocytes in the Boyden chamber. Journal of Immunological Methods. 105, 275-280 (1987).
- Zigmond, S. H. Ability of polymorphonuclear leukocytes to orient in gradients of chemotactic factors. The Journal of Cell Biology. 75, 606-616 (1977).
- Zicha, D., Dunn, G. A., Brown, A. F. A new direct-viewing chemotaxis chamber. Journal of Cell Science. 99, Pt 4 769-775 (1991).
- Muinonen-Martin, A. J., Veltman, D. M., Kalna, G., Insall, R. H. An improved chamber for direct visualisation of chemotaxis. PLoS One. 5, 15309(2010).
- Zengel, P., et al. mu-Slide Chemotaxis: a new chamber for long-term chemotaxis studies. BMC Cell Biology. 12, 21(2011).
- Valentim, A. M., Guedes, S. R., Pereira, A. M., Antunes, L. M. Euthanasia using gaseous agents in laboratory rodents. Lab Animal. 50, 241-253 (2016).
- Franks, N. P. General anaesthesia: from molecular targets to neuronal pathways of sleep and arousal. Nature Reviews. Neuroscience. 9, 370-386 (2008).
- Cordelieres, F. P., et al. Automated cell tracking and analysis in phase-contrast videos (iTrack4U): development of Java software based on combined mean-shift processes. PLoS One. 8, 81266(2013).
- Zantl, R., Horn, E. Chemotaxis of slow migrating mammalian cells analysed by video microscopy. Methods in Molecular Biology. 769, 191-203 (2011).
- Biswenger, V., et al. Characterization of EGF-guided MDA-MB-231 cell chemotaxis in vitro using a physiological and highly sensitive assay system. PLoS One. 13, 0203040(2018).
- Austyn, J. M., Gordon, S. F4/80, a monoclonal antibody directed specifically against the mouse macrophage. European Journal of Immunology. 11, 805-815 (1981).
- Hanley, P. J., et al. Motorized RhoGAP myosin IXb (Myo9b) controls cell shape and motility. Proceedings of the National Academy of Sciences of the United States of America. 107, 12145-12150 (2010).
- Wilkinson, P. C. Cell Locomotion and Chemotaxis: Basic Concepts and Methodological Approaches. Methods. 10, 74-81 (1996).
- Pfeffer, W. Locomotorische Richtungsbewegungen durch chemische Reize. Untersuchungen aus dem Botanischen Institut zu Tübingen. 1, 363(1884).
- Konigs, V., et al. Mouse macrophages completely lacking Rho subfamily GTPases (RhoA, RhoB, and RhoC) have severe lamellipodial retraction defects, but robust chemotactic navigation and altered motility. The Journal of Biological Chemistry. 289, 30772-30784 (2014).
- Horsthemke, M., et al. Multiple roles of filopodial dynamics in particle capture and phagocytosis and phenotypes of Cdc42 and Myo10 deletion. The Journal of Biological Chemistry. 292, 7258-7273 (2017).
- Bachg, A. C., et al. Phenotypic analysis of Myo10 knockout (Myo10(tm2/tm2)) mice lacking full-length (motorized) but not brain-specific headless myosin X. Scientific Reports. 9, 597(2019).
- Horsthemke, M., et al. A novel isoform of myosin 18A (Myo18Agamma) is an essential sarcomeric protein in mouse heart. The Journal of Biological Chemistry. 294, 7202-7218 (2019).
- Bzymek, R., et al. Real-time two- and three-dimensional imaging of monocyte motility and navigation on planar surfaces and in collagen matrices: roles of Rho. Scientific Reports. 6, 25016(2016).
- Wang, G. G., et al. Quantitative production of macrophages or neutrophils ex vivo using conditional Hoxb8. Nature Methods. 3, 287-293 (2006).
- Gran, S., et al. Imaging, myeloid precursor immortalization, and genome editing for defining mechanisms of leukocyte recruitment in vivo. Theranostics. 8, 2407-2423 (2018).
- Magidson, V., Khodjakov, A. Circumventing photodamage in live-cell microscopy. Methods in Cell Biology. 114, 545-560 (2013).
- Icha, J., Weber, M., Waters, J. C., Norden, C. Phototoxicity in live fluorescence microscopy, and how to avoid it. BioEssays : News and Reviews in Molecular, Cellular and Developmental Biology. 39 (8), 1700003(2017).
- Isfort, K., et al. Real-time imaging reveals that P2Y2 and P2Y12 receptor agonists are not chemoattractants and macrophage chemotaxis to complement C5a is phosphatidylinositol 3-kinase (PI3K)- and p38 mitogen-activated protein kinase (MAPK)-independent. The Journal of Biological Chemistry. 286, 44776-44787 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados