Method Article
単一細菌化学を探るツールとして赤外線分光法と組み合わせた原子間力顕微鏡
要約
原子間力顕微鏡-赤外線分光法(AFM-IR)は、細菌研究のための強力なプラットフォームを提供し、ナノスケールの分解能を達成することを可能にします。いずれも、細胞内変化(例えば、細胞分裂時)のマッピング、ならびに化学組成の比較研究(例えば、薬剤耐性から生じる)のマッピングは、細菌中の単一細胞レベルで行うことができる。
要約
原子間力顕微鏡-赤外線分光法(AFM-IR)は、ナノスケール分解能を有する試料の物理的性質と化学組成の同時特性を可能にする新しい組み合わせ技術です。AFMとIRを組み合わせることで、従来のIRの空間分解能の限界を克服し、20〜100nmの分解能を達成することができます。これは、従来のIR顕微鏡によって達成できなかった、数マイクロメートルよりも小さいサンプルを探査するためのIRの広範な新しいアプリケーションのための扉を開きます。AFM-IRは細菌研究に非常に適しており、単一細胞レベルと細胞内レベルでスペクトル情報と空間情報の両方を提供します。細菌感染に関する世界的な健康上の懸念の高まりと将来の予測が好ましくない、特に、抗菌性の急速な発展は、単一細胞および細胞下レベルでのフェドニティクス探査が可能な研究ツールの緊急の必要性を生み出した。AFM-IRは、単一の細菌の化学組成の詳細な特性評価を可能にすることによって、このニーズに対処する可能性を提供します。ここでは、細菌研究に対するAFM-IRの応用に向けて、単一スペクトルおよびマッピングモダリティのサンプル調製およびデータ取得のための完全なプロトコルを提供する。
概要
細菌は、単一細胞原核生物であり、様々な形および大きさで生じ、典型的には数百ナノメートルからマイクロメートルの範囲で起こる。それらは様々な生息地に存在し、生命の存在に不可欠です。人体の中では、腸内に存在する細菌の大半は無害であり、多くは実際には有益である1.しかし、いくつかの細菌種は病原性であり、感染症の範囲を引き起こす。細菌感染は敗血症と敗血症性ショックの発症につながる可能性があります:生命を脅かす状態、感染に対する身体の反応から生じる2.敗血症は世界的な主要な健康上の脅威であり、世界的に高い有病率と重度の死亡率を有する。2017年だけでも、世界中で推定5,000万例の敗血症が記録され、そのうち1,100万人が死亡(約20%)となりました。さらに、患者の生存率の低下は、遅れた治療に起因して、毎時3,4の方法で起こることが示された。
細菌感染は抗生物質で治療される。細菌性血流感染(BSI)の潜在的な結果の重症度は、抗菌療法の迅速な開始の明確な意義と共に、即時の抗生物質投与の必要性を促す。しかし、臨床現場で使用される現在の診断アプローチ(例えば、血液培養)は比較的長い時間を必要とするため、抗生物質投与は陽性BSI診断5の前にしばしば起こる。この要因は、農業などの他の分野での過剰な抗生物質の使用と共に、抗菌性(AMR)6,7の開発に対する深刻な進化的圧力を生み出す抗生物質の広範な過剰使用につながります。AMRは現在、世界で最も差し迫った健康問題の1つである7,8であり、2050年までに死亡原因の第一人者になると予測されています。耐性の発達は、AMR株の広がりと共に、驚くべきペースで起こっている7、8、9及び超え、はるかに、新しい抗生物質10の発見の速度を超える。新しい耐性の優れた型は、世界中で絶えず出現し、一方で
AMR関連の変化を理解することに専念する研究は、多くの場合、遅く、利用可能なアプローチによって制限されています11.また、ポリメラーゼ連鎖反応(PCR)や全遺伝子シーケンシング(WGS)などの一般的に使用される方法は、遺伝子接合変化のみに焦点を当てます。これらは、耐性11のメカニズムを明らかにするのに十分ではなく、細菌の化学組成を理解することを可能にする研究ツールの緊急の必要性を促す。
赤外線分光法(IR)は、サンプルの分子特性を提供し、従って、フェロチ細菌の探査のための有望な候補である。初期の用途12以来、その使用の大きな例が文献13,14で実証された。これらには、15属の細菌のフェホチベースの同定、種16、および株17、18レベルが含まれる。しかしながら、従来のIRの空間分解能は、波長回折空間分解能限界19に起因する数ミクロンに制限されている。大多数の細菌の大きさはその限界(例えば、直径400nm≈ブドウ球菌)以下であるため、従来のIRは単細胞レベルまたは細胞内レベルでのプローブには適用されません。
最近、IR分光と原子間力顕微鏡(AFM-IR)を組み合わせることで、空間分解能の限界を克服しました。この場合、IR吸収は間接的に検出され、物質19、20、21、22の熱膨張を介して検出される。簡単に言うと、IR放射の吸収は局所的な温度上昇をもたらす。これは、直接23、またはAFMカンチレバープローブの振動の測定を通じて、IR吸収20,21によって生成された力インパルスから生じる。コンビネータトリーAFM-IR技術は、20nm近くにある空間分解能を達成し、サンプル(AFM)の局所的な物性とその化学組成(AFM-IR)に関する情報を同時に提供することを可能にします。両方の収集、選択したスポットからの単一スペクトル、選択した領域内の選択された波の値の強度のマッピングが可能です。
AFM-IRの達成可能な空間分解能を考慮すると、この技術が単一細菌細胞およびそれらの細胞内組成24の化学的/形質検査の可能性を開くことが明らかである。これまで、単一細菌に対するAFM-IRの適用例は、文献19、20、21、22、25、26、27、28に示された。これらは、単一のスペクトル分析19、21、22および細胞内レベル19、22、25、26、27、28でのマッピングを含む。例えば、単一細菌の中で細胞内脂質小胞27およびウイルス28を検出する能力が説明されている。これらの結果は、単一細菌および臨床的に関連する病原体のナノスケール研究におけるAFM-IRの有用性を示す19。
そこで、多層、単層、単細胞細菌サンプルのAFM-IRデータのサンプル調製および収集方法を提示する。本明細書に記載されたプロトコルは、異種の細菌22およびその化学組成の変化を研究するために適用された。特に、バンコマイシン耐性とダプトマイシン非感受性のインビボ開発を、S.アウレウス19の臨床対で調べた。いずれも、S.アウレウス(VISAおよびDpR)におけるバンコマイシン間欠性およびダプトマイシン非感受性が比較的最近出現し、これらの抗生物質の診療所への使用と導入の増加に続いて、重大な医学的問題を構成した。さらに、特に、ダプトマイシン非感受性のメカニズムは依然として不可解なままであり、代替医薬品開発19,29を妨げる。提示されたプロトコルは、実験目的に従って、さまざまな化学測定アプローチを用いてさらに分析することができる単一細菌の信頼性の高いAFM-IRスペクトルの提供に焦点を当てています。さらに、細胞内調査に適用可能なマッピングアプローチも含まれています。
プロトコル
病原性細菌に対して行われるすべての作業は、適切な安全対策を講じて行われるべきである。これらは、適切なバイオセーフティレベルを有する実験室で作業し、バイオセーフティキャビン(PC2)で作業するだけでなく、適切な消毒剤、例えば、80%エタノール溶液で作業領域の慎重な除染が含まれます。適切なPPEは常に着用する必要があります。
1. 溶剤・材料の調製
- 溶剤: 超純水を溶媒として使用します。実験の前にオートクレーブされた精製水を使用して、潜在的な交差汚染を避けてください。
- 基板:AFM-IR、例えば、ZnSe、CaF 2、BaF2、等のためのこれらの基質のいずれかを使用する。AFM-IRは、原則として非破壊技術であるため、AFM-IR分析後の同じサンプルに様々な他の研究ツールを適用することができます。例えば、ラマングレードCaF2またはBaF2スライドを使用すると、ラマン分光法と結果の相関を行うことができます。
- プラスチックはサンプルを汚染する可能性がありますので、プラスチックチューブの代わりにガラスバイアルを使用してください。
2. AFM-IRのサンプル調製
- サンプルの成長/インキュベーション
- 液体培地や固体プレート上で細菌を成長させます。培地の種類、成長条件(温度、酸素の入手可能性など)と成長時間を、調査中の細菌種の特定の要件に従って選択します。例えば 、S.アウレウス 心輸液(HI)寒天プレートの場合、好気的な条件下で37°Cで16時間成長して使用することができます。
注:最良の結果を得るためには、増殖/インキュベーションは、サンプルのマイクロペレットの収集を可能にする十分な細菌を得る必要があります。コロニー形成ユニットまたは細菌細胞の特定の数は、細菌の種類と大きさに依存します。
- 液体培地や固体プレート上で細菌を成長させます。培地の種類、成長条件(温度、酸素の入手可能性など)と成長時間を、調査中の細菌種の特定の要件に従って選択します。例えば 、S.アウレウス 心輸液(HI)寒天プレートの場合、好気的な条件下で37°Cで16時間成長して使用することができます。
- サンプルデポジション
- 滅菌ループを使用して、寒天プレートのコロニーから細菌を慎重に収集し、ガラス管に移します。コロニーの上から細菌のみを収集します。液体培養液からサンプルを採取する場合は、ピペットを用いて、約1mLの細菌懸濁液をガラス管に移す。容積は細菌の負荷によって変えることができる。
注:コロニーの下から任意の媒体を収集(または可能な限り最小限に抑える)を試みることは重要です。サンプル調製の後続のステップは、メディアの潜在的な残留を取り除くことを目指しています。最初から残留する潜在的な媒体の最小化は精製された細菌細胞からのデータのスペクトル獲得を可能にする。手順 2.2.2 および 2.2.3 は、寒天プレートから調製したサンプルに適用されます。液体媒体から調製したサンプルについては、ステップ2.2.4に進みます。 - チューブに1mLの超純水を加えます。集めた細菌ペレットがチューブの底部に見えなくなるまでの渦(通常は1〜2分)。
- 調製した溶液とマクファーランド標準との間の視覚的比較30により、例えば、マクファーランド標準を用いて、溶液の大まかな濁度を推定する。細菌懸濁液の濁度が非常に低いと思われる場合は、滅菌ループと渦を使用してプレートから細菌を追加します。溶液の大まかな濁りがマクファーランド規格0.5および1に匹敵するまで繰り返します。これは一般的に、細菌ペレットの良い量をもたらすでしょう。
- 細菌懸濁液を3,000xgで5分間遠心し、ペレットを得た。
注:遠心分離パラメータは、細菌ペレットを得るために変更することができます。g力を高める場合は、細菌の破壊を誘発しないように注意する必要があります(特にグラム陰性菌の場合)。 - ピペットを使用して、ペレットの上から上清をそっと取り出します。1 mLの超純水をチューブと渦に加え、ペレットを再懸濁させます。続いて、ステップ2.2.4で行われたサンプルを遠心分離する。
- 洗浄手順(ステップ2.2.2および2.2.4)を少なくとも3回繰り返します。液体培地から初期サンプルを採取した場合は、少なくとも4回(培地除去後に3回のスケート)を繰り返す。
- 最後の洗浄後、上清を取り除き、超純水と渦を2分以上加えます。続いて、試料の5μLを基板に堆積させる(例えば、ラマングレードCaF2)。
- サンプルの所望の厚みが細菌の多層である場合は、サンプルを空気乾燥にしておきます。
- 所望の厚みが単層または個々の細菌である場合、サンプルを沈着した直後(ステップ2.2.7)は、20〜100μLの超純水を加え、ピペットチップと穏やかに混ぜます。空気乾燥にしておきます。
注:水の正確な体積は、多くの要因(例えば、生物の大きさ、ペレットの密度など)に依存するため、実験によって異なる可能性があり、したがって、経験的に最もよく決定されます。添加された超純水の様々な量を持つ一連のサンプルの調製は、細菌の所望の厚さ/密度を有するサンプルを選択することを可能にする。細菌の厚さ/密度は、その後の段階でAFMを介して容易に視覚化することができる。単層および単一細胞サンプルからのAFM画像の例を 図1A–Hに示します。 - 両面粘着テープを使用して、AFM金属検体ディスクに基板を取り付けます。
- 滅菌ループを使用して、寒天プレートのコロニーから細菌を慎重に収集し、ガラス管に移します。コロニーの上から細菌のみを収集します。液体培養液からサンプルを採取する場合は、ピペットを用いて、約1mLの細菌懸濁液をガラス管に移す。容積は細菌の負荷によって変えることができる。
3. 計器の準備
注: ここで説明するインストゥルメンタル手順は、 資料一覧に記載されているインストゥルメントに関するものです。AFM-IR機器の新しいモデルを使用する場合、詳細インストゥルメンタル手順は、ここで説明したものとは若干異なる場合があります。
- [初期化]ボタンを押して、計測器をオンにして 初期化 します。レーザーシャッターがレーザーテストの オープン 位置にあることを確認します。
- パージシステムが設定されている場合は、N 2の流れをオンにしてN2 で器具をパージします。窒素パージを調整して、安定した湿度レベル(例えば、20%)を達成します。測定中、およびバックグラウンドデータとサンプルデータ収集の間で湿度が変動しないようにします。湿度レベルが安定するまで約20分を許容することが推奨されます。
- [ロード]ボタンを押してサンプルをサンプルチャンバーに ロード します。サンプルの読み込みは、ソフトウェア ウィザードを通じて行います。ソフトウェアウィザードを操作しながら、まず先端に焦点を当て、矢印を使用して顕微鏡ステージをZ方向に移動し、[ 次へ]をクリックします。第二に、インプレーンの動きを導く矢印を使用して、データ収集スポットを調整し、AFMヘッドの上部にあるノブを使用してAFMレーザーとAFM検出器を整列させます。続いて、顕微鏡ステージをZ方向に移動させることにより、試料表面に焦点を当てます。
注: サンプルの読み込みの各ステップの詳細な図は、ソフトウェアマニュアル31に記載されています。サンプルに焦点を当てるには注意して行う必要があります。Z方向にサンプル表面に近づくときは、低速のモータ速度を使用してください。 - [アプローチ] ボタンをクリックして、操作せずにサンプルに アプローチ します。
4. データ収集
- バックグラウンド
- データ取得の前に、背景を収集します。バックグラウンドコレクションの場合は、レーザーシャッターが 「オープン 」の位置にあることを確認します。スペクトルの範囲と解像度(解析の目的に応じて)と、スキャンの数と背景の共平均の数を選択します。これらは一般的に高くすることをお勧めします(例えば、1024スキャンと3の共平均)。
注: 一般的に、スペクトル解像度は 4 cm-1 または 8 cm-1、 スペクトル範囲は 3,200 cm-1 -2,800cm-1 および 1,800 cm-1-900 cm-1 をお勧めします。 - 背景を取得した後、背景ファイルを保存します。ファイルは自動的には保存されません。レーザーシャッターの位置を [閉じる]に変更します。
- データ取得の前に、背景を収集します。バックグラウンドコレクションの場合は、レーザーシャッターが 「オープン 」の位置にあることを確認します。スペクトルの範囲と解像度(解析の目的に応じて)と、スキャンの数と背景の共平均の数を選択します。これらは一般的に高くすることをお勧めします(例えば、1024スキャンと3の共平均)。
- サンプル – 単一スペクトル
- [Engage]ボタンを押してサンプルにエンゲージします。直接接触が検出されるまで、システムはサンプル表面に近づき始めます。
注: この作業で使用される設定点は 0.15 ~ 2 V の範囲で、フィードバックゲイン(I ゲインと P ゲイン)は通常 3 ~ 10 に設定されます。NIR2コンタクトプローブは、一般的にnanoIR2システム(モデル:PR-EX-nIR2-10、共振周波数(kHz):13 +/-4 kHz、ばね定数(N/m):0.07-0.4 Nm-1)で使用されます。 - 表面を視覚化するためにAFM画像を収集します。最初の例では、より低い空間分解能(例えば、200 x 200ポイント)で大きな領域(例えば50 x 50 μm)をスキャンする(図1I)。
注:AFM-IRデータは常に接触モードで収集されていますが、AFMデータは接触またはタッピングモードで収集することができます。 - AFM 高さ/偏向画像から、特定の対象領域を選択し、より高い空間解像度で再画像化します (図 1J–K)。データ収集の速度が適切で、遅いチップ移動(例えば、スキャンレート0.2~0.4Hz)であることを確認します。
- 測定スポット(例えば、単一細菌)を選択し、先端をスポットに移動します。
- IR レーザーを合わせます。この目的のために、サンプルが吸収する波数を使用します。生物材料に関しては、例えば、アミドI(1655cm-1)が可能である。バンドパスフィルタがオフになっていることを確認し、[IRの開始] をクリックします。nanoIRメーターの右グラフ(振幅対周波数として表示される偏向のFFT)は、少なくとも1つの明確なピークを示し、左グラフ(偏向対時間)は周期波形を持っている必要があります。もしそうでなかった場合は、IRスポットの最適化に進みます。
注: 高速フーリエ変換(FFT)と偏向が期待されるプロファイルを示している場合でも、少なくともいくつかの波数に対して IR スポットの最適化を行うことを推奨します。 - 選択した波形番号の値を使用して、IR データ収集のホット スポットを最適化します。従来の細菌のIRスペクトル(例えば、細菌ペレットのATRスペクトル)を使用して、バンドの位置を特定し、ホットスポットを最適化するためにそれらを使用することが有用です。さまざまなスペクトル領域からさまざまな波形数値(8~10など)を選択します。
注:AFM-IRデータ収集前に目的の細菌の従来のIRスペクトルを収集できなかった場合、文献で入手可能な細菌スペクトルは大まかなガイダンスとして使用することができます。IRスポットの最適化の結果は、各xとy位置におけるFFTの大きさ信号の地図を提示する画像である。最大の信号を持つ位置が自動的に選択されます。このような画像の例は、ソフトウェアマニュアル31に示されている。 - 選択した波形数値の IR スポットを最適化した後、スペクトルデータ収集のパラメータ(スペクトル領域、スペクトル解像度、スキャン数、および適用されたパワーと入力)を定義し、ソフトウェアの適切なウィンドウにこれらを入力します。スペクトル解像度はバックグラウンド解像度と一致し、スペクトル領域はバックグラウンドが収集されたスペクトル領域内に含まれている必要があります。
注: 一般的な初期パラメータのセットは、スペクトル範囲: 3200 cm-1-2800 cm-1 および 1800 cm-1-900 cm-1、スペクトル解像度: 4 cm-1 または 8 cm-1、スキャン数: 512 -2048 です。 - 必要に応じて、信号に応じてレーザーパワーを調整します。一般に、レーザーパワーの8~10%の値は、信号の良質に十分な値でなければなりません。大きい値はサンプルの損傷を引き起こす可能性があるため、注意して使用できます。
注: レーザーの割合は、IR レーザーの種類によって異なります。ここで示すパーセント値は OPO レーザーです。 - AFM-IRスペクトルを収集するには、 取得 をクリックしてください。
- AFM-IRスペクトルの収集後、同じ領域からAFMデータを再収集します。これは、サンプルに対する潜在的なドリフトおよび/または破壊的な影響を明らかにするので、強くお勧めします。
- AFM-IRスペクトルが満足のいくものであり、サンプルに対する破壊的な影響が見られない場合は、データ収集を進めます。必要に応じて、 配列 オプションを使用してデータ収集のための一連の点を定義し、AFM の高さまたは偏向画像を収集します。このオプションでは、単一スペクトルに対して定義された同じスペクトルパラメータを使用して、各ポイントから連続してスペクトルを収集することができます。
- AFM-IRスペクトルの収集後に収集されたAFM画像がサンプル(通常は焼けたスポット)に破壊的な影響を明らかにした場合は、パワーを下げます。別のスポットを選択し、ステップ 4.3.8 ~ 4.3.11 を繰り返します。
- AFM-IRスペクトルの信号が満足のいくものでない場合は、IRスポットの最適化の正確性を確認してください(ステップ4.3.6)。正しい場合は、レーザーパワーをわずかに上げ、ステップ4.3.7~4.3.11を繰り返します。これは、満足のいく信号が達成されるまで繰り返すことができる。
- [Engage]ボタンを押してサンプルにエンゲージします。直接接触が検出されるまで、システムはサンプル表面に近づき始めます。
- サンプル – イメージングアプローチ
注: 選択した波形値の強度分布画像を収集する前に、細菌の単一の AFM-IR スペクトルを記録することを強くお勧めします。- 選択したサンプル領域の AFM イメージを記録します。これを行うには、まず、より低い空間解像度(例えば、50 x 50 μm、200 x 200ポイント)の大きな領域のAFM画像を収集し、対象領域を選択して、空間解像度を高めたAFM画像を収集します( 図1I–Kを参照)。
- AFM-IR イメージングのウェーブ番号の値を選択します。
- レーザーの IR スポットが、選択した波形番号値に合わせて最適化されていることを確認します (ステップ 4.3.6)。IR スポットが一部の波形番号に最適化されていない場合(クリア最大値なし)、それらのスポットに最適化します。
- イメージ領域のパラメータ(幅と高さ、X 方向と Y 方向のデータ ポイント数)を定義します。
注: 前の AFM イメージから連続したスポットを適用すると(図 1I–Kに示すように)、領域のマーキング時に幅と高さのフィールドが自動的に塗りつぶされます。 - スペクトル信号取得のパラメータ(波長、スキャン数、レーザーパワー)を定義します。
注: スキャンの数は、理由の範囲内に保持する必要があります。64 または 32 スキャンは、通常、十分な量の信号を許可します。 - スキャンレートをクリックしてAFMチップの動きのパラメータを定義します。前のステップのスキャン数が多く、X 方向のデータポイント数が多いほど、先端の動きが遅くなります。これらのパラメータ間の調整が不足すると、先端の動きが速くなりすぎて、各ポイントから定義された数のスキャンが実際に取得されなくなる。
注: たとえば、64 のコレクションと 200 ポイントを含む適切な IR 信号の収集の場合、スキャン レートを 0.07 kHz に設定します。 - [IR イメージングを有効にする] ボックスにチェックが入っていることを確認します。
- イメージングを開始します。選択された波数における信号の強度のAFM-IRは、その領域からのAFMデータと同時に収集されます。
注:OPOレーザーを使用する場合、同時に接触共鳴ピーク周波数画像を収集することが可能です。これは、異なる場所でのサンプルの相対的な剛性に関する情報を取得するために使用できます。 - [キャプチャ シーケンス] ウィンドウを使用して、同じ領域から同じ範囲の AFM-IR データの連続したコレクションを設定します。そのためには、キャプチャシーケンスウィンドウを開き、各波形番号を入力し、適用されるレーザパワー(各波形番号)を定義します。
- 収集したデータ(AFMとAFM-IR、単一スペクトル、イメージング)をさまざまな形式にエクスポートし、特定の研究目的に適した方法で分析します。
結果
記載されたプロトコルは、サンプルの初期濃度および添加水量に応じて、基質上の細菌の細胞分布の範囲を得ることを可能にする。 図1 は、グラム陽性(S.アウレウス)およびグラム陰性(大腸菌)細菌から記載されたプロトコルを用いて作製された単層および単一細胞サンプルから記録されたAFM画像(高さおよび偏向)の例を示す。
ここで説明するプロトコルは、単一細菌の細胞内および細胞外構造のAFM-IRイメージングに利用することができる。このアプリケーションの例を図2に示し、これは、S.アウレウス細胞の分裂中に起こる空間的に局在化した化学変化を監視した結果を示している。空気乾燥は一般に細菌製剤の固定アプローチとして考えられているが、細菌は、本質的に、温度などの外的要因に対して非常に高い耐性を示し、脱水32を生存すると報告された。ここで示した結果は、空気乾燥サンプルから取得した。中隔の形成は、同一領域の12画像を連続的に収集することによってAFMイメージング(図2A–D)を介して観察・監視した(1枚の画像の収集≈20分)。図2A-Dは、4つの選択されたAFM画像を示し、各画像の収集間隔は約40分です。形成された構造(隔隔)は高さ45nmである。形成された中隔はAFM高さおよび偏向画像ではっきりと見える(図2E–F)。細胞および隔壁領域から記録されたAFM-IRスペクトル(図2G、図2Fで示された起点)を比較前にアミドIバンドに正規化し、データ収集の点間のサンプル厚さの変化の影響を最小限に抑えた。中隔のAFM-IRスペクトルは、細胞領域から収集されたAFM-IRスペクトルと比較して1240および1090cm-1のバンドの高い相対強度によって特徴付けられる。これらは、細胞壁成分(例えば、ペプチドグリカンおよびテイコ酸を含む)の炭水化物およびホスホジエステル群に起因する22。
また、記載されたプロトコルは、多数の異なるサンプル間の単一スペクトルの比較にも使用できる。このアプリケーションの例を結果と共に図3および図 4に示します。研究の目的は、S.アウレウス(VISA)におけるバンコマイシン間欠抵抗のインビボ開発の結果として起こる化学変化を決定することである。この目的のために、臨床サンプルのペアは患者から収集され、入院時および抗生物質療法の前に親株が単離され(バンコマイシン感受性S.アウレウス、VSSA)および抗生物質および臨床的障害を認めた後に同じ患者から隔離された娘株であった。試料は寒天培地上でさらに増殖し、プロトコルに従って調製した(図3A–B)。AFM-IRスペクトルは、VSSAおよびVISA用の複数の単一細菌(および複数のサンプル)から収集され、その後、いくつかの化学測定アプローチを用いて分析された(図3C)。
VSSA細胞とVISA細胞の間には形態学的差異は認められなかった(図4A–C)。しかし、AFM-IRスペクトル(図4D,F)とそれらの第二誘導体(図4E,G)は、耐性株と感受性株の間の化学組成に明確な違いを示した。細胞壁成分(特に、1088cm-1のバンド)からの炭水化物およびホスホジエエステル群に関連するバンドの相対強度は、耐性株において明らかに増加し、感受性の高い相手と比較した。注目すべきは、すべての再コード化スペクトル(VISA:81、VSSA:88)が小さな標準偏差を示しているという事実です。これは、同じ菌株の異なるサンプルから記録されたスペクトル間での判別が不可能であったため、同じ菌株から作成された様々なサンプルから記録されたデータの良好な再現性を示す。観察された違いは、他の文献レポート33、34と一致したままである感受性の高い相手と比較して、耐性株における細胞壁の厚さの増加を示した。

図1:AFM-IR測定用の各種細菌サンプルの代表AFM画像。基質の希釈に応じて、プロトコルは、細菌の多層および単層だけでなく、単一細胞サンプルを得ることを可能にする。代表AFM画像: (A-D) 単層および (E–H) 単細胞サンプル (A,B,E,F) グラム陽性 (S. アウレウス) および (C, D, G, H) グラム陰性 (大腸菌) 細菌.(A,C,E,G)は高さ画像を示し、(B,D,F,H)は対応する偏向画像を示す。画像領域のサイズ: (A-D, G,H)20 x 20 μm, (E,F) 50 x 50 μm(I–K) AFM-IR マッピングの領域の連続選択。これは、単一のS.アウレウス細胞の例において空間分解能を高めるAFMイメージングを用いて達成される。各画像は200 x 200ポイントをサンプリングして収集され、画像領域のサイズが縮小されたために空間解像度が増加します。画像領域のサイズ: (I) 40 x 40 μm、 (J)20 x 20 μmおよび (K) 2.24 x 2.24 μm(I) の黒い四角形は、でイメージされた領域をマークします 。(J) の黒い四角形は、 (K) でイメージされた領域をマークします。この図の大きなバージョンを表示するには、ここをクリックしてください。
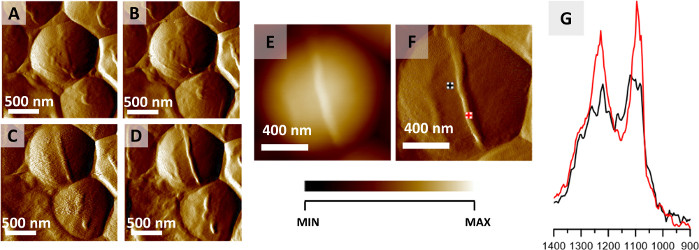
図2:AFM-IR によるS.アウレウス 細胞分裂のモニタリング(A-D) 前の細胞分裂に先行する中隔の形成を示す S.アウレウス 細胞のAFM画像。画像領域のサイズ:2 x 2 μm。画像は、より大きなシリーズ(20分ごとに12枚の画像が記録された)から選択され、AFM-IRスペクトルの収集のマークされたポイントを持つ細胞中隔形成の終わりに記録された40分(E-F)AFM高さおよび偏向画像を表す。画像領域のサイズ 1.17 x 1.15 μm。新たに形成された構造の高さは45nmである。(G) AFM-IR スペクトルは、セル領域(黒)および中隔領域(赤)(F)でマーク)、1400〜900 cm-1の範囲で記録された。両方のスペクトルをアミドIバンドに正規化し、中隔からの細胞壁成分の相対的強度の増加を示す。この図は、K.コーチャーンら22から変更されています。 この図の大きなバージョンを表示するには、ここをクリックしてください。
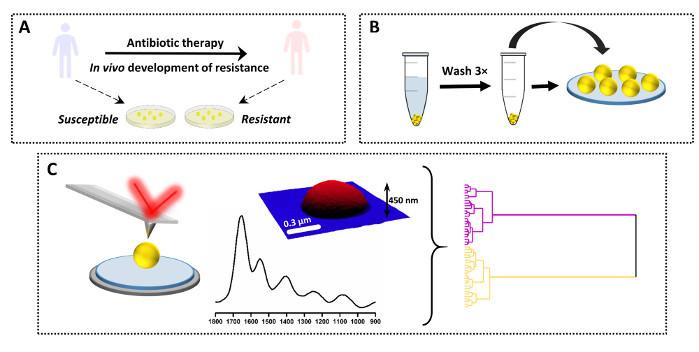
図3:抗菌性のAFM-IR研究のための実験計画の概要(A)サンプル起源および初期製剤:抗生物質治療の前に患者から親株を採取し、抗生物質療法および臨床不全(生体内抵抗性開発)後に同じ患者から娘耐性株を採取した。細菌を単離し、37°Cで16時間の心注入(HI)寒天で培養した。(B)AFM-IRの後続のサンプル調製は、細菌パレット(3×)およびサンプル沈着の洗浄に続くサンプルの採取を含む。(C) AFM-IR データ収集および分析: AFM 高さおよび AFM-IR スペクトル (1800 – 900 cm-1)。AFM画像領域のサイズ:1.7 x 1.4 μm。AFM-IRスペクトルを細胞の中央から採取した。その後、階層クラスター分析を含む化学測定アプローチを使用してデータを分析しました。この図は、K.コーチャーンら19.この図の大きなバージョンを表示するには、ここをクリックしてください。
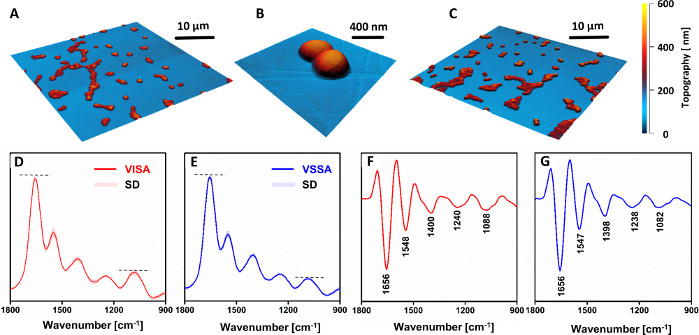
図4:臨床ペアにおけるバンコマイシン感受性S.アウレウス(VSSA)と比較したバンコマイシン中間体S.アウレウス(VISA)の化学変化に関する研究のAFMおよびAFM-IR結果。AFM 画像 (A –B) VISA および (C) VSSA 単細胞サンプル。画像領域のサイズ: (A,C) 40 x 40 μm, (B) 2.56 x 2.45 μm. (D–E) 平均 AFM-IR スペクトル及びそれらの (F–G) 2 次誘導体: (D, F) VISA および (E, G) VSSA 細胞のスペクトル範囲 1800-900 cm-1.提示されるスペクトルは、平均81(VISA)および88(VSSA)の個々のスペクトルであり、標準偏差(SD)と共に提示されます。平均化は、全ての個々のスペクトルを一緒に正規化した後に行った。主要なバンドは、(F-G)でマークされています。この図は、K.コーチャーンら19.この図の大きなバージョンを表示するには、ここをクリックしてください。

図5:AFM-IRマップの連続登録に対する画像ドリフトは 、S.アウレウス セルの選択された波数値で行われます。(上段行):AFM画像は、選択された波形値でのIR信号の強度に基づいて、対応する(一番下の行)AFM-IRマップと同時に記録された。波番号値(966,1055,1079,1106,1234,1398,1454,1540,1656,1740cm-1)は、下段の上にアポイントされています。各セット(AFM画像とAFM-IRマップ)は、前の画像の直後(セットあたり約40分)の直後に記録されました。画像/マッピング領域のサイズ:1.54 x 1.57 μm。画像の間に明確なドリフトが表示されます。 この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
その化学組成の文脈における広範囲の生物学的サンプルの特性評価のためのIR分光法の有用性は十分に確立されている。過去10年間で、IR分光法は細菌研究12、13、14、15、16、17のための有望なツールとして登場しました。化学組成を通じて表現型の特徴付けが可能な数少ない技術の1つとして、微生物学の分野に大きな関心を集め続けています。この文脈において、従来のFTIR顕微鏡の主な欠点は、限られた空間分解能にあり、単一細胞および細菌の細胞内研究を防止する。実際、細菌の小さなサイズは、IRだけでなく、技術の大半の障害を表しています。したがって、細菌の単一細胞および細胞内研究のための利用可能な研究ツールは著しく制限されています。AFMとIRの組み合わせにより、IR分光法の空間分解限界を克服することができ、化学組成のナノスケールのプローブが可能な細菌研究のための新しいツールを提供します。
この技術は単一細胞研究に限定されず、厚さの範囲の様々なサンプルを探査することを可能にする。間違いなく、クリーンで慎重なサンプル準備は、高品質の画像を実現するために重要です。本明細書のプロトコルは、様々な細菌の多層、単層、および/または単一細胞サンプルを調製する方法を提供する(図1)。調製されたサンプルは、初期細菌負荷、洗浄後希釈、および基材上のさらなる希釈を含むいくつかの要因に依存する。洗浄されたペレットを希釈した後、かつ基板上に沈着する前に得られるサンプルの量は、典型的には多数のサンプルの調製を可能にする。したがって、基板上のサンプルの所望の分布を得るために、それらの希釈に及ぶ一連のサンプルを調製することが有益であることが多い。細胞内イメージングではなくAFM-IRスペクトルの収集を目指す研究では、サンプルの量を(例えば、単層から多層に)変更することは、シグナルの強度を高めるために有益であり得る。
サンプル調製におけるもう一つの重要な側面は、培地残差の適切な除去である。選択したサンプル培養方法に応じて、サンプルは液体培地または寒天プレートから採取されます。どちらの場合も、培地残差はサンプルに存在する可能性が高いが、寒天プレートからの採取時にははるかに少ない程度に。細菌増殖培地には様々な生物学的成分が豊富に含まれているので、培地の適切な除去を確実にすることが重要です。寒天プレートサンプルには超純水で3回の清水を、培地から採取したサンプルには少なくとも4回のスメを推奨します。必要に応じて、多くの場合、この数を増やすことができます。ただし、さまざまなサンプル間で比較を行う場合は、サンプル間で一貫性を保つことが重要です。実証されたプロトコルは、リン酸緩衝液(PBS)または生理食塩水などの溶媒ではなく、水を利用する。PBSと生理乾燥の両方が空気乾燥時に結晶の形成につながり、細菌に損傷を与える可能性があります。さらに、どちらも強烈なIRバンドの源であり、PBS、特に、指紋領域に複数のバンドを含む。生理学またはPBSの使用能力の欠如は、現在、この技術に対する重要な制限を表している。通常、洗浄のための水の使用は、細菌に破壊的な影響を与えません。ただし、注意を払う必要があり、可能であれば、水の暴露の時間を制限する必要があります。サンプル調製プロトコルを洗浄の段階で一時停止する必要がある場合は、水を除去した後、ペレット状にサンプルを残しておくことをお勧めします。これは、グラム陰性細菌にとって特に重要であり、破裂しやすいほど薄い細胞壁を含む。
適切で高品質なAFM-IRデータを確保するためには、データ収集プロトコルのいくつかの側面が重要です。まず、データ取得には背景の正しい収集が不可欠です。特に、背景収集全体、およびバックグラウンドとサンプル収集の間で安定した湿度レベルの維持が必要です。これを確実にするため、窒素で器具をパージし、湿度レベルを25%以下に保つことをお勧めします。パージの欠如は、特に湿度の高い場所では、大きな制限を課すことができます。第二に、IRスポットの適切な最適化の重要性を強調すべきである。最良の結果を得るには、バンドマキシマの位置に関する予備知識が有益である可能性があります。例えば、細菌ペレットの従来のIRスペクトルを使用して、サンプルから期待されるバンドの位置を決定することができる。取得できない場合、代替アプローチとして、ユーザは、文献で入手可能なIRスペクトルを利用するか、細菌に期待される妥当なバンド位置(例えば、アミドIおよびアミドII)を用いて最適化を開始することができる。第三に、データ収集では、破壊効果を持つ可能性があるため、慎重な電力選択(良好なS/N比を達成可能)の重要性を強調することが重要です。推奨されるパワーはサンプルの厚さに依存し、機器マニュアル31で入手できる大まかなガイダンスを持っています。AFM画像の収集により、サンプルの事後測定の状態を実証的にテストすることを推奨します。さらに、AFM-IRスペクトルの収集前後の同じ領域からのAFM画像の収集は、ドリフトが発生していない、スペクトルが実際に細胞内の選択された点から発生していることを確認する良い役割を果たします。撮像モダリティを適用する際には、選択された波数値でのIR強度の連続イメージングを通じて、ドリフトの可能性が特に重要です。この例を 図 5に示します。画像領域は実験の開始時に定義されており、すべての波形値に対して一貫性を持たされるようにします。ただし、各AFM高さ(および対応するIR波数強度)画像の間には、各マップの取得時間が約40分の鮮明なドリフトが見られます。このため、画像データを収集するユーザーには、常に対象のサンプルよりもわずかに大きな領域を選択して、ドリフトが存在しても、目的のサンプルが画像領域内に残るようにすることをお勧めします。
プロトコルの潜在的な制限は、上記の生理学的溶液(例えば、生理食塩水またはPBS)における水和状態でデータを収集する能力の欠如を含む。また、特に高湿度領域では、窒素パージが必要な場合が多い。さらに、プロトコルは、より小さな構造のために使用する可能性を除いて、100 nmまでの大きさの生物を探査することを可能にする。これは別のレーザー(例えば、20nmの空間分解能を達成することを可能にする量子カスケードレーザー)を使用して克服することができるが、それはまた、限られたスペクトル範囲と同様に良好な信号対雑音比を得るの難さと関連している。最後に、柔らかい表面の探査は、先端が表面を正しく検出せず、破断するまで接触点を越えて進むという課題を提示する可能性があります。これは通常、細菌サンプルの問題ではありませんが、より柔らかいサンプルの測定時に発生する可能性があります。このような場合には、サンプルに近接して基板のクリーンな表面に係合することを推奨する。
記載されたプロトコルは、細胞内検査と同様に、様々なサンプル間の比較研究を含む、細菌研究の多数のタイプのために利用することができる。このデータは、研究の目的に応じて、単一スペクトルおよびイメージングモダリティ35に対する化学メトリックアプローチを用いて分析することができる。さらに、プロトコルは、固定の添加によって、他の生物学的物質(真菌、酵母、細胞など)への適用のために変更することもできる。
開示事項
私たちは、出版料の支払いのためにブルカーを認めたいと思います。KK、BRW、AP、PHは、このアプローチの基本的な側面の一部を説明する国際特許(PCTIB2020/052339)の発明者です。
謝辞
私たちは、ブルーカーの彼らのサポートを認めたいと思います。この作品は、モナッシュ大学の女性の成功助成金(K.コーシャン)によって支えられました。A.Y.Pは、オーストラリア国民保健医療研究評議会開業医フェローシップ(APP1117940)からの支援を認めています。この作品は、オーストラリア研究評議会ディスカバリープロジェクトDP180103484によって資金提供されました。フィンレイ・シャンクス氏のインストゥルメンタル・サポートとゼニア・コストゥリアス氏のサンプルに対する技術的支援に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| AFM metal specimen disc | PST ProSciTech Pty Ltd | GA530-15 | Recommended 15 mm |
| Anasys AFM-IR nanoIR2 | Anaysys Instruments | model: nanoIR2 | |
| Contact mode NIR2 Probes for nanoIR 2 | Bruker / Anasys Instruments | - | Model: Model: PR-EX-NIR2 |
| Heraeus Pico 17 Microcentrifuge | Thermo Scientific | - | - |
| Matlab | Mathworks Inc | - | Multivariate data analysis software |
| Micro-centrifuge tubes, 1.5 mL | Heathrow Scientific | HEA4323 | Can be replaced with any other micro-centrifuge tube |
| NanoIR 2 instrument | Bruker / Anasys Instruments | - | - |
| PLS toolbox | Mathworks Inc | - | GUI for Matlab |
| Selected bacterial medium (e.g. HBA Columbia Plates) | Thermo Fisher | PP2001 | Provided type of medium is an example and can be replaced by others, depending on the type of experiment |
| Selected bacterial strain | - | - | The source depends on the aim of research (patient isolates, ATCC strains, etc.) |
| Substrate (e.g. Raman grade CaF2) | Crystran | CAFP13-2R | Recommended size: 13 mm Ø x 2.0 mm |
| Tip pipette 1000 µl | Axygen | T-1000-B | - |
| Tip pipette 200 µl | Axygen | T-200-C | - |
| Tip pipette 0.5-10 µl | Axygen | T-300-R | - |
| Ultrapure water | - | - | - |
参考文献
- Sears, C. L. A dynamic partnership: celebrating our gut flora. Anaerobe. 11 (5), 247-251 (2005).
- Rudd, K. E., et al. regional, and national sepsis incidence and mortality, 1990-2017: analysis for the Global Burden of Disease Study. The Lancet. 395 (10219), 200-211 (2020).
- Seymour, C. W., et al. Time to treatment and mortality during mandated emergency care for sepsis. The New England Journal of Medicine. 376 (23), 2235-2244 (2017).
- Weiss, S. L., et al. Delayed antimicrobial therapy increases mortality and organ dysfunction duration in pediatric sepsis. Critical Care Medicine. 42 (11), 2409-2417 (2014).
- Peker, N., Couto, N., Sinha, B., Rossen, J. W. Diagnosis of bloodstream infections from positive blood cultures and directly from blood samples: recent developments in molecular approaches. Clinical Microbiology and Infection: The Official Publication of the European Society of Clinical Microbiology and Infectious Diseases. 24 (9), 944-955 (2018).
- Aminov, R. I. The role of antibiotics and antibiotic resistance in nature. Environmental Microbiology. 11 (12), 2970-2988 (2009).
- Levy, S. B., Marshall, B. Antibacterial resistance worldwide: causes, challenges and responses. Nature Medicine. 10 (12), 122-129 (2004).
- Roca, I., et al. The global threat of antimicrobial resistance: science for intervention. New Microbes and New Infections. 6, 22-29 (2015).
- O'Neill, J. The review on antimicrobial resistance. Tackling drug-resistant infections globally: final report and recommendations. Wellcome Trust. , (2016).
- Perry, J. A., Westman, E. L., Wright, G. D. The antibiotic resistome: what's new. Current Opinion in Microbiology. 21, 45-50 (2014).
- Piddock, L. J. Assess drug-resistance phenotypes, not just genotypes. Nature Microbiology. 1 (8), 16120 (2016).
- Naumann, D., Helm, D., Labischinski, H. Microbiological characterizations by FT-IR spectroscopy. Nature. 351 (6321), 81-82 (1991).
- Zarnowiec, P., Lechowicz, L., Czerwonka, G., Kaca, W. Fourier Transform Infrared Spectroscopy (FTIR) as a tool for the identification and differentiation of pathogenic bacteria. Current Medicinal Chemistry. 22 (14), 1710-1718 (2015).
- Quintelas, C., Ferreira, E. C., Lopes, J. A., Sousa, C. An overview of the evolution of infrared spectroscopy applied to bacterial typing. Biotechnology Journal. 13 (1), 1700449 (2018).
- San-Blas, E., Cubillán, N., Guerra, M., Portillo, E., Esteves, I. Characterization of xenorhabdus and photorhabdus bacteria by Fourier transform mid-infrared spectroscopy with attenuated total reflection (FT-IR/ATR). Spectrochimica Acta. Part A, Molecular and Biomolecular Spectroscopy. 93, 58-62 (2012).
- Sousa, C., et al. Discrimination of the acinetobacter calcoaceticus-acinetobacter baumannii complex species by Fourier transform infrared spectroscopy. European Journal of Clinical Microbiology & Infectious Diseases. 33 (8), 1345-1353 (2014).
- Rodriguez-Saona, L. E., Khambaty, F. M., Fry, F. S., Calvey, E. M. Rapid detection and identification of bacterial strains by Fourier transform near-infrared spectroscopy. Journal of Agricultural and Food Chemistry. 49 (2), 574-579 (2001).
- Dawson, S. E., et al. Implementation of Fourier transform infrared spectroscopy for the rapid typing of uropathogenic Escherichia coli. European Journal of Clinical Microbiology & Infectious Diseases. 33 (6), 983-988 (2014).
- Kochan, K., et al. Detection of Antimicrobial Resistance-Related Changes in Biochemical Composition of Staphylococcus aureus by Means of Atomic Force Microscopy-Infrared Spectroscopy. Analytical Chemistry. 91 (24), 15397-15403 (2019).
- Dazzi, A., Prater, C. B. AFM-IR: Technology and Applications in Nanoscale Infrared Spectroscopy and Chemical Imaging. Chemical Reviews. 117 (7), 5146-5173 (2017).
- Dazzi, A., et al. AFM-IR: combining atomic force microscopy and infrared spectroscopy for nanoscale chemical characterization. Applied Spectroscopy. 66 (12), 1365-1384 (2012).
- Kochan, K., et al. et al. In vivo atomic force microscopy-infrared spectroscopy of bacteria. Journal of the Royal Society, Interface. 15 (140), (2018).
- Katzenmeyer, A. M., et al. Mid-infrared spectroscopy beyond the diffraction limit via direct measurement of the photothermal effect. Nanoscale. 7 (42), 17637-17641 (2015).
- . Bruker Life Science Applications Available from: https://www.bruker.com/products/surface-and-dimensional-analysis/nanoscale-infrared-spectrometers/nanoscale-ir-spectroscopy-applications/life-sciences.html (2020)
- Mayet, C., Dazzi, A., Prazeres, R., Ortega, J. M., Jaillard, D. In situ identification and imaging of bacterial polymer nanogranules by infrared nanospectroscopy. Analyst. 135 (10), 2540-2545 (2010).
- Baldassarre, L., et al. Mapping the amide I absorption in single bacteria and mammalian cells with resonant infrared nanospectroscopy. Nanotechnology. 27 (7), 075101 (2016).
- Vitry, P., et al. Combining infrared and mode synthesizing atomic force microscopy: Application to the study of lipid vesicles inside Streptomyces bacteria. Nano Research. 9 (6), 1674-1681 (2016).
- Dazzi, A., et al. Chemical mapping of the distribution of viruses into infected bacteria with a photothermal method. Ultramicroscopy. 108 (7), 635-641 (2008).
- Steenbergen, J. N., Alder, J., Thorne, G. M., Tally, F. P. Daptomycin: a lipopeptide antibiotic for the treatment of serious Gram-positive infections. The Journal of Antimicrobial Chemotherapy. 55 (3), 283-288 (2005).
- Garcia, L. S. MacFarlan Standards. Clinical Microbiology Procedures Handbook, 3rd Edition. , (2010).
- NanolR-2 System Manual. Anasys Instruments Available from: https://www.anasysinstruments.com/downloadpr/nanoIR2_s_System_Manual.pdf (2020)
- Whelan, D. R., et al. Detection of an en masse and reversible B- to A-DNA conformational transition in prokaryotes in response to desiccation. Journal of the Royal Society, Interface. 11 (97), 20140454 (2014).
- McGuinness, W. A., Malachowa, N., DeLeo, F. R. Vancomycin Resistance in Staphylococcus aureus. The Yale Journal of Biology and Medicine. 90 (2), 269-281 (2017).
- Howden, B. P., Peleg, A. Y., Stinear, T. P. The evolution of vancomycin intermediate Staphylococcus aureus (VISA) and heterogenous-VISA. Infection, Genetics and Evolution: Journal of Molecular Epidemiology and Evolutionary Genetics in Infectious Diseases. 21, 575-582 (2014).
- Perez-Guaita, D., et al. Multispectral Atomic Force Microscopy-Infrared Nano-Imaging of Malaria Infected Red Blood Cells. Analytical Chemistry. 90 (5), 3140-3148 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved