Method Article
La microscopie à force atomique combinée à la spectroscopie infrarouge comme outil pour sonder la chimie d’une seule bactérie
Dans cet article
Résumé
La microscopie à force atomique-spectroscopie infrarouge (AFM-IR) fournit une plate-forme puissante pour les études bactériennes, permettant d’atteindre une résolution à l’échelle nanométrique. La cartographie des changements subcellulaires (p. ex., lors de la division cellulaire) ainsi que les études comparatives de la composition chimique (p. ex., découlant de la résistance aux médicaments) peuvent être menées à un seul niveau cellulaire chez les bactéries.
Résumé
La microscopie à force atomique-spectroscopie infrarouge (AFM-IR) est une nouvelle technique combinatoire permettant la caractérisation simultanée des propriétés physiques et de la composition chimique de l’échantillon avec une résolution à l’échelle nanométrique. En combinant l’AFM avec l’IR, la limitation de résolution spatiale de l’IR conventionnel est surmontée, ce qui permet d’atteindre une résolution de 20 à 100 nm. Cela ouvre la porte à un large éventail de nouvelles applications de l’IR pour sonder des échantillons inférieurs à plusieurs micromètres, auparavant irréalisables au moyen de la microscopie IR conventionnelle. L’AFM-IR est éminemment adapté à la recherche bactérienne, fournissant des informations spectrales et spatiales au niveau de la cellule unique et intracellulaire. Les préoccupations croissantes en matière de santé mondiale et les prévisions futures défavorables concernant les infections bactériennes, et en particulier le développement rapide de la résistance aux antimicrobiens, ont créé un besoin urgent d’un outil de recherche capable de sonder phénotypiquement au niveau de la cellule unique et subcellulaire. L’AFM-IR offre le potentiel de répondre à ce besoin, en permettant la caractérisation détaillée de la composition chimique d’une seule bactérie. Ici, nous fournissons un protocole complet pour la préparation des échantillons et l’acquisition de données de spectres uniques et de modalités de cartographie, pour l’application de l’AFM-IR aux études bactériennes.
Introduction
Les bactéries sont des organismes procaryotes unicellulaires, présents sous différentes formes et tailles, généralement de l’ordre de plusieurs centaines de nanomètres à micromètres. Ils existent dans une variété d’habitats et sont essentiels à l’existence de la vie. Dans le corps humain, la majorité des bactéries présentes dans l’intestin sont inoffensives et beaucoup sont en fait bénéfiques1. Cependant, plusieurs espèces bactériennes sont pathogènes et causent une gamme de maladies infectieuses. Les infections bactériennes peuvent entraîner le développement d’une septicémie et d’un choc septique: une condition potentiellement mortelle, résultant de la réponse du corps à une infection2. La septicémie est une menace majeure pour la santé mondiale, avec une prévalence élevée dans le monde entier et des taux de mortalité sévères. Rien qu’en 2017, on estime que 50 millions de cas de septicémie ont été enregistrés dans le monde, dont 11 millions ont entraîné la mort (environ 20 %)2. En outre, il a été démontré qu’une diminution des chances de survie du patient, due à un traitement retardé, se produisait de manière horaire3,4.
Les infections bactériennes sont traitées avec des antibiotiques. La gravité des conséquences potentielles des infections bactériennes de la circulation sanguine (ISC), ainsi que l’importance évidente de l’initiation rapide du traitement antimicrobien, incitent à la nécessité d’une administration immédiate d’antibiotiques. Cependant, comme les approches diagnostiques actuelles utilisées dans la pratique clinique (p. ex., la culturedu sang) nécessitent une période relativement longue, l’administration d’antibiotiques a souvent lieu avant un diagnostic positif d’IBS5. Ce facteur conduit à une surutilisation intensive des antibiotiques, ce qui, associé à une utilisation excessive d’antibiotiques dans d’autres secteurs tels que l’agriculture, crée une forte pression évolutive vers le développement d’une résistance aux antimicrobiens (RM)6,7. La RRÉA est actuellement l’un des problèmes de santé mondiaux les plus urgents7,8 et, d’ici 2050, devrait devenir la principale cause de décès9. Le développement de la résistance, ainsi que la propagation des souches DE RÉSISTANCE SE PRODUISENT À UN RYTHME ALARMANT7,8,9 ET DÉPASSENT, DE LOIN, le taux de découverte de nouveaux antibiotiques10. De nouveaux phénotypes résistants émergent continuellement dans le monde entier, tandis que
la recherche consacrée à la compréhension des changements liés à la R EST SOUVENT LENTE ET LIMITÉE PAR LES APPROCHES DISPONIBLES11. En outre, les méthodes couramment utilisées, telles que la réaction en chaîne par polymérase (PCR) et le séquençage de gènes entiers (WGS), se concentrent uniquement sur les changements génotypiques. Celles-ci ne suffisent pas à révéler les mécanismes de résistance11,ce qui entraîne un besoin urgent d’un outil de recherche permettant de comprendre la composition chimique des bactéries.
La spectroscopie infrarouge (IR) fournit une caractérisation moléculaire de l’échantillon et est donc un candidat prometteur pour le sondage bactérien phénotypique. Depuis ses premières applications12, une grande ampleur d’exemples de son utilisation a été démontrée dans la littérature13,14. Il s’agit notamment de l’identification phénotypique des bactéries du genre15,de l’espèce16et de la souche17,18. Cependant, la résolution spatiale de l’IR conventionnel est limitée à plusieurs microns en raison de la limite de résolution spatiale de diffraction de longueur d’onde19. Étant donné que la taille de la majorité des bactéries se situe en dessous de cette limite (p. ex., Staphylococcus aureus ≈ 400 nm de diamètre), l’IR conventionnel ne s’applique pas au sondage au niveau unicellulaire ou intracellulaire.
La limitation de la résolution spatiale a récemment été surmontée en combinant la spectroscopie IR avec la microscopie à force atomique (AFM-IR). Dans ce cas, l’absorption IR est détectée indirectement, par dilatation thermique du matériau19,20,21,22. En bref, l’absorption du rayonnement IR entraîne une augmentation locale de la température. Cela peut être mesuré soit directement23, soit par la mesure de l’oscillation de la sonde en porte-à-faux AFM, résultant de l’impulsion de force créée par l’absorption IR20,21. La technique combinatoire AFM-IR permet d’atteindre une résolution spatiale proche de 20 nm, fournissant des informations simultanées sur les propriétés physiques locales d’un échantillon (AFM) et sa composition chimique (AFM-IR). La collecte des deux spectres uniques à partir de points sélectionnés et la cartographie de l’intensité des valeurs de nombre d’onde sélectionnées dans une zone choisie sont possibles.
Compte tenu de la résolution spatiale réalisable de l’AFM-IR, il est évident que la technique ouvre la possibilité d’un sondage chimique/ phénotypique d’une seule cellule de bactérie et de leur composition intracellulaire24. Jusqu’à présent, plusieurs exemples de l’application de l’AFM-IR pour des bactéries uniques ont été démontrés dans la littérature19,20,21 , 22,25,26,27,28. Ceux-ci impliquent une analyse spectrale unique19,21,22 et une cartographie au niveau subcellulaire19,22,25,26,27,28. Par exemple, la capacité de détecter les vésicules lipidiques intracellulaires27 et les virus28 au sein d’une seule bactérie a été décrite. Ces résultats démontrent l’utilité de l’AFM-IR pour les études à l’échelle nanométrique de bactéries individuelles et d’agents pathogènes cliniquement pertinents19.
Par conséquent, nous présentons une méthode de préparation et de collecte d’échantillons pour les données AFM-IR d’échantillons bactériens multicouches, monocouches et unicellulaires. Le protocole décrit ici a été appliqué pour étudier différentes espèces de bactéries22 et les changements dans leur composition chimique. En particulier, le développement in vivo de la résistance à la vancomycine et de la non-susceptibilité à la daptomycine a été étudié dans des paires cliniques de S. aureus19. La résistance intermittente à la vancomycine et la non-susceptibilité à la daptomycine chez S. aureus (VISA et DpR) sont apparues relativement récemment, à la suite de l’utilisation accrue et de l’introduction de ces antibiotiques dans les cliniques, constituant un problème médical important. En outre, en particulier, le mécanisme de non-susceptibilité à la daptomycine reste insaisissable, entravant le développement de médicaments alternatifs19,29. Le protocole présenté se concentre sur la fourniture de spectres AFM-IR fiables de bactéries uniques, qui peuvent être analysés en utilisant une variété d’approches chimiométriques, selon les objectifs expérimentaux. Il comprend également l’approche cartographique, qui est applicable aux études intracellulaires.
Protocole
Tous les travaux menés avec des bactéries pathogènes doivent être entrepris avec des mesures de sécurité appropriées en place. Il s’agit notamment de travailler dans un laboratoire avec un niveau de biosécurité adéquat et dans une cabine de biosécurité (PC2) ainsi que de décontaminer soigneusement la zone de travail avec un désinfectant approprié, par exemple une solution d’éthanol à 80%. Un EPI approprié doit être porté tout le temps.
1. Préparation des solvants et des matériaux
- Solvants : Utilisez de l’eau ultrapure comme solvant. Utilisez de l’eau purifiée, autoclavée avant l’expérience pour éviter toute contamination croisée potentielle.
- Substrat: Utilisez l’un de ces substrats pour AFM-IR, par exemple, ZnSe, CaF2,BaF2,etc. Étant donné que l’AFM-IR est, en principe, une technique non destructive, on peut appliquer une variété d’autres outils de recherche au même échantillon après l’analyse AFM-IR. Par exemple, la corrélation des résultats avec la spectroscopie Raman peut être effectuée si des lames De grade Raman CaF2 ou BaF2 sont utilisées.
- Utilisez des flacons en verre au lieu de tubes en plastique, car le plastique peut contaminer l’échantillon.
2. Préparation de l’échantillon pour AFM-IR
- Croissance/incubation de l’échantillon
- Cultiver des bactéries dans des milieux liquides ou sur des plaques solides. Sélectionnez le type de milieu, les conditions de croissance (p. ex., température, disponibilité de l’oxygène) et le temps de croissance en fonction des besoins particuliers des espèces de bactéries étudiées. Par exemple, pour S. aureus Heart Infusion (HI), des plaques de gélose peuvent être utilisées, avec une croissance de 16 h à 37 °C dans des conditions aérobies.
REMARQUE: Pour obtenir les meilleurs résultats, la croissance / incubation doit produire suffisamment de bactéries qui permettraient la collecte d’une micro-pastille d’échantillon. Le nombre spécifique d’unités formant des colonies ou de cellules bactériennes dépend du type et de la taille de la bactérie.
- Cultiver des bactéries dans des milieux liquides ou sur des plaques solides. Sélectionnez le type de milieu, les conditions de croissance (p. ex., température, disponibilité de l’oxygène) et le temps de croissance en fonction des besoins particuliers des espèces de bactéries étudiées. Par exemple, pour S. aureus Heart Infusion (HI), des plaques de gélose peuvent être utilisées, avec une croissance de 16 h à 37 °C dans des conditions aérobies.
- Dépôt d’échantillons
- À l’aide d’une boucle stérile, collectez soigneusement les bactéries des colonies sur la plaque de gélose et transférez-les dans un tube en verre. Collectez les bactéries uniquement du haut des colonies. Si vous prélevez des échantillons d’une culture liquide, à l’aide d’une pipette, transférer environ 1 mL de la suspension bactérienne dans un tube en verre. Le volume peut être modifié en fonction de la charge bactérienne.
REMARQUE: Il est important d’essayer de ne pas collecter (ou de minimiser autant que possible la collecte de) tout support sous la colonie. Les étapes suivantes de la préparation de l’échantillon visent à éliminer tout résidu potentiel de milieu. La minimisation du milieu potentiel résiduel dès le début permet l’acquisition spectrale de données provenant de cellules bactériennes purifiées. Les étapes 2.2.2 et 2.2.3 s’appliquent aux échantillons préparés à partir de plaques de gélose. Pour les échantillons préparés à partir de milieux liquides, passez à l’étape 2.2.4. - Ajouter 1 mL d’eau ultrapure au tube. Vortex jusqu’à ce que la pastille bactérienne collectée ne soit plus visible au fond du tube (généralement 1 à 2 min).
- Estimer la turbidité approximative de la solution en utilisant, par exemple, les normes McFarland par comparaison visuelle30 entre la solution préparée et les normes McFarland. Si la turbidité de la suspension bactérienne semble être très faible, ajoutez plus de bactéries de la plaque en utilisant une boucle stérile et vortex à nouveau. Répéter jusqu’à ce que la turbidité approximative de la solution soit comparable aux normes McFarland 0,5 et 1. Cela donnera généralement une bonne quantité de granulés bactériens.
- Centrifuger la suspension bactérienne à 3 000 x g pendant 5 min pour obtenir une pastille.
REMARQUE: Les paramètres de centrifugation peuvent être modifiés pour obtenir une pastille bactérienne. Des précautions doivent être prises en cas d’augmentation de la force g, pour ne pas induire de rupture des bactéries (en particulier dans le cas de bactéries à Gram négatif). - À l’aide d’une pipette, retirez doucement le surnageant au-dessus de la pastille. Ajouter 1 mL d’eau ultrapure au tube et au vortex pour suspendre à nouveau la pastille. Par la suite, centrifuger l’échantillon comme cela a été fait à l’étape 2.2.4.
- Répétez la procédure de lavage (étapes 2.2.2 et 2.2.4) au moins trois fois. En cas de prélèvement de l’échantillon initial sur un milieu liquide, répétez la procédure au moins quatre fois (retrait du milieu suivi de trois lavages).
- Après le lavage final, retirez le surnageant, ajoutez de l’eau ultrapure et du vortex pendant au moins 2 min. Par la suite, déposez 5 μL de l’échantillon sur le substrat (par exemple, Grade Raman CaF2).
- Si l’épaisseur souhaitée de l’échantillon est une multicouche de bactéries, laissez l’échantillon sécher à l’air.
- Si l’épaisseur souhaitée est monocouche ou bactérienne individuelle, immédiatement après le dépôt de l’échantillon (étape 2.2.7), ajouter entre 20 et 100 μL d’eau ultrapure et mélanger doucement avec une pointe de pipette. Laisser sécher à l’air.
REMARQUE: Le volume exact d’eau peut varier d’une expérience à l’autre, car il dépend de nombreux facteurs (par exemple, la taille de l’organisme, la densité de la pastille, etc.) et est donc mieux déterminé empiriquement. La préparation d’une série d’échantillons avec des volumes variables d’eau ultrapure ajoutée permet de sélectionner un échantillon avec l’épaisseur / densité souhaitée de bactéries. L’épaisseur / densité des bactéries peut être facilement visualisée via AFM dans les étapes suivantes. Des exemples d’images AFM provenant d’échantillons monocouches et monocellulaires sont présentés à la figure 1A–H. - Montez le substrat sur un disque d’échantillon métallique AFM à l’aide de ruban adhésif double face.
- À l’aide d’une boucle stérile, collectez soigneusement les bactéries des colonies sur la plaque de gélose et transférez-les dans un tube en verre. Collectez les bactéries uniquement du haut des colonies. Si vous prélevez des échantillons d’une culture liquide, à l’aide d’une pipette, transférer environ 1 mL de la suspension bactérienne dans un tube en verre. Le volume peut être modifié en fonction de la charge bactérienne.
3. Préparation de l’instrument
REMARQUE : Les procédures instrumentales décrites ici concernent l’instrument répertorié dans la Table des matériaux. La procédure instrumentale détaillée peut différer légèrement de celle décrite ici si vous utilisez un modèle plus récent de l’instrument AFM-IR.
- Allumez et initialisez l’instrument en appuyant sur le bouton Initialiser. Assurez-vous que l’obturateur laser est en position ouverte pour le test laser.
- Si un système de purge est mis en place, purgez l’instrument avec N2 en allumant le débit de N2. Ajustez la purge d’azote pour obtenir un taux d’humidité stable (par exemple, 20%). Assurez-vous que l’humidité ne fluctue pas pendant les mesures et entre la collecte des données de fond et des échantillons. Il est recommandé de prévoir environ 20 minutes pour que les niveaux d’humidité se stabilisent.
- Chargez l’échantillon dans la chambre d’échantillonnage en appuyant sur le bouton Charger. Le chargement de l’exemple s’effectue via l’assistant logiciel. Lors de l’utilisation de l’assistant logiciel, concentrez-vous d’abord sur la pointe, en utilisant des flèches pour déplacer l’étage du microscope dans la direction Z et cliquez sur Suivant. Deuxièmement, ajustez le point de collecte de données à l’aide de flèches guidant le mouvement dans le plan et alignez le laser AFM et le détecteur AFM à l’aide des boutons situés sur le dessus de la tête AFM. Par la suite, concentrez-vous sur la surface de l’échantillon en déplaçant l’étage du microscope dans la direction Z.
REMARQUE: Des illustrations détaillées de chaque étape de chargement de l’échantillon sont fournies dans le manuel du logiciel31. Se concentrer sur l’échantillon doit être effectué avec soin. Lorsque vous approchez de la surface de l’échantillon dans la direction Z, utilisez une vitesse de moteur lente. - Approchez l’exemple sans engagement en cliquant sur le bouton Approche.
4. Collecte de données
- Arrière-plan
- Avant l’acquisition des données, collectez l’arrière-plan. Pour la collecte en arrière-plan, assurez-vous que l’obturateur laser est en position ouverte. Sélectionnez la gamme spectrale et la résolution (en fonction de l’objectif de l’analyse) ainsi que le nombre de scans et le nombre de co-moyennes d’arrière-plan. Il est généralement recommandé d’être élevés (p. ex., 1024 scans et 3 co-moyennes).
REMARQUE: En général, une résolution spectrale de 4 cm-1 ou 8 cm-1 et des plages spectrales de 3 200 cm-1-2 800 cm-1 et 1 800 cm-1-900 cm-1 sont recommandées. - Après l’acquisition de l’arrière-plan, enregistrez le fichier d’arrière-plan. Le fichier n’est pas stocké automatiquement. Modifiez la position de l’obturateur laser sur Fermer.
- Avant l’acquisition des données, collectez l’arrière-plan. Pour la collecte en arrière-plan, assurez-vous que l’obturateur laser est en position ouverte. Sélectionnez la gamme spectrale et la résolution (en fonction de l’objectif de l’analyse) ainsi que le nombre de scans et le nombre de co-moyennes d’arrière-plan. Il est généralement recommandé d’être élevés (p. ex., 1024 scans et 3 co-moyennes).
- Échantillon – spectres uniques
- Appuyez sur le bouton Engager pour vous engager dans l’exemple. Le système commencera à s’approcher de la surface de l’échantillon jusqu’à ce qu’un contact direct soit détecté.
REMARQUE: Le point de consigne utilisé dans ce travail variait entre 0,15 et 2 V et les gains de rétroaction (gain I et gain P) seraient généralement réglés sur 3 et 10. Les sondes de contact NIR2 sont couramment utilisées avec le système nanoIR2 (modèle : PR-EX-nIR2-10, fréquence de résonance (kHz) : 13 +/−4 kHz, constante de ressort (N/m) : 0,07−0,4 Nm-1). - Collectez une image AFM pour visualiser la surface. Dans un premier temps, numérisez une plus grande surface (par exemple, 50 x 50 μm) avec une résolution spatiale inférieure (par exemple, 200 x 200 points)(Figure 1I).
REMARQUE: Les données AFM-IR sont toujours collectées en mode contact, cependant, les données AFM peuvent être collectées en mode contact ou en mode tapotant. - À partir de l’image hauteur/déviation AFM, sélectionnez une zone d’intérêt spécifique et ré-imagez-la avec une résolution spatiale plus élevée(Figure 1J–K). Assurez-vous que la vitesse de collecte des données est appropriée, avec un mouvement lent de la pointe (par exemple, vitesse de balayage de 0,2 à 0,4 Hz).
- Sélectionnez le point de mesure (p. ex., une bactérie unique) et déplacez la pointe vers l’endroit.
- Alignez le laser IR. À cette fin, utilisez un numéro d’onde auquel l’échantillon sera absorbé. Pour les matières biologiques, cela peut être, par exemple, l’amide I (1655 cm-1). Assurez-vous que le filtre passe-bande est désactivé et cliquez sur Démarrer IR. Le graphique de droite dans le nanoIRmètre (FFT de la déviation affichée en amplitude vs fréquence) devrait montrer au moins un pic clair et le graphique de gauche (déviation vs temps) devrait avoir une forme d’onde périodique. Si ce n’est pas le cas, procédez à l’optimisation des points IR.
REMARQUE: Même si la transformée de Fourier rapide (FFT) et la déviation montrent le profil attendu, il est recommandé d’effectuer l’optimisation des points IR pour au moins plusieurs numéros d’onde, où des bandes sont attendues. - Optimisez les points chauds pour la collecte de données IR à l’aide des valeurs de nombre d’onde sélectionnées. Il peut être utile d’utiliser un spectre IR conventionnel des bactéries (par exemple, le spectre ATR des pastilles bactériennes) pour identifier les positions des bandes et les utiliser pour optimiser les points chauds. Sélectionnez différentes valeurs de nombre d’onde (par exemple, 8 à 10) dans différentes régions spectrales.
REMARQUE: Si le spectre IR conventionnel des bactéries d’intérêt n’a pas pu être collecté avant la collecte de données AFM-IR, les spectres bactériens disponibles dans la littérature peuvent être utilisés comme guide approximatif. Le résultat de l’optimisation d’un spot IR est une image, qui présente une carte du signal de magnitude FFT à chaque emplacement x et y. L’emplacement avec le signal le plus grand est sélectionné automatiquement. Des exemples de telles images sont donnés dans le manuel du logiciel31. - Après avoir optimisé les points IR pour les valeurs de nombre d’onde sélectionnées, définissez les paramètres de la collecte de données spectrales: région spectrale, résolution spectrale, nombre de balayages et puissance appliquée et saisissez-les dans les fenêtres appropriées du logiciel. La résolution spectrale doit correspondre à la résolution de fond et la région spectrale doit se situer dans la région spectrale pour laquelle l’arrière-plan a été collecté.
REMARQUE: Un ensemble initial générique de paramètres pourrait être: gamme spectrale: 3200 cm-1–2800 cm-1 et 1800 cm-1–900 cm-1, résolution spectrale: 4 cm-1 ou 8 cm-1, nombre de balayages: 512–2048. - Si nécessaire, ajustez la puissance du laser en fonction du signal. En général, des valeurs comprises entre 8% et 10% de la puissance du laser devraient être suffisantes pour une bonne qualité du signal. Des valeurs plus élevées peuvent être utilisées avec prudence, car elles peuvent endommager l’échantillon.
REMARQUE: Le pourcentage de puissance laser peut varier en fonction du type de laser IR. Les valeurs de pourcentage données ici sont pour le laser OPO. - Cliquez sur Acquérir pour collecter le spectre AFM-IR.
- Re-collecter les données AFM de la même zone après la collecte du spectre AFM-IR. Ceci est fortement recommandé car il révélera toute dérive potentielle et / ou influence destructrice sur l’échantillon.
- Si le spectre AFM-IR est satisfaisant et qu’aucune influence destructrice sur l’échantillon n’est observée, procéder à la collecte des données. Si nécessaire, définissez une série de points pour la collecte de données à l’aide de l’option Array et de l’image de hauteur ou de déviation AFM collectée. Cette option permet de collecter des spectres consécutifs à partir de chaque point avec les mêmes paramètres spectraux que ceux définis pour un seul spectre.
- Si l’image AFM recueillie après la collecte du spectre AFM-IR révèle une influence destructrice sur l’échantillon (généralement un point brûlé), réduisez la puissance; sélectionnez un autre endroit et répétez les étapes 4.3.8 à 4.3.11.
- Si le signal dans le spectre AFM-IR n’est pas satisfaisant, vérifiez l’exactitude de l’optimisation des points IR (étape 4.3.6). Si c’est correct, augmentez légèrement la puissance du laser et répétez les étapes 4.3.7 à 4.3.11. Cela peut être répété jusqu’à ce qu’un signal satisfaisant soit obtenu.
- Appuyez sur le bouton Engager pour vous engager dans l’exemple. Le système commencera à s’approcher de la surface de l’échantillon jusqu’à ce qu’un contact direct soit détecté.
- Exemple – approche d’imagerie
REMARQUE: Il est fortement recommandé d’enregistrer un seul spectre AFM-IR de la bactérie avant de collecter une image de distribution d’intensité pour une valeur de nombre d’onde sélectionnée.- Enregistrez une image AFM de la zone d’échantillonnage choisie. Pour ce faire, collectez d’abord une image AFM d’une zone plus grande avec une résolution spatiale inférieure (par exemple, 50 x 50 μm, 200 x 200 points), puis sélectionnez une région d’intérêt et collectez une image AFM avec une résolution spatiale accrue (comme illustré à la Figure 1I-K).
- Sélectionnez les valeurs de nombre d’onde pour l’imagerie AFM-IR.
- Assurez-vous que le point IR du laser est optimisé pour les valeurs de nombre d’onde sélectionnées (étape 4.3.6). Si le spot IR n’est pas optimisé pour certains nombres d’onde (pas de maximum clair), optimisez-le pour eux.
- Définissez les paramètres de la zone imagée : la largeur et la hauteur, le nombre de points de données dans les directions X et Y.
REMARQUE: Si la sélection consécutive de taches des images AFM précédentes est appliquée (comme illustré à la figure 1I à K), les champs de largeur et de hauteur seront automatiquement remplis lors du marquage de la zone. - Définissez les paramètres d’acquisition du signal spectral : la longueur d’onde, le nombre de balayages et la puissance du laser.
REMARQUE: Le nombre d’analyses doit être maintenu dans des limites raisonnables. 64 ou 32 scans permettent généralement une quantité suffisante de signal. - Définissez les paramètres du mouvement de la pointe AFM en cliquant sur le scan rate. Plus le nombre de scans de l’étape précédente et le nombre de points de données dans la direction X sont élevés, plus les mouvements de la pointe devront être lents. L’absence de réglage entre ces paramètres entraînera un mouvement trop rapide de la pointe, empêchant l’acquisition réelle d’un nombre défini de scans à partir de chaque point.
REMARQUE: Par exemple, pour une collection appropriée de signal IR avec 64 co-ajouts et 200 points, définissez le taux de balayage sur 0,07 kHz. - Assurez-vous que la case Activer l’imagerie IR est cochée.
- Commencez l’imagerie. L’AFM-IR de l’intensité du signal au numéro d’onde sélectionné sera collectée simultanément avec les données AFM de cette zone.
REMARQUE: Lorsque le laser OPO est utilisé, il est possible de collecter simultanément une image de fréquence de crête de résonance de contact. Cela peut être utilisé pour obtenir des informations sur la rigidité relative de l’échantillon à différents endroits. - Utilisez la fenêtre Séquence de capture pour définir une collection consécutive de données AFM-IR provenant de la même zone avec les mêmes paramètres, mais pour des valeurs de nombre d’onde différentes. Pour ce faire, ouvrez la fenêtre Séquence de capture, tapez chaque numéro d’onde et définissez la puissance laser appliquée (pour chaque numéro d’onde).
- Exportez les données collectées (AFM et AFM-IR, spectres simples et imagerie) dans différents formats et analysez-les à l’aide de méthodes adaptées à des objectifs de recherche spécifiques.
Résultats
Le protocole décrit permet d’obtenir une gamme de types de distributions cellulaires de bactéries sur le substrat, en fonction de la concentration initiale de l’échantillon et de la quantité d’eau ajoutée. La figure 1 illustre les exemples d’images AFM (hauteur et déviation) enregistrées à partir de monocouches et d’échantillons unicellulaires préparés à l’aide du protocole décrit par les bactéries Gram positif(S. aureus)et Gram négatif(Escherichia coli).
Le protocole décrit ici peut être utilisé pour l’imagerie AFM-IR des structures intra- et extra-cellulaires de bactéries uniques. Un exemple de cette application est illustré à la figure 2, qui montre les résultats de la surveillance des changements chimiques localisés spatialement se produisant lors de la division d’une cellule de S. aureus. Bien que le séchage à l’air soit généralement considéré comme une approche de fixation pour la préparation bactérienne, les bactéries, par nature, présentent une très grande résistance aux facteurs externes tels que la température et ont survécu à la déshydratation32. Les résultats présentés ici ont été obtenus à partir d’un échantillon séché à l’air. La formation d’un septum, se produisant avant la division cellulaire, a été observée et surveillée par imagerie AFM(Figure 2A–D)par la collecte de 12 images de la même zone consécutivement (collecte d’une seule image ≈ 20 min). La figure 2A–D montre 4 images AFM sélectionnées, avec un temps entre la collecte de chaque image d’environ 40 min. La structure formée (septum) mesure 45 nm de haut. Le septum formé est clairement visible dans les images de hauteur et de déviation AFM(Figure 2E–F). Les spectres AFM-IR enregistrés à partir de la zone de la cellule et du septum(figure 2G,points d’origine marqués à la figure 2F)ont été normalisés dans la bande amide I avant la comparaison, afin de minimiser l’influence de la variation de l’épaisseur de l’échantillon entre les points de collecte de données. Le spectre AFM-IR du septum est caractérisé par une intensité relative plus élevée des bandes à 1240 et 1090 cm-1 par rapport au spectre AFM-IR collecté dans la zone cellulaire. Ceux-ci sont attribués aux groupes glucidiques et phosphodiester de composants de la paroi cellulaire (y compris, par exemple, le peptidoglycane et l’acide teichoïque)22.
Le protocole décrit peut également être utilisé pour comparer un seul spectre entre un certain nombre d’échantillons différents. Un exemple de cette application avec les résultats est illustré à la Figure 3 et à la Figure 4. L’objectif de l’étude est de déterminer les changements chimiques résultant du développement in vivo de la résistance intermittente à la vancomycine chez S. aureus (VISA). À cette fin, des paires cliniques d’échantillons ont été prélevées sur des patients, la souche mère ayant été isolée lors de son admission à l’hôpital et avant l’antibiothérapie (S. aureussensible à la vancomycine, VSSA) et la souche fille isolée du même patient après l’admission d’antibiotiques et l’échec clinique. Les échantillons ont ensuite été cultivés sur un milieu agar et préparés conformément au protocole(figure 3A–B). Les spectres AFM-IR ont été prélevés à partir de plusieurs bactéries uniques (et de plusieurs échantillons) pour VSSA et VISA, puis analysés à l’aide de plusieurs approches chimiométriques(Figure 3C).
Aucune différence morphologique n’a été observée entre les cellules VSSA et VISA (Figure 4A–C). Cependant, les spectres AFM-IR (Figure 4D,F) et leurs dérivés secondaires (Figure 4E,G) ont démontré une nette différence dans la composition chimique entre les souches résistantes et sensibles. L’intensité relative des bandes associées aux groupes glucides et phosphodiesters des composants de la paroi cellulaire (en particulier, la bande à 1088 cm-1)a nettement augmenté dans la souche résistante, par rapport à la contrepartie sensible. Il est à noter que tous les spectres recodés (VISA: 81, VSSA: 88) montrent un faible écart-type. Cela démontre une bonne reproductibilité des données enregistrées à partir de divers échantillons préparés à partir de la même souche, car aucune discrimination n’était possible entre les spectres enregistrés à partir de différents échantillons de la même souche. Les différences observées indiquaient une augmentation de l’épaisseur de la paroi cellulaire dans les souches résistantes, par rapport à la contrepartie sensible, qui reste en accord avec d’autres rapports de littérature33,34.

Figure 1 : Images AFM représentatives de divers échantillons bactériens pour les mesures AFM-IR. En fonction de la dilution sur substrat, le protocole permet d’obtenir des multicouches et des monocouches de bactéries ainsi que des échantillons unicellulaires. Images AFM représentatives de: (A–D) monocouche et (E–H) échantillon unicellulaire pour (A,B,E,F) Gram positif (S. aureus) et (C,D,G,H) Gram négatif (E. coli) bactéries. (A, C, E, G) montrent des images de hauteur et (B, D, F, H) montrent des images de déviation correspondantes. Taille des zones imagées: (A-D, G, H) 20 x 20 μm, (E, F) 50 x 50 μm. (I-K) sélection consécutive d’une zone pour la cartographie AFM-IR. Ceci est réalisé en utilisant l’imagerie AFM avec une résolution spatiale croissante dans l’exemple d’une seule cellule de S. aureus. Chaque image est collectée en échantillonnant 200 x 200 points, avec une résolution spatiale croissante en raison de la réduction de la taille de la zone imagée. Taille des zones imagées: (I) 40 x 40 μm, (J) 20 x 20 μm et (K) 2,24 x 2,24 μm. Le carré noir en (I) marque la zone imagée en (J). Le carré noir en (J) marque la zone imagée en (K). Veuillez cliquer ici pour voir une version agrandie de cette figure.
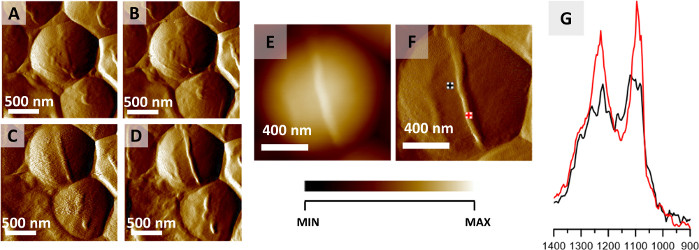
Figure 2 : Surveillance de la division cellulaire de S. aureus via AFM-IR. (A–D) Images AFM de la cellule de S. aureus montrant la formation de septum précédant la division cellulaire. Taille de la zone imagée : 2 x 2 μm. Les images ont été sélectionnées à partir d’une série plus grande (12 images enregistrées toutes les 20 minutes) et représentent des données enregistrées toutes les 40 minutes. (E-F) Image de hauteur et de déviation AFM enregistrée à la fin de la formation du septum cellulaire avec des points marqués de collecte de spectres AFM-IR. Taille de la zone imagée 1,17 x 1,15 μm. La hauteur de la structure nouvellement formée est de 45 nm. (G) Spectres AFM-IR enregistrés à partir de la zone cellulaire (noir) et de la zone septum (rouge) (marqués en (F)), dans la gamme 1400–900 cm-1. Les deux spectres ont été normalisés dans la bande amide I et démontrent une augmentation de l’intensité relative des composants de la paroi cellulaire du septum. Ce chiffre a été modifié à partir de K. Kochan et al.22. Veuillez cliquer ici pour voir une version agrandie de cette figure.
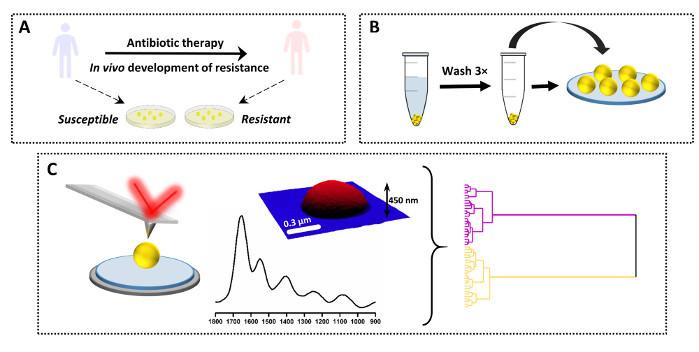
Figure 3 : Aperçu de la conception expérimentale de l’étude AFM-IR de la résistance aux antimicrobiens. (A) Origine de l’échantillon et préparation initiale : la souche mère sensible a été prélevée sur un patient avant l’antibiothérapie et la souche fille résistante provient du même patient après l’antibiothérapie et l’échec clinique (développement d’une résistance in vivo). Les bactéries ont été isolées et cultivées sur une gélose pour perfusion cardiaque (IH) pendant 16 h à 37 °C. (B) Préparation ultérieure de l’échantillon pour L’AFM-IR, y compris le prélèvement de l’échantillon suivi du lavage de la palette bactérienne (3×) et du dépôt de l’échantillon. (C) Collecte et analyse de données AFM-IR: hauteur AFM et spectre AFM-IR (1800–900 cm-1). Taille de la zone imagée AFM : 1,7 x 1,4 μm. Le spectre AFM-IR a été collecté au milieu de la cellule. Les données ont ensuite été analysées à l’aide d’approches chimiométriques, y compris l’analyse hiérarchique par grappes. Ce chiffre a été modifié à partir de K. Kochan et al.19. Veuillez cliquer ici pour voir une version agrandie de cette figure.
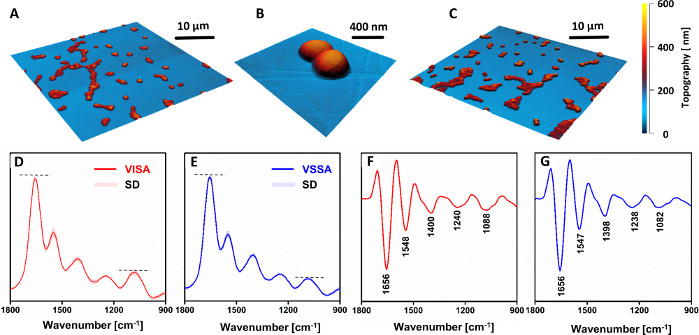
Figure 4 : Résultats AFM et AFM-IR de l’étude des changements chimiques dans la vancomycine intermédiaire S. aureus (VISA) par rapport à S. aureus sensible à la vancomycine (VSSA) dans des paires cliniques. Images AFM d’échantillons monocellulaires (A–B) VISA et (C) VSSA. Taille des zones imagées: (A,C) 40 x 40 μm, (B) 2,56 x 2,45 μm. (D–E) Spectres AFM-IR moyens et leurs (F–G) dérivées secondes pour: (D,F) VISA et (E,G) VSSA cellules, dans la gamme spectrale 1800–900 cm-1. Les spectres présentés sont une moyenne de 81 (VISA) et 88 (VSSA) spectres individuels et sont présentés avec l’écart-type (SD). La moyenne a été effectuée après normalisation de tous les spectres individuels ensemble. Les bandes principales sont marquées en (F–G). Ce chiffre a été modifié à partir de K. Kochan et al.19. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Dérive de l’image sur l’enregistrement consécutif des cartes AFM-IR aux valeurs de nombre d’onde sélectionnées pour la cellule de S. aureus. (Ligne du haut) : Les images AFM ont été enregistrées simultanément avec les cartes AFM-IR correspondantes(ligne du bas)en fonction de l’intensité du signal IR aux valeurs de nombre d’onde sélectionnées. Les valeurs des numéros d’onde (966, 1055, 1079, 1106, 1234, 1398, 1454, 1540, 1656, 1740 cm-1) sont annotées au-dessus de la rangée du bas. Chaque ensemble (image AFM et carte AFM-IR) a été enregistré directement après l’image précédente (environ 40 minutes par série). La taille de la zone imagée/cartographiée : 1,54 x 1,57 μm. Une dérive claire est visible entre les images. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
L’utilité de la spectroscopie IR pour la caractérisation d’un large éventail d’échantillons biologiques dans le contexte de leur composition chimique est bien établie. Au cours de la dernière décennie, la spectroscopie IR est apparue comme un outil prometteur pour les études bactériennes12,13,14,15,16,17. Il continue d’attirer un intérêt substantiel dans le domaine de la microbiologie, comme l’une des rares techniques permettant une caractérisation phénotypique à travers la composition chimique. Dans ce contexte, l’inconvénient majeur de la microscopie FTIR conventionnelle réside dans la résolution spatiale limitée, empêchant les études unicellulaires et subcellulaires des bactéries. En fait, la petite taille des bactéries représente un obstacle non seulement pour l’IR, mais pour la grande majorité des techniques. Ainsi, les outils de recherche disponibles pour les études unicellulaires et subcellulaires des bactéries sont considérablement limités. La combinaison de l’AFM avec l’IR permet de surmonter la limitation de la résolution spatiale de la spectroscopie IR, fournissant un nouvel outil pour la recherche bactérienne, capable de sonder la composition chimique à l’échelle nanométrique.
La technique ne se limite pas aux études sur une seule cellule et permet de sonder une variété d’échantillons, dont l’épaisseur varie. Sans aucun doute, une préparation propre et minutieuse des échantillons est essentielle pour obtenir des images de haute qualité. Le protocole ci-après fournit une méthode pour préparer des échantillons multicouches, monocouches et/ou unicellulaires de diverses bactéries (Figure 1). L’échantillon préparé dépend de plusieurs facteurs, notamment la charge bactérienne initiale, la dilution post-lavage ainsi que la dilution ultérieure sur le substrat. La quantité d’échantillon obtenue après dilution des granulés lavés et avant le dépôt sur le substrat permet généralement la préparation de nombreux échantillons. Par conséquent, pour obtenir la distribution souhaitée de l’échantillon sur le substrat, il est souvent avantageux de préparer une série d’échantillons, allant dans leur dilution. Pour les études visant à présaurvirons des spectres AFM-IR plutôt qu’à l’imagerie subcellulaire, la modification de la quantité d’échantillon (par exemple, de monocouche à multicouche) peut être bénéfique pour augmenter l’intensité du signal.
Un autre aspect critique de la préparation des échantillons est l’élimination appropriée des résidus moyens. Selon les méthodes de culture de l’échantillon sélectionnées, l’échantillon est prélevé soit dans un milieu liquide, soit dans une plaque de gélose. Dans les deux cas, le milieu résiduel est susceptible d’être présent dans l’échantillon, bien que dans une bien moindre mesure lors de la collecte sur des plaques d’agar. Comme les milieux de croissance bactériens contiennent une abondance de divers composants biologiques, il est essentiel d’assurer une élimination appropriée du milieu. Nous recommandons trois lavages à l’eau ultrapure pour les échantillons de plaques de gélose et au moins quatre lavages pour les échantillons prélevés sur le milieu. Le nombre de lavages peut être augmenté, si nécessaire; toutefois, pour la comparaison entre les différents échantillons, il est important de la maintenir cohérente entre les échantillons. Le protocole démontré utilise de l’eau, plutôt que des solvants tels que la solution tampon de phosphate (PBS) ou la solution saline. Le PBS et la solution saline entraînent la formation de cristaux lors du séchage à l’air, ce qui peut endommager les bactéries. En outre, les deux sont une source de bandes IR intenses, avec PBS, en particulier, contenant plusieurs bandes dans la région des empreintes digitales. Le manque de capacité pour l’utilisation de solution saline ou PBS, représente actuellement une limitation importante pour la technique. En règle générale, l’utilisation d’eau pour le lavage ne provoque aucune influence destructrice sur les bactéries; cependant, il faut faire attention et, si possible, limiter le temps d’exposition à l’eau. Si le protocole de préparation de l’échantillon doit être mis en pause au stade du lavage, il est recommandé de laisser l’échantillon sous forme de granulés après avoir retiré l’eau. Ceci est particulièrement important pour les bactéries à Gram négatif, contenant une paroi cellulaire plus mince car elles sont plus sujettes à la rupture.
Pour garantir des données AFM-IR appropriées et de haute qualité, plusieurs aspects du protocole de collecte de données sont d’une importance cruciale. Tout d’abord, la collecte correcte de l’arrière-plan est essentielle pour l’acquisition de données. En particulier, le maintien de niveaux d’humidité stables tout au long de la collecte de fond ainsi qu’entre la collecte de fond et la collecte d’échantillons est nécessaire. Pour ce faire, nous vous recommandons de purger l’instrument avec de l’azote et de maintenir les niveaux d’humidité ne dépassant pas 25%. L’absence de purge peut imposer une limitation importante, en particulier dans les endroits très humides. Deuxièmement, l’importance d’une bonne optimisation des taches IR doit être soulignée. Pour de meilleurs résultats, une connaissance a priori de la position des maxima de bande peut être bénéfique. Par exemple, un spectre IR conventionnel de pastille bactérienne peut être utilisé pour déterminer les positions des bandes attendues d’un échantillon. S’il n’est pas possible d’acquérir, comme autre approche, l’utilisateur peut utiliser les spectres IR disponibles dans la littérature ou commencer l’optimisation en utilisant une position de bande à laquelle il est raisonnable de s’attendre dans la bactérie (par exemple, l’amide I et l’amide II). Troisièmement, pour la collecte de données, il est important de souligner l’importance d’une sélection minutieuse de la puissance (permettant d’obtenir un bon rapport S / N), car elle peut avoir un effet destructeur. La puissance conseillée dépend de l’épaisseur de l’échantillon, avec un guidage approximatif disponible dans le manuel de l’instrument31. Nous recommandons de tester empiriquement l’état de l’échantillon après la mesure par la collecte d’une image AFM, car cela révélera toute influence destructrice. En outre, la collecte d’images AFM de la même zone avant et après la collecte des spectres AFM-IR sert de bonne confirmation qu’aucune dérive ne s’est produite et que les spectres proviennent effectivement du point sélectionné dans la cellule. La possibilité de dérive est particulièrement importante lors de l’application de la modalité d’imagerie, par le biais d’une imagerie consécutive de l’intensité IR à des valeurs de nombre d’onde sélectionnées. Un exemple de ceci est illustré à la figure 5. La zone imagée a été définie au début de l’expérience et est censée être cohérente pour toutes les valeurs de nombre d’onde. Cependant, une dérive claire est visible entre chaque image de hauteur AFM (et l’intensité du numéro d’onde IR correspondant), avec un temps d’acquisition de chaque carte d’environ 40 min. Pour cette raison, pour les utilisateurs qui collectent des données d’imagerie, nous recommandons de toujours sélectionner une zone légèrement plus grande que l’échantillon d’intérêt, afin de s’assurer que même en cas d’existence de dérive, l’échantillon d’intérêt restera dans la zone imagée.
Les limites potentielles du protocole comprennent le manque de capacité à recueillir des données à l’état hydraté dans les solutions physiologiques (p. ex., solution saline ou PBS) décrites ci-dessus. De plus, en particulier dans les zones à forte humidité, il est souvent nécessaire de purger l’azote. En outre, le protocole permet de sonder des organismes jusqu’à 100 nm de taille, excluant la possibilité de son utilisation pour des structures plus petites. Bien que cela puisse être surmonté à l’aide d’un laser différent (par exemple, un laser à cascade quantique permettant d’atteindre une résolution spatiale de 20 nm), il est également associé à une portée spectrale limitée ainsi qu’à des difficultés à obtenir un bon rapport signal/ bruit. Enfin, le sondage des surfaces molles peut présenter un défi, la pointe ne détectant pas correctement la surface et se dirigeant au-delà du point de contact, jusqu’à la rupture. Bien que ce ne soit généralement pas un problème avec les échantillons bactériens, cela peut se produire lors de mesures d’échantillons plus mous. Dans de tels cas, il est recommandé d’essayer de s’engager sur la surface propre du substrat à proximité de l’échantillon.
Le protocole décrit peut être utilisé pour de nombreux types de recherche bactérienne, y compris des études comparatives entre divers échantillons ainsi que des examens subcellulaires. Les données peuvent être analysées à l’aide d’approches chimiométriques pour des spectres uniques et des modalités d’imagerie35, en fonction de l’objectif de la recherche. En outre, le protocole peut également être modifié pour une application à d’autres matériels biologiques (tels que des champignons, des levures, des cellules, etc.), par l’ajout de fixation.
Déclarations de divulgation
Nous tenons à remercier Bruker pour le paiement des frais de publication. KK, BRW, AP et PH sont des inventeurs sur un brevet international (PCTIB2020/052339), qui décrit certains des aspects fondamentaux de l’approche.
Remerciements
Nous tenons à remercier Bruker pour son soutien. Ce travail a été soutenu par la bourse Monash University Advancing Women’s Success Grant (K. Kochan). A.Y.P reconnaît le soutien d’une bourse de praticien du Conseil national australien de la santé et de la recherche médicale (APP1117940). Ce travail a été financé par un projet de découverte du Conseil australien de la recherche DP180103484. Nous tenons à remercier M. Finlay Shanks pour son soutien instrumental et Mme Xenia Kostoulias pour son assistance technique avec les échantillons.
matériels
| Name | Company | Catalog Number | Comments |
| AFM metal specimen disc | PST ProSciTech Pty Ltd | GA530-15 | Recommended 15 mm |
| Anasys AFM-IR nanoIR2 | Anaysys Instruments | model: nanoIR2 | |
| Contact mode NIR2 Probes for nanoIR 2 | Bruker / Anasys Instruments | - | Model: Model: PR-EX-NIR2 |
| Heraeus Pico 17 Microcentrifuge | Thermo Scientific | - | - |
| Matlab | Mathworks Inc | - | Multivariate data analysis software |
| Micro-centrifuge tubes, 1.5 mL | Heathrow Scientific | HEA4323 | Can be replaced with any other micro-centrifuge tube |
| NanoIR 2 instrument | Bruker / Anasys Instruments | - | - |
| PLS toolbox | Mathworks Inc | - | GUI for Matlab |
| Selected bacterial medium (e.g. HBA Columbia Plates) | Thermo Fisher | PP2001 | Provided type of medium is an example and can be replaced by others, depending on the type of experiment |
| Selected bacterial strain | - | - | The source depends on the aim of research (patient isolates, ATCC strains, etc.) |
| Substrate (e.g. Raman grade CaF2) | Crystran | CAFP13-2R | Recommended size: 13 mm Ø x 2.0 mm |
| Tip pipette 1000 µl | Axygen | T-1000-B | - |
| Tip pipette 200 µl | Axygen | T-200-C | - |
| Tip pipette 0.5-10 µl | Axygen | T-300-R | - |
| Ultrapure water | - | - | - |
Références
- Sears, C. L. A dynamic partnership: celebrating our gut flora. Anaerobe. 11 (5), 247-251 (2005).
- Rudd, K. E., et al. regional, and national sepsis incidence and mortality, 1990-2017: analysis for the Global Burden of Disease Study. The Lancet. 395 (10219), 200-211 (2020).
- Seymour, C. W., et al. Time to treatment and mortality during mandated emergency care for sepsis. The New England Journal of Medicine. 376 (23), 2235-2244 (2017).
- Weiss, S. L., et al. Delayed antimicrobial therapy increases mortality and organ dysfunction duration in pediatric sepsis. Critical Care Medicine. 42 (11), 2409-2417 (2014).
- Peker, N., Couto, N., Sinha, B., Rossen, J. W. Diagnosis of bloodstream infections from positive blood cultures and directly from blood samples: recent developments in molecular approaches. Clinical Microbiology and Infection: The Official Publication of the European Society of Clinical Microbiology and Infectious Diseases. 24 (9), 944-955 (2018).
- Aminov, R. I. The role of antibiotics and antibiotic resistance in nature. Environmental Microbiology. 11 (12), 2970-2988 (2009).
- Levy, S. B., Marshall, B. Antibacterial resistance worldwide: causes, challenges and responses. Nature Medicine. 10 (12), 122-129 (2004).
- Roca, I., et al. The global threat of antimicrobial resistance: science for intervention. New Microbes and New Infections. 6, 22-29 (2015).
- O'Neill, J. The review on antimicrobial resistance. Tackling drug-resistant infections globally: final report and recommendations. Wellcome Trust. , (2016).
- Perry, J. A., Westman, E. L., Wright, G. D. The antibiotic resistome: what's new. Current Opinion in Microbiology. 21, 45-50 (2014).
- Piddock, L. J. Assess drug-resistance phenotypes, not just genotypes. Nature Microbiology. 1 (8), 16120 (2016).
- Naumann, D., Helm, D., Labischinski, H. Microbiological characterizations by FT-IR spectroscopy. Nature. 351 (6321), 81-82 (1991).
- Zarnowiec, P., Lechowicz, L., Czerwonka, G., Kaca, W. Fourier Transform Infrared Spectroscopy (FTIR) as a tool for the identification and differentiation of pathogenic bacteria. Current Medicinal Chemistry. 22 (14), 1710-1718 (2015).
- Quintelas, C., Ferreira, E. C., Lopes, J. A., Sousa, C. An overview of the evolution of infrared spectroscopy applied to bacterial typing. Biotechnology Journal. 13 (1), 1700449 (2018).
- San-Blas, E., Cubillán, N., Guerra, M., Portillo, E., Esteves, I. Characterization of xenorhabdus and photorhabdus bacteria by Fourier transform mid-infrared spectroscopy with attenuated total reflection (FT-IR/ATR). Spectrochimica Acta. Part A, Molecular and Biomolecular Spectroscopy. 93, 58-62 (2012).
- Sousa, C., et al. Discrimination of the acinetobacter calcoaceticus-acinetobacter baumannii complex species by Fourier transform infrared spectroscopy. European Journal of Clinical Microbiology & Infectious Diseases. 33 (8), 1345-1353 (2014).
- Rodriguez-Saona, L. E., Khambaty, F. M., Fry, F. S., Calvey, E. M. Rapid detection and identification of bacterial strains by Fourier transform near-infrared spectroscopy. Journal of Agricultural and Food Chemistry. 49 (2), 574-579 (2001).
- Dawson, S. E., et al. Implementation of Fourier transform infrared spectroscopy for the rapid typing of uropathogenic Escherichia coli. European Journal of Clinical Microbiology & Infectious Diseases. 33 (6), 983-988 (2014).
- Kochan, K., et al. Detection of Antimicrobial Resistance-Related Changes in Biochemical Composition of Staphylococcus aureus by Means of Atomic Force Microscopy-Infrared Spectroscopy. Analytical Chemistry. 91 (24), 15397-15403 (2019).
- Dazzi, A., Prater, C. B. AFM-IR: Technology and Applications in Nanoscale Infrared Spectroscopy and Chemical Imaging. Chemical Reviews. 117 (7), 5146-5173 (2017).
- Dazzi, A., et al. AFM-IR: combining atomic force microscopy and infrared spectroscopy for nanoscale chemical characterization. Applied Spectroscopy. 66 (12), 1365-1384 (2012).
- Kochan, K., et al. et al. In vivo atomic force microscopy-infrared spectroscopy of bacteria. Journal of the Royal Society, Interface. 15 (140), (2018).
- Katzenmeyer, A. M., et al. Mid-infrared spectroscopy beyond the diffraction limit via direct measurement of the photothermal effect. Nanoscale. 7 (42), 17637-17641 (2015).
- . Bruker Life Science Applications Available from: https://www.bruker.com/products/surface-and-dimensional-analysis/nanoscale-infrared-spectrometers/nanoscale-ir-spectroscopy-applications/life-sciences.html (2020)
- Mayet, C., Dazzi, A., Prazeres, R., Ortega, J. M., Jaillard, D. In situ identification and imaging of bacterial polymer nanogranules by infrared nanospectroscopy. Analyst. 135 (10), 2540-2545 (2010).
- Baldassarre, L., et al. Mapping the amide I absorption in single bacteria and mammalian cells with resonant infrared nanospectroscopy. Nanotechnology. 27 (7), 075101 (2016).
- Vitry, P., et al. Combining infrared and mode synthesizing atomic force microscopy: Application to the study of lipid vesicles inside Streptomyces bacteria. Nano Research. 9 (6), 1674-1681 (2016).
- Dazzi, A., et al. Chemical mapping of the distribution of viruses into infected bacteria with a photothermal method. Ultramicroscopy. 108 (7), 635-641 (2008).
- Steenbergen, J. N., Alder, J., Thorne, G. M., Tally, F. P. Daptomycin: a lipopeptide antibiotic for the treatment of serious Gram-positive infections. The Journal of Antimicrobial Chemotherapy. 55 (3), 283-288 (2005).
- Garcia, L. S. MacFarlan Standards. Clinical Microbiology Procedures Handbook, 3rd Edition. , (2010).
- NanolR-2 System Manual. Anasys Instruments Available from: https://www.anasysinstruments.com/downloadpr/nanoIR2_s_System_Manual.pdf (2020)
- Whelan, D. R., et al. Detection of an en masse and reversible B- to A-DNA conformational transition in prokaryotes in response to desiccation. Journal of the Royal Society, Interface. 11 (97), 20140454 (2014).
- McGuinness, W. A., Malachowa, N., DeLeo, F. R. Vancomycin Resistance in Staphylococcus aureus. The Yale Journal of Biology and Medicine. 90 (2), 269-281 (2017).
- Howden, B. P., Peleg, A. Y., Stinear, T. P. The evolution of vancomycin intermediate Staphylococcus aureus (VISA) and heterogenous-VISA. Infection, Genetics and Evolution: Journal of Molecular Epidemiology and Evolutionary Genetics in Infectious Diseases. 21, 575-582 (2014).
- Perez-Guaita, D., et al. Multispectral Atomic Force Microscopy-Infrared Nano-Imaging of Malaria Infected Red Blood Cells. Analytical Chemistry. 90 (5), 3140-3148 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon