Method Article
Atomik Kuvvet Mikroskopisi, Tek Bakteri Kimyasını Araştırmak için Bir Araç Olarak Kızılötesi Spektroskopi ile Birleştirildi
Bu Makalede
Özet
Atomik Kuvvet Mikroskopisi-Kızılötesi Spektroskopi (AFM-IR), bakteriyel çalışmalar için güçlü bir platform sağlayarak nano ölçekli çözünürlük elde etmeyi sağlar. Her ikisi de, hücre altı değişikliklerin haritalandırılması (örneğin, hücre bölünmesi üzerine) ve kimyasal bileşimin karşılaştırmalı çalışmaları (örneğin, ilaç direncinden kaynaklanan) bakterilerde tek bir hücre düzeyinde yapılabilir.
Özet
Atomik Kuvvet Mikroskopisi-Kızılötesi Spektroskopi (AFM-IR), nano ölçekli çözünürlükle numunenin fiziksel özelliklerinin ve kimyasal bileşiminin eşzamanlı olarak karakterize edilmesine olanak tanıyan yeni bir kombinatoryal tekniktir. AFM ile IR birleştirilerek, geleneksel IR'nin uzamsal çözünürlük sınırlaması aşılarak 20-100 nm çözünürlüğe ulaşılmıştır. Bu, daha önce geleneksel IR mikroskopisi ile ulaşılamaz olan birkaç mikrometreden daha küçük numuneleri yoklama yolunda geniş bir IR uygulaması yelpazesine kapı açar. AFM-IR, bakteriyel araştırmalar için son derece uygundur ve tek hücre ve hücre içi düzeyde hem spektral hem de mekansal bilgi sağlar. Bakteriyel enfeksiyonlarla ilgili artan küresel sağlık endişeleri ve olumsuz gelecek tahmini ve özellikle antimikrobiyal direncin hızlı gelişimi, tek hücre ve hücre altı düzeyde fenotipik problama yapabilen bir araştırma aracına acil bir ihtiyaç yaratmıştır. AFM-IR, tek bir bakterinin kimyasal bileşiminin ayrıntılı olarak nitelendirilmesini sağlayarak bu ihtiyacı giderme potansiyeli sunar. Burada, AFM-IR'nin bakteriyel çalışmalara uygulanması için tek spektrumlu ve haritalama modalitesinin örnek hazırlanması ve veri alımı için eksiksiz bir protokol sunuyoruz.
Giriş
Bakteriler, tipik olarak mikrometrelere birkaç yüz nanometre aralığında, çeşitli şekil ve boyutlarda meydana gelen tek hücreli prokaryotik organizmalardır. Çeşitli habitatlarda bulunurlar ve yaşamın varlığı için gereklidirler. İnsan vücudunda, bağırsakta bulunan bakterilerin çoğu zararsızdır ve birçoğuaslındafaydalıdır 1 . Bununla birlikte, birkaç bakteri türü patojeniktir ve bir dizi bulaşıcı hastalığa neden olur. Bakteriyel enfeksiyonlar sepsis ve septik şok gelişimine yol açabilir: vücudun bir enfeksiyona yanıt verinden kaynaklanan hayatı tehdit eden bir durum2. Sepsis, dünya çapında yüksek yaygınlık ve ağır ölüm oranları ile küresel bir büyük sağlık tehdididir. Sadece 2017 yılında, dünya çapında tahmini 50 milyon sepsis vakası kaydedildi ve bunların 11 milyonunun ölümle sonuçlanması (yaklaşık% 20)2. Ayrıca, gecikmiş tedavi nedeniyle hastanın hayatta kalma şansında bir azalma olduğu gösterilmiştir3,4.
Bakteriyel enfeksiyonlar antibiyotiklerle tedavi edilir. Bakteriyel kan dolaşımı enfeksiyonlarının (BSI' ler) potansiyel sonuçlarının şiddeti ve antimikrobiyal tedavinin hızlı başlatılmasının açık bir önemi, acil antibiyotik tedavisi ihtiyacını doğurur. Bununla birlikte, klinik uygulamada kullanılan mevcut tanı yaklaşımları (örneğin, kan kültleme) nispeten uzun bir süre gerektirdiği için, antibiyotik uygulaması genellikle pozitif BSI tanısından önce ortaya çıkar5. Bu faktör, tarım gibi diğer sektörlerde aşırı antibiyotik kullanımı ile birlikte antimikrobiyal direncin (AMR)gelişimineyönelik şiddetli bir evrimsel baskı yaratan antibiyotiklerin aşırı kullanımına yol açar 6,7. AMR şu anda en acil küresel sağlık sorunlarından biridir7,8 ve, 2050 yılına kadar, önde gelen ölüm nedeni olması öngörülür9. Direncin gelişimi, AMR suşlarının yayılması ile birlikte endişe verici bir hızda meydana geliyor7,8,9 ve açık ara yeni antibiyotiklerin keşif oranını aşıyor10. Yeni dirençli fenotipler dünya çapında sürekli olarak ortaya çıkarken,
AMR ile ilgili değişiklikleri anlamaya yönelik araştırmalar genellikle yavaştır ve mevcut yaklaşımlar ile sınırlıdır11. Ek olarak, polimeraz zincir reaksiyonu (PCR) ve tüm gen dizilimi (WGS) gibi yaygın olarak kullanılan yöntemler sadece genotipik değişikliklere odaklanır. Bunlar direnç mekanizmalarını ortaya çıkarmak için yeterli değildir11Bakterilerin kimyasal bileşimini anlamaya yönelik acil bir araştırma aracına ihtiyaç duyar.
Kızılötesi spektroskopi (IR) numunenin moleküler bir karakterizasyonunu sağlar ve bu nedenle fenotipik bakteriyel problama için umut verici bir adaydır. İlk uygulamalarından bu yana12, kullanım örneklerinin büyük bir büyüklüğü literatürde gösterilmiştir13,14. Bunlar arasında 15 , tür16ve suş17,18seviyesindeki bakterilerin fenotipik bazlı tanımlanması bulunur. Bununla birlikte, geleneksel IR'nin uzamsal çözünürlüğü dalga boyu kırınım uzamsal çözünürlük sınırı19nedeniyle birkaç mikron ile sınırlıdır. Bakterilerin çoğunluğunun büyüklüğü bu sınırın altında olduğundan (örneğin, Staphylococcus aureus ≈ 400 nm çapında), geleneksel IR tek hücreli veya hücre içi düzeyde yoklama için geçerli değildir.
Mekansal çözünürlük sınırlaması yakın zamanda IR spektroskopisi ile Atomik Kuvvet Mikroskopisi (AFM-IR) birleştirilerek aşıldı. Bu durumda, IR emilimi dolaylı olarak, malzemenin termal genişlemesi yoluyla19,20 ,21,22. Kısacası, IR radyasyonunun emilimi yerel bir sıcaklık artışına neden olur. Bu doğrudan 23 veya IR emilimi 20,21 tarafından oluşturulan kuvvet dürtüsü sonucu AFM cantileverprob salınım ölçümü yoluyla ölçülebilir. Kombinatory AFM-IR tekniği, 20 nm'ye yaklaşan uzamsal çözünürlüğe ulaşmayı sağlayarak bir numunenin (AFM) ve kimyasal bileşiminin (AFM-IR) yerel fiziksel özellikleri hakkında eşzamanlı bilgi sağlar. Seçilen noktalardan her ikisinin de toplanması ve seçilen bir alan içindeki seçili dalga sayısı değerlerinin yoğunluğunun haritalandırılması mümkündür.
AFM-IR'nin ulaşılabilir mekansal çözünürlüğü göz önüne alındığında, tekniğin tek bakteri hücresinin kimyasal / fenotipik problama olasılığını ve hücre içi bileşimlerini24açtığı açıktır. Hitherto, AFM-IR'nin tek bakteri için uygulanmasının çeşitli örnekleri literatürdegösterilmiştir 19,20,21,22,25,26,27,28. Bunlar tek spektral analiz19,21,22 ve alt hücre düzeyinde haritalama içerir19,22,25,26,27,28. Örneğin, hücre içi lipid veziklinleri27 ve virüsleri28 tek bakteri içinde tespit etme yeteneği tanımlanmıştır. Bu sonuçlar, AFM-IR'nin tek bakterilerin ve klinik olarak ilgili patojenlerin nano ölçekli çalışmaları için yararlılığını göstermektedir19.
Bu nedenle, çok katmanlı, monolayer ve tek hücreli bakteri örneklerinin AFM-IR verileri için örnek bir hazırlama ve toplama yöntemi sunuyoruz. Burada açıklanan protokol, farklı bakteri türleri22'yi ve kimyasal bileşimlerindeki değişiklikleri incelemek için uygulanmıştır. Özellikle, S. aureus19'unklinik çiftlerinde vankomisiyan direnç ve daptomisiyan duyarlılıksızlığın in vivo gelişimi araştırılmıştır. Her ikisi de, S. aureus'ta (VISA ve DpR) vankomisinin aralıklı direnci ve daptomisiyan duyarlılık nispeten yakın zamanda ortaya çıktı, bu antibiyotiklerin kliniklere kullanımının ve tanıtılmasının ardından önemli bir tıbbi sorun ortaya çıktı. Ayrıca, özellikle, daptomisiyan duyarlılık mekanizması hala zor olmaya devam ediyor ve alternatif ilaç geliştirmeyi19,29. Sunulan protokol, deneysel amaçlara göre çeşitli kemometrik yaklaşımlar kullanılarak daha fazla analiz edilebilen tek bakterilerin güvenilir AFM-IR spektrumlarının sağlanmasına odaklanmıştır. Ayrıca hücre içi çalışmalar için geçerli olan haritalama yaklaşımını içerir.
Protokol
Patojenik bakterilerle yapılan tüm çalışmalar uygun güvenlik önlemleri alınarak yapılmalıdır. Bunlar arasında yeterli biyogüvenlik seviyesine sahip bir laboratuvarda ve biyogüvenlik kabininde (PC2) çalışmanın yanı sıra çalışma alanının uygun bir dezenfektanla dikkatli bir şekilde arındırılma, örneğin% 80 etanol çözeltisi sayılabilir. Uygun KKD her zaman giyilmelidir.
1. Çözücülerin ve malzemelerin hazırlanması
- Çözücüler: Çözücü olarak ultra saf su kullanın. Olası çapraz kontaminasyonu önlemek için deneyden önce otomatik olarak kapatılmış arıtılmış su kullanın.
- Substrat: AfM-IR için bu yüzeylerden herhangi birini kullanın, örneğin, ZnSe, CaF2,BaF2,vb. AFM-IR, prensip olarak tahribatsız bir teknik olduğundan, AFM-IR analizi sonrası aynı örneklem için çeşitli diğer araştırma araçları uygulanabilir. Örneğin, Raman sınıf CaF2 veya BaF2 slaytları kullanılıyorsa, sonuçların Raman spektroskopisi ile korelasyonu yapılabilir.
- Plastik numuneyi kirletebileceğinden plastik tüpler yerine cam şişeler kullanın.
2. AFM-IR için örnek hazırlık
- Numunenin büyümesi/inkübasyonu
- Bakterileri sıvı ortamda veya katı plakalarda yetiştirin. Araştırılmak üzere bakteri türlerinin özel gereksinimlerine göre orta, büyüme koşulları (örneğin sıcaklık, oksijenin kullanılabilirliği) ve büyüme süresini seçin. Örneğin, S. aureus Heart Infusion (HI) agar plakaları için kullanılabilir, aerobik koşullarda 37 ° C'de 16 saat büyüme ile.
NOT: En iyi sonuçları elde etmek için, büyüme / inkübasyon, bir mikro-numune peletinin toplanmasına izin verecek kadar bakteri vermelidir. Koloni oluşturan birimlerin veya bakteri hücrelerinin belirli sayısı bakterinin türüne ve boyutuna bağlıdır.
- Bakterileri sıvı ortamda veya katı plakalarda yetiştirin. Araştırılmak üzere bakteri türlerinin özel gereksinimlerine göre orta, büyüme koşulları (örneğin sıcaklık, oksijenin kullanılabilirliği) ve büyüme süresini seçin. Örneğin, S. aureus Heart Infusion (HI) agar plakaları için kullanılabilir, aerobik koşullarda 37 ° C'de 16 saat büyüme ile.
- Örnek biriktirme
- Steril bir döngü kullanarak, agar plakasındaki kolonilerden bakterileri dikkatlice toplayın ve bir cam tüpe aktarın. Bakterileri sadece kolonilerin tepesinden toplayın. Sıvı kültüründen numune topluyorsanız, pipet kullanarak, bakteri süspansiyonunun yaklaşık 1 mL'lik kısmını bir cam tüpe aktarın. Hacim bakteri yüküne bağlı olarak değiştirilebilir.
NOT: Koloninin altından herhangi bir ortamı toplamamaya (veya mümkün olduğunca minimalize etmemeye) çalışmak önemlidir. Örnek hazırlamanın sonraki adımları, herhangi bir potansiyel medya artıklığını ortadan kaldırmayı amaçlamaktadır. Başlangıçtan itibaren potansiyel orta kalıntının en aza indirilmesi, saflaştırılmış bakteri hücrelerinden verilerin spektral olarak elde edilmesine olanak tanır. Agar plakalarından hazırlanan numuneler için 2.2.2 ve 2.2.3 adımları geçerlidir. Sıvı ortamdan hazırlanan numuneler için 2.2.4 adımına geçin. - Tüpe 1 mL ultra saf su ekleyin. Toplanan bakteri peletine kadar girdap artık tüpün dibinde görünmez (tipik olarak 1-2 dk).
- Hazırlanan çözüm ile McFarland standartları arasında görsel karşılaştırma30 ile McFarland standartlarını kullanarak çözümün kaba bulanıklığını tahmin edin. Bakteri süspansiyonunun bulanıklığı çok düşük görünüyorsa, steril bir döngü ve tekrar girdap kullanarak plakadan daha fazla bakteri ekleyin. Çözeltinin kaba bulanıklığı McFarland standartları 0.5 ve 1 ile karşılaştırılabilene kadar tekrarlayın. Bu genellikle iyi miktarda bakteri pelet verecektir.
- Bir pelet elde etmek için bakteri süspansiyonu 5 dakika boyunca 3.000 x g'da santrifüj edin.
NOT: Santrifüjleme parametreleri bakteriyel pelet elde etmek için değiştirilebilir. G kuvvetini artırıyorsa, bakterilerin kırılmasına neden olmamak için (özellikle Gram-negatif bakteriler durumunda) dikkatli olunmalıdır. - Bir pipet kullanarak, süpernatant'ı peletin üstünden hafifçe çıkarın. Peletin yeniden askıya alınmasını sağlamak için tüpe ve girdaplara 1 mL ultra saf su ekleyin. Daha sonra, 2.2.4 adımında yapıldığı gibi numuneyi santrifüj edin.
- Yıkama prosedürünü (adım 2.2.2 ve 2.2.4) en az üç kez tekrarlayın. İlk numunenin sıvı ortamdan toplanması durumunda, prosedürü en az dört kez tekrarlayın (ortam kaldırma ve ardından üç yıkama).
- Son yıkamadan sonra, süpernatant çıkarın, en az 2 dakika ultra saf su ve girdap ekleyin. Daha sonra, numunenin 5 μL'sini substrata yatırın (örneğin, Raman sınıfı CaF2).
- Numunenin istenen kalınlığı çok katmanlı bir bakteri ise, numuneyi hava kurumaya bırakın.
- İstenilen kalınlık monolayer veya bireysel bakteri ise, numuneyi biriktirdikten hemen sonra (adım 2.2.7) 20-100 μL arasında ultra saf su ekleyin ve bir pipet ucu ile hafifçe karıştırın. Hava kurumaya bırakın.
NOT: Suyun tam hacmi, birçok faktöre (örneğin, organizmanın büyüklüğü, peletin yoğunluğu vb.) bağlı olduğu ve bu nedenle ampirik olarak en iyi şekilde belirlendiği için deneyler arasında değişebilir. Farklı hacimlerde ultra saf su eklenmiş bir dizi numunenin hazırlanması, bakterilerin istenen kalınlığına / yoğunluğuna sahip bir numune seçilmesini sağlar. Bakterilerin kalınlığı/yoğunluğu sonraki aşamalarda AFM üzerinden kolayca görselleştirilebilir. Tek katmanlı ve tek hücreli örneklerden afm görüntüleri örnekleri Şekil 1A–H'degösterilmiştir. - Alt tabakayı çift taraflı yapışkan bant kullanarak bir AFM metal numune diske monte edin.
- Steril bir döngü kullanarak, agar plakasındaki kolonilerden bakterileri dikkatlice toplayın ve bir cam tüpe aktarın. Bakterileri sadece kolonilerin tepesinden toplayın. Sıvı kültüründen numune topluyorsanız, pipet kullanarak, bakteri süspansiyonunun yaklaşık 1 mL'lik kısmını bir cam tüpe aktarın. Hacim bakteri yüküne bağlı olarak değiştirilebilir.
3. Enstrüman hazırlama
NOT: Burada açıklanan enstrümantal prosedürler Malzeme Tablosunda listelenen enstrüman içindir. Afm-IR enstrümanının daha yeni bir modeli kullanılarak, ayrıntılı enstrümantal prosedür burada açıklanandan biraz farklı olabilir.
- Başlat düğmesine basarak cihazı aç ve başlat. Lazer deklanşörün lazer testi için Açık konumda olduğundan emin olun.
- Bir temizleme sistemi kurulursa,N 2 akışını açarak cihazı N2ile arındırın. Sabit bir nem seviyesine (örneğin, %20) ulaşmak için azot temizlemeyi ayarlayın. Ölçümler sırasında ve arka plan ile örnek veri toplama arasında nemin dalgalanmamasını sağlayın. Nem seviyelerinin stabilize olması için yaklaşık 20 dakika izin verilmesi önerilir.
- Yükle düğmesine basarak numuneyi numune haznesine yükleyin. Örnek yükleme, yazılım sihirbazı aracılığıyla gerçekleştirilir. Yazılım sihirbazını çalıştırırken, önce uçta odaklanın, mikroskop aşamasını Z yönünde taşımak için okları kullanın ve İleri 'yitıklatın. İkinci olarak, düzlem içi hareketi yönlendiren okları kullanarak veri toplama noktasını ayarlayın ve AFM kafasının üstündeki düğmeleri kullanarak AFM lazer ve AFM dedektörünü hizalayın. Daha sonra, mikroskop aşamasını Z yönünde hareket ettirerek numune yüzeyi üzerinde durun.
NOT: Örnek yüklemenin her adımının ayrıntılı çizimleri yazılım kılavuzunda verilmiştir31. Numuneye odaklanmak özenle yapılmalıdır. Numune yüzeyi Z yönünde yaklaşırken yavaş bir motor hızı kullanın. - Yaklaşım düğmesine tıklayarak örneğe etkileşim kurmadan yaklaşın.
4. Veri toplama
- Arka plan
- Veri toplamadan önce arka planı toplayın. Arka plan koleksiyonu için lazer deklanşörün Açık konumda olduğundan emin olun. Spektral aralığı ve çözünürlüğü (analizin amacına bağlı olarak) ve tarama sayısını ve arka planın ortak ortalama sayısını seçin. Bunların genellikle yüksek olması önerilir (örneğin, 1024 tarama ve 3 ortak ortalama).
NOT: Genel olarak, 4 cm-1 veya 8 cm-1 spektral çözünürlük ve 3.200 cm-1 –2.800cm -1 ve 1.800 cm-1 –900cm-1 spektral aralıkları önerilir. - Arka planı satın ad ettikten sonra, arka plan dosyasını kaydedin. Dosya otomatik olarak depolanmaz. Lazer deklanşör konumunu Kapatolarak değiştirin.
- Veri toplamadan önce arka planı toplayın. Arka plan koleksiyonu için lazer deklanşörün Açık konumda olduğundan emin olun. Spektral aralığı ve çözünürlüğü (analizin amacına bağlı olarak) ve tarama sayısını ve arka planın ortak ortalama sayısını seçin. Bunların genellikle yüksek olması önerilir (örneğin, 1024 tarama ve 3 ortak ortalama).
- Örnek – tek spektrum
- Örneğe müdahale etmek için Etkileşim düğmesine basın. Sistem, doğrudan temas tespit edilene kadar numune yüzeyine yaklaşmaya başlayacaktır.
NOT: Bu çalışmada kullanılan ayar noktası 0,15–2 V arasında değişir ve geri bildirim kazançları (I Gain ve P Gain) genellikle 3 ve 10 olarak ayarlanır. NIR2 kontak probları genellikle nanoIR2 sistemi ile kullanılır (model: PR-EX-nIR2-10, rezonans frekansı (kHz): 13 +/−4 kHz, yay sabiti (N/m): 0,07−0,4 Nm-1). - Yüzeyi görselleştirmek için bir AFM görüntüsü toplayın. İlk durumda, daha büyük bir alanı (örneğin, 50 x 50 μm) daha düşük uzamsal çözünürlüğe (örneğin, 200 x 200 puan)tarayın ( Şekil 1I).
NOT: AFM-IR verileri her zaman temas modunda toplanır, ancak AFM verileri temas veya dokunma modunda toplanabilir. - AFM yükseklik/sapma görüntüsünden belirli bir ilgi alanı seçin ve daha yüksek uzamsal çözünürlükle yeniden görüntüleyin (Şekil 1J–K). Yavaş uç hareketiyle (örneğin, Tarama Hızı 0,2–0,4 Hz) veri toplama hızının uygun olduğundan emin olun.
- Ölçüm noktasını (örneğin, tek bir bakteri) seçin ve ucu noktaya taşıyın.
- IR lazeri hizalayın. Bu amaçla, örneğin emeceği bir dalga sayısı kullanın. Biyolojik malzemeler için bu olabilir, örneğin, I (1655 cm-1). Bant Geçiş Filtresi'nin kapalı olduğundan emin olun ve IR'yi Başlat'ı tıklatın. NanoIR metredeki sağ grafik (genlik ve frekans karşılaştırması olarak görüntülenen sapmanın FFT'si) en az bir net tepe göstermeli ve sol grafik (sapma ve zaman) periyodik bir dalga formuna sahip olmalıdır. Bu durumda, IR noktalarını optimize etmeye devam edin.
NOT: Hızlı Fourier Dönüşümü (FFT) ve sapma beklenen profili gösterse bile, bantların beklendiği en az birkaç dalga sayısı için IR noktalarının optimizasyonunun yapılması önerilir. - Seçili dalga sayısı değerlerini kullanarak IR veri toplama için etkin noktaları en iyi duruma getirme. Bantların konumlarını tanımlamak ve sıcak noktaları optimize etmek için kullanmak için bakterilerin geleneksel bir IR spektrumunu (örneğin, bakteri peletININ ATR spektrumu) kullanmak yararlı olabilir. Çeşitli spektral bölgelerden çeşitli dalga sayısı değerlerini (örneğin, 8-10) seçin.
NOT: Afm-IR veri toplamadan önce geleneksel IR bakteri spektrumu toplanamazsa, literatürde bulunan bakteri spektrumu kaba bir kılavuz olarak kullanılabilir. Bir IR noktasının optimizasyonunun sonucu, her x ve y konumunda FFT büyüklük sinyalinin bir haritasını sunan bir görüntüdür. En büyük sinyale sahip konum otomatik olarak seçilir. Bu tür görüntülere örnekler yazılım kılavuzunda verilmiştir31. - IR noktalarını seçilen dalga sayısı değerleri için optimize ettikten sonra, spektral veri toplama parametrelerini tanımlayın: spektral bölge, spektral çözünürlük, tarama sayısı ve uygulanan güç ve bunları yazılımdaki uygun pencerelere girin. Spektral çözünürlük arka plan çözünürlüğü ile eşleşmeli ve spektral bölge arka planın toplandığı spektral bölge içinde olmalıdır.
NOT: Genel bir başlangıç parametre kümesi olabilir: spektral aralık: 3200 cm-1–2800 cm-1 ve 1800 cm-1–900 cm-1, spektral çözünürlük: 4 cm-1 veya 8 cm-1, tarama sayısı: 512–2048. - Gerekirse, sinyale bağlı olarak lazer gücünü ayarlayın. Genel olarak, lazer gücünün% 8-10'ı arasındaki değerler iyi sinyal kalitesi için yeterli olmalıdır. Numune hasarına neden olabileceğinden, daha yüksek değerler dikkatli bir şekilde kullanılabilir.
NOT: Lazer gücü yüzdesi IR lazerin türüne bağlı olarak değişebilir. Burada verilen yüzde değerleri OPO lazer içindir. - AFM-IR spektrumu toplamak için Acquire'e tıklayın.
- AFM-IR spektrumunun toplanmasından sonra AFM verilerini aynı alandan yeniden toplayın. Bu, numune üzerinde olası sürüklenme ve/veya yıkıcı etkileri ortaya getireceği için şiddetle tavsiye edilir.
- AFM-IR spektrumu tatmin ediciyse ve örnek üzerinde yıkıcı bir etki gözlenmezse, veri toplamaya devam edin. Gerekirse, Dizi seçeneğini ve toplanan AFM yüksekliği veya sapma görüntüsünü kullanarak veri toplama için bir dizi nokta tanımlayın. Bu seçenek, tek bir spektrum için tanımlanan aynı spektral parametrelerle her noktadan ardışık olarak spektrum toplamayı sağlar.
- AFM-IR spektrumunun toplanmasından sonra toplanan AFM görüntüsü numune üzerinde yıkıcı bir etki ortaya koyuyorsa (genellikle yanmış bir nokta), gücü azaltın; farklı bir nokta seçin ve 4.3.8–4.3.11 adımlarını yineleyin.
- AFM-IR spektrumundaki sinyal tatmin edici değilse, IR noktalarının optimizasyonunun doğruluğunu kontrol edin (adım 4.3.6). Doğruysa, lazer gücünü hafifçe artırın ve 4.3.7–4.3.11 adımlarını tekrarlayın. Tatmin edici sinyal elde edilene kadar bu tekrarlanabilir.
- Örneğe müdahale etmek için Etkileşim düğmesine basın. Sistem, doğrudan temas tespit edilene kadar numune yüzeyine yaklaşmaya başlayacaktır.
- Örnek – görüntüleme yaklaşımı
NOT: Seçilen dalga sayısı değeri için yoğunluk dağılım görüntüsü toplamadan önce bakterinin tek bir AFM-IR spektrumunun kaydedilmeleri şiddetle tavsiye edilir.- Seçilen örnek alanın AFM görüntüsünü kaydedin. Bunu yapmak için, önce daha düşük uzamsal çözünürlüğe sahip daha büyük bir alanın AFM görüntüsünü toplayın (örneğin, 50 x 50 μm, 200 x 200 puan), daha sonra ilgi çekici bir bölge seçin ve daha yüksek uzamsal çözünürlüğe sahip bir AFM görüntüsü toplayın (Şekil 1I–K'degösterildiği gibi).
- AFM-IR görüntüleme için dalga sayısı değerlerini seçin.
- Lazerin IR noktasının seçilen dalga sayısı değerleri için optimize olduğundan emin olun (adım 4.3.6). IR noktası bazı dalga sayıları için optimize edilmiş değilse (net bir maksimum yok), onlar için optimize edin.
- Görüntülenmiş alanın parametrelerini tanımlayın: genişlik ve yükseklik, X ve Y yönünde veri noktalarının sayısı.
NOT: Önceki AFM görüntülerinden ardışık nokta seçimi uygulanırsa (Şekil 1I–K'degösterildiği gibi), alanın işaretlenmesi üzerine genişlik ve yükseklik alanları otomatik olarak doldurulur. - Spektral sinyal alımının parametrelerini tanımlayın: dalga boyu, tarama sayısı ve lazer gücü.
NOT: Tarama sayısının makul bir şekilde tutulması gerekir. 64 veya 32 tarama genellikle yeterli miktarda sinyale izin verir. - Tarama Hızı'nı tıklatarak AFM ipucu hareketinin parametrelerini tanımlayın. Önceki adımdaki tarama sayısı ve X yönündeki veri noktalarının sayısı ne kadar yüksekse, uç hareketlerinin o kadar yavaş olması gerekir. Bu parametreler arasındaki ayarlama eksikliği, ucun çok hızlı hareket etmesini ve her noktadan tanımlanmış sayıda taramanın gerçek olarak alınmasını önleyecektir.
NOT: Örneğin, 64 birlikte ekleme ve 200 nokta içeren uygun bir IR sinyali koleksiyonu için Tarama Hızını 0,07 kHz olarak ayarlayın. - IR görüntülemeyi etkinleştir kutusunun işaretli olduğundan emin olun.
- Görüntülemeye başlayın. Seçilen dalga numarasındaki sinyal yoğunluğunun AFM-IR'si, o bölgedeki AFM verileriyle aynı anda toplanacak.
NOT: OPO lazer kullanıldığında, aynı anda temas rezonansı tepe frekansı görüntüsünü toplamak da mümkündür. Bu, numunenin farklı konumlardaki göreli sertliği hakkında bilgi edinmek için kullanılabilir. - Aynı alandan aynı parametrelerle, ancak farklı dalga sayısı değerleri için ardışık afm-IR veri koleksiyonu ayarlamak için Yakalama Sırası penceresini kullanın. Bunu yapmak için Yakalama Sırası penceresini açın, her dalga sayısını yazın ve uygulanan lazer gücünü tanımlayın (her dalga sayısı için).
- Toplanan verileri (AFM ve AFM-IR, tek spektrumlu ve görüntüleme) çeşitli formatlara dışa aktararak ve belirli araştırma amaçları için yeterli yöntemleri kullanarak analiz edin.
Sonuçlar
Açıklanan protokol, numunenin ilk konsantrasyonuna ve eklenen su miktarına bağlı olarak, substrattaki bakterilerin bir dizi hücre dağılımını elde etmeyi sağlar. Şekil 1, Gram-pozitif (S. aureus) ve Gram-negatif (Escherichia coli) bakterilerinden açıklanan protokol kullanılarak hazırlanan monolayerlerden ve tek hücreli örneklerden kaydedilen AFM görüntülerinin (yükseklik ve sapma) örneklerini göstermektedir.
Burada açıklanan protokol, tek bakterilerin hücre içi ve hücre dışı yapılarının AFM-IR görüntülemesi için kullanılabilir. Bu uygulamanın bir örneği şekil 2'de gösterilmiştir, bu da bir S. aureus hücresinin bölünmesi sırasında meydana gelen mekansal lokalize kimyasal değişikliklerin izlenmesinin sonuçlarını göstermektedir. Hava kurutma genellikle bakteriyel preparat için bir fiksasyon yaklaşımı olarak kabul edilse de, bakteriler, doğası gereği sıcaklık gibi dış etkenlere karşı çok yüksek direnç gösterir ve dehidrasyon32. Burada sunulan sonuçlar havadan kurutulmuş bir numuneden elde edildi. Hücre bölünmesinden önce meydana gelen septum oluşumu, afm görüntüleme(Şekil 2A-D)ile aynı bölgenin ardışık 12 görüntüsünün toplanmasıyla gözlendi ve izlendi (tek bir görüntünün toplanması ≈ 20 dk). Şekil 2A–D, seçilen 4 AFM görüntüsünü gösterir ve her görüntünün toplanması arasındaki süre yaklaşık 40 dakikadır. Oluşan yapı (septum) 45 nm yüksekliğindedir. Oluşan septum AFM yüksekliği ve sapma görüntülerinde açıkça görülebilir (Şekil 2E-F). Hücre ve septum alanından kaydedilen AFM-IR spektrumu (Şekil 2G, Şekil 2File işaretlenmiş menşe noktaları ) karşılaştırmadan önce amide I bandına normalleştirilerek veri toplama noktaları arasındaki değişen numune kalınlığının etkisini en aza indirdi. Septumun AFM-IR spektrumu, hücre bölgesinden toplanan AFM-IR spektrumu ile karşılaştırıldığında 1240 ve 1090 cm-1'deki bantların daha yüksek bağıl yoğunluğu ile karakterizedir. Bunlar, hücre duvarı bileşenlerinin karbonhidrat ve fosfoditer gruplarına atfedilir (örneğin, peptidoglikan ve teikoik asit dahil)22.
Açıklanan protokol, bir dizi farklı örnek arasında tek bir spektrumun karşılaştırılması için de kullanılabilir. Sonuçlarla birlikte bu uygulamaya bir örnek Şekil 3 ve Şekil 4'te gösterilmiştir. Çalışmanın amacı, S. aureus'ta (VISA) vankomasin aralıklı direncinin in vivo gelişimi sonucu meydana gelen kimyasal değişiklikleri belirlemektir. Bu amaçla, hastalardan klinik örnek çiftleri toplanmış, ana suş hastaneye başvurduktan sonra ve antibiyotik tedavisinden önce (vankomasisine duyarlı S. aureus, VSSA) ve kız çocuğu suşu antibiyotik ve klinik yetmezliğin kabulünden sonra aynı hastadan izole edilmiştir. Numuneler daha da ağar ortamında yetiştirildi ve protokole göre hazırlandı (Şekil 3A–B). AFM-IR spektrumu VSSA ve VISA için birden fazla tek bakteriden (ve birden fazla örnekten) toplanmış ve daha sonra birkaç kemometrik yaklaşım kullanılarak analiz edilmiştir (Şekil 3C).
VSSA ve VISA hücreleri arasında morfolojik fark gözlenmedi(Şekil 4A–C). Bununla birlikte, AFM-IR spektrumu (Şekil 4D,F) ve ikinci türevleri (Şekil 4E,G) dirençli ve hassas suşlar arasındaki kimyasal bileşimde açık bir fark olduğunu göstermiştir. Hücre duvarı bileşenlerinden karbonhidrat ve fosfodiester grupları ile ilişkili bantların göreceli yoğunluğu (özellikle, 1088 cm-1'dekibant), hassas muadili ile karşılaştırıldığında dirençli suşta açıkça artmıştır. Not, yeniden kodlanmış tüm spektrumların (VISA: 81, VSSA: 88) küçük bir standart sapma göstermesidir. Bu, aynı suştan hazırlanan çeşitli örneklerden kaydedilen verilerin iyi tekrarlanabilirliğini göstermektedir, çünkü aynı türün farklı örneklerinden kaydedilen spektrumlar arasında ayrımcılık mümkün değildir. Gözlenen farklılıklar, diğer literatür raporları33,34ile aynı fikirde kalan duyarlı muadili ile karşılaştırıldığında, dirençli suşlarda hücre duvarının kalınlığının arttığını gösterdi.

Şekil 1: AFM-IR ölçümleri için çeşitli bakteri örneklerinin temsili AFM görüntüleri. Substrat üzerindeki seyreltmeye bağlı olarak, protokol, tek hücreli örneklerin yanı sıra bakterilerin çok katmanlı ve monolayerlerini elde etmesine izin verir. Temsili AFM görüntüleri: (A–D) monolayer ve (E–H) tek hücreli örnek (A,B,E,F) Gram pozitif (S. aureus) ve (C,D,G,H) Gram negatif (E. coli) bakteri. (A,C,E,G) yükseklik görüntülerini gösterir ve (B,D,F,H) karşılık gelen sapma görüntülerini gösterir. Görüntülenmiş alanların boyutu: (A-D, G,H) 20 x 20 μm, (E,F) 50 x 50 μm. (I–K) AFM-IR eşlemesi için ardışık alan seçimi. Bu, tek bir S. aureus hücresi örneğinde artan uzamsal çözünürlük ile AFM görüntüleme kullanılarak elde edilir. Her görüntü, 200 x 200 nokta örneklenerek toplanır ve görüntülenen alanın boyutunun azalması nedeniyle artan uzamsal çözünürlük. Görüntülenmiş alanların boyutu: (I) 40 x 40 μm, (J) 20 x 20 μm ve (K) 2.24 x 2.24 μm. (I )içinde siyah kare (J) içinde görüntülenmiş alanı işaretler. (J) içinde siyah kare (K) içinde görüntülenmiş alanı işaretler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
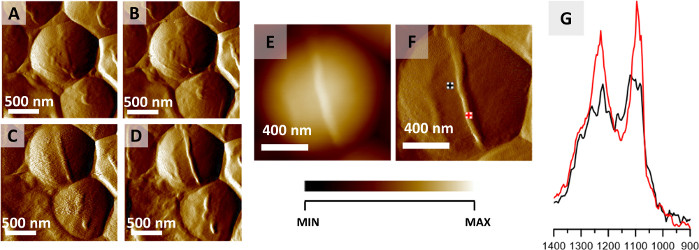
Şekil 2: AFM-IR üzerinden S. aureus hücre bölünmesinin izlenmesi. (A–D) S. aureus hücresinin AFM görüntüleri septum oluşumunu hücre bölünmesinden önce gösterir. Görüntülenmiş alanın boyutu: 2 x 2 μm. Görüntüler daha büyük bir seriden (her 20 dakikada bir kaydedilen 12 görüntü) seçildi ve her 40 dakikada bir kaydedilen verileri temsil ediyor. (E-F) AFM yüksekliği ve hücre septum oluşumunun sonunda kaydedilen sapma görüntüsü, AFM-IR spektrumlarının belirgin toplama noktalarıyla. Görüntülenmiş alanın boyutu 1,17 x 1,15 μm. Yeni oluşan yapının yüksekliği 45 nm'dir. (G) HÜCRE BÖLGESİNDEN (siyah) ve septum bölgesinden (kırmızı) kaydedilen AFM-IR spektrumları((F)olarak işaretlenmiştir), 1400–900 cm-1aralığındadır. Her iki spektrum da amid i bandına normalleştirildi ve septumdan hücre duvarı bileşenlerinin göreceli yoğunluğunda bir artış olduğunu gösteriyor. Bu rakam K. Kochan ve ark.22'den değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
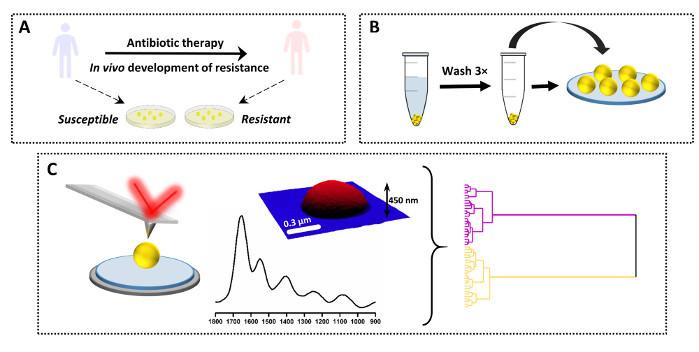
Şekil 3: Antimikrobiyal direncin AFM-IR çalışması için deneysel tasarıma genel bakış. (A) Örnek köken ve ilk hazırlık: antibiyotik tedavisinden önce bir hastadan duyarlı ebeveyn suşu toplanmış ve antibiyotiğe ve klinik başarısızlıktan (in vivo direnç gelişimi) sonra kıza dirençli suş aynı hastadan temin edildi. Bakteriler 37 °C'de 16 saat boyunca Kalp İnfüzyonu (HI) agarında izole edildi ve kültürlendi. (B)Numunenin toplanması ve ardından bakteri paletinin yıkanması (3×) ve numune birikimi de dahil olmak üzere AFM-IR için sonraki numune hazırlığı. (C) AFM-IR veri toplama ve analizi: AFM yüksekliği ve AFM-IR spektrumu (1800–900 cm-1). AFM görüntü alanının boyutu: 1,7 x 1,4 μm. AFM-IR spektrumu hücrenin ortasından toplandı. Veriler daha sonra hiyerarşik küme analizi de dahil olmak üzere kemometrik yaklaşımlar kullanılarak analiz edildi. Bu rakam K. Kochan ve ark.19'dan değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
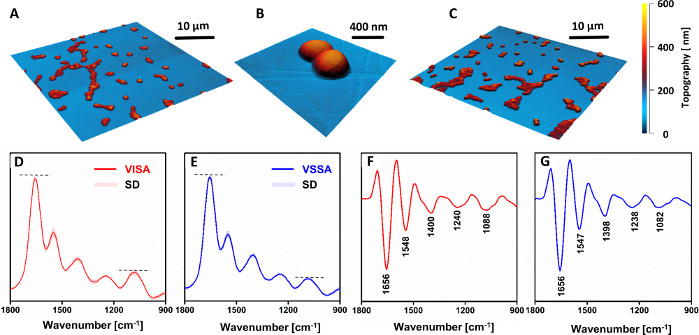
Şekil 4: AFM ve AFM-IR, klinik çiftlerde vankomasin duyarlı S. aureus (VSSA) ile karşılaştırıldığında vankomasin ara S. aureus (VISA) kimyasal değişikliklerin incelenmesinin sonuçlarıdır. AFM görüntüleri (A–B) VISA ve (C) VSSA tek hücreli örnekleri. Görüntülenmiş alanların boyutu: (A,C) 40 x 40 μm, (B) 2.56 x 2.45 μm. (D–E) Ortalama AFM-IR spektrumları ve (F-G) ikinci türevleri için: (D,F) VISA ve (E,G) VSSA hücreleri, spektral aralıkta 1800–900 cm-1. Sunulan spektrum ortalama 81 (VISA) ve 88 (VSSA) bireysel spektradır ve standart sapma (SD) ile birlikte sunulur. Ortalama, tüm bireysel spektrumların birlikte normalleşmesi sonrasında gerçekleştirildi. Ana bantlar (F-G) olarak işaretlenmiştir. Bu rakam K. Kochan ve ark.19'dan değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: S. aureus hücresi için seçilen dalga sayısı değerlerinde AFM-IR haritalarının ardışık kaydı üzerinde görüntü kayması. (Üst satır): AFM görüntüleri, seçilen dalga sayısı değerlerinde IR sinyalinin yoğunluğuna bağlı olarak karşılık gelen ( altsatır) AFM-IR haritalarıyla aynı anda kaydedildi. Dalga sayı değerleri (966, 1055, 1079, 1106, 1234, 1398, 1454, 1540, 1656, 1740 cm-1)alt satırın üzerinde açıklamalı. Her set (AFM görüntüsü ve AFM-IR haritası) doğrudan önceki görüntüden sonra kaydedildi (set başına yaklaşık 40 dk). Görüntülenen/eşlenen alanın boyutu: 1,54 x 1,57 μm. Görüntüler arasında net bir sürüklenme görülebilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
IR spektroskopisinin, kimyasal bileşimleri bağlamında çok çeşitli biyolojik numunelerin karakterizasyonu için yararlılığı iyi belirlenmiştir. Son on yılda, IR spektroskopisi bakteriyel çalışmalar için umut verici bir araç olarak ortaya çıkmıştır12,13,14,15,16,17. Kimyasal bileşim yoluyla fenotipik bir karakterizasyon sağlayan birkaç teknikten biri olarak mikrobiyoloji alanında önemli ilgi görmeye devam etmektedir. Bu bağlamda, geleneksel FTIR mikroskopisinin en büyük dezavantajı, bakterilerin tek hücreli ve hücre altı çalışmalarını önleyen sınırlı uzamsal çözünürlükte yatmaktadır. Aslında, bakterilerin küçük boyutu sadece IR için değil, tekniklerin büyük çoğunluğu için bir engeli temsil eder. Bu nedenle, bakterilerin tek hücreli ve hücre altı çalışmaları için mevcut araştırma araçları önemli ölçüde sınırlıdır. AFM'nin IR ile kombinasyonu, IR spektroskopisinin mekansal çözünürlük sınırlamasının üstesinden gelinmesine olanak sağlayarak, kimyasal bileşimin nano ölçekli problama yeteneğine sahip bakteriyel araştırmalar için yeni bir araç sağlar.
Teknik tek hücreli çalışmalarla sınırlı değildir ve kalınlıkta çeşitli örneklerin araştırılmasına izin verir. Kuşkusuz, temiz ve dikkatli numune hazırlama, yüksek kaliteli görüntüler elde etmek için kritik öneme sahiptir. Buradaki protokol, çeşitli bakterilerin çok katmanlı, monolayer ve/veya tek hücreli örneklerini hazırlamak için bir yöntem sağlar (Şekil 1). Hazırlanan numune, ilk bakteri yükü, yıkama sonrası seyreltme ve substratta daha fazla seyreltme dahil olmak üzere çeşitli faktörlere bağlıdır. Yıkanmış peletlerin seyreltildikten sonra ve substratta biriktirmeden önce elde edilen numune miktarı tipik olarak çok sayıda numunenin hazırlanmasına izin verir. Bu nedenle, numunenin substrat üzerinde istenen dağılımını elde etmek için, seyreltmelerine göre değişen bir dizi numune hazırlamak genellikle faydalıdır. Hücre altı görüntüleme yerine AFM-IR spektrumlarının toplanmasını amaçlayan çalışmalar için, numune miktarının değiştirilmesi (örneğin, monolayerden çok katmanlıya) sinyalin yoğunluğunu artırmak için yararlı olabilir.
Numune hazırlamada bir diğer kritik husus da orta kalıntıların uygun şekilde çıkarılmasıdır. Seçilen numune kültleme yöntemlerine bağlı olarak, numune sıvı ortamdan veya bir agar plakasından toplanır. Her iki durumda da, agar plakalarından toplanması üzerine çok daha az ölçüde olmasına rağmen, orta kalıntının numunede bulunması muhtemeldir. Bakteriyel büyüme ortamı çeşitli biyolojik bileşenlerin bolluğunu içerdiğinden, ortamın uygun şekilde çıkarılmasını sağlamak önemlidir. Agar plaka örnekleri için ultra saf suyla üç yıkama ve ortamdan toplanan numuneler için en az dört yıkama öneriyoruz. Gerekirse yıkama sayısı artırılabilir; ancak, çeşitli örnekler arasında karşılaştırma için, örnekler arasında tutarlı tutmak önemlidir. Gösterilen protokol fosfat tampon çözeltisi (PBS) veya salin gibi çözücüler yerine su kullanır. Hem PBS hem de salin, havanın kurumasının ardından kristallerin oluşumuna yol açar ve bu da bakterilere zarar verebilir. Buna ek olarak, her ikisi de özellikle PBS ile parmak izi bölgesinde birden fazla bant içeren yoğun IR bantları kaynağıdır. Tuzlu su veya PBS kullanımı için yetenek eksikliği, şu anda teknik için önemli bir sınırlamayı temsil ediyor. Tipik olarak, yıkama için su kullanımı bakteriler üzerinde herhangi bir yıkıcı etkiye neden olmaz; ancak, dikkatli olunmalı ve mümkünse suya maruz kalma süresi sınırlanmalıdır. Numune hazırlama protokolünün yıkama aşamasında duraklatılması gerekiyorsa, suyu çıkardıktan sonra numunenin peletlenmiş formda ayrılması önerilir. Bu, yırtılmaya daha yatkın oldukları için daha ince bir hücre duvarı içeren Gram-negatif bakteriler için özel bir öneme sahiptir.
Doğru ve yüksek kaliteli AFM-IR verileri sağlamak için, veri toplama protokolündeki çeşitli yönler kritik öneme sahiptir. İlk olarak, veri toplama için doğru arka plan koleksiyonu gereklidir. Özellikle, arka plan koleksiyonu boyunca ve arka plan ile numune toplama arasında istikrarlı nem seviyelerinin korunması gereklidir. Bunu sağlamak için, aletin azotla temizlenmesini ve nem seviyelerinin% 25'ten yüksek olmamasını öneririz. Temizleme eksikliği, özellikle yüksek neme sahip yerlerde önemli bir sınırlama getirebilir. İkinci olarak, IR noktalarının uygun şekilde optimize edilmesi önemi vurgulanmalıdır. En iyi sonuçlar için, bant maxima konumu hakkında bir priori bilgisi yararlı olabilir. Örneğin, bir numuneden beklenen bantların konumlarını belirlemek için geleneksel bir IR bakteri pelet spektrumu kullanılabilir. Bu mümkün değilse, alternatif bir yaklaşım olarak, kullanıcı literatürde mevcut olan IR spektrumunu kullanabilir veya bakteride beklemek için makul bir bant pozisyonu kullanarak optimizasyona başlayabilir (örneğin, amide I ve amide II). Üçüncü olarak, veri toplama için, yıkıcı bir etkiye sahip olabileceği için dikkatli güç seçiminin (iyi bir S / N oranı elde etmeye izin verme) önemini vurgulamak önemlidir. Tavsiye gücü, numunenin kalınlığına bağlıdır, cihaz kılavuzunda bulunan kaba kılavuz31. Herhangi bir yıkıcı etkiyi ortaya getireceğinden, bir AFM görüntüsünün toplanmasıyla örnek post-ölçümün durumunu ampirik olarak test etmenizi öneririz. Ayrıca, AFM-IR spektrumunun toplanmasından önce ve sonra aynı alandan AFM görüntülerinin toplanması, herhangi bir sürüklenmenin meydana gelmediğini ve spektrumun gerçekten hücredeki seçilen noktadan kaynaklandığının iyi bir teyidi olarak hizmet eder. Görüntüleme modalitesi uygulanırken, seçilen dalga sayısı değerlerinde IR yoğunluğunun ardışık olarak görüntülenmesi yoluyla sürüklenme olasılığı özellikle önemlidir. Bunun bir örneği Şekil 5'te gösterilmiştir. Görüntülenmiş alan deneyin başında tanımlanmıştır ve tüm dalga sayısı değerleri için tutarlı olması amaçlanmaktadır. Bununla birlikte, her AFM yüksekliği (ve karşılık gelen IR dalga sayısı yoğunluğu) görüntüsü arasında, yaklaşık 40 dakikalık her haritanın edinme süresiyle net bir sürüklenme görülebilir. Bu nedenle, görüntüleme verilerini toplayan kullanıcılar için, sürüklenmenin varlığından bile, ilgi örneğinin görüntülenmiş alanda kalmasını sağlamak için her zaman ilgi örneğinden biraz daha büyük bir alan seçmenizi öneririz.
Protokolün potansiyel sınırlamaları, yukarıda açıklanan fizyolojik çözeltilerde (örneğin, salin veya PBS) nemli bir durumda veri toplama yeteneğinin olmamasını içerir. Ayrıca, özellikle yüksek nem alanlarında, genellikle azot temizlemeye ihtiyaç vardır. Ayrıca, protokol, daha küçük yapılar için kullanım olasılığı hariç olmak üzere, 100 nm'ye kadar olan organizmaların araştırılmasını sağlar. Bu farklı bir lazer kullanılarak üstesinden gelinebilse de (örneğin, 20 nm uzamsal çözünürlüğe ulaşmayı sağlayan kuantum basamaklı lazer), sınırlı spektral aralığın yanı sıra gürültü oranına iyi bir sinyal elde etmedeki zorluklarla da ilişkilidir. Son olarak, yumuşak yüzeylerin yoklanması, ucun yüzeyi düzgün bir şekilde algılamaması ve kırılmaya kadar temas noktasının ötesine geçmesiyle bir zorluk ortaya çıkabilir. Bu tipik olarak bakteriyel örneklerle ilgili bir sorun olmasa da, daha yumuşak numunelerin ölçülmesi üzerine ortaya çıkabilir. Bu gibi durumlarda, numuneye yakın olarak substratın temiz yüzeyine girmeye çalışmanız önerilir.
Açıklanan protokol, çeşitli örnekler arasındaki karşılaştırmalı çalışmalar ve hücre altı inceleme de dahil olmak üzere çok sayıda bakteriyel araştırma türü için kullanılabilir. Veriler, araştırmanın amacına bağlı olarak tek spektrumlu ve görüntüleme yöntemleri için kemometrik yaklaşımlar kullanılarak analiz edilebilir35. Ayrıca, protokol, fiksasyon ilavesi yoluyla diğer biyolojik materyallere (mantarlar, mayalar, hücreler vb.) uygulanması için de değiştirilebilir.
Açıklamalar
Bruker'e yayın ücretinin ödenmesi için teşekkür ederiz. KK, BRW, AP ve PH, yaklaşımın bazı temel yönlerini açıklayan uluslararası bir patentin (PCTIB2020/052339) mucitleridir.
Teşekkürler
Bruker'e destekleri için teşekkür ederiz. Bu çalışma Monash Üniversitesi İleriCi Kadın Başarı Hibesi (K. Kochan) tarafından desteklendi. A.Y.P, Avustralya Ulusal Sağlık ve Tıbbi Araştırma Konseyi Uygulayıcı Bursu'ndan (APP1117940) destek kabul eder. Bu çalışma Bir Avustralya Araştırma Konseyi Keşif Projesi DP180103484 tarafından finanse edildi. Bay Finlay Shanks'a enstrümantal desteği için ve Bayan Xenia Kostoulias'a numunelerdeki teknik yardımı için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| AFM metal specimen disc | PST ProSciTech Pty Ltd | GA530-15 | Recommended 15 mm |
| Anasys AFM-IR nanoIR2 | Anaysys Instruments | model: nanoIR2 | |
| Contact mode NIR2 Probes for nanoIR 2 | Bruker / Anasys Instruments | - | Model: Model: PR-EX-NIR2 |
| Heraeus Pico 17 Microcentrifuge | Thermo Scientific | - | - |
| Matlab | Mathworks Inc | - | Multivariate data analysis software |
| Micro-centrifuge tubes, 1.5 mL | Heathrow Scientific | HEA4323 | Can be replaced with any other micro-centrifuge tube |
| NanoIR 2 instrument | Bruker / Anasys Instruments | - | - |
| PLS toolbox | Mathworks Inc | - | GUI for Matlab |
| Selected bacterial medium (e.g. HBA Columbia Plates) | Thermo Fisher | PP2001 | Provided type of medium is an example and can be replaced by others, depending on the type of experiment |
| Selected bacterial strain | - | - | The source depends on the aim of research (patient isolates, ATCC strains, etc.) |
| Substrate (e.g. Raman grade CaF2) | Crystran | CAFP13-2R | Recommended size: 13 mm Ø x 2.0 mm |
| Tip pipette 1000 µl | Axygen | T-1000-B | - |
| Tip pipette 200 µl | Axygen | T-200-C | - |
| Tip pipette 0.5-10 µl | Axygen | T-300-R | - |
| Ultrapure water | - | - | - |
Referanslar
- Sears, C. L. A dynamic partnership: celebrating our gut flora. Anaerobe. 11 (5), 247-251 (2005).
- Rudd, K. E., et al. regional, and national sepsis incidence and mortality, 1990-2017: analysis for the Global Burden of Disease Study. The Lancet. 395 (10219), 200-211 (2020).
- Seymour, C. W., et al. Time to treatment and mortality during mandated emergency care for sepsis. The New England Journal of Medicine. 376 (23), 2235-2244 (2017).
- Weiss, S. L., et al. Delayed antimicrobial therapy increases mortality and organ dysfunction duration in pediatric sepsis. Critical Care Medicine. 42 (11), 2409-2417 (2014).
- Peker, N., Couto, N., Sinha, B., Rossen, J. W. Diagnosis of bloodstream infections from positive blood cultures and directly from blood samples: recent developments in molecular approaches. Clinical Microbiology and Infection: The Official Publication of the European Society of Clinical Microbiology and Infectious Diseases. 24 (9), 944-955 (2018).
- Aminov, R. I. The role of antibiotics and antibiotic resistance in nature. Environmental Microbiology. 11 (12), 2970-2988 (2009).
- Levy, S. B., Marshall, B. Antibacterial resistance worldwide: causes, challenges and responses. Nature Medicine. 10 (12), 122-129 (2004).
- Roca, I., et al. The global threat of antimicrobial resistance: science for intervention. New Microbes and New Infections. 6, 22-29 (2015).
- O'Neill, J. The review on antimicrobial resistance. Tackling drug-resistant infections globally: final report and recommendations. Wellcome Trust. , (2016).
- Perry, J. A., Westman, E. L., Wright, G. D. The antibiotic resistome: what's new. Current Opinion in Microbiology. 21, 45-50 (2014).
- Piddock, L. J. Assess drug-resistance phenotypes, not just genotypes. Nature Microbiology. 1 (8), 16120 (2016).
- Naumann, D., Helm, D., Labischinski, H. Microbiological characterizations by FT-IR spectroscopy. Nature. 351 (6321), 81-82 (1991).
- Zarnowiec, P., Lechowicz, L., Czerwonka, G., Kaca, W. Fourier Transform Infrared Spectroscopy (FTIR) as a tool for the identification and differentiation of pathogenic bacteria. Current Medicinal Chemistry. 22 (14), 1710-1718 (2015).
- Quintelas, C., Ferreira, E. C., Lopes, J. A., Sousa, C. An overview of the evolution of infrared spectroscopy applied to bacterial typing. Biotechnology Journal. 13 (1), 1700449 (2018).
- San-Blas, E., Cubillán, N., Guerra, M., Portillo, E., Esteves, I. Characterization of xenorhabdus and photorhabdus bacteria by Fourier transform mid-infrared spectroscopy with attenuated total reflection (FT-IR/ATR). Spectrochimica Acta. Part A, Molecular and Biomolecular Spectroscopy. 93, 58-62 (2012).
- Sousa, C., et al. Discrimination of the acinetobacter calcoaceticus-acinetobacter baumannii complex species by Fourier transform infrared spectroscopy. European Journal of Clinical Microbiology & Infectious Diseases. 33 (8), 1345-1353 (2014).
- Rodriguez-Saona, L. E., Khambaty, F. M., Fry, F. S., Calvey, E. M. Rapid detection and identification of bacterial strains by Fourier transform near-infrared spectroscopy. Journal of Agricultural and Food Chemistry. 49 (2), 574-579 (2001).
- Dawson, S. E., et al. Implementation of Fourier transform infrared spectroscopy for the rapid typing of uropathogenic Escherichia coli. European Journal of Clinical Microbiology & Infectious Diseases. 33 (6), 983-988 (2014).
- Kochan, K., et al. Detection of Antimicrobial Resistance-Related Changes in Biochemical Composition of Staphylococcus aureus by Means of Atomic Force Microscopy-Infrared Spectroscopy. Analytical Chemistry. 91 (24), 15397-15403 (2019).
- Dazzi, A., Prater, C. B. AFM-IR: Technology and Applications in Nanoscale Infrared Spectroscopy and Chemical Imaging. Chemical Reviews. 117 (7), 5146-5173 (2017).
- Dazzi, A., et al. AFM-IR: combining atomic force microscopy and infrared spectroscopy for nanoscale chemical characterization. Applied Spectroscopy. 66 (12), 1365-1384 (2012).
- Kochan, K., et al. et al. In vivo atomic force microscopy-infrared spectroscopy of bacteria. Journal of the Royal Society, Interface. 15 (140), (2018).
- Katzenmeyer, A. M., et al. Mid-infrared spectroscopy beyond the diffraction limit via direct measurement of the photothermal effect. Nanoscale. 7 (42), 17637-17641 (2015).
- . Bruker Life Science Applications Available from: https://www.bruker.com/products/surface-and-dimensional-analysis/nanoscale-infrared-spectrometers/nanoscale-ir-spectroscopy-applications/life-sciences.html (2020)
- Mayet, C., Dazzi, A., Prazeres, R., Ortega, J. M., Jaillard, D. In situ identification and imaging of bacterial polymer nanogranules by infrared nanospectroscopy. Analyst. 135 (10), 2540-2545 (2010).
- Baldassarre, L., et al. Mapping the amide I absorption in single bacteria and mammalian cells with resonant infrared nanospectroscopy. Nanotechnology. 27 (7), 075101 (2016).
- Vitry, P., et al. Combining infrared and mode synthesizing atomic force microscopy: Application to the study of lipid vesicles inside Streptomyces bacteria. Nano Research. 9 (6), 1674-1681 (2016).
- Dazzi, A., et al. Chemical mapping of the distribution of viruses into infected bacteria with a photothermal method. Ultramicroscopy. 108 (7), 635-641 (2008).
- Steenbergen, J. N., Alder, J., Thorne, G. M., Tally, F. P. Daptomycin: a lipopeptide antibiotic for the treatment of serious Gram-positive infections. The Journal of Antimicrobial Chemotherapy. 55 (3), 283-288 (2005).
- Garcia, L. S. MacFarlan Standards. Clinical Microbiology Procedures Handbook, 3rd Edition. , (2010).
- NanolR-2 System Manual. Anasys Instruments Available from: https://www.anasysinstruments.com/downloadpr/nanoIR2_s_System_Manual.pdf (2020)
- Whelan, D. R., et al. Detection of an en masse and reversible B- to A-DNA conformational transition in prokaryotes in response to desiccation. Journal of the Royal Society, Interface. 11 (97), 20140454 (2014).
- McGuinness, W. A., Malachowa, N., DeLeo, F. R. Vancomycin Resistance in Staphylococcus aureus. The Yale Journal of Biology and Medicine. 90 (2), 269-281 (2017).
- Howden, B. P., Peleg, A. Y., Stinear, T. P. The evolution of vancomycin intermediate Staphylococcus aureus (VISA) and heterogenous-VISA. Infection, Genetics and Evolution: Journal of Molecular Epidemiology and Evolutionary Genetics in Infectious Diseases. 21, 575-582 (2014).
- Perez-Guaita, D., et al. Multispectral Atomic Force Microscopy-Infrared Nano-Imaging of Malaria Infected Red Blood Cells. Analytical Chemistry. 90 (5), 3140-3148 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır