Method Article
Rasterkraftmikroskopie kombiniert mit Infrarotspektroskopie als Werkzeug zur Untersuchung der Chemie einzelner Bakterien
In diesem Artikel
Zusammenfassung
Rasterkraftmikroskopie-Infrarotspektroskopie (AFM-IR) bietet eine leistungsstarke Plattform für Bakterienstudien, die es ermöglicht, eine nanoskalige Auflösung zu erreichen. Sowohl die Abbildung subzellulärer Veränderungen (z. B. bei Zellteilung) als auch vergleichende Untersuchungen der chemischen Zusammensetzung (z. B. durch Arzneimittelresistenz) können auf Einzelzellebene in Bakterien durchgeführt werden.
Zusammenfassung
Rasterkraftmikroskopie-Infrarotspektroskopie (AFM-IR) ist eine neuartige kombinatorische Technik, die die gleichzeitige Charakterisierung physikalischer Eigenschaften und chemischer Zusammensetzung der Probe mit nanoskaliger Auflösung ermöglicht. Durch die Kombination von AFM mit IR wird die räumliche Auflösungsgrenze herkömmlicher IR überwunden, wodurch eine Auflösung von 20–100 nm erreicht werden kann. Dies öffnet die Tür für eine breite Palette neuer Anwendungen von IR zur Sondierung von Proben, die kleiner als mehrere Mikrometer sind, die bisher mit herkömmlicher IR-Mikroskopie nicht erreichbar waren. AFM-IR eignet sich hervorragend für die Bakterienforschung und liefert sowohl spektrale als auch räumliche Informationen auf Einzelzell- und intrazellulärer Ebene. Die zunehmenden globalen Gesundheitsbedenken und ungünstigen Zukunftsprognosen in Bezug auf bakterielle Infektionen und insbesondere die schnelle Entwicklung antimikrobieller Resistenzen haben einen dringenden Bedarf an einem Forschungsinstrument geschaffen, das in der Lage ist, phänotypische Sondierungen auf einzelzelliger und subzellulärer Ebene durchzuführen. AFM-IR bietet das Potenzial, diesen Bedarf zu decken, indem es eine detaillierte Charakterisierung der chemischen Zusammensetzung eines einzelnen Bakteriums ermöglicht. Hier bieten wir ein komplettes Protokoll für die Probenvorbereitung und Datenerfassung von Einzelspektren und Kartierungsmodalitäten für die Anwendung von AFM-IR auf Bakterielle Studien.
Einleitung
Bakterien sind einzellige prokaryotische Organismen, die in verschiedenen Formen und Größen vorkommen, typischerweise im Bereich von mehreren hundert Nanometern bis Mikrometern. Sie existieren in einer Vielzahl von Lebensräumen und sind für die Existenz des Lebens unerlässlich. Im menschlichen Körper ist die Mehrheit der im Darm vorhandenen Bakterien harmlos und viele sind tatsächlich vorteilhaft1. Mehrere Bakterienarten sind jedoch pathogen und verursachen eine Reihe von Infektionskrankheiten. Bakterielle Infektionen können zur Entwicklung von Sepsis und septischem Schock führen: ein lebensbedrohlicher Zustand, der aus der Reaktion des Körpers auf eine Infektionresultiert 2. Sepsis ist eine globale große Gesundheitsbedrohung mit hoher Prävalenz weltweit und schweren Mortalitätsraten. Allein im Jahr 2017 wurden weltweit schätzungsweise 50 Millionen Sepsisfälle registriert, von denen 11 Millionen zum Tod führten (ca. 20%)2. Darüber hinaus wurde gezeigt, dass eine Abnahme der Überlebenschancen des Patienten aufgrund einer verzögerten Therapie stündlich auftritt3,4.
Bakterielle Infektionen werden mit Antibiotika behandelt. Die Schwere der möglichen Folgen bakterieller Blutbahninfektionen (BSIs) zusammen mit einer klaren Bedeutung der schnellen Einleitung einer antimikrobiellen Therapie führt zu einer sofortigen Antibiotikaverabreichung. Da die derzeit in der klinischen Praxis verwendeten diagnostischen Ansätze (z.B. Blutkultivierung) jedoch relativ lange benötigen, erfolgt die Antibiotikagabe häufig vor der positiven BSI-Diagnose5. Dieser Faktor führt zu einem umfangreichen Übermäßigen Einsatz von Antibiotika, der – zusammen mit einem übermäßigen Antibiotikaeinsatz in anderen Sektoren wie der Landwirtschaft – einen starken evolutionären Druck auf die Entwicklung von Antibiotikaresistenzen (AMR) erzeugt6,7. AMR ist derzeit eines der drängendsten globalen Gesundheitsprobleme7,8 und wird bis 2050 voraussichtlich zur häufigsten Todesursache werden9. Die Entwicklung von Resistenzen, zusammen mit der Ausbreitung von AMR-Stämmen, tritt in einem alarmierenden Tempo7,8,9 auf und übersteigt bei weitem die Entdeckungsrate neuer Antibiotika10. Weltweit entstehen kontinuierlich neue resistente Phänotypen, während
Forschung, die sich dem Verständnis der AMR-bezogenen Veränderungen widmet, ist oft langsam und durch verfügbare Ansätze begrenzt11. Darüber hinaus konzentrieren sich die häufig verwendeten Methoden wie die Polymerase-Kettenreaktion (PCR) und die Gesamtgensequenzierung (WGS) nur auf genotypische Veränderungen. Diese reichen nicht aus, um die Mechanismen derResistenz 11aufzudecken, was zu einem dringenden Bedarf an einem Forschungswerkzeug führt, das es ermöglicht, die chemische Zusammensetzung von Bakterien zu verstehen.
Die Infrarotspektroskopie (IR) liefert eine molekulare Charakterisierung der Probe und ist damit ein vielversprechender Kandidat für die phänotypische bakterielle Sondierung. Seit seinen frühen Anwendungen12wurde eine große Anzahl von Beispielen seiner Verwendung in der Literatur13,14nachgewiesen. Dazu gehören die phänotypische Identifizierung von Bakterien auf Gattung15, Art16und Stamm17,18 Ebene. Die räumliche Auflösung herkömmlicher IR ist jedoch aufgrund der Wellenlängenbeugung aufgrund der räumlichen Auflösungsgrenze19auf mehrere Mikrometer beschränkt. Da die Größe der mehrheitlich bakterien unterhalb dieser Grenze liegt (z.B. Staphylococcus aureus ≈ 400 nm Durchmesser), ist herkömmliches IR für die Sondierung auf einzelzelliger oder intrazellulärer Ebene nicht anwendbar.
Die räumliche Auflösungsbeschränkung wurde kürzlich durch die Kombination von IR-Spektroskopie mit Rasterkraftmikroskopie (AFM-IR) überwunden. In diesem Fall wird die IR-Absorption indirekt durch thermische Ausdehnung des Materials19,20,21,22detektiert. Kurz gesagt, die Absorption von IR-Strahlung führt zu einem lokalen Temperaturanstieg. Dies kann entweder direkt23 oder durch die Messung der Schwingung der AFM-Auslegersonde gemessen werden, die sich aus einem Kraftimpuls ergibt, der durch IR-Absorption20,21erzeugt wird. Die kombinatorische AFM-IR-Technik ermöglicht eine räumliche Auflösung von annähernd 20 nm und liefert gleichzeitig Informationen über die lokalen physikalischen Eigenschaften einer Probe (AFM) und ihre chemische Zusammensetzung (AFM-IR). Die Erfassung sowohl einzelner Spektren von ausgewählten Spots als auch die Abbildung der Intensität ausgewählter Wellenzahlwerte innerhalb eines ausgewählten Bereichs sind möglich.
In Anbetracht der erreichbaren räumlichen Auflösung von AFM-IR ist es offensichtlich, dass die Technik die Möglichkeit der chemischen/phänotypischen Sondierung einzelner Bakterienzellen und ihrer intrazellulären Zusammensetzung eröffnet24. Bisher wurden mehrere Beispiele für die Anwendung von AFM-IR bei einzelnen Bakterien in der Literatur19,20,21,22,25 ,26,27,28nachgewiesen. Diese beinhalten einzelspektrale Analysen19,21,22 und Mapping auf der subzellulären Ebene19,22,25,26,27,28. Zum Beispiel wurde die Fähigkeit beschrieben, intrazelluläre Lipidvesikel27 und Viren28 innerhalb eines einzelnen Bakteriums nachzuweisen. Diese Ergebnisse zeigen die Nützlichkeit von AFM-IR für nanoskalige Studien an einzelnen Bakterien und klinisch relevanten Krankheitserregern19.
Daher präsentieren wir eine Probenvorbereitungs- und -entnahmemethode für AFM-IR-Daten von mehrschichtigen, monoschichtigen und einzelligen Bakterienproben. Das hier beschriebene Protokoll wurde angewendet, um verschiedene Bakterienarten22 und die Veränderungen ihrer chemischen Zusammensetzung zu untersuchen. Insbesondere wurde die in vivo Entwicklung von Vancomycinresistenz und Daptomycin-Nicht-Suszeptibilität in klinischen Paaren von S. aureus19untersucht. Sowohl die intermittierende Resistenz von Vancomycin als auch die Nichtanfälligkeit von Daptomycin bei S. aureus (VISA und DpR) traten erst vor relativ kurzer Zeit auf, nachdem diese Antibiotika vermehrt eingesetzt und in Kliniken einmedizinisches Problem eingesetzt wurden. Darüber hinaus bleibt insbesondere der Mechanismus der Nichtanfälligkeit von Daptomycin nach wie vor schwer fassbar und behindert die Entwicklung alternativer Arzneimittel19,29. Das vorgestellte Protokoll konzentriert sich auf die Bereitstellung zuverlässiger AFM-IR-Spektren einzelner Bakterien, die mit einer Vielzahl von chemometrischen Ansätzen entsprechend den experimentellen Zielen weiter analysiert werden können. Es beinhaltet zusätzlich den Mapping-Ansatz, der für intrazelluläre Studien anwendbar ist.
Protokoll
Alle Arbeiten mit pathogenen Bakterien sollten mit geeigneten Sicherheitsmaßnahmen durchgeführt werden. Dazu gehören die Arbeit in einem Labor mit ausreichender Biosicherheit und in einer Biosicherheitskabine (PC2) sowie die sorgfältige Dekontamination des Arbeitsbereichs mit einem geeigneten Desinfektionsmittel, z.B. 80%iger Ethanollösung. Geeignete PSA müssen die ganze Zeit getragen werden.
1. Herstellung von Lösungsmitteln und Materialien
- Lösungsmittel: Verwenden Sie Reinstwasser als Lösungsmittel. Verwenden Sie gereinigtes Wasser, das vor dem Experiment autoklaviert wurde, um eine mögliche Kreuzkontamination zu vermeiden.
- Substrat: Verwenden Sie eines dieser Substrate für AFM-IR, z. B. ZnSe, CaF2,BaF2usw. Da AFM-IR im Prinzip eine zerstörungsfreie Technik ist, kann man eine Vielzahl anderer Forschungswerkzeuge auf die gleiche Probe nach afM-IR-Analyse anwenden. Beispielsweise kann eine Korrelation der Ergebnisse mit der Raman-Spektroskopie durchgeführt werden, wenn Raman-Objektträger Der CaF2- oder BaF2-Grad verwendet werden.
- Verwenden Sie Glasfläschchen anstelle von Kunststoffröhrchen, da Kunststoff die Probe kontaminieren kann.
2. Probenvorbereitung für AFM-IR
- Wachstum/Inkubation der Probe
- Züchte Bakterien in flüssigen Medien oder auf festen Platten. Wählen Sie die Art des Mediums, die Wachstumsbedingungen (z. B. Temperatur, Verfügbarkeit von Sauerstoff) und die Wachstumszeit entsprechend den spezifischen Anforderungen der untersuchten Bakterienart. Zum Beispiel können für S. aureus Heart Infusion (HI) Agarplatten verwendet werden, mit Wachstum für 16 h bei 37 ° C unter aeroben Bedingungen.
HINWEIS: Um die besten Ergebnisse zu erzielen, sollte das Wachstum / die Inkubation genügend Bakterien liefern, die die Entnahme eines Mikropellets der Probe ermöglichen würden. Die spezifische Anzahl der koloniebildenden Einheiten oder Bakterienzellen hängt von der Art und Größe des Bakteriums ab.
- Züchte Bakterien in flüssigen Medien oder auf festen Platten. Wählen Sie die Art des Mediums, die Wachstumsbedingungen (z. B. Temperatur, Verfügbarkeit von Sauerstoff) und die Wachstumszeit entsprechend den spezifischen Anforderungen der untersuchten Bakterienart. Zum Beispiel können für S. aureus Heart Infusion (HI) Agarplatten verwendet werden, mit Wachstum für 16 h bei 37 ° C unter aeroben Bedingungen.
- Probenabscheidung
- Sammeln Sie mit einer sterilen Schlaufe vorsichtig Bakterien aus den Kolonien auf der Agarplatte und übertragen Sie sie in ein Glasrohr. Sammeln Sie Bakterien nur von der Spitze der Kolonien. Wenn Sie Proben aus einer flüssigen Kultur mit einer Pipette entnehmen, werden etwa 1 ml der Bakteriensuspension in ein Glasröhrchen übertragen. Das Volumen kann je nach Bakterienbelastung verändert werden.
HINWEIS: Es ist wichtig zu versuchen, kein Medium unter der Kolonie zu sammeln (oder so weit wie möglich zu minimieren). Die nachfolgenden Schritte der Probenvorbereitung zielen darauf ab, mögliche Medienreste zu entfernen. Die Minimierung des potenziellen Mediumsrests von Anfang an ermöglicht die spektrale Erfassung von Daten aus gereinigten Bakterienzellen. Die Schritte 2.2.2 und 2.2.3 gelten für Proben, die aus Agarplatten hergestellt wurden. Für Proben, die aus flüssigen Medien hergestellt wurden, fahren Sie mit Schritt 2.2.4 fort. - Fügen Sie 1 ml Reinstwasser in das Rohr hinzu. Wirbel bis zum gesammelten Bakterienpellet sind am Boden des Röhrchens nicht mehr sichtbar (typischerweise 1–2 min).
- Schätzen Sie die grobe Trübung der Lösung unter Verwendung z. B. mcFarland-Standards durch visuellen Vergleich30 zwischen der vorbereiteten Lösung und McFarland-Standards. Wenn die Trübung der Bakteriensuspension sehr gering zu sein scheint, fügen Sie mehr Bakterien von der Platte hinzu, indem Sie eine sterile Schleife und einen Wirbel verwenden. Wiederholen Sie diesen Vorgang, bis die grobe Trübung der Lösung mit den McFarland-Standards 0,5 und 1 vergleichbar ist. Dies führt im Allgemeinen zu einer guten Menge an Bakterienpellets.
- Zentrifugieren Sie die Bakteriensuspension bei 3.000 x g für 5 min, um ein Pellet zu erhalten.
HINWEIS: Zentrifugationsparameter können modifiziert werden, um bakterienpellets zu erhalten. Vorsicht ist geboten, wenn die g-Kraft erhöht wird, um keinen Bakterienbruch zu induzieren (insbesondere bei gramnegativen Bakterien). - Entfernen Sie mit einer Pipette vorsichtig den Überstand über dem Pellet. Fügen Sie 1 ml Reinstwasser in das Rohr und den Wirbel hinzu, um das Pellet wieder aufzuhängen. Anschließend zentrifugiert man die Probe wie in Schritt 2.2.4.
- Wiederholen Sie den Waschvorgang (Schritte 2.2.2 und 2.2.4) mindestens dreimal. Im Falle der Entnahme der Ausgangsprobe aus flüssigen Medien wiederholen Sie den Vorgang mindestens viermal (Medienentfernung gefolgt von drei Waschgängen).
- Nach der letzten Wäsche den Überstand entfernen, Reinstwasser und Wirbel für mindestens 2 min hinzufügen. Anschließend werden 5 μL der Probe auf dem Substrat abgelegt (z. B. Raman-Qualität CaF2).
- Wenn die gewünschte Dicke der Probe eine Multischicht von Bakterien ist, lassen Sie die Probe an der Luft trocknen.
- Wenn die gewünschte Dicke Monoschicht oder einzelne Bakterien ist, fügen Sie unmittelbar nach dem Ablegen der Probe (Schritt 2.2.7) zwischen 20-100 μL Reinstwasser hinzu und mischen Sie es vorsichtig mit einer Pipettenspitze. An der Luft trocknen lassen.
HINWEIS: Das genaue Wasservolumen kann zwischen den Experimenten variieren, da es von vielen Faktoren abhängt (z. B. Größe des Organismus, Dichte des Pellets usw.) und daher am besten empirisch bestimmt wird. Die Vorbereitung einer Reihe von Proben mit unterschiedlichen Mengen an Zuträtung von Reinstwasser ermöglicht es, eine Probe mit der gewünschten Dicke / Dichte von Bakterien auszuwählen. Die Dicke/Dichte von Bakterien kann in den nachfolgenden Stufen einfach über AFM visualisiert werden. Beispiele für AFM-Bilder aus Monolayer- und Einzelzellproben sind in Abbildung 1A–H dargestellt. - Montieren Sie das Substrat auf einer AFM-Metallprobenscheibe mit doppelseitigem Klebeband.
- Sammeln Sie mit einer sterilen Schlaufe vorsichtig Bakterien aus den Kolonien auf der Agarplatte und übertragen Sie sie in ein Glasrohr. Sammeln Sie Bakterien nur von der Spitze der Kolonien. Wenn Sie Proben aus einer flüssigen Kultur mit einer Pipette entnehmen, werden etwa 1 ml der Bakteriensuspension in ein Glasröhrchen übertragen. Das Volumen kann je nach Bakterienbelastung verändert werden.
3. Instrumentenvorbereitung
HINWEIS: Die hier beschriebenen instrumentellen Verfahren gelten für das in der Materialtabelle aufgeführte Instrument. Das instrumentelle Detailverfahren kann geringfügig von dem hier beschriebenen abweichen, wenn ein neueres Modell des AFM-IR-Instruments verwendet wird.
- Schalten Sie das Instrument ein und initialisieren Sie es, indem Sie die Initialize-Taste drücken. Stellen Sie sicher, dass sich der Laserverschluss für den Lasertest in der offenen Position befindet.
- Wenn ein Spülsystem eingerichtet ist, spülen Sie das Gerät mit N2, indem Sie den Durchfluss vonN2 einschalten. Stellen Sie die Stickstoffspülung ein, um eine stabile Luftfeuchtigkeit (z. B. 20%) zu erreichen. Stellen Sie sicher, dass die Luftfeuchtigkeit während der Messungen und zwischen Hintergrund- und Probendatenerfassung nicht schwankt. Es wird empfohlen, ca. 20 Minuten Zeit für die Stabilisierung der Luftfeuchtigkeit zu lassen.
- Laden Sie die Probe durch Drücken der Taste Load in die Probenkammer. Das Laden der Proben erfolgt über den Software-Assistenten. Konzentrieren Sie sich bei der Bedienung des Software-Assistenten zunächst auf die Spitze, bewegen Sie den Mikroskopstand mit Pfeilen in Z-Richtung und klicken Sie auf Weiter. Zweitens, passen Sie den Datenerfassungspunkt mit Pfeilen an, die die Bewegung in der Ebene leiten, und richten Sie den AFM-Laser und den AFM-Detektor mit den Knöpfen auf der Oberseite des AFM-Kopfes aus. Konzentrieren Sie sich anschließend auf die Probenoberfläche, indem Sie den Mikroskoptischstuf in Z-Richtung bewegen.
HINWEIS: Detaillierte Abbildungen zu jedem Schritt des Probenladens finden Sie im Softwarehandbuch31. Die Fokussierung auf die Probe sollte mit Vorsicht erfolgen. Wenn Sie sich der Probenoberfläche in Z-Richtung nähern, verwenden Sie eine langsame Motordrehzahl. - Nähern Sie sich dem Beispiel, ohne sich zu engagieren, indem Sie auf die Schaltfläche Ansatz klicken.
4. Datenerhebung
- Hintergrund
- Sammeln Sie vor der Datenerfassung den Hintergrund. Stellen Sie für die Hintergrunderfassung sicher, dass sich der Laserverschluss in der Position Offen befindet. Wählen Sie den Spektralbereich und die Auflösung (abhängig vom Ziel der Analyse) sowie die Anzahl der Scans und die Anzahl der Co-Mittelwerte des Hintergrunds. Diese werden im Allgemeinen als hoch empfohlen (z. B. 1024 Scans und 3 Co-Durchschnittswerte).
HINWEIS: Generell werden eine spektrale Auflösung von 4 cm-1 oder 8 cm-1 und Spektralbereiche von 3.200 cm-1–2.800 cm-1 und 1.800 cm-1–900 cm-1 empfohlen. - Speichern Sie nach dem Erfassung des Hintergrunds die Hintergrunddatei. Die Datei wird nicht automatisch gespeichert. Ändern Sie die Laserverschlussposition in Schließen.
- Sammeln Sie vor der Datenerfassung den Hintergrund. Stellen Sie für die Hintergrunderfassung sicher, dass sich der Laserverschluss in der Position Offen befindet. Wählen Sie den Spektralbereich und die Auflösung (abhängig vom Ziel der Analyse) sowie die Anzahl der Scans und die Anzahl der Co-Mittelwerte des Hintergrunds. Diese werden im Allgemeinen als hoch empfohlen (z. B. 1024 Scans und 3 Co-Durchschnittswerte).
- Probe – einzelne Spektren
- Drücken Sie die Taste Engage , um das Beispiel zu betraufen. Das System beginnt sich der Probenoberfläche zu nähern, bis ein direkter Kontakt erkannt wird.
HINWEIS: Der in dieser Arbeit verwendete Sollpunkt lag zwischen 0,15 und 2 V und die Rückkopplungsgewinne (I Gain und P Gain) würden normalerweise auf 3 und 10 eingestellt. NIR2-Kontaktsonden werden üblicherweise mit nanoIR2-System verwendet (Modell: PR-EX-nIR2-10, Resonanzfrequenz (kHz): 13 +/−4 kHz, Federkonstante (N/m): 0,07−0,4 Nm-1). - Sammeln Sie ein AFM-Bild, um die Oberfläche zu visualisieren. Scannen Sie zunächst einen größeren Bereich (z. B. 50 x 50 μm) mit geringerer räumlicher Auflösung (z. B. 200 x 200 Punkte) (Abbildung 1I).
HINWEIS: AFM-IR-Daten werden immer im Kontaktmodus gesammelt, die AFM-Daten können jedoch im Kontakt- oder Tapping-Modus gesammelt werden. - Wählen Sie aus dem AFM-Höhen-/Ablenkbild einen bestimmten Interessenbereich aus und stellen Sie ihn mit höherer räumlicher Auflösung neu ab (Abbildung 1J–K). Stellen Sie sicher, dass die Geschwindigkeit der Datenerfassung bei langsamer Spitzenbewegung angemessen ist (z. B. Scanrate 0,2–0,4 Hz).
- Wählen Sie die Messstelle (z. B. einzelnes Bakterium) und bewegen Sie die Spitze zur Stelle.
- Richten Sie den IR-Laser aus. Verwenden Sie dazu eine Wellenzahl, bei der die Probe absorbiert. Bei biologischen Materialien kann dies z.B. Amid I (1655 cm-1)sein. Stellen Sie sicher, dass der Bandpassfilter ausgeschaltet ist und klicken Sie auf Start IR. Der rechte Graph im nanoIR-Meter (FFT der Ablenkung, die als Amplitude vs. Frequenz angezeigt wird) sollte mindestens einen klaren Peak zeigen und der linke Graph (Ablenkung vs. Zeit) sollte eine periodische Wellenform aufweisen. Wenn dies nicht der Fall ist, fahren Sie mit der Optimierung der IR-Spots fort.
HINWEIS: Auch wenn die Fast Fourier Transform (FFT) und die Ablenkung das erwartete Profil zeigen, wird empfohlen, die Optimierung von IR-Spots für mindestens mehrere Wellenzahlen durchzuführen, bei denen Bänder erwartet werden. - Optimieren Sie die Hot Spots für die IR-Datenerfassung mit den ausgewählten Wellenzahlwerten. Es kann hilfreich sein, ein herkömmliches IR-Spektrum der Bakterien (z. B. ATR-Spektrum des Bakterienpellets) zu verwenden, um die Positionen der Bänder zu identifizieren und die Hot Spots zu optimieren. Wählen Sie verschiedene Wellenzahlwerte (z. B. 8–10) aus verschiedenen Spektralbereichen aus.
HINWEIS: Wenn das konventionelle IR-Spektrum von Bakterien von Interesse nicht vor der AFM-IR-Datenerfassung gesammelt werden konnte, können die in der Literatur verfügbaren Bakterienspektren als grobe Anleitung verwendet werden. Das Ergebnis der Optimierung eines IR-Spots ist ein Bild, das eine Karte des FFT-Magnitudensignals an jeder x- und y-Position darstellt. Der Standort mit dem größten Signal wird automatisch ausgewählt. Beispiele für solche Bilder sind im Softwarehandbuch31angegeben. - Nachdem Sie die IR-Spots für ausgewählte Wellenzahlwerte optimiert haben, definieren Sie die Parameter der spektralen Datenerfassung: Spektralbereich, spektrale Auflösung, Anzahl der Scans und angewendete Leistung und geben Sie diese in die entsprechenden Fenster in der Software ein. Die spektrale Auflösung sollte mit der Hintergrundauflösung übereinstimmen und der Spektralbereich sollte innerhalb des Spektralbereichs liegen, für den der Hintergrund gesammelt wurde.
HINWEIS: Ein generischer Anfangssatz von Parametern könnte sein: Spektralbereich: 3200 cm-1–2800 cm-1 und 1800 cm-1–900 cm-1, spektrale Auflösung: 4 cm-1 oder 8 cm-1, Anzahl der Scans: 512–2048. - Passen Sie bei Bedarf die Laserleistung in Abhängigkeit vom Signal an. Im Allgemeinen sollten Werte zwischen 8% und 10% der Laserleistung für eine gute Signalqualität ausreichen. Höhere Werte können mit Vorsicht verwendet werden, da sie zu Probenschäden führen können.
HINWEIS: Die prozentuale Laserleistung kann je nach IR-Lasertyp variieren. Die hier angegebenen Prozentwerte beziehen sich auf den OPO-Laser. - Klicken Sie auf Erwerben, um das AFM-IR-Spektrum zu erfassen.
- Sammeln Sie die AFM-Daten aus demselben Bereich nach der Erfassung des AFM-IR-Spektrums erneut. Dies wird dringend empfohlen, da es eine mögliche Drift und/ oder einen zerstörerischen Einfluss auf die Probe aufdeckt.
- Wenn das AFM-IR-Spektrum zufriedenstellend ist und kein destruktiver Einfluss auf die Probe beobachtet wird, fahren Sie mit der Datenerfassung fort. Definieren Sie bei Bedarf eine Reihe von Punkten für die Datenerfassung mit der Option Array und dem erfassten AFM-Höhen- oder Ablenkungsbild. Diese Option ermöglicht es, Spektren nacheinander von jedem Punkt mit den gleichen spektralen Parametern zu sammeln, die für ein einzelnes Spektrum definiert sind.
- Wenn das AFM-Bild, das nach der Entnahme des AFM-IR-Spektrums gesammelt wurde, einen zerstörerischen Einfluss auf die Probe (typischerweise eine verbrannte Stelle) zeigt, reduzieren Sie die Leistung; Wählen Sie eine andere Stelle aus und wiederholen Sie die Schritte 4.3.8 bis 4.3.11.
- Wenn das Signal im AFM-IR-Spektrum nicht zufriedenstellend ist, überprüfen Sie die Richtigkeit der Optimierung von IR-Spots (Schritt 4.3.6). Wenn es richtig ist, erhöhen Sie die Laserleistung leicht und wiederholen Sie die Schritte 4.3.7–4.3.11. Dies kann wiederholt werden, bis ein zufriedenstellendes Signal erreicht ist.
- Drücken Sie die Taste Engage , um das Beispiel zu betraufen. Das System beginnt sich der Probenoberfläche zu nähern, bis ein direkter Kontakt erkannt wird.
- Beispiel – bildgebender Ansatz
HINWEIS: Es wird dringend empfohlen, ein einzelnes AFM-IR-Spektrum des Bakteriums aufzuzeichnen, bevor ein Intensitätsverteilungsbild für einen ausgewählten Wellenzahlwert gesammelt wird.- Zeichnen Sie ein AFM-Bild des ausgewählten Probenbereichs auf. Sammeln Sie dazu zunächst afM-Bild eines größeren Bereichs mit geringerer räumlicher Auflösung (z. B. 50 x 50 μm, 200 x 200 Punkte), wählen Sie dann einen interessanten Bereich aus und sammeln Sie ein AFM-Bild mit erhöhter räumlicher Auflösung (wie in Abbildung 1I–Kdargestellt).
- Wählen Sie die Wellenzahlwerte für die AFM-IR-Bildgebung aus.
- Stellen Sie sicher, dass der IR-Spot des Lasers für die ausgewählten Wellenzahlwerte optimiert ist (Schritt 4.3.6). Wenn der IR-Spot für einige Wellenzahlen nicht optimiert ist (kein klares Maximum), optimieren Sie ihn für sie.
- Definieren Sie die Parameter des abgebildeten Bereichs: Breite und Höhe, Anzahl der Datenpunkte in X- und Y-Richtung.
HINWEIS: Wenn die aufeinanderfolgende Auswahl von Spots aus den vorherigen AFM-Bildern angewendet wird (wie in Abbildung 1I–Kgezeigt), werden die Felder für Breite und Höhe bei der Markierung des Bereichs automatisch ausgefüllt. - Definieren Sie die Parameter der spektralen Signalerfassung: Wellenlänge, Anzahl der Scans und Laserleistung.
HINWEIS: Die Anzahl der Scans muss im Rahmen des Zumutbaren gehalten werden. 64 oder 32 Scans ermöglichen in der Regel eine ausreichende Signalmenge. - Definieren Sie die Parameter der AFM-Spitzenbewegung, indem Sie auf die Scanrateklicken. Je höher die Anzahl der Scans im vorherigen Schritt und die Anzahl der Datenpunkte in X-Richtung ist, desto langsamer müssen die Spitzenbewegungen sein. Mangelnde Anpassung zwischen diesen Parametern führt zu einer zu schnellen Bewegung der Spitze, wodurch die tatsächliche Erfassung einer definierten Anzahl von Scans von jedem Punkt verhindert wird.
HINWEIS: Für eine geeignete Erfassung des IR-Signals mit 64 Co-Additionen und 200 Punkten stellen Sie beispielsweise die Scanrate auf 0,07 kHz ein. - Stellen Sie sicher, dass das Kontrollkästchen IR-Bildgebung aktivieren aktiviert ist.
- Beginnen Sie mit der Bildgebung. AFM-IR der Signalintensität bei der gewählten Wellenzahl wird gleichzeitig mit den AFM-Daten aus diesem Bereich gesammelt.
HINWEIS: Wenn der OPO-Laser verwendet wird, ist es möglich, zusätzlich gleichzeitig Kontaktresonanz-Spitzenfrequenzbild zu sammeln. Dies kann verwendet werden, um Informationen über die relative Steifigkeit der Probe an verschiedenen Stellen zu erhalten. - Verwenden Sie das Fenster Sequenz erfassen, um eine aufeinanderfolgende Sammlung von AFM-IR-Daten aus demselben Bereich mit den gleichen Parametern, aber für unterschiedliche Wellenzahlwerte festzulegen. Öffnen Sie dazu das Fenster Capture Sequence, geben Sie jede Wellenzahl ein und definieren Sie die angewendete Laserleistung (für jede Wellenzahl).
- Exportieren Sie die gesammelten Daten (AFM und AFM-IR, Einzelspektren und Bildgebung) in verschiedene Formate und analysieren Sie sie mit Methoden, die für spezifische Forschungsziele geeignet sind.
Ergebnisse
Das beschriebene Protokoll ermöglicht es, eine Reihe von Arten von Zellverteilungen von Bakterien auf dem Substrat zu erhalten, abhängig von der Anfangskonzentration der Probe und der Menge des zugesetzten Wassers. Abbildung 1 zeigt die Beispiele von AFM-Bildern (Höhe und Ablenkung), die von Monoschichten und Einzelzellproben aufgenommen wurden, die nach dem beschriebenen Protokoll von grampositiven (S. aureus) und gramnegativen (Escherichia coli) Bakterien hergestellt wurden.
Das hier beschriebene Protokoll kann für die AFM-IR-Bildgebung von intra- und extrazellulären Strukturen einzelner Bakterien verwendet werden. Ein Beispiel für diese Anwendung ist in Abbildung 2dargestellt, die die Ergebnisse der Überwachung der räumlich lokalisierten chemischen Veränderungen zeigt, die während der Teilung einer S. aureus-Zelle auftreten. Obwohl die Lufttrocknung allgemein als Fixierungsansatz für die bakterielle Zubereitung angesehen wird, zeigen Bakterien von Natur aus eine sehr hohe Resistenz gegen äußere Faktoren wie Temperatur und es wurde berichtet, dass sie die Dehydrierung überleben32. Die hier vorgestellten Ergebnisse wurden aus einer luftgetrockneten Probe gewonnen. Die Bildung eines Septums, das vor der Zellteilung auftrat, wurde beobachtet und mittels AFM-Bildgebung (Abbildung 2A-D) durch Sammlung von 12 Bildern desselben Bereichs nacheinander überwacht (Sammlung eines einzelnen Bildes ≈ 20 min). Abbildung 2A–D zeigt 4 ausgewählte AFM-Bilder mit einer Zeit zwischen der Erfassung jedes Bildes von ca. 40 Min. Die gebildete Struktur (Septum) ist 45 nm hoch. Das gebildete Septum ist in AFM-Höhen- und Ablenkbildern deutlich sichtbar (Abbildung 2E–F). Die AFM-IR-Spektren, die aus dem Zell- und Septumbereich aufgezeichnet wurden (Abbildung 2G, in Abbildung 2Fmarkierte Ursprungspunkte ) wurden vor dem Vergleich auf das Amid-I-Band normalisiert, um den Einfluss unterschiedlicher Probendicke zwischen den Datenerfassungspunkten zu minimieren. Das AFM-IR-Spektrum des Septums zeichnet sich durch eine höhere relative Intensität der Bänder bei 1240 und 1090 cm-1 im Vergleich zum AFM-IR-Spektrum aus der Zellfläche aus. Diese werden Kohlenhydrat- und Phosphodiestergruppen von Zellwandkomponenten (einschließlich z.B. Peptidoglykan und Teichotinsäure)zugeschrieben 22.
Das beschriebene Protokoll kann auch zum Vergleich einer einzelnen Spektren zwischen einer Reihe verschiedener Proben verwendet werden. Ein Beispiel für diese Anwendung zusammen mit den Ergebnissen ist in Abbildung 3 und Abbildung 4 dargestellt. Ziel der Studie ist es, die chemischen Veränderungen zu bestimmen, die infolge der in vivo Entwicklung einer intermittierenden Vancomycin-Resistenz bei S. aureus (VISA) auftreten. Zu diesem Zweck wurden klinische Probenpaare von Patienten entnommen, wobei der Elternstamm bei der Aufnahme in das Krankenhaus und vor der Antibiotikatherapie (Vancomycin susceptible S. aureus,VSSA) und der Tochterstamm nach Aufnahme von Antibiotika und klinischem Versagen vom selben Patienten isoliert wurde. Die Proben wurden auf Agarmedium weiter gezüchtet und gemäß dem Protokoll vorbereitet (Abbildung 3A–B). Die AFM-IR-Spektren wurden von mehreren einzelnen Bakterien (und mehreren Proben) für VSSA und VISA gesammelt und anschließend mit mehreren chemometrischen Ansätzen analysiert (Abbildung 3C).
Es wurden keine morphologischen Unterschiede zwischen VSSA- und VISA-Zellen beobachtet (Abbildung 4A–C). Die AFM-IR-Spektren (Abbildung 4D,F) und ihre zweiten Derivate (Abbildung 4E,G) zeigten jedoch einen deutlichen Unterschied in der chemischen Zusammensetzung zwischen resistenten und anfälligen Stämmen. Die relative Intensität der mit Kohlenhydrat- und Phosphodiestergruppen assoziierten Bänder aus Zellwandkomponenten (insbesondere das Band bei 1088 cm-1)nahm im resistenten Stamm im Vergleich zum anfälligen Gegenstück deutlich zu. Bemerkenswert ist die Tatsache, dass alle umcodierten Spektren (VISA: 81, VSSA: 88) eine kleine Standardabweichung aufweisen. Dies zeigt eine gute Reproduzierbarkeit der Daten, die von verschiedenen Proben aufgezeichnet wurden, die aus demselben Stamm hergestellt wurden, da keine Unterscheidung zwischen Spektren möglich war, die von verschiedenen Proben desselben Stammes aufgezeichnet wurden. Die beobachteten Unterschiede deuteten auf eine erhöhte Dicke der Zellwand bei resistenten Stämmen im Vergleich zum anfälligen Gegenstück hin, was in Übereinstimmung mit anderen Literaturberichten33,34bleibt.

Abbildung 1: Repräsentative AFM-Bilder verschiedener Bakterienproben für AFM-IR-Messungen. Abhängig von der Verdünnung auf dem Substrat ermöglicht das Protokoll, Mehrschichten und Monoschichten von Bakterien sowie Einzelzellproben zu erhalten. Repräsentative AFM-Aufnahmen von: (A–D) Monoschicht- und (E-H) Einzelzellprobe für (A, B, E, F) Gram-positive (S. aureus) und (C, D, G, H) Gram-negative (E. coli) Bakterien. (A,C,E,G) zeigen Höhenbilder und (B,D,F,H) entsprechende Ablenkbilder. Größe der abgebildeten Bereiche: (A-D,G,H) 20 x 20 μm, (E,F) 50 x 50 μm. (I–K) fortlaufende Auswahl eines Bereichs für AFM-IR-Mapping. Dies wird mittels AFM-Bildgebung mit zunehmender räumlicher Auflösung am Beispiel einer einzelnen S. aureus-Zelle erreicht. Jedes Bild wird durch Sampling von 200 x 200 Punkten gesammelt, wobei die räumliche Auflösung aufgrund der Verringerung der Größe des bildbebilderten Bereichs zunimmt. Größe der abgebildeten Bereiche: (I) 40 x 40 μm, (J) 20 x 20 μm und (K) 2,24 x 2,24 μm. Das schwarze Quadrat in (I) markiert den in (J) abgebildeten Bereich. Das schwarze Quadrat in (J) markiert den in (K) abgebildeten Bereich. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
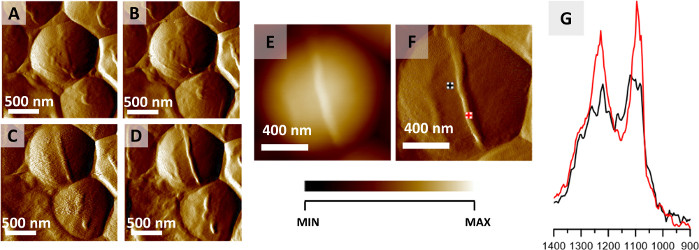
Abbildung 2: Überwachung der S. aureus Zellteilung über AFM-IR. (A–D) AFM-Bilder der S. aureus-Zelle, die die Bildung des Septums vor der Zellteilung zeigen. Größe der bildierten Fläche: 2 x 2 μm. Die Bilder wurden aus einer größeren Serie ausgewählt (12 Bilder alle 20 Minuten) und stellen Daten dar, die alle 40 Minuten aufgezeichnet wurden. (E-F) AFM-Höhen- und Ablenkbild, das am Ende der Zellseptumbildung mit markierten Sammelpunkten von AFM-IR-Spektren aufgenommen wurde. Größe der abgebildeten Fläche 1,17 x 1,15 μm. Die Höhe der neu gebildeten Struktur beträgt 45 nm. (G) AFM-IR-Spektren, die aus der Zellfläche (schwarz) und der Septumfläche (rot) (markiert in (F)) im Bereich von 1400–900 cm -1 aufgezeichnetwurden. Beide Spektren wurden auf das Amid-I-Band normalisiert und zeigen eine Erhöhung der relativen Intensität der Zellwandkomponenten aus dem Septum. Diese Zahl wurde von K. Kochan et al.22modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
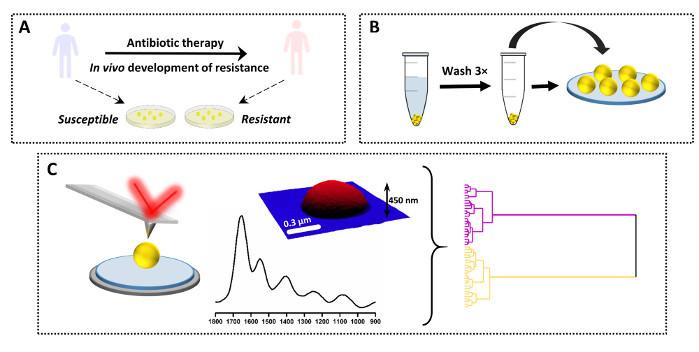
Abbildung 3: Ein Überblick über das experimentelle Design für die AFM-IR-Studie zur Antibiotikaresistenz. (A) Probenherkunft und erstvorbereitung: Der anfällige Elternstamm wurde vor der Antibiotikatherapie von einem Patienten entnommen, und der tochterresistente Stamm wurde nach Antibiotikatherapie und klinischem Versagen (In-vivo-Resistenzentwicklung) von demselben Patienten bezogen. Bakterien wurden isoliert und auf Herzinfusions-Agar (HI) für 16 h bei 37 °C kultiviert. (B) Anschließende Probenvorbereitung für AFM-IR, einschließlich Entnahme der Probe, gefolgt von Waschen der Bakterienpalette (3×) und Abscheidung der Probe. (C) AFM-IR Datenerfassung und -analyse: AFM-Höhe und AFM-IR-Spektrum (1800–900 cm-1). Größe des AFM-Bildbereichs: 1,7 x 1,4 μm. Das AFM-IR-Spektrum wurde von der Mitte der Zelle gesammelt. Die Daten wurden anschließend mit chemometrischen Ansätzen, einschließlich hierarchischer Clusteranalyse, analysiert. Diese Zahl wurde von K. Kochan et al.19modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
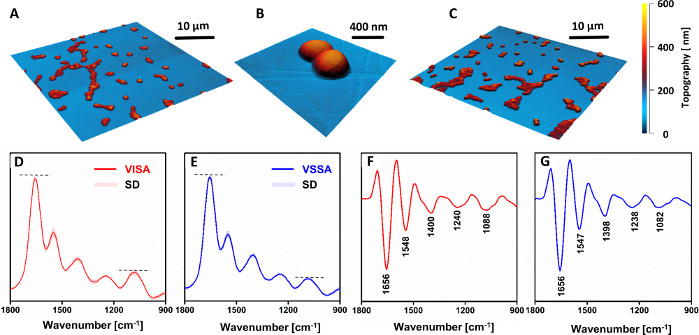
Abbildung 4: AFM- und AFM-IR-Ergebnisse der Untersuchung chemischer Veränderungen in Vancomycin Intermediate S. aureus (VISA) im Vergleich zu Vancomycin-anfälligem S. aureus (VSSA) in klinischen Paaren. AFM-Bilder von (A–B) VISA und (C) VSSA Einzelzellproben. Größe der abgebildeten Bereiche: (A,C) 40 x 40 μm, (B) 2,56 x 2,45 μm. (D–E) Mittlere AFM-IR-Spektren und ihre (F-G) zweiten Derivate für: (D, F) VISA und (E, G) VSSA-Zellen, im Spektralbereich 1800-900 cm-1. Die dargestellten Spektren sind durchschnittlich 81 (VISA) und 88 (VSSA) Einzelspektren und werden zusammen mit der Standardabweichung (SD) dargestellt. Die Mittelwertbildung wurde nach Normalisierung aller einzeln Spektren zusammen durchgeführt. Die Hauptbänder sind in (F–G) markiert. Diese Zahl wurde von K. Kochan et al.19modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Bilddrift über die aufeinanderfolgende Registrierung von AFM-IR-Karten bei ausgewählten Wellenzahlwerten für die S. aureus-Zelle. (Obere Zeile): AFM-Bilder wurden gleichzeitig mit den entsprechenden (unteren Reihe) AFM-IR-Karten basierend auf der Intensität des IR-Signals bei ausgewählten Wellenzahlwerten aufgenommen. Die Wellenzahlwerte (966, 1055, 1079, 1106, 1234, 1398, 1454, 1540, 1656, 1740 cm-1) sind oberhalb der unteren Reihe mit Anmerkungen versehen. Jedes Set (AFM-Bild und AFM-IR-Karte) wurde direkt nach dem vorherigen Bild aufgenommen (ca. 40 min pro Set). Die Größe des abgebildeten/kartierten Bereichs: 1,54 x 1,57 μm. Zwischen den Bildern ist eine deutliche Drift sichtbar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die Nützlichkeit der IR-Spektroskopie zur Charakterisierung eines breiten Spektrums biologischer Proben im Kontext ihrer chemischen Zusammensetzung ist gut belegt. In den letzten zehn Jahren hat sich die IR-Spektroskopie zu einem vielversprechenden Werkzeug für Bakterienstudien entwickelt12,13,14,15,16,17. Es stößt weiterhin auf großes Interesse auf dem Gebiet der Mikrobiologie, als eine der wenigen Techniken, die eine phänotypische Charakterisierung durch die chemische Zusammensetzung ermöglichen. In diesem Zusammenhang liegt der Hauptnachteil der herkömmlichen FTIR-Mikroskopie in der begrenzten räumlichen Auflösung, die Einzelzell- und subzelluläre Untersuchungen von Bakterien verhindert. Tatsächlich stellt die geringe Größe der Bakterien nicht nur für IR, sondern auch für die überwiegende Mehrheit der Techniken ein Hindernis dar. Daher sind die verfügbaren Forschungswerkzeuge für einzellige und subzelluläre Untersuchungen von Bakterien signifikant begrenzt. Die Kombination von AFM mit IR ermöglicht es, die räumliche Auflösungsbeschränkung der IR-Spektroskopie zu überwinden und bietet ein neuartiges Werkzeug für die Bakterienforschung, das in der Lage ist, die chemische Zusammensetzung im Nanomaßstab zu untersuchen.
Die Technik ist nicht auf Einzelzellstudien beschränkt und ermöglicht es, eine Vielzahl von Proben mit unterschiedlicher Dicke zu untersuchen. Zweifellos ist eine saubere und sorgfältige Probenvorbereitung entscheidend, um qualitativ hochwertige Bilder zu erzielen. Das hierin enthaltene Protokoll bietet eine Methode zur Herstellung von mehrschichtigen, einschichtigen und/oder einzelligen Proben verschiedener Bakterien (Abbildung 1). Die vorbereitete Probe hängt von mehreren Faktoren ab, einschließlich der anfänglichen Bakterienbelastung, der Verdünnung nach dem Waschen sowie der weiteren Verdünnung auf dem Substrat. Die Menge der Probe, die nach dem Verdünnen der gewaschenen Pellets und vor der Abscheidung auf dem Substrat erhalten wird, ermöglicht typischerweise die Vorbereitung zahlreicher Proben. Um die gewünschte Verteilung der Probe auf dem Substrat zu erhalten, ist es daher oft von Vorteil, eine Reihe von Proben vorzubereiten, die in ihrer Verdünnung reichen. Für Studien, die auf die Sammlung von AFM-IR-Spektren und nicht auf subzelluläre Bildgebung abzielen, kann die Modifizierung der Probenmenge (z. B. von Monoschicht zu Multischicht) von Vorteil sein, um die Intensität des Signals zu erhöhen.
Ein weiterer kritischer Aspekt bei der Probenvorbereitung ist die angemessene Entfernung von Mediumsrückständen. Abhängig von den gewählten Probenkulturmethoden wird die Probe entweder aus flüssigem Medium oder aus einer Agarplatte entnommen. In beiden Fällen ist es wahrscheinlich, dass der Mediumrest in der Probe vorhanden ist, wenn auch in viel geringerem Maße bei der Entnahme von Agarplatten. Da bakterielle Wachstumsmedien eine Fülle verschiedener biologischer Komponenten enthalten, ist es wichtig, eine angemessene Entfernung des Mediums sicherzustellen. Wir empfehlen drei Wäschen mit Reinstwasser für Agarplattenproben und mindestens vier Wäschen für Proben, die aus Medium gesammelt wurden. Die Anzahl der Waschungen kann bei Bedarf erhöht werden; Für den Vergleich zwischen verschiedenen Proben ist es jedoch wichtig, sie zwischen den Proben konsistent zu halten. Das demonstrierte Protokoll verwendet Wasser anstelle von Lösungsmitteln wie Phosphatpufferlösung (PBS) oder Kochsalzlösung. Sowohl PBS als auch Kochsalzlösung führen bei der Lufttrocknung zur Bildung von Kristallen, die die Bakterien schädigen können. Darüber hinaus sind beide eine Quelle intensiver IR-Bänder, wobei insbesondere PBS mehrere Bänder im Fingerabdruckbereich enthält. Die mangelnde Fähigkeit zur Verwendung von Kochsalzlösung oder PBS stellt derzeit eine wichtige Einschränkung für die Technik dar. Typischerweise verursacht die Verwendung von Wasser zum Waschen keinen zerstörerischen Einfluss auf die Bakterien; Es sollte jedoch vorsichtig vorgegangen werden, und wenn möglich, sollte die Zeit der Wasserexposition begrenzt werden. Wenn das Probenvorbereitungsprotokoll in der Phase des Waschens pausiert werden muss, wird empfohlen, die Probe nach dem Entfernen des Wassers in pelletierter Form zu belassen. Dies ist besonders wichtig für gramnegative Bakterien, die eine dünnere Zellwand enthalten, da sie anfälliger für Brüche sind.
Um korrekte und qualitativ hochwertige AFM-IR-Daten zu gewährleisten, sind mehrere Aspekte des Datenerfassungsprotokolls von entscheidender Bedeutung. Erstens ist die korrekte Erfassung der Hintergründe für die Datenerfassung unerlässlich. Insbesondere ist die Aufrechterhaltung stabiler Luftfeuchtigkeitswerte während der gesamten Hintergrunderfassung sowie zwischen Hintergrund und Probenentnahme erforderlich. Um dies zu gewährleisten, empfehlen wir, das Gerät mit Stickstoff zu reinigen und die Luftfeuchtigkeit nicht höher als 25% zu halten. Mangelnde Spülung kann eine erhebliche Einschränkung mit sich bringt, insbesondere an Orten mit hoher Luftfeuchtigkeit. Zweitens sollte die Bedeutung der richtigen Optimierung von IR-Spots hervorgehoben werden. Für beste Ergebnisse kann a priori Wissen über die Position von Bandmaxima von Vorteil sein. Beispielsweise kann ein herkömmliches IR-Spektrum von Bakterienpellets verwendet werden, um die Positionen der von einer Probe erwarteten Bänder zu bestimmen. Wenn dies nicht möglich ist, kann der Benutzer alternativ IR-Spektren verwenden, die in der Literatur verfügbar sind, oder die Optimierung mit einer Bandposition beginnen, die im Bakterium zu erwarten ist (z. B. Amid I und Amid II). Drittens ist es für die Datenerfassung wichtig, die Bedeutung einer sorgfältigen Leistungsauswahl (die es ermöglicht, ein gutes S / N-Verhältnis zu erreichen) hervorzuheben, da dies eine zerstörerische Wirkung haben kann. Die empfohlene Leistung hängt von der Dicke der Probe ab, wobei die grobe Anleitung im Instrumentenhandbuch31verfügbar ist. Wir empfehlen, den Zustand der Probe nach der Messung empirisch zu testen, indem ein AFM-Bild entnommen wird, da es einen zerstörerischen Einfluss aufdeckt. Darüber hinaus dient die Sammlung von AFM-Bildern aus dem gleichen Bereich vor und nach der Erfassung von AFM-IR-Spektren als gute Bestätigung, dass keine Drift aufgetreten ist und die Spektren tatsächlich vom ausgewählten Punkt in der Zelle stammen. Die Möglichkeit der Drift ist besonders wichtig bei der Anwendung der Bildgebungsmodalität durch konsekutive Bildgebung der IR-Intensität bei ausgewählten Wellenzahlwerten. Ein Beispiel hierfür ist in Abbildung 5dargestellt. Der abgebildete Bereich wurde zu Beginn des Experiments definiert und soll für alle Wellenzahlwerte konsistent sein. Zwischen jedem BILD der AFM-Höhe (und der entsprechenden IR-Wellenzahlintensität) ist jedoch eine deutliche Drift sichtbar, wobei die Aufnahmezeit jeder Karte etwa 40 Minuten beträgt. Aus diesem Zusammenhang empfehlen wir Benutzern, die Bildgebungsdaten sammeln, immer einen Bereich auszuwählen, der etwas größer ist als die gewünschte Stichprobe, um sicherzustellen, dass die interessierende Probe auch bei Vorhandensein einer Drift innerhalb des abgebildeten Bereichs verbleibt.
Zu den möglichen Einschränkungen des Protokolls gehört die mangelnde Fähigkeit, Daten in hydratisiertem Zustand in physiologischen Lösungen (z. B. Kochsalzlösung oder PBS) zu sammeln, die oben beschrieben wurden. Darüber hinaus besteht insbesondere in Bereichen mit hoher Luftfeuchtigkeit häufig ein Bedarf an Stickstoffspülung. Darüber hinaus ermöglicht das Protokoll die Untersuchung von Organismen bis zu einer Größe von 100 nm, wobei die Möglichkeit seiner Verwendung für kleinere Strukturen ausgeschlossen ist. Obwohl dies mit einem anderen Laser überwunden werden kann (z. B. Quantenkaskadenlaser, der es ermöglicht, die räumliche Auflösung von 20 nm zu erreichen), ist es auch mit einem begrenzten Spektralbereich sowie Schwierigkeiten bei der Erzielung eines guten Signal-Rausch-Verhältnisses verbunden. Schließlich kann die Sondierung weicher Oberflächen eine Herausforderung darstellen, da die Spitze die Oberfläche nicht richtig erkennt und bis zum Bruch über den Kontaktpunkt hinausgeht. Obwohl dies bei Bakterienproben in der Regel kein Problem darstellt, kann es bei Messungen weicherer Proben auftreten. In solchen Fällen wird empfohlen, zu versuchen, auf einer sauberen Oberfläche des Substrats in der Nähe der Probe zu arbeiten.
Das beschriebene Protokoll kann für zahlreiche Arten der Bakterienforschung verwendet werden, einschließlich vergleichender Studien zwischen verschiedenen Proben sowie subzellulärer Untersuchungen. Die Daten können mit chemometrischen Ansätzen für einzelne Spektren und Bildgebungsmodalitäten35analysiert werden, abhängig vom Ziel der Forschung. Darüber hinaus kann das Protokoll auch für die Anwendung auf anderes biologisches Material (wie Pilze, Hefen, Zellen usw.) durch Zugabe von Fixierung modifiziert werden.
Offenlegungen
Wir danken Bruker für die Zahlung der Publikationsgebühr. KK, BRW, AP und PH sind Erfinder eines internationalen Patents (PCTIB2020/052339), das einige der grundlegenden Aspekte des Ansatzes beschreibt.
Danksagungen
Wir danken Bruker für ihre Unterstützung. Diese Arbeit wurde durch das Monash University Advancing Women's Success Grant (K. Kochan) unterstützt. A.Y.P würdigt die Unterstützung durch ein Australian National Health and Medical Research Council Practitioner Fellowship (APP1117940). Diese Arbeit wurde von einem Australian Research Council Discovery Project DP180103484 finanziert. Wir danken Herrn Finlay Shanks für seine instrumentale Unterstützung und Frau Xenia Kostoulias für ihre technische Unterstützung bei den Samples.
Materialien
| Name | Company | Catalog Number | Comments |
| AFM metal specimen disc | PST ProSciTech Pty Ltd | GA530-15 | Recommended 15 mm |
| Anasys AFM-IR nanoIR2 | Anaysys Instruments | model: nanoIR2 | |
| Contact mode NIR2 Probes for nanoIR 2 | Bruker / Anasys Instruments | - | Model: Model: PR-EX-NIR2 |
| Heraeus Pico 17 Microcentrifuge | Thermo Scientific | - | - |
| Matlab | Mathworks Inc | - | Multivariate data analysis software |
| Micro-centrifuge tubes, 1.5 mL | Heathrow Scientific | HEA4323 | Can be replaced with any other micro-centrifuge tube |
| NanoIR 2 instrument | Bruker / Anasys Instruments | - | - |
| PLS toolbox | Mathworks Inc | - | GUI for Matlab |
| Selected bacterial medium (e.g. HBA Columbia Plates) | Thermo Fisher | PP2001 | Provided type of medium is an example and can be replaced by others, depending on the type of experiment |
| Selected bacterial strain | - | - | The source depends on the aim of research (patient isolates, ATCC strains, etc.) |
| Substrate (e.g. Raman grade CaF2) | Crystran | CAFP13-2R | Recommended size: 13 mm Ø x 2.0 mm |
| Tip pipette 1000 µl | Axygen | T-1000-B | - |
| Tip pipette 200 µl | Axygen | T-200-C | - |
| Tip pipette 0.5-10 µl | Axygen | T-300-R | - |
| Ultrapure water | - | - | - |
Referenzen
- Sears, C. L. A dynamic partnership: celebrating our gut flora. Anaerobe. 11 (5), 247-251 (2005).
- Rudd, K. E., et al. regional, and national sepsis incidence and mortality, 1990-2017: analysis for the Global Burden of Disease Study. The Lancet. 395 (10219), London, England. 200-211 (2020).
- Seymour, C. W., et al. Time to treatment and mortality during mandated emergency care for sepsis. The New England Journal of Medicine. 376 (23), 2235-2244 (2017).
- Weiss, S. L., et al. Delayed antimicrobial therapy increases mortality and organ dysfunction duration in pediatric sepsis. Critical Care Medicine. 42 (11), 2409-2417 (2014).
- Peker, N., Couto, N., Sinha, B., Rossen, J. W. Diagnosis of bloodstream infections from positive blood cultures and directly from blood samples: recent developments in molecular approaches. Clinical Microbiology and Infection: The Official Publication of the European Society of Clinical Microbiology and Infectious Diseases. 24 (9), 944-955 (2018).
- Aminov, R. I. The role of antibiotics and antibiotic resistance in nature. Environmental Microbiology. 11 (12), 2970-2988 (2009).
- Levy, S. B., Marshall, B. Antibacterial resistance worldwide: causes, challenges and responses. Nature Medicine. 10 (12), Suppl 122-129 (2004).
- Roca, I., et al. The global threat of antimicrobial resistance: science for intervention. New Microbes and New Infections. 6, 22-29 (2015).
- O'Neill, J. The review on antimicrobial resistance. Tackling drug-resistant infections globally: final report and recommendations. Wellcome Trust. , (2016).
- Perry, J. A., Westman, E. L., Wright, G. D. The antibiotic resistome: what's new. Current Opinion in Microbiology. 21, 45-50 (2014).
- Piddock, L. J. Assess drug-resistance phenotypes, not just genotypes. Nature Microbiology. 1 (8), 16120(2016).
- Naumann, D., Helm, D., Labischinski, H. Microbiological characterizations by FT-IR spectroscopy. Nature. 351 (6321), 81-82 (1991).
- Zarnowiec, P., Lechowicz, L., Czerwonka, G., Kaca, W. Fourier Transform Infrared Spectroscopy (FTIR) as a tool for the identification and differentiation of pathogenic bacteria. Current Medicinal Chemistry. 22 (14), 1710-1718 (2015).
- Quintelas, C., Ferreira, E. C., Lopes, J. A., Sousa, C. An overview of the evolution of infrared spectroscopy applied to bacterial typing. Biotechnology Journal. 13 (1), 1700449(2018).
- San-Blas, E., Cubillán, N., Guerra, M., Portillo, E., Esteves, I. Characterization of xenorhabdus and photorhabdus bacteria by Fourier transform mid-infrared spectroscopy with attenuated total reflection (FT-IR/ATR). Spectrochimica Acta. Part A, Molecular and Biomolecular Spectroscopy. 93, 58-62 (2012).
- Sousa, C., et al. Discrimination of the acinetobacter calcoaceticus-acinetobacter baumannii complex species by Fourier transform infrared spectroscopy. European Journal of Clinical Microbiology & Infectious Diseases. 33 (8), 1345-1353 (2014).
- Rodriguez-Saona, L. E., Khambaty, F. M., Fry, F. S., Calvey, E. M. Rapid detection and identification of bacterial strains by Fourier transform near-infrared spectroscopy. Journal of Agricultural and Food Chemistry. 49 (2), 574-579 (2001).
- Dawson, S. E., et al. Implementation of Fourier transform infrared spectroscopy for the rapid typing of uropathogenic Escherichia coli. European Journal of Clinical Microbiology & Infectious Diseases. 33 (6), 983-988 (2014).
- Kochan, K., et al. Detection of Antimicrobial Resistance-Related Changes in Biochemical Composition of Staphylococcus aureus by Means of Atomic Force Microscopy-Infrared Spectroscopy. Analytical Chemistry. 91 (24), 15397-15403 (2019).
- Dazzi, A., Prater, C. B. AFM-IR: Technology and Applications in Nanoscale Infrared Spectroscopy and Chemical Imaging. Chemical Reviews. 117 (7), 5146-5173 (2017).
- Dazzi, A., et al. AFM-IR: combining atomic force microscopy and infrared spectroscopy for nanoscale chemical characterization. Applied Spectroscopy. 66 (12), 1365-1384 (2012).
- Kochan, K., et al. et al. In vivo atomic force microscopy-infrared spectroscopy of bacteria. Journal of the Royal Society, Interface. 15 (140), (2018).
- Katzenmeyer, A. M., et al. Mid-infrared spectroscopy beyond the diffraction limit via direct measurement of the photothermal effect. Nanoscale. 7 (42), 17637-17641 (2015).
- Bruker Life Science Applications. , Available from: https://www.bruker.com/products/surface-and-dimensional-analysis/nanoscale-infrared-spectrometers/nanoscale-ir-spectroscopy-applications/life-sciences.html (2020).
- Mayet, C., Dazzi, A., Prazeres, R., Ortega, J. M., Jaillard, D. In situ identification and imaging of bacterial polymer nanogranules by infrared nanospectroscopy. Analyst. 135 (10), 2540-2545 (2010).
- Baldassarre, L., et al. Mapping the amide I absorption in single bacteria and mammalian cells with resonant infrared nanospectroscopy. Nanotechnology. 27 (7), 075101(2016).
- Vitry, P., et al. Combining infrared and mode synthesizing atomic force microscopy: Application to the study of lipid vesicles inside Streptomyces bacteria. Nano Research. 9 (6), 1674-1681 (2016).
- Dazzi, A., et al. Chemical mapping of the distribution of viruses into infected bacteria with a photothermal method. Ultramicroscopy. 108 (7), 635-641 (2008).
- Steenbergen, J. N., Alder, J., Thorne, G. M., Tally, F. P. Daptomycin: a lipopeptide antibiotic for the treatment of serious Gram-positive infections. The Journal of Antimicrobial Chemotherapy. 55 (3), 283-288 (2005).
- Garcia, L. S. MacFarlan Standards. Clinical Microbiology Procedures Handbook, 3rd Edition. , American Society of Microbiology. (2010).
- NanolR-2 System Manual. Anasys Instruments. , Available from: https://www.anasysinstruments.com/downloadpr/nanoIR2_s_System_Manual.pdf (2020).
- Whelan, D. R., et al. Detection of an en masse and reversible B- to A-DNA conformational transition in prokaryotes in response to desiccation. Journal of the Royal Society, Interface. 11 (97), 20140454(2014).
- McGuinness, W. A., Malachowa, N., DeLeo, F. R. Vancomycin Resistance in Staphylococcus aureus. The Yale Journal of Biology and Medicine. 90 (2), 269-281 (2017).
- Howden, B. P., Peleg, A. Y., Stinear, T. P. The evolution of vancomycin intermediate Staphylococcus aureus (VISA) and heterogenous-VISA. Infection, Genetics and Evolution: Journal of Molecular Epidemiology and Evolutionary Genetics in Infectious Diseases. 21, 575-582 (2014).
- Perez-Guaita, D., et al. Multispectral Atomic Force Microscopy-Infrared Nano-Imaging of Malaria Infected Red Blood Cells. Analytical Chemistry. 90 (5), 3140-3148 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten