Method Article
下流免疫染色解析のためのマウス半離層上皮周期の特定段階のトランスイルミネーション支援解離
要約
本プロトコルは、半日本円上皮周期の特定段階を表す成体マウス半細管の断面微小切除法、およびその中の細胞タイプ、および後にスカッシュ製剤および無傷の管状セグメントの免疫染色を記述する。
要約
精子形成は、最終的に身体の最も明確な細胞タイプの1つである精子を生み出すユニークな分化プロセスである。生殖細胞の分化は、4〜5世代の生殖細胞を同時に宿主とする細胞質セルトリ細胞の細胞質ポケットで同時に行われ、それらの発達を調整し、同期させる。したがって、断面内の生殖細胞型の組成は一定であり、これらの細胞の関連は半日本体上皮周期の段階(I-XII)としても知られている。重要なことに、ステージは、トランスイルミネーションによって明らかにされた差動光吸収/散乱特性に基づいて無傷の半細管から同定することができ、また、ステージが管状に沿って順番に続き続くという事実も示す。本稿では、マウス半離上皮周期の特定段階を表す半細管セグメントの分離のためのトランスイルミネーション支援マイクロ解離法について説明する。半細管の光吸収パターンは、まず解剖顕微鏡で検査され、次に特定の段階を表す管状のセグメントを切断し、下流の用途に使用します。ここでは、ステージ特異的スカッシュ製剤および無傷の細管セグメントに対する免疫染色プロトコルについて説明する。この方法により、研究者は精子形成の特定の段階で起こる生物学的事象に焦点を当てることができ、精子形成および基礎分子メカニズムの発達、毒物学、および細胞学的研究のためのユニークなツールを提供する。
概要
男性生殖細胞の二量体精子から成熟したハプロイド精子腫への分化、すなわち、精子形成は、性的成熟した個体1の精巣における半細管の上皮において行われる複雑なプロセスである。A1精子の有糸状子は、最初に5回分裂して分化をコミットした個体群を拡大し、最終的にハプロイド精子を生じさせる精子細胞としてメイオシスに入る。円形精子の分化、すなわち、精子形成は、核圧縮および壊死体およびフラゲラムのような精子特異的構造の構築を含む細胞形態の複雑な変化を伴う。マウスでは、精子形成の全過程は、完了するまでに35日を要します2,3.
任意のロケールで、半種上皮は、分化生殖細胞の最大5コホートに生殖細胞幹細胞/前駆細胞および体細胞セルトリ細胞1を宿す。分化性生殖細胞は同心円状の層を形成し、その組成は予測可能であり、開発の所定の段階でハプロイド細胞は常に特定のタイプの精子細胞および精子4,5と関連する。したがって、管状の任意の断面は、一定の組成の生殖細胞のコホートをホストする。これらの特定の細胞会合は、半日本体上皮の段階として定義される。ステージ当たりの段階は、滞っているチェックポイントのような状態を提示しないが、同期1、2、6で胚芽細胞コホートの分化が進行するにつれて継続的に発達する。マウスでは、半細管の縦軸に沿ってセグメント状に配置された12段階(I-XII)2があり、セミニファーの上皮、または精子発生性波7、8、9の波を形成する論理的な順序で互いに従う(図1)。精子形成の完了には4サイクルかかり、任意の半細管断面内の分化性生殖細胞の階層層またはコホートは、一時的に互いに離れた半円性周期である。サイクルの長さは種に依存し、マウスでは各サイクルは8.6日10を要する。
この段階は、組織学的精巣の断面5(図1および図2)上の半上皮の細胞組成および組織に基づいて同定することができる。しかし、組織学的分析は手間がかかり、時間がかかり、固定と染色を必要とし、したがって、生きた組織に適用することはできません。重要なことに、ステージングは、異なる段階のサイクルによって示される明確な光吸収/散乱パターンを利用することによって、解剖顕微鏡下で生体組織に対しても行うことができる(図2)。各段階が光を吸収し、散乱する能力は、任意の所定のステージがホストする後期のポストマイオティック精子のクロマチン縮合のレベルとこれらの細胞の梱包をバンドル7,11に対して相対的である。精子分化、すなわち、精子形成は、さらに、円形精子の8ステップ(ステップ1〜8)および8ステップの分化(ステップ9〜16)分化を含む16の発達段階に分けられる(ステップ9〜16)分化する(図1)。ステップ 9-11 伸長精液(ステージ IX-XI)は、低レベルのクロマチン縮合のみを表示し、低量の光が吸収される。クロマチン縮合はステップ11の精子(ステージXI)から始まり、ステップ15-16伸長性の精子(ステージIV-VIII)は完全に凝縮したクロマチンを含み、したがって最大の光吸収を示す(図3)。クロマチンは、精子の頭部にしっかりと詰め込まれるには凝縮する必要があります。光吸収パターンに寄与するその他の要因は、上皮内の精液を伸長させる場所(基底対円端)および伸長性精液の束縛(II-Vの段階で発音される)11(図3)。束は、細管の真ん中のスポットとして、解剖顕微鏡の下でエッジ上のストライプとして見られ、クロマチンをより凝縮すると、スポット/ストライプ11が暗くなる。
この記事では、半日本体上皮周期の特定段階を表す半細管セグメントの分離のためのトランスイルミネーション支援マイクロ解離法の使用について説明する。一旦単離されると、段階的な細管セグメントは、生化学的RNAおよびタンパク質分析12、13、14、15、フローサイトメトリー16、エクスビボチューブ培養17および免疫染色を含む様々な下流分析を受けることができる。また、生細胞形態学的解析とその後の免疫染色のために、ステージされた細管セグメントの押しつぶされた単層を調製するための詳細な下流プロトコル、ならびに管状セグメントの全実装免疫染色を提供する。図 4で説明する一言で説明したワークフロー。
トランスイルミネーション支援マイクロディション法は、ステージの同期された細胞組成のおかげで分化の特定のステップで生殖細胞を正確に同定し、単離することを可能にする。重要なことに、それはまた、生きた組織上の精子形成中のステージ依存性事象の研究を可能にする。精子形成のためのスケーラブルなインビトロモデルの欠如を考えると、この方法はまた、ステージ特異的な尿細管セグメントex vivo12、17に対する標的短期発達および毒物学的研究を可能にするユニークな利点を有する。ここでマウスの方法を説明する一方で、同じ手順は、ラット4、7、15、19、20などの半上層の半上皮の縦方向およびセグメント配置を有する任意の哺乳類種に適用することができる。
プロトコル
実験用マウスおよびすべての動物実験の維持は、トゥルク大学の実験動物のケアと使用に関する関連するガイドラインと規則に従って行われました。
1. 微小解剖のための半細管の調製
- CO2窒息、子宮頸部脱臼を経て、成人男性マウス(生後8週≥、精巣は80~120mg)をCO2 窒息で犠牲にします。
注:マウスは性的に成熟し、できれば少なくとも8週は生まれでなければなりません。若年マウスのトランスイルミネーションパターンは、半日本上皮の波がまだ完全に確立されていないため成人とは異なり、そして精子形成の第1波のタイミングは21,22と異なる。<4週齢の雄マウスにおける長期精子の欠如は、トランスイルミネーション支援微小解剖への使用を妨げる。正常な精子形成を有するすべてのマウス株を使用することができる。 - 腹側腹部に70%エタノールを吹き付けます。無菌はさみを使用して腹部腔を開き、V字型の開口部を作ります。
- 滅菌鉗子で精巣上脂肪パッドを引っ張り、精巣を見つけ、はさみを使って解剖し、PBSを含む無菌100mmペトリ皿の上に置きます。
注:無菌性を維持するために、すべてのラボウェアと外科用ツールが無菌であることを確認してください。 - 細かい先端のはさみを使用して、テニの膜を覆う厚い繊維状シートである チュニカ・アルブギネアでスリットを切断して精巣を脱カプセル化する。その後、鉗子のペアを使用して開いたチュニカを引き裂きます。鉗子で押して管を強制的に外に出し、チュニカを捨てます。
注意:チュニカを捨てる間、 動脈精巣 がチュニカと一緒に取り除かれるのは、いくつかの下流のアプリケーションにとって有益かもしれません。半細管を損傷しないようにします。 - 新しいペトリ皿に半細管を移動し、ペトリ皿の底をカバーするのに十分な無菌PBSを注ぎます。次に、細管をそっと引き離しますが、細管を損傷しないようにします。
注: 機械的なストレスが多すぎると、トランスイルミネーション パターンに影響を与え、組織とその細胞アーキテクチャの実行可能性に影響を与えます。また、この管は、ステージング(3B)なしでこの時点から全実装免疫染色のために処理することもできる。SALL4、c-KITおよびDNMT3A18,23のような分化した精子で発現されるタンパク質に対する抗体を含めることによって、遡及的にステージを定義するだけで十分である場合がある。精子の密度は比較的信頼性の高いステージ指標である(図2)。
2. トランスイルミネーション支援マイクロディシス
- ペトリ皿をステージにテーピングして解剖顕微鏡の下にしっかりと置きます。
注:ペトリ皿をよくテープで留めて、収集した段階的な半細管セグメントの混合を引き起こす可能性のある動きを防ぐことが重要です。 - 焦点下の半細管の光吸収パターンを明らかにするために、サンプルが下から照らされ、光がサンプルを通過することを確認してください。 すなわち、それはトランスライトされます。
注:吸収/散乱光の量は、細長い精子の凝縮のレベルに対して相対的であり、半細管内のそれらの束縛:より凝縮され、より多くの光が吸収され、 すなわち、より暗く見える。 - 図2、図5A、図S1で説明した異なる段階の光吸収パターンを、細管の束を細切りで慎重に移動させることで、よく知ることができます。
注:段階は常に論理的な順序で互いに従い、半会体上皮の波を形成します。しかし、精子波の方向が時々逆転し、再び戻ってくる(モジュレーション4、9とも呼ばれる)、時には手順を複雑にすることを知ることが重要です。また、各段階の長さは、細管のmm数という点で、かなり異なる。 - 注意深くフックチップで鉗子を使用して目的の管管を持ち上げ、マイクロディションハサミを使用して適切な長さのセグメントを切断します( 補足ビデオ1を参照)。鉗子の先端のフックは管管を持ち上げて持ち上げることを容易にし、それを絞るのを避けるのを助ける。
注: 切り取るセグメントの長さは、ダウンストリーム のアプリケーションによって異なります。タンパク質またはRNA解析用の特定の段階のプールされた細管片のコレクション12、13(II-V、VII-VIIIおよびIX-XI、図5B)の長さは、典型的には2〜5mmです。標準的なフェノール-クロロホルム抽出が使用される場合、約200ngのRNAは1mmの尿細管から導出され得る。ステージされたチューブセグメントの全体マウント染色の場合、セグメントの長さは>5 mmでなければなりません。スカッシュの準備の場合、セグメントの中央のセルが長すぎると終了できなくなる可能性があるため、セグメントの長さが 1 ~ 2 mm を超えないようにしてください。小管長の正確な測定のためにペトリ皿の下にmmスケールを使用してください。
3. 異なる製剤の免疫染色
- スカッシュ調製:ステージ検証および免疫染色
注:ステージ特異的な細管片は、フェーズコントラスト顕微鏡とその後の免疫染色によって生きている細胞の形態学的分析を行うためにカバーガラスと顕微鏡スライド上で押しつぶすことができます。トランスイルミネーション支援マイクロディセクショネ法に慣れた段階を検証するには、このアプローチを使用することをお勧めします。- ピペットを使用して10 μLの体積でセグメントを収集し、顕微鏡スライドに移動します。
- カバーガラス(20mm x 20mm)を慎重にチューブに置いて、細管を押しつぶします。その結果、細胞は細管から流れ出て、生細胞単層を形成する。カバーガラスの端にフィルターペーパーを置き、細胞の広がりを容易にします。細胞を押しつぶしすぎて生き続けないようにしてください。
- 顕微鏡下で広がる細胞を監視しなさい。40x目的で位相差顕微鏡を用いて、存在する細胞の種類を調べることによってステージ認識を検証する(図2、図S2)。
- 細胞が広がって細管の両端から丸い単層を形成したら、滑り台を鉗子で保持しながら液体窒素を含む容器に浸します。10 sのために水没し続けてください。または、凍結のためのドライアイスプレートの上にスライドを置きます。
- カバーガラスをメスでひっくり返して取り外します。
- 遅れることなく、固定を進め、2〜5分間90%エタノールの容器にスライドを素早く入れます。
注:スカッシュの準備が90%エタノールに置く前に解凍しないことを確認してください。他の固定剤は、アセトンなどの10分間使用することもできる。 - 空気乾燥し、室温(RT)(いくつかの日まで)または-80 °C(長期)で保存します。
- 免疫染色の場合、RTで10分間、4%パラホルムアルデヒド(PFA)でサンプルを後固定します。
- PBSでリンスし、0.1%トリトンX-100でPBSで5分間透過させます。
- PBSですすいで、各スカッシュサンプルの周りにグリースリングを描きます。
- 50~100 μLの10%BSA(牛血清アルブミン)をPBSの0.1%Tween(PBST)に加え、RTで30分間サンプルをブロックします。
- BSA溶液を取り出し、一次抗体をPBSTで10%のBSAで希釈し、RTで1時間インキュベートします。
- PBSTで5分間3倍洗います。
- PBSTで10%BSAに希釈した二次抗体を用いてインキュベートする。
注:アクロソームを染色するために、サンプルは、特定の一次および二次抗体の代わりに、10%のPBSTで10%BSAのローダミン標識ピーナッツ凝集剤抗体(PNA、1:1:1000)でインキュベートすることができます(図S3)。 - PBSTで5分間3倍洗い、PBSで洗い流し、DAPIを含むマウント剤でマウントします。
- 半細管の全実装免疫染色
注: 以下のプロトコルは、(ステップ 2.4 から)管状セグメントの全体マウント染色について説明します。研究者がステージングなしで全体マウント染色を実行したい場合(ステップ1.5から)、3.2.1と3.2.7のメモに注意してください。- ピペットを使用して、氷冷PBSの細管セグメント(ステップ2.4から)を15 mL円錐形チューブに移し、氷の上で堆積させます。
注:1.5.から未段のチューブを使用する場合は、数回傾いた皿にピペットを上下に戻すことによって、ペトリ皿の中の管状を分離します。カットチップ付きの1mLピペットを使用してください。このステップは、組織の構造を開くことを意図しています。ただし、チューブを損傷する可能性があるため、あまり多くのピペットを避けてください。尿細管の沈降には数十秒かかります。小管状の断片、間質細胞および細胞の破片は上清にとどまる。 - ピペットまたは吸引器を使用して上清(SN)を慎重に除去します。氷冷PBSの10 mLを追加し、反転によって混合します。
- 堆積物を許可し、前と同様にSNを削除します。
- 5 mLの4%PFAを加え、+4 °Cの回転テーブル(20~30 rpm)で5時間固定します。
注: 固定時間は、関心のあるタンパク質とその細胞内局在性に依存します。核および細胞質タンパク質の場合、2時間固定は典型的には十分であるが、GFRα1(GDNFファミリー受容体α1;GDNFファミリー受容体α1のような膜マーカー; 図 6A,B) は、最大 6 時間の長い固定の恩恵を受けます。 - 堆積物を可能にし、以前のようにSN(PFA)を取り除き、PBSの10 mLを加えてチューブを反転させることによって短時間すすいだ。
- 堆積物を可能にし、以前のようにSNを取り除き、+4°Cの回転テーブルでそれぞれ少なくとも10分間PBS洗浄工程を3回繰り返し、+4°Cで染色または保存を進めます。
注:作業条件が無菌で清潔であれば、サンプルを保管して少なくとも数週間使用することができます。また、2%のストック溶液から0.02%(w/v)の最終濃度にアジドナトリウムを加え、+4°Cで保存する前に細管を保存するのに役立ちます。 - 1 mL ピペットを使用して、10 ~ 20 個の固定チューブセグメントを 2 mL ラウンドボトム チューブに移動します。堆積物を許可し、SNを削除します。
注:上演されていない長い管状を使用している場合は、細管をペトリ皿に注ぎ、マイクロディスセクションはさみと鉗子カットセグメントを使用して約5〜20mmです。染色手順の間に長すぎるセグメントが絡み合うのに対して、短すぎるとセグメントが失われやすくなります。 - PBS(PBSX)で2%BSA +10%FBS(胎児ウシ血清)を0.3%トリトンX-100に1mL加えます。RTで回転テーブル(20~30 rpm)で少なくとも1時間ブロックします。
- 1 mLのPBSXでリンスし、ピペット処理によりSNを除去し、PBSXで1%BSAに希釈した一次抗体250μLを加えます(1:100-1:2000希釈)。RTで2時間、または回転テーブル上の+4 °Cで一晩(20〜30 rpm)インキュベートします。
- 上記のように1mLのPBSXで細管をピペットして抗体溶液を除去します。回転テーブル(20~30 rpm)の上で、PBSXで1時間3回洗浄します。
注:この最初の洗浄の後、サンプルは必要に応じて+4 °Cで一晩放置することができます。 - SNを取り除き、PBSXで1%BSAで希釈した250μLの二次抗体を添加します(通常、蛍光標識抗体の希釈量は1:500)。ホイルで覆い、回転テーブル(20~30 rpm)をRTで1時間インキュベートします。
- 3.2.10 を繰り返します。
- 最後にSNを取り外し、細管を顕微鏡スライドに注ぎます。ゲルローディングチップを使用して、細管をリニアストリップにそっと分離して配置します。余分なバッファーを排出し、取り付け媒体とカバースリップを追加します。
注意:細管を配置しながら乾燥しないでください。DAPIを用いた核の逆染色は、ほとんどの場合必要ありません。カバースリップの端をマニキュアでシールし、サンプルの乾燥や劣化を防ぎます。スライドはイメージングの前に+4 °Cで1〜2週間保存することができます。
- ピペットを使用して、氷冷PBSの細管セグメント(ステップ2.4から)を15 mL円錐形チューブに移し、氷の上で堆積させます。
結果
成功したトランスイルミネーション支援のステージングとマウス半日系細管のマイクロディセクションは、主に適切な照明条件と適切な解剖顕微鏡を見つけることに依存し、各段階を特徴付ける特定の特徴を認識する能力。ステージVII-VIIIは、上皮の有端表面に整列された完全凝縮伸縮性精液を多数含んでいるため、均質に暗く見える(図5Aおよび図S1)。成熟した精子が精子で内腔に放出された後、上皮に凝縮伸長した精子がないため、尿細管は段階IX-XIで非常に青白く見える。トランスライトされた細管で識別する最も簡単な特徴は、暗いゾーン(VII–VIII)から淡いゾーン(IX-XI)への突然の移行である、精子のポイント(図5Aと図S1のアスタリスク)です。淡いゾーンの後に、弱いスポット ゾーン (XII–I) が続きます。斑点の外観は、束の凝縮されたクロマチンと精細化した精子の組織に由来します。バンドルは、次の強いスポットゾーン(II–V)で非常に顕著になります。さらに、精子束は、基底層層の近くに位置するセルトリ細胞核に向かって移行し、これは、トランスライトされた場合にステージII-V管状の縞模様の外観として反射される(図2、図5A、Bおよび図S1)。バンドルは最終的にステージVIで分散し、伸びる精子はステージVIIIで上皮から放出される内腔の近くに移動します。
管管セグメントの正確な段階はスカッシュ製剤の位相対位顕微鏡によって正確に検証することができる(図2 および 図S2)。スカッシュ製剤の特定の段階は、ステップ1〜8ラウンド精子の経常的発達、細長い精子におけるクロマチン縮合の状態、および精子束16 の存在に基づいて認識される(図3 および 図S2)。さらに、B型精子やレプトテン、またはジゴテン精子細胞などの初期の細胞型の存在は、それらの形態学的特徴に基づいて認識することができる、ステージ認識をサポートするために使用することができる。パキテイン精子細胞核のサイズはステージVIの周りでサイズが大きくなり、ステージングにも追加の助けが得られる。
段階的スカッシュ製剤は、免疫染色を用いて半日本体上皮に関心のあるタンパク質の発現および局在化を研究するために使用することができる。これにより、各段階で明確に定義された細胞組成のために、細胞型特異的発現の非常に正確な分析が可能になります。ステージ特異的発現は、円形の精子分化の異なるステップの可視化を可能にする、アクロソーム(例えば、PNAを用いた)の共染色によってさらに増強することができる。PNA染色されたアクロソームの代表的な画像を、様々な段階で 示します。アクロスソーム染色は、遡及的にステージを定義するためにも使用できます。しかし、トランスイルミネーション支援のステージングは、無計画な方法で未演の断片を使用するよりも、目的の段階を見つけるのがかなり簡単で速い方法です。
半細管全マウント染色は、通常、半細星上皮の基部膜に接触している細胞タイプを研究するために使用されます, いずれかの管状側に (精子, プレレプトテン精子細胞とセルトリ細胞;図6A,B)または間質側(頭蓋骨下筋細胞および頭蓋骨管内マクロファージ;図6Cおよび図S4A)24.しかし、この方法は、血液検査バリア(Espin、図S4B)またはポストメオティック胚芽細胞(アクロソームマーカーPNA、図S4C)のような上皮の深部に位置する細胞または構造を研究するためにも使用することができる。未段の細管セグメントを用いれば、分化した精子(A1、A2、A3、A4、InおよびB;集合的にAdiff)で発現されるタンパク質に対する抗体を用いて、所定の段階を遡及的に推定することができる(図2)。その後、ステージングは、精子原性分化の最初のサイクルの間に段階依存的な方法で6つの有糸分裂を受ける同期Adiffの密度に依存し、したがって各部門1、25の後に同期中のA位の異なる精子の数を倍増させる。ただし、振り返りステージングは、異なる世代の A diff の特定のマーカーがなく、A diff密度の評価がエラーになりやすいため、トランスイルミネーション支援ステージングよりも精度が低くなります。

図1:マウス精子形成のステージングのための半離層上皮周期マップ。縦列は、半離層上皮周期の異なる段階での細胞の関連を示す(ローマ数字I-XIIでマーク)。最も未熟な胚芽細胞は下部にあり、最も分化された細胞は上部にある。生殖細胞分化の進行に従うためには、左から右へ、そして下から上に移動する必要があります。半種上皮の周期は、数値順に互いに続く一連の段階である。ウント、未分化精子;A1-4、タイプA1-A4精子;中に, 中間精子;B型、B型精子;Pl, プレレプトテン精子細胞;L, レプトテン精子細胞;Z,ジゴテン精子細胞;P, パキテーン精子細胞;D, ジプロテン精子細胞;2°、二次精子細胞と大動脈分裂。アラビア数字1〜16は、後の精神病性精子成熟(精子形成)のステップを指す。 この図の大きなバージョンを表示するには、ここをクリックしてください。
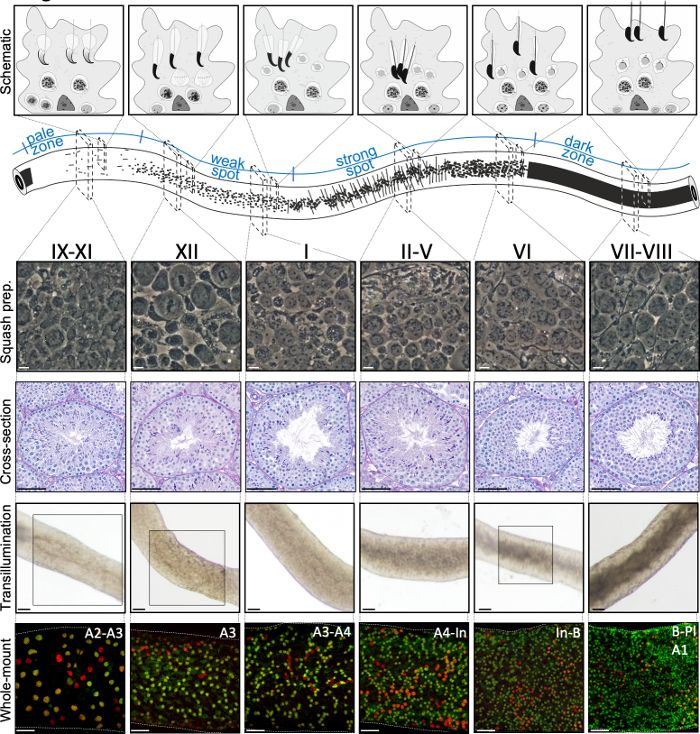
図2:マウス半離上皮周期の段階における細胞会合。半日本体上皮周期の段階は論理的な順序で互いに従い、したがって、半細管の縦軸に沿って精子波を形成する。上面パネルは、異なる段階での生殖細胞の関連を示し、半日本上皮におけるセルトリ細胞(薄灰色)の細胞質ポケット内の細胞タイプの位置を示す。半細管の図は、淡い、弱点、強いスポットと暗いゾーンの精子波と特定のトランスイルミネーションパターンを視覚化しています。示された各段階から、スカッシュ製剤および周期酸シフ(PAS)染色された精巣の断面の代表的な生きた細胞の位相対照画像が示されている。下の2つのパネルは、トランスイルミネーション(上)またはSALL4(赤、汎精子症マーカー)およびDNMT3A(緑色、Aディフ マーカー)に対する抗体(下)で染色した後の半日本有管のセグメントを示す。ステージ IX-XI、XII、VI のトランスイルミネーション パターンは、ボックス化された領域でハイライト表示されます。光吸収パターン(上)とDNMT3A陽性分化精子(下)の密度の両方を使用して、半日本周期の(近似)段階を定義することができる。Adiff の連続した世代は、A1型-A4型、中間(In)およびB型精子と呼ばれる。各結果の分裂は、精子細胞密度の倍増をもたらす。半離層上皮の基部膜上で最も高い細胞密度は、精細形プレレプトテン精子細胞(Pl)が観察される段階VI-VIIIで見られる。スケールバー:スカッシュ準備10μm、その他50μm。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図3:精子形成のステップ。精子形成の異なるステップでの精子の特徴的な特徴. この図の大きなバージョンを表示するには、ここをクリックしてください。
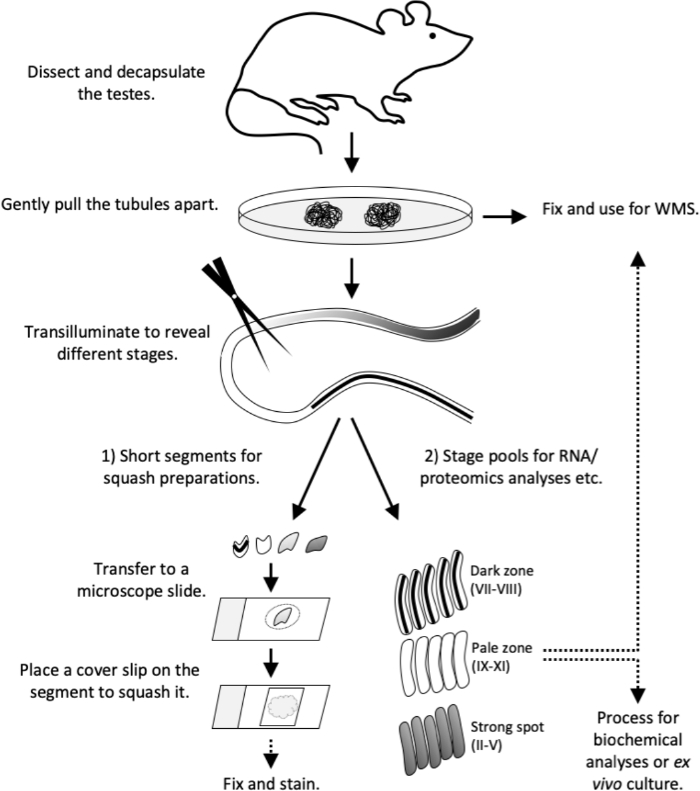
図4:この研究のワークフロー。トランスイルミネーションパターンは、大人(>8週齢)のマウスで完全に確立されています。マウスを犠牲にして、試験解剖とカプセル化解除を遅滞なく進めます。ペトリ皿の上に細管をそっと引き離します。全体のマウント染色のための管状を固定するか、またはトランスイルミネーションを進めます。トランスイルミネーション1)では、スカッシュ調製(品質管理または免疫染色用)または2)の特定の段階の短い細管セグメントを切断し、RNAおよびプロテオミクス分析、組織培養または全実装染色のためのステージプールを収集するために長いセグメントを切断した。PBSの10 μLの容積の顕微鏡のスライドに短い管管の区分を移す。細胞を強制的に外に出し、生細胞単層を形成するために、セグメント上にカバースリップを置きます。顕微鏡で細胞の種類を観察し、その後、固定し、汚れ。WMS、全マウント染色。 この図の大きなバージョンを表示するには、ここをクリックしてください。
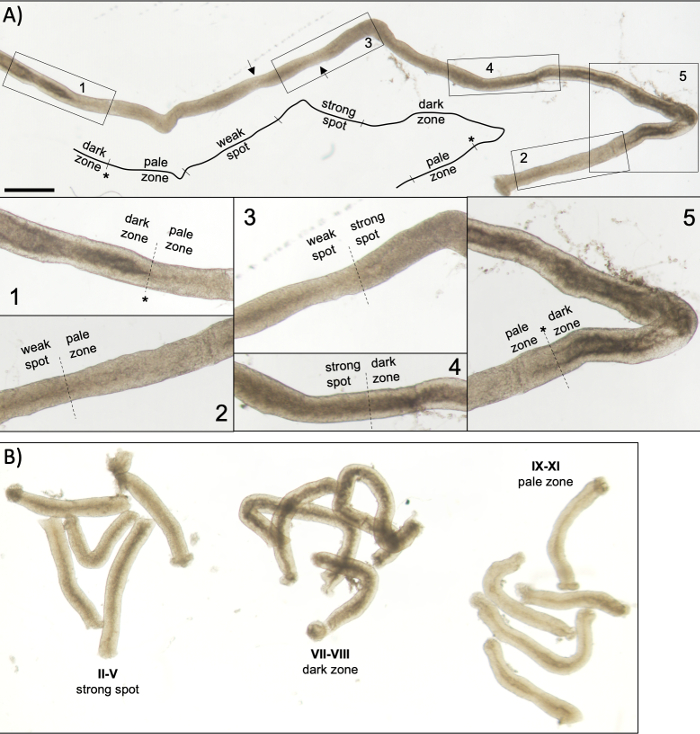
図5:トランスイルミネーション顕微鏡下で見た成体マウスの精細管。(A) 半線上皮の波を示すトランスイルミネーション下で見られる半細管の長いセグメント。4つの異なるゾーンは、精子におけるクロマチンの圧縮と上皮内の局在性に基づいて同定することができる:暗いゾーン(ステージVII-VIII)、淡いゾーン(ステージIX-XI)、弱いスポットゾーン(ステージXII-I)、および強いスポットゾーン(ステージII-VI)。アスタリスク、精子のポイント。矢印は、弱いスポットゾーン内の 2 つの短いセグメントを示し、チューブの機械的応力による淡い外観を持ちます。スケールバー:500 μm。インセット 1 ~ 5 は、選択したチューブ セグメントから高い倍率です。 (B) ステージII–V(強いスポットゾーン)、VII-VIII(暗いゾーン)およびIX-XI(淡いゾーン)を表す半細管のプールされたセグメント。 この図の大きなバージョンを表示するには、ここをクリックしてください。
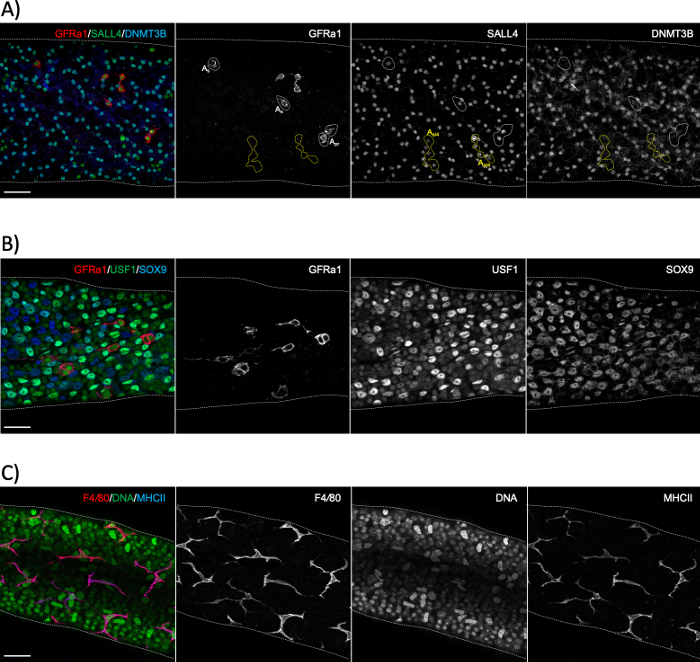
図6:精子、セルトリ細胞および垂管状マクロファージマーカーを用いた全実装免疫染色。(A) GFRα1(赤)、SALL4(緑)、DNMT3B(青)に対する抗体を有するステージXI-IIを表すセグメントの全実装染色。染色は、精子の3つの異なる集団を明らかにする:単独で単離された(A)またはペア(Apr)未分化幹細胞性精子(GFRα1+/SALL4+/DNMT3B-; 白い点線領域)、短い同期性(ここでは4つの整列細胞;al4) 前駆細胞性精子 (GFRα1-/SALL4+/DNMT3B-; 黄色の点線領域) および分化精子 (GFRα1-/SALL4+/DNMT3B+).SALL4+/DNMT3B+細胞はタイプA3-A4精子である。(B)GFRα1(赤)、USF1(緑色)およびSOX9(青)に対する抗体を用いた全実装半細管染色。GFRα1は、精子の茎サブセットを染色する。USF1は、精子およびSOX9+セルトリ細胞の両方によって発現される。(C)成体マウスの眼下マクロファージはF4/80(赤)とMHCII(青)の両方に陽性である。DAPIはDNA(緑色)を染色する。明るい大きな核は、頭膜状筋細胞核である。スケールバー:50 μm。この図の大きなバージョンを表示するには、ここをクリックしてください。
図S1:半線上皮の波を示すトランスイルミネーション下で見られる半細管の長いセグメント。 精液中のクロマチン圧縮と上皮内の局在性に基づいて、4つの異なるゾーンを同定できます:弱いスポットゾーン(ステージXII–I)、強いスポットゾーン(ステージII-VI)、暗いゾーン(ステージVII-VIII)、および淡いゾーン(ステージIX-XI)。精子化点(アスタリスク)は、暗いゾーンが淡いゾーンに突然通過すると認識することができる。スケールバー:500 μm。インセット 1 ~ 4 は、選択したチューブ セグメントから高い倍率です。 こちらをダウンロードしてください。
図S2:半日本体上皮周期の異なる段階の生細胞単層の位相対面顕微鏡観察。(A)段階 I. ステップ 1 ラウンド精子は、まだアクロスソーム構造を欠いている.それらは独特の単一のクロモ中心(白い矢)を持つ小さい丸い核(赤い円)によって特徴付けられる。クロマトイド体は、核膜(青い矢印)と密接に接触した暗顆粒として細胞質に見える。セルトリ細胞核(白い円)には、2つの衛星発色体中心を持つ大きな核オールの3つの暗い病巣が含まれています。セルトリ細胞はスカッシュ製剤では見られないが、胚芽細胞と一緒に尿細管から流出することもある。(B) ステージ II–IV.ステップ4の円形の精子(赤い円)では、頭角構造(赤い矢印)が、核エンベロープに付着した白いわずかに平坦な小胞として現れる。長い精子は束を形成し、精子尾の中間部分にミトコンドリア鞘の存在を示す既に厚い旗ラム(白い矢印)を有している。パキテイン精子細胞の核(PSpc)は、円形の精子の約2倍の大きさであり、核全体に分布する暗黒クロマチン領域によって特徴付けられる。(C) ステージ V-VI.ステップ5~6の円形の精子(赤い円)では、アクロソームはさらに平坦化され、核(赤い矢印)に広がります。アクロソームに面した核エンベロープの領域は、アクロソマル膜と核膜の間にタンパク質が豊富なプレートであるアクロプラキソームが存在するため、暗く見える。長い精子は束(白い矢印)から放出される。パチテイン精子細胞(PSpc)は上皮に頻繁に認められる。(D) ステージ VII-VIII.白い影を持つ核エンベロープの暗い裏地であるアクロソーム(赤い矢印)は完全に拡張され、ステップ7-8ラウンド精子(赤い円)のほぼ全体の有端側を覆っています。この段階は、スカッシュ製剤の多くの部分に豊富である可能性のある成熟した精子(白い矢印)によって特徴付けられる。パキテイン精子細胞の核(PSpc)は、開発中に大きさが大きくなり、前の段階よりもステージVII–VIIIで大きく見えます。パキテイン精子細胞の核内の暗黒クロマチン領域(PSpc)は、高い転写活性および起尿事象のためにあいまいに見える。(E)段階X.ステップX.精子核(白矢印)は伸びを開始したが、クロマチンはまだ凝縮していない。アクロソームは核先端(赤い矢印)でフックを形成し始める。パキテイン精子細胞の核(PSpc)は、大きく見えるが、それらは、大きく、大きな分裂の準備をしている。(F) ステージ XII.ステージXIIは、大動脈メタフェーズプレート(白い破線円)の存在によって特徴付けられる。典型的な凝縮されたクロマチンパターンを有する小さな丸い細胞は、シナプトン複合体形成を開始するために姉妹染色体が整列しているジゴテン精子細胞(ZSpc)である。スケールバー:10 μm。こちらをダウンロードしてください。
図S3:アクロスソームおよび核染色に基づいて半染色上皮周期の段階を同定する。 アセトン固定スカッシュ製剤は、ローダミン共役PNAおよびDAPIで染色した。ステージI:ステップ1ラウンド精子には無嚢体は存在しないが、完全に発達したアクロソームは、細長い精子で検出することができる。第2期~IV期:アクロソームの発達は、円形の精子中の原性/アクロスソーム顆粒の出現から始まる。核表面上のアクロスソーム小胞は、ステップ3精子まで丸く現れ、その後、ステップ4の精子で平坦化する。ステージV: アクロソームに近い角度は40度から最大95°まで広がります。VI–VIIの段階: アクロソームに近い角度は95度から120度まで延長されます。ステージVIII-IX:アクロソームはステップ8の精子(ステージVIII)で完全に拡張され、細胞膜に接触する細胞の先端側の核偏光(図示せず)である。ステージIXによって、精子核は変形する;後部および腹側の表面が最初に見られる。ステージX-XI:精子は、後ろの角度を示す。ステージXII:この段階は、細長い部門の外観によって最もよく特徴付けられる。メタフェーズプレートは白い矢印で示されます。アクロソームを伴う長期の精子も見られる。スケールバー:10μm。 こちらをダウンロードしてください。
図S4:型破りマーカーの全マウント染色。(A)α 平滑筋アクチン(aSMA)は、管内筋状のマイオイド細胞によって表される。 (B) エスピンはセルトリ細胞のタイトな接合部に局部化し、血液検査障壁に寄与する。 (C) PNAは、精子のアクロソームに局部化する。スケールバー:50μm。 こちらをダウンロードしてください。
補足ビデオ1:ステージVII-VIIIを表す半細管の短いセグメントを切断する。こちらをクリックして、このビデオをダウンロードしてください。
ディスカッション
上記で述べたトランスイルミネーション支援マイクロディクショクション法は、精子形成の研究のためのステージ指向のアプローチを可能にする。精子形成は高度に同期化されたプロセスであり、分化コミットメント(段階VII-VIII)、分裂(VII-VIII)の発症、突然変異分裂(XII)、精子伸び(VIII)および精子(V8)の発症など、精子異分化中のすべての重要なステップは、段階依存的な方法で調節され、実行される。ステージ指向の分析は、精子形成の特定のステップに制限され、したがって半日本体上皮周期の定義された段階でのみ発見されるこれらの特定の事象を研究するための強力なツールを提供する。この方法を習得するには、いくつかの練習が必要であり、良質の解剖顕微鏡と適切な照明条件の使用が成功の鍵です。この方法を日常のツールキットの一部として実施することは、精子形成中の分子事象のより正確な解剖を可能にすることによって、男性の生殖機能に関する研究の影響および生物学的関連性を大幅に改善する能力を有する。
我々が研究してきたすべてのWTマウス株は、同様のトランスイルミネーションパターンを示し、半日形成上皮周期の段階で保存された細胞会合を示す。生殖細胞の精子形成分化はWTマウスと大きく異ならないという条件では、我々が研究したすべてのノックアウトマウスモデルにも同じことが当てはまります。また、半日本円上皮周期7の段階の縦方向の区分配置を示す他の種にも適用することができる。ただし、非セグメント段階(ヒトなど)を持つ種は使用できません。トランスイルミネーションパターンを定義する際に、細長い精子のクロマチン縮合の本質的な役割を考えると、このプロセスのいかなる誤った調節も必然的にこの方法の実装に影響を及ぼすことが明らかである。若年マウスおよび若年成人(5-6週間)では、トランスイルミネーションパターンはまだ完全に確立されていないため、8週以上経過したマウスのみを使用する必要があります。また、細管を圧迫して引っ張ることは、半上皮内の細胞アーキテクチャを歪めるため、必然的にトランスイルミネーションパターンに影響を与えることに留意することも重要です。
分離された半細管セグメントはまた、虚生を含む精子形成結合プロセスの ex vivo 観察および操作を可能にする培養することができる。組織の生存率を確保し、RNAおよびタンパク質の分解を防ぐために、サンプルを採取し、マウスを犠牲にしてから2時間以内に処理する必要があります。半細管の エキビボ 培養では、犠牲から培養の発症までの時間は1時間を超えてはならない。尿細管断片の完全性は、通常、適切に収穫されれば 、インビトロで 72時間まで維持することができる。
半日膜上皮周期の段階は、スカッシュ製剤16の位相対比顕微鏡を用いて検証し、さらに正確に定義することができる。顕微鏡検査は、細胞の生きた上で行われ、分析に追加の次元を提供し、精子形成28、29、30の特定段階における細胞小器官または細胞の動きを観察することを可能にする。位相対照顕微鏡は、その後の免疫染色のための正確なステージングを提供し、ステージ特異的な変化を含む精子形成中のタンパク質発現および局在性ダイナミクスの非常に詳細な分析を可能にする。
細胞はスカッシュ製剤の上皮コンテキストから放出されるが、尿細管セグメントの全実装免疫染色は、その生理学的環境における精子形成細胞の研究を可能にする。したがって、全実装製剤は、断面での免疫染色よりも、半細管アーキテクチャとその細胞間接触のより良い視覚化を提供し得る。重要なことに、免疫染色前の管状セグメントのトランスイルミネーション支援ステージングは、特定のセグメントの特定の段階に関する情報を含めることによって、アプローチをさらに強力にします。全型染色は、細管周囲筋膜細胞、骨周管マクロファージ、精子などの半細管周囲の細胞の研究に特に有用であるが、滑術細胞および心肥後性胚芽細胞に関する研究に関する新しい洞察を開く可能性がある。
開示事項
著者らは開示するものは何もない。
謝辞
この作品は、フィンランドアカデミー[315948、314387からN.K.への]からの助成金によって支えられ、;シグリッド・ジュセリウス財団[N.K.、J.T.へ]。エミール・アールトネン財団[J.-A.M.、T.L.へ]。トゥルク分子医学博士課程[S.C.-M.、O.O.O.]。
資料
| Name | Company | Catalog Number | Comments |
| bovine serum albumin (BSA) | Sigma | A9647 | |
| cover glass 20x20 mm | Menzel Gläser | 11961988 | |
| Falcon conical tube 15-ml | Sarstedt | 62.554.502 | |
| fetal bovine serum (FBS) | Biowest | S1810 | |
| grease pen (ImmEdge) | Vector Laboratories | H-4000 | |
| microscope slide Superfrost Plus | Thermo Scientific | 22-037-246 | |
| Parafolmaldehyde (PFA) | Electron Microscopy Sciences | 15714 | |
| Petri dish (100-mm) | Greiner | 664160 | |
| phosphate-buffered saline (PBS) | Gibco | 11503387 | |
| ProLong Diamond Antifade Mountant | Thermo Fisher | P36962 | |
| rhodamine-labelled Peanut agglutinin (PNA) | Vector Laboratories | RL-1072 | |
| Triton X-100 | Sigma | 93443 | |
| Tween-20 | Sigma | P2287 |
参考文献
- Mäkelä, J. A., Toppari, J. Testis Physiology: Seminiferous Cycle. Encyclopedia of Reproduction. , (2018).
- Oakberg, E. F. Duration of spermatogenesis in the mouse and timing of stages of the cycle of the seminiferous epithelium. The American Journal of Anatomy. 99 (3), 507-516 (1956).
- Clermont, Y. Kinetics of spermatogenesis in mammals: seminiferous epithelium cycle and spermatogonial renewal. Physiological Reviews. 52 (1), 198-236 (1972).
- Perey, B., Clermont, Y., Leblond, C. The wave of the seminiferous epithelium in the rat. American Journal of Anatomy. 108 (1), 47-77 (1961).
- de Lima e Martins Lara, N., Costa, G., Avelar, G., Lacerda, S., Hess, R., França, L. Testis Physiology-Overview and Histology. Encyclopedia of Reproduction. , (2018).
- Leblond, C. P., Clermont, Y. Definition of the stages of the cycle of the seminiferous epithelium in the rat. Annals of the New York Academy of Sciences. 55 (4), 548-573 (1952).
- Parvinen, M. Regulation of the seminiferous epithelium. Endocrine Reviews. 3 (4), 404-417 (1982).
- Kotaja, N., et al. Preparation, isolation and characterization of stage-specific spermatogenic cells for cellular and molecular analysis. Nature Methods. 1 (3), 249-254 (2004).
- Nakata, H., Sonomura, T., Iseki, S. Three-dimensional analysis of seminiferous tubules and spermatogenic waves in mice. Reproduction. 154 (5), 569-579 (2017).
- Russell, L. D., Ettlin, R. A., SinhaHikim, A. P., Clegg, E. D. . Histological and histopathological evaluation of the testis. , (1990).
- Parvinen, M., Hecht, N. B. Identification of living spermatogenic cells of the mouse by transillumination-phase contrast microscopic technique for "in situ" analyses of DNA polymerase activities. Histochemistry. 71 (4), 567-579 (1981).
- Ventelä, S., Mäkelä, J. A., Kulmala, J., Westermarck, J., Toppari, J. Identification and regulation of a stage-specific stem cell niche enriched by Nanog-positive spermatogonial stem cells in the mouse testis. Stem Cells. 30 (5), 1008-1020 (2012).
- Faisal, I., et al. Transcription factor USF1 is required for maintenance of germline stem cells in male mice. Endocrinology. 160 (5), 1119-1136 (2019).
- Wright, W. W., et al. Identification of stage-specific proteins synthesized by rat seminiferous tubules. Biology of Reproduction. 29 (1), 257-270 (1983).
- Johnston, D. S., et al. Stage-specific gene expression is a fundamental characteristic of rat spermatogenic cells and Sertoli cells. Proceedings of the National Academy of Sciences of the United States of America. 105 (24), 8315-8320 (2008).
- Toppari, J., Bishop, P. C., Parker, J. W., diZerega, G. S. DNA flow cytometric analysis of mouse seminiferous epithelium. Cytometry. 9 (5), 456-462 (1988).
- Mäkelä, J. A., et al. Hedgehog signalling promotes germ cell survival in the rat testis. Reproduction. 142 (5), 711-721 (2011).
- La, H. M., et al. Identification of dynamic undifferentiated cell states within the male germline. Nature Communications. 9 (1), 04827 (2018).
- Toppari, J., Parvinen, M. In vitro differentiation of rat seminiferous tubular segments from defined stages of the epithelial cycle morphologic and immunolocalization analysis. Journal of Andrology. 6 (6), 334-343 (1985).
- Parvinen, M., Vanha-Perttula, T. Identification and enzyme quantitation of the stages of the seminiferous epithelial wave in the rat. The Anatomical Record. 174 (4), 435-449 (1972).
- Kluin, P. M., Kramer, M. F., de Rooij, D. G. Spermatogenesis in the immature mouse proceeds faster than in the adult. International Journal of Andrology. 5 (3), 282-294 (1982).
- Yoshida, S., et al. The first round of mouse spermatogenesis is a distinctive program that lacks the self-renewing spermatogonia stage. Development. 133 (8), 1495-1505 (2006).
- Chan, A. L., et al. Germline stem cell activity is sustained by SALL4-dependent silencing of distinct tumor suppressor genes. Stem Cell Reports. 9 (3), 956-971 (2017).
- Lokka, E., et al. Generation, localization and functions of macrophages during the development of testis. Nat Commun. 11 (1), 4375 (2020).
- Mäkelä, J. A., Toppari, J. Testis physiology: Spermatogenic cell syncytium. Encyclopedia of Reproduction. , (2018).
- Griswold, M. D. Spermatogenesis: The commitment to meiosis. Physiological Reviews. 96 (1), 1-17 (2016).
- Mäkelä, J. A., Toppari, J. Spermatogenesis. Endocrinology of the Testis and Male Reproduction. , 1-39 (2017).
- Ventela, S., Toppari, J., Parvinen, M. Intercellular organelle traffic through cytoplasmic bridges in early spermatids of the rat: mechanisms of haploid gene product sharing. Molecular Biology of the Cell. 14 (7), 2768-2780 (2003).
- Parvinen, M., Parvinen, L. M. Active movements of the chromatoid body. A possible transport mechanism for haploid gene products. The Journal of Cell Biology. 80 (3), 621-628 (1979).
- Parvinen, M., Söderström, K. O. Chromosome rotation and formation of synapsis. Nature. 260 (5551), 534-535 (1976).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved