Method Article
Dissection assistée par transillumination d’étapes spécifiques du cycle épithélial séminifique de la souris pour les analyses d’immunostaining en aval
Dans cet article
Résumé
Ce protocole décrit la microdissection transillumination-aidée des segments des tubules séminifères adultes de souris représentant des étapes spécifiques du cycle épithélial séminifère, et des types de cellules là, et l’immunostaining suivant des préparations de courge et des segments intacts de tubule.
Résumé
Spermatogenesis est un processus de différenciation unique qui donne finalement lieu à l’un des types de cellules les plus distincts du corps, le sperme. La différenciation des cellules germinales a lieu dans les poches cytoplasmiques des cellules somatiques sertoli qui hébergent simultanément 4 à 5 générations de cellules germinales et coordonnent et synchronisent leur développement. Par conséquent, la composition des types de cellules germinales dans une section transversale est constante, et ces associations cellulaires sont également connues sous le nom de stades (I-XII) du cycle épithélial séminifère. Fait important, les stades peuvent également être identifiés à partir de tubules séminifères intacts en fonction de leurs caractéristiques différentielles d’absorption/dispersion de la lumière révélées par la transillumination, et du fait que les stades se suivent le long du tubule dans un ordre numérique. Cet article décrit une méthode de microdissection transillumination-aidée pour l’isolement des segments seminifères de tubule représentant des étapes spécifiques du cycle épithélial séminifique de souris. Le modèle d’absorption de la lumière des tubules séminifères est d’abord inspecté au microscope à dissection, puis les segments de tubules représentant des étapes spécifiques sont coupés et utilisés pour des applications en aval. Ici, nous décrivons les protocoles d’immunostaining pour les préparations de courges spécifiques à l’étape et pour les segments intacts de tubule. Cette méthode permet à un chercheur de se concentrer sur les événements biologiques qui se déroulent à des phases spécifiques de spermatogenèse, fournissant ainsi un outil unique pour les études développementales, toxicologiques et cytologiques de la spermatogenèse et des mécanismes moléculaires sous-jacents.
Introduction
La différenciation des cellules germinales mâles de la spermatogonie diploïde au spermatozoa haploïde mature, c’est-à-dire la spermatogenèse, est un processus complexe qui a lieu dans l’épithélium des tubules séminifères dans les testicules d’un individu sexuellement mature1. Les descendants mitotiques de la spermatogonie A1 se divisent d’abord cinq fois pour augmenter la population engagée par différenciation, puis entrent dans la méiose sous forme de spermatoocytes qui donnent finalement naissance à des spermatides haploïdes. La différenciation des spermatozods ronds en spermatozoa, c’est-à-dire la spermiogenèse, implique des changements complexes dans la morphologie cellulaire, y compris le compactage nucléaire et la construction de structures spécifiques au sperme telles que l’acrosome et le flagellum. Chez la souris, l’ensemble du processus de spermatogenèse prend 35 jours pour terminer2,3.
À n’importe quel endroit donné, l’épithélium séminifère accueille jusqu’à cinq cohortes de cellules germinales différenciantes plus les cellules souches/progénitrices germinales et les cellules somatiques sertoli1. Les cellules germinales différenciantes forment des couches concentriques dont la composition est prévisible, et les cellules haploïdes à un pas donné de développement s’associent toujours à certains types de spermatocytes et de spermatogonia4,5. Par conséquent, n’importe quelle section transversale d’un tubule accueille des cohortes de cellules germinales d’une composition constante. Ces associations cellulaires spécifiques sont définies comme les stades de l’épithélium séminifère. Les stades en soi ne présentent pas d’états stagnants de type check-point, mais se développent continuellement à mesure que la différenciation des cohortes de cellules germinales progresse ensynchronie 1,2,6. Chez la souris, il y a 12 étapes (I-XII)2 qui sont disposées de façon segmentale le long de l’axe longitudinal du tubule séminifère, et elles se suivent dans un ordre logique formant ainsi l’onde de l’épithélium séminifère, ou vague spermatogénique7,8,9 ( Figure1). L’achèvement de la spermatogenèse prend quatre cycles, et les couches hiérarchiques ou les cohortes de cellules germinales différenciantes dans n’importe quelle section transversale de tubule séminifère sont temporellement un cycle séminifère indépendamment les uns des autres. La durée du cycle dépend des espèces et chez la souris chaque cycle prend 8,6 jours10.
Les stades peuvent être identifiés sur la base de la composition cellulaire et de l’organisation de l’épithélium séminifère sur les sections5 des testicules histologiques (figure 1 et figure 2). Cependant, l’analyse histologique est laborieuse, chronophage et nécessite une fixation et une coloration, et ne peut donc pas être appliquée aux tissus vivants. Fait important, la mise en scène peut également être effectuée sur des tissus vivants sous un microscope à dissection en profitant de modèles distincts d’absorption/dispersion de la lumière exposés à différentes étapes du cycle (figure 2). La capacité de chaque étape d’absorber et de disperser la lumière est relative au niveau de condensation de chromatine des spermatatids post-méiotiques tardifs que n’importe quel hôte de stade donné et l’emballage de ces cellules dans les faisceaux7,11. La différenciation spermatid, c’est-à-direla spermiogenèse, est encore divisée en 16 étapes de développement, y compris 8 étapes de spermatid ronde (étape 1-8) et 8 étapes de différenciation du spermatid allongé (étapes 9-16) (figure 1). Les spermatids allongés de l’étape 9-11 (stade IX-XI) n’affichent qu’un faible niveau de condensation de chromatine, ce qui entraîne l’absorption d’une faible quantité de lumière. La condensation de chromatine commence à l’étape 11 spermatids (stade XI), et l’étape 15-16 allongeant les spermatatids (stade IV-VIII) contiennent la chromatine entièrement condensée, et présentent donc une absorption maximale de lumière (figure 3). La chromatine doit être condensée afin d’être bien emballée dans la tête du sperme. D’autres facteurs qui contribuent au modèle d’absorption de la lumière sont l’emplacement des spermatatids allongés dans l’épithélium (basal vs apical) et le regroupement des spermatatids allongés (prononcés aux stades II-V)11 (Figure 3). Les faisceaux sont considérés comme des taches au milieu des tubules et comme des rayures sur les bords sous un microscope de dissection et plus la chromatine est condensée, plus la tache/bande11 est foncée.
Cet article décrit l’utilisation de la méthode de microdissection transillumination-aidée pour l’isolement des segments seminifères de tubule représentant des étapes spécifiques du cycle épithélial séminifère. Une fois isolés, les segments de tubules mis en scène peuvent faire l’objet de diverses analyses en aval, y compris les analyses biochimiquesde l’ARN et des protéines 12,13,14,15, cytométrie du débit16, culture ex vivo tubule17 et immunostaining18. Ici, nous fournissons également des protocoles détaillés en aval pour préparer les monocouches écrasées des segments de tubules par étapes pour l’analyse morphologique des cellules vivantes et l’immunostaining subséquent, ainsi que des immunostainings de montage entier des segments de tubule. Le flux de travail en un mot décrit dans la figure 4.
La méthode de microdissection assistée par transillumination permet l’identification et l’isolement précis des cellules germinales à des étapes spécifiques de différenciation grâce à la composition cellulaire synchronisée des stades. Fait important, il permet également l’étude d’événements dépendant des stades pendant la spermatogenèse sur les tissus vivants. Étant donné l’absence de modèles in vitro évolutifs pour la spermatogenèse, cette méthode a également un avantage unique de permettre des études développementales et toxicologiques ciblées à court terme sur des segments tubules spécifiques à l’étape ex vivo12,17. Alors que nous décrivons la méthode ici pour la souris, la même procédure peut être appliquée à toutes les espèces de mammifères avec arrangement longitudinal et segmental des stades épithéliales séminifères, tels que le rat4,7,15,19,20.
Protocole
L’entretien des souris de laboratoire et de toutes les expériences sur les animaux a été effectué conformément aux lignes directrices et règlements pertinents pour le soin et l’utilisation des animaux de laboratoire à l’Université de Turku.
1. Préparation de tubules séminifères pour la microdissection
- Sacrifier une souris mâle adulte (≥8 semaines, testis 80-120 mg selon la souche et l’âge) par asphyxie au CO2 suivie d’une dislocation cervicale.
REMARQUE : La souris doit être mature sexuellement et de préférence d’au moins 8 semaines. Le modèle de transillumination des souris juvéniles diffère de l’adulte parce que l’onde de l’épithélium séminifique n’a pas encore été entièrement établie, et le moment de la première vague de spermatogenèse est distinct21,22. Le manque de spermatids allongés chez des souris mâles de 4 semaines empêche leur utilisation pour la microdissection assistée par transillumination. Toutes les souches de souris qui ont une spermatogenèse normale peuvent être utilisées. - Vaporiser l’abdomen ventral de 70 % d’éthanol. Ouvrez la cavité abdominopelvienne à l’aide de ciseaux stériles, en faisant une ouverture en forme de V.
- Tirant sur le tampon de graisse épididymale avec des forceps stériles, localisez les testicules, disséquez-les à l’aide de ciseaux et placez-les sur une boîte de Pétri stérile de 100 mm contenant du PBS.
REMARQUE : Pour maintenir la stérilité, assurez-vous que tous les outils de laboratoire et chirurgicaux sont stériles. - À l’aide de ciseaux à pointe fine décapsulent les testicules en coupant une fente dans le tunica albuginea,l’épaisse feuille fibreuse encapsulant les testicules. Puis déchirer la tunica ouverte à l’aide d’une paire de forceps. Forcer les tubules en appuyant avec des forceps et jeter la tunica.
REMARQUE : Tout en jetant la tunica, il pourrait être avantageux pour certaines applications en aval que l’artéiculaire testiculaire soit enlevée avec la tunica. Évitez d’endommager les tubules séminifères. - Déplacez les tubules séminifères dans une nouvelle boîte de Pétri et versez suffisamment de PBS stérile pour couvrir le fond de la boîte de Pétri. Ensuite, retirez doucement les tubules, mais évitez d’endommager les tubules.
REMARQUE : Trop de stress mécanique emprisera le modèle de transillumination et affectera la viabilité du tissu et de son architecture cellulaire. Les tubules peuvent également être traités pour des immunostainings de montage entier à partir de ce point sans mise en scène (3B). Parfois, il suffit de définir la scène rétrospectivement en incluant des anticorps contre les protéines exprimées dans la différenciation spermatogonia, tels que SALL4, c-KIT et DNMT3A18,23. La densité du spermatogonia est un indicateur de stade relativement fiable (Figure 2).
2. Microdissection assistée par transillumination
- Placez fermement la boîte de Pétri sous un microscope à dissection en l’enlanant sur scène.
REMARQUE : Il est important d’enregistrer bien la boîte de Pétri pour empêcher son mouvement qui pourrait causer le mélange des segments de tubule séminifères mis en scène rassemblés. - Pour révéler le modèle d’absorption de la lumière des tubules séminifères sous mise au point, assurez-vous que l’échantillon est éclairé d’en bas et que la lumière traverse l’échantillon, c’est-à-direqu’il est transilluminé.
REMARQUE : La quantité de lumière absorbée/dispersée est par rapport au niveau de condensation de chromatine dans les spermatids allongés et à leur regroupement à l’intérieur du tubule séminifère : plus il est condensé, plus la lumière est absorbée, c’est-à-dire qu’elleapparaît plus foncée. - Familiarisez-vous avec le modèle d’absorption de la lumière des différentes étapes tel que décrit dans la figure 2, la figure 5A et la figure S1 en déplaçant soigneusement des faisceaux de tubules à l’aide de forceps fins.
REMARQUE : Les étapes se suivent toujours dans un ordre logique, formant la vague de l’épithélium séminifère. Cependant, il est important de savoir que la direction de l’onde spermatogénique s’inverse parfois, puis revient à nouveau (également connu sous le nom de modulations4,9), compliquant parfois la procédure. En outre, la longueur de chaque étape, en termes de combien de mm de tubule, varie considérablement. - Soulevez soigneusement le tubule d’intérêt à l’aide de forceps avec une pointe accrochée, puis coupez un segment de longueur appropriée à l’aide de ciseaux de microdissection (voir vidéo supplémentaire 1). Un crochet à l’extrémité des forceps facilite le levage et la tenue d’un tubule et aide à éviter de le presser.
REMARQUE : La longueur des segments à couper dépend des applications en aval. Pour la collecte de morceaux de tubule mis en commun d’une étape spécifique pour l’analyse des protéines ou del’ARN 12,13 (II-V, VII-VIII et IX-XI, figure 5B),la longueur est généralement de 2-5 mm. Lorsque l’extraction standard phénol-chloroforme est utilisée, environ 200 ng d’ARN peuvent être dérivés de 1 mm de tubule. Pour la coloration de montage entier des segments de tubule mis en scène, la longueur des segments devrait être >5 mm. Pour les préparations de courge, la longueur des segments ne doit pas dépasser 1 à 2 mm parce que les cellules au milieu du segment peuvent ne pas sortir si elles sont trop longues. Utilisez une échelle de mm sous la boîte de Pétri pour une mesure précise de la longueur du tubule.
3. Immunostaining de différentes préparations
- Préparation de courge : vérification de stade et immunostaining
REMARQUE : Des morceaux de tubule spécifiques à l’étape peuvent être écrasés sur une lame de microscope avec un verre de couverture pour effectuer l’analyse morphologique des cellules vivantes par microscopie de phase-contraste et immunostaining suivant. Un débutant est recommandé d’utiliser cette approche pour vérifier les étapes lors de la connaissance de la méthode de microdissection assistée par transillumination.- Recueillir le segment dans un volume de 10 μL à l’aide d’une pipette et le déplacer sur une lame de microscope.
- Écraser le tubule en plaçant soigneusement un verre de couverture (20 mm x 20 mm) sur le tubule. En conséquence, les cellules s’écoulent du tubule et forment un monocouche à cellules vivantes. Placez un papier filtre sur le bord du verre de couverture pour faciliter la propagation des cellules. Évitez trop d’écraser les cellules pour les garder en vie.
- Surveiller la propagation des cellules au microscope. Utilisez un microscope à contraste de phase à l’objectif 40x pour vérifier la reconnaissance par étapes en examinant les types de cellules présents (figure 2, figure S2).
- Une fois que les cellules se sont propagées pour former un monomouche rond des deux extrémités du tubule, trempez la glissière dans un récipient contenant de l’azote liquide tout en la tenant avec des forceps. Gardez-le immergé pendant 10 s. Placez alternativement la glissade sur une plaque de glace sèche pour le gel.
- Retirer le verre de couverture en le renversant à l’aide d’un scalpel.
- Sans délai, procéder à la fixation et placer rapidement la glissière dans un récipient avec 90% d’éthanol pendant 2-5 min.
REMARQUE : Assurez-vous que la préparation de la courge ne dégèle pas avant de la placer à 90 % d’éthanol. D’autres fixatifs peuvent également être utilisés, comme l’acétone, pendant 10 min. - Sécher à l’air et les conserver à température ambiante (RT) (jusqu’à quelques jours) ou à -80 °C (à long terme).
- Pour l’immunostaining, post-fixer les échantillons dans 4% paraformaldéhyde (PFA) pendant 10 min à RT.
- Rincer en PBS et perméabilizer avec 0,1% Triton X-100 en PBS pendant 5 min.
- Rincer au PBS et dessiner un anneau de graisse autour de chaque échantillon de courge.
- Ajouter 50 à 100 μL de 10 % de BSA (albumine de sérum bovin) dans 0,1 % de préadolescent dans le PBS (PBST) à l’intérieur de l’anneau de graisse et bloquer les échantillons pendant 30 min à RT.
- Retirez la solution BSA et incubez avec un anticorps primaire dilué dans 10% BSA en PBST pendant 1 h à RT.
- Laver 3x pendant 5 min avec PBST.
- Incuber avec un anticorps secondaire dilué dans 10% BSA en PBST.
REMARQUE : Pour tacher les acrosomes, les échantillons peuvent être incubés avec de l’anticorps agglutinine d’arachide étiqueté rhodamine (PNA, 1:1000) dans 10% BSA en PBST pendant 1 h à RT (figure S3) au lieu d’anticorps primaires et secondaires spécifiques. - Laver 3x pendant 5 min chacun avec PBST, rincer avec PBS et monter avec un support contenant DAPI.
- Immunostaining de montage entier des tubules seminifères
REMARQUE : Le protocole ci-dessous décrit la coloration de montage entier pour les segments de tubules mis en scène (à partir de l’étape 2.4). Si un chercheur veut effectuer des taches de montage entier sans mise en scène (à partir de l’étape 1.5), faites attention aux notes en 3.2.1 et 3.2.7.- À l’aide d’une pipette, transférer les segments tubules (de l’étape 2.4) dans un PBS glacé dans un tube conique de 15 mL et leur permettre de sédimenter sur la glace.
REMARQUE : Si vous utilisez des tubules non mis en scène à partir de 1,5,, séparez les tubules dans une boîte de Pétri en érigés de haut en arrière sur un plat incliné plusieurs fois. Utilisez une pipette de 1 mL avec une pointe coupée. Cette étape vise à ouvrir la structure du tissu. Cependant, évitez trop de pipetage car il pourrait endommager les tubules. La sédimentation des tubules prendra quelques dizaines de secondes. De petits fragments de tubules, des cellules interstitielles et des débris cellulaires restent dans le supernatant. - Retirez soigneusement le supernatant (SN) par pipetting ou avec un aspirateur. Ajouter 10 mL de PBS glacé et mélanger par inversion.
- Laisser sédimenter, puis enlever le SN comme avant.
- Ajouter 5 mL de 4% de PFA et fixer pendant 5 h sur une table rotative (20-30 rpm) à +4 °C.
REMARQUE : Le temps de fixation dépend des protéines d’intérêt et de leur localisation subcellulaire. Pour les protéines nucléaires et cytoplasmiques, une fixation de 2 h est généralement suffisante, cependant, des marqueurs membranaires, tels que GFRα1 (récepteur familial GDNF alpha 1; Figure 6A,B), bénéficier d’une fixation plus longue, jusqu’à 6 h. - Laisser sédimenter, enlever le SN (PFA) comme avant, et rincer brièvement en ajoutant 10 mL de PBS et en inversant le tube.
- Laisser sédimenter, enlever le SN comme avant, et répéter l’étape de lavage PBS trois fois pendant au moins 10 min chacun sur une table rotative à +4 °C et procéder à la coloration ou le stocker à +4 °C.
REMARQUE : Si les conditions de travail sont stériles et propres, les échantillons peuvent être stockés et utilisés pendant au moins quelques semaines. Sinon, ajoutez de l’azide de sodium à une concentration finale de 0,02 % (w/v) à partir d’une solution de stock de 2 % pour aider à préserver les tubules avant de les stocker à +4 °C. - À l’aide d’une pipette de 1 mL, déplacez 10 à 20 segments de tubules fixes vers un tube à fond rond de 2 mL. Laisser sédimenter et enlever le SN.
REMARQUE : Si vous travaillez avec de longs tubules qui n’ont pas été mis en scène, versez les tubules sur une boîte de Pétri et à l’aide de ciseaux de microdissection et de forceps coupent des segments d’environ 5 à 20 mm. Les segments trop longs s’emmêlent pendant la procédure de coloration, tandis que les segments trop courts sont facilement perdus. - Ajouter 1 mL de 2% BSA + 10% FBS (sérum bovin fœtal) dans 0,3% Triton X-100 en PBS (PBSX). Bloquez pendant au moins 1 h sur une table rotative (20-30 tr/min) à RT.
- Rincer avec 1 mL de PBSX, retirer le SN par pipetting et ajouter 250 μL d’anticorps primaires dilués dans 1% BSA dans PBSX (1:100-1:2000 dilution). Incuber pendant 2 h à RT ou toute la nuit à +4 °C sur une table rotative (20-30 tr/min).
- Retirez la solution d’anticorps en pipetage et rincez les tubules avec 1 mL de PBSX comme ci-dessus. Laver trois fois pendant 1 h en PBSX sur une table rotative (20-30 tr/min) à RT.
REMARQUE : Après ce premier lavage, l’échantillon peut être laissé toute la nuit à +4 °C si nécessaire. - Retirer le SN et ajouter 250 μL d’anticorps secondaires dilués dans 1 % de BSA dans PBSX (dilution généralement de 1 500 d’un anticorps étiqueté fluorescent). Couvrir de papier d’aluminium et incuber sur une table rotative (20-30 tr/min) à RT pendant 1 h.
- Répétez 3.2.10.
- Enfin enlever le SN et verser les tubules sur une lame de microscope. Séparer délicatement et disposer les tubules en bandes linéaires à l’aide de pointes de chargement de gel. Égoutter l’excès de tampon et ajouter le milieu de montage et un coverslip.
REMARQUE : Évitez de sécher les tubules tout en les arrangeant. La contre-coloration des noyaux avec dapi n’est pas nécessaire dans la plupart des cas. Sceller le bord du coverslip avec du vernis à ongles pour éviter le séchage et la détérioration de l’échantillon. Les diapositives peuvent être stockées pendant 1 à 2 semaines à +4 °C avant l’imagerie.
- À l’aide d’une pipette, transférer les segments tubules (de l’étape 2.4) dans un PBS glacé dans un tube conique de 15 mL et leur permettre de sédimenter sur la glace.
Résultats
Une mise en scène et une microdissection réussies des tubules séminifères de souris dépendent principalement de la recherche des conditions d’éclairage appropriées et d’un microscope de dissection approprié, et de la capacité de reconnaître des caractéristiques spécifiques qui caractérisent chaque étape. Les stades VII-VIII semblent homogènement sombres parce qu’ils contiennent un grand nombre de spermatids allongés entièrement condensés qui sont alignés à la surface apical de l’épithélium (figure 5A et figure S1). Après que le spermatozoa mûr soit libéré dans le lumen dans la spermiation, le tubule semble très pâle aux étapes IX-XI dues à l’absence de spermatids allongés condensés dans l’épithélium. La caractéristique la plus facile à identifier sur les tubules transilluminés est le point de spermiation (astérisque dans la figure 5A et la figure S1),c’est-à-dire la transition soudaine de la zone sombre (VII-VIII) à la zone pâle (IX-XI). La zone pâle est suivie par la zone de point faible (XII-I). L’apparence inégale provient de l’organisation de spermaturdes allongés avec de la chromatine condensée en faisceaux. Les faisceaux deviennent très importants dans la zone de point forte suivante (II-V). De plus, les faisceaux de spermatozoïdes migrent vers les noyaux cellulaires sertoli situés près du lamina basal, qui se reflète comme l’apparence rayée du tubule de stade II-V lorsqu’il est transilluminé (figure 2, figure 5A,B et figure S1). Les faisceaux se dispersent finalement au stade VI et les spermatidés allongés se déplacent près du lumen pour être libérés de l’épithélium au stade VIII.
L’étape exacte du segment des tubules peut être vérifiée avec précision par microscopie à contraste de phase des préparations de courges (figure 2 et figure S2). Les étapes spécifiques dans les préparations de courge sont reconnues sur la base du développement acrosomal des spermatatids ronds de l’étape 1-8, de l’état de condensation de chromatine dans l’allongement des spermatids, et de la présence de faisceaux spermatid16 (figure 3 et figure S2). En outre, la présence de types de cellules antérieures, tels que le spermatogonia de type B et les spermatocytes leptotene ou zygotène, qui peuvent être reconnus sur la base de leurs caractéristiques morphologiques, peut être utilisée pour soutenir la reconnaissance de stade. La taille des noyaux de spermatocyte de pachytene augmente dans la taille autour du stade VI, qui peut également fournir l’aide supplémentaire dans la mise en scène.
Les préparations de courges par étapes peuvent être utilisées pour étudier l’expression et la localisation des protéines d’intérêt dans l’épithélium séminifère à l’aide de l’immunostaining. Cela permet une analyse très précise de l’expression spécifique au type de cellule en raison de la composition cellulaire bien définie à chaque étape. L’expression spécifique à l’étape peut être encore augmentée par la co-coloration de l’acrosome(par exemple,avec PNA) qui permet la visualisation d’étapes distinctes de la différenciation ronde de spermatid. Des images représentatives d’acrosomes tachés de PNA à différents stades sont fournies à la figure S3. La coloration acrosomale peut également être utilisée pour définir la scène rétrospectivement. Cependant, la mise en scène assistée par transillumination est une méthode beaucoup plus facile et plus rapide pour trouver l’étape désirée que d’utiliser des fragments non mis en scène d’une manière aléatoire.
La coloration du tubule seminifère à montage entier est généralement utilisée pour étudier les types de cellules qui sont en contact avec la membrane du sous-sol de l’épithélium séminifère, soit du côté tubulaire (spermatogonia, spermatocytes préleptotene et cellules sertoli; Figure 6A,B) ou le côté interstitiel (cellules myoïdes péritubulaires et macrophages péritubulaires; Figure 6C et Figure S4A)24. Cependant, la méthode peut également être utilisée pour étudier les cellules ou les structures qui sont situées plus profondément dans l’épithélium, comme la barrière de testicules sanguins (Espin, Figure S4B),ou les cellules germinales postméiotiques (marqueur acrosome PNA, figure S4C). Si vous utilisez des segments de tubules non mis en scène, il est possible d’estimer rétrospectivement une étape donnée à l’aide d’un anticorps contre une protéine qui s’exprime dans la différenciation du spermatogonie (A1, A2, A3, A4, In et B; collectivement Adiff) (Figure 2). La mise en scène s’appuie alors sur la densité dudiff syncytial A qui subissent six divisions mitotic d’une manière étape-dépendante pendant le premier cycle de différenciation spermatogenic1,doublant ainsi le nombre de spermatogoniade diff A dans la syncytie après chaque division1,25. Cependant, la mise en scène rétrospective est moins précise que la mise en scène assistée par transillumination parce qu’il n’y a pas de marqueurs spécifiques pour desgénérations distinctes de Diff A et l’évaluation dela densité diff A peut être sujette à erreur.

Figure 1 : Carte du cycle épithélial séminifique pour la mise en scène de la spermatogenèse de souris. Les colonnes verticales montrent des associations cellulaires à différents stades du cycle épithélial séminifique (marquées de chiffres romains I-XII). Les cellules germinales les plus immatures se trouvent en bas, tandis que les plus différenciées se trouvent en haut. Pour suivre l’évolution de la différenciation des cellules germinales, il faut passer de gauche à droite et de bas en haut. Un cycle de l’épithélium séminifère est une série complète d’étapes qui se suivent dans un ordre numérique. Anon,spermatogonia indifférencié; A1-4, spermatogonie de type A1-A4; Dans, spermatogonia intermédiaire ; B, spermatogonie de type B; Pl, spermatocytes préleptotene; L, spermatocytes leptotene; Z, spermatocytes zygotènes; P, spermatocytes pachytene; D, spermatocytes diplotène; 2°, spermatocytes secondaires plus divisions méiotiques. Les chiffres arabes 1-16 se réfèrent à des étapes de maturation post-méiotique de spermatid (spermiogenèse). S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
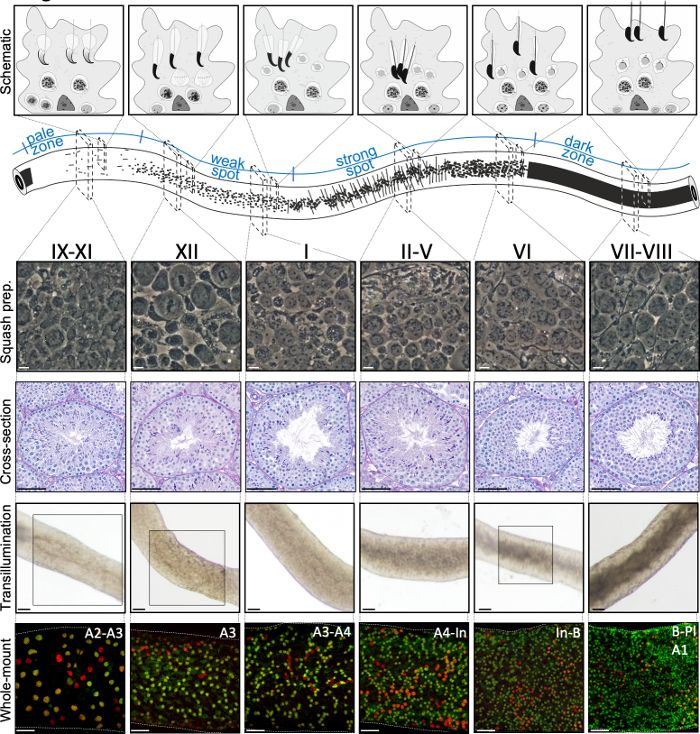
Figure 2 : Associations cellulaires à un stade du cycle épithélial séminifère de la souris. Les étapes du cycle épithélial séminifique se suivent dans un ordre logique, et forment ainsi l’onde spermatogenic le long de l’axe longitudinal d’un tubule séminifère. Le panneau supérieur illustre les associations de cellules germinales à différents stades, et l’emplacement des types de cellules dans les poches cytoplasmiques des cellules sertoli (gris clair) dans l’épithélium séminifère. L’illustration du tubule séminifère visualise l’onde spermatogenic et les modèles spécifiques de transillumination du point pâle et faible, du point fort et des zones foncées. À partir de chaque stade indiqué, des images représentatives de contraste de phase des cellules vivantes des préparations de courges et des sections transversales périodiques de testicules tachés d’acide-Schiff (PAS) sont montrées. Les deux panneaux du bas montrent des segments de tubule séminifère après la transillumination (en haut) ou la coloration avec des anticorps (en bas) contre SALL4 (rouge, un marqueur pan-spermatogonial) et DNMT3A (vert,un marqueur A diff). Les modèles de transillumination des étapes IX-XI, XII et VI sont mis en évidence avec des zones en boîte. Le modèle d’absorption de la lumière (en haut) et la densité de spermatogonia différeciant DNMT3A-positif (en bas) peuvent être utilisés pour définir le stade (approximatif) du cycle séminifère. Les générations successivesde Diff A sont appelées spermatogonie de type A1-A4, intermédiaire (In) et de type B. La division de chaque a comme résultat le doublement de la densité spermatogoniale de cellules. La densité cellulaire la plus élevée sur la membrane du sous-sol de l’épithélium séminifique est observée aux stades VI-VIII lorsque des spermatocytes méiotiques de préleptotene (Pl) sont observés. Barres d’échelle : préparation de courge. 10 μm, autres 50μm. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.

Figure 3 : Étapes de la spermiogenèse. Caractéristiques distinctives des spermatocats à différentes étapes de la spermiogenèse. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
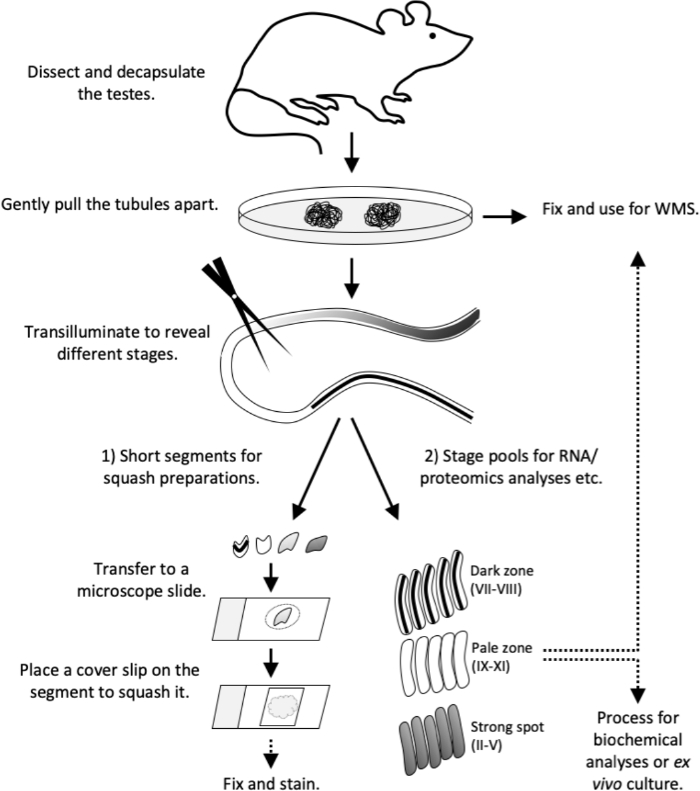
Figure 4 : Flux de travail de cette étude. Le modèle de transillumination a été entièrement établi chez une souris adulte (>8 semaines). Sacrifiez la souris et procédez sans délai à la dissection et à la décapsulation des testicules. Retirer délicatement les tubules sur une boîte de Pétri. Fixer les tubules pour les taches de montage entier ou procéder à la transillumination. Sous transillumination 1) coupez de courts segments tubules de stades spécifiques (s) pour les préparations de courges (contrôle de la qualité ou immunostaining) ou 2) coupez des segments plus longs pour recueillir des pools de stade pour les analyses d’ARN et de protéomique, la culture tissulaire ou pour les taches de montage entier. Transférez de courts segments de tubules sur une lame de microscope en volume de 10 μL de PBS. Placez un glissement de couverture sur le segment pour forcer les cellules et pour former un monocouche cellulaire vivant. Observez les types de cellules au microscope, puis fixez et tacher. WMS, coloration de montage entier. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
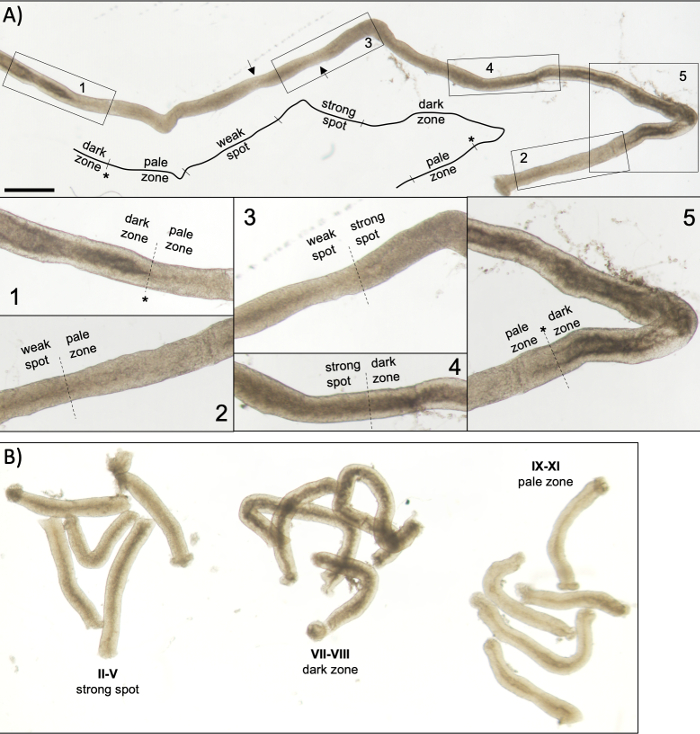
Figure 5 : Tubule séminifère d’une souris adulte vu sous microscopie de transillumination. (A) Un long segment de tubule séminifère vu sous transillumination affichant l’onde de l’épithélium séminifère. Quatre zones distinctes peuvent être identifiées en fonction du compactage de la chromatine chez les spermatatids et de leur localisation à l’intérieur de l’épithélium : zone sombre (stades VII-VIII), zone pâle (stades IX-XI), zone de points faibles (stades XII-I) et zone forte (stades II-VI). Astérisque, point de spermiation. Les flèches indiquent deux segments courts dans la zone de point faible qui ont un aspect pâle en raison du stress mécanique sur le tubule. Barre d’échelle : 500 μm. Les insets 1-5 sont des grossissements plus élevés provenant de segments de tubules sélectionnés. (B) Segments mis en commun de tubules séminifères représentant les stades II-V (zone forte), VII-VIII (zone sombre) et IX-XI (zone pâle). S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
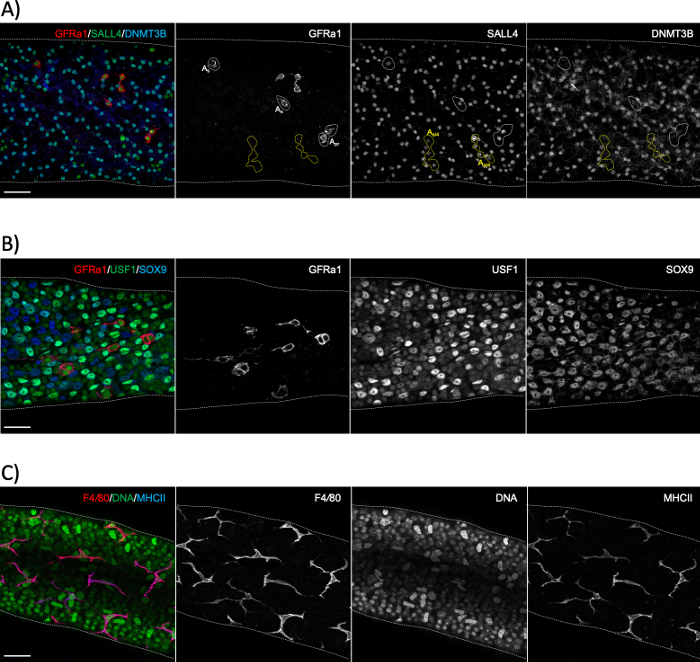
Figure 6 : Immunostainings à montage entier à l’aide de marqueurs de macrophage spermatogonial, sertoli et péritubulaire. (A) Coloration de montage entier pour un segment représentant l’étape XI-II avec des anticorps contre GFRα1 (rouge), SALL4 (vert) et DNMT3B (bleu). La coloration révèle trois populations distinctes de spermatogonie : isolée ment (As)ou appariée (Apr)spermatogonia souche indifférenciée (GFRα1+/SALL4+/DNMT3B- ;zones pointillées blanches), syncytial court (ici 4 cellules alignées; Aal4) progéniteur spermatogonia (GFRα1-/SALL4+/DNMT3B-; zones pointillées jaunes) et différenciant spermatogonia (GFRα1-/SALL4+/DNMT3B+). SALL4+/DNMT3B+ les cellules sont de type A3-A4 spermatogonia. (B) Tache de tubule séminifère à montage entier avec des anticorps contre GFRα1 (rouge), USF1 (vert) et SOX9 (bleu). GFRα1 tache le sous-ensemble de tige de spermatogonia. USF1 est exprimé par les cellules spermatogonia et SOX9+ Sertoli. (C) Les macrophages péritubulaires chez les souris adultes sont positifs à la fois pour F4/80 (rouge) et MHCII (bleu). Dapi tache l’ADN (vert). Les gros noyaux lumineux sont des noyaux cellulaires myoïdes péritubulaires. Barres d’échelle : 50 μm. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Figure S1 : Un long segment de tubule séminifère observé sous transillumination affichant l’onde d’épithélium séminifère. Quatre zones distinctes peuvent être identifiées en fonction du compactage de la chromatine chez les spermatatids et de leur localisation dans l’épithélium : zone de point faible (stades XII-I), zone forte (stades II-VI), zone sombre (stades VII-VIII) et zone pâle (stades IX-XI). Le point de spermiation (astérisque) peut être reconnu comme la zone sombre transite brusquement dans la zone pâle. Barre d’échelle : 500 μm. Les insets 1-4 sont des grossissements plus élevés provenant de segments de tubules sélectionnés. S’il vous plaît cliquez ici pour télécharger ce chiffre.
Figure S2 : Microscopie à contraste de phase des monocouches à cellules vivantes de différentes étapes du cycle épithélial séminifère. (A) Étape I. Étape 1 spermatids ronds n’ont toujours pas la structure acrosomale. Ils sont caractérisés par un petit noyau rond (cercles rouges) avec un chromocenter unique distinctif (flèches blanches). Le corps chromatoïde est visible dans le cytoplasme comme granule foncé en contact étroit avec la membrane nucléaire (flèches bleues). Le noyau cellulaire sertoli (cercle blanc) contient trois foyers sombres : un grand nucléolus avec deux chromocenters satellites. Les cellules sertoli ne sont pasoften vu dans les préparations de courge, mais ils s’écoulent parfois de la tubule avec des cellules germinales. (B) Étape II-IV. Dans l’étape 4 des spermatatids ronds (cercles rouges), la structure acrosomale (flèches rouges) apparaît sous la forme d’une vésicule blanche légèrement aplatie fixée à l’enveloppe nucléaire. Les spermatocats allongés forment des faisceaux et ont déjà un flagellum épais (flèches blanches) indiquant la présence de gaine mitochondriale dans le morceau moyen de la queue de sperme. Les noyaux des spermatocytes pachytene (PSpc) sont environ deux fois plus grands que ceux des spermatides ronds et sont caractérisés par des régions de chromatine foncée réparties dans tout le noyau. (C) Étape V-VI. Dans l’étape 5-6 spermatids ronds (cercle rouge), l’acrosome est encore aplati et s’étend sur le noyau (flèches rouges). La zone de l’enveloppe nucléaire face à l’acrosome semble sombre en raison de la présence de l’acroplaxome, une plaque riche en protéines entre la membrane acrosomale et la membrane nucléaire. Les spermatids allongés sont libérés des faisceaux (flèches blanches). Des spermatocytes de Pachytene (PSpc) sont fréquemment observés dans l’épithélium. (D) Étape VII-VIII. L’acrosome (flèches rouges), une doublure sombre sur l’enveloppe nucléaire avec des ombres blanches, est entièrement étendu et couvre presque tout le côté apical de l’étape 7-8 spermatids ronds (cercles rouges). Cette étape est caractérisée par des spermatatids matures (flèches blanches) qui peuvent être abondants sur de nombreuses parties de la préparation de courge. Le noyau des spermatocytes pachytene (PSpc) se développe en taille pendant le développement et apparaît plus grand au stade VII-VIII qu’aux étapes précédentes. Les zones de chromatine foncée à l’intérieur du noyau des spermatocytes pachytene (PSpc) semblent floues en raison de l’activité transcriptionnelle élevée et des événements méiotiques. (E) Stade X. L’étape 10 des noyaux spermatid (flèches blanches) ont initié l’allongement, mais la chromatine n’a pas encore condensé. Les acrosomes commencent à former un crochet à la pointe nucléaire (flèche rouge). Les noyaux des spermatocytes de pachytene (PSpc) semblent très grands pendant qu’ils se préparent aux divisions méiotiques. (F) Étape XII. L’étape XII se caractérise par la présence de plaques méiotiques de métaphe (cercles blancs pointillés). Les petites cellules rondes avec le modèle condensé typique de chromatine sont des spermatocytes de zygotène (ZSpc), dans lesquels les chromosomes sœurs s’alignent pour initier la formation complexe synaptonemal. Barres d’échelle : 10 μm. S’il vous plaît cliquez ici pour télécharger ce chiffre.
Figure S3 : Identification du stade du cycle épithélial séminifique sur la base de taches acrosomales et nucléaires. Les préparations de courges fixées à l’acétone ont été tachées d’ANA et de DAPI conjuguées à la rhodamine. Étape I : Bien qu’il n’existe pas d’acrosome à l’étape 1 des spermatatids ronds, un acrosome entièrement développé peut être détecté chez les spermatatids allongés. Stades II-IV : Le développement acrosomal commence par l’apparition de granules proacrosomal/acrosomal chez les spermatatids ronds. Le vésicule acrosomal sur la surface nucléaire apparaît rond jusqu’à l’étape 3 spermatids, puis s’aplatit dans l’étape 4 spermatids. Étape V : L’angle sous-tendé par l’acrosome s’étend de 40 degrés à un maximum de 95°. Étapes VI-VII : L’angle sous-tendé par l’acrosome s’étend de 95 degrés à 120 degrés. Stades VIII-IX : L’acrosome est complètement étendu dans l’étape 8 spermatids (étape VIII), et les noyaux polarisent sur le côté apical de la cellule prenant contact avec la membrane plasmatique (non montré). Au stade IX, le noyau de spermaturdes se déforme; les surfaces dorsales et ventrales sont d’abord vues. Étapes X-XI: Spermatids montrent l’angle dorsal. Étape XII: Cette étape est mieux caractérisée par l’apparition de divisions méiotiques; les plaques de métaphyse sont indiquées avec des flèches blanches. On voit aussi des spermatids allongés avec leurs acrosomes. Barres d’échelle : 10μm. S’il vous plaît cliquez ici pour télécharger ce chiffre.
Figure S4 : Coloration de montage entier pour marqueurs non conventionnels. (A) L’actine musculaire lisse alpha (aSMA) est exprimée par les cellules myoïdes péritubulaires. (B) Espin localise à sertoli cellules jonctions serrées et contribue à la barrière de testicules sanguins. (C) PNA se localise en acrosomes de spermaturdes. Barres d’échelle : 50μm. S’il vous plaît cliquez ici pour télécharger ce chiffre.
Vidéo supplémentaire 1 : Couper un court segment de tubule séminifère représentant l’étape VII-VIII. S’il vous plaît cliquez ici pour télécharger cette vidéo.
Discussion
La méthode de microdissection assistée par transillumination que nous avons décrite ci-dessus permet une approche axée sur le stade pour l’étude de la spermatogenèse. La spermatogenèse est un processus hautement synchronisé, et toutes les étapes clés de la différenciation spermatogénique sont régulées et exécutées d’une manière dépendante de l’étape, telles que l’engagement de différenciation (aux stades VII-VIII), l’apparition de la méiose (VII-VIII), les divisions méiotiques (XII), l’apparition de l’allongement du spermatodon (VIII) et la spermiation (VIII)1,26,27. L’analyse scénique fournit un outil puissant pour étudier ces événements particuliers qui sont limités à des étapes spécifiques de la spermatogenèse et ne se trouvent donc qu’à des stades définis du cycle épithélial séminifère. Maîtriser la méthode demande une certaine pratique et l’utilisation d’un microscope de dissection de bonne qualité et des conditions d’éclairage appropriées sont la clé du succès. La mise en œuvre de cette méthode dans le cadre de la boîte à outils quotidienne a la capacité d’améliorer considérablement l’impact et la pertinence biologique de la recherche sur les fonctions reproductives masculines en permettant une dissection plus précise des événements moléculaires pendant la spermatogenèse.
Toutes les souches de souris WT que nous avons étudiées présentent un modèle de transillumination similaire et présentent des associations cellulaires conservées aux stades du cycle épithélial séminifère. À condition que la différenciation spermiogénique des cellules germinales ne soit pas très différente des souris WT, la même chose s’applique également à tous les modèles de souris knock-out que nous avons étudiés. En outre, il peut être appliqué à d’autres espèces qui présentent un arrangement segmental longitudinal des stades du cycle épithélial séminifique7. Toutefois, les espèces dont les stades ne sont pas segmentaux (comme l’homme) ne peuvent pas être utilisées. Étant donné le rôle essentiel de la condensation de la chromatine dans l’allongement des spermatatids dans la définition du modèle de transillumination, il est clair que toute mauvaise réglementation de ce processus empiilait inévitablement la mise en œuvre de cette méthode. Chez les souris juvéniles et les jeunes adultes (5-6 semaines), le modèle de transillumination n’a pas encore été pleinement établi, et, par conséquent, seules les souris de plus de 8 semaines devraient être utilisées. Il est également important de garder à l’esprit que la compression et la traction des tubules empièteront inévitablement sur le modèle de transillumination parce qu’elles déforment l’architecture cellulaire dans l’épithélium séminifère.
Les segments isolés de tubule séminifère peuvent également être cultivés permettant l’observation ex vivo et la manipulation des processus spermatogenesis-couplés, y compris la méiose. Pour assurer la viabilité du tissu et prévenir la dégradation de l’ARN et des protéines, les échantillons doivent être prélevés et traités au plus tard 2 heures après avoir sacrifié la souris. Pour la culture ex vivo des tubules séminifères, le temps du sacrifice à l’apparition de la culture ne doit pas dépasser 1 heure. L’intégrité des fragments de tubules peut généralement être maintenue jusqu’à 72 heures in vitro si elle est récoltée correctement.
Le stade du cycle épithélial séminifère peut être vérifié et encore plus précisément défini à l’aide de la microcopie de contraste de phase des préparations decourge 16. La microscopie est effectuée sur les cellules vivantes, ce qui fournit une dimension supplémentaire dans l’analyse et permet l’observation des mouvements organiques ou cellulaires à des stades spécifiques de la spermatogenèse28,29,30. La microscopie de contraste de phase fournit la mise en scène exacte pour l’immunostaining suivant, qui permet l’analyse très détaillée de l’expression de protéine et de la dynamique de localisation pendant la spermatogenèse, y compris les changements étape-spécifiques.
Tandis que les cellules sont libérées du contexte épithélial dans des préparations de courge, les immunostainings de montage entier des segments de tubule permettent l’étude des cellules spermatogenic dans leur environnement physiologique. Par conséquent, les préparations de montage entier peuvent fournir une meilleure visualisation de l’architecture de tubule séminifère et de ses contacts intercellulaires que l’immunostaining sur des sections transversales. Fait important, la mise en scène assistée par transillumination des segments tubules avant l’immunostaining rend l’approche encore plus puissante en incluant des informations sur l’étape spécifique d’un segment donné. La coloration de montage entier est un outil particulièrement utile pour l’étude des cellules à la périphérie des tubules séminifères, tels que les cellules myoïdes peritubulaires, les macrophages périphériques et la spermatogonie, mais pourrait également ouvrir de nouvelles perspectives dans la recherche sur les cellules germinales méiotiques et postméiotiques.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ces travaux ont été soutenus par des subventions de l’Académie de Finlande [315948, 314387 à N.K.]; Fondation Sigrid Jusélius [à N.K., J.T.]; Emil Aaltonen Foundation [à J.-A.M., T.L.]; Turku Doctoral Programme of Molecular Medicine [S.C.-M., O.O.].
matériels
| Name | Company | Catalog Number | Comments |
| bovine serum albumin (BSA) | Sigma | A9647 | |
| cover glass 20x20 mm | Menzel Gläser | 11961988 | |
| Falcon conical tube 15-ml | Sarstedt | 62.554.502 | |
| fetal bovine serum (FBS) | Biowest | S1810 | |
| grease pen (ImmEdge) | Vector Laboratories | H-4000 | |
| microscope slide Superfrost Plus | Thermo Scientific | 22-037-246 | |
| Parafolmaldehyde (PFA) | Electron Microscopy Sciences | 15714 | |
| Petri dish (100-mm) | Greiner | 664160 | |
| phosphate-buffered saline (PBS) | Gibco | 11503387 | |
| ProLong Diamond Antifade Mountant | Thermo Fisher | P36962 | |
| rhodamine-labelled Peanut agglutinin (PNA) | Vector Laboratories | RL-1072 | |
| Triton X-100 | Sigma | 93443 | |
| Tween-20 | Sigma | P2287 |
Références
- Mäkelä, J. A., Toppari, J. Testis Physiology: Seminiferous Cycle. Encyclopedia of Reproduction. , (2018).
- Oakberg, E. F. Duration of spermatogenesis in the mouse and timing of stages of the cycle of the seminiferous epithelium. The American Journal of Anatomy. 99 (3), 507-516 (1956).
- Clermont, Y. Kinetics of spermatogenesis in mammals: seminiferous epithelium cycle and spermatogonial renewal. Physiological Reviews. 52 (1), 198-236 (1972).
- Perey, B., Clermont, Y., Leblond, C. The wave of the seminiferous epithelium in the rat. American Journal of Anatomy. 108 (1), 47-77 (1961).
- de Lima e Martins Lara, N., Costa, G., Avelar, G., Lacerda, S., Hess, R., França, L. Testis Physiology-Overview and Histology. Encyclopedia of Reproduction. , (2018).
- Leblond, C. P., Clermont, Y. Definition of the stages of the cycle of the seminiferous epithelium in the rat. Annals of the New York Academy of Sciences. 55 (4), 548-573 (1952).
- Parvinen, M. Regulation of the seminiferous epithelium. Endocrine Reviews. 3 (4), 404-417 (1982).
- Kotaja, N., et al. Preparation, isolation and characterization of stage-specific spermatogenic cells for cellular and molecular analysis. Nature Methods. 1 (3), 249-254 (2004).
- Nakata, H., Sonomura, T., Iseki, S. Three-dimensional analysis of seminiferous tubules and spermatogenic waves in mice. Reproduction. 154 (5), 569-579 (2017).
- Russell, L. D., Ettlin, R. A., SinhaHikim, A. P., Clegg, E. D. . Histological and histopathological evaluation of the testis. , (1990).
- Parvinen, M., Hecht, N. B. Identification of living spermatogenic cells of the mouse by transillumination-phase contrast microscopic technique for "in situ" analyses of DNA polymerase activities. Histochemistry. 71 (4), 567-579 (1981).
- Ventelä, S., Mäkelä, J. A., Kulmala, J., Westermarck, J., Toppari, J. Identification and regulation of a stage-specific stem cell niche enriched by Nanog-positive spermatogonial stem cells in the mouse testis. Stem Cells. 30 (5), 1008-1020 (2012).
- Faisal, I., et al. Transcription factor USF1 is required for maintenance of germline stem cells in male mice. Endocrinology. 160 (5), 1119-1136 (2019).
- Wright, W. W., et al. Identification of stage-specific proteins synthesized by rat seminiferous tubules. Biology of Reproduction. 29 (1), 257-270 (1983).
- Johnston, D. S., et al. Stage-specific gene expression is a fundamental characteristic of rat spermatogenic cells and Sertoli cells. Proceedings of the National Academy of Sciences of the United States of America. 105 (24), 8315-8320 (2008).
- Toppari, J., Bishop, P. C., Parker, J. W., diZerega, G. S. DNA flow cytometric analysis of mouse seminiferous epithelium. Cytometry. 9 (5), 456-462 (1988).
- Mäkelä, J. A., et al. Hedgehog signalling promotes germ cell survival in the rat testis. Reproduction. 142 (5), 711-721 (2011).
- La, H. M., et al. Identification of dynamic undifferentiated cell states within the male germline. Nature Communications. 9 (1), 04827 (2018).
- Toppari, J., Parvinen, M. In vitro differentiation of rat seminiferous tubular segments from defined stages of the epithelial cycle morphologic and immunolocalization analysis. Journal of Andrology. 6 (6), 334-343 (1985).
- Parvinen, M., Vanha-Perttula, T. Identification and enzyme quantitation of the stages of the seminiferous epithelial wave in the rat. The Anatomical Record. 174 (4), 435-449 (1972).
- Kluin, P. M., Kramer, M. F., de Rooij, D. G. Spermatogenesis in the immature mouse proceeds faster than in the adult. International Journal of Andrology. 5 (3), 282-294 (1982).
- Yoshida, S., et al. The first round of mouse spermatogenesis is a distinctive program that lacks the self-renewing spermatogonia stage. Development. 133 (8), 1495-1505 (2006).
- Chan, A. L., et al. Germline stem cell activity is sustained by SALL4-dependent silencing of distinct tumor suppressor genes. Stem Cell Reports. 9 (3), 956-971 (2017).
- Lokka, E., et al. Generation, localization and functions of macrophages during the development of testis. Nat Commun. 11 (1), 4375 (2020).
- Mäkelä, J. A., Toppari, J. Testis physiology: Spermatogenic cell syncytium. Encyclopedia of Reproduction. , (2018).
- Griswold, M. D. Spermatogenesis: The commitment to meiosis. Physiological Reviews. 96 (1), 1-17 (2016).
- Mäkelä, J. A., Toppari, J. Spermatogenesis. Endocrinology of the Testis and Male Reproduction. , 1-39 (2017).
- Ventela, S., Toppari, J., Parvinen, M. Intercellular organelle traffic through cytoplasmic bridges in early spermatids of the rat: mechanisms of haploid gene product sharing. Molecular Biology of the Cell. 14 (7), 2768-2780 (2003).
- Parvinen, M., Parvinen, L. M. Active movements of the chromatoid body. A possible transport mechanism for haploid gene products. The Journal of Cell Biology. 80 (3), 621-628 (1979).
- Parvinen, M., Söderström, K. O. Chromosome rotation and formation of synapsis. Nature. 260 (5551), 534-535 (1976).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon