Method Article
Disección asistida por transilluminación de etapas específicas del ciclo epitelial seminiferoso del ratón para análisis de inmunodetención aguas abajo
En este artículo
Resumen
Este protocolo describe la microdisección asistida por transilluminación de segmentos de tubulos seminiferosos de ratón adultos que representan etapas específicas del ciclo epitelial seminferoso, y los tipos celulares en el mismo, y la inmunodetención posterior de preparaciones de calabaza y segmentos de tubérculos intactos.
Resumen
La espermatogénesis es un proceso de diferenciación único que en última instancia da lugar a uno de los tipos celulares más distintos del cuerpo, el espermatozoide. La diferenciación de las células germinales tiene lugar en los bolsillos citoplasmáticos de las células sertoli somáticas que alojan de 4 a 5 generaciones de células germinales simultáneamente y coordinan y sincronizan su desarrollo. Por lo tanto, la composición de los tipos de células germinales dentro de una sección transversal es constante, y estas asociaciones celulares también se conocen como etapas (I-XII) del ciclo epitelial seminferoso. Es importante destacar que las etapas también se pueden identificar a partir de túbulos seminiferosos intactos en función de sus características diferenciales de absorción/dispersión de la luz reveladas por la transilluminación, y el hecho de que las etapas se siguen entre sí a lo largo del tubérculo en un orden numérico. En este artículo se describe un método de microdissección asistido por transilluminación para el aislamiento de segmentos de tubérculos seminiferosos que representan etapas específicas del ciclo epitelial seminiferoso del ratón. El patrón de absorción de luz de los túbulos semeferosos se inspecciona primero bajo un microscopio de disección, y luego los segmentos de tubérculos que representan etapas específicas se cortan y se utilizan para aplicaciones aguas abajo. Aquí describimos protocolos de inmunostaining para preparaciones de calabaza específicas de la etapa y para segmentos de tubérculos intactos. Este método permite a un investigador centrarse en eventos biológicos que tienen lugar en fases específicas de la espermatogénesis, proporcionando así una herramienta única para estudios de desarrollo, toxicológicos y citológicos de espermatogénesis y mecanismos moleculares subyacentes.
Introducción
La diferenciación de las células germinales masculinas de la espermatogonia diploide a los espermatozoides haploides maduros, es decir,la espermatogénesis, es un proceso complejo que tiene lugar en el epitelio de los túbulos semeferosos en los testículos de un individuo sexualmente maduro1. Los descendientes mitoticos de la espermatogonia A1 primero se dividen cinco veces para expandir la población comprometida con la diferenciación, luego entran en la meiosis como espermatozoides que finalmente dan lugar a espermatozoides haploides. La diferenciación de espermatozoides redondos en espermatozoides, es decir,espermatogénesis, implica cambios complejos en la morfología celular, incluyendo la compactación nuclear y la construcción de estructuras específicas de espermatozoides como el acrosoma y el flagelo. En ratone, todo el proceso de espermatogénesis tarda 35 días encompletarse 2,3.
En cualquier lugar dado, el epitelio seminferoso alberga hasta cinco cohortes de células germinales diferenciadoras, además de las células madre/progenitoras germinales y las células sertoli somáticas1. Las células germinales diferenciadoras forman capas concéntricas de la composición de las cuales es predecible, y las células haploides en un paso dado de desarrollo siempre se asocian con ciertos tipos de espermatozoides y espermatozoides4,5. Por lo tanto, cualquier sección transversal de un tubérculo alberga cohortes de células germinales de una composición constante. Estas asociaciones celulares específicas se definen como las etapas del epitelio seminiferoso. Las etapas per se no presentan estados estancados similares a puntos de control, sino que se desarrollan continuamente a medida que avanza la diferenciación de cohortes de células germinales en sincronía1,2,6. En ratones, hay 12 etapas (I-XII)2 que se organizan de forma segmentaria a lo largo del eje longitudinal del tubérculo seminiferoso, y se siguen entre sí en un orden lógico formando así la onda de epitelio seminífero, o onda espermatogénica7,8,9 (Figura 1). La finalización de la espermatogénesis toma cuatro ciclos, y las capas jerárquicas o cohortes de células germinales diferenciadoras dentro de cualquier sección transversal de tubérculo seminiferoso son temporalmente un ciclo seminiferoso aparte unas de otras. La longitud del ciclo depende de las especies y en el ratón cada ciclo tarda 8,6 días10.
Las etapas se pueden identificar sobre la base de la composición celular y la organización del epitelio seminiferoso en testículos histológicos secciones5 (Figura 1 y Figura 2). Sin embargo, el análisis histológico es laborioso, requiere mucho tiempo y requiere fijación y tinción, y por lo tanto no se puede aplicar al tejido vivo. Es importante destacar que la puesta en escena también se puede realizar en el tejido vivo bajo un microscopio de disección aprovechando patrones distintos de absorción/dispersión de la luz exhibidos por diferentes etapas del ciclo (Figura 2). La capacidad de cada etapa para absorber y dispersar la luz es relativa al nivel de condensación de cromatina de espermatozoides post-meioticos tardíos que cualquier etapa dada aloja y el embalaje de estas células en los paquetes7,11. La diferenciación espermática, es decir,la espermatogénesis, se divide además en 16 pasos de desarrollo, incluyendo 8 pasos de espermatozoides redondos (paso 1-8) y 8 pasos de espermacia alargada (pasos 9-16) diferenciación (Figura 1). Los espermatozoides alargadores paso 9-11 (etapa IX-XI) muestran sólo un bajo nivel de condensación de cromatina que resulta en una baja cantidad de luz que se absorbe. La condensación de cromatina comienza en los espermatozoides del paso 11 (etapa XI), y los espermatozoides elongantes del paso 15-16 (etapa IV-VIII) contienen cromatina totalmente condensada y, por lo tanto, exhiben una absorción máxima de la luz(Figura 3). La cromatina necesita ser condensada para ser apretada en la cabeza del espermatozoide. Otros factores que contribuyen al patrón de absorción de la luz son la ubicación de espermatozoides alargados dentro del epitelio (basal frente a apical) y la agrupación de espermatozoides alargados (pronunciados en etapas II-V)11 (Figura 3). Los haces son vistos como manchas en el medio de los túbulos y como rayas en los bordes bajo un microscopio de disección y cuanto más condensado la cromatina, más oscura es la mancha/raya11.
En este artículo se describe el uso del método de microdissección asistido por transilluminación para el aislamiento de segmentos de tubérculos semeferosos que representan etapas específicas del ciclo epitelial seminferoso. Una vez aislados, los segmentos de tubérculos escenificados pueden estar sujetos a varios análisis posteriores, incluyendo ARN bioquímico y análisis de proteínas12,13,14,15,citometría de flujo16,cultivo de tubérculo ex vivo 17 e inmunostaining18. Aquí también proporcionamos protocolos detallados aguas abajo para preparar monocapas aplastadas de segmentos de tubérculos escenificados para análisis morfológicos de células vivas y inmunostaining posterior, así como inmunostainings de montaje completo de segmentos de tubérculos. El flujo de trabajo en pocas palabras en descrito en la figura 4.
El método de microdissección asistido por transilluminación permite una identificación y aislamiento precisos de las células germinales en pasos específicos de diferenciación gracias a la composición celular sincronizada de las etapas. Es importante destacar que también permite el estudio de eventos dependientes de la etapa durante la espermatogénesis en el tejido vivo. Dada la falta de modelos in vitro escalables para la espermatogénesis, este método también tiene una ventaja única de permitir estudios de desarrollo y toxicológicos específicos a corto plazo en segmentos de tubérculos específicos del escenario ex vivo12,17. Mientras que describimos el método aquí para el ratón, el mismo procedimiento se puede aplicar a cualquier especie de mamífero con disposición longitudinal y segmental de etapas epiteliales seminiferosas, como la rata4,7,15,19,20.
Protocolo
El mantenimiento de ratones de laboratorio y todos los experimentos con animales se realizó de conformidad con las directrices y regulaciones pertinentes para el cuidado y uso de animales de laboratorio en la Universidad de Turku.
1. Preparación de tubulos semeferosos para microdissección
- Sacrificar un ratón macho adulto (≥8 semanas de edad, testis 80–120 mg dependiendo de la cepa y la edad) a través de la asfixia de CO2 seguido de dislocación cervical.
NOTA: El ratón debe ser sexualmente maduro, y preferiblemente por lo menos 8 semanas de edad. El patrón de transilluminación de ratones juveniles difiere de los adultos porque la onda del epitelio seminiferoso aún no se ha establecido completamente, y el tiempo de la primera onda de espermatogénesis es distinto21,22. La falta de espermatozoides alargados en ratones machos de 4 semanas de edad impide su uso para la microdisección asistida por transilluminación. Todas las cepas de ratón que tienen espermatogénesis normal se pueden utilizar. - Rocíe el abdomen ventral con un 70% de etanol. Abra la cavidad abdominopelvica con tijeras estériles, haciendo una abertura en forma de V.
- Tirando de la almohadilla de grasa epidídmica con fórceps estériles, localice los testículos, diseccionarlos con tijeras y colóquelos en una placa estéril de Petri de 100 mm que contenga PBS.
NOTA: Para mantener la esterilidad, asegúrese de que todos los artículos de laboratorio y herramientas quirúrgicas sean estériles. - El uso de tijeras de punta fina decapsula los testículos cortando una hendidura en la tunica albuginea,la gruesa lámina fibrosa que encapsula los testículos. A continuación, desgarre la tunica con un par de fórceps. Fuerza los túbulos presionando con fórceps y desecha el tunica.
NOTA: Al descartar la tunica, podría ser beneficioso para algunas aplicaciones aguas abajo que arteria testicularis se elimina junto con la tunica. Evite dañar los túbulos seminiferosos. - Mueva los tubulos semestrales a una nueva placa De Petri y vierta suficiente PBS estéril para cubrir la parte inferior de la placa De Petri. A continuación, desgarra suavemente los túbulos, pero evita dañar los túbulos.
NOTA: Demasiado estrés mecánico afectará al patrón de transilluminación y afectará la viabilidad del tejido y su arquitectura celular. Los túbulos también se pueden procesar para inmunostainings de montaje completo desde este punto sin ensayo (3B). A veces basta con definir la etapa retrospectivamente mediante la inclusión de anticuerpos contra proteínas expresadas en espermatogonia diferenciadora, como SALL4, c-KIT y DNMT3A18,23. La densidad de espermatogonia es un indicador de etapa relativamente fiable (Figura 2).
2. Microdissección asistida por transilluminación
- Coloque la placa Petri bajo un microscopio de disección firmemente grabándola en el escenario.
NOTA: Es importante grabar bien la placa Petri para evitar su movimiento, lo que podría causar la mezcla de los segmentos de tubérculos semeferosos escenificados recogidos. - Para revelar el patrón de absorción de luz de los túbulos semeferosos bajo enfoque, asegúrese de que la muestra se ilumina desde abajo y la luz pasa a través de la muestra, es decir,se transillumina.
NOTA: La cantidad de luz absorbida/dispersa es relativa al nivel de condensación de cromatina en espernátidos alargados y su agrupación dentro del tubérculo seminferoso: cuanto más condensado, más luz se absorbe, es decir,aparece más oscuro. - Familiarícese con el patrón de absorción de luz de diferentes etapas como se describe en la Figura 2, Figura 5A y Figura S1 moviendo cuidadosamente haces de túbulos usando fórceps finos.
NOTA: Las etapas siempre se siguen entre sí en un orden lógico, formando la onda de epitelio seminiferoso. Sin embargo, es importante saber que la dirección de la onda espermatogénica ocasionalmente se invierte y luego retrocede de nuevo (también conocidas como modulaciones4,9),a veces complicando el procedimiento. Además, la longitud de cada etapa, en términos de cuántos mm de tubérculo, varía considerablemente. - Levante cuidadosamente el tubérculo de interés usando fórceps con una punta enganchada, y luego corte un segmento de longitud apropiada usando tijeras de microdissección (ver Video Suplementario 1). Un gancho en la punta de los fórceps hace que levantar y sostener un tubérculo sea más fácil y ayuda a evitar apretarlo.
NOTA: La longitud de los segmentos a cortar depende de las aplicaciones posteriores. Para la recolección de piezas de tubérculos agrupados de una etapa específica para el análisis de proteínas o ARN12,13 (II-V, VII–VIII y IX-XI, Figura 5B)la longitud es típicamente de 2-5 mm. Cuando se utiliza extracción estándar de fenol-cloroformo, alrededor de 200 ng de ARN se pueden derivar de 1 mm de tubérculo. Para la tinción de montaje completo de segmentos de tubérculos escenificados, la longitud de los segmentos debe ser de >5 mm. Para las preparaciones de calabaza, la longitud de los segmentos no debe exceder de 1-2 mm porque las células en el centro del segmento pueden no salir si es demasiado larga. Utilice una escala mm debajo de la placa Petri para una medición precisa de la longitud del tubérculo.
3. Inmunodetención de diferentes preparaciones
- Preparación de calabazas: verificación de etapas e inmunodetención
NOTA: Las piezas de tubérculos específicas del escenario se pueden aplastar en un tobogán de microscopio con un vidrio de cubierta para realizar análisis morfológicos de las células vivas mediante microscopía de contraste de fase e inmunostaining posterior. Se recomienda a un principiante utilizar este enfoque para verificar las etapas al familiarizarse con el método de microdissección asistido por transilluminación.- Recoge el segmento en un volumen de 10 μL usando una pipeta y muévelo a una diapositiva de microscopio.
- Aplaste el tubérculo colocando un vaso de cubierta (20 mm x 20 mm) cuidadosamente en el tubérculo. Como resultado, las células fluirán fuera del tubérculo y formarán una monocapa de células vivas. Coloque un papel filtrante en el borde del vidrio de la cubierta para facilitar la propagación de las células. Evite aplastar las células demasiado para mantenerlas vivas.
- Monitoree la propagación celular bajo un microscopio. Utilice un microscopio de contraste de fase en el objetivo 40x para verificar el reconocimiento de etapas examinando los tipos de células presentes (Figura 2, Figura S2).
- Una vez que las células se hayan extendido para formar una monocapa redonda desde ambos extremos del tubérculo, sumerja la diapositiva en un recipiente que contenga nitrógeno líquido mientras la sujeta con fórceps. Mantenlo sumergido durante 10 s. Alternativamente coloque el tobogán en una placa de hielo seco para congelarse.
- Retire el vaso de la cubierta volteándolo con un bisturí.
- Sin demora, proceda con la fijación y coloque rápidamente la diapositiva en un recipiente con un 90% de etanol durante 2-5 min.
NOTA: Asegúrese de que la preparación de la calabaza no se descongele antes de colocarla al 90% de etanol. También se pueden utilizar otros fijadores, como la acetona, durante 10 minutos. - Aire seco y almacenar a temperatura ambiente (RT) (hasta algunos días) o a -80 °C (largo plazo).
- Para la inmunodetención, después de fijar las muestras en 4% paraformaldehído (PFA) durante 10 min en RT.
- Enjuague en PBS y permeabilice con 0.1% Tritón X-100 en PBS durante 5 min.
- Enjuague en PBS y dibuje un anillo de grasa alrededor de cada muestra de calabaza.
- Añadir 50–100 μL de 10% BSA (albúmina sérica bovina) en 0.1% De interpolación en PBS (PBST) dentro del anillo de grasa y bloquear muestras durante 30 minutos en RT.
- Retire la solución BSA e incuba con un anticuerpo primario diluido en 10% BSA en PBST durante 1 h en RT.
- Lave 3x durante 5 minutos con PBST.
- Incubar con un anticuerpo secundario diluido en 10% BSA en PBST.
NOTA: Para manchar los acromas, las muestras se pueden incubar con anticuerpos de aglutinina de cacahuete etiquetados con rhodamina (PNA, 1:1000) en 10% BSA en PBST durante 1 h en RT (Figura S3) en lugar de anticuerpos primarios y secundarios específicos. - Lave 3x durante 5 minutos cada uno con PBST, enjuague con PBS y monte con un soporte que contenga DAPI.
- Inmunostaining integral de tubulos seminferosos
NOTA: El protocolo siguiente describe la tinción de montaje completo para segmentos de tubérculos por etapas (desde el paso 2.4). Si un investigador quiere realizar manchas de montaje completo sin ensayo (desde el paso 1.5), preste atención a las notas en 3.2.1 y 3.2.7.- Usando una pipeta, transfiera los segmentos de tubérculos (desde el paso 2.4) en PBS helado a un tubo cónico de 15 ml y déjalos sedimentar sobre hielo.
NOTA: Si usa tubulos sin etiquetar de 1.5., separe los túbulos en una placa de Petri pipeteando hacia arriba y hacia atrás en un plato inclinado varias veces. Use una pipeta de 1 ml con una punta de corte. Este paso está destinado a abrir la estructura del tejido. Sin embargo, evite demasiado pipeteo, ya que podría dañar los túbulos. La sedimentación de los tubulos tomará unas decenas de segundos. Pequeños fragmentos de tubérculos, células intersticiales y desechos celulares permanecen en el sobrenadante. - Retire cuidadosamente el sobrenadante (SN) pipeteando o con un aspirador. Agregue 10 ml de PBS helado y mezcle por inversión.
- Deje sedimentar y luego eliminar SN como antes.
- Añadir 5 mL de 4% PFA y fijar para 5 h en una mesa giratoria (20–30 rpm) a +4 °C.
NOTA: El tiempo de fijación depende de las proteínas de interés y su localización subcelular. Para las proteínas nucleares y citoplasmáticas, una fijación de 2 h es típicamente suficiente, sin embargo, marcadores de membrana, como GFRα1 (receptor de la familia GDNF alfa 1; Figura 6A,B), beneficiarse de una fijación más larga, hasta 6 h. - Permitir sedimentar, eliminar SN (PFA) como antes, y enjuagar brevemente añadiendo 10 mL de PBS e invirtiendo el tubo.
- Dejar sedimentar, eliminar SN como antes y repetir el paso de lavado PBS tres veces durante al menos 10 minutos cada uno en una mesa giratoria a +4 °C y proceder con la tinción o almacenar a +4 °C.
NOTA: Si las condiciones de trabajo son estériles y limpias, las muestras se pueden almacenar y utilizar durante al menos algunas semanas. Alternativamente, añadir Azide de sodio a una concentración final de 0.02% (w/v) de una solución de stock del 2% para ayudar a preservar los túbulos antes de almacenar a +4 °C. - Con una pipeta de 1 ml, mueva segmentos de tubérculos fijos de 10 a 20 a un tubo de fondo redondo de 2 ml. Permitir sedimentar y eliminar SN.
NOTA: Si trabaja con tubulos largos que no han sido escenificados, vierta los túbulos sobre una placa Petri y usando tijeras de microdisección y fórceps corte segmentos de alrededor de 5-20 mm. Segmentos demasiado largos se enredarán durante el procedimiento de tinción, mientras que los segmentos demasiado cortos se pierden fácilmente. - Añadir 1 ml de 2% BSA + 10% FBS (suero bovino fetal) en 0.3% Tritón X-100 en PBS (PBSX). Bloquee durante al menos 1 h en una mesa giratoria (20-30 rpm) en RT.
- Enjuague con 1 ml de PBSX, retire la SN pipeteando y agregue 250 μL de anticuerpo primario diluido en 1% BSA en PBSX (dilución 1:100–1:2000). Incubar durante 2 h a RT o durante la noche a +4 °C en una mesa giratoria (20-30 rpm).
- Retire la solución de anticuerpos pipeteando y enjuague los túbulos con 1 ml de PBSX como arriba. Lave tres veces durante 1 h en PBSX en una mesa giratoria (20-30 rpm) en RT.
NOTA: Después de este primer lavado, la muestra se puede dejar durante la noche a +4 °C si es necesario. - Retire la SN y agregue 250 μL de anticuerpo secundario diluido en 1% BSA en PBSX (típicamente dilución de 1:500 de un anticuerpo con etiqueta fluorescente). Cubra en papel de aluminio e incubar en una mesa giratoria (20-30 rpm) en RT durante 1 h.
- Repita 3.2.10.
- Finalmente retire SN y vierta los túbulos a una diapositiva de microscopio. Separe suavemente y organice los tubulos en tiras lineales con puntas de carga de gel. Escurrir el exceso de búfer y añadir medio de montaje y un tubo de cubierta.
NOTA: Evite secar los túbulos mientras los organiza. La contra-tinción de los núcleos con DAPI no es necesaria en la mayoría de los casos. Cierre el borde de la cubierta con esmalte de uñas para evitar el secado y el deterioro de la muestra. Las diapositivas se pueden almacenar durante 1-2 semanas a +4 °C antes de la toma de imágenes.
- Usando una pipeta, transfiera los segmentos de tubérculos (desde el paso 2.4) en PBS helado a un tubo cónico de 15 ml y déjalos sedimentar sobre hielo.
Resultados
Una puesta en escena asistida por transilluminación exitosa y una microdisección de los tubulos seminiferosos del ratón dependen principalmente de la búsqueda de las condiciones de iluminación adecuadas y de un microscopio de disección adecuado, y de la capacidad de reconocer características específicas que caracterizan cada etapa. Las etapas VII-VIII parecen homogéneamente oscuras porque contienen un alto número de espermatozoides elargados totalmente condensados que están alineados en la superficie apical del epitelio(Figura 5A y Figura S1). Después de que los espermatozoides maduros se liberan en el lúmenes en el esperma, el tubérculo aparece muy pálido en las etapas IX-XI debido a la ausencia de espermatozoides alargados condensados en el epitelio. La característica más fácil de identificar en los túbulos transilluminados es el punto de esperma (asterisco en la Figura 5A y figura S1),que es la transición repentina de la zona oscura (VII–VIII) a la zona pálida (IX-XI). La zona pálida es seguida por la zona de punto débil (XII-I). La apariencia irregular se origina en la organización de espermatozoides alargados con cromatina condensada en paquetes. Los paquetes se vuelven muy prominentes en la siguiente zona de punto fuerte (II-V). Además, los haces de espermatozoides migran hacia núcleos celulares Sertoli que se encuentran cerca de la lámina basal, que se refleja como apariencia a rayas del tubérculo de fase II-V cuando se transillumina(Figura 2, Figura 5A, B y Figura S1). Los haces finalmente se dispersan en la etapa VI y los espermatozoides alargadores condensados se mueven cerca del lumen para ser liberados del epitelio en la etapa VIII.
La etapa exacta del segmento de tubérculos se puede verificar con precisión mediante microscopía de contraste de fase de preparaciones de calabaza(Figura 2 y Figura S2). Las etapas específicas en las preparaciones de calabaza se reconocen sobre la base del desarrollo acrosomal de espermatozoides redondos paso 1-8, el estado de condensación de cromatina en espermatozoides alargados, y la presencia de haces de espermatíd16 (Figura 3 y Figura S2). Además, la presencia de tipos celulares anteriores, como espermatozoides tipo B y leptoteno o espermatozoides de cigoteno, que pueden ser reconocidos sobre la base de sus rasgos morfológicos, se puede utilizar para apoyar el reconocimiento escénico. El tamaño de los núcleos de espermatocitos paquiteno aumenta de tamaño alrededor de la etapa VI, lo que también puede proporcionar ayuda adicional en la puesta en escena.
Las preparaciones de calabaza por etapas se pueden utilizar para estudiar la expresión y localización de proteínas de interés en el epitelio seminferoso mediante inmunodetención. Esto permite un análisis muy preciso de la expresión específica del tipo de célula debido a la composición celular bien definida en cada etapa. La expresión específica de la etapa se puede aumentar aún más mediante la co-tinción del acrosoma(por ejemplo,con PNA) que permite la visualización de distintos pasos de diferenciación espermática redonda. En la Figura S3se proporcionan imágenes representativas de acromas manchados de ANP en varias etapas. La tinción acrosomal también se puede utilizar para definir el escenario retrospectivamente. Sin embargo, la puesta en escena asistida por transilluminación es un método considerablemente más fácil y rápido para encontrar la etapa deseada que el uso de fragmentos sin etiquetar de una manera azarosa.
La tinción seminiferosa de tubérculos de montaje completo se utiliza normalmente para estudiar los tipos celulares que están en contacto con la membrana del sótano del epitelio seminferoso, ya sea en el lado tubular (espermatogonia, espermatocitos preleptotenos y células sertoli; Figura 6A,B)o el lado intersticial (células mioides peritubulares y macrófagos peritubulares; Figura 6C y figura S4A)24. Sin embargo, el método también se puede utilizar para estudiar células o estructuras que se encuentran más profundamente en el epitelio, como la barrera de los testículos de sangre (Espin, Figura S4B),o células germinales postmeioticas (marcador acásico PNA, Figura S4C). Si se utilizan segmentos de tubérculos sin etiquetar, es posible estimar una etapa determinada retrospectivamente utilizando un anticuerpo contra una proteína que se expresa en la diferenciación de espermatozoides (A1, A2, A3, A4, In y B; colectivamente Adiff) (Figura 2). La puesta en escena se basa entonces en la densidad dediff A sincitial que se someten a seis divisiones mitoticas de una manera dependiente de la etapa durante el primer ciclo de diferenciación espermatogénica1,duplicando así el número de Adiff spermatogonia en sincronía después de cada división1,25. Sin embargo, la puesta en escena retrospectiva es menos precisa que la puesta en escena asistida por transilluminación porque no hay marcadores específicos para generaciones distintas de Adiff y la evaluación de la densidad dediferencia A puede ser propensa a errores.

Figura 1: Mapa seminiferoso del ciclo epitelial para la puesta en escena de la espermatogénesis del ratón. Las columnas verticales muestran asociaciones celulares en diferentes etapas del ciclo epitelial seminiferoso (marcado con números romanos I–XII). Las células germinales más inmaduras están en la parte inferior, mientras que las más diferenciadas están en la parte superior. Para seguir el progreso de la diferenciación de células germinales, uno tiene que moverse de izquierda a derecha, y de abajo a arriba. Un ciclo del epitelio seminiferoso es una serie completa de etapas que se siguen entre sí en un orden numérico. Una espermatogoniaindiferenciada; A1–4, espermatogonia tipo A1–A4; En, espermatogonia intermedia; B, espermatogonia tipo B; Pl, espermatocitos preleptotenos; L, espermatocitos de leptoteno; Z, espermatozoides de cigoteno; P, espermatocitos de paquiteno; D, espermatocitos de diploteno; 2°, espermatozoides secundarios más divisiones meioticas. Los números árabes 1-16 se refieren a pasos de la maduración espernáutica post-meiotica (espermatogénesis). Haga clic aquí para ver una versión más grande de esta figura.
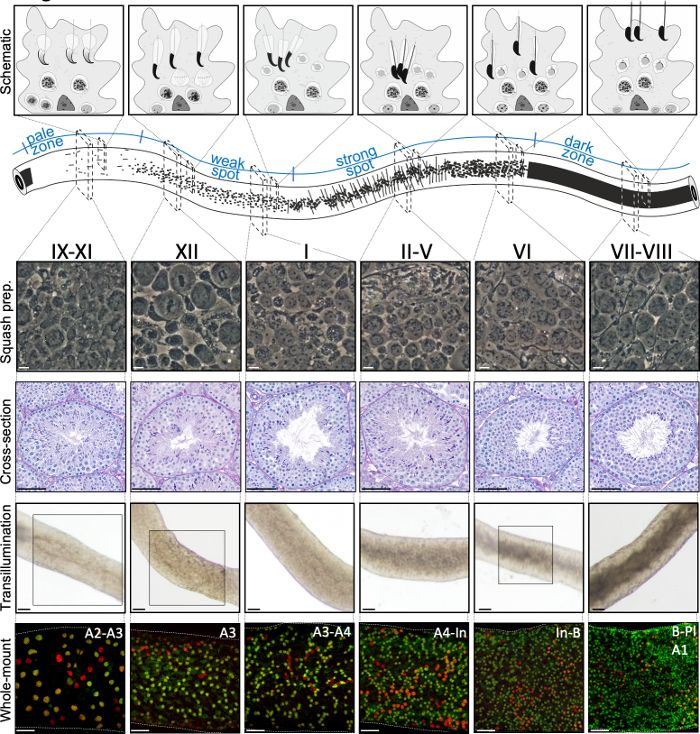
Figura 2: Asociaciones celulares en etapas del ciclo epitelial seminiferoso del ratón. Las etapas del ciclo epitelial seminferoso se siguen entre sí en un orden lógico, y por lo tanto forman la onda espermatogénica a lo largo del eje longitudinal de un tubérculo seminferoso. El panel superior ilustra las asociaciones de células germinales en diferentes etapas, y la ubicación de los tipos celulares dentro de los bolsillos citoplasmáticos de las células Sertoli (gris claro) en el epitelio seminiferoso. La ilustración del tubérculo seminferoso visualiza la onda espermatógena y los patrones de transilluminación específicos del punto pálido, débil, punto fuerte y zonas oscuras. Desde cada etapa indicada, se muestran imágenes representativas de contraste de fase de células vivas de preparaciones de calabaza y testículos teñidos de ácido (PAS) periódicos. Los dos paneles inferiores muestran segmentos de tubérculo seminferoso después de la transilluminación (superior) o la tinción con anticuerpos (abajo) contra SALL4 (rojo, un marcador pan-espermatgonial) y DNMT3A (verde, un marcadorde diferencia A). Los patrones de transilluminación de las etapas IX-XI, XII y VI se resaltan con áreas en caja. Tanto el patrón de absorción de luz (superior) como la densidad de la espermatogonia diferenciadora DNMT3A positiva (inferior) se pueden utilizar para definir la etapa (aproximada) del ciclo semeferoso. Las generaciones sucesivas de Adiff se conocen como espermatozoides tipo A1–A4, intermedios (In) y tipo B. División de cada uno resulta en la duplicación de la densidad celular espermatogonial. La densidad celular más alta en la membrana del sótano del epitelio seminiferoso se observa en las etapas VI-VIII cuando se observan espermatozoides preleptotenos meioticos (Pl). Barras de escala: preparación de calabaza. 10 μm, otras 50μm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Pasos de la espermatogénesis. Características distintivas de los espermatozoides en diferentes pasos de la espermatogénesis. Haga clic aquí para ver una versión más grande de esta figura.
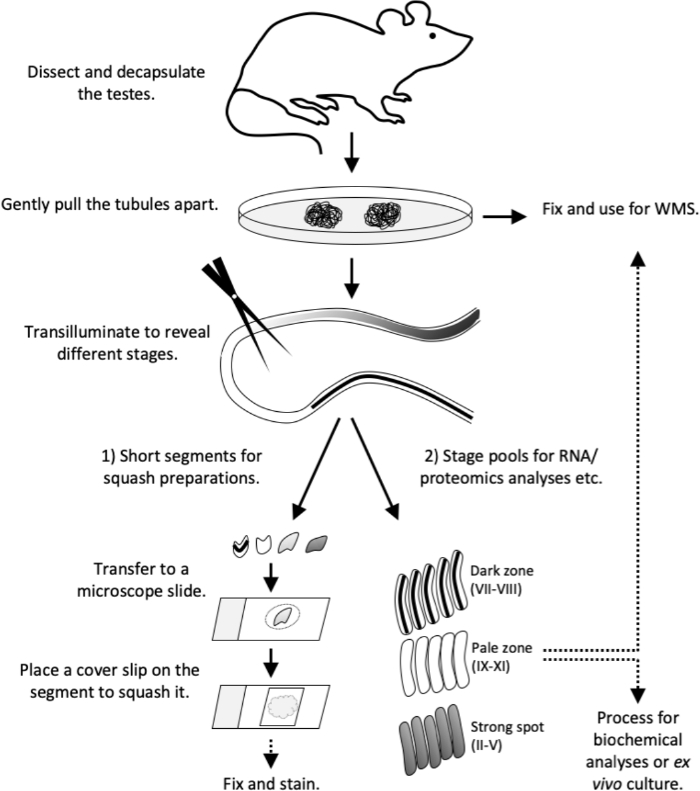
Figura 4: Flujo de trabajo de este estudio. El patrón de transilluminación se ha establecido completamente en un ratón adulto (>8 semanas de edad). Sacrificar el ratón y proceder con testis disección y decapsulación sin demora. Desgarra suavemente los túbulos en una placa de Petri. Fije los tubulos para manchas de montaje completo o proceda con la transilluminación. Bajo la transilluminación 1) cortar segmentos de tubérculos cortos de etapas específicas para preparaciones de calabaza (control de calidad o para inmunostaining) o 2) cortar segmentos más largos para recoger piscinas de escenario para análisis de ARN y proteómica, cultivo de tejidos o para tinciones de montaje completo. Transfiera segmentos cortos de tubérculos a una diapositiva de microscopio en un volumen de 10 μL de PBS. Coloque un resbalón de cubierta en el segmento para forzar las celdas y formar una monocapa de celda viva. Observe los tipos de células bajo un microscopio y, a continuación, arregle y manche. WMS, tinción integral. Haga clic aquí para ver una versión más grande de esta figura.
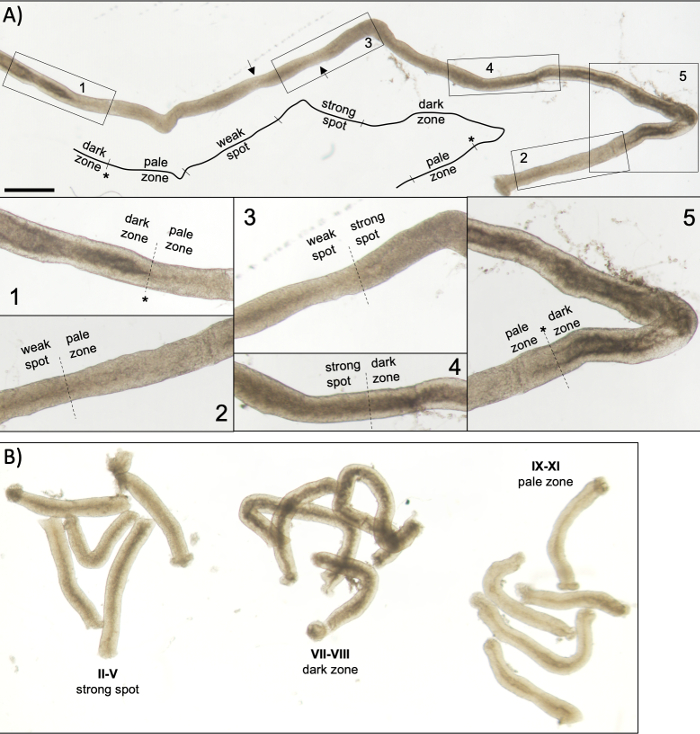
Figura 5: Tubérculo seminiferoso de un ratón adulto visto bajo microscopía de transilluminación. (A) Un largo segmento de tubérculo seminferoso visto bajo transilluminación que muestra la onda de epitelio seminferoso. Se pueden identificar cuatro zonas distintas basadas en la compactación de cromatina en espermatozoides y su localización dentro del epitelio: zona oscura (etapas VII–VIII), zona pálida (etapas IX-XI), zona irregular débil (etapas XII-I) y zona de punto fuerte (etapas II-VI). Asterisco, punto de esperma. Las flechas indican dos segmentos cortos dentro de la zona de punto débil que tienen un aspecto pálido debido a la tensión mecánica en el tubérculo. Escala: 500 μm. Los insertos 1–5 son aumentos más altos de los segmentos de tubérculos seleccionados. (B) Segmentos agrupados de tubérculo semeferoso que representan las etapas II-V (zona de punto fuerte), VII–VIII (zona oscura) e IX-XI (zona pálida). Haga clic aquí para ver una versión más grande de esta figura.
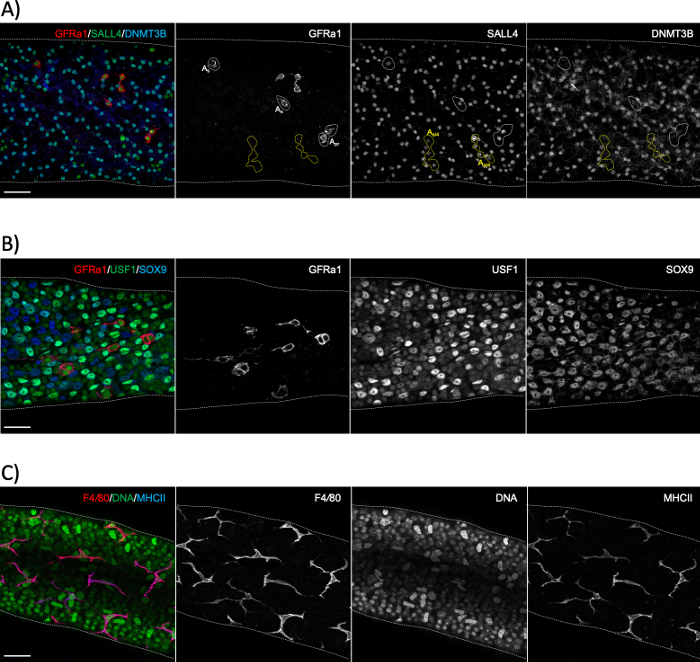
Figura 6: Inmunostainings de montaje completo utilizando marcadores de macrófago espermatogonial, células Sertoli y macrófago peritubulares. (A) Tinción de montaje completo para un segmento que representa la etapa XI-II con anticuerpos contra GFRα1 (rojo), SALL4 (verde) y DNMT3B (azul). La tinción revela tres poblaciones distintas de espermatogonia: aislado (As)o emparejado (Apr)espermatogonia madre indiferenciada (GFRα1+/SALL4+/DNMT3B-; áreas punteadas blancas), sincitios cortos (aquí 4 células alineadas; Aal4) espermatogonia progenitora (GFRα1-/SALL4+/DNMT3B-; zonas de puntos amarillos) y espermatogonia diferenciadora (GFRα1-/SALL4+/DNMT3B+). SALL4+/DNMT3B+ las células son espermatozoides tipo A3–A4. (B) Tinción de tubérculo seminferoso de montaje completo con anticuerpos contra GFRα1 (rojo), USF1 (verde) y SOX9 (azul). GFRα1 mancha el subconjunto de espermatozoides. USF1 se expresa tanto por espermatozoidesgonia como por células SOX9+ Sertoli. (C) Los macrófagos peritubulares en ratones adultos son positivos tanto para F4/80 (rojo) como para MHCII (azul). DAPI mancha el ADN (verde). Los núcleos grandes brillantes son núcleos celulares mioides peritubulares. Barras de escala: 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
Figura S1: Un largo segmento de tubérculo seminferoso visto bajo transilluminación que muestra la onda de epitelio seminiferoso. Se pueden identificar cuatro zonas distintas basadas en la compactación de cromatina en espermatozoides y su localización dentro del epitelio: zona de punto débil (etapas XII-I), zona de punto fuerte (etapas II–VI), zona oscura (etapas VII–VIII) y zona pálida (etapas IX-XI). El punto de esperma (asterisco) se puede reconocer a medida que la zona oscura transita abruptamente hacia la zona pálida. Escala: 500 μm. Los insertos 1–4 son aumentos más altos de los segmentos de tubérculos seleccionados. Haga clic aquí para descargar esta figura.
Figura S2: Microscopía de contraste de fase de monocapas de células vivas de diferentes etapas del ciclo epitelial seminferoso. (A) Etapa I. Paso 1 espermatozoides redondos todavía carecen de la estructura acrosomal. Se caracterizan por un pequeño núcleo redondo (círculos rojos) con un cromocente único distintivo (flechas blancas). El cuerpo cromatoideo es visible en el citoplasma como un gránulo oscuro en estrecho contacto con la membrana nuclear (flechas azules). El núcleo celular sertoli (círculo blanco) contiene tres focos oscuros: un núcleo grande con dos cromoscentros satelitales. Las células sertoli no se ven en los preparados de calabaza, pero ocasionalmente fluyen desde el tubérculo junto con las células germinales. (B) Etapa II–IV. En los espermatozoides redondos del paso 4 (círculos rojos), la estructura acrosomal (flechas rojas) aparece como una vesícula blanca ligeramente aplanada unida a la envolvente nuclear. Los espermatozoides alargados forman haces y ya tienen un flagelo grueso (flechas blancas) que indica la presencia de funda mitocondrial en la parte media de la cola de espermatozoides. Los núcleos de los espermatozoides de paquiteno (PSpc) son aproximadamente el doble de grandes que los de los espermatozoides redondos y se caracterizan por regiones de cromatina oscura distribuidas por todo el núcleo. (C) Etapa V–VI. En los espermatozoides redondos del paso 5–6 (círculo rojo), el acrosoma se aplana aún más y se extiende sobre el núcleo (flechas rojas). El área de la envolvente nuclear frente al acrosoma parece oscura debido a la presencia del acroplaxome, una placa rica en proteínas entre la membrana acrosomal y la membrana nuclear. Los espermatozoides alargados se liberan de los haces (flechas blancas). Los espermatozoides de pachytene (PSpc) se observan con frecuencia en el epitelio. (D) Etapa VII-VIII. El acrosoma (flechas rojas), un revestimiento oscuro en el sobre nuclear con sombras blancas, está completamente extendido y cubre casi todo el lado apical de los espermatozoides redondos del paso 7-8 (círculos rojos). Esta etapa se caracteriza por espermatozoides maduros (flechas blancas) que pueden ser abundantes en muchas partes de la preparación de la calabaza. El núcleo de los espermatozoides de paquiteno (PSpc) crece en tamaño durante el desarrollo y aparecen más grandes en la etapa VII-VIII que en etapas anteriores. Las áreas oscuras de cromatina dentro del núcleo de los espermatozoides de paquiteno (PSpc) parecen difusas debido a la alta actividad transcripcional y eventos meioticos. (E) Etapa X. Los núcleos espermáticos del paso 10 (flechas blancas) han iniciado la alargamiento, pero la cromatina aún no se ha condensado. Los acromas comienzan a formar un gancho en la punta nuclear (flecha roja). Los núcleos de los espermatozoides de paquiteno (PSpc) parecen muy grandes, ya que se están preparando para divisiones meioticas. (F) Etapa XII. La etapa XII se caracteriza por la presencia de placas metafásicas meioticas (círculos blancos discontinuos). Las células redondas pequeñas con el patrón típico de cromatina condensada son los espermatocitos de cigoteno (ZSpc), en los que los cromosomas hermanos se alinean para iniciar la formación de complejos sinaptonemales. Barras de escala: 10 μm. Haga clic aquí para descargar esta figura.
Figura S3: Identificación de la etapa del ciclo epitelial seminferoso sobre la base de la tinción acrosomal y nuclear. Los preparados de calabaza fija de acetona se mancharon con PNA y DAPI con conjugados con rhodamina. Etapa I: Si bien no existe ningún acrosoma en los espermatozoides redondos del paso 1, se puede detectar un acrosoma completamente desarrollado en espermatozoides alargados. Etapas II–IV: El desarrollo acrosomal comienza con la aparición de gránulos proacrosómicos/acrosomales en espermatozoides redondos. La vesícula acrosomal en la superficie nuclear aparece redonda hasta el paso 3 de espermatozoides, y luego se aplana en el paso 4 espermatozoides. Etapa V: El ángulo subtendido por el acrosoma se extiende de 40 grados a un máximo de 95°. Etapas VI–VII: El ángulo subtendido por el acrosoma se extiende de 95 grados a 120 grados. Etapas VIII-IX: El acrosoma se extiende completamente en los espermatozoides del paso 8 (etapa VIII), y los núcleos polarizan en el lado apical de la célula haciendo contacto con la membrana plasmática (no se muestra). En la etapa IX el núcleo de espermatozoides se deforma; las superficies dorsales y ventrales se ven por primera vez. Etapas X-XI: Los espermatozoides muestran el ángulo dorsal. Etapa XII: Esta etapa se caracteriza mejor por la aparición de divisiones meioticas; las placas de metafase se indican con flechas blancas. También se ven espermatozoides alargados con sus acromas. Barras de escala: 10μm. Haga clic aquí para descargar esta figura.
Figura S4: Tinción de montaje completo para marcadores no convencionales. (A) Alfa actina muscular lisa (aSMA) se expresa por células mioides peritubulares. (B) Espin localiza las uniones estrechas de células Sertoli y contribuye a la barrera de los testículos de sangre. (C) La ANP localiza a los acromas de espermatozoides. Barras de escala: 50μm. Haga clic aquí para descargar esta figura.
Vídeo complementario 1: Corte de un segmento corto de tubérculo seminferoso que represente la etapa VII-VIII. Por favor, haga clic aquí para descargar este video.
Discusión
El método de microdissección asistido por transilluminación que hemos descrito anteriormente permite un enfoque orientado a la etapa para el estudio de la espermatogénesis. La espermatogénesis es un proceso altamente sincronizado, y todos los pasos clave durante la diferenciación espermatogénica se regulan y ejecutan de manera dependiente de la etapa, como el compromiso de diferenciación (en las etapas VII-VIII), el inicio de la meiosis (VII-VIII), las divisiones meioticas (XII), el inicio de la elongación espermática (VIII) y la espermatación (VIII)1,26,27. El análisis orientado a la etapa proporciona una poderosa herramienta para estudiar estos eventos particulares que están restringidos a pasos específicos de la espermatogénesis y por lo tanto se encuentran sólo en etapas definidas del ciclo epitelial seminiferoso. Dominar el método requiere cierta práctica y el uso de un microscopio de disección de buena calidad y condiciones de iluminación adecuadas son clave para el éxito. La implementación de este método como parte del kit de herramientas cotidiano tiene una capacidad para mejorar en gran medida el impacto y la relevancia biológica de la investigación en las funciones reproductivas masculinas al permitir una disección más precisa de los eventos moleculares durante la espermatogénesis.
Todas las cepas de ratón WT que hemos estudiado muestran un patrón de transilluminación similar y exhiben asociaciones celulares conservadas en etapas del ciclo epitelial seminiferoso. Con la condición de que la diferenciación espermatogénica de las células germinales no sea groseramente diferente de los ratones WT, lo mismo se aplica a todos los modelos de ratón knock-out que hemos estudiado. Además, se puede aplicar a otras especies que exhiben disposición segmental longitudinal de etapas del ciclo epitelial seminferoso7. Sin embargo, no se pueden utilizar especies con etapas no segmentadas (como las humanas). Dado el papel esencial de la condensación de cromatina en espermatozoides alargadores en la definición del patrón de transilluminación, está claro que cualquier desregulación de este proceso inevitablemente obstaculizará la implementación de este método. En ratones juveniles y adultos jóvenes (5-6 semanas) el patrón de transilluminación aún no se ha establecido completamente y, por lo tanto, sólo se deben utilizar ratones mayores de 8 semanas. También es importante tener en cuenta que apretar y tirar de los túbulos inevitablemente obstaculizará el patrón de transilluminación porque distorsiona la arquitectura celular dentro del epitelio seminiferoso.
Los segmentos aislados de tubérculos seminiferosos también se pueden cultivar permitiendo la observación ex vivo y la manipulación de procesos acoplados a la espermatogénesis, incluida la meiosis. Para garantizar la viabilidad del tejido y evitar la degradación del ARN y las proteínas, las muestras deben recogerse y procesarse no más de 2 horas después de sacrificar el ratón. Para la cultura ex vivo de los tubulos semeferosos, el tiempo del sacrificio al inicio de la cultura no debe exceder de 1 hora. La integridad de los fragmentos de tubérculos normalmente se puede mantener hasta 72 horas in vitro si se cosecha correctamente.
La etapa del ciclo epitelial seminferoso se puede verificar y definir con mayor precisión mediante microcopía de contraste de fase de preparaciones de calabaza16. La microscopía se realiza en células vivas, lo que proporciona una dimensión adicional en el análisis y permite la observación de movimientos organelle o celulares en etapas específicas de la espermatogénesis28,29,30. La microscopía de contraste de fase proporciona una puesta en escena exacta para el inmunostaining posterior, lo que permite un análisis muy detallado de la expresión proteica y la dinámica de localización durante la espermatogénesis, incluidos los cambios específicos de la etapa.
Mientras que las células se liberan del contexto epitelial en preparaciones de calabaza, los inmunostainings de montaje completo de segmentos de tubérculos permiten el estudio de células espermatogénicas en su entorno fisiológico. Por lo tanto, las preparaciones de montaje completo pueden proporcionar una mejor visualización de la arquitectura seminiferosa de tubérculos y sus contactos intercelulares que la inmunodetención en secciones transversales. Es importante destacar que la puesta en escena asistida por transilluminación de los segmentos de tubérculos antes de la inmunodetención hace que el enfoque sea aún más potente al incluir información sobre la etapa específica de un segmento determinado. La tinción integral es una herramienta particularmente útil para el estudio de células en la periferia de los túbulos semeferosos, como las células mioides peritubulares, macrófagos peritubulares y espermatogonia, pero también podría abrir nuevos conocimientos sobre la investigación sobre células germinales meioticas y postmetóticas.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por subvenciones de la Academia de Finlandia [315948, 314387 a N.K.]; Fundación Sigrid Jusélius [a N.K., J.T.]; Fundación Emil Aaltonen [a J.-A.M., T.L.]; Programa de Doctorado en Medicina Molecular de Turku [S.C.-M., O.O.].
Materiales
| Name | Company | Catalog Number | Comments |
| bovine serum albumin (BSA) | Sigma | A9647 | |
| cover glass 20x20 mm | Menzel Gläser | 11961988 | |
| Falcon conical tube 15-ml | Sarstedt | 62.554.502 | |
| fetal bovine serum (FBS) | Biowest | S1810 | |
| grease pen (ImmEdge) | Vector Laboratories | H-4000 | |
| microscope slide Superfrost Plus | Thermo Scientific | 22-037-246 | |
| Parafolmaldehyde (PFA) | Electron Microscopy Sciences | 15714 | |
| Petri dish (100-mm) | Greiner | 664160 | |
| phosphate-buffered saline (PBS) | Gibco | 11503387 | |
| ProLong Diamond Antifade Mountant | Thermo Fisher | P36962 | |
| rhodamine-labelled Peanut agglutinin (PNA) | Vector Laboratories | RL-1072 | |
| Triton X-100 | Sigma | 93443 | |
| Tween-20 | Sigma | P2287 |
Referencias
- Mäkelä, J. A., Toppari, J. Testis Physiology: Seminiferous Cycle. Encyclopedia of Reproduction. , (2018).
- Oakberg, E. F. Duration of spermatogenesis in the mouse and timing of stages of the cycle of the seminiferous epithelium. The American Journal of Anatomy. 99 (3), 507-516 (1956).
- Clermont, Y. Kinetics of spermatogenesis in mammals: seminiferous epithelium cycle and spermatogonial renewal. Physiological Reviews. 52 (1), 198-236 (1972).
- Perey, B., Clermont, Y., Leblond, C. The wave of the seminiferous epithelium in the rat. American Journal of Anatomy. 108 (1), 47-77 (1961).
- de Lima e Martins Lara, N., Costa, G., Avelar, G., Lacerda, S., Hess, R., França, L. Testis Physiology-Overview and Histology. Encyclopedia of Reproduction. , (2018).
- Leblond, C. P., Clermont, Y. Definition of the stages of the cycle of the seminiferous epithelium in the rat. Annals of the New York Academy of Sciences. 55 (4), 548-573 (1952).
- Parvinen, M. Regulation of the seminiferous epithelium. Endocrine Reviews. 3 (4), 404-417 (1982).
- Kotaja, N., et al. Preparation, isolation and characterization of stage-specific spermatogenic cells for cellular and molecular analysis. Nature Methods. 1 (3), 249-254 (2004).
- Nakata, H., Sonomura, T., Iseki, S. Three-dimensional analysis of seminiferous tubules and spermatogenic waves in mice. Reproduction. 154 (5), 569-579 (2017).
- Russell, L. D., Ettlin, R. A., SinhaHikim, A. P., Clegg, E. D. . Histological and histopathological evaluation of the testis. , (1990).
- Parvinen, M., Hecht, N. B. Identification of living spermatogenic cells of the mouse by transillumination-phase contrast microscopic technique for "in situ" analyses of DNA polymerase activities. Histochemistry. 71 (4), 567-579 (1981).
- Ventelä, S., Mäkelä, J. A., Kulmala, J., Westermarck, J., Toppari, J. Identification and regulation of a stage-specific stem cell niche enriched by Nanog-positive spermatogonial stem cells in the mouse testis. Stem Cells. 30 (5), 1008-1020 (2012).
- Faisal, I., et al. Transcription factor USF1 is required for maintenance of germline stem cells in male mice. Endocrinology. 160 (5), 1119-1136 (2019).
- Wright, W. W., et al. Identification of stage-specific proteins synthesized by rat seminiferous tubules. Biology of Reproduction. 29 (1), 257-270 (1983).
- Johnston, D. S., et al. Stage-specific gene expression is a fundamental characteristic of rat spermatogenic cells and Sertoli cells. Proceedings of the National Academy of Sciences of the United States of America. 105 (24), 8315-8320 (2008).
- Toppari, J., Bishop, P. C., Parker, J. W., diZerega, G. S. DNA flow cytometric analysis of mouse seminiferous epithelium. Cytometry. 9 (5), 456-462 (1988).
- Mäkelä, J. A., et al. Hedgehog signalling promotes germ cell survival in the rat testis. Reproduction. 142 (5), 711-721 (2011).
- La, H. M., et al. Identification of dynamic undifferentiated cell states within the male germline. Nature Communications. 9 (1), 04827 (2018).
- Toppari, J., Parvinen, M. In vitro differentiation of rat seminiferous tubular segments from defined stages of the epithelial cycle morphologic and immunolocalization analysis. Journal of Andrology. 6 (6), 334-343 (1985).
- Parvinen, M., Vanha-Perttula, T. Identification and enzyme quantitation of the stages of the seminiferous epithelial wave in the rat. The Anatomical Record. 174 (4), 435-449 (1972).
- Kluin, P. M., Kramer, M. F., de Rooij, D. G. Spermatogenesis in the immature mouse proceeds faster than in the adult. International Journal of Andrology. 5 (3), 282-294 (1982).
- Yoshida, S., et al. The first round of mouse spermatogenesis is a distinctive program that lacks the self-renewing spermatogonia stage. Development. 133 (8), 1495-1505 (2006).
- Chan, A. L., et al. Germline stem cell activity is sustained by SALL4-dependent silencing of distinct tumor suppressor genes. Stem Cell Reports. 9 (3), 956-971 (2017).
- Lokka, E., et al. Generation, localization and functions of macrophages during the development of testis. Nat Commun. 11 (1), 4375 (2020).
- Mäkelä, J. A., Toppari, J. Testis physiology: Spermatogenic cell syncytium. Encyclopedia of Reproduction. , (2018).
- Griswold, M. D. Spermatogenesis: The commitment to meiosis. Physiological Reviews. 96 (1), 1-17 (2016).
- Mäkelä, J. A., Toppari, J. Spermatogenesis. Endocrinology of the Testis and Male Reproduction. , 1-39 (2017).
- Ventela, S., Toppari, J., Parvinen, M. Intercellular organelle traffic through cytoplasmic bridges in early spermatids of the rat: mechanisms of haploid gene product sharing. Molecular Biology of the Cell. 14 (7), 2768-2780 (2003).
- Parvinen, M., Parvinen, L. M. Active movements of the chromatoid body. A possible transport mechanism for haploid gene products. The Journal of Cell Biology. 80 (3), 621-628 (1979).
- Parvinen, M., Söderström, K. O. Chromosome rotation and formation of synapsis. Nature. 260 (5551), 534-535 (1976).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados