Method Article
下游免疫污染分析小鼠水母上皮周期特定阶段的转化-辅助解剖
摘要
该协议描述了代表半尖上皮周期特定阶段的成年小鼠半尼弗管段的透水辅助微分流,以及其中的细胞类型,以及壁球制剂和完整大肠管段的后续免疫污染。
摘要
精子生成是一个独特的分化过程,最终产生身体最独特的细胞类型之一,精子。生殖细胞的分化发生在体细胞的细胞质口袋中,这些细胞同时承载4至5代生殖细胞,并协调和同步其发育。因此,横截面内生殖细胞类型的组成是恒定的,这些细胞关联也被称为半上皮周期的阶段(I-XII)。重要的是,阶段也可以根据透水所揭示的微分光吸收/散射特性,以及这些阶段沿管子以数字顺序相互跟随的事实,从完整的半细管中识别出来。本文描述了一种透水辅助微分流方法,用于分离代表小鼠半尖上皮周期特定阶段的半细管段。先在解剖显微镜下检查半成品管的光吸收模式,然后切割代表特定阶段的管状段,用于下游应用。在这里,我们描述了针对特定阶段的壁球制剂和完整的大块头段的免疫污染协议。这种方法使研究人员能够专注于精子生成特定阶段发生的生物事件,从而为精子生成和基础分子机制的发育、毒理学和细胞学研究提供了独特的工具。
引言
男性生殖细胞的分化,从二倍体精子到成熟的哈普洛德精子,即精子生成,是一个复杂的过程,发生在性成熟个体1的睾丸中半尼弗管的上皮。A1精子的线粒体后代首先分裂五次,以扩大分化承诺人群,然后进入美氏症作为精子细胞,最终导致类胡萝卜精子。将圆形精子分化为精子,即精子生成,涉及细胞形态的复杂变化,包括核压实和精子特异性结构的构建,如坏死体和旗体。在小鼠中,精子生成的整个过程需要35天才能完成2,3。
在任何给定部位,半衰状上皮承载多达五组分化生殖细胞加上生殖系干细胞/祖细胞和体细胞塞尔托利细胞1。区分生殖细胞形成同心层,其组成是可预测的,在给定的发展步骤中,类固醇细胞总是与某些类型的精子细胞和精子4,5。因此,管子的任何横截面都承载着一组不断组合的生殖细胞。这些特定的细胞关联被定义为半上皮的阶段。阶段本身并不呈现停滞的检查点状状态,而是随着生殖细胞群的分化同步进行而不断发展。在小鼠中,有12个阶段(I-XII)2,它们沿着半尼弗管的纵轴以段状方式排列,它们以逻辑顺序相互跟随,从而形成半尼皮上皮波,或精子波7、8、9(图1)。精子生成的完成需要四个周期,而任何半成分管横截面内的分化生殖细胞的分层层或群落在时间上是彼此分开的一个半衰期周期。周期的长度是物种依赖,在鼠标中每个周期需要8.6天10。
阶段可以根据组体学睾丸第5节(图1和图2)的细胞组成和半尖上皮的组织来识别。然而,组织学分析是费力的,耗时的,需要固定和染色,因此不能应用于活组织。重要的是,在解剖显微镜下,通过利用周期不同阶段所表现出的明显的光吸收/散射模式(图2),也可以在活组织上进行分期。每个阶段吸收和散射光的能力是相对于任何给定阶段主机的晚期后精子的色素凝结水平,以及这些细胞的包装束7,11。精子分化,即精子生成,进一步分为16个发育步骤,包括8个步骤的圆形精子(步骤1-8)和8个步骤的拉长精子(步骤9-16)分化(图1)。步骤 9-11 拉长精子(阶段 IX-XI)仅显示低水平的色素凝结,导致吸收的光量低。色素凝结开始于第11步精子(第十一阶段),第15-16步拉长精子(第四阶段-第八阶段)含有完全浓缩的色素,因此表现出最大的光吸收(图3)。色素需要浓缩,以便紧密地挤入精子头部。导致光吸收模式的其他因素包括上皮内拉长精子(基础与apical)的位置,以及拉长精子的捆绑(在II-V阶段发音)11(图3)。捆绑物被视为管子中间的斑点,在解剖显微镜下边缘的条纹,色素凝结得越多,斑点/条纹11越暗。
本文描述了使用透水辅助微分流方法分离代表半尼弗上皮周期特定阶段的半尼弗管段。一旦分离,分阶段的管状部分可以接受各种下游分析,包括生化RNA和蛋白质分析12,13,14,15,流细胞学16,外活管培养17和免疫污染18。在这里,我们还提供详细的下游协议,准备压扁的单层分阶段管状段活细胞形态分析和随后的免疫污染,以及整个安装的管状部分的免疫污染。简而言之,图 4中描述的工作流程。
由于各个阶段的同步细胞组成,透晶辅助微分流法允许在分化的特定步骤准确识别和分离生殖细胞。重要的是,它也有助于研究在活组织精子生成过程中的阶段依赖事件。鉴于精子生成缺乏可扩展的体外模型,这种方法还具有独特的优势,允许有针对性的短期发育和毒理学研究阶段特定的管状部分前活体12,17。虽然我们在这里描述小鼠的方法,同样的程序可以适用于任何哺乳动物物种与纵向和分割排列的半上皮阶段,如大鼠4,7,15,19,20。
研究方案
对实验鼠和所有动物实验的维护是按照图尔库大学有关照顾和使用实验动物的准则和条例进行的。
1. 为微切准备半成分管
- 牺牲成年雄性小鼠(≥8周大,睾丸80-120毫克取决于应变和年龄)通过CO2 窒息,然后宫颈脱位。
注意:老鼠应该是性成熟,最好是至少8周大。幼鼠的转化模式与成人不同,因为半尖顶的波尚未完全确定,第一波精子生成的时间是明显的21,22。在 +lt;4 周大的雄性小鼠中缺乏拉长精子,则无法用于透气辅助微分。所有具有正常精子生成的老鼠菌株都可以使用。 - 用 70% 乙醇喷洒腹腹部。使用无菌剪刀打开腹部骨盆腔,制作 V 形开口。
- 用无菌钳子拉上表皮脂肪垫,定位睾丸,用剪刀解剖,放在含有PBS的无菌100毫米培养皿上。
注意:要保持不育,请确保所有实验室软件和手术工具都是无菌的。 - 使用细尖剪刀通过切割 图尼卡阿尔布吉内亚的缝隙来斩首睾丸,厚纤维板封装睾丸。然后用一对钳子撕开图尼卡。用钳子压出浴缸,然后丢弃图尼卡。
注:在丢弃图尼卡的同时,动脉 睾丸 与图尼卡一起被切除,这可能对一些下游应用有益。避免损坏半成纤维管。 - 将半衰状的管子移到新的培养皿中,倒入足够的无菌PBS,以覆盖培养皿的底部。接下来,轻轻地将浴缸拉开,但避免损坏大管。
注:过多的机械应力会影响透气模式,影响组织及其细胞结构的生存能力。管子也可以从这一点上处理全安装免疫污染,而无需暂存 (3B)。有时,通过将抗体加入到分化精子中表达的蛋白质中,如SALL4、c-KIT和DNMT3A18,23,就足以追溯地定义这个阶段。精子的密度是一个相对可靠的阶段指标(图2)。
2. 透气辅助微分
- 将培养皿贴在舞台上,将培养皿牢牢地放在解剖显微镜下。
注:重要的是要磁带的培养皿,以防止其运动,这可能会导致混合收集的分阶段半细管段。 - 要揭示对焦下半成纤维管的光吸收模式,请确保样品从下面点亮,光线通过样品, 即透光。
注:吸收/散射的光量相对于拉长精子中的色素凝结水平及其在半尼气管内的捆绑:凝结越多,吸收的光就越多, 即显得较暗。 - 通过使用细钳小心地移动一束管子,熟悉 图 2、图 5A 和 图 S1 中描述的不同阶段的光吸收模式。
注:这些阶段总是按逻辑顺序相互跟随,形成半尖顶的波。然而,重要的是要知道,精子生成波的方向偶尔会逆转,然后再次恢复(也称为调制4,9),有时使程序复杂化。此外,每个阶段的长度,就多少毫米的浴缸,有很大不同。 - 使用带钩尖的钳子小心地抬起兴趣的管子,然后使用微分剪剪剪切一段适当的长度段(见 补充视频 1)。钳子尖端的钩子使提升和握住浴缸更加容易,并有助于避免挤压它。
注:要切割的段的长度取决于下游应用。对于蛋白质或RNA分析12、13(II-V、VII-VIII和IX-XI,图5B)特定阶段的集合管片的集合,长度通常为2-5毫米。当使用标准苯酚-氯仿萃取时,大约 200 ng 的 RNA 可以从 1 mm 的管子中提取。对于分阶段浴缸段的全安装染色,段的长度应为 +gt;5 mm。对于壁球制剂,段的长度不应超过 1-2 mm,因为段中间的单元格如果过长,可能会无法退出。在培养皿下使用毫米比例,准确测量大管长度。
3. 免疫不同制剂
- 壁球准备:阶段验证和免疫
注:舞台特异性管状块可以在显微镜滑梯上用覆盖玻璃压扁,通过相对比显微镜和随后的免疫污染对活细胞进行形态分析。建议初学者在熟悉透水辅助微分流方法时使用此方法验证阶段。- 使用移液器将该段收集为 10 μL 的音量,并将其移动到显微镜幻灯片上。
- 将盖玻璃(20 毫米 x 20 毫米)小心地放在大管上,将浴缸挤压。因此,细胞将流出管子,形成一个活细胞单层。将滤纸放在盖玻璃的边缘,以促进细胞的扩散。避免压扁细胞太多,以保持他们活着。
- 监测细胞在显微镜下扩散。使用相位对比显微镜在40倍的目标,通过检查存在的细胞类型(图2,图S2)来验证阶段识别。
- 一旦细胞从管子的两端扩散形成圆形单层,将滑梯浸入含有液氮的容器中,同时用钳子将其握住。让它淹没10s。或者将滑梯放在干冰板上冷冻。
- 使用手术刀翻转盖玻璃,取下盖玻璃。
- 毫不拖延地进行固定,并快速将滑梯放置在装有 90% 乙醇的容器中 2-5 分钟。
注意:在将壁球制剂放入 90% 乙醇之前,请确保壁球制剂不会解冻。其他固定剂也可用于10分钟,如丙酮。 - 空气干燥,在室温 (RT) (最多几天) 或在 -80 °C (长期) 存储。
- 对于免疫污渍,在 RT 将样品固定在 4% 甲醛 (PFA) 中 10 分钟。
- 在PBS中冲洗,在PBS中以0.1%的Triton X-100渗透5分钟。
- 冲洗 PBS,并在每个壁球样品周围画一个油脂环。
- 在润滑脂环内的 PBS (PBST) 中加入 50-100 μL 的 10% BSA(牛血清白蛋白),并在 RT 中阻止样品 30 分钟。
- 取出 BSA 溶液,在 PBST 中稀释 10% BSA 中的原发抗体在 RT 中孵化 1 小时。
- 用PBST洗3次5分钟。
- 在PBST中用10%的BSA稀释二次抗体进行孵化。
注:要弄脏坏的生物体,样品可以在PBST的10%BSA中孵育罗达明标记的花生凝胶素抗体(PNA,1:1000),在RT(图S3)中孵育1小时,而不是特定的初级和次要抗体。 - 用 PBST 清洗 3 次 5 分钟,用 PBS 冲洗,并安装包含 DAPI 的坐骑。
- 半成品管的全安装免疫污染
注:下面的协议描述了分阶段(从步骤2.4)大块头段的全安装染色。如果研究人员想要在没有暂存的情况下执行全安装染色(从步骤 1.5 开始),请注意 3.2.1 和 3.2.7 中的注释。- 使用移液器,将冰冷 PBS 中的浴缸段(从步骤 2.4)转移到 15 mL 圆锥管中,并允许它们沉积在冰上。
注意:如果使用 1.5.使用带切割尖端的 1 mL 移液器。此步骤旨在打开组织结构。但是,避免过多的管道,因为它可能会损坏管子。浴缸的沉降需要几十秒。小管状碎片、间歇细胞和细胞碎片留在超自然体中。 - 通过管道或吸气器小心地去除超纳坦 (SN)。加入10 mL的冰冷PBS,然后倒置混合。
- 允许沉积物,然后像以前一样去除SN。
- 在 +4 °C 的旋转桌上添加 5 mL 的 4% PFA 并修复 5 小时(20-30 rpm)。
注:固定时间取决于感兴趣的蛋白质及其亚细胞定位。对于核蛋白和细胞质蛋白,2小时固定通常足够,但是,膜标记,如GFR+1(GDNF家族受体α 1: 图6A,B),受益于更长的固定,高达6小时。 - 允许沉积物,像以前一样去除 SN (PFA),并通过添加 10 mL 的 PBS 和倒置管子短暂冲洗。
- 允许沉积物,像以前一样去除 SN,并在 +4 °C 的旋转桌上重复 PBS 清洗步骤三次,每次至少 10 分钟,然后以 +4 °C 进行染色或存储。
注:如果工作条件无菌且清洁,样品至少可以存储和使用数周。或者,将 Azide 钠添加到 2% 库存溶液的最终浓度 0.02% (w/v) 中,以帮助在储存在 +4 °C 之前保存管子。 - 使用 1mL 移液器,将 10-20 个固定管段移动到 2 mL 圆底管。允许沉积物并清除 SN。
注意:如果使用尚未上演的长管,将管子倒入培养皿中,并使用微分切剪刀和钳子切割约 5-20 mm 的段。在染色过程中,过长的段会缠绕,而过短的段很容易丢失。 - 在 PBS (PBSX) 中添加 1 毫升 2% BSA + 10% FBS (胎儿牛血清) 在 0.3% 特里顿 X-100 中。在 RT 的旋转桌(20-30 rpm)上块至少 1 小时。
- 用 1 mL 的 PBSX 冲洗,通过管道清除 SN,并在 PBSX 中加入 250 μL 的原发抗体稀释在 1% BSA 中(1:100-1:2000 稀释)。在 RT 孵化 2 小时,或在旋转表上以 +4 °C (20-30 rpm) 过夜。
- 通过管道管道取出抗体溶液,并按上图用 1 mL 的 PBSX 冲洗管子。在 RT 的旋转表(20-30 rpm)上,在 PBSX 中洗三次 1 小时。
注:第一次清洗后,样品可在+4°C下过夜(如有必要)。 - 去除 SN 并添加 250 μL 的次要抗体,在 PBSX 中稀释 1% BSA(通常为荧光标记抗体的 1:500 稀释)。用铝箔盖住,在 RT 的旋转桌上孵育 1 小时(20-30 rpm)。
- 重复 3.2.10。
- 最后取出SN,将管子倒入显微镜滑梯。使用凝胶加载提示轻轻分离并排列线性条状的管子。排空多余的缓冲区,并添加安装介质和盖夹。
注意:在安排管子时避免干燥。在大多数情况下,没有必要用DAPI对核进行反污渍。用指甲油密封盖唇的边缘,以防止样品干燥和变质。在成像前,幻灯片可在 +4 °C 下存储 1-2 周。
- 使用移液器,将冰冷 PBS 中的浴缸段(从步骤 2.4)转移到 15 mL 圆锥管中,并允许它们沉积在冰上。
结果
小鼠半成分管的成功透析辅助分期和微分,主要取决于能否找到合适的照明条件和合适的解剖显微镜,以及识别每个阶段特征的特定特征的能力。阶段七-八出现同质黑暗,因为它们含有大量的完全浓缩的拉长精子,在上皮表面对齐(图5A和图S1)。成熟精子在精子中释放到流明后,由于上皮中缺乏浓缩的拉长精子,大肠在九至十一阶段显得非常苍白。在透光管上最容易识别的特征是精子化点(图5A中的星号和图S1),即从暗区(VII-VIII)突然过渡到苍白区域(IX-XI)。苍白区域后面是弱点区(XII-I)。斑点外观源于将精子与凝结染色质捆绑在一起的拉长精子的组织。捆绑包在以下强点区域 (II-V) 中变得非常突出。此外,精子束迁移到位于基底层拉米纳附近的塞尔托利细胞核,这反映为转月时阶段II-V管的条纹外观(图2,图5A,B和图S1)。束最终在第六阶段分散,凝结拉长精子靠近流明,在第八阶段从上皮释放出来。
通过壁球制剂的相对比显微镜(图2和图S2),可以准确验证大块头段的确切阶段。 壁球制剂的具体阶段是根据第1-8步圆精子的交叉体发育、色素凝结在拉长精子中的状态以及精子束16(图3和图S2)的存在来识别的。此外,早期细胞类型的存在,如B型精子和瘦素或齐戈泰尼精子细胞,可以根据其形态特征识别,可用于支持阶段识别。在第六阶段左右,帕奇滕精子细胞核的大小增加,这也可能为分期提供额外的帮助。
阶段性壁球制剂可用于研究使用免疫污染的半成分上皮中感兴趣的蛋白质的表达和本地化。这允许非常准确地分析细胞类型特定的表达,因为每个阶段的细胞组成定义明确。阶段特异性表达可以通过共同染色杂技(例如,与PNA),使圆形精子分化的不同步骤的可视化进一步增强。 图S3提供了不同阶段的PNA染色杂技演员的代表性图像。反常染色也可以用来追溯地定义舞台。然而,与随意使用未标记的碎片相比,透气辅助分期是找到所需阶段的一种简单和快速得多的方法。
半硝基管全装染色通常用于研究与半硝基上皮的地下室膜接触的细胞类型,或在管状侧(精子、前瘦精细胞和塞尔托利细胞:图6A、B)或间质侧(腹膜肌细胞和腹膜巨噬细胞:图 6C和图 S4A)24。然而,该方法也可用于研究位于上皮深处的细胞或结构,如血液睾丸屏障(埃斯平,图S4B),或后骨髓生殖细胞(坏死标记PNA,图S4C)。如果使用未标记的浴缸段,则可以回顾性地估计给定阶段,使用抗体对抗在分化精子(A1、A2、A3、A4、In 和 B 中)中表达的蛋白质的抗体(图 2)。然后,在精子分化1的第一个周期中,以阶段依赖的方式经历六个线粒体分裂的同位素A差异的密度,因此,在每一个分征1、25之后,同步的Adiff精子群的数量增加了一倍。但是,回顾性分期不如透水辅助分期准确,因为不同代 A差异没有特定标记,并且对 A差异密度的评估可能容易出错。

图1:小鼠精子生成的半上皮周期图。垂直列显示半上皮周期不同阶段的细胞关联(标有罗马数字 I-XII)。最不成熟的生殖细胞在底部,而最分化的是在顶部。要跟随生殖细胞分化的进展,必须从左到右,从下到上移动。半尖顶的周期是一个完整的阶段,以数字顺序相互跟随。一个没有差别的精子:A1-4型A1-A4精子:在,中间精子:B型精子:Pl, 前瘦素精子细胞;L, 瘦素精子细胞;Z, 齐戈特内精子细胞;P, 帕奇滕精子细胞;D、二聚苯精子细胞;2°,次生精子细胞加上肌分裂。阿拉伯数字1-16是指后生精子成熟(精子生成)的步骤。 请点击这里查看此数字的较大版本。
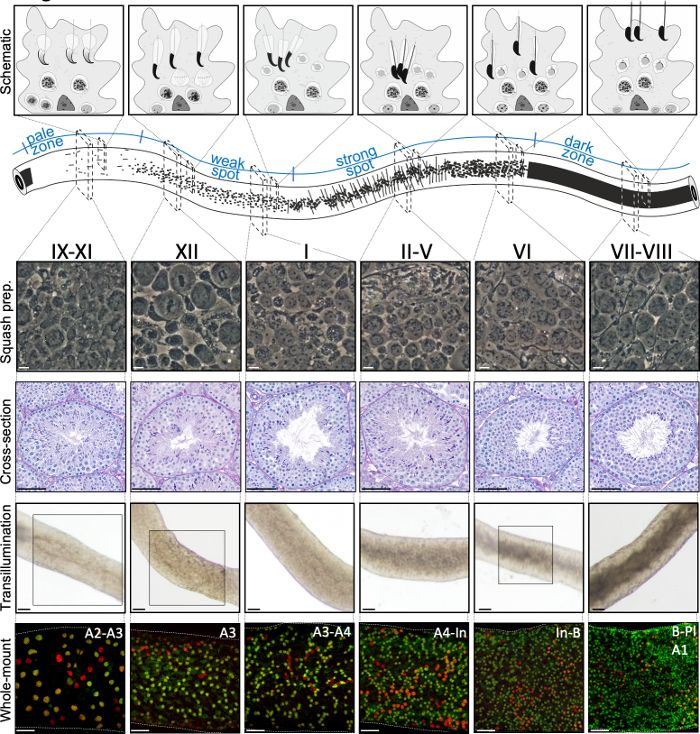
图2:小鼠半尖上皮周期阶段的细胞关联。半尼皮上皮周期的阶段以逻辑顺序相互跟随,从而沿着半尼弗状管的纵轴形成精子生成波。顶部面板说明了不同阶段的生殖细胞关联,以及半上皮中塞尔托利细胞(浅灰色)细胞质口袋中的细胞类型位置。半尼弗管的插图可视化苍白、弱点、强点和暗区的精子生成波和特定的透气模式。从每个指示的阶段,代表性的活细胞相对比图像壁球制剂和周期性酸-希夫(PAS)染色睾丸横截面。底部两个面板显示透水(顶部)或与SALL4(红色,泛精子标记)和DNMT3A(绿色,差异 标记)的抗体(底部)染色后的半成精管段。第九至第十一阶段、第十二阶段和第六阶段的透气模式以盒装区域突出显示。DNMT3A阳性分化精子(底部)的光吸收模式(顶部)和密度均可用于定义半衰周期的(近似)阶段。连续几代A差异 被称为A1-A4型、中间型(In)和B型精子。每个分工导致精子细胞密度增加一倍。当观察到甲基苯精子细胞(Pl)时,在半乳腺上皮的地下室膜上,细胞密度最高的是VI-VIII阶段。比例尺:壁球准备10微米,其他50μm。 请点击这里查看此数字的较大版本。

图3:精子生成的步骤。精子在精子生成不同步骤的显著特征。 请点击这里查看此数字的较大版本。
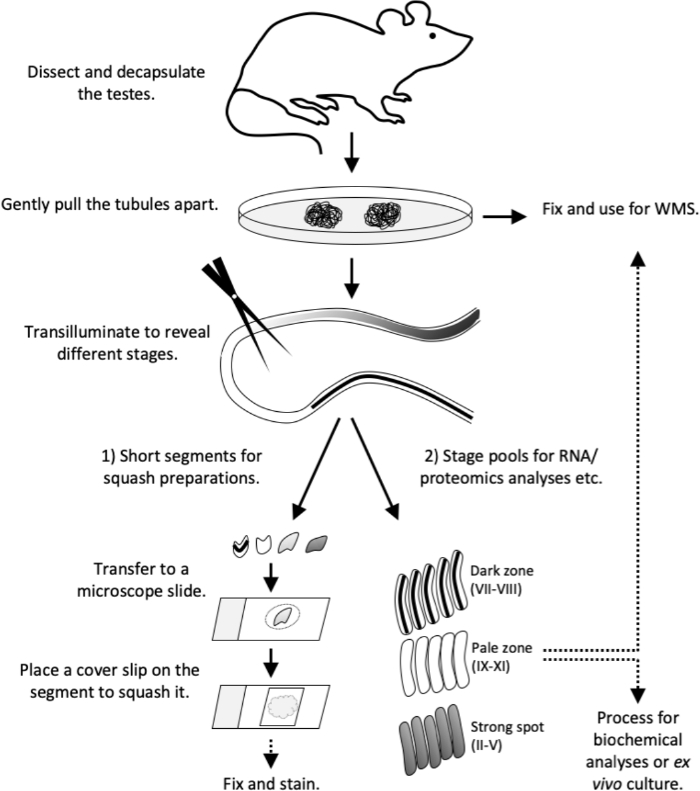
图4:本研究的工作流程。在成人(+8周大)鼠标中已完全建立了透气模式。牺牲鼠标,并立即进行睾丸解剖和斩首。轻轻地在培养皿上将浴缸拉开。修复整个安装染色管或进行透气。在透水下 1) 切割特定阶段的短管段(用于壁球制剂(质量控制或免疫污渍)或 2) 切割较长的段,以收集用于RNA 和蛋白组学分析、组织培养或全安装染色的阶段池。将短管段传输到 10 μL 容量的 PBS 中的显微镜滑梯。在段上放置一个盖滑,以强制取出细胞并形成活细胞单层。在显微镜下观察细胞类型,然后修复和染色。WMS,全安装染色。 请点击这里查看此数字的较大版本。
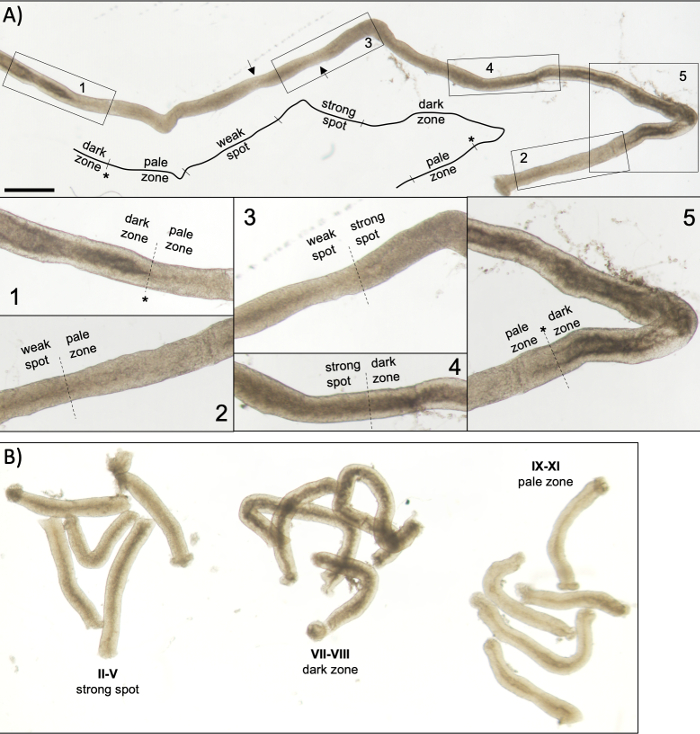
图5:在透水显微镜下看到的成年小鼠的半纤维管。(A) 在透水下看到的一长段半成精管,显示半成分形的上皮波。可根据精子中的色素压实及其在上皮中的定位确定四个不同的区域:暗区(第七-第八阶段)、苍白区域(第九阶段-XI阶段)、弱点区(第十二阶段-I)和强点区(第二至第六阶段)。星号,精子点。箭头表示弱点区域内的两个短段,由于管子上的机械应力而外观苍白。比例:500μm。Insets 1-5 是来自选定浴缸段的更高放大倍率。 (B) 代表第二阶段-V级(强点区)、七-八(暗区)和IX-XI(苍白区)的分组。 请点击这里查看此数字的较大版本。
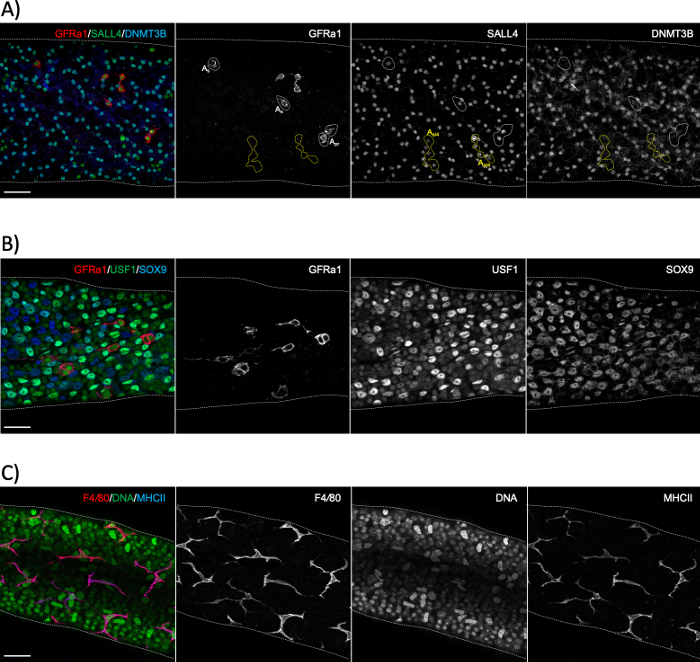
图6:使用精子、塞尔托利细胞和围膜巨噬细胞标记进行全安装免疫污染。(A) 代表阶段 XI-II 的全安装染色剂,具有对 GFR®1(红色)、SALL4(绿色)和 DNMT3B(蓝色)的抗体。染色揭示了三种不同的精子群:单分离(As)或配对(Apr)未分化的干细胞精子(GFR+1+/SALL4+/DNMT3B-;白色点状区域),短同步(此处为4对齐细胞):a al4) 祖传精子 (GFRé1-/SALL4+/ DNMT3B-; 黄色点状区域) 和分化精子( GFR1-/SALL4+/ DNMT3B+)。SALL4+/DNMT3B+细胞是A3-A4型精子。(B) 全安装半成重管染色与抗体对GFR®1(红色),USF1(绿色)和SEX9(蓝色)。GFR®1 会弄脏精子的茎子集。USF1是由精子和SIX9+塞尔托利细胞表达的。(C) 成年小鼠的腹膜巨噬细胞对F4/80(红色)和MHCII(蓝色)均呈阳性。DAPI染色DNA(绿色)。明亮的大核是外周肌细胞核。刻度条:50μm。请点击这里查看此数字的较大版本。
图S1:在透水下看到的半成分管的长段,显示半尼弗上皮的波。 可根据精子中的色素压实及其在上皮中的定位确定四个不同的区域:弱点区(第十二阶段-I)、强点区(第二阶段-VI)、暗区(第七-第八阶段)和苍白区域(第九至第十一阶段)。精子点(星号)可以被识别为暗区突然进入苍白区域。比例:500μm。Insets 1-4 是来自选定管段的更高放大倍率。 请点击这里下载此数字。
图S2:半上皮周期不同阶段的活细胞单层的相位对比显微镜。 (A) 第一阶段第一步圆形精子仍然缺乏相声结构。它们的特点是一个小圆核(红色圆圈),具有独特的单色中心(白色箭头)。色素体在细胞质中可见,作为与核膜(蓝色箭头)密切接触的暗颗粒。塞尔托利细胞核(白圆)包含三个暗体:一个带有两个卫星染色中心的大核。在壁球制剂中,Sertoli细胞是很少见到的,但它们偶尔会与生殖细胞一起从管子里流出。(B) 第二阶段-第四阶段。在第4步圆形精子(红色圆圈)中,交生体结构(红色箭头)显示为连接到核信封的白色稍微扁平的囊泡。拉长精子形成束,并已经有一个厚厚的旗状物(白色箭头),表明线粒体护套在精子尾巴的中间部分的存在。帕奇滕精子细胞(PSpc)的核大约是圆形精子的两倍大,其特征是分布在细胞核的暗色素区域。(C) 第五阶段-第六阶段。在第5-6步圆精子(红色圆圈),坏死体进一步扁平化,并蔓延到核(红色箭头)。由于存在显微镜,朝向坏肢体的核信封区域显得黑暗,轴状体是一种富含蛋白质的盘,它存在于交声膜和核膜之间。拉长精子从束(白色箭头)释放出来。帕奇滕精子细胞 (PSpc) 经常在上皮中观察到。(D) 第七阶段-第八阶段。杂技(红色箭头),一个黑暗的衬里在核信封与白色阴影,是完全扩展,并覆盖几乎整个apical侧的第7-8步圆精子(红圈)。这个阶段的特点是成熟的精子(白箭),可能是丰富的壁球准备的许多部分。帕奇滕精子细胞(PSpc)的细胞核在发育过程中大小增大,在第七阶段-第八阶段看起来比前一阶段更大。由于高转录活性和间质事件,帕奇滕精子细胞(PSpc)核心内的暗色素区域显得模糊不清。(E) 阶段 X. 步骤 10 精子核 (白箭) 已开始拉长, 但色素尚未凝结。杂技演员开始在核尖端(红色箭头)形成钩子。帕奇泰内精子细胞(PSpc)的核看起来非常大,因为他们正在准备肌分裂。(F) 第十二阶段。第十二阶段的特点是存在间质元相板(白色破折号圆)。具有典型凝结染色质图案的小型圆形细胞是zygotene精子细胞(ZSpc),其中姊妹染色体对齐以启动突触复合形成。比例: 10μm. 请点击这里下载此数字。
图S3:根据结晶体和核染色确定半生命上皮周期的阶段。 丙酮固定壁球制剂沾染了罗达明结合的PNA和DAPI。第一阶段:虽然第1步圆形精子中不存在坏死体,但在拉长精子中可以检测到完全发育的精子。第二阶段-第四阶段:非生殖体发育始于圆形精子中的前列素/非曲热颗粒的外观。核表面的全声囊泡呈圆形状,直到第3步精子,然后在第4步精子中扁平化。第五阶段:由杂技演员子定的角度从40度延伸至最大95°。第六阶段-第七阶段:由杂技演员子定的角度从95度延伸到120度。阶段八-九:精子体在第8步精子(第八阶段)中完全延长,细胞的apical侧与血浆膜接触的细胞核极化(未显示)。到第九阶段,精子核变形:鼻腔和心室表面是首次看到。阶段X-XI:精子显示圆角。第十二阶段:这个阶段最突出的特点是出现分裂:元相板用白色箭头表示。也可以看到精子与他们的杂技演员拉长。刻度条:10μm。 请点击这里下载此数字。
图 S4:非常规标记的全安装染色。(A) 阿尔法平滑肌肉作用素 (aSMA) 由腹膜肌细胞表示。 (B) 埃斯平局部到塞尔托利细胞紧密结,并有助于血液睾丸屏障。 (C) PNA 将精子精子的精子本地化。刻度条:50μm。 请点击这里下载此数字。
补充视频1:切割代表第七阶段-第八阶段的半尼气管的短段。请点击这里下载此视频。
讨论
我们上面描述的透气辅助微分化方法为精子生成的研究提供了一种面向阶段的方法。精子生成是一个高度同步的过程,精子分化过程中的所有关键步骤都以阶段依赖的方式进行调节和执行,如分化承诺(第七至第八阶段)、发病(VII-VIII)、肌分裂(XII)、精子拉长(VI)和精子(八)1、26、27。以阶段为导向的分析为研究这些特定事件提供了有力的工具,这些特定事件仅限于精子生成的特定步骤,因此仅在半上皮周期的特定阶段发现。掌握该方法需要一些实践,使用高质量的解剖显微镜和适当的照明条件是成功的关键。将这种方法作为日常工具包的一部分,通过允许在精子生成过程中更准确地解剖分子事件,能够大大提高研究男性生殖功能的影响和生物学相关性。
我们研究过的所有WT小鼠菌株都表现出类似的透水模式,并在半上皮周期的阶段表现出保存的细胞关联。在生殖细胞的精子原分化与WT小鼠没有明显差异的情况下,同样的情况也适用于我们研究过的所有淘汰小鼠模型。此外,它可以应用于其他物种,表现出纵向段排列阶段的半上皮周期7。但是,不能使用具有非分割阶段的物种(如人类)。鉴于色素凝结在拉长精子在定义透气模式方面的重要作用,很明显,这一过程的任何错误调节都不可避免地会影响这一方法的实施。在幼鼠和幼鼠(5-6周)中,透气模式尚未完全建立,因此,只应使用8周以上的小鼠。同样重要的是要记住,挤压和拉管子将不可避免地影响透水模式,因为它扭曲了半尖顶内的细胞结构。
分离的半尼弗管段也可以培养 ,使前活体 观察和操纵精子生成耦合过程,包括肌瘤。为了确保组织的生存能力,并防止RNA和蛋白质降解,样品应在牺牲小鼠后不超过2小时收集和处理。对于半成品管的 外生文化 来说,从牺牲到文化开始的时间不应超过1小时。如果收获得当,在 体外 通常可以保持长达72小时的管状碎片的完整性。
使用壁球制剂16的相位对比缩影,可以验证和更准确地定义半上皮周期的阶段。显微镜对活细胞进行,这为分析提供了额外的维度,并允许观察精子生成28,29,30的特定阶段的细胞器或细胞运动。相位对比显微镜为后续免疫控制提供了精确的分期,从而能够非常详细地分析精子生成过程中的蛋白质表达和定位动力学,包括阶段特异性变化。
虽然细胞在壁球制剂中从上皮环境中释放出来,但管状部分的全壁塞免疫污染使对其生理环境中的精子细胞的研究得以进行。因此,与横截面上的免疫接触相比,全安装制剂可以更好地可视化半细管结构及其细胞间接触。重要的是,在免疫污染之前,输卵管段的透气辅助分期通过包括特定段特定阶段的信息,使方法更加强大。全安装染色是研究半成分菌管外围细胞(如腹膜肌细胞、腹膜巨噬细胞和精子)的特别有用的工具,但也可能为研究肌细胞和后肌生殖细胞开辟新的见解。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了芬兰学院的赠款[315948,314387到N.K.]的支持:西格丽德·朱塞利叶斯基金会[到北卡罗来纳州,J.T.]埃米尔·阿尔托宁基金会[到J.-A.M,T.L.]图尔库分子医学博士方案[S.C-M.,O.O.]。
材料
| Name | Company | Catalog Number | Comments |
| bovine serum albumin (BSA) | Sigma | A9647 | |
| cover glass 20x20 mm | Menzel Gläser | 11961988 | |
| Falcon conical tube 15-ml | Sarstedt | 62.554.502 | |
| fetal bovine serum (FBS) | Biowest | S1810 | |
| grease pen (ImmEdge) | Vector Laboratories | H-4000 | |
| microscope slide Superfrost Plus | Thermo Scientific | 22-037-246 | |
| Parafolmaldehyde (PFA) | Electron Microscopy Sciences | 15714 | |
| Petri dish (100-mm) | Greiner | 664160 | |
| phosphate-buffered saline (PBS) | Gibco | 11503387 | |
| ProLong Diamond Antifade Mountant | Thermo Fisher | P36962 | |
| rhodamine-labelled Peanut agglutinin (PNA) | Vector Laboratories | RL-1072 | |
| Triton X-100 | Sigma | 93443 | |
| Tween-20 | Sigma | P2287 |
参考文献
- Mäkelä, J. A., Toppari, J. Testis Physiology: Seminiferous Cycle. Encyclopedia of Reproduction. , (2018).
- Oakberg, E. F. Duration of spermatogenesis in the mouse and timing of stages of the cycle of the seminiferous epithelium. The American Journal of Anatomy. 99 (3), 507-516 (1956).
- Clermont, Y. Kinetics of spermatogenesis in mammals: seminiferous epithelium cycle and spermatogonial renewal. Physiological Reviews. 52 (1), 198-236 (1972).
- Perey, B., Clermont, Y., Leblond, C. The wave of the seminiferous epithelium in the rat. American Journal of Anatomy. 108 (1), 47-77 (1961).
- de Lima e Martins Lara, N., Costa, G., Avelar, G., Lacerda, S., Hess, R., França, L. Testis Physiology-Overview and Histology. Encyclopedia of Reproduction. , (2018).
- Leblond, C. P., Clermont, Y. Definition of the stages of the cycle of the seminiferous epithelium in the rat. Annals of the New York Academy of Sciences. 55 (4), 548-573 (1952).
- Parvinen, M. Regulation of the seminiferous epithelium. Endocrine Reviews. 3 (4), 404-417 (1982).
- Kotaja, N., et al. Preparation, isolation and characterization of stage-specific spermatogenic cells for cellular and molecular analysis. Nature Methods. 1 (3), 249-254 (2004).
- Nakata, H., Sonomura, T., Iseki, S. Three-dimensional analysis of seminiferous tubules and spermatogenic waves in mice. Reproduction. 154 (5), 569-579 (2017).
- Russell, L. D., Ettlin, R. A., SinhaHikim, A. P., Clegg, E. D. . Histological and histopathological evaluation of the testis. , (1990).
- Parvinen, M., Hecht, N. B. Identification of living spermatogenic cells of the mouse by transillumination-phase contrast microscopic technique for "in situ" analyses of DNA polymerase activities. Histochemistry. 71 (4), 567-579 (1981).
- Ventelä, S., Mäkelä, J. A., Kulmala, J., Westermarck, J., Toppari, J. Identification and regulation of a stage-specific stem cell niche enriched by Nanog-positive spermatogonial stem cells in the mouse testis. Stem Cells. 30 (5), 1008-1020 (2012).
- Faisal, I., et al. Transcription factor USF1 is required for maintenance of germline stem cells in male mice. Endocrinology. 160 (5), 1119-1136 (2019).
- Wright, W. W., et al. Identification of stage-specific proteins synthesized by rat seminiferous tubules. Biology of Reproduction. 29 (1), 257-270 (1983).
- Johnston, D. S., et al. Stage-specific gene expression is a fundamental characteristic of rat spermatogenic cells and Sertoli cells. Proceedings of the National Academy of Sciences of the United States of America. 105 (24), 8315-8320 (2008).
- Toppari, J., Bishop, P. C., Parker, J. W., diZerega, G. S. DNA flow cytometric analysis of mouse seminiferous epithelium. Cytometry. 9 (5), 456-462 (1988).
- Mäkelä, J. A., et al. Hedgehog signalling promotes germ cell survival in the rat testis. Reproduction. 142 (5), 711-721 (2011).
- La, H. M., et al. Identification of dynamic undifferentiated cell states within the male germline. Nature Communications. 9 (1), 04827 (2018).
- Toppari, J., Parvinen, M. In vitro differentiation of rat seminiferous tubular segments from defined stages of the epithelial cycle morphologic and immunolocalization analysis. Journal of Andrology. 6 (6), 334-343 (1985).
- Parvinen, M., Vanha-Perttula, T. Identification and enzyme quantitation of the stages of the seminiferous epithelial wave in the rat. The Anatomical Record. 174 (4), 435-449 (1972).
- Kluin, P. M., Kramer, M. F., de Rooij, D. G. Spermatogenesis in the immature mouse proceeds faster than in the adult. International Journal of Andrology. 5 (3), 282-294 (1982).
- Yoshida, S., et al. The first round of mouse spermatogenesis is a distinctive program that lacks the self-renewing spermatogonia stage. Development. 133 (8), 1495-1505 (2006).
- Chan, A. L., et al. Germline stem cell activity is sustained by SALL4-dependent silencing of distinct tumor suppressor genes. Stem Cell Reports. 9 (3), 956-971 (2017).
- Lokka, E., et al. Generation, localization and functions of macrophages during the development of testis. Nat Commun. 11 (1), 4375 (2020).
- Mäkelä, J. A., Toppari, J. Testis physiology: Spermatogenic cell syncytium. Encyclopedia of Reproduction. , (2018).
- Griswold, M. D. Spermatogenesis: The commitment to meiosis. Physiological Reviews. 96 (1), 1-17 (2016).
- Mäkelä, J. A., Toppari, J. Spermatogenesis. Endocrinology of the Testis and Male Reproduction. , 1-39 (2017).
- Ventela, S., Toppari, J., Parvinen, M. Intercellular organelle traffic through cytoplasmic bridges in early spermatids of the rat: mechanisms of haploid gene product sharing. Molecular Biology of the Cell. 14 (7), 2768-2780 (2003).
- Parvinen, M., Parvinen, L. M. Active movements of the chromatoid body. A possible transport mechanism for haploid gene products. The Journal of Cell Biology. 80 (3), 621-628 (1979).
- Parvinen, M., Söderström, K. O. Chromosome rotation and formation of synapsis. Nature. 260 (5551), 534-535 (1976).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。