Method Article
ダイヤモンド光源での固定ターゲットシリアルデータ収集
要約
ダイヤモンドビームラインI24でのシリアルシンクロトロン結晶学用の固定対象サンプル調製、データ収集、データ処理に関する包括的なガイドを提供します。
要約
シリアルデータ収集は、シンクロトロンユーザーにとって比較的新しい手法です。I24での固定ターゲットデータ収集のユーザーマニュアル、ダイヤモンド光源は、スムーズなデータ収集のための詳細なステップバイステップの手順、図、およびビデオを提示されています。
概要
シリアルシンクロトロン結晶学(SSX)は、X線自由電子レーザー(XFEL)1、2、3に触発されたデータ収集の新しい方法です。XFELでは、極めて明るいX線パルスによって結晶が破壊される前に、通常非常に小さなタンパク質結晶から単一の回折パターンが記録される。これは、通常、新しい結晶をX線ビームに導入して別の回折パターン4を得なければならないことを意味する。これは、結晶を継続的に補充する必要があり、多くのシリアルサンプル配送技術5の開発を推進しています。
シンクロトロンでは、古典的な(非シリアル)回転結晶学法が広く適用され、ゴニオメーターを使用してX線ビームで回転する単一の大きな結晶を利用して、構造溶液6の完全なデータセットを収集する。結晶の寿命を長くして、完全なデータセットを7、8、および出荷と自動サンプル転送を容易にするために、結晶はデータ収集のために〜100 Kまで凍結冷却されます。強烈なマイクロフォーカスビームラインでは、放射線損傷が単結晶9、10、11からの完全なデータセットの収集を禁止することができるため、多結晶戦略が頻繁に採用されています。放射線損傷による制限にもかかわらず、使用される結晶の数は比較的控えめなままであり、使用されるアプローチは本質的に単結晶実験と同じです。
一方、SSXはシリアルサンプル配信を使用して、何千ものランダム配向結晶から単一のまだ回折パターンを取得し、完全なデータセットを生成します。結晶回転を組み込んだシリアル技術は、まだゼロ回転、アプローチに焦点を当てていますが、開発中12、13に注目されています。異なる長所と短所を持つサンプル配信システムは多種多様で、流れに焦点を当てた/粘性ジェット機15、16、17、マイクロ流体チップ18、19、またはエッチングされたシリコンチップ20、21などの固定ターゲット上の結晶の流れに結晶を送達することから、さまざまなものがあります。.典型的には、結晶は室温で保持され、より大きな立体構造多様性が観察され、より生理学的に関連する環境22を提供することを可能にする。SSXは、データセットの総投与量が1つの結晶の単一の短いX線暴露に相当するので、非常に低い線量データセット23の収集を可能にする。SSXが提供するもう一つの大きな利点は、時間分解された方法によるタンパク質ダイナミクスの研究であり、レーザー光への曝露によって引き起こされる反応24、25、26、27、または結晶とリガンド/基質28、29の混合によって引き起こされる。より小さい結晶を用いると、レーザー光が結晶全体を貫通し、多光子吸収を伴わずに反応を均一に起用し、異なる時点27で撮影された回折データに対して適切に定義された反応中間体を提供する。より大きな結晶および回転ベースのデータ収集方法の使用は、レーザーの貫通深度、不均一または多光子の活性化、放射線損傷、およびデータスイープ内の機械的オーバーヘッド時間に苦しんでおり、より速い反応速度で解釈することが困難または不可能な反応中間体の組み合わせにつながります。小さい結晶は、混合実験において同様の利点を提供し、リガンドが結晶全体に迅速かつ均一に拡散することができるように、再び異なる時間遅延30、31、32で記録される定義された反応中間体を可能にする。
ダイヤモンドのマイクロフォーカスビームラインI24では、従来の回転とSSXの両方の実験が行えます。ここでは、I24で固定ターゲットを使用したSSXサンプル調製とデータ収集のための包括的なプロトコルと、Diamondでのシリアルデータのデータ分析プロトコルを紹介します。原稿と付随するビデオは、ユーザーがI24で成功したSSX実験を行うことを可能にするべきですが、これは急速に発展している分野であり、アプローチは絶えず進化しています。また、シリアル方式は、ペトラIII(P14-TREXX)、MAX IV(BioMAX)33、SLS(PXIおよびPXII)34、およびNSLS(FMX)35を含むがこれらに限定されない他のシンクロトロン源で利用可能であることを留意すべきである。シリアルデータの収集と処理の詳細はソースによって異なりますが、コア原則は変わりません。以下のプロトコルは、達成される可能性のあるサミットではなく、ベースキャンプへの出発点と経路を表すものと見なされるべきです。
このプロトコルは、ユーザーがタンパク質または小分子結晶系を有し、そこからmL当たりの微小結晶の密度が良好な0.5〜2.0 mLの微結晶スラリーが生成されていることを前提とする。結晶スラリーを得るためのプロトコルは、先に説明した36.多くの異なるタイプの固定ターゲットが利用可能であり、I24で最も一般的に使用されるシリコンチップを正確に利用する。他のチップレイアウトと区別するために、ビームラインインターフェースの下とビームラインでは、これは「オックスフォードチップ」と呼ばれています。オックスフォードチップレイアウトは、前に述べたように8×8 '都市ブロック'で構成され、それぞれ20×20開口を含み、合計25,600開口20,21を有する。
プロトコル
1. チップの準備とロード
注:このプロセスは、タンパク質結晶が乾燥するのを防ぐために、湿度制御環境(図1)内で行われます(図1)は、通常、80%から90%以上の相対湿度の間で行われます。一度装填して密封すると、結晶は24時間以上生き残ることができます。しかし、これは結晶系によって大きく異なる場合がある。チャンバー内には、シリコンチップ(図1)、シリコンチップ、ポリエステル箔付きチップホルダー(図2)、p200ピペット、200μLピペットチップ、ピンセット、フィルターペーパー、タンパク質結晶スラリーを保持するローパワー真空ポンプが必要です。
- チップホルダーを準備します。
- ポリエステル箔を2枚、約6cm×6cmの正方形に切ります。
- 2つのベースプレート(大小)の上にポリエステルシートを置きます。
- 金属シールリングを使用して、ポリエステルシートを所定の位置に固定します。
- 余分なポリエステル箔を慎重に引っ張って折り目を取り除き、後でサンプルを視覚化し、センタリングしやすくします。
- 結晶のサイズに対して適切なサイズの開口部(7~30 μm)を持つシリコンチップを選択します。
- グローは0.39 mBarで25秒間チップを排出し、15 mAの電流を使用してチップ上にマイクロクリスタルを容易に広げます。
- 上げられた棒が下を向いているピンセットを使用して、チップローディングステージにシリコンチップを置きます。
- マイクロクリスタルスラリーの200 μLをピペットを使用してチップの平らな側に塗布します。
- チップのすべての「都市ブロック」をカバーするためにクリスタルスラリーを広げます。
- チップが破損している場合は、ポリエステルホイルまたはフィルターピペットチップの小さな部分で穴を覆い、真空を均一に適用できるようにします。
- 余分な液体がチップを通して吸い込まれるまで、穏やかな真空を適用します。
- チップローディングステージからピンセットでチップを取り外します。
- 余分な液体を取り除くために、フィルターペーパーでチップの下側を慎重にブロットします。
- チップホルダーの大きな半分に、チップホルダーの大きな半分に、取り付けたチップを、ガイドマークの平らな側面の間に置きます。
- チップホルダーの小さい半分を上に置いてチップを密封します。
- チップホルダーの2つの半分が所定の位置にスナップします。後半がフラッシュに座っていない場合は、ホルダーを180°回転して磁石を適切に位置合わせします。
- チップホルダーを六六本ボルトで閉じて、チップをしっかりと固定します。
注:または「チップレス」チップは、チップホルダー 37のポリエステル箔の2つの層の間に挟まれた結晶スラリー(〜15 μL)の小さなボリュームで、同様の方法でロードすることができ、またはより小さなボリュームは、以前に説明したようにポリエステル箔に直接適用される50μmの厚さの両面接着スペーサーを使用してロードすることができます38.接着スペーサーを使用すると、チップレスチップに複数のサンプル(またはリガンド浸漬などのサンプルの変異体)を積み込むことも可能です。アコースティックドロップ放出(ADE)を利用してシリコンチップをロードする相補的なローディングアプローチも、Diamond39で使用できます。ADEはピペットの負荷より小さい量の水晶スラリーを使用してチップをロードすることを可能にする。スラリーの化学組成と粘度を考慮する必要がありますが、サンプルが不足している場合は特に有用な技術です。
2. ビームラインでのGUIとセットアップ
- シンプルな EPICS ディスプレイ マネージャ (edm) グラフィカル ユーザー インターフェイス (GUI) を使用して、データ収集のすべてのチップアライメントとセットアップを実行します (図 3a)。これにより、ビームライン計測に対するポイント アンド クリック インターフェイスが提供され、Python ベースのデータコレクションの入力パラメータが提供されます。サブウィンドウは、サンプルホルダのサブ領域(図3b)またはレーザー/LEDポンププローブ実験(図3c)から収集するための追加制御を提供します。
3. チップの位置合わせ
- キネマティックマウントを使用して、ロードしたチップをビームライン( 図4aに示す)のXYZステージに配置します。
- 進行方向に沿ってステージを引っ張らないように注意してください。運動台の磁石は非常に強いので、これは偶然に非常に簡単に行うことができます。
- マウントに近づくと、チップホルダーはわずかな角度(±30°)で保持する必要があります。磁石が接触すると、チップホルダーが床(0°)に平行に回転し、チップホルダーが所定の位置をクリックします(図4b)。
- チップをアンロードする場合は、逆パスに従ってください。チップホルダーを引き離す前に、チップをステージから離して回転させ、角度を付けます。
- ビームラインのオン軸表示システムとチップアライメントGUIを使用して、チップの左上の受託者を見つけます。受託者は3つの正方形で、2つの小さな正方形と1つの大きさで、互いに直角に(図5a)です。チップは後ろに照らされているので、チップは白い正方形として開口部で暗く見えます。
- X、Y、および Z の受託者ゼロを中心にします (図 5b)。X と Y をそれぞれ左右に動かして、上下に合わせます。チップをフォーカスの外に移動して Z を揃えます。
- [受託者ゼロを設定]をクリックします。
- 受託者1(右上、 図5c)と受託者2(左下、 図5d)に対してステップ3.2を繰り返して、すべての受託者をX線ビームに揃えます。
- 「共進システム を作る」を押してコーディネート行列を生成し、これはチップのオフセット、ピッチ、ロール、ヨーを計算し、チップの後続の動きをすべてチップコーディネートフレームで行えるようにします。
- [ ブロック チェック ]をクリックして、各都市ブロックの最初のウェルに XYZ ステージを移動し、チップが適切に位置合わせされていることを視覚的に確認します。
- X線のクロスヘアがアパーチャーと並ぶ場合、チップは整列されます。ない場合は、手順 3.2 ~ 3.3 を繰り返します。
注: (壊れた受託者) の位置合わせが困難な場合は、チップ上の異なる絞りを使用して「アライメントタイプ」プルダウンメニューを使用できます。固定ターゲットデータ収集には、さまざまな種類のチップを使用できます。チップタイプの「チップタイプ」プルダウンメニューを使用して、異なるチップタイプに対応しています。I24で使用される最も一般的なチップタイプは「オックスフォード」と「カスタム」チップです。チップ上の絞りと受託者の数と間隔は、プルダウンメニュー を介して 定義されたチップディクショナリから読み取られます。カスタムチップは、開口部の間隔をオンザフライで定義することを可能にし、これは薄膜シートオンシートまたは結晶がホルダー37を横切ってランダムに配置される他の「チップレス」タイプのチップに特に有用である。新しい Python GUI は、移動オンクリック機能と自動チップアライメントを提供していますが、この原稿の執筆時点での日常的な使用の準備はまだ整っていません。
4. データ収集の設定
注: データ収集の設定は、調査対象のシステムと実行する実験によって異なります。これは、最も単純なSSX実験から低線量構造の収集、レーザーまたは迅速な混合を使用した時間分解実験まで、異なる時間遅延で複数の完全なデータセットを必要とする反応を開始する。データコレクションを設定するには、次のパラメータを定義する必要があります。
- 実験変数: フォルダー、ファイル名、露光時間、送信時間、検出器の距離、および開口部ごとのショット数を必要に応じて入力します。
- チップタイプ:前述のように、チップタイプを使用中のチップに一致させます。
- 薄膜またはチップレスチップを使用している場合は、チップタイプを Noneに設定します。
- GUI の x と y の両方でステップ数とステップサイズを定義します。
- マップの種類を設定する: これにより、データ収集用にチップのサブセクションを選択できます (図 3b)。「なし」は、チップ上のすべての絞りからデータが収集されるということを意味します。「Lite」は、チップ上の選択された都市ブロックからデータが収集されていることを意味します(図3b)。これは、たとえば、チップの領域が不適切にロードされているか、空であることがわかっている場合に役立ちます。「完全」では、個々の絞りをデータ収集に選択できます。この場合、正しいフォーマットのテキスト ファイルを指定する必要があります。詳細とテンプレートは、ビームラインスタッフから入手できます。
- ポンププローブ: ポンププローブ実験の種類と希望の時間遅延を選択します。ポンプのトリガー(通常はLEDまたはレーザー)は、特定の実験に特異的であることが多いので、ここでは詳細には説明しません。
- 「短い」遅延は、ポンプとプローブの間の各開口部に位取りがある場合の実験を指します(すなわち、ポンプ、プローブ、次のサンプルに移動します)。遅延は通常、1 秒または数十ミリ秒の順序で行います。
- 長い遅延は、開口が2回訪問される励起と訪問(EAVA)戦略を指し、訪問の間に定義された時間遅延(すなわち、ポンプ、移動、ポンプ、移動、プローブ、プローブなど)。時間遅延は、X線露光時間(図3c)と計算され、通常は〜1秒以上である。
5. 一般的なデータ収集方法
注: 実行する実験の種類を定義する主要なパラメーターを次に示します。このセクションでは、プロトコル 3 の「データ収集の設定」の他の設定が定義されていることを前提としています。
-
シナリオ 1: 低用量データ収集。サンプルホルダー上の選択された各絞りから単一回折像のコレクション。
- 開口あたりのショット数を 1 に設定します。
- ポンププローブを Noneに設定します。
-
シナリオ 2: 用量シリーズは、サンプルホルダー上の選択された各絞りから順次 n 枚の画像を収集する。チップは各絞りで静止し 、n 個の画像の各セットが収集されます。
- 1 回の開口あたりのショット数を'n'に設定します。 n=5、10、20、または別の倍数が 10 の場合、処理は単純化されることに注意してください。nが5を<場合、トレンドを確立することは困難です。チップをカバーするのに必要な合計時間と 、n が増えたときに生成されるイメージ ファイルの数を考慮すると便利です。
- ポンププローブを Noneに設定します。
-
シナリオ 3: ポンププローブ法
- ポンププローブプルダウンメニューから方法を選択して、レーザー励起コントロールセンターを開きます。
- ポンププローブ実験の場合は、 各絞りオプションでレーザードウェルを 充填します。
- EAVA の場合は、各絞りとX 線露光でレーザードウェルを埋め、[計算] をクリックします。
- 必要な遅延時間に対して、edm GUI ポンプ プローブドロップダウンメニューで適切な 繰り返 しオプションを選択します。
- 実験がプリ照明ステップを必要とする場合 は、レーザー2ドウェル セクションに記入します。
- すべての実験変数が定義された後 、Set パラメータを押して短いリストを作成します。これにより、実験変数がジオブリック コントローラに読み込まれます。これが完了した後 、Start を押すと、検出器が移動し、バックライトが消え、データ収集が開始されます。データ収集を設定する際に、各手順の状態と結果に関するフィードバックを印刷するターミナル ウィンドウを開くと便利です。
6. データ処理
注: 大まかに言えば、データ処理は、フィードバックが必要な緊急度に基づいて3つのグループに分けられます。結晶が存在するかどうか、そして拡散している場合は、どのような数字であるかを示すために、迅速なフィードバックが必要です。これは、データ収集に追い付く必要があります。データのインデックス作成と統合を実行するが、データ収集と同等の時間スケールで実行する必要があります。反射強度を構造解析用の mtz ファイルにマージしてスケーリングし、電子密度マップの生成は最終ステップを表し、まだ遅くなる可能性があります。ここでは、最初の2段階のI24でパイプラインを開始する場合、実験を導くためにリアルタイムのフィードバックが必要であるため、ヒット率やスケーリング統計などの指標は電子密度の検査に代わるものではありません。 クリスタルロで.
- 迅速なフィードバック
- データ処理モジュールをロードするには 、モジュールタイプ i24-ssx を任意のビームラインワークステーションの端末にロードします。
- ヒット検索分析を実行するには 、端末に i24-ssx /path/to/visit/directory/ と入力します。
注 : このウィンドウは 3 つのターミナル ウィンドウを開き、データがディスクに書き込まれると、高度な光源向けの回折統合 (DIALS) 40、41(図 6a) のスポット検索結果をグラフィカルに表示します。- デフォルト設定では、10番目 の画像ごとにスコアを付け、数秒ごとに更新して、計算負荷を最小限に抑えます。
- 上記のコマンドの最後に引数を追加して、デフォルトを変更します。たとえば、'i24-ssx /dls/i24/data/2020/mx12345-6 2' i24-ssxは、他のすべてのイメージでヒット検索を実行します。ただし、これによりクラスター (共有リソース! ) に過度の負担がかかり、処理時間が遅くなる可能性があります。グラフはインデックス化が成功する可能性に基づいて色分けされ、赤は少なくとも15のブラッグスポットが見つかり(インデックス化の可能性が高い)、青色はほとんどまたは有用な回折を示さないことを示す。
- スポットファインダーインターフェイス上のスポットをクリックして、DIALS画像ビューアで興味のある回折画像を表示します。
- インデックス作成と統合フィードバック
注 : dials.still_process機能40,41を使用して、回折データのインデックス作成と統合は DIALS を使用して実行されます。そのため、結晶に関する特定の情報(期待される結晶空間グループ、ユニットセル、実験ジオメトリ)を.philテキストファイルに入れる必要があります。- 端末に モジュールロードダイヤルを入力して、ダイヤルモジュールをロード します。
- データセットの種類dials.still_process /path/to/images/ /pathto/phil- file.phil.すべての処理データセットの進捗状況は、stills_monitorスクリプトを実行してmonitor_stills_process.pyと入力して監視できます (モジュールロード i24-ssxを実行し、ディレクトリを現在の訪問に変更した後) (図 6b)。
- インデックス付き回折データの単位セル分布(図7a)は、 コマンドctbx.xfel.plot_uc_cloud_from_experiments/パス/ダイヤル/出力/*refined.expt combine_all_input=true これは、以前に説明した42のようにユニットセル多形を識別し、解決するのに特に有用である。
- 'Visualzie' この分布が、/訪問/処理/_hit_finding/chip.outコマンド python pacman.py を使用して 2D プロット (図 7b) を生成することによって、固定ターゲット全体で変化する場合、
- dialS コマンドdials.stereographic_projection hkl= 0,0,1 expand_to_P 1 =True /パス/ダイヤル/出力/*refined.exptを使用して、すべてのインデックス付き回折データの立体投影を生成します (図 7c)。
注: ブラヴァイス格子の対称性が完全な双対として表示される空間グループ対称性よりも高い結晶からの静止データを処理する場合、それは一般的な病理です。データ処理アルゴリズムは、この病理43、44、45、46を解決するために進化しましたが、ユーザーはデータを処理しながらこれを念頭に置くべきです。
結果
低線量データ収集とシリーズ
低用量(ステップ5.1:シナリオ1)および用量系列(ステップ5.2:シナリオ2)データをI24で亜硝酸還元酵素マイクロ結晶の銅に収集し、以前に42を公表した。すべてのサンプルは、ステップ1で説明したように調製し、ステップ3、4、および5に従って収集したデータを、ステップ6の方法を用いて処理した。この研究では、迅速な線量系列を、新鮮なサンプルに移る前に、各開口で撮影された20回折像(すなわち、上記のデータ収集GUIでn=20)で収集した。これらのデータから、空間群P213の単位細胞の双型分布を同定した(a=b=c=97.25 Å、a=b=c=96.38Å)。これらの単位細胞多形を同定して分離して処理を行うと、データ品質指標が著しい改善を示し、全データを一緒に処理する際に観察される混合状態ではなく、残基189〜193の間の柔軟なループで2つの異なる構造を明らかにした。このような多形の同定は、小さな構造変化のみが予想される繊細な時間分解構造研究のすべての違いを生み出す可能性がある。さらに、採取された用量シリーズは、結晶中の用量依存単位細胞変化を明らかにし、より大きな単位細胞を支持して集団をシフトする用量の増加を伴った。
同様の作業は、SSX(ステップ5.1:シナリオ1)の低用量構造をSFXを使用して測定されたものと比較するために、ストレプトマイセス・リビダン(DtpAa)から色素型ヘムペルオキシダーゼから用量シリーズ(ステップ5.2:シナリオ2)から採取されたEbrahim et al(2019)47によって行われた。SFXデータは、10フェムト秒のパルス長と30Hzの繰り返しレートでSACLAビームラインBL2 EH3で収集されました。10フェムト秒パルス持続時間は、SFXデータに線量依存効果が存在しないことを保証します。SFXデータをビームラインI24で収集したSSXデータと比較し、各サンプル位置(すなわち、n=10)で10の順次10ミリ秒の露光を測定した。鉄から離れたヘム鉄協調水分子の用量依存性移動が観察されただけでなく、SSX用量系列におけるヘムプロピオン酸基の1つの立体構造変化も観察された。SFX構造のようにダメージを受けにくいわけではないが、用量系列はゼロ用量データセットのFe-O結合長(フェリックヘム)を外挿することを可能にし、これはSFXから得られた値と実験的誤差内で一致した。
ここで説明する逐次結晶学データ収集方法は、例えば室温での嫌気性タンパク質構造の研究に新しいサンプル環境を提供するように容易に適応することができる。Rabe et al 2020 48で概説されているように、無酸素室に異なるシールフィルムを備えた「シートオンシート」サンプル、または「チップレスチップ」をロードすると、二酸素感受性サンプルからの構造データの室温収集が可能になります。
ポンププローブ
以下の代表的な結果はダイヤモンドビームラインI24では収集されなかったが、これらの方法は、iNEXTプログラムの施設間の緊密な連携で開発され、逐次結晶学法の開発における標準的な方法に向けて取り組む。ビームラインI24は、上記のプロトコルで説明した方法を用いてそのような実験を行うために、以下に説明するものに対して同等の収集方法を提供するか、または提供する予定である。
ポンププローブ:急速な混合
急速混合SSXは、固定標的に対する反応を開始するためにピエゾ駆動液滴注入器を用いて、メヘラビら(2019)28によってPETRA IIIのビームラインT-REXXで行われた。 この研究は、GlcNac3をリソチームマイクロ結晶に結合するチップ混合実験に関する原理の証明を提示し、75pL滴の50ms以内に結合がサンプルに適用される。この研究は、7構造の時間分解一連のキシロースイソメラーゼ活性を追跡し、15ms以内のグルコース結合と60秒遅延後のグルコース分子における開いた環の立体構造の形成を実証した。液滴注入の同等のセットアップは、現在、I24で使用するために開発中です。
ポンププローブ:光の活性化
光活性化ポンププローブ連続実験はシュルツら (2018) 49で提示されます。フルオロアセテートデヒドロゲナーゼを光カチズクロ酢酸で浸し、320-360 nmレーザー光でポンピングし、4つの時点(t=0、30、752、および2,052 ms)で構造を生成しました。静止状態構造(0 ms)は、いくつかの水分子を除く空の活性部位と、両タンパク質サブユニットのキャップドメイン間の等価な密度を示す。光活性化後30msおよび752msは、サブユニットAに対するサブユニットBのキャップドメインにおいて電子密度の有意な減少を観察することができる。サブユニットBのキャップドメインにおける電子密度の低下は、サブユニットAの活性部位における752msにおけるフルオロアセテートの出現と一致する。2,052 msの最終データセットは、リガンドのさらなる構造再配置を示し、SN2攻撃に対する正しい形状を促進すると疑われ、反応中の中間状態の潜在的な形成を示す。I24では、フェムト秒パルスを提供する210〜2500 nmから調整可能なポータブルファロスレーザーシステムを光活性化に使用できます。初期の実験は、放出されたリガンドを標的タンパク質に結合した308nmの励起を用いてフォトケージの活性化に成功したことを示した。ビームラインの人員安全システムへの統合を書いている時点で進行中であり、定期的なユーザー実験は2021年初めに予想されます。より強い光パルスが必要な場合の実験では、TTL制御LEDによる光活性化が成功しています。

図1:ダイヤモンド光源での設置機器のサンプル セットアップは真空ポンプ(a)、グローブボックス(b)、加湿器(c)で構成されています。グローブボックス内の真空圧は、サンプルブロック(d)に取り付けられた水晶スラリーを搭載したチップ(d)に取り付けられ、圧力調整器(f、黄色の矢印)を介してストップコック(g、青矢印)に取り付けられた圧力調整器を介して作動する。湿気の多い空気は、加湿器(h)に取り付けられたプラスチックチューブを介してテントに送り込まれ、湿度計(i)を使用して測定される。コンポーネントはクランプスタンド(j)を使用して所定の位置に保持されます。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図2:サンプルホルダー彼らは金属Oリング(a)を使用して、サンプルホルダーをサンプルステージに取り付けるために使用される下半分のスポーツ磁気マウント(d)で、ポリエステルフィルムを上(b)と下半分にクランプします。ポリエステルフィルム(6μm(e)または3μm(f)))とゴム製Oリング(白矢印)は、六六重ボルト(g)で密閉されたサンプルホルダーで結晶を積んだチップが急速に乾燥するのを防ぎます。チップは、dH2O、1 M HCl、およびdH2O(h)の順次15分浴場を使用して洗浄されます。この図の大きなバージョンを表示するには、ここをクリックしてください。
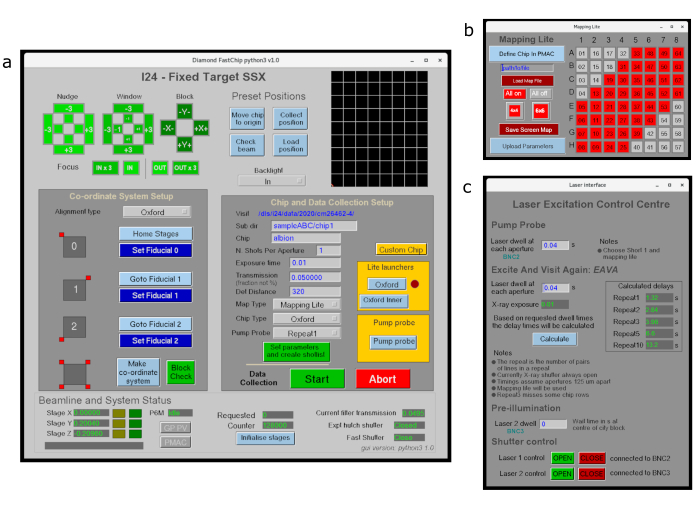
図3:I24での固定ターゲットデータ収集用のデータ収集GUI. (a) チップの整列とデータ収集パラメータの定義に使用されるメインインタフェースを示し、 (b)はデータ収集用チップのサブ領域を定義するために使用されるマッピングライトインタフェースであり、 (c)はレーザー照明のパラメータを定義するためのインタフェースである。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図4:ステップ3、ポイント1で説明したように、チップホルダーをステージに取り付けるプロセス。
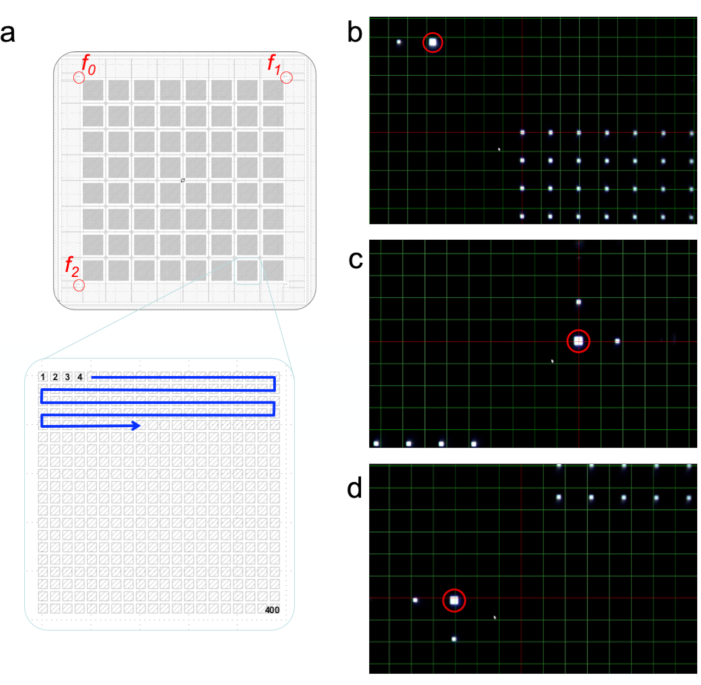
図5:チップアライメント。チップは、チップ上の3つの受託マーカーをクリックして整列します( a )。ビームラインオン軸表示システムを通る受託者0、1、2のビューは、(b)、(c)および(d)に示されています。この図の大きなバージョンを表示するには、ここをクリックしてください。
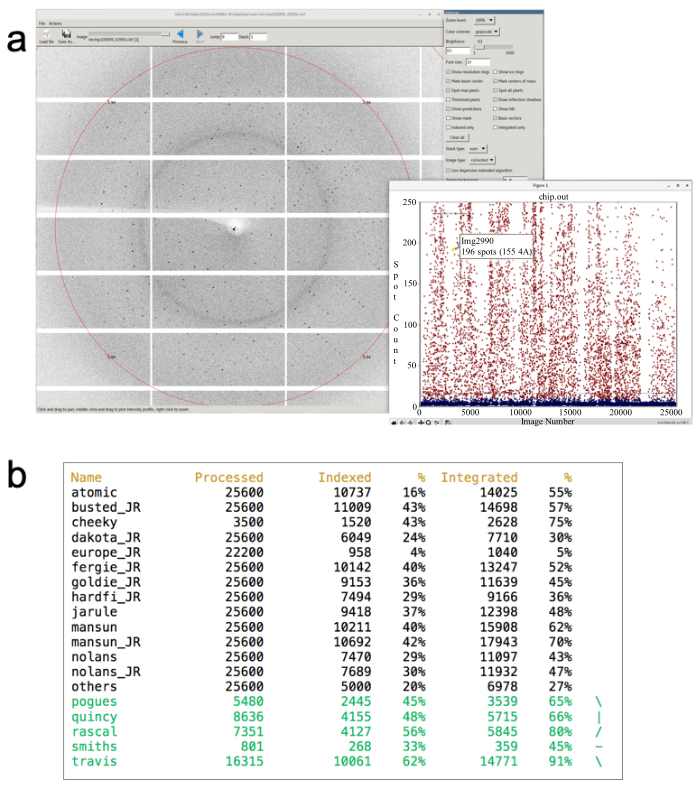
図6: 自動処理結果は、ステップ6.1で説明したように起動された表示です。 更新ヒット率プロットが表示されます(a、inset)。「ヒット」がクリックされた場合は、対応する回折画像がダイヤル画像ビューアに表示されます。現在のデータ収集のヒット率が表示されます (この例では 29.6%)パネル (b) は、リアルタイムで更新された、これまで収集されたデータの現在のインデックス作成と統合率を示すウィンドウの例を示しています。 この図の大きなバージョンを表示するには、ここをクリックしてください。
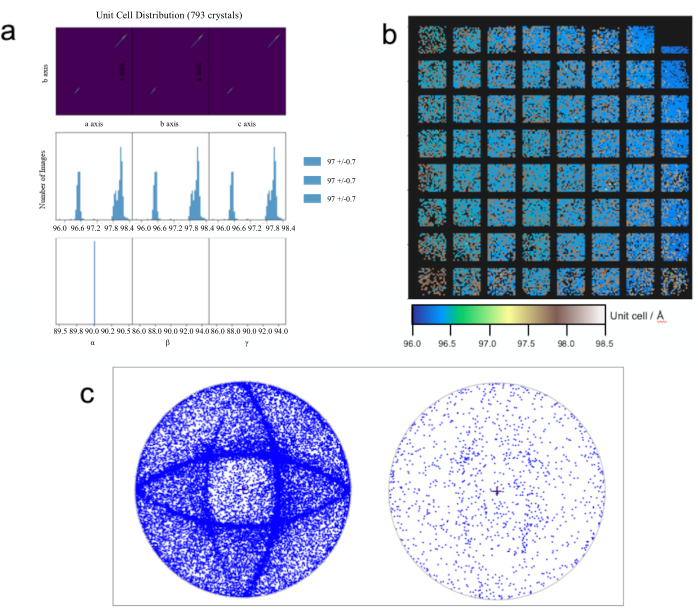
図7:より詳細なデータ分析ユニットセルパラメータの可視化は、多形(a)を明らかにすることができます。平均単位セルパラメータが計算されます。しかし、これはポリモーフの個々の平均にはまだ及びません。小さなデータのサブセットの視覚化(示されたデータは、Ebrahim et al 2019で説明したデータから793個の亜硝酸還元酵素結晶のサブセットである)は、しばしば傾向を明らかにするのに十分である。有用なパラメータの2次元プロットを作成して、今後のデータ収集に対処できるロードまたは脱水効果によって生じる変動を明らかにすることもできます (b)。ステレオグラフィック投影は、負荷プロトコル(c)にフィードバックする優先方向の有無を明らかにすることができます。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
シリアルシンクロトロンデータ収集は、MXビームラインで比較的新しい技術であり、XFELsで現在行われている超高速データ収集と従来のシンクロトロンベースのMXとの間のギャップを埋めています。この原稿は、ビームラインI24、ダイヤモンド光源、低線量、線量シリーズ、および時間分解実験で固定ターゲットシリアルデータを正常に収集する方法の概要を示すことを目的としています。標準的な結晶学と同様に、サンプル調製物は構造の主要なボトルネックの解決である。SSXは変わらないし、十分な量の均質な結晶スラリーの調製は、単一の大きなタンパク質結晶の成長のような研究と洗練の数十年の恩恵をまだ受けていない。しかし、これらのスラリーの調製はこの論文の範囲外であり、他の場所で要約されている36.ここで説明するアプローチの重要なステップは、GUI インターフェイスを使用して利用可能なサンプルを注意深く使用する (ステップ 3) と自動化されたデータ処理パイプライン (ステップ 6) チップの読み込み (ステップ 1) と実験の進め方を通知します。
高速フィードバック パイプラインは、データ収集中に最初のヒット率を評価し、後続のチップ読み込みプロトコルにデータ収集を成功させるための通知を行う強力なツールです。ヒット率が低い(<5%)に直面すると、ユーザーは不完全なデータを収集したり、追加のコレクションでビームタイムを無駄にしたりするリスクがあります。この場合、サンプルをプールし、穏やかな遠心分離によって濃縮し、さらに/またはより大きなボリュームをステップ1.5でロードすることができます。一般的にヒット率が高いほど好ましいが、オーバーロードが同じ井戸内の複数の結晶につながるリターンを減少させる点がある。DIALSは、多格子回折データ50を扱うことができるが、インデックスおよび統合よりも大きな懸念は、結晶のグループ化が正確な時間分解実験のためにレーザー光または急速混合によって結晶の活性化に及ぼす有害な影響である。したがって、時間解決実験の固定ターゲットの過負荷を避けるために、特に注意する必要があります。
インデックス作成と積分処理ステップは、ビーム方向を表す中心十字、個々の格子のhkl 001反射の方向を表す各点、およびビーム軸から90°離れた回転を表す円の外輪を持つプロットを生成します。これは、お使いのクリスタルが優先する向きを持っているかどうかを示します, データの完全性に影響を与える可能性があり、より多くのデータを収集する必要性を示すか、負荷プロトコルを変更します. 図7cの左側のパネルには、HEWL結晶を用いたチップの過負荷の効果が示されています。開口部がより多くの結晶で満たされると、ランダムな向きでベースにくさぶるのではなく、開口部の斜めの壁に固執します。2つの直交楕円は、ビーム方向に〜35°にあるチップの内部壁に横たわっている結晶の結果である。これにより、ロードされる結晶の体積を減らし、ヒット率を下げ、これらの好ましい平面に横たわる結晶の割合を劇的に減らします。
なお、LCP押出機やマイクロ流体チップなど、I24では他のシリアルアプローチが利用可能です。これらは同様の GUI を使用し、同じ処理パイプラインを使用するので、別の手法を使用しても適用可能です。ここで説明する固定ターゲットアプローチを超えて、SSXとSFXの両方に対して多くのシリアルアプローチが存在し、それぞれが実行される実験および実験に使用されるビームラインに応じて、他の方よりも一定の利点を有する。シリアルアプローチが急速に進化しているので、最近のアップデートについてビームラインウェブページ(https://www.diamond.ac.uk/Instruments/Mx/I24.html)をチェックし、ビームタイムを計画する際にできるだけ早い段階でビームラインスタッフと話すことをお勧めします。標準およびシリアル実験用のI24へのアクセスは、使用時点で無料です。英国とEUのユーザーの旅行と宿泊費は、部分的にiNEXTディスカバリーを通じてカバーされています。
謝辞
この研究は、欧州委員会のHorizon 2020プログラムが資金を提供するiNEXT-Discovery(グラント871037)によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| Chip Holders | Custom Built | N/A | In-house custom built metallic chip holders consisting of 2 magnetic base plates, 2 metal rings, and a kinematic mount. |
| Chipless Chip Spacers | SWISCII | N/A | LCP adhesive sheets available as part of the LCP modular range |
| Geobrick LV-IMS-II | Delta Tau | N/A | A multi-axis controller/amplifier with a custom Diamond Light Source hardware configuration |
| Kinematic Mounts | ThorLabs | KB25/M | Square bases with 3 magnets arranged in a triangle affixed to chip holders. |
| KNF Laboport Vacuum Pump | Merck | Z262285-1EA | Solid PTFE vauum pump, 10 l/min pumping speed. |
| Mylar Sheets 6 µm | Fisher Scientific | 15360562 | 300 ft roll of 6 µm thick mylar XRF film by SPEX SamplePrep |
| Mylar Sheets 3 µm | Fisher Scientific | 04-675-4 | 300 ft roll of 3 µm thick mylar XRF film by SPEX SamplePrep |
| Pelco easiGlow Glow Discharge System | Ted Pella, INC. | 91000 | A compact stand alone glow discharge system used to produce hydrophillic surfaces |
| Silicon Chips | University of Southampton | N/A | Custom etched silicon chips with 25,6000 apertures available in a variety of sizes. |
| Translation Stages | Smaract | N/A | XYZ sample stages are a collaborative design by Diamond Light Source and SmarAct, custom-built by SmarAct using three linear translation 50mm travel stages, precise crossed roller guideways, and an integrated sensor with up to 1 nm resolution |
| 1byOne Humidifier (701UK-0003 ) | 1byOne | B01DENO0EQ | Commercially available 1.3 Litre ultrasonic humidifier |
参考文献
- Schlichting, I. Serial femtosecond crystallography: the first five years. IUCrJ. 2 (2), 246-255 (2015).
- Diederichs, K., Wang, M. Serial Synchrotron X-Ray Crystallography (SSX). Protein Crystallography: Methods and Protocols. Wlodawer, A., Dauter, Z., Jaskolski, M. , Springer. New York, NY. 239-272 (2017).
- Pearson, A. R., Mehrabi, P. Serial synchrotron crystallography for time-resolved structural biology. Current Opinion in Structural Biology. 65, 168-174 (2020).
- Chapman, H. N. Structure Determination Using X-Ray Free-Electron Laser Pulses. Protein Crystallography: Methods and Protocols. Wlodawer, A., Dauter, Z., Jaskolski, M. , Springer New York. New York, NY. 295-324 (2017).
- Chavas, L. M., Gumprecht, L., Chapman, H. N. Possibilities for serial femtosecond crystallography sample delivery at future light sources. Structural Dynamics. 2 (4), 041709(2015).
- Dauter, Z., Wlodawer, A. Progress in protein crystallography. Protein & Peptide Letters. 23 (3), 201-210 (2016).
- Owen, R. L., Rudiño-Piñera, E., Garman, E. F. Experimental determination of the radiation dose limit for cryocooled protein crystals. Proceedings of the National Academy of Sciences of the United States of America. 103 (13), 4912-4917 (2006).
- Garman, E. F., Weik, M. X-ray radiation damage to biological samples: recent progress. Journal of Synchrotron Radiation. 26, Pt 4 907-911 (2019).
- Axford, D., et al. In situ macromolecular crystallography using microbeams. Acta crystallographica. Section D, Biological crystallography. 68, Pt 5 592-600 (2012).
- Warren, A. J., Axford, D., Paterson, N. G., Owen, R. L. Exploiting Microbeams for Membrane Protein Structure Determination. Advances in Experimental Medicine and Biology. 922, 105-117 (2016).
- Sanishvili, R., Fischetti, R. F. Applications of X-Ray Micro-Beam for Data Collection. Protein Crystallography: Methods and Protocols. Wlodawer, A., Dauter, Z., Jaskolski, M. , Springer New York. New York, NY. 219-238 (2017).
- Wierman, J. L., et al. Fixed-target serial oscillation crystallography at room temperature. IUCrJ. 6 (2), 305-316 (2019).
- Maeki, M., et al. Room-temperature crystallography using a microfluidic protein crystal array device and its application to protein-ligand complex structure analysis. Chemical Science. 11 (34), 9072-9087 (2020).
- Grunbein, M. L., Nass Kovacs, G. Sample delivery for serial crystallography at free-electron lasers and synchrotrons. Acta Crystallographica Section D. 75 (2), 178-191 (2019).
- Weierstall, U. Liquid sample delivery techniques for serial femtosecond crystallography. Philosophical Transactions of the Royal Society B: Biological Sciences. 369 (1647), 20130337(2014).
- Botha, S., et al. Room-temperature serial crystallography at synchrotron X-ray sources using slowly flowing free-standing high-viscosity microstreams. Acta crystallographica. Section D, Biological crystallography. 71, Pt 2 387-397 (2015).
- Kovácsová, G., et al. Viscous hydrophilic injection matrices for serial crystallography. IUCrJ. 4, Pt 4 400-410 (2017).
- Monteiro, D. C. F., et al. A microfluidic flow-focusing device for low sample consumption serial synchrotron crystallography experiments in liquid flow. Journal of Synchrotron Radiation. 26 (2), 406-412 (2019).
- Monteiro, D. C. F., et al. 3D-MiXD: 3D-printed X-ray-compatible microfluidic devices for rapid, low-consumption serial synchrotron crystallography data collection in flow. IUCrJ. 7, Pt 2 207-219 (2020).
- Mueller, C., et al. Fixed target matrix for femtosecond time-resolved and in situ serial micro-crystallography. Structural Dynamics. 2 (5), 054302(2015).
- Owen, R. L., et al. Low-dose fixed-target serial synchrotron crystallography. Acta Crystallographica Section D: Structural Biology. 73, Pt 4 373-378 (2017).
- Keedy, D. A., et al. Mapping the conformational landscape of a dynamic enzyme by multitemperature and XFEL crystallography. eLife. 4, (2015).
- de la Mora, E., et al. Radiation damage and dose limits in serial synchrotron crystallography at cryo- and room temperatures. Proceedings of the National Academy of Sciences. 117 (8), 4142-4151 (2020).
- Barends, T. R., et al. Direct observation of ultrafast collective motions in CO myoglobin upon ligand dissociation. Science. 350 (6259), 445-450 (2015).
- Pande, K., et al. Femtosecond structural dynamics drives the trans/cis isomerization in photoactive yellow protein. Science. 352 (6286), 725-729 (2016).
- Standfuss, J., Spence, J. Serial crystallography at synchrotrons and X-ray lasers. IUCrJ. 4 (2), 100-101 (2017).
- Grünbein, M. L., et al. Illumination guidelines for ultrafast pump-probe experiments by serial femtosecond crystallography. Nature Methods. 17 (7), 681-684 (2020).
- Mehrabi, P., et al. Liquid application method for time-resolved analyses by serial synchrotron crystallography. Nature Methods. 16 (10), 979-982 (2019).
- Beyerlein, K. R., et al. Mix-and-diffuse serial synchrotron crystallography. IUCrJ. 4, Pt 6 769-777 (2017).
- Schmidt, M. Mix and Inject: Reaction Initiation by Diffusion for Time-Resolved Macromolecular Crystallography. Advances in Condensed Matter Physics. , 167276(2013).
- Kupitz, C., et al. Structural enzymology using X-ray free electron lasers. Structural Dynamics. 4 (4), 044003(2017).
- Stagno, J. R., et al. Structures of riboswitch RNA reaction states by mix-and-inject XFEL serial crystallography. Nature. 541 (7636), 242-246 (2017).
- Shilova, A., et al. Current status and future opportunities for serial crystallography at MAX IV Laboratory. Journal of Synchrotron Radiation. 27 (5), 1095-1102 (2020).
- Huang, C. -Y., et al. In meso in situ serial X-ray crystallography of soluble and membrane proteins. Acta Crystallographica Section D. 71 (6), 1238-1256 (2015).
- Gao, Y., et al. High-speed raster-scanning synchrotron serial microcrystallography with a high-precision piezo-scanner. Journal of Synchrotron Radiation. 25 (5), 1362-1370 (2018).
- Beale, J. H., et al. Successful sample preparation for serial crystallography experiments. Journal of Applied Crystallography. 52, Pt 6 1385-1396 (2019).
- Doak, R. B., et al. Crystallography on a chip - without the chip: sheet-on-sheet sandwich. Acta Crystallographica Section D: Structural Biology. 74, Pt 10 1000-1007 (2018).
- Axford, D., Aller, P., Sanchez-Weatherby, J., Sandy, J. Applications of thin-film sandwich crystallization platforms. Acta Crystallographica Section F: Structural Biology Communications. 72, Pt 4 313-319 (2016).
- Davy, B., et al. Reducing sample consumption for serial crystallography using acoustic drop ejection. Journal of Synchrotron Radiation. 26 (5), 1820-1825 (2019).
- Brewster, A. S., et al. Improving signal strength in serial crystallography with DIALS geometry refinement. Acta Crystallographica Section D. 74 (9), 877-894 (2018).
- Winter, G., et al. DIALS: implementation and evaluation of a new integration package. Acta Crystallographica Section D. 74 (2), 85-97 (2018).
- Ebrahim, A., et al. Resolving polymorphs and radiation-driven effects in microcrystals using fixed-target serial synchrotron crystallography. Acta Crystallographica Section D. 75 (2), 151-159 (2019).
- Brehm, W., Diederichs, K. Breaking the indexing ambiguity in serial crystallography. Acta Crystallographica Section D. 70 (1), 101-109 (2014).
- White, T. Processing serial crystallography data with CrystFEL: a step-by-step guide. Acta Crystallographica Section D. 75 (2), 219-233 (2019).
- Shi, Y., Liu, H. EM-detwin: A Program for Resolving Indexing Ambiguity in Serial Crystallography Using the Expectation-Maximization Algorithm. Crystals. 10 (7), 588(2020).
- Gildea, R. J., Winter, G. Determination of Patterson group symmetry from sparse multi-crystal data sets in the presence of an indexing ambiguity. Acta Crystallographica Section D. 74 (5), 405-410 (2018).
- Ebrahim, A., et al. Dose-resolved serial synchrotron and XFEL structures of radiation-sensitive metalloproteins. IUCrJ. 6 (4), 543-551 (2019).
- Rabe, P., et al. Anaerobic fixed-target serial crystallography. IUCrJ. 7 (5), 901-912 (2020).
- Schulz, E. C., et al. The hit-and-return system enables efficient time-resolved serial synchrotron crystallography. Nature Methods. 15 (11), 901-904 (2018).
- Gildea, R. J., et al. New methods for indexing multi-lattice diffraction data. Acta Crystallographica Section D. 70 (10), 2652-2666 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved