Method Article
Raccolta dati seriali a destinazione fissa presso Diamond Light Source
In questo articolo
Riepilogo
Presentiamo una guida completa alla preparazione del campione target fisso, alla raccolta e all'elaborazione dei dati per la cristallografia seriale di sincrotrone presso Diamond beamline I24.
Abstract
La raccolta di dati seriali è una tecnica relativamente nuova per gli utenti di sincrotrone. Un manuale utente per la raccolta di dati target fissi su I24, Diamond Light Source viene presentato con istruzioni dettagliate passo-passo, figure e video per una raccolta dati fluida.
Introduzione
La cristallografia seriale di sincrotrone (SSX) è un metodo emergente di raccolta dati che è stato ispirato dai laser a elettroni liberi a raggi X (XFEL)1,2,3. In un XFEL, un singolo modello di diffrazione viene registrato da un cristallo proteico solitamente molto piccolo, prima che il cristallo venga distrutto dall'impulso a raggi X estremamente luminoso. Ciò significa, tipicamente, che un nuovo cristallo deve essere introdotto nel fascio di raggi X per ottenere un altro modello di diffrazione4. Questa necessità di ricostituire continuamente i cristalli ha guidato lo sviluppo di molte tecniche di consegna seriale dei campioni5.
Nei sincrotroni, i metodi classici di cristallografia a rotazione (non seriale) sono ampiamente applicati, sfruttando un singolo cristallo di grandi dimensioni che viene ruotato in un fascio di raggi X utilizzando un goniometro per raccogliere un set di dati completo per la soluzione di struttura6. Al fine di aumentare la durata dei cristalli in modo che un set di dati completo possa essere raccolto7,8, e anche per facilitare la spedizione e il trasferimento automatico del campione, i cristalli vengono crioraffreddati a ~ 100 K per la raccolta dei dati. A linee di fascio microfocus intense, le strategie multi-cristallo sono spesso impiegate in quanto i danni da radiazioni possono impedire la raccolta di un set di dati completo da un singolo cristallo9,10,11. Nonostante i limiti imposti dai danni da radiazioni, il numero di cristalli utilizzati rimane relativamente modesto e l'approccio utilizzato è essenzialmente identico all'esperimento del singolo cristallo.
SSX, d'altra parte, utilizza la consegna seriale del campione per ottenere singoli modelli di diffrazione fissa da migliaia di cristalli orientati casualmente per generare un set di dati completo. Si noti che le tecniche seriali che incorporano la rotazione dei cristalli sono in fase di sviluppo12,13 anche se ci concentriamo su approcci fermi, a rotazione zero. Esistono un'ampia varietà di sistemi di erogazione dei campioni con diversi vantaggi e svantaggi14,che vanno dalla fornitura di un flusso di cristalli in un flusso focalizzato / viscoso jet15,16,17, chip microfluidico18,19o cristalli su un bersaglio fisso come un chip di silicio inciso20,21 . Tipicamente, i cristalli sono tenuti a temperatura ambiente, consentendo di osservare una maggiore diversità conformazionale e fornendo un ambiente fisiologicamente più rilevante22. SSX consente la raccolta di set di dati a dosi molto basse23, poiché la dose totale del set di dati equivale a una singola breve esposizione ai raggi X di un cristallo. Un altro grande vantaggio che SSX fornisce è lo studio della dinamica delle proteine attraverso metodi risolti nel tempo, con reazioni innescate dall'esposizione alla luce laser24,25, 26,27o dalla miscelazione di cristalli e ligando/substrato28,29. L'uso di cristalli più piccoli significa che la luce laser può penetrare l'intero cristallo, avviando uniformemente la reazione senza assorbimento multifotone per fornire intermedi di reazione ben definiti per i dati di diffrazione presi in diversi punti temporali27. L'uso di cristalli più grandi e metodi di raccolta dei dati basati sulla rotazione soffre di una profondità di penetrazione laser limitata, attivazione non uniforme o multifotonica, danni da radiazioni e tempo di sovraccarico meccanico all'interno delle scansioni dei dati, con conseguente combinazione di intermedi di reazione che possono rivelarsi difficili o impossibili da interpretare a velocità di reazione più elevate. I cristalli più piccoli forniscono un vantaggio simile negli esperimenti di miscelazione, poiché i ligandi possono diffondersi rapidamente e più uniformemente in tutto il cristallo, consentendo nuovamente di registrare intermedi di reazione definiti a diversi ritarditemporali 30,31,32.
Presso la beamline microfocus I24 di Diamond è possibile eseguire sia esperimenti di rotazione convenzionale che SSX. Qui viene presentato un protocollo completo per la preparazione dei campioni SSX e la raccolta dei dati utilizzando target fissi a I24 e protocolli per l'analisi dei dati seriali a Diamond. Mentre il manoscritto e i video di accompagnamento dovrebbero consentire agli utenti di eseguire un esperimento SSX di successo a I24, va notato che questo è un campo in rapido sviluppo e gli approcci sono in continua evoluzione. Va anche notato che i metodi seriali sono disponibili presso altre sorgenti di sincrotrone, inclusi ma non limitati a Petra III (P14-TREXX), MAX IV (BioMAX)33, SLS (PXI e PXII)34e NSLS (FMX)35. Mentre le specifiche della raccolta e dell'elaborazione dei dati seriali differiranno tra le fonti, i principi fondamentali rimarranno gli stessi. I protocolli sottostanti dovrebbero essere visti come un punto di partenza e un percorso verso il campo base piuttosto che il vertice di ciò che potrebbe essere raggiunto.
Questo protocollo presuppone che gli utenti abbiano un sistema cristallino proteico o a piccole molecole, da cui è stato prodotto un impasto microcristallino dell'ordine di 0,5-2,0 ml con una buona densità di microcristalli per mL. I protocolli per ottenere fanghi di cristallo sono stati descritti in precedenza 36. Sono disponibili molti tipi diversi di target fisso, i più comunemente usati a I24 utilizzano un chip di silicio definito con precisione. Al fine di differenziarsi da altri layout di chip, sotto e nell'interfaccia beamline questo è indicato come un "chip Oxford". Come descritto in precedenza, il layout del chip Oxford comprende 8×8 "blocchi città", ciascuno contenente 20×20 aperture per un totale di 25.600 aperture20,21.
Protocollo
1. Preparazione e caricamento di un chip
NOTA: Il processo avviene all'interno di un ambiente a umidità controllata (Figura 1), in genere tra l'80% e il 90% o superiore di umidità relativa, per evitare che i cristalli proteici si secchino. Una volta caricati e sigillati, i cristalli possono sopravvivere fino a 24 ore. Tuttavia, questo può variare notevolmente tra i sistemi cristallini. All'interno della camera sono necessari una pompa per vuoto a bassa potenza collegata a uno stadio di carico per contenere un chip di silicio (Figura 1), un chip di silicio, un portachip con foglio di poliestere (Figura2 ), una pipetta p200, punte di pipette da 200 μL, pinzette, carta da filtro e il liquame di cristallo proteico.
- Preparare un portachip.
- Tagliare due fogli di foglio di poliestere in quadrati di circa 6 cm x 6 cm.
- Posare i fogli di poliestere sopra le due piastre di base (grande e piccola).
- Fissare i fogli di poliestere in posizione utilizzando gli anelli di tenuta in metallo.
- Tirare con attenzione il foglio di poliestere in eccesso per rimuovere eventuali pieghe per facilitare la visualizzazione e la centratura dei campioni in seguito.
- Selezionare un chip di silicio con aperture di dimensioni appropriate (7-30 μm) rispetto alla dimensione dei cristalli.
- Glow scarica il chip per 25 secondi a 0,39 mBar e utilizzando una corrente di 15 mA per consentire una facile diffusione dei micro cristalli sul chip.
- Posizionare il chip di silicio sulla fase di caricamento del chip utilizzando una pinzetta con le barre rialzate rivolte verso il basso.
- Applicare 200 μL di liquame microcristallino sul lato piatto del truciolo utilizzando una pipetta.
- Stendi il liquame di cristallo per coprire tutti i "blocchi di città" del chip.
- Se il chip è danneggiato, coprire eventuali fori con un piccolo pezzo di lamina di poliestere o la punta della pipetta del filtro per garantire che possa essere applicato un vuoto uniforme.
- Applicare un aspirapolvere delicato fino a quando tutto il liquido in eccesso è stato aspirato attraverso il chip.
- Rimuovere il chip dalla fase di caricamento del chip con una pinzetta.
- Asciugare accuratamente la parte inferiore del chip con carta da filtro per rimuovere il liquido in eccesso.
- Posizionare il chip caricato sulla metà più grande del supporto del chip tra i segni di guida con il lato piatto verso il basso.
- Sigillare il chip posizionando la piccola metà del supporto del chip sulla parte superiore.
- Le due metà del supporto del chip si aggancieranno in posizione. Se la seconda metà non si trova a filo, ruotare il supporto di 180° per allineare correttamente i magneti.
- Avvitare il portachip chiuso con bulloni esagonali per fissare saldamente il chip in posizione.
NOTA: In alternativa, un chip "senza chip" può essere caricato in modo simile, con un volume minore di liquame di cristallo (~ 15 μL) inserito tra i due strati di foglio di poliestere nel portachip 37, oppure un volume più piccolo può essere caricato utilizzando un distanziatore biadesivo di 50 μm di spessore applicato direttamente sul foglio di poliestere come descritto in precedenza 38 . L'uso di distanziatori adesivi consente inoltre di caricare più campioni (o varianti di campioni come i ligandi) su ciascun chip senza chip. Un approccio di carico complementare che sfrutta l'espulsione acustica delle cadute (ADE) per caricare i chip di silicio può essere utilizzato anche a Diamond39. ADE consente di caricare i trucioli utilizzando volumi più piccoli di liquame di cristallo rispetto al caricamento a pipetta. È una tecnica particolarmente utile quando i campioni sono scarsi, anche se la composizione chimica e la viscosità del liquame devono essere prese in considerazione.
2. GUI e configurazione alla beamline
- Eseguire l'allineamento e la configurazione di tutti i chip per la raccolta dei dati tramite una semplice interfaccia utente grafica (GUI) di EPICS Display Manager (EDM) (Figura 3a). Ciò fornisce un'interfaccia point-and-click per la strumentazione beamline e fornisce parametri di input per la raccolta di dati basata su Python. Le finestre secondarie forniscono un controllo aggiuntivo per la raccolta da sottoregioni di un portacampioni (Figura 3b) o esperimenti di pompa-sonda laser/LED (Figura 3c).
3. Allineamento del chip
- Posizionare il chip caricato sullo stadio XYZ in corrispondenza della beamline (mostrato nella Figura 4a)utilizzando i supporti cinematici.
- Fai attenzione a evitare di tirare le tappe lungo la loro direzione di viaggio. I magneti nei supporti cinematici sono abbastanza forti, quindi questo può essere fatto abbastanza facilmente per caso.
- Quando ci si avvicina al supporto, il portachip deve essere tenuto con una leggera angolazione (±30°). Quando i magneti entrano in contatto, consentire al portachip di ruotare parallelamente al pavimento (0°) e il supporto del chip farà clic in posizione (Figura 4b).
- Quando si scarica un chip seguire un percorso inverso. Ruotare e angolare il chip lontano dagli stadi prima di estrarre il portachip.
- Utilizzando il sistema di visualizzazione sull'asse della beamline e la GUI di allineamento del chip, individuare il fiduciario in alto a sinistra del chip. I fiduciali sono tre quadrati, due piccoli e uno grande, ad angolo retto l'uno rispetto all'altro (Figura 5a). Il chip è retroilluminato in modo che il chip appaia scuro con aperture come quadrati bianchi.
- Centro sullo zero fiduciale in X, Y e Z (Figura 5b). Allineare X e Y spostandosi rispettivamente a sinistra/destra e su/giù. Allineare Z spostando il chip in entrata e fuori fuoco.
- Fare clic su Imposta zero fiduciale.
- Ripetere il passaggio 3.2 per quello fiduciario (in alto a destra, Figura 5c)e il due fiduciale (in basso a sinistra, Figura 5d)per allineare tutti i fiduciali con il fascio di raggi X.
- Genera una matrice di coordinate premendo make co-ordinate system, questo calcola l'offset, il beccheggio, il rollio e l'imbardata del chip rispetto agli stadi consentendo di eseguire tutti i movimenti successivi nel telaio di coordinate del chip.
- Fare clic su Block Check per spostare lo stadio XYZ nel primo pozzo di ogni isolato per la conferma visiva che il chip è ben allineato.
- Se il mirino a raggi X si allinea con le aperture, il chip è allineato. In caso contrario, ripetere i passaggi da 3.2 a 3.3.
NOTE: In caso di difficoltà di allineamento (fiduciali rotti), è possibile utilizzare diverse aperture sul chip per l'allineamento utilizzando il menu a discesa "tipo di allineamento". Sono disponibili molti tipi diversi di chip per la raccolta di dati di destinazione fissa. Diversi tipi di chip sono ospitati attraverso l'uso del menu a discesa "tipo di chip". I tipi di chip più comuni utilizzati all'I24 sono i chip "Oxford" e "personalizzati". Il numero e la spaziatura delle aperture e dei fiduciali sul chip vengono letti da un dizionario di chip definito tramite il menu a discesa. Il chip personalizzato consente di definire al volo la spaziatura dell'apertura, il che è particolarmente utile per il foglio su foglio a film sottile o altri chip di tipo "senza chip" in cui i cristalli sono posizionati in modo casuale attraverso il supporto37. Una nuova GUI Python, che offre funzionalità move-on-click e allineamento automatico dei chip, è attualmente in fase di sviluppo, ma non è ancora pronta per l'uso di routine al momento della stesura di questo manoscritto.
4. Impostazione della raccolta dei dati
NOTA: l'impostazione della raccolta dati dipenderà dal sistema studiato e dall'esperimento da eseguire. Questo può variare dal più semplice esperimento SSX, raccogliendo una struttura a basso dosaggio, a un esperimento risolto nel tempo utilizzando laser o miscelazione rapida per avviare una reazione che richiederà più set di dati completi a diversi ritardi temporali. Per impostare una raccolta dati è necessario definire i seguenti parametri.
- Variabili sperimentali: inserisci la cartella, il nome del file, il tempo di esposizione, la trasmissione, la distanza del rilevatore e il numero di scatti per apertura, a seconda dei casi.
- Tipo di chip: come descritto sopra, abbinare il tipo di chip al chip in uso.
- Se viene utilizzato un chip a film sottile o "senza chip", impostare il tipo di chip su Nessuno.
- Definire il numero di passaggi e la dimensione dei passi sia in x che in y nella GUI.
- Impostare il tipo di mappa: questo permette di selezionare le sottosezioni di un chip per la raccolta dei dati (Figura 3b). "Nessuno" significa che i dati vengono raccolti da ogni apertura su un chip. 'Lite' significa che i dati vengono raccolti da blocchi di città selezionati sul chip (Figura 3b). Questo può essere utile se, ad esempio, una regione di un chip è nota per essere mal caricata o vuota. 'Full' consente di selezionare singole aperture per la raccolta dei dati. In questo caso è necessario fornire un file di testo formattato correttamente. I dettagli e un modello possono essere ottenuti dal personale beamline.
- Pompa-sonda: selezionare il tipo di esperimento di sonda della pompa e il ritardo temporale desiderato. L'attivazione della pompa (di solito un LED o un laser) è spesso specifica per un particolare esperimento, quindi non sarà descritta in dettaglio qui.
- I ritardi "brevi" si riferiscono agli esperimenti in cui c'è una dimora in ogni apertura tra la pompa e la sonda (ad esempio, pompa, sonda, "sposta al campione successivo"). I ritardi sono in genere dell'ordine di 1 secondo o decine di millisecondi.
- I ritardi lunghi si riferiscono a una strategia EAVA (excite and visit again), in cui le aperture vengono visitate due volte, con un ritardo temporale definito tra le visite (ad esempio, pompa, spostamento, pompa, spostamento, sonda, spostamento, sonda, sonda, ecc.). Il ritardo temporale viene calcolato e i tempi di esposizione ai raggi X (Figura 3c) ed è in genere ~ 1 secondo o più.
5. Metodi comuni di raccolta dei dati
NOTA: di seguito sono riportati i parametri chiave che definiscono il tipo di esperimento in esecuzione. In questa sezione si presuppone che siano state definite le altre impostazioni del protocollo 3 "Impostazione della raccolta dati".
-
Scenario 1: Raccolta di dati a basso dosaggio. Raccolta di una singola immagine di diffrazione da ogni apertura selezionata sul supporto del campione.
- Impostare il numero di scatti per apertura su 1.
- Impostare la sonda della pompa su Nessuno.
-
Scenario 2: Una serie di dosi, che raccoglie n immagini in sequenza da ogni apertura selezionata sul supporto del campione. Il chip è fermo ad ogni apertura mentre viene raccolto ogni set di n immagini.
- Impostare il numero di scatti per apertura su'n'. Si noti che l'elaborazione è semplificata se n= 5, 10, 20 o un altro multiplo di 10. È difficile stabilire le tendenze se n < 5. È utile considerare il tempo totale necessario per coprire un chip e il numero di file di immagine prodotti quando n viene aumentato.
- Impostare la sonda della pompa su Nessuno.
-
Scenario 3: Metodi pompa-sonda
- Selezionare un metodo dal menu a discesa Sonda pompa per aprire il Centro di controllo dell'eccitazione laser.
- Per un esperimento di sonda a pompa, compilare l'opzione Laser Dwell a ciascuna apertura.
- Per EAVA compilare la dimora laser a ciascuna apertura e esposizione ai raggi X e fare clic su Calcola.
- Selezionare l'opzione Ripeti appropriata nel menu a discesa della sonda della pompa GUI edm per il tempo di ritardo desiderato.
- Se l'esperimento richiede una fase di pre-illuminazione, compilare la sezione Laser 2 Dwell.
- Dopo aver definito tutte le variabili sperimentali premere Imposta parametri e creare una breve lista. Questo carica le variabili sperimentali sul controller geobrick. Al termine, premere Start sposterà il rilevatore all'interno, la retroilluminazione si spegnerà e avvierà la raccolta dei dati. In tutti i punti dell'impostazione della raccolta dei dati è utile avere una finestra terminale aperta in cui viene stampato il feedback sullo stato e l'esito di ciascuno dei passaggi.
6. Trattamento dei dati
NOTA: In generale, l'elaborazione dei dati può essere suddivisa in tre gruppi in base all'urgenza con cui è richiesto il feedback. È necessario un feedback rapido per mostrare se i cristalli sono presenti e diffratti e, in caso affermativo, in quali numeri. Questo dovrebbe tenere il passo con la raccolta dei dati. Esecuzione dell'indicizzazione e dell'integrazione dei dati che possono essere più lente ma dovrebbero comunque essere eseguite su scale temporali comparabili con la raccolta dei dati. La fusione e il ridimensionamento delle intensità di riflessione in un file mtz per la soluzione della struttura e la generazione di mappe di densità elettronica rappresenta il passo finale e può essere ancora più lento. Qui verranno discusse le pipeline di avvio a I24 solo per le prime due fasi, in quanto sono necessarie per il feedback in tempo reale per guidare l'esperimento, anche se si noti che metriche come hit-rate e statistiche di ridimensionamento non sostituiscono l'ispezione della densità degli elettroni, che può fornire l'unica conferma che un ligando si è legato o che si è verificata una reazione, in cristallo.
- Feedback rapido
- Per caricare i moduli di elaborazione dati digitare modulo caricare i24-ssx nel terminale su qualsiasi workstation beamline.
- Per eseguire l'analisi hit-finding digitare i24-ssx /path/to/visit/directory/ nel terminale: i24-ssx /dls/i24/data/2020/mx12345-6/
NOTA: questo apre tre finestre terminali e, una volta che i dati sono stati scritti su disco, una rappresentazione grafica dei risultati di ricerca spot da Diffraction Integration for Advanced Light Sources (DIALS) 40,41(Figura 6a).- Le impostazioni predefinite assegnano un punteggio ogni10a immagine e si aggiornano ogni pochi secondi per ridurre al minimo il carico computazionale.
- Modificare il valore predefinito aggiungendo un argomento alla fine del comando precedente. Ad esempio, 'i24-ssx /dls/i24/data/2020/mx12345-6 2' i24-ssx eseguirebbe hit finding su ogni altra immagine. Tuttavia, ciò può mettere a dura prova il cluster (una risorsa condivisa!) e rallentare i tempi di elaborazione. Il grafico è codificato a colori in base alla probabilità di successo dell'indicizzazione, il rosso mostra che sono stati trovati almeno 15 punti di Bragg (buone possibilità di indicizzazione), il blu mostra poca o nessuna diffrazione utile.
- Visualizza le immagini di diffrazione di interesse nel visualizzatore di immagini DIALS facendo clic sugli spot nell'interfaccia del cercatore di spot.
- Feedback sull'indicizzazione e l'integrazione
NOTA: L'indicizzazione e l'integrazione dei dati di diffrazione vengono eseguite con DIALS utilizzando la funzione dials.still_process 40,41. Pertanto, le informazioni specifiche relative al cristallo (gruppo di spazio cristallino previsto, cella unitaria e geometria di un esperimento) devono essere inserite in un file di testo .phil.- Caricare i moduli DIALS digitando le manopole di caricamento del modulo in un terminale.
- Per iniziare l'elaborazione di un set di dati, digitare dials.still_process /path/to/images/ /pathto/phil- file.phil. L'avanzamento di tutti i set di dati ancora in elaborazione può essere monitorato eseguendo lo script stills_monitor digitando monitor_stills_process.py (dopo aver eseguito il caricamento del modulo i24-ssx e aver modificato la directory nella visita corrente) (Figura 6b).
- La distribuzione delle celle unitarie dei dati di diffrazione indicizzati (Figura 7a) può essere monitorata utilizzando il comando ctbx.xfel.plot_uc_cloud_from_experiments/path/to/dials/output/*refined.expt combine_all_input=true Questo è particolarmente utile per identificare e risolvere i polimorfi delle celle unitarie come discusso in precedenza 42.
- 'Visualzie' se, e come, questa distribuzione varia su un target fisso producendo un grafico 2D (Figura 7b) usando il comando python pacman.py /visit/processing/_hit_finding/chip.out.
- Produrre proiezioni stereografiche di tutti i dati di diffrazione indicizzati (Figura 7c) utilizzando il comando DIALS dials.stereographic_projection hkl= 0,0,1 expand_to_P 1 =True /path/to/dials/output/*refined.expt.
NOTA: È una patologia comune quando si elaborano dati di foto da cristalli in cui la simmetria del reticolo di Bravais è superiore alla simmetria del gruppo spaziale che i dati uniti appaiono come un gemello perfetto. Gli algoritmi di elaborazione dei dati si sono evoluti per risolvere questa patologia 43,44,45,46 ma gli utenti dovrebbero essere consapevoli di questo durante l'elaborazione dei loro dati.
Risultati
Raccolta e serie di dati a basso dosaggio
I dati a basso dosaggio (Fase 5.1: Scenario 1) e le serie di dosi (Fase 5.2: Scenario 2) sono stati raccolti su micro cristalli di nitrito reduttasi di rame a I24 e sono stati pubblicati in precedenza 42. Tutti i campioni sono stati preparati come descritto nella fase 1, i dati raccolti secondo i passaggi 3, 4 e 5 ed elaborati utilizzando i metodi del passaggio 6. In questo lavoro è stata raccolta una serie di dosi rapide con 20 immagini di diffrazione prese ad ogni apertura (cioè n= 20 nella GUI di raccolta dati mostrata sopra) prima di passare a un nuovo campione. Da questi dati è stata identificata una distribuzione bimodale di celle unitarie nel gruppo spaziale P213 (a = b = c = 97,25 Å e a = b = c = 96,38 Å). L'identificazione e la separazione di questi polimorfi unità-cella per l'elaborazione ha mostrato un netto miglioramento degli indicatori di qualità dei dati e ha rivelato due diverse strutture in un ciclo flessibile tra i residui 189-193 invece dello stato misto osservato durante l'elaborazione di tutti i dati insieme. L'identificazione di tali polimorfi potrebbe fare la differenza in un delicato studio strutturale risolto nel tempo in cui sono previsti solo piccoli cambiamenti strutturali. Inoltre, le serie di dosi raccolte hanno rivelato un cambiamento delle cellule unità dose-dipendenti nel cristallo, con un aumento della dose che sposta la popolazione a favore della cellula unitaria più grande.
Un lavoro simile è stato eseguito da Ebrahim et al (2019)47, dove una serie di dosi (Step 5.2: Scenario 2) è stata raccolta da un perossidasi eme di tipo colorante da Streptomyces lividans (DtpAa) per confrontare strutture a basso dosaggio da SSX (Step 5.1: Scenario 1) con quelle misurate nello stesso sistema target fisso utilizzando SFX. I dati SFX sono stati raccolti presso SACLA Beamline BL2 EH3 con una lunghezza dell'impulso di 10 femtosecondi e una frequenza di ripetizione di 30 Hz. La durata dell'impulso di 10 femtosecondi assicura che i dati SFX non presentino effetti dose-dipendenti. I dati SFX sono stati confrontati con i dati SSX raccolti sulla beamline I24, dove sono state misurate 10 esposizioni sequenziali di 10 millisecondi in ogni posizione del campione (cioè n= 10). È stata osservata la migrazione dose-dipendente di una molecola d'acqua coordinata di ferro eme lontano dal ferro, nonché un cambiamento conformazionale in uno dei gruppi eme propionato nella serie di dosi SSX. Sebbene non priva di danni come la struttura SFX, la serie di dosi ha permesso di estrapolare la lunghezza del legame Fe-O di un set di dati a dose zero (eme ferrico), concordando questo all'interno dell'errore sperimentale con il valore ottenuto da SFX.
I metodi di raccolta dei dati di cristallografia seriale qui descritti possono anche essere facilmente adattati per fornire nuovi ambienti campione per, ad esempio, studiare strutture proteiche anaerobiche a temperatura ambiente. Come indicato in Rabe et al 2020 48, il caricamento di un campione "foglio su foglio", o "chip senza chip", con diversi film sigillanti in una camera anerobica consente la raccolta a temperatura ambiente di dati strutturali da campioni sensibili al diossigeno.
Sonda pompa
Sebbene i seguenti risultati rappresentativi non siano stati raccolti presso Diamond Beamline I24, questi metodi sono stati sviluppati in stretta collaborazione tra le strutture del programma iNEXT per lavorare verso metodi standard nello sviluppo del metodo di cristallografia seriale. Beamline I24 offre, o offrirà presto, metodi di raccolta equivalenti a quelli descritti di seguito per eseguire tali esperimenti utilizzando i metodi descritti nei protocolli di cui sopra.
Sonda della pompa: miscelazione rapida
La miscelazione rapida SSX è stata eseguita alla beamline T-REXX a PETRA III da Mehrabi et al (2019) 28 utilizzando un iniettore a goccioline guidato da piezo per avviare reazioni su bersagli fissi. Questo lavoro presenta una prova di principio sull'esperimento di miscelazione dei chip che lega GlcNac3ai microcristalli di lisozima, con legame che si verifica entro 50 ms da una goccia di 75 pL applicata al campione. Questo studio è stato seguito da una serie di 7 strutture risolte nel tempo dell'attività della xilosio isomerasi, dimostrando il legame del glucosio entro 15 ms e la formazione di una conformazione ad anello aperto nella molecola di glucosio dopo un ritardo di 60 secondi. Una configurazione equivalente per l'iniezione di goccioline è attualmente in fase di sviluppo per l'uso su I24.
Pompa-Sonda: Attivazione della luce
Un esperimento seriale pompa-sonda attivata dalla luce è presentato in Schulz et al (2018) 49. La fluoroacetato deidrogenasi è stata imbevuta di fluoroacetato fotoincollato e pompata con luce laser a 320-360 nm per produrre strutture in 4 punti temporali (t = 0, 30, 752 e 2.052 ms). La struttura dello stato di riposo (0 ms) mostra un sito attivo vuoto, ad eccezione di alcune molecole d'acqua, e una densità equivalente tra i domini del cappuccio di entrambe le subunità proteiche. 30 ms e 752 ms dopo l'attivazione della luce si può osservare una significativa riduzione della densità elettronica nel dominio cap della subunità B rispetto alla subunità A. La riduzione della densità elettronica nel dominio cap della subunità B coincide con la comparsa di fluoroacetato nel sito attivo della subunità A a 752 ms. Il set di dati finale a 2.052 ms mostra un ulteriore riarrangiamento strutturale del ligando, sospettato di facilitare la geometria corretta per l'attacco SN2, e la potenziale formazione di uno stato intermedio nella reazione. Su I24, un sistema laser portatile Pharos sintonizzabile da 210-2500 nm che fornisce impulsi di femtosecondi può essere utilizzato per l'attivazione della luce. Gli esperimenti iniziali hanno mostrato l'attivazione riuscita di una foto gabbia utilizzando l'eccitazione a 308 nm con legame del ligando rilasciato alla proteina bersaglio osservata. Al momento della stesura di questo articolo, l'integrazione nel sistema di sicurezza del personale beamline è in corso e gli esperimenti di routine degli utenti sono previsti all'inizio del 2021. Per gli esperimenti in cui sono richiesti impulsi di luce meno intensi, l'attivazione della luce con LED controllati da TTL è stata eseguita con successo.

Figura 1: Apparecchiature di carico dei campioni in posizione presso Diamond Light Source. Il set-up è costituito da una pompa per vuoto (a), glove-box (b) e umidificatore (c). All'interno del vano portaoggetti la pressione del vuoto viene utilizzata per agire su un chip caricato con liquame di cristallo tenuto in un blocco di campione(d)attaccato a un pallone Büchner(e,freccia verde), tramite un regolatore di pressione(f,freccia gialla) attaccato a un rubinetto(g,freccia blu). L'aria umida viene pompata nella tenda tramite tubi di plastica collegati all'umidificatore (h) e misurata utilizzando un igrometro (i). I componenti sono tenuti in posizione utilizzando supporti a morsetto (j). Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Portacampioni. Utilizzano un O-ring metallico ( a ) per bloccareilfilm di poliestere su una metà superiore (b) e inferiore (c), con la metà inferiore che sfoggia supporti magnetici (d) che vengono utilizzati per collegare il portacampioni agli stadi del campione. Il film di poliestere (6 μm (e) o 3 μm (f)) e gli O-ring in gomma (frecce bianche) impediscono a un truciolo caricato di cristalli di asciugarsi rapidamente in un portacampioni che viene chiuso ermeticamente con bulloni esagonali (g). I chip vengono puliti utilizzando bagni sequenziali di 15 minuti in dH2O, 1 M HCl e dH2O(h). Fare clic qui per visualizzare una versione più grande di questa figura.
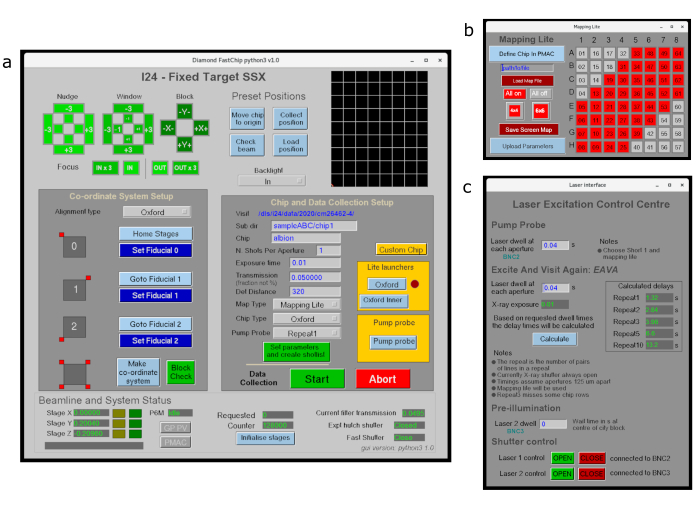
Figura 3: GUI di raccolta dati per la raccolta di dati target fissi a I24. (a ) Mostra l'interfaccia principale utilizzata per allineare i chip e definire i parametri di raccolta dati, (b) è l'interfaccia mapping lite utilizzata per definire le sottoregioni di un chip per la raccolta dei dati e (c) è un'interfaccia per la definizione dei parametri per l'illuminazione laser. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Il processo di montaggio di un portachip sugli stadi come descritto nella fase 3, punto 1. Fare clic qui per visualizzare una versione più grande di questa figura.
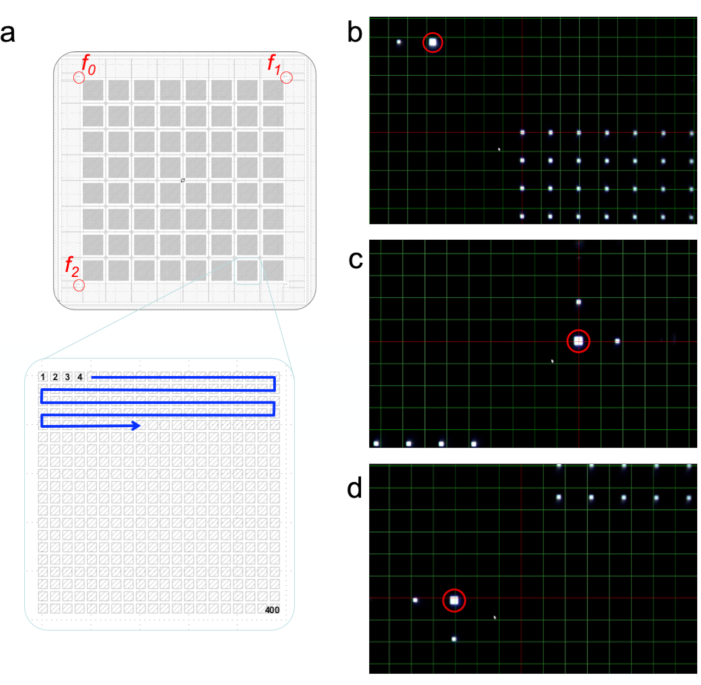
Figura 5: Allineamento dei chip. Un chip viene allineato facendo clic su tre marcatori fiduciali sul chip mostrato in (a). Le viste dei fiduciali 0, 1 e 2 attraverso il sistema di visualizzazione dell'asse della linea di fascio sono mostrate in (b), (c) e (d). Fare clic qui per visualizzare una versione più grande di questa figura.
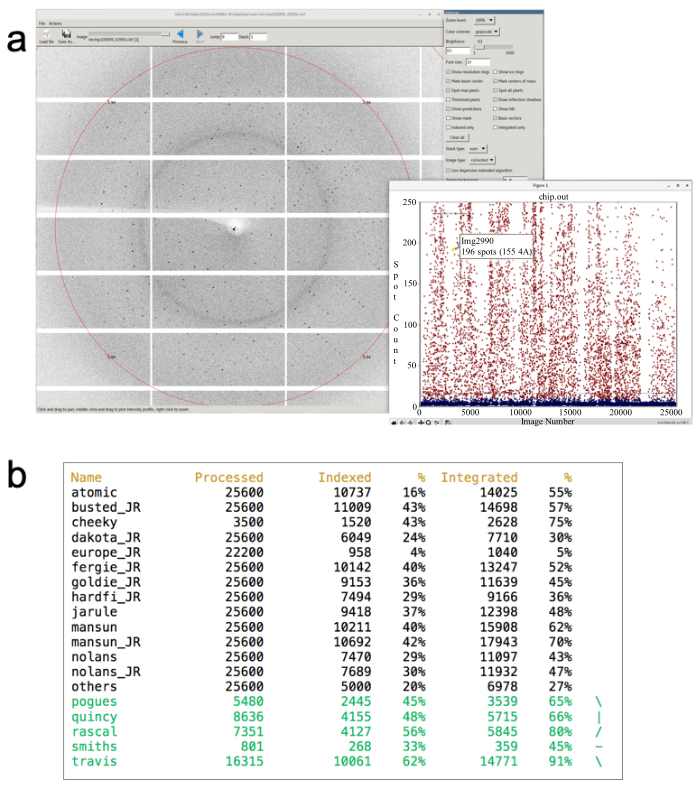
Figura 6: L'elaborazione automatica dei risultati viene visualizzata come descritto nel passaggio 6.1. Viene visualizzato un grafico di hit-rate di aggiornamento(uninserto ).) Se si fa clic su un "colpo" sull'immagine di diffrazione corrispondente, viene visualizzata nel visualizzatore di immagini dei quadranti. Viene mostrato il tasso di hit per la raccolta dati corrente (29,6% in questo esempio). Il pannello(b)mostra un esempio di finestra che mostra gli attuali tassi di indicizzazione e integrazione per i dati raccolti finora durante la visita che si aggiorna in tempo reale. Fare clic qui per visualizzare una versione più grande di questa figura.
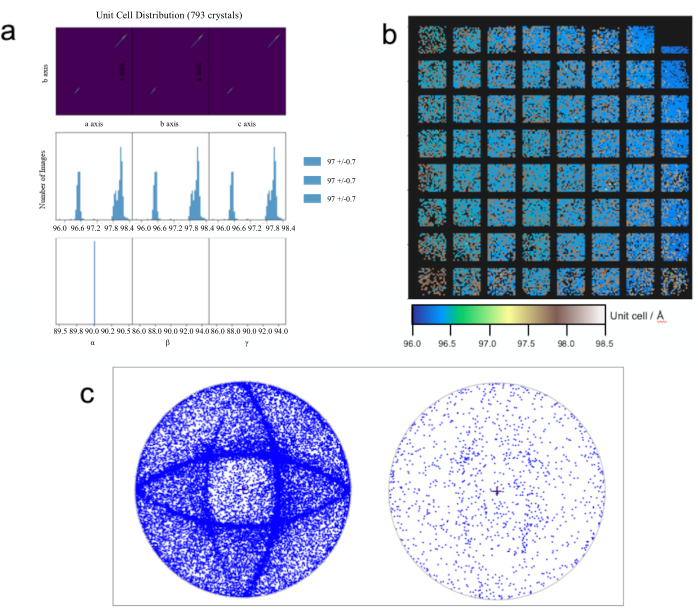
Figura 7: Analisi dei dati più approfondita. La visualizzazione dei parametri delle celle unitarie può rivelare polimorfi (a). Vengono calcolati i parametri medi delle celle unitarie; tuttavia, questo non si estende ancora alle medie individuali per i polimorfi. La visualizzazione di un piccolo sottoinsieme di dati (i dati mostrati sono un sottoinsieme di 793 cristalli di nitrito reduttasi di rame dai dati descritti in Ebrahim et al 2019) è spesso sufficiente per rivelare le tendenze. Grafici 2D di parametri utili possono anche essere prodotti per rivelare variazioni che sorgono a causa di effetti di carico o disidratazione che potrebbero essere affrontati per le prossime raccolte di dati (b). Le proiezioni stereografiche possono rivelare la presenza, o l'assenza, di orientamenti preferiti che alimentano il protocollo di caricamento (c). Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
La raccolta dati di sincrotrone seriale è una tecnica relativamente nuova nelle linee di fascio MX, che colma il divario tra le raccolte di dati ultraveloci attualmente eseguite presso XFEL e MX tradizionali basati su sincrotrone. Questo manoscritto mira a fornire una panoramica di come raccogliere con successo dati seriali target fissi presso la beamline I24, Diamond Light Source per basse dosi, serie di dosi ed esperimenti risolti nel tempo. Come per la cristallografia standard, la preparazione del campione è un importante collo di bottiglia nella soluzione della struttura. SSX non è diverso, e la preparazione di un impasto di cristallo omogeneo in quantità sufficienti non ha ancora beneficiato di diversi decenni di studio e raffinamento come la crescita di singoli grandi cristalli proteici. Tuttavia, la preparazione di questi fanghi esula dallo scopo di questo documento ed è stata riassunta altrove36. Il passaggio critico nell'approccio qui descritto prevede l'uso attento del campione disponibile utilizzando interfacce GUI facili da usare (passaggio 3) e pipeline di elaborazione dati automatizzate (passaggio 6) per informare il caricamento del chip (passaggio 1) e come dovrebbe procedere un esperimento.
La pipeline di feedback veloce è un potente strumento che consente agli utenti di valutare i tassi di hit iniziali durante la raccolta dei dati per informare i successivi protocolli di caricamento dei chip per una raccolta dati di successo. Di fronte a un basso tasso di hit (<5%), gli utenti rischiano di raccogliere dati incompleti e/o sprecare il beamtime con raccolte aggiuntive. In questo caso, il campione potrebbe essere raggruppato, concentrato mediante centrifugazione delicata e/o volumi maggiori potrebbero essere caricati nel passaggio 1.5. Un tasso di successo più elevato è generalmente favorevole, tuttavia, c'è un punto di ritorno decrescente in cui il sovraccarico porta a più cristalli nello stesso pozzo. DIALS è in grado di gestire i dati di diffrazione multi-reticolo50, ma una preoccupazione maggiore rispetto all'indicizzazione e all'integrazione è l'effetto dannoso che il raggruppamento dei cristalli può avere sull'attivazione uniforme dei cristalli tramite luce laser o miscelazione rapida per esperimenti precisi risolti nel tempo. Particolare attenzione dovrebbe quindi essere prestata per evitare di sovraccaricare obiettivi fissi per esperimenti risolti nel tempo.
La fase di elaborazione dell'indicizzazione e dell'integrazione produce un grafico con la croce centrale che rappresenta la direzione del fascio, ogni punto che rappresenta la direzione della riflessione hkl 001 dei singoli reticoli e l'anello esterno del cerchio che rappresenta una rotazione di 90 ° dall'asse del fascio. Questo mostrerà se i tuoi cristalli hanno un orientamento preferito, che può influire sulla completezza dei dati e indicare la necessità di raccogliere più dati o variare il protocollo di caricamento. Nel pannello di sinistra della Figura 7c, viene mostrato l'effetto del sovraccarico di un chip con cristalli HEWL. Man mano che le aperture si riempiono di più cristalli, si attaccano alle pareti angolate delle aperture piuttosto che incunearsi alla base in un orientamento casuale. Le due ellissi ortogonali sono il risultato di cristalli che giacciono sulle pareti interne del chip che si trovano a ~ 35 ° rispetto alla direzione del fascio. Ciò riduce il volume dei cristalli caricati, riduce il tasso di successo e riduce drasticamente la frazione di cristalli che si trovano in questi piani preferiti.
Va notato che altri approcci seriali sono disponibili a I24, come estrusori LCP e chip microfluidici. Questi utilizzano GUI simili e le stesse pipeline di elaborazione, quindi gran parte di quanto sopra rimarrà applicabile anche se viene utilizzata una tecnica diversa. Esistono numerosi approcci seriali sia per SSX che per SFX oltre l'approccio target fisso qui descritto, ognuno ha determinati vantaggi rispetto all'altro a seconda dell'esperimento da eseguire e della beamline utilizzata per l'esperimento. Poiché gli approcci seriali si stanno evolvendo rapidamente, è consigliabile controllare le pagine Web beamline (https://www.diamond.ac.uk/Instruments/Mx/I24.html) per gli aggiornamenti recenti e parlare con il personale beamline il prima possibile durante la pianificazione del beamtime. L'accesso a I24 per esperimenti standard e seriali è gratuito nel punto di utilizzo. Per gli utenti del Regno Unito e dell'UE i costi di viaggio e alloggio sono in parte coperti da iNEXT Discovery.
Riconoscimenti
Questo lavoro è stato supportato dall'iNEXT-Discovery (Grant 871037) finanziato dal programma Horizon 2020 della Commissione Europea.
Materiali
| Name | Company | Catalog Number | Comments |
| Chip Holders | Custom Built | N/A | In-house custom built metallic chip holders consisting of 2 magnetic base plates, 2 metal rings, and a kinematic mount. |
| Chipless Chip Spacers | SWISCII | N/A | LCP adhesive sheets available as part of the LCP modular range |
| Geobrick LV-IMS-II | Delta Tau | N/A | A multi-axis controller/amplifier with a custom Diamond Light Source hardware configuration |
| Kinematic Mounts | ThorLabs | KB25/M | Square bases with 3 magnets arranged in a triangle affixed to chip holders. |
| KNF Laboport Vacuum Pump | Merck | Z262285-1EA | Solid PTFE vauum pump, 10 l/min pumping speed. |
| Mylar Sheets 6 µm | Fisher Scientific | 15360562 | 300 ft roll of 6 µm thick mylar XRF film by SPEX SamplePrep |
| Mylar Sheets 3 µm | Fisher Scientific | 04-675-4 | 300 ft roll of 3 µm thick mylar XRF film by SPEX SamplePrep |
| Pelco easiGlow Glow Discharge System | Ted Pella, INC. | 91000 | A compact stand alone glow discharge system used to produce hydrophillic surfaces |
| Silicon Chips | University of Southampton | N/A | Custom etched silicon chips with 25,6000 apertures available in a variety of sizes. |
| Translation Stages | Smaract | N/A | XYZ sample stages are a collaborative design by Diamond Light Source and SmarAct, custom-built by SmarAct using three linear translation 50mm travel stages, precise crossed roller guideways, and an integrated sensor with up to 1 nm resolution |
| 1byOne Humidifier (701UK-0003 ) | 1byOne | B01DENO0EQ | Commercially available 1.3 Litre ultrasonic humidifier |
Riferimenti
- Schlichting, I. Serial femtosecond crystallography: the first five years. IUCrJ. 2 (2), 246-255 (2015).
- Diederichs, K., Wang, M. Serial Synchrotron X-Ray Crystallography (SSX). Protein Crystallography: Methods and Protocols. Wlodawer, A., Dauter, Z., Jaskolski, M. , Springer. New York, NY. 239-272 (2017).
- Pearson, A. R., Mehrabi, P. Serial synchrotron crystallography for time-resolved structural biology. Current Opinion in Structural Biology. 65, 168-174 (2020).
- Chapman, H. N. Structure Determination Using X-Ray Free-Electron Laser Pulses. Protein Crystallography: Methods and Protocols. Wlodawer, A., Dauter, Z., Jaskolski, M. , Springer New York. New York, NY. 295-324 (2017).
- Chavas, L. M., Gumprecht, L., Chapman, H. N. Possibilities for serial femtosecond crystallography sample delivery at future light sources. Structural Dynamics. 2 (4), 041709(2015).
- Dauter, Z., Wlodawer, A. Progress in protein crystallography. Protein & Peptide Letters. 23 (3), 201-210 (2016).
- Owen, R. L., Rudiño-Piñera, E., Garman, E. F. Experimental determination of the radiation dose limit for cryocooled protein crystals. Proceedings of the National Academy of Sciences of the United States of America. 103 (13), 4912-4917 (2006).
- Garman, E. F., Weik, M. X-ray radiation damage to biological samples: recent progress. Journal of Synchrotron Radiation. 26, Pt 4 907-911 (2019).
- Axford, D., et al. In situ macromolecular crystallography using microbeams. Acta crystallographica. Section D, Biological crystallography. 68, Pt 5 592-600 (2012).
- Warren, A. J., Axford, D., Paterson, N. G., Owen, R. L. Exploiting Microbeams for Membrane Protein Structure Determination. Advances in Experimental Medicine and Biology. 922, 105-117 (2016).
- Sanishvili, R., Fischetti, R. F. Applications of X-Ray Micro-Beam for Data Collection. Protein Crystallography: Methods and Protocols. Wlodawer, A., Dauter, Z., Jaskolski, M. , Springer New York. New York, NY. 219-238 (2017).
- Wierman, J. L., et al. Fixed-target serial oscillation crystallography at room temperature. IUCrJ. 6 (2), 305-316 (2019).
- Maeki, M., et al. Room-temperature crystallography using a microfluidic protein crystal array device and its application to protein-ligand complex structure analysis. Chemical Science. 11 (34), 9072-9087 (2020).
- Grunbein, M. L., Nass Kovacs, G. Sample delivery for serial crystallography at free-electron lasers and synchrotrons. Acta Crystallographica Section D. 75 (2), 178-191 (2019).
- Weierstall, U. Liquid sample delivery techniques for serial femtosecond crystallography. Philosophical Transactions of the Royal Society B: Biological Sciences. 369 (1647), 20130337(2014).
- Botha, S., et al. Room-temperature serial crystallography at synchrotron X-ray sources using slowly flowing free-standing high-viscosity microstreams. Acta crystallographica. Section D, Biological crystallography. 71, Pt 2 387-397 (2015).
- Kovácsová, G., et al. Viscous hydrophilic injection matrices for serial crystallography. IUCrJ. 4, Pt 4 400-410 (2017).
- Monteiro, D. C. F., et al. A microfluidic flow-focusing device for low sample consumption serial synchrotron crystallography experiments in liquid flow. Journal of Synchrotron Radiation. 26 (2), 406-412 (2019).
- Monteiro, D. C. F., et al. 3D-MiXD: 3D-printed X-ray-compatible microfluidic devices for rapid, low-consumption serial synchrotron crystallography data collection in flow. IUCrJ. 7, Pt 2 207-219 (2020).
- Mueller, C., et al. Fixed target matrix for femtosecond time-resolved and in situ serial micro-crystallography. Structural Dynamics. 2 (5), 054302(2015).
- Owen, R. L., et al. Low-dose fixed-target serial synchrotron crystallography. Acta Crystallographica Section D: Structural Biology. 73, Pt 4 373-378 (2017).
- Keedy, D. A., et al. Mapping the conformational landscape of a dynamic enzyme by multitemperature and XFEL crystallography. eLife. 4, (2015).
- de la Mora, E., et al. Radiation damage and dose limits in serial synchrotron crystallography at cryo- and room temperatures. Proceedings of the National Academy of Sciences. 117 (8), 4142-4151 (2020).
- Barends, T. R., et al. Direct observation of ultrafast collective motions in CO myoglobin upon ligand dissociation. Science. 350 (6259), 445-450 (2015).
- Pande, K., et al. Femtosecond structural dynamics drives the trans/cis isomerization in photoactive yellow protein. Science. 352 (6286), 725-729 (2016).
- Standfuss, J., Spence, J. Serial crystallography at synchrotrons and X-ray lasers. IUCrJ. 4 (2), 100-101 (2017).
- Grünbein, M. L., et al. Illumination guidelines for ultrafast pump-probe experiments by serial femtosecond crystallography. Nature Methods. 17 (7), 681-684 (2020).
- Mehrabi, P., et al. Liquid application method for time-resolved analyses by serial synchrotron crystallography. Nature Methods. 16 (10), 979-982 (2019).
- Beyerlein, K. R., et al. Mix-and-diffuse serial synchrotron crystallography. IUCrJ. 4, Pt 6 769-777 (2017).
- Schmidt, M. Mix and Inject: Reaction Initiation by Diffusion for Time-Resolved Macromolecular Crystallography. Advances in Condensed Matter Physics. , 167276(2013).
- Kupitz, C., et al. Structural enzymology using X-ray free electron lasers. Structural Dynamics. 4 (4), 044003(2017).
- Stagno, J. R., et al. Structures of riboswitch RNA reaction states by mix-and-inject XFEL serial crystallography. Nature. 541 (7636), 242-246 (2017).
- Shilova, A., et al. Current status and future opportunities for serial crystallography at MAX IV Laboratory. Journal of Synchrotron Radiation. 27 (5), 1095-1102 (2020).
- Huang, C. -Y., et al. In meso in situ serial X-ray crystallography of soluble and membrane proteins. Acta Crystallographica Section D. 71 (6), 1238-1256 (2015).
- Gao, Y., et al. High-speed raster-scanning synchrotron serial microcrystallography with a high-precision piezo-scanner. Journal of Synchrotron Radiation. 25 (5), 1362-1370 (2018).
- Beale, J. H., et al. Successful sample preparation for serial crystallography experiments. Journal of Applied Crystallography. 52, Pt 6 1385-1396 (2019).
- Doak, R. B., et al. Crystallography on a chip - without the chip: sheet-on-sheet sandwich. Acta Crystallographica Section D: Structural Biology. 74, Pt 10 1000-1007 (2018).
- Axford, D., Aller, P., Sanchez-Weatherby, J., Sandy, J. Applications of thin-film sandwich crystallization platforms. Acta Crystallographica Section F: Structural Biology Communications. 72, Pt 4 313-319 (2016).
- Davy, B., et al. Reducing sample consumption for serial crystallography using acoustic drop ejection. Journal of Synchrotron Radiation. 26 (5), 1820-1825 (2019).
- Brewster, A. S., et al. Improving signal strength in serial crystallography with DIALS geometry refinement. Acta Crystallographica Section D. 74 (9), 877-894 (2018).
- Winter, G., et al. DIALS: implementation and evaluation of a new integration package. Acta Crystallographica Section D. 74 (2), 85-97 (2018).
- Ebrahim, A., et al. Resolving polymorphs and radiation-driven effects in microcrystals using fixed-target serial synchrotron crystallography. Acta Crystallographica Section D. 75 (2), 151-159 (2019).
- Brehm, W., Diederichs, K. Breaking the indexing ambiguity in serial crystallography. Acta Crystallographica Section D. 70 (1), 101-109 (2014).
- White, T. Processing serial crystallography data with CrystFEL: a step-by-step guide. Acta Crystallographica Section D. 75 (2), 219-233 (2019).
- Shi, Y., Liu, H. EM-detwin: A Program for Resolving Indexing Ambiguity in Serial Crystallography Using the Expectation-Maximization Algorithm. Crystals. 10 (7), 588(2020).
- Gildea, R. J., Winter, G. Determination of Patterson group symmetry from sparse multi-crystal data sets in the presence of an indexing ambiguity. Acta Crystallographica Section D. 74 (5), 405-410 (2018).
- Ebrahim, A., et al. Dose-resolved serial synchrotron and XFEL structures of radiation-sensitive metalloproteins. IUCrJ. 6 (4), 543-551 (2019).
- Rabe, P., et al. Anaerobic fixed-target serial crystallography. IUCrJ. 7 (5), 901-912 (2020).
- Schulz, E. C., et al. The hit-and-return system enables efficient time-resolved serial synchrotron crystallography. Nature Methods. 15 (11), 901-904 (2018).
- Gildea, R. J., et al. New methods for indexing multi-lattice diffraction data. Acta Crystallographica Section D. 70 (10), 2652-2666 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon