Method Article
組織と尿からのヒト腎臓結管状突起の生成
要約
ヒト腎臓結管状尿細管培養は、腎臓生理学と疾患を研究するための貴重な インビトロ モデルを表す。尿管は、腎臓組織(健康および罹患)と尿から確立することができ、後者は容易に得られ、侵襲性の低い研究材料源を表す。
要約
成人幹細胞(ASC)由来のヒト腎臓上皮オルガノイド、または管状突起は、高効率で健康で病気の腎臓上皮から確立することができる。正常な腎臓結管状突起は、その起源の組織の多くの側面を再現する。彼らは明確なネフロンセグメントを表しています - 特に近位細管、ヘンレのループ、遠位細管、および収集ダクト - と正常な腎臓生理学を研究するために使用することができます。さらに、尿細管技術は、例 えば、感染症および癌に対する疾患モデリングを容易にする。しかし、尿細管発生のための腎臓上皮細胞の取得は、残った外科材料(部分)腎摘出術または針の生検に依存する。尿から尿細管を成長させる能力は、健康な腎臓上皮細胞の代替、より侵襲性の低い供給源を提供するであろう。以前は、尿細管培養物が、採取した尿の数ミリリットルのみから正常に生成できることが示されています。この記事では、組織および尿サンプルから ASC 由来のヒト腎臓結節培養物を生成および伝播するためのプロトコルについて説明します。
概要
腎臓は体液のバランスを全身的に制御する機能を果たす。それらの生理機能の障害は、糖尿病、高血圧、および薬物誘発毒性1を含む異なる要因によって引き起こされる可能性がある。腎疾患の発症だけでなく、正常な腎臓生理学をよりよく理解するためには、代表的な前臨床モデルの使用が重要です。近年、いわゆるオルガノイド技術2に基づいていくつかのインビトロ腎臓モデルが生成されている。オルガノイドは、それらが起源とする組織(正常または病気)の形態および生理学に似た三次元の多細胞構造である。それらは、多能性(PSC)または成体幹細胞(ASC)から生成することができ、それぞれが独自の特性と用途を持っています。
PSC由来の腎臓オルガノイドは、腎生年月日3、4、5を模倣する。それらはまた強制脱分化(誘発多能性またはiPSC)によって患者由来のコミットされた細胞から確立することができる。iPSCは、特定の成長因子カクテルにタイムリーに曝露することによって、腎臓の機能単位である腎細胞の異なる細胞タイプに分化することができます。皿の中でかなり完全なミニオルガンを作成しながら、その確立は時間のかかるままであり、再プログラミングプロトコルのために、iPSCは望ましくない遺伝的不安定性の影響を受けやすい6。さらに、iPSCオルガノイドは、成人腎臓細胞に完全に成熟することができないので、初期の発達段階7で胎児腎臓に似た転写体プロファイルを明らかにする。
ASC由来のヒト腎臓結管状管状突起は、成人腎臓上皮の再生を再現することが示されている。それらは主に、異なるトランスポータータンパク質8、9、10の発現によって確認されるように、近位管、ヘンレのループ、遠位管、および集集ダクトを表す。尿細管培養プロトコルは、安定したゲノムを保持しながら、患者由来の腎臓組織の急速な拡大を可能にする。研究アプリケーションには、正常な腎臓生理学、腎毒性、薬物検査、ならびに疾患モデリング8、10、11、12の研究が含まれます。管状体を含む患者由来のオルガノイド培養物の確立の潜在的な制限は、新鮮な組織の利用可能性である。しかしながら、いくつかの報告によると、尿は腎臓上皮細胞の供給源となり、それによって、管状体培養8、13、14の患者材料を得るためのはるかに単純で侵襲性の低い戦略を提供する。実際、尿管状の尿8から尿を成長させることができることが最近示されている。本稿では、腎臓組織および尿からの尿管状培養物の確立および維持について述べている。
プロトコル
注:本明細書に記載された実験は、エラスムス医療センター(オランダロッテルダム)とマキシマ小児腫瘍学センター(オランダ、ユトレヒト)の医療倫理委員会によって承認されました。
1. 組織からのヒト腎臓結管状の生成
- 料
- プレウォームマルチウェル組織培養プレート(6、12および24ウェル)を一晩で37°Cで行う。
- 基礎培地(AdDF+++)を1x L-アラニン/L-グルタミンサプリメント、1%w/v 4-(2-ヒドロキセチル)-1-ピペラジンエタンスルホン酸(HEPES、10 mM)、および1%ペニシリン/ストレプトマイシン抗生物質を高度DMEM/F12に加えて調製します。
- 1.5%B27サプリメントを添加することにより培養培地を調製し、10%R-スポンディンコンディション培地、 表皮成長因子(50 ng/mL)、線維芽細胞増殖因子-10(100 ng/mL)、N-アセチルシステイン(1.25mM)、ローキナーゼ阻害剤Y-27632(10μM)、広域抗生物質(0.1mg/mL)、A83-01(5μM)からAdDF++++++++ 使用前に37°Cまで温める。
- 4°Cでアリコートを一晩解凍して、元素膜抽出物(BME)を調製する。 手順中にBMEを氷の上に置いてください。
- コラゲターゼをAdDF+++で1mg/mLの最終濃度に希釈し、10 μM Y-27632を加えてコラゲターゼ溶液を調製します。37°Cまで温める。
- 10センチペトリ料理、メス、ピンセットを用意します。紫外線ランプを20分間塗布し、消毒剤、デミ水、70%のv/vエタノールで洗浄を行い、調理器具を消毒します。調理器具を空気乾燥させます。
- 水平シェーカーを37°Cに予熱する。
- プロシージャ
- AdDF+++培地の30-40 mLで満たされた50 mLの管の腎臓組織を集める。10cmのペトリ皿に、培地の1mL程度に組織片を入れます。メスを使用して、組織を約1mm3サイズにミンチします(図1A)。
- 鉗子およびメスを使用して15 mLの管にひき肉のティッシュを移す。5 mLの AdDF+++をペトリ皿に加え、洗浄し、10 mLの滅菌ピペットで培地を回収します。すべての内容物を同じチューブに移します。
- 室温で5分間300×gで遠心分離機を出し、上清を取り除きます。15 mL チューブに3~4 mLのコラゲナーゼ溶液を加えます。37 °Cの水平シェーカーセットと250rpmの速度にチューブを移動します。
- インキュベーションの最初の15分後、サンプルを確認し、チューブを激しく振ります。懸濁液が均質で、ほとんどの組織片が消失するまで繰り返し、最大インキュベーション時間は45〜60分である(図1B)。
- チューブをAdDF+++で埋め、チューブを5-10倍に反転して混ぜます。4°Cで5分間300×gで遠心分離機を出し、上清を取り除く。 ペレットが赤の場合は、ステップ 1.2.6 に進みます。それ以外の場合は、ステップ 1.2.8 に進みます。
- 細胞ペレットの上に赤血球のリシスバッファー( 材料表を参照)の1 mLを加えます。チューブを軽くタップしてペレットを再中断します(ピペットチップで再中断しないでください)。室温で5分間インキュベートします。
- チューブを AdDF+++ で埋めます。4°Cで5分間300×gで遠心分離機を出し、上清を取り除く。 血液細胞がまだ見える場合は、ステップ1.2.6から始めて、もう一度手順を繰り返します。それ以外の場合は、ステップ 1.2.8 に進みます。
- プロトコルのこの時点で組織の塊が見える場合は、ステップ1.2.8に進みます。それ以外の場合は、ステップ1.2.9でペレット体積の測定を進める。チューブに5 mLのAdDF+++を加え、10 mLの滅菌ピペットで再中断します。50 mLチューブに置かれた100 μmのナイロンセルストレーナーでサスペンションをフィルターします。
- 濾過した懸濁液を新しい15 mLチューブに移します。4°Cで5分間300×gで遠心分離機を出し、上清を取り除く。 p1000ピペットを使用して細胞ペレットの体積を測定します。気泡を作成せずに再中断するために慎重に上下にピペット。チューブを氷に1分間移します。
- ペレットに70~75%のBMEを加えます。p1000またはp200ピペットを使用して再中断し、プレウォームされたマルチウェル細胞培養プレート(6、12、または24ウェル、総めっき量(<100 μL、24ウェル、100-200 μL、12ウェル、>200 μL、6ウェル)にプレート15 μLの液滴を使用して再中断します。
- プレートを裏返しにし、プレートを37°Cで15〜20分間インキュベーターで休ませる(図1C)。温かくした培養培地を加え、培養物を検査する(図1C、D)。
2. 尿からのヒト腎臓結管の生成
注:尿は細胞にとって敵対的な環境です。尿サンプルは、できるだけ早く、好ましくは排泄から4時間以内に処理されることが、このプロトコルの正常な実行のために重要である。その間、尿サンプルは4°Cで保存する必要があります。
- 料
- プレウォームマルチウェル組織培養プレート(6、12および24ウェル)を一晩で37°Cで行う。
- 洗浄媒体を準備する: AdDF+++は広域スペクトル抗生物質(0.1 mg/mL)および10 μM Y-27632を添加した。
- 上述したように培地を調製する。使用前に37°Cでウォームアップしてください。
- BME マトリックスを準備します。手順中に氷の上に保管してください。
- プロシージャ
- 尿サンプルを採取し、それを50mLチューブに均等に分割する(図2A-I)。各チューブに10〜20mLの洗浄媒体を加えます。4°Cで5分間300×gの遠心分離機(図2A-II)、上清を慎重に取り除きます。
- 各チューブに10mLの洗浄媒体を加えます。10 mLの滅菌ピペットを使用してペレットを慎重に再懸濁します。4°Cで5分間300xgの遠心分離機(図2A-III)、上清を慎重に取り除きます。
- ペレットを再懸濁し、すべてのチューブの内容物を15 mLチューブに移します。チューブに洗浄媒体を充填します。4°Cで5分間300xgの遠心分離機(図2A-IV)、上清を取り除く。
- p1000ピペットを使用して細胞ペレットの体積を測定します。気泡を作成せずに再中断するために慎重に上下にピペット。チューブを氷に1分間移します。
- ペレットにBMEの70〜75%の体積を加えます。p1000またはp200ピペットを使用して再中断し、プレウォームされたマルチウェル細胞培養プレート(6、12、または24ウェル、総めっき量(<100 μL、24ウェル、100-200 μL、12ウェル、>200 μL、6ウェル)にプレート15 μLの液滴を使用して再中断します。
- 37°Cで15〜20分間、インキュベーターでプレートを逆さまにします。 温め込まれた培養培地を加え、培養物を検査する(図2B)。
3. チューブロイド培養の拡大
注:チューブロイド培養は、1:2-1:3の分割比で、およそ1〜2週間ごとに通過することができます。これらは通常、ライン固有のバリエーションで、約15の通路のために拡張することができます。
- 料
- プレウォームマルチウェル組織培養プレート(6、12および24ウェル)を一晩で37°Cで行う。
- 基礎培地 (AdDF+++) を準備し、手順中に氷の上に保管します。
- 先に述べたように培地を調製する。使用前に37°Cまで温める。
- BMEマトリックスを準備し、手順中に氷の上に保ちます。
- Y-27632を濃度10μMに添加してトリプシン交換剤を調製し、使用前に37°Cまで温めます。
- フィルターなしの p10 ヒントをオートクレーブします。
- 遠心分離機を4°Cに冷却します。
- プロシージャ
- ウェルに存在する培地を使用してp1000ピペットで上下にピペットを入れ、管状体を含む液滴を破壊する。先端を使用して井戸の底を削り取り、底部に取り付けられたすべてのセルを収集します。
- 15 mLチューブに入った内容物を集めろ。10 mL の AdDF+++ を追加します。4°Cで5分間 300xg で遠心分離機を、上清を取り除く。
- ペレットのサイズに基づいて、10 μM Y-27632を補ったトリプシン交換剤を添加します。細管を含むBME液滴の200 μLに対して1mLのトリプシン交換剤を使用してください。37°Cで5分間インキュベートします。
- チップ付きのp1000ピペットを使用し、1000 μLチップの上に非濾過済みの無菌p10チップを挿入します。ピペットは20〜30倍の上下に、オルガノイドを機械的に破壊する。
- 顕微鏡下で、多くの無傷のオルガノイドがまだチューブに存在しているかどうかを確認してください(図3A)。この時点でインタクトオルガノイドの10%以上が存在する場合、ステップ3.2.3の5分間のインキュベーションから、ステップ3.2.5でインタクトオルガロイドの顕微鏡観察までもう一度繰り返す。それ以外の場合は、ステップ 3.2.6 に進みます。
- チューブを AdDF+++ で埋めます。遠心分離機300×gで5分間4°Cで5分間、上清を取り除く。p1000ピペットを使用して細胞ペレットの体積を測定します。気泡を作成せずに再中断するために慎重に上下にピペット。チューブを氷に1分間移します。
- ペレットに70~75%のBMEを加えます。p1000またはp200ピペットを使用して再中断し、プレウォームされたマルチウェル細胞培養プレート(6、12、または24ウェル、総めっき量(<100 μL、24ウェル、100-200 μL、12ウェル、>200 μL、6ウェル)にプレート15 μLの液滴を使用して再中断します。
- プレートを裏返しにし、プレートを37°Cで15〜20分間保育器で休ませます。 温かくした培養培地を加え、培養物を検査する(図3B)。
結果
腎臓組織の場合、チューブロイド構造は通常、確立後7日以内に現れる(図1D)。最初の 7 日以内に明らかな成長が欠如している場合、プロトコルの結果が失敗したことを示しています。一般的に、チューブロイド培養は、最初のめっき後1〜2週間以内に継ぐ必要があります。尿の場合、細胞増殖は確立後約14〜21日後に明らかになり、プレートの底部にコンパクトな管状構造および/または付着細胞が現れる(図2B)。培養は、めっき後4週間以内に明視野顕微鏡で増殖を検出できない場合に失敗した可能性が最も高い。尿由来培養物の場合、最初の通過は一般的に3〜4週間の間に起こる。腎臓結節培養物の最初の通路では主にコンパクトな構造からなるが、嚢胞性上皮管状の存在は、通過数の増加に伴って増加する(図1Dおよび図2B)。ヒト腎臓結節培養物の生成に成功した結果は、ペアドボックス遺伝子8タンパク質(PAX8)などの管状腎臓上皮で発現するマーカーに対して免疫組織化学的染色を行うことによって評価することができる(図4A、B)。
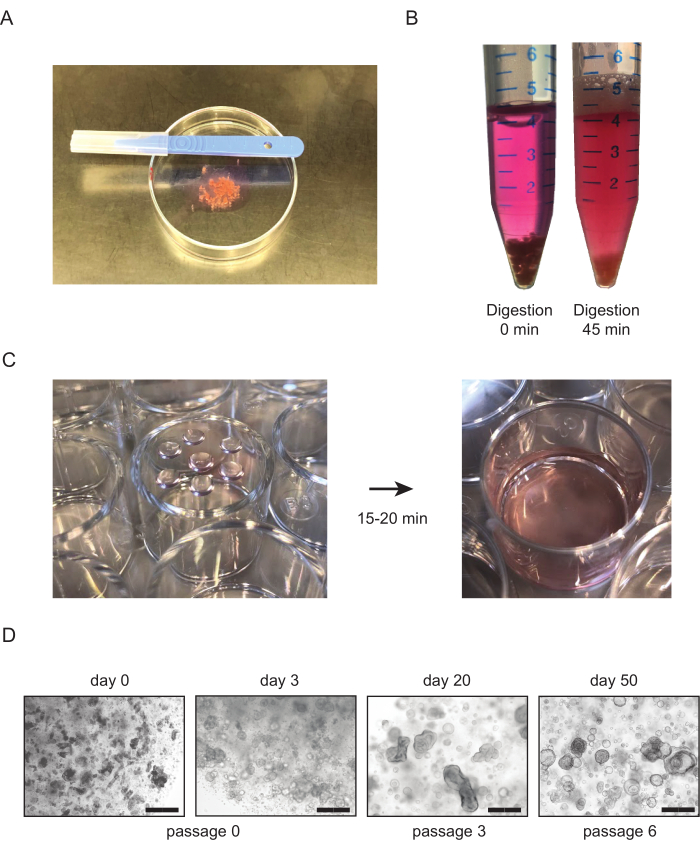
図1:組織由来の腎臓結管状培養物(A)腎臓組織をミンチする手順の概要。組織はメスを用いて〜1mm3の大きさに細かく刻む。(B) 健康な腎臓組織の正しい酵素消化の例組織は、コラゲターゼによる酵素消化の前(左)および(右)45分後に示される。チューブの下部にまだ見える組織はほとんどなく、溶液は濁り、懸濁液中の細胞の存在を示す。(C)処理された腎臓組織を含むBME液滴のめっき後の細胞培養プレートの代表的な画像。液滴をめっきした後、培養プレートを上下に反転させ(左)、37°Cでインキュベーターに入れた。 15〜20分後、温感培養培地をウェル(右)に添加する。(D)組織由来の管状の培養物の代表的な明視野画像。最初のチューブロイド構造は、最初の播種後2〜3日後に目に見えるようになります。通路数が増加すると、管状体は通常、形態をより嚢胞的表現型に変化させる。スケールバー= 300 μm略語: BME = 原膜抽出物この図の大きなバージョンを表示するには、ここをクリックしてください。
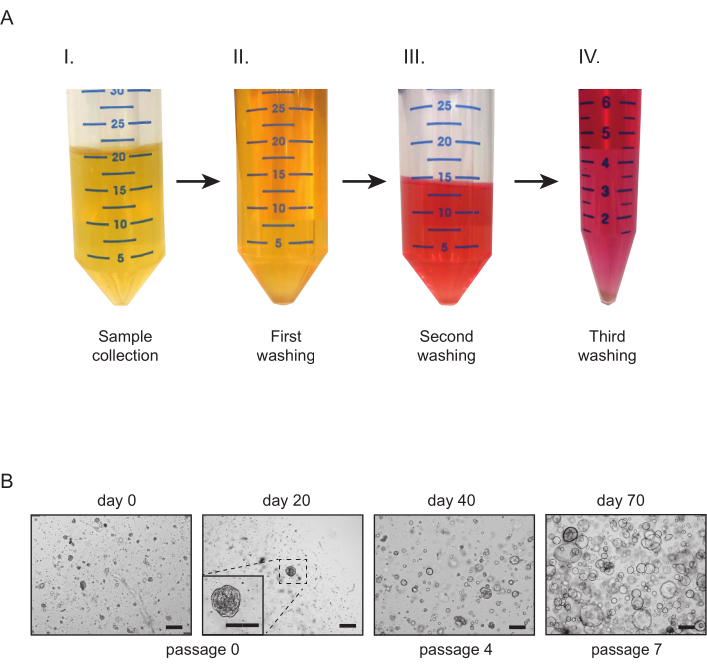
図2:尿由来の腎臓結腸管状培養物(A)尿サンプル処理の概要採取後できるだけ早く(I)、尿サンプルは50mLチューブに分けられ、洗浄媒体(II)で希釈される。第2の洗浄工程(III)の後、チューブの含有量がプールされ、3番目と最後の洗浄工程(IV)がめっきの前に行われる。(B) 尿由来の尿管状の培養物の代表的な明視野画像。最初の管状突起構造および付着細胞は、最初のめっき後21日以内に見えるべきである。スケールバー= 300 μm.この図の大きなバージョンを表示するには、ここをクリックしてください。
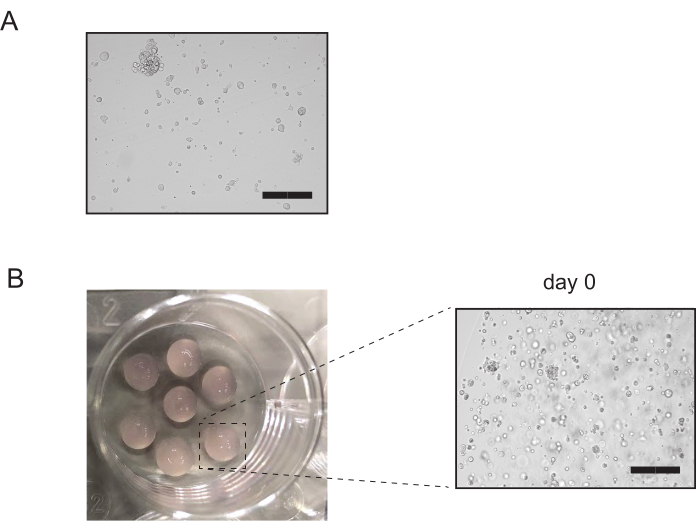
図3:腎臓結管状培養物の経接合. (A) 酵素消化後の腎臓結管培養の代表的な画像消化を完了した後、無傷の尿細管構造の10%以下が残るべきではありません。スケールバー=300μm(B)メッキ後の腎臓結節培養物の代表的な画像。培養物の検査は、大部分の管状体が破壊されたことを確認する。スケールバー= 300 μmこの図の大きなバージョンを表示するには、ここをクリックしてください。
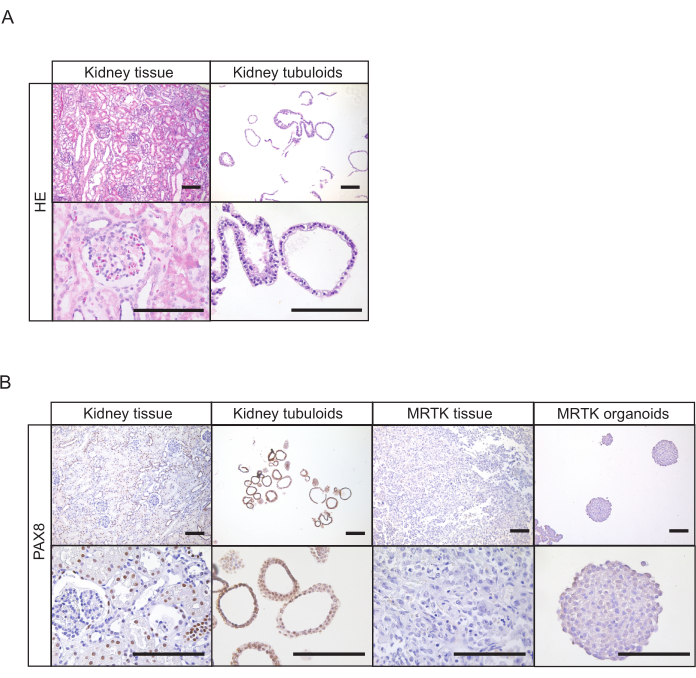
図4:尿細管培養物の組織学的特徴を示す(A)健康な腎臓組織と管状体のH&E染色スケールバー=100μm(B)正常な腎臓組織、管状体、MRTK組織、およびMRTKオルガノイドにおけるPAX8の免疫組織化学。PAX8オルガノイド構造の陽性は、腎臓上皮の起源を確認する。健康な腎臓組織は、陽性(尿細管)と陰性の両方の構造(糸球体)を示す。MRTK組織およびオルガノイドは陰性対照として含まれていた。スケールバー= 100 μm. 略語: H&E = ヘマトキシリンおよびエオシン;PAX8 = ペアドボックス遺伝子 8;MRTK = 腎臓の悪性ラブドイド腫瘍この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
オルガノイドは、それらが由来する組織のアバターと考えられる。それらは起源の組織15の遺伝子質および表述の特徴を維持している間患者材料の急速な拡大を可能にする。オルガノイド技術は最近、ベンチからベッドサイドに所見を翻訳するための重要なツールとして使用することができる、より代表的な前臨床モデルの開発のための扉を開いた。腎臓結管状突起は、薬物誘発性腎毒性を試験するためのインビトロモデルで有望であり、多くの化学療法薬2、8、12の一般的な副作用である。このように、患者由来の腫瘍オルガノイド培養物は、治療16、17、18に対する患者応答について予測的であることが実証された。したがって、尿細管でハイスループットな方法で薬物を検査すると、治療用ウィンドウのより良い定義が可能になり、患者における薬物誘発性腎毒性のリスクが低下する可能性があります。
一般的に使用される抗生物質は、腎臓19に毒性作用を及ぼすと記載されている。汚染を予防することによって培養物を正常に確立するためには、広域スペクトル抗生物質の存在が必要であるが、その潜在的な腎毒性を考慮することが重要である。尿細体培養の確立に対する抗生物質の悪影響は認められていないが、その効果を十分に評価するためには、さらなる調査が必要である。管状体は、病気を研究し、モデリングするために利用することができます8.毛細血管障害(繊毛の病理学的機能不全)ならびに腎臓に影響を及ぼす他の遺伝的症候群は、罹患した被験者から直接管状結線を生成するか、またはCRISPR/Cas9ゲノム編集20を介して疾患特異的ドライバー変異を導入できる健全な培養物を用いて研究することができる。
尿細管は多細胞性腎臓培養物であるが、それらは、ポドサイトおよび内皮細胞8を含むいくつかの腎細胞タイプを欠いている。さらに、他のASC由来オルガノイドモデルとは対照的に、管状体型は約15の通路に培養することができるため、限定的な複製ポテンシャルを有する。しかし、この限られた寿命は、Wntを培養培地21に添加することによって大幅に延長することができる。さらに、尿細形培養プロトコルの最適化は、より分化された細胞タイプを含む腎臓をより代表的なものにするために必要である。組織サンプルからの管状突起の確立の効率は非常に高いが(>95%)、まれに失敗する可能性がある。1)出発物質の質の悪さ(例えば、薬物治療の結果としての壊死組織)、2)組織サンプルの過剰消化、または3)一次サンプルの汚染を含む異なる原因がある可能性があります。
受け取った組織サンプルの品質がプロトコルを進めるのに十分であることを確認するには、手術時に組織の評価を行う病理スタッフとの密接な接触を維持することが重要です。十分な材料が利用可能な場合、その生存率は、組織学的検査(例えば、ヘマトキシリンおよびエオシン染色)によって確認されなければならない。さらに、酵素消化時の細胞ライシスを防ぐためには、インキュベーション手順が1時間以下でなることが重要である。最後に、汚染を防ぐために、抗生物質および抗真菌剤を洗浄および培養培地に添加すべきである。
尿は、尿細管培養を汚染する可能性がある腎臓22に由来しない剥離上皮細胞を含むことができる。これらは、例えば、尿路上皮細胞が、尿細管細胞とは対照的に、腫瘍タンパク質P63およびPAX88に対する陰性に対する陽性である。従って、PAX8陽性の培養をテストして、確立された腎臓結管状結線の純度を確認してから、フォローアップ実験を進めることをお勧めします(図4B)。
尿は、高い浸透圧と低pHによる細胞の敵対的な環境を表します。したがって、尿採取時にサンプルをできるだけ早く処理することがプロトコルの成功にとって重要です。したがって、採取した尿は、播種時に生存細胞の存在を確実にするために、できるだけ早く緩衝液で希釈し、広範囲に洗浄されるべきである。尿を処理する前に数時間保存すると、尿細管の確立の成功率が大幅に低下します。最後に、無菌であるが、尿は、採取プロセスに関連する汚染の危険性が高い。したがって、抗生物質および抗真菌剤で洗浄および成長培地を補うことが重要である。上記のすべてを考慮すると、約50%の成功率を達成することができます。
開示事項
著者らは利益相反を宣言しない。
謝辞
私たちは、研究に参加してくれたすべての患者とその家族に感謝します。私たちは、私たちの研究を促進した臨床チームに感謝します。欧州研究評議会(ERC)の助成金850571(J.D.)、オランダ癌学会(KWF)/アルプ・デュゼス・バス・ムルダー賞(No.10218、J.D.)、オンコード研究所、財団チルドレン・キャンティ・アン・ガンフリー(KiKa no.292、C.C)の支援に感謝しています。
資料
| Name | Company | Catalog Number | Comments |
| A83-01 | Tocris | 2939/10 | Stock of 5 mM, final concentration of 5 µM, activin receptor-like kinase 5 inhibitor |
| Advanced DMEM/F12 | ThermoFisher Scientific | 12634010 | |
| antiPAX8 antibody | LSBio | LS-B13466 | |
| B27 supplement | ThermoFisher Scientific | 17504044 | Stock of 50x, final concentration of 1x |
| BME | Trevigen | 3533-010-02 | |
| Collagenase | Sigma Aldrich | C9407 | Stock of 10 mg/mL, final concentration of 1 mg/mL |
| EGF | Peprotech | AF-100-15 | Stock of 0.5 mg/mL, final concentration of 50 ng/mL |
| FGF10 | Peprotech | 100-26 | Stock of 0.1 mg/mL, final concentration of 100 ng/mL |
| GlutaMAX - L-alanine/L-glutamine | Gibco | 35050061 | Stock of 100x, final concentration of 1x |
| Hepes | Gibco | 15630106 | Stock of 1 M, final concentration of 10 mM |
| Multiwell tissue culture plates 12 wells | CELLSTAR | 665180 | |
| Multiwell tissue culture plates 24 wells | CELLSTAR | 662160 | |
| Multiwell tissue culture plates 6 wells | CELLSTAR | 657160 | |
| N-acetylcysteine | Sigma Aldrich | A9165 | Stock of 500 mM, final concentration of 1.25 mM |
| Penicillin/Streptomycin | Gibco | 15140163 | Stock of 10.000 U/mL, final concentration of 100 U/mL |
| Primocin - broad-range antibiotics | Invivogen | ant-pm-1 | Stock of 50 mg/mL, final concentration of 0.1 mg/mL |
| Red blood cells lysis buffer | Roche | 11814389001 | |
| RhoKinase inhibitor Y-27632 | Abmole Bioscience | M1817 | Stock of 100 mM, final concentration of 10 µM |
| R-spondin conditioned medium | Produced in house with the use of stable cell lines generated by Calvin Kuo lab. Final concentration is 10% | ||
| TrypLe Express/ trypsin replacement agent | ThermoFisher Scientific | 12605010 |
参考文献
- Romagnani, P., et al. Chronic kidney disease. Nature Reviews. Disease Primers. 3, 17088 (2017).
- Ooms, A. H., Calandrini, C., de Krijger, R. R., Drost, J. Organoid models of childhood kidney tumours. Nature Reviews. Urology. 17 (6), 311-313 (2020).
- Takasato, M., et al. Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis. Nature. 526 (7574), 564-568 (2015).
- Low, J. H., et al. Generation of human PSC-derived kidney organoids with patterned nephron segments and a de novo vascular network. Cell Stem Cell. 25 (3), 373-387 (2019).
- Little, M. H., Combes, A. N. Kidney organoids: accurate models or fortunate accidents. Genes & Development. 33 (19-20), 1319-1345 (2019).
- Papapetrou, E. P. Patient-derived induced pluripotent stem cells in cancer research and precision oncology. Nature Medicine. 22 (12), 1392-1401 (2016).
- Wu, H., et al. Comparative analysis and refinement of human PSC-derived kidney organoid differentiation with single-cell transcriptomics. Cell Stem Cell. 23 (6), 869-881 (2018).
- Schutgens, F., et al. Tubuloids derived from human adult kidney and urine for personalized disease modeling. Nature Biotechnology. 37 (3), 303-313 (2019).
- Jun, D. Y., et al. Tubular organotypic culture model of human kidney. PLoS One. 13 (10), 0206447 (2018).
- Grassi, L., et al. Organoids as a new model for improving regenerative medicine and cancer personalized therapy in renal diseases. Cell Death & Disease. 10 (3), 1-15 (2019).
- Yousef Yengej, F. A., Jansen, J., Rookmaaker, M. B., Verhaar, M. C., Clevers, H. Kidney organoids and tubuloids. Cells. 9 (6), 1326 (2020).
- Calandrini, C., et al. An organoid biobank for childhood kidney cancers that captures disease and tissue heterogeneity. Nature Communications. 11 (1), 1310 (2020).
- Jansen, J., et al. A morphological and functional comparison of proximal tubule cell lines established from human urine and kidney tissue. Experimental Cell Research. 323 (1), 87-99 (2014).
- Zhou, T., et al. Generation of human induced pluripotent stem cells from urine samples. Nature Protocols. 7 (12), 2080 (2012).
- Drost, J., Clevers, H. Organoids in cancer research. Nature Reviews Cancer. 18 (7), 407-418 (2018).
- Vlachogiannis, G., et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science. 359 (6378), 920-926 (2018).
- Ooft, S. N., et al. Patient-derived organoids can predict response to chemotherapy in metastatic colorectal cancer patients. Science Translational Medicine. 11 (513), (2019).
- Tiriac, H., et al. Organoid profiling identifies common responders to chemotherapy in pancreatic cancer. Cancer Discovery. 8 (9), 1112-1129 (2018).
- Morales-Alvarez, M. C. Nephrotoxicity of antimicrobials and antibiotics. Advances in Chronic Kidney Disease. 27 (1), 31-37 (2020).
- Drost, J., et al. Sequential cancer mutations in cultured human intestinal stem cells. Nature. 521 (7550), 43-47 (2015).
- Miao, Y., et al. Next-generation surrogate Wnts support organoid growth and deconvolute Frizzled pleiotropy in vivo. Cell Stem Cell. 27 (5), 840-851 (2020).
- Dörrenhaus, A., et al. Cultures of exfoliated epithelial cells from different locations of the human urinary tract and the renal tubular system. Archives of Toxicology. 74 (10), 618-626 (2000).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved