Method Article
Erzeugung von menschlichen Nierentubuliden aus Gewebe und Urin
In diesem Artikel
Zusammenfassung
Menschliche Nierentupuloidkulturen stellen ein wertvolles In-vitro-Modell zur Untersuchung der Nierenphysiologie und -krankheit dar. Tubuloide können sowohl aus Nierengewebe (gesund und krank) als auch aus Urin hergestellt werden, wobei letzterer eine leicht erhältliche und weniger invasive Quelle für Forschungsmaterial darstellt.
Zusammenfassung
Adulte Stammzellen (ASC)-abgeleitete menschliche Nierenepithelorganoide oder Tubuloide können aus gesundem und krankem Nierenepithel mit hoher Effizienz hergestellt werden. Normale Nierentuuloide rekapitulieren viele Aspekte ihres Ursprungsgewebes. Sie repräsentieren unterschiedliche Nephronsegmente - vor allem den proximalen Tubulus, die Henle-Schleife, die distalen Tubuli und den Sammelgang - und können verwendet werden, um die normale Nierenphysiologie zu untersuchen. Darüber hinaus erleichtert die Tubuloid-Technologie die Krankheitsmodellierung, z.B.für Infektionskrankheiten sowie für Krebs. Die Gewinnung von Nierenepithelzellen für die Tubuloidbildung ist jedoch abhängig von übrig gebliebenem chirurgischem Material (z. B. partiellen Nephrektomien) oder Nadelbiopsien. Die Fähigkeit, Tubuloide aus Urin zu züchten, würde eine alternative, weniger invasive Quelle für gesunde Nierenepithelzellen bieten. Es wurde bereits gezeigt, dass tubuloide Kulturen aus nur wenigen Millilitern frisch gesammeltem Urin erfolgreich erzeugt werden können. Dieser Artikel beschreibt die Protokolle zur Erzeugung und Verbreitung von ASC-abgeleiteten menschlichen Nierentupuloidkulturen aus Gewebe- und Urinproben.
Einleitung
Nieren erfüllen die Funktion, das Gleichgewicht der Körperflüssigkeiten systematisch zu kontrollieren. Die Beeinträchtigung ihrer physiologischen Funktion kann durch verschiedene Faktoren verursacht werden, einschließlich Diabetes, Bluthochdruck und medikamenteninduzierterToxizität 1. Für ein besseres Verständnis der normalen Nierenphysiologie sowie der Entstehung von Nierenerkrankungen ist der Einsatz repräsentativer präklinischer Modelle entscheidend. In den letzten Jahren wurden mehrere in vitro Nierenmodelle auf Basis der sogenannten Organoid-Technologieerstellt 2. Organoide sind dreidimensionale, vielzellige Strukturen, die der Morphologie und Physiologie des Gewebes (normal oder krank) ähneln, aus dem sie stammen. Sie können aus pluripotenten (PSCs) oder adulten Stammzellen (ASCs) erzeugt werden, die jeweils ihre eigenen Eigenschaften und Anwendungen haben.
PSC-abgeleitete Nierenorganoide ahmen die Nephrogenese nach3,4,5. Sie können auch aus patientenabgeleiteten committed-Zellen durch erzwungene Dedifferenzierung (induzierte Pluripotenz oder iPSC) hergestellt werden. iPSCs können anschließend in die verschiedenen Zelltypen des Nephrons, der Funktionseinheit der Niere, durch rechtzeitige Exposition gegenüber spezifischen Wachstumsfaktorcocktails unterschieden werden. Während ein ziemlich vollständiges Mini-Organ in einer Schüssel entsteht, bleibt ihre Einrichtung zeitaufwendig, und aufgrund des Reprogrammierungsprotokolls können iPSCs anfällig für unerwünschte genetische Instabilität sein6. Darüber hinaus sind iPSC-Organoide nicht in der Lage, vollständig zu adulten Nierenzellen zu reifen, was ein Transkriptomprofil zeigt, das der fetalen Niere in einem frühen Entwicklungsstadiumähnelt 7.
Es wurde gezeigt, dass ASC-abgeleitete menschliche Nierentuuloide die Erneuerung des erwachsenen Nierenepithels rekapitulieren. Sie repräsentieren in erster Linie den proximalen Tubulus, die Henle-Schleife, die distalen Tubuli und den Sammelkanal, wie durch die Expression verschiedener Transporterproteine8,9,10bestätigt. Das tubuloide Kulturprotokoll ermöglicht die schnelle Expansion von patientenbasiertem Nierengewebe unter Beibehaltung eines stabilen Genoms. Forschungsanwendungen umfassen die Untersuchung der normalen Nierenphysiologie, Nephrotoxizität, Drogentests sowie Krankheitsmodellierung8,10,11,12. Eine mögliche Einschränkung der Etablierung von patientenabgeleiteten Organoidkulturen, einschließlich Tubuloiden, ist die Verfügbarkeit von frischem Gewebe. Mehrere Berichte haben jedoch gezeigt, dass Urin als Quelle für Nierenepithelzellen dienen kann, wodurch eine viel einfachere, weniger invasive Strategie zur Gewinnung von Patientenmaterial für tubuloide Kulturen8,13,14. In der Tat wurde kürzlich gezeigt, dass Tubuloide aus Urin gezüchtet werden können8. Dieser Artikel beschreibt die Etablierung und Aufrechterhaltung von Tubuloidkulturen aus Nierengewebe und Urin.
Protokoll
HINWEIS: Die hier beschriebenen Experimente wurden von der medizinisch-ethischen Kommission des Erasmus Medical Center (Rotterdam, Niederlande) und des Princess Máxima Center for Pediatric Oncology (Utrecht, Niederlande) genehmigt.
1. Erzeugung von menschlichen Nierentubuliden aus Gewebe
- Materialien
- Vorwärmen Sie Multiwell-Gewebekulturplatten (6, 12 und 24 Wells) über Nacht bei 37 °C.
- Bereiten Sie basales Medium (AdDF+++) vor, indem Sie 1x L-Alanin / L-Glutamin-Ergänzung, 1% w / v 4-(2-Hydroxyethyl)-1-piperazin-Ethansulfonsäure (HEPES, 10 mM) und 1% Penicillin / Streptomycin-Antibiotika zu Advanced DMEM / F12 hinzufügen.
- Bereiten Sie das Kulturmedium vor, indem Sie 1,5% B27-Ergänzung, 10% R-Spondin-konditioniertes Medium, epidermalen Wachstumsfaktor (50 ng / ml), Fibroblastenwachstumsfaktor-10 (100 ng / ml), N-Acetylcystein (1,25 mM), Rho-Kinase-Inhibitor Y-27632 (10 μM), Breitbandantibiotika (0,1 mg / ml) und A83-01 (5 μM) zu AdDF +++ hinzufügen. Vor Gebrauch auf 37 °C erwärmen.
- Bereiten Sie den Basalmembranextrakt (BME) vor, indem Sie ein Aliquot über Nacht bei 4 °C auftauen. Halten Sie das BME während des Eingriffs auf Eis.
- Kollagenaselösung vorbereiten, indem Sie die Kollagenase auf eine Endkonzentration von 1 mg / ml in AdDF ++ + verdünnen, unter Zugabe von 10 μM Y-27632. Auf 37 °C erwärmen.
- Bereiten Sie 10 cm Petrischale, Skalpelle und Pinzetten zu. Desinfizieren Sie die Utensilien, indem Sie 20 Minuten lang eine UV-Lampe auftragen, gefolgt von Waschungen mit Desinfektionsmittel, Demi-Wasser und 70% v / v Ethanol. Trocknen Sie die Utensilien an der Luft.
- Einen horizontalen Shaker auf 37 °C vorwärmen.
- Verfahren
- Sammeln Sie Nierengewebe in einem 50-ml-Röhrchen, das mit 30-40 ml AdDF+++ Medium gefüllt ist. Legen Sie das Stück Gewebe in ~ 1 ml Medium in eine 10 cm Petrischale. Das Gewebe mit Skalpellen in Stücke von~1 mm 3 Größe zerkleinern (Abbildung 1A).
- Das gehackte Gewebe mit einer Zette und einem Skalpell in ein 15-ml-Röhrchen geben. 5 ml AdDF+++ in die Petrischale geben, waschen und das Medium mit einer sterilen Pipette von 10 ml auffangen. Übertragen Sie alle diese Inhalte in dieselbe Röhre.
- Zentrifuge bei 300 × g für 5 min bei Raumtemperatur und entfernen Sie den Überstand. Fügen Sie 3-4 ml Kollagenaselösung in die 15 ml Röhrchen hinzu. Bewegen Sie das Rohr zu einem horizontalen Shaker, der auf 37 °C und eine Drehzahl von 250 U/min eingestellt ist.
- Nach den ersten 15 Minuten der Inkubation die Probe überprüfen und das Röhrchen kräftig schütteln. Wiederholen Sie, bis die Suspension homogen ist und die meisten Gewebestücke verschwunden sind, mit einer maximalen Inkubationszeit von 45-60 min. (Abbildung 1B).
- Füllen Sie die Tube mit AdDF+ auf und mischen Sie sie, indem Sie die Tube 5-10x umkehren. Zentrifuge bei 300 × g für 5 min bei 4 °C und entfernen Sie den Überstand. Wenn das Pellet rot ist, fahren Sie mit Schritt 1.2.6 fort. Fahren Sie andernfalls mit Schritt 1.2.8 fort.
- Fügen Sie 1 ml Lysepuffer für rote Blutkörperchen (siehe Materialtabelle)auf das Zellpellet hinzu. Klopfen Sie vorsichtig auf das Röhrchen, um das Pellet wieder zu kehren (nicht mit Pipettenspitze resuspendieren). Bei Raumtemperatur für 5 min inkubieren.
- Füllen Sie die Tube mit AdDF+++. Zentrifuge bei 300 × g für 5 min bei 4 °C und entfernen Sie den Überstand. Wenn die Blutzellen noch sichtbar sind, wiederholen Sie den Vorgang ab Schritt 1.2.6 noch einmal. Fahren Sie andernfalls mit Schritt 1.2.8 fort.
- Wenn an dieser Stelle des Protokolls Gewebebrocken sichtbar sind, fahren Sie mit Schritt 1.2.8 fort. Andernfalls fahren Sie mit der Messung des Pelletvolumens in Schritt 1.2.9 fort. 5 ml AdDF+++ in das Röhrchen geben und mit einer sterilen Pipette von 10 ml wieder aufschnüsten. Filtern Sie die Suspension durch ein 100 μm Nylon-Zellsieb, das auf einem 50-ml-Röhrchen platziert ist.
- Übertragen Sie die gefilterte Suspension in ein neues 15-ml-Rohr. Zentrifuge bei 300 × g für 5 min bei 4 °C und entfernen Sie den Überstand. Messen Sie das Volumen des Zellpellets mit einer p1000-Pipette, die auf ein bekanntes Volumen eingestellt ist. Vorsichtig auf und ab pipetten, um wieder zu resuspendieren, ohne Luftblasen zu erzeugen. Das Rohr für 1 min auf Eis geben.
- Fügen Sie 70-75% Volumen BME zum Pellet hinzu. Resuspend mit einer p1000- oder p200-Pipette und Platte 15 μL Tröpfchen in einer vorgewarnten Multiwell-Zellkulturplatte (6, 12 oder 24 Wells, basierend auf dem gesamten Beschichtungsvolumen (<100 μL, 24 Wells; 100-200 μL, 12 Wells; >200 μL, 6 Wellen)).
- Drehen Sie die Platte auf den Kopf und lassen Sie die Platte 15-20 min bei 37 °C im Inkubator ruhen (Abbildung 1C). Fügen Sie vorgewarntes Kulturmedium hinzu, und überprüfen Sie die Kulturen (Abbildung 1C, D).
2. Erzeugung von menschlichen Nierentubuliden aus Urin
HINWEIS: Urin ist eine feindliche Umgebung für Zellen. Für eine erfolgreiche Durchführung dieses Protokolls ist es wichtig, dass Urinproben so schnell wie möglich, vorzugsweise innerhalb von 4 h nach der Ausscheidung, verarbeitet werden. In der Zwischenzeit sollten Urinproben bei 4 °C gelagert werden.
- Materialien
- Vorwärmen Sie Multiwell-Gewebekulturplatten (6, 12 und 24 Wells) über Nacht bei 37 °C.
- Waschmedium vorbereiten: AdDF+++ ergänzt mit Breitbandantibiotika (0,1 mg/ml) und 10 μM Y-27632.
- Bereiten Sie das Kulturmedium wie oben beschrieben vor. Vor Gebrauch bei 37 °C aufwärmen.
- Bereiten Sie die BME-Matrix vor. Während des Eingriffs auf Eis bleiben.
- Verfahren
- Sammeln Sie eine Urinprobe und teilen Sie sie gleichmäßig in 50 ml Röhrchen auf (Abbildung 2A-I). Fügen Sie 10-20 ml Waschmedium in jede der Röhrchen hinzu. Zentrifuge bei 300 × g für 5 min bei 4 °C (Abbildung 2A-II) und entfernen Sie den Überstand vorsichtig.
- Fügen Sie 10 ml Waschmedium in jede der Röhrchen hinzu. Die Pellets vorsichtig mit einer 10 ml sterilen Pipette wieder aufsorgen. Zentrifugieren Sie bei 300 x g für 5 min bei 4 °C (Abbildung 2A-III) und entfernen Sie den Überstand vorsichtig.
- Resuspendieren Sie die Pellets und übertragen Sie den Inhalt aller Röhrchen in ein 15-ml-Röhrchen. Füllen Sie die Tube mit Waschmedium. Zentrifuge bei 300 x g für 5 min bei 4 °C (Abbildung 2A-IV) und entfernen Sie den Überstand.
- Messen Sie das Volumen des Zellpellets mit einer p1000-Pipette, die auf ein bekanntes Volumen eingestellt ist. Vorsichtig auf und ab pipetten, um wieder zu resuspendieren, ohne Luftblasen zu erzeugen. Das Rohr für 1 min auf Eis geben.
- Fügen Sie 70-75% Volumen des BME zum Pellet hinzu. Resuspend mit einer p1000- oder p200-Pipette und Platte 15 μL Tröpfchen in einer vorgewarnten Multiwell-Zellkulturplatte (6, 12 oder 24 Wells, basierend auf dem gesamten Beschichtungsvolumen (<100 μL, 24 Wells; 100-200 μL, 12 Wells; >200 μL, 6 Wellen)).
- Drehen Sie die Platten im Inkubator für 15-20 min bei 37 °C auf den Kopf. Fügen Sie vorgewarntes Kulturmedium hinzu, und überprüfen Sie die Kulturen (Abbildung 2B).
3. Expansion tubuloider Kulturen
HINWEIS: Tubuloidkulturen können etwa alle 1-2 Wochen mit einem Split-Verhältnis von 1: 2-1: 3 durchgepasst werden. Sie können typischerweise für etwa 15 Passagen erweitert werden, mit linienspezifischen Variationen.
- Materialien
- Vorwärmen Sie Multiwell-Gewebekulturplatten (6, 12 und 24 Wells) über Nacht bei 37 °C.
- Bereiten Sie basales Medium (AdDF+++) vor und halten Sie es während des Eingriffs auf Eis.
- Bereiten Sie das Nährmedium wie zuvor beschrieben vor. Vor Gebrauch auf 37 °C erwärmen.
- Bereiten Sie die BME-Matrix vor und halten Sie sie während des Verfahrens auf Eis.
- Trypsin-Ersatzmittel unter Zugabe von Y-27632 in einer Konzentration von 10 μM vorbereiten. Vor Gebrauch auf 37 °C erwärmen.
- Autoklaven nicht gefilterte p10-Spitzen.
- Kühlen Sie die Zentrifuge auf 4 °C.
- Verfahren
- Unterbrechen Sie die Tröpfchen, die die Tubuloiden enthalten, indem Sie mit einer p1000-Pipette unter Verwendung des im Bohrraum vorhandenen Mediums auf und ab pipettieren. Verwenden Sie die Spitze, um den Boden des Brunnens zu kratzen, und stellen Sie sicher, dass alle zellen gesammelt werden, die an der Unterseite befestigt sind.
- Sammeln Sie den Inhalt in einem 15-ml-Röhrchen. Fügen Sie 10 ml AdDF+++ hinzu. Zentrifuge bei 300 x g für 5 min bei 4 °C und entfernen Sie den Überstand.
- Basierend auf der Größe des Pellets Fügen Sie Trypsin-Ersatzmittel hinzu, das mit 10 μM Y-27632 ergänzt wird. Verwenden Sie 1 ml Trypsin-Ersatzmittel für 200 μL BME-Tröpfchen, die Tubuloide enthalten. Bei 37 °C 5 min inkubieren.
- Verwenden Sie eine p1000-Pipette mit Spitze und legen Sie eine nicht gefilterte, sterile p10-Spitze über die 1000-μL-Spitze. Pipette 20-30x auf und ab, um die Organoide mechanisch zu stören.
- Überprüfen Sie unter dem Mikroskop, ob noch viele intakte Organoide in der Röhre vorhanden sind (Abbildung 3A). Wenn zu diesem Zeitpunkt mehr als 10% intakte Organoide vorhanden sind, wiederholen Sie die 5-minütige Inkubation in Schritt 3.2.3 bis zur mikroskopischen Beobachtung auf intakte Organoide in Schritt 3.2.5 noch einmal. Fahren Sie andernfalls mit Schritt 3.2.6 fort.
- Füllen Sie die Tube mit AdDF+++. Zentrifuge bei 300 × g für 5 min bei 4 °C und entfernen Sie den Überstand. Messen Sie das Volumen des Zellpellets mit einer p1000-Pipette, die auf ein bekanntes Volumen eingestellt ist. Vorsichtig auf und ab pipetten, um wieder zu resuspendieren, ohne Luftblasen zu erzeugen. Das Rohr für 1 min auf Eis geben.
- Fügen Sie 70-75% Volumen BME zum Pellet hinzu. Resuspend mit einer p1000- oder p200-Pipette und Platte 15 μL Tröpfchen in einer vorgewarnten Multiwell-Zellkulturplatte (6, 12 oder 24 Wells, basierend auf dem gesamten Beschichtungsvolumen (<100 μL, 24 Wells; 100-200 μL, 12 Wells; >200 μL, 6 Wellen)).
- Drehen Sie die Platten auf den Kopf und lassen Sie die Platte 15-20 min bei 37 °C im Inkubator ruhen. Fügen Sie vorgewarntes Kulturmedium hinzu, und überprüfen Sie die Kulturen (Abbildung 3B).
Ergebnisse
Für Nierengewebe treten tubuloide Strukturen typischerweise innerhalb von 7 Tagen nach der Etablierung auf (Abbildung 1D). Das Fehlen eines scheinbaren Wachstums innerhalb der ersten 7 Tage deutet auf ein erfolgloses Ergebnis des Protokolls hin. Im Allgemeinen müssen tubuloide Kulturen innerhalb von 1-2 Wochen nach der ersten Beschichtung durchgepasst werden. Beim Urin zeigt sich das Zellwachstum etwa 14-21 Tage nach der Etablierung mit dem Auftreten kompakter tubuloider Strukturen und/ oder adhärenter Zellen auf der Unterseite der Platte (Abbildung 2B). Die Kulturgründung ist höchstwahrscheinlich gescheitert, wenn mit einem Hellfeldmikroskop innerhalb von 4 Wochen nach der Beschichtung kein Wachstum nachgewiesen werden kann. Bei aus Urin gewonnenen Kulturen tritt die erste Passagierung in der Regel zwischen 3 und 4 Wochen auf. Während in den ersten Passagen Nierentupuloidkulturen hauptsächlich aus kompakten Strukturen bestehen, nimmt das Vorhandensein von zystischen Epitheltuuloiden mit der Zunahme der Durchgangszahl zu (Abbildung 1D und Abbildung 2B). Die erfolgreiche Erzeugung von humanen Nierentubuloidkulturen kann durch immunhistochemische Färbung von Markern, die in tubulärem Nierenepithel exprimiert werden, wie z. B. Paired Box Gene 8 Protein (PAX8) (Abbildung 4A,B), beurteilt werden.
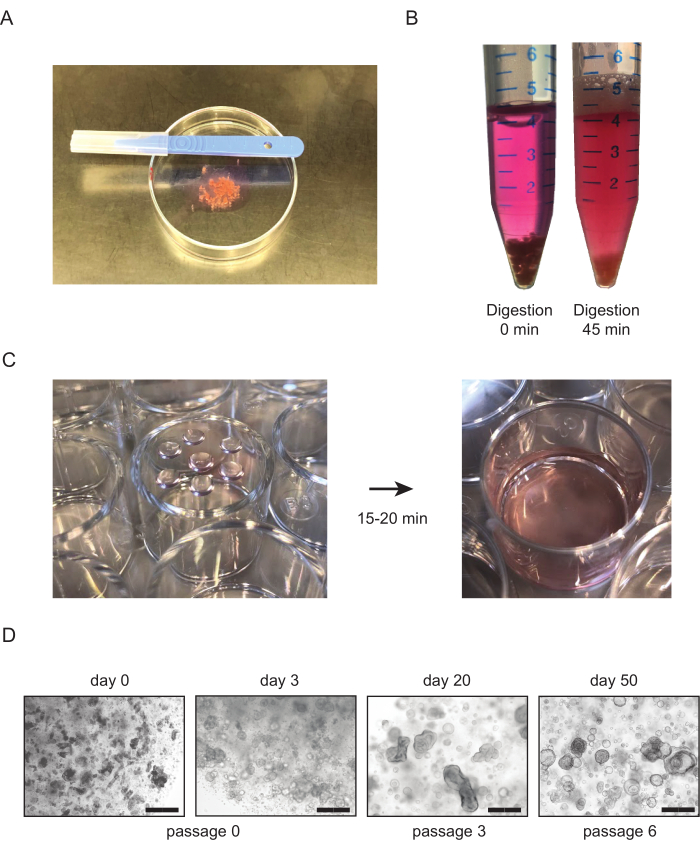
Abbildung 1: Aus Gewebe gewonnene Nierentupuloidkulturen. (A) Überblick über das Verfahren zur Zerhackung von Nierengewebe. Das Gewebe wird mit Skalpellen auf eine Größe von ~1 mm3 gehackt. (B) Beispiel für eine korrekte enzymatische Verdauung von gesundem Nierengewebe. Gewebe wird vor (links) und nach (rechts) 45 minuten enzymatischer Verdauung mit Kollagenase gezeigt. Nur wenige Gewebestücke sind noch am Boden der Röhre sichtbar, und die Lösung sollte trüb werden, was auf das Vorhandensein von Zellen in der Suspension hinweist. (C) Repräsentatives Bild von Zellkulturplatten nach beschichtung von BME-Tröpfchen, die das verarbeitete Nierengewebe enthalten. Nach dem Plattieren der Tröpfchen werden die Kulturplatten auf den Kopf gestellt (links) und bei 37 °C in den Inkubator gelegt. Nach 15-20 min wird vorgewarmtes Kulturmedium in den Brunnen zugegeben (rechts). (D) Repräsentative Hellfeldbilder von aus Gewebe gewonnenen Tubuloidkulturen. Die ersten tubuloiden Strukturen werden 2-3 Tage nach der ersten Aussaat sichtbar. Mit zunehmenden Durchgangszahlen ändern Tubuloide typischerweise die Morphologie zu einem zystischen Phänotyp. Maßstabsbalken = 300 μm. Abkürzungen: BME = Basement Membrane Extract. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
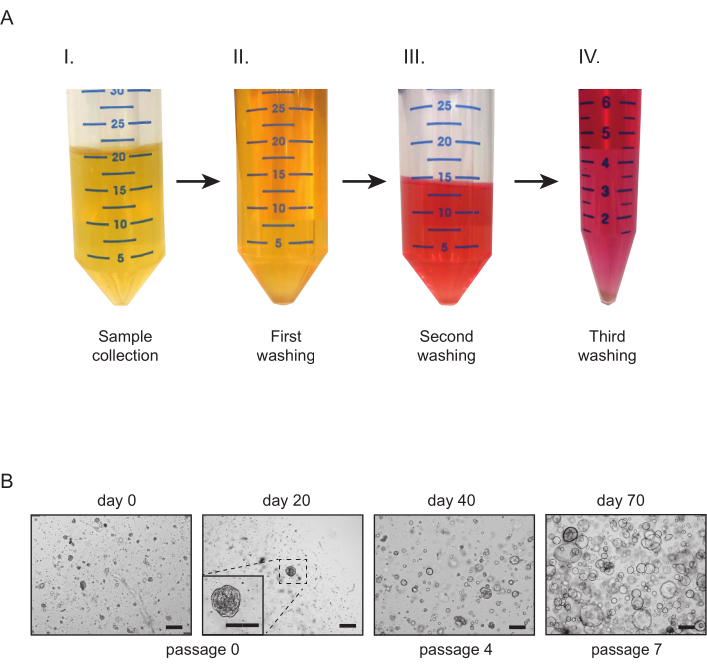
Abbildung 2: Urin-abgeleitete Nierentuuloidkulturen. (A) Überblick über die Verarbeitung von Urinproben. So bald wie möglich nach der Entnahme (I) werden Urinproben in 50 ml Röhrchen aufgeteilt und in Waschmedium verdünnt (II). Nach einem zweiten Waschschritt (III) wird der Inhalt der Röhrchen gebündelt und ein dritter und letzter Waschschritt (IV) vor der Beschichtung durchgeführt. (B) Repräsentative Hellfeldbilder von urinbasierten Tubuloidkulturen. Die ersten tubuloiden Strukturen und adhärenten Zellen sollten innerhalb von 21 Tagen nach der ersten Beschichtung sichtbar sein. Maßstabsbalken = 300 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
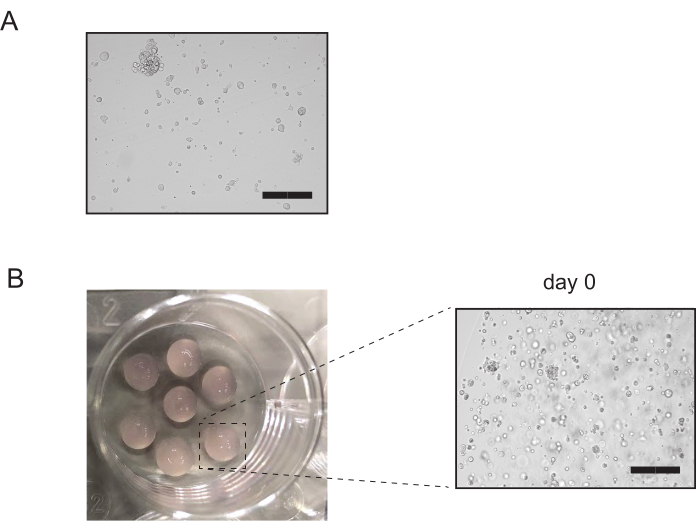
Abbildung 3: Passaging von Nierentupuloidkulturen. (A) Repräsentatives Bild von Nierentupuloidkulturen nach enzymatischer Verdauung. Nach Abschluss der Verdauung sollten nicht mehr als 10% der intakten tubuloiden Strukturen verbleiben. Maßstabsbalken = 300μm. (B) Repräsentatives Bild von Nierentubulidenkulturen nach der Beschichtung. Die Inspektion der Kulturen bestätigt, dass die Mehrheit der Tubuloiden gestört wurde. Maßstabsleiste = 300 μm Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
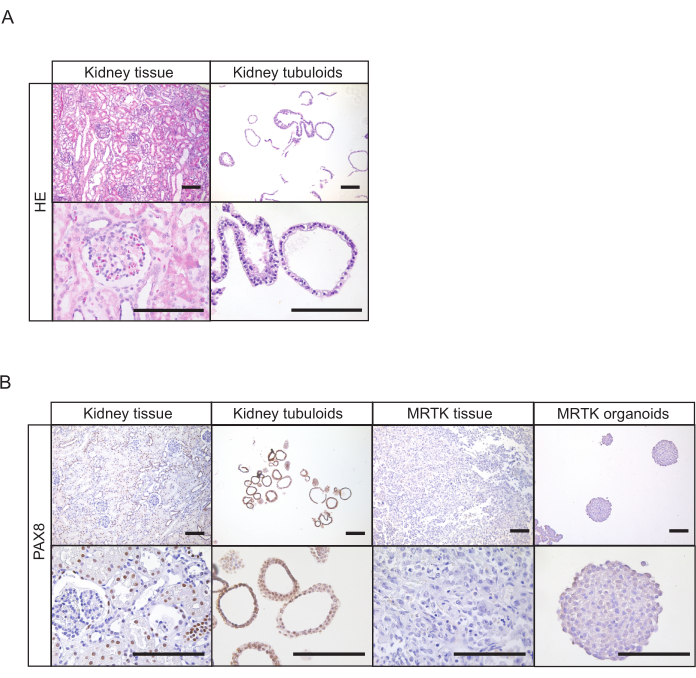
Abbildung 4: Histologische Charakterisierung von Tubuloidkulturen. (A) H&E-Färbung von gesundem Nierengewebe und Tubuliden. Schuppenbalken = 100 μm. (B) Immunhistochemie von PAX8 in normalem Nierengewebe, Tubuloiden, MRTK-Gewebe und MRTK-Organoiden. Die PAX8-Positivität der Organoidstrukturen bestätigt ihren nierenepithelialen Ursprung. Gesundes Nierengewebe zeigt sowohl positive (Tubuli) als auch negative Strukturen (Glomeruli). MRTK-Gewebe und Organoide wurden als Negativkontrolle eingeschlossen. Maßstabsbalken = 100 μm. Abkürzungen: H&E = Hämatoxylin und Eosin; PAX8 = gepaartes Box-Gen 8; MRTK = maligner rhabdoider Tumor der Niere. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Organoide gelten als Avatare des Gewebes, aus dem sie stammen. Sie ermöglichen eine schnelle Ausdehnung des Patientenmaterials unter Beibehaltung der genotypischen und phänotypischen Eigenschaften des Ursprungsgewebes15. Die Organoid-Technologie hat kürzlich die Türen für die Entwicklung repräsentativerer präklinischer Modelle geöffnet, die als wichtige Werkzeuge verwendet werden können, um Erkenntnisse von der Bank in das Krankenbett zu übersetzen. Nierentuuloide sind vielversprechende In-vitro-Modelle zum Testen der medikamenteninduzierten Nephrotoxizität, einer häufigen Nebenwirkung vieler Chemotherapeutika2,8,12. Daher wurde gezeigt, dass patientenabgeleite Tumororganoidkulturen prädiktiv für das Ansprechen des Patienten auf die Behandlungsind 16,17,18. Die Prüfung von Medikamenten mit hohem Durchsatz an Tubuliden ermöglicht daher möglicherweise eine bessere Definition von therapeutischen Fenstern und verringert das Risiko einer medikamenteninduzierten Nephrotoxizität bei Patienten.
Es wurde beschrieben, dass häufig verwendete Antibiotika eine toxische Wirkung auf die Nieren ausüben19. Obwohl das Vorhandensein von Breitbandantibiotika für die erfolgreiche Etablierung der Kulturen durch die Verhinderung von Kontaminationen notwendig ist, ist es wichtig, ihre potenzielle Nephrotoxizität zu berücksichtigen. Obwohl keine negativen Auswirkungen von Antibiotika auf die Etablierung von Tubuloidkulturen beobachtet wurden, sind weitere Untersuchungen erforderlich, um ihre Wirkungen gründlich zu bewerten. Tubuloide können für die Untersuchung und Modellierung von Krankheiten genutzt werden8. Ziliopathien (pathologische Dysfunktion von Zilien) sowie andere genetische Syndrome, die die Niere betreffen, könnten untersucht werden, indem entweder tubuloide Linien direkt von betroffenen Probanden erzeugt werden oder indem gesunde Kulturen verwendet werden, in denen krankheitsspezifische Treibermutationen durch CRISPR/Cas9-Genom-Editing eingebracht werden können20.
Obwohl Tubuloide mehrzellige Nierenkulturen sind, fehlen ihnen mehrere Nierenzelltypen, einschließlich Podozyten und Endothelzellen8. Darüber hinaus haben Tubuloide im Gegensatz zu einigen anderen ASC-abgeleiteten Organoidmodellen ein begrenztes Replikationspotenzial, da sie für etwa 15 Passagen kultiviert werden können. Diese begrenzte Lebensdauer kann jedoch durch die Zugabe von Wnt zum Kulturmedium21deutlich verlängert werden. Eine weitere Optimierung des Tubuloid-Kulturprotokolls ist erforderlich, um sie noch repräsentativer für die Niere zu machen, einschließlich differenzierterer Zelltypen. Obwohl die Effizienz der tubuloiden Etablierung aus Gewebeproben sehr hoch ist (>95%), kann sie in seltenen Fällen versagen. Es kann verschiedene Ursachen geben, darunter: 1) schlechte Qualität des Ausgangsmaterials(z. B.nekrotisches Gewebe als Folge einer medikamentösen Behandlung), 2) Überverdauung der Gewebeprobe oder 3) Kontamination der Primärprobe.
Um sicherzustellen, dass die Qualität der erhaltenen Gewebeproben ausreicht, um mit dem Protokoll fortzufahren, ist es wichtig, engen Kontakt mit dem Pathologiepersonal zu halten, das die Bewertung des Gewebes nach der Operation durchführt. Wenn ausreichend Material vorhanden ist, muss seine Lebensfähigkeit durch histologische Untersuchung(z. B.Hämatoxylin- und Eosinfärbung) bestätigt werden. Um die Zelllyse während der enzymatischen Verdauung zu verhindern, ist es außerdem wichtig, dass der Inkubationsprozess nicht länger als 1 h dauert. Um eine Kontamination zu verhindern, sollten antibiotika und antimykotische Mittel schließlich den Wasch- und Kulturmedien zugesetzt werden.
Urin kann exfolierte Epithelzellen enthalten, die nicht aus der Niere22stammen, die die tubuliförmigen Kulturen kontaminieren können. Dazu gehören beispielsweise Urothelzellen, die im Gegensatz zu nierentubulären Zellen positiv für das Tumorprotein P63 und negativ für PAX88sind. Es wird daher empfohlen, die Kulturen auf PAX8-Positivität zu testen, um die Reinheit etablierter Nierentupuloidlinien zu bestätigen, bevor mit Folgeexperimenten fortgefahren wird (Abbildung 4B).
Urin stellt aufgrund des hohen osmotischen Drucks und des niedrigen pH-Werts eine feindliche Umgebung für Zellen dar. Für den Erfolg des Protokolls ist es daher entscheidend, dass die Proben so schnell wie möglich nach der Urinentnahme verarbeitet werden. Daher sollte der gesammelte Urin so schnell wie möglich verdünnt und umfassend mit gepufferter Lösung gewaschen werden, um sicherzustellen, dass zum Zeitpunkt der Aussaat lebensfähige Zellen vorliegen. Die Erfolgsrate der Tubuloid-Etablierung nimmt signifikant ab, wenn Urin vor der Verarbeitung mehrere Stunden gelagert wird. Schließlich, obwohl steril, hat Urin ein hohes Risiko der Kontamination im Zusammenhang mit dem Sammelprozess. Es ist daher wichtig, Wasch- und Wachstumsmedium mit Antibiotika und Antimykotika zu ergänzen. Unter Berücksichtigung all dessen kann eine Erfolgsquote von ca. 50% erreicht werden.
Offenlegungen
Die Autoren erklären keinen Interessenkonflikt.
Danksagungen
Wir danken allen Patienten und ihren Familien für die Teilnahme an der Studie. Wir danken dem klinischen Team, das unsere Forschung ermöglicht hat. Wir sind dankbar für die Unterstützung des Starting Grant des Europäischen Forschungsrats (ERC) 850571 (J.D.), der Niederländischen Krebsgesellschaft (KWF)/Alpe d'HuZes Bas Mulder Award (Nr. 10218, J.D.), des Oncode Institute und der Foundation Children Cancer Free (KiKa Nr. 292, C.C.)
Materialien
| Name | Company | Catalog Number | Comments |
| A83-01 | Tocris | 2939/10 | Stock of 5 mM, final concentration of 5 µM, activin receptor-like kinase 5 inhibitor |
| Advanced DMEM/F12 | ThermoFisher Scientific | 12634010 | |
| antiPAX8 antibody | LSBio | LS-B13466 | |
| B27 supplement | ThermoFisher Scientific | 17504044 | Stock of 50x, final concentration of 1x |
| BME | Trevigen | 3533-010-02 | |
| Collagenase | Sigma Aldrich | C9407 | Stock of 10 mg/mL, final concentration of 1 mg/mL |
| EGF | Peprotech | AF-100-15 | Stock of 0.5 mg/mL, final concentration of 50 ng/mL |
| FGF10 | Peprotech | 100-26 | Stock of 0.1 mg/mL, final concentration of 100 ng/mL |
| GlutaMAX - L-alanine/L-glutamine | Gibco | 35050061 | Stock of 100x, final concentration of 1x |
| Hepes | Gibco | 15630106 | Stock of 1 M, final concentration of 10 mM |
| Multiwell tissue culture plates 12 wells | CELLSTAR | 665180 | |
| Multiwell tissue culture plates 24 wells | CELLSTAR | 662160 | |
| Multiwell tissue culture plates 6 wells | CELLSTAR | 657160 | |
| N-acetylcysteine | Sigma Aldrich | A9165 | Stock of 500 mM, final concentration of 1.25 mM |
| Penicillin/Streptomycin | Gibco | 15140163 | Stock of 10.000 U/mL, final concentration of 100 U/mL |
| Primocin - broad-range antibiotics | Invivogen | ant-pm-1 | Stock of 50 mg/mL, final concentration of 0.1 mg/mL |
| Red blood cells lysis buffer | Roche | 11814389001 | |
| RhoKinase inhibitor Y-27632 | Abmole Bioscience | M1817 | Stock of 100 mM, final concentration of 10 µM |
| R-spondin conditioned medium | Produced in house with the use of stable cell lines generated by Calvin Kuo lab. Final concentration is 10% | ||
| TrypLe Express/ trypsin replacement agent | ThermoFisher Scientific | 12605010 |
Referenzen
- Romagnani, P., et al. Chronic kidney disease. Nature Reviews. Disease Primers. 3, 17088 (2017).
- Ooms, A. H., Calandrini, C., de Krijger, R. R., Drost, J. Organoid models of childhood kidney tumours. Nature Reviews. Urology. 17 (6), 311-313 (2020).
- Takasato, M., et al. Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis. Nature. 526 (7574), 564-568 (2015).
- Low, J. H., et al. Generation of human PSC-derived kidney organoids with patterned nephron segments and a de novo vascular network. Cell Stem Cell. 25 (3), 373-387 (2019).
- Little, M. H., Combes, A. N. Kidney organoids: accurate models or fortunate accidents. Genes & Development. 33 (19-20), 1319-1345 (2019).
- Papapetrou, E. P. Patient-derived induced pluripotent stem cells in cancer research and precision oncology. Nature Medicine. 22 (12), 1392-1401 (2016).
- Wu, H., et al. Comparative analysis and refinement of human PSC-derived kidney organoid differentiation with single-cell transcriptomics. Cell Stem Cell. 23 (6), 869-881 (2018).
- Schutgens, F., et al. Tubuloids derived from human adult kidney and urine for personalized disease modeling. Nature Biotechnology. 37 (3), 303-313 (2019).
- Jun, D. Y., et al. Tubular organotypic culture model of human kidney. PLoS One. 13 (10), 0206447 (2018).
- Grassi, L., et al. Organoids as a new model for improving regenerative medicine and cancer personalized therapy in renal diseases. Cell Death & Disease. 10 (3), 1-15 (2019).
- Yousef Yengej, F. A., Jansen, J., Rookmaaker, M. B., Verhaar, M. C., Clevers, H. Kidney organoids and tubuloids. Cells. 9 (6), 1326 (2020).
- Calandrini, C., et al. An organoid biobank for childhood kidney cancers that captures disease and tissue heterogeneity. Nature Communications. 11 (1), 1310 (2020).
- Jansen, J., et al. A morphological and functional comparison of proximal tubule cell lines established from human urine and kidney tissue. Experimental Cell Research. 323 (1), 87-99 (2014).
- Zhou, T., et al. Generation of human induced pluripotent stem cells from urine samples. Nature Protocols. 7 (12), 2080 (2012).
- Drost, J., Clevers, H. Organoids in cancer research. Nature Reviews Cancer. 18 (7), 407-418 (2018).
- Vlachogiannis, G., et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science. 359 (6378), 920-926 (2018).
- Ooft, S. N., et al. Patient-derived organoids can predict response to chemotherapy in metastatic colorectal cancer patients. Science Translational Medicine. 11 (513), (2019).
- Tiriac, H., et al. Organoid profiling identifies common responders to chemotherapy in pancreatic cancer. Cancer Discovery. 8 (9), 1112-1129 (2018).
- Morales-Alvarez, M. C. Nephrotoxicity of antimicrobials and antibiotics. Advances in Chronic Kidney Disease. 27 (1), 31-37 (2020).
- Drost, J., et al. Sequential cancer mutations in cultured human intestinal stem cells. Nature. 521 (7550), 43-47 (2015).
- Miao, Y., et al. Next-generation surrogate Wnts support organoid growth and deconvolute Frizzled pleiotropy in vivo. Cell Stem Cell. 27 (5), 840-851 (2020).
- Dörrenhaus, A., et al. Cultures of exfoliated epithelial cells from different locations of the human urinary tract and the renal tubular system. Archives of Toxicology. 74 (10), 618-626 (2000).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten