このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ヒト腫瘍細胞及び異種マウスにおけるマクロピノサイトシスにより媒介されるATP内在化のための蛍光顕微鏡
* これらの著者は同等に貢献しました
要約
ATPサロゲートである非加水分解蛍光アデノシン三リン酸(ATP)の高い細胞分解能を可視化する再現性のある方法を開発しました。我々は、ヒト腫瘍組織を用いて異種移植されたヒト腫瘍細胞株および免疫不全マウスを用いて、イン ビトロ および インビボ内 独立のアッセイを用いて我々の方法を検証した。
要約
アデノシン三リン酸(ATP)は、細胞外ATP(eATP)を含む、薬剤耐性、上皮間葉転移(EMT)、転移などの腫瘍形成の様々な側面において重要な役割を果たすることが示されている。腫瘍内eATPは、通常組織よりも濃度が10 3〜10倍高い。eATPはEMT誘導のための純粋なシグナル伝達を活性化するメッセンジャーとして機能する一方で、特定のタイプのエンドサイトーシスである上方制御されたマクロピノサイトーシスを通じて癌細胞によって内在化され、多種多様な生物学的機能を実行する。これらの機能には、ATPを必要とする生化学反応にエネルギーを提供すること、シグナル伝達中にリン酸基を寄付すること、転写補因子としての遺伝子発現の促進または加速が含まれる。ATPは容易に利用でき、癌および他の分野での研究は間違いなく増加するだろう。しかし、eATPの研究は初期段階にとどまっており、eATPと内部化された細胞内ATPが行う重要で汎用性の高い活動が完全に解明される前に、未解決の質問は未回答のままです。
これらの著者の研究者のこれらの初期のeATP研究への貢献は、非加水分解蛍光ATPの顕微鏡イメージング、マクロピノサイトーシスおよびエンドサイトーシストレーサーとして機能する高分子および低分子蛍光デックストランス、ならびにeATP化プロセスを監視し、特徴付けるために様々なエンドサイトーシス阻害剤を含む。このイメージングモダリティは、腫瘍細胞株及び免疫不全マウスに適用され、ヒト癌腫瘍を用いて異種移植し、 インビトロ 及び インビボでeATP内在化を研究した。本論文では、マクロピノサイトーシス/エンドサイトーシスを介したeATP内在化アッセイを異なるシステムで正常に実行できるようにアッセイ条件の修正と微調整を重視した、イン ビトロ および インビボ プロトコルについて説明する。
概要
腫瘍外細胞外(すなわち)栄養素の日和見摂取は、最近、癌代謝の重要な特徴と命名された1.これらの重要な栄養素の1つはATPであり、ieATPの濃度は正常組織に見られるものよりも103および10倍高く、数百μM〜低mM2、3、4、5の範囲である。重要なエネルギーとシグナル伝達分子として、ATPは癌性および健康な細胞6、7、8における細胞代謝において中心的な役割を果たす。細胞外ATPは癌細胞増殖に関与するだけでなく、薬剤耐性を促進する9.最近、ATPの認識されていない機能は、最近同定されており、アルツハイマー病10などの疾患にATPが関与する。確かに、がん細胞、健康な細胞、その他の病気の細胞におけるATPとその機能に関する私たちの理解は決して完全ではありません。しかし、細胞の不安定性と高い回転率のために、細胞膜を横切って細胞内へのATPの動きを監視することは技術的に困難です。
この問題に対処し、この研究領域の必要性を満たすために、非加水分解性蛍光ATP(NHF-ATP)(図1)を代理としてATPの内部化を可視化し、インビトロとインビボ11、12の両方の内在化ATPの細胞内空間局在化を観察する方法を開発した。.NHF-ATPは、動物細胞膜を横切るATPの動きを調査するために内因性ATPの代用を示し、癌細胞株および免疫不全マウス11,12上に異種移植されたヒト腫瘍組織の両方で行う。また、eATP内在化を遮断した細胞にマクロピノサイトーシス阻害剤を投与し、eATPの細胞内取り込みは、マクロピノサイトーション機構9、11、12を伴うことを示唆している。このプロトコルは、細胞特異的タンパク質に対する免疫ベースのコラベル化を可能にし、したがって、どの細胞タイプがNHF-ATPを内在化するかを同定する。生体内腫瘍異種移植片と高解像度顕微鏡を用いて、NHF-ATPは組織サンプル全体、さらには単一細胞内でも空間的に可視化することができる。これらの方法は、細胞の取り込みの割合、マクロピノサイトー小胞の数、および内在化動態などの定量的分析も可能にする。この論文では、NHF-ATPが、単独で、またはエンドサイトーシストレーサー蛍光デクストランス13、14、15、16と一緒に働いて、細胞内在化に続くATPの内在化および細胞内局在化を研究するために、異なる実験設定で使用される方法を詳細に述べる。

図1:非加水分解性蛍光ATPおよびテトラメチルローダミンの構造は、高分子量蛍光デキストラン(A)NHF-ATPの構造を標識した。(B) HMWFDの概略表現。略語: ATP = アデノシン三リン酸;NHF-ATP = 非加水蛍光ATP;TMR = テトラメチルロダミン;HMWFD = 高分子量蛍光デキストランこの図の大きなバージョンを表示するには、ここをクリックしてください。
Access restricted. Please log in or start a trial to view this content.
プロトコル
ここに報告されたすべての手順は、オハイオ大学のIACUCおよびNIHに従って行われた。
1. 非加水分解性蛍光ATP(NHF-ATP)およびデックストランスの選択
- 蛍光ホスホア結合NHF-ATP(図1A)およびエンドサイトシストレーサー、高分子蛍光デックストランス(TMR-HMWFDおよびTMR-LMWFD)(図1B))を選択し、適切なフィルタを搭載した発光波長(例えば、適切なフィルタを搭載したイメージングシステム)および特定のエンドサイトシスプロセスを選択する。
2. ATPローカリゼーション研究,インビトロ(図2)
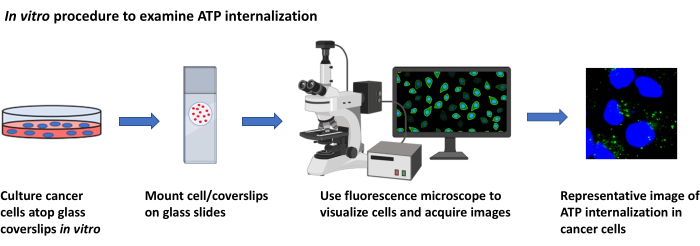
図2: IN Vitro の手順でATPの内部化を調べる。 蛍光顕微鏡を用いた培養癌細胞における細胞外ATPの内在化を可視化するプロトコルの概略図表。 この図の大きなバージョンを表示するには、ここをクリックしてください。
- 細胞培養と細胞の調製
注:組織培養フードで無菌条件下で細胞培養を行います。- 10%(v/v)胎児ウシ血清(FBS)と1%(v/v)ペニシリン/ストレプトマイシン(ここでは)を含むダルベッコの修正イーグル培地(DMEM)を準備する DMEM/FBSと呼ばれ、無菌リン酸緩衝生理食塩水(PBS)、および0.25%トリプシン/エチレンアミン酢酸(EDTA)を37°Cの水浴に使用した。
- 100mm組織培養皿でのDMEM/FBSのヒト癌細胞の培養。5%CO2雰囲気で37°Cに設定したインキュベーター内の細胞を維持します。
- 細胞が合流に達すると、まず培養液を除去して細胞を通過させる。次に、5 mLの無菌PBSで皿をすすいで、PBSを取り除き、0.25%トリプシンの3 mLを加えます。5%CO2雰囲気で37°Cで5分間インキュベートします。
- 皿を取り出し、6 mLのDMEM/FBSを加えてトリプシンを止める。懸濁液中の細胞を15mL円錐形チューブに移し、遠心分離機を800×gで5分間細胞をペレット化する。
- 遠心分離後、上清を吸引し、10 mLのDMEM/FBSを使用して、ピペット処理により細胞ペレットを再懸濁します。
- ヘモサイトメーターを使用して、細胞密度と生存率をカウントします。DMEM/FBSを使用して、セル懸濁液を約7.5×4セル /mLの密度に希釈します。
- カバーリップと播種細胞の調製
- 70%エタノールで12mmのカバーリップを洗い、繊細な作業ワイプで慎重に拭きます。オートクレーブ処理を介してカバーリップと1組の鉗子を殺菌します。
- 組織培養フードでは、鉗子を使用して、24ウェル組織培養プレートの各ウェルに1つのカバースリップを配置します。
注:後で、カバースリップは、細胞と、イメージングのために顕微鏡スライドに直接取り付けられます。 - 細胞懸濁液(DMEM/FBSのセル)の300 μLを、1ウェルあたり〜2.5×10個の細胞の播種密度で、滅菌されたカバースリップを含む24ウェルプレートに分配する。5%CO2流を有する37°Cで無菌条件でインキュベートする。
- 細胞の飢餓
- シード処理の 24 時間後に、各ウェルから DMEM/FBS を取り外します。すぐに各ウェルに300μLの無血清DMEMを加え、細胞外栄養素の取り込み誘導のために15〜18時間細胞を血清飢餓させます。
注: 15-18 h の飢餓期間は重要なパラメータです。
- シード処理の 24 時間後に、各ウェルから DMEM/FBS を取り外します。すぐに各ウェルに300μLの無血清DMEMを加え、細胞外栄養素の取り込み誘導のために15〜18時間細胞を血清飢餓させます。
- NHF-ATPおよびHMWFD/LMWFDソリューションの準備
- 分析バランスを使用して、高分子量(70 kDa)蛍光TMRデキストラン(TMR-HMWFD、1mg/mL)、マクロピノソームを視覚化するためのトレーサー、または1.5 mLマイクロ遠心チューブ内の無血清DMEM中のNHF-ATP(10μmol/L)を計量します。37°Cの水浴に、光から保護されたチューブを15分間置きます。
- 室温で5分間12,000×gの遠心分離機。透明な上清を新しい1.5 mLマイクロ遠心分離チューブに慎重に移し、ペレットや破片をそのまま残して不溶性の結晶を除去します。
- ステップ2.4.1の溶液を各ウェルの細胞に加え、37°Cで30分間培養します。
注:HMWFDとNHF-ATP溶液を混合して細胞との共培養を行う場合は、両方の溶液を最終濃度の2倍にして調製してください。溶液は、最終的な正確な作業濃度を達成するために、1:1の比率で後で混合されます。試薬は光に敏感なので、光を避けてください。
- 細胞の治療と固定
- 新鮮な24ウェルプレートで、500 μLのプリウォームドPBSを5つのウェルのそれぞれに分配します。
- 細胞インキュベーション後、鉗子を使用して各カバースリップを慎重に拾います。プリウォームドPBSの500 μLに浸して、カバースリップを1つずつすすめます。5つのPBS充填されたウェルを使用して5回繰り返します。
注:細胞オンカバーリップの穏やかな洗浄は、この実験の成功のために重要です。 - 最後のPBS洗浄後、繊細な作業ワイプのカバースリップをタップして余分なPBSを吸収し、カバースリップを24ウェルプレートにプリセットした3.7%ホルムアルデヒドをすぐに冷やして転送します。室温で15分間細胞を固定します。
- 細胞が固定されている間、プレクリーン顕微鏡は70%エタノールでスライドします。ウェルからカバーリップを取り外し、カバースリップごとに核染色4′、6-ジミディノ-2フェニリンドール(DAPI)を含む水性取り付け媒体5μLを使用してスライドに取り付けます。ペーパータオルまたは繊細なタスクワイプで余分なPBSをやさしく拭きます。
- 蛍光顕微鏡と画像取得
- 上記のステップの2~24時間後に、蛍光イメージングシステムとデータ取得ソフトウェアを使用して、細胞および内部化されたHMWFDおよび/またはNHF-ATPの画像をキャプチャします。
注:このサブセクションでは、ニコンNiU顕微鏡、蛍光イメージング機能を搭載した画像を取得する手順、およびニコンNISエレメンツソフトウェアについて説明します。しかし、他の同等の撮像システムおよび取得ソフトウェアが使用されてもよい。製造元の操作手順に従います。- スライドを双眼鏡モードで直立した発蛍光顕微鏡のステージに置きます。イメージングプログラムにアクセスします。
- 10xの目標を選択し、フォーカスを定義するためにステージを調整し、左から右にスライドをスキャンして、関心のある領域を識別します。
注:関心のある領域の特定は細胞タイプによって異なり、一部の細胞株/癌タイプはTMR-HMWFDおよび/またはNHF-ATP取り込みの多様かつ明確な程度を示します。 - 40xの目的を選択し、顕微鏡のトグルを使用して双眼鏡モードから画像キャプチャモードに切り替えます。
- イメージングプログラムの ライブ品質 アイコンをクリックして、画像を表示し、その後取得します。
- [注釈と測定]ツールバーの[OC]パネルを使用して、各フィルタキューブまたは蛍光チャネルの露出パラメータを定義します。
注:信号強度が異なるように、各チャンネルに適した露出時間を選択します。たとえば、DAPI の露出時間として 200 ミリ秒、HMWFD の場合は 2 秒、NHF-ATP の場合は 4 秒を選択します。チャンネルごとに露光時間が決まったら、この設定をチャンネルごとに、異なる処理や条件で、すべての画像に対して使用します。 - 各チャンネルに露出設定を設定したら、マルチチャンネル取得ツールバーを使用して、定義された露出設定で3チャンネル画像を取得します。
メモ:マルチチャンネルND取得モードでの画像取得により、同じ視野のチャンネルごとに自動画像キャプチャが可能になります。タレットの変更の合間にシャッターが自動的に閉じられます。 - また、フィルタキューブ間の切り替え、露光時間の設定、各チャンネルの画像取得の間のシャッターのクローズ/オープン、個々のチャンネルで撮影した各画像のオーバーレイを行い、マルチチャンネル画像を手動で取得します。
注: ND 取得モードでは、このプロセスを自動化し、マージされたイメージを提供します。 - イメージを .nd2 ファイルとして保存します (ニコン要素形式はメタデータを保存します)。結合されたチャンネル画像や個々のチャンネル画像を含むTIFファイルを保存します。
注:TIFファイルは、ソフトウェアアプリケーションの幅広い選択で使用することができます。 - [解析] ツールバーの[オブジェクト数]機能を使用して、保存された .nd2 イメージ ファイルの NHF-ATP、TMR-HMWFD、および/または TMR-LMWFD 陽性セルの数をカウントします。
- 分析プログラムを使用して、データをスプレッドシートにエクスポートします。
- 上記のステップの2~24時間後に、蛍光イメージングシステムとデータ取得ソフトウェアを使用して、細胞および内部化されたHMWFDおよび/またはNHF-ATPの画像をキャプチャします。
- データの定量と分析
- アッセイした条件ごとに、定量化のための画像50〜100個の細胞。データ解析ソフトウェア(起蛍光イメージングシステムまたはその他のソフトウェアに含まれるソフトウェア)を使用して、細胞あたりの蛍光小胞の平均数をカウントし、計算します。
- 適切な統計手法を使用して、定量化された結果を分析します。
3. 腫瘍におけるATP内在化,ex vivo (図3)

図3: IN vivo の手順で ATP の内部化を調べる。 凍結切除および蛍光顕微鏡を用いた腫瘍異種移植片における細胞外ATPの内在化を可視化するプロトコルの概略図表 この図の大きなバージョンを表示するには、ここをクリックしてください。
- 移植のための細胞培養の準備
- 225 cm2 フラスコで 37 °C で 80% 合流したがん細胞を成長させ、FBS を補充した DMEM を使用して、1% (v/v) の最終濃度 (v/v) と 1% (v/v) でペニシリン/ストレプトマイシンの最終濃度に成長します。
- 10mLのPBSで細胞を2回洗います。プリウォーム 0.25% トリプシン/EDTA 37 °C. トリプシン/EDTAを8 mL加え、37°Cで2分間インキュベートします。
- フラスコの底部から細胞が取り外し始めたら、10 mLの無菌血清学的ピペットを使用して8 mLのDMEM/FBSを加えます。任意の接着細胞を取り除くために2回吸引する。ピペットを使用して、フラスコから50 mLの円錐状のチューブに切り離した細胞を移します。
- 10 mL ピペットを使用して 10 mL の DMEM/FBS を追加し、残りのすべての浮遊セルを同じ 50 mL 円錐形チューブに集めます。
- 600×gで細胞懸濁液を遠心分離し、4°Cで4分間。上清を取り除き、氷冷PBSの1mLで細胞を再懸濁します。
- ヘモサイトメーターを使用して細胞密度をカウントします。カウントしながら、氷の上に細胞懸濁液を保ちます。
- 600×gで細胞懸濁液を遠心分離し、4°Cで4分間。上清を取り除き、細胞密度がPBSの100μLあたり5×106細胞になるように氷冷PBSで細胞を懸濁させる。細胞懸濁液を1.5 mLマイクロ遠心チューブに移します。
- 異種移植腫瘍発生のための癌細胞の皮下注射
- がん細胞の注入には、精密滑空針(27G針)を用いたラテックスフリーシリンジ(1mL)を使用してください。
- 細胞懸濁液(5×106、PBSの100 μL)を1.5mLマイクロ遠心チューブに移します。細胞をシリンジに引き込みます。
- 免疫不全(ヌード)マウスの脇腹に注射部位を選択し、75%エタノールを使用して皮膚を静かに洗浄します。余分なエタノールを繊細な作業ワイプで拭き取ります。
- 皮下注射の場合は、針を皮膚に対して約10°の角度で保持します。針の先端、ベベル側を皮膚のすぐ下に挿入し、針の1〜2mmだけが皮膚の外に見えるようにします。約10s以上ゆっくりとシリンジから細胞を分配します。
- ボリューム全体を注入した後、3-5秒の針を所定の位置に保持し続け、針を引き出し、注射部位に3〜5秒間穏やかだがしっかりとした圧力をかけるように指を使って注入された内容の漏れを防ぐ。
- 腫瘍が200〜500mm3の体積に達するまで、バーニアキャリパーを使用して腫瘍の成長を監視および測定する。
- 腫瘍切除術後に使用されるHMWFDおよびNHF-ATP溶液の調製
- 16 mg/mL HMWFDの300 μLを無血清DMEM(培養培地)に溶解し、37°Cの水浴中で30分間インキュベートし、遠心分離機を12,000×gで5分間溶解します。 溶液を1.5 mLマイクロ遠心チューブに移します。
- 40 μLのNHF-ATPアナログストック(1 mM)を160 μLの無血清DMEMに加え、0.2 mM NHF-ATP溶液を調製します。
- 実験井戸の作製
注:この実験計画は、マクロピノソームによる取り込みの指標であるHMWFD+NHF-ATPの細胞内内イントラニゼーションをアッセイします。- ウェルを次のように準備します: よく #1, コントロール: 200 μL の無血清 DMEM;まあ#2、コントロール:16 mg /mL LMWFDの100 μL + 100 μLの無血清DMEM = 200 μL 8 mg/mL LMWFD;ウェル#3、コントロール:0.2 mM NHF-ATPの100 μLは、無血清DMEM = 0.1 mM NHF-ATPの200 μLです。まあ#4;実験:100 μL 16 mg/mL HMWFD + 100 μL 0.2mM NHF-ATP = 0.1 mM NHF-ATP および 8 mg/mL HMWFD の 200 μL。
- 腫瘍組織の調製
- 頸部脱臼によって、またはIACUC承認の議定書に従ってマウスを安楽死させる。
- サイズ10メスを使用して、分離された腫瘍を〜500~1,000μmの厚さにスライスします。
- 100 μM NHF-ATP を補った無血清 DMEM の腫瘍スライスを、5% CO2 の流量で 37 °C でマイクロ遠心分離チューブで 40 分間、マイクロ遠心分離管で 8 mg/mL H/LMWFD インキュベートします。
注:インキュベーション後、腫瘍組織代謝は、培地の色が変化する原因となる。 - 37°CプレウォームドPBS(24ウェルプレートの各リンスに対して2mL)で組織をリンスします。
- 事前に温めた新鮮なPBSで新しい24ウェルプレートに組織を移し、すすいで穏やかな揺れで4回繰り返します。
- クライオ埋め込み(凍結組織ブロックの準備)
- 採取する腫瘍ごとに識別ラベルを用意します。2cmの実験室用テープを切り、半分に折り、側面を縦に折ります。マーキング ペンを使用して、たとえば、マウス/腫瘍識別番号を使用してタグにラベルを付けます。
- ステンレス鋼のティッシュ型をドライアイスの上に直接置くことによって埋め込み型を準備する。
注:ドライアイスは凍傷、やけど、窒息を引き起こす可能性があります。ドライアイスを扱う際は、絶縁手袋を着用してください。換気の良い場所でドライアイスを使用してください。密閉容器にドライアイスを入れておかないでください。代わりに、ガスが逃げる容器(発泡スチロールクーラーなど)に保管してください。 - カビが冷え込む間、組織凍結培地の小さなプールを10mmの組織培養プレートに入れます。収穫される腫瘍組織を水没させるのに十分な量であることを確認してください。
- 穿穿なるスプーンを使用して切除された腫瘍組織をすくい上げ、すぐに組織を凍結媒体に入れ、組織が水没することを保証する。穿クロススプーンを使用して、凍結媒体で組織をそっとロールし、培地がすべての組織表面を浴びっていることを確認します。
- 凍結培地を含む埋め込み型に組織を慎重に移動します。対応するラベル タグを固定メディア/金型に垂直に配置して、所定の位置にフリーズします。書き込まれたラベルがメディアの外側に表示されていることを確認します。
- 凍結が完了したら(凍結媒体は不透明白色に変わります)、組織ブロックをカビから取り出し、ドライアイスの上に置き、腫瘍ごとに繰り返します。組織ブロックは、凍結切断手順の前に数ヶ月間-80 °Cで保管してください。
- 組織サンプルのスライドの調製
- 内在化陽性細胞を見つけ、より代表的な組織領域を有する可能性を最大限に高めるために、クライオスタットを使用して-18〜-20°Cの連続凍結切片を収集する。
- プレチルクライオスツール(ブレード、カミソリブレード、アンチロールプレート、ティッシュチャックホルダー、ペイントブラシ)と-18〜-20°Cのクライオスタットチャンバーに配置することにより、腫瘍組織ブロックを平衡化します。 ブレードホルダーの角度を5~10°に設定します。必要に応じて、カミソリの刃で組織ブロックを慎重にトリミングし、組織凍結媒体を「接着剤」として使用してチャックホルダーに取り付けます。
- チャックホルダーをマイクロトームユニットの垂直位置にロックし、ハンドクランクの各ターンで設定距離(例えば10 μm)に進みます。アンチロールプレートを、ブレードの高さのすぐ上に置きます。ミクロトームを進める前に組織のカールを防ぐために、慎重に組織ブロックの下端に親指をスライドさせます。
- ミクロトームが進み、組織セクションが金属板に落ちるにつれて、必要に応じて、ペイントブラシを使用して組織セクションを導き、組織を展開します。
- 顕微鏡は、セクションがスライドに引き付けられるように触れることなく、組織セクションの上にスライドを置きます。
注意:クライオスタットブレード(ハイプロファイル、使い捨て)は非常に鋭く、重傷を引き起こす可能性があります。ブレードを取り扱い、クライオスタットを操作する際は注意してください。ブレード プロテクタ (可能な場合) を使用します。適切なトレーニングが必要です。 - 腫瘍を10μmの厚さのセクションにスライスします。すぐに正に帯電したガラス顕微鏡スライドにスライスされたセクションを移す。
注:シリアルセクションの場合は、最初に正に充電された8枚のスライドの左上隅に10 μmの厚さのセクションを集めます。その後の100~200μmの組織を通してクライオスタットを進め、組織を捨てます。すべてのスライスした切片を、すぐにガラス顕微鏡スライドに移します。 - 次に、8枚のスライドのそれぞれについて、以前に配置された組織セクションの隣に、別の10 μmの厚さのセクションを集めます。8枚のスライドのそれぞれに8つの組織セクションが含まれるまで、このシリアル収集プロセスを繰り返します。蛍光を維持するために、暗闇の中で組織の切片を保ちます。
メモ:スライド上の組織セクションは、数ヶ月間-80°Cのスライドボックスに保存することができます。
- 内在化陽性細胞を見つけ、より代表的な組織領域を有する可能性を最大限に高めるために、クライオスタットを使用して-18〜-20°Cの連続凍結切片を収集する。
- 組織スライドの固定
- 臨界ステップ:-18~-20°Cで95%エタノールで組織切片を5分間固定します。
- 固定セクションを室温PBSで5分間洗浄し、DAPIを使用した水性取り付け媒体の10 μLを使用して、固定腫瘍セクションをガラスカバースリップの下に取り付けます。
- 取り付け後12〜24時間、上記の培養細胞について説明したように、蛍光顕微鏡による固定腫瘍切片を調べ、画像を取得する。
- 蛍光顕微鏡と画像取得
- セクション2.6で説明されているように、関心のある領域を特定し、画像を取得します。
- データの定量と分析
- セクション 2.7 のように、セルを定量化し、適切な統計分析を適用します。
4. 腫瘍におけるATP内在化, 生体内
- セクション3.1に記載されているように移植のための細胞培養を準備する。
- 異種移植腫瘍発生のための癌細胞の皮下注射
- セクション3.2に記載されているように異種移植腫瘍を生成する。
- 異種移植片腫瘍へのATPおよび/またはデキストラン注射
- 上記のように、DMEM(車両)または8 mg/mL HMWFDまたはLMWFDの治療溶液を、上記のとおり、DMEMでNHF-ATP(100 μM)の有無にかかわらず調製します。
- 1 mL シリンジを使用して、1 つの治療溶液の 50 μL を収集し、各異種移植片腫瘍に直接注入します。各処置の4つの生物学的複製に対して手順を繰り返す。
- 組織収穫と凍結埋め込み
- 採取する腫瘍ごとに識別ラベルを用意します。2cmの実験室用テープを切り、半分に折り、側面を縦に折ります。マーキング ペンを使用して、たとえば、マウス/腫瘍識別番号を使用してタグにラベルを付けます。
- 約5分の注射後、子宮頸部脱臼によってマウスを安楽死させるか、またはIACUC承認プロトコルに従って。
- メスのサイズを10個使用して、腫瘍に隣接し、針注射の方向に対してほぼ垂直に切開を行う。周囲の組織から腫瘍組織を切除するために鉗子と外科用はさみを使用してください。
- 腫瘍の合計サイズに応じて、腫瘍を2〜4個の1cm2 個に分けます。
- 埋め込み金型を準備し、上記のセクション3.6で説明したように、組織を埋め込みます。腫瘍内デキストラン注射からクライオ埋め込みまでの収穫時間が7〜8分以下であることを確認してください。
- 組織サンプルのスライドの調製
- セクション3.7で説明されているように、連続腫瘍セクションを収集します。
- 組織スライドの固定
- セクション3.8に記載されているように、組織を固定します。
- 蛍光顕微鏡と画像取得
- セクション2.6で説明されているように、関心のある領域を特定し、画像を取得します。
- データの定量と分析
- セクション 2.7 で説明されているように、セルを定量化し、適切な統計分析を適用します。
Access restricted. Please log in or start a trial to view this content.
結果
インビトロ 研究
NHF-ATPの細胞内内内イントラニゼーションは、HMWFDまたはLMWFDとのNHF-ATPの共局化によって実証された(図4)。この手順の成功は、主に、NHF-ATPおよびデクストランスの適切な濃度の使用とデクストランス(ポリリジン対中性)の適切なタイプを決定することに依存する。例えば、マクロピノサイトーシスを調査するために、HMWF...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
非加水分解性ATPの細胞内在化の空間的、時間的、定量的な分析のために開発された方法。この方法は、様々な腫瘍形成モデルを含む多様な生物学的システムでの使用に広く適用され、技術的な指示および代表的なデータを提供しています。 in vivo ATPの内在化研究(プロトコルのセクション4)の間に解釈可能なデータを取得するには、腫瘍内デキストラン注射からクライオ埋め込みに経過?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者らは競合する利益を宣言しない。
謝辞
クライオセクションは、オハイオ大学組織病理学コアで現場で行われました。この作品は、Cニールセンへのスタートアップ資金(オハイオ大学芸術科学大学)によって部分的に支えられ、その一部は支援されました。NIHは、XチェンにR15 CA242177-01とRSAC賞を付与します。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| A549 cells, human lung epithelial, carcinoma | National Cancer Institute | n/a | Less expensive source |
| Acetone | Fisher Scientific | S25904 | |
| Aluminum foil, Reynolds | Grainger | 6CHG6 | |
| Aqueous Mounting Medium, ProLong Gold Anti-fade Reagent | ThermoFisher | P36930 | |
| ATP analog | Jena Biosciences | NK-101 | |
| Autoclave, sterilizer | Grainger | 33ZZ40 | |
| Blades, cryostat, high profile | C. L. Sturkey, Inc. | DT554550 | |
| Calipers, vernier | Grainger | 4KU77 | |
| Cell medium, Ham's Nutrient Mixture F12, serum-free | Millipore Sigma | 51651C-1000ML | |
| Centrifuge, refrigerated with swinging bucket rotor | Eppendorf | 5810R | |
| Chloroform | Acros Organics | 423555000 | |
| Conical tube, 15 mL | VWR | 21008-216 | |
| Conical tube, 50 mL | VWR | 21008-242 | |
| Coverslips, glass, 12 mm | Corning | 2975-245 | |
| Cryostat, Leica CM1950 | Leica Biosystems | CM1950 | |
| Delicate task wipe, Kim Wipes | Kimberly-Clark | 34155 | |
| Dextran, Lysine fixable, High Molecular Weight (HMW) | Invitrogen | D1818 | MW = 70,000, Tetramethylrhodamine |
| Dextran, Neutral, High Molecular Weight (HMW) | Invitrogen | D1819 | |
| Dulbecco's Modified Eagle Medium (DMEM), serum-free | Fisher Scientific | 11885076 | |
| Dry ice | Local delivery | Custom order | |
| Epifluorescent imaging system, Nikon NiU and Nikon NIS Elements acquisition software | Nikon | Custom order | |
| Ethanol | Fisher Scientific | BP2818-4 | |
| Fetal bovine serum (FBS) | ThermoFisher | 16000044 | |
| Forceps, Dumont #7, curved | Fine Science Tools | 11274-20 | |
| Forceps, Dumont #5, straight | Fine Science Tools | 11254-20 | |
| Gloves (small, medium, large) | Microflex | N191, N192, N193 | |
| Gloves, MAPA Temp-Ice 700 Thermal (for handling dry ice) | Fisher Scientific | 19-046-563 | |
| Hemocytometer | Daigger | EF16034F EA | |
| Incubator, cell culture | Eppendorf | Galaxy 170 S | |
| Labelling tape | Fisher Scientific | 159015R | |
| Marking pen, Sharpie (ultra-fine) | Staples | 642736 | |
| Mice, immunodeficient (Nu/J) | Jackson Laboratory | 2019 | |
| Microcentrifuge, accuSpin Micro17 | Fisher Scientific | 13-100-675 | |
| Microcentrifgue tubes, Eppendorf tubes (1.5 mL) | Axygen | MCT-150-C | |
| Microscope slide box | Fisher Scientific | 50-751-4983 | |
| Needle, 27 gauge | Becton-Dickinson | 752 0071 | |
| Paintbrush | Grainger | 39AL12 | |
| Paper towels | Staples | 33550 | |
| Paraformaldehyde | Acros Organics | 416785000 | |
| Penicillin/Streptomycin | Gibco | 15140122 | |
| Perforated spoon, 15 mm diameter, 135 mm length | Roboz Surgical Instrument Co. | RS-6162 | |
| Phosphate buffered saline (PBS) | Fisher Scientific | BP3991 | |
| Pipet tips (10 μL) | Fisher Scientific | 02-707-438 | |
| Pipet tips (200 μL) | Fisher Scientific | 02-707-411 | |
| Pipet tips (1000 μL) | Fisher Scientific | 02-707-403 | |
| Pipets, serological (10 mL) | VWR | 89130-910 | |
| Pippetor, Gilson P2 | Daigger | EF9930A | |
| Pipettor Starter Kit, Gilson (2-10 μL, 20-200 μL, 200-1000 μL) | Daigger | EF9931A | |
| Platform shaker - orbital, benchtop | Cole-Parmer | EW-51710-23 | |
| Positively-charged microscope slides, Superfrost | Fisher Scientific | 12-550-15 | |
| Scalpel, size 10, Surgical Design, Inc. | Fisher Scientific | 22-079-707 | |
| Scissors, surgical - sharp, curved | Fine Science Tools | 14005-12 | |
| Software for image analysis, Nikon Elements | Nikon | Custom order | |
| Software for image analysis, ImageJ (FIJI) | National Institutes of Health | n/a | Download online (free) |
| Specimen disc 30 mm (chuck holder), cryostat accessory | Leica Biosystems | 14047740044 | |
| Staining tray, 245 mm BioAssay Dish | Corning | 431111 | |
| Syringe, 1 cc | Becton-Dickinson | 309623 | |
| Tape, laboratory, 19 mm width | Fisher Scientific | 15-901-5R | |
| Timer | Fisher Scientific | 14-649-17 | |
| Tissue culture dish, 100 x 15 mm diameter | Fisher Scientific | 08-757-100D | |
| Tissue culture flask, 225 cm2 | ThermoFisher | 159933 | |
| Tissue culture plate, 24-well | Becton-Dickinson | 353226 | |
| Tissue embedding mold, stainless steel | Tissue Tek | 4161 | |
| Tissue Freezing Medium, Optimal Cutting Temperature (OCT) | Fisher Scientific | 4585 | |
| Trypsin-EDTA (ethylenediaminetetraacetic acid), 0.25% | Gibco | 25200072 | |
| Water bath, Precision GP 2S | ThermoFisher | TSGP2S |
参考文献
- Pavlova, N. N., Thompson, C. B. The emerging hallmarks of cancer metabolism. Cell Metabolism. 23 (1), 27-47 (2016).
- Pellegatti, P., et al. Increased level of extracellular ATP at tumor sites: in vivo imaging with plasma membrane luciferase. PLoS ONE. 3, 25992008(2008).
- Falzoni, S., Donvito, G., Di Virgilio, F. Detecting adenosine triphosphate in the pericellular space. Interface Focus. 3 (3), 20120101(2013).
- Michaud, M., et al. Autophagy-dependent anticancer immune responses induced by chemotherapeutic agents in mice. Science. 334, 1573-1577 (2011).
- Wilhelm, K., et al. Graft-versus-host disease is enhanced by extracellular ATP activating P2X7R. Nature Medicine. 16, 1434-1438 (2010).
- Vander Heiden, M. G., Cantley, L. C., Thompson, C. B. Understanding the Warburg effect: the metabolic requirements of cell proliferation. Science. 324, 1029-1033 (2009).
- Cairns, R. A., Harris, I. S., Mak, T. W. Regulation of cancer cell metabolism. Nature Reviews Cancer. 11, 85-95 (2011).
- Chen, X., Qian, Y., Wu, S. The Warburg effect: evolving interpretations of an established concept. Free Radical Biology & Medicine. 79, 253-263 (2015).
- Wang, X., et al. Extracellular ATP, as an energy and phosphorylating molecule, induces different types of drug resistances in cancer cells through ATP internalization and intracellular ATP level increase. Oncotarget. 8 (5), 87860-87877 (2017).
- Patel, A., et al. ATP as a biological hydrotrope. Science. 356, 753-756 (2017).
- Qian, Y., et al. Extracellular ATP is internalized by macropinocytosis and induces intracellular ATP increase and drug resistance in cancer cells. Cancer Letters. 351, 242-251 (2014).
- Qian, Y., Wang, X., Li, Y., Cao, Y., Chen, X. Extracellular ATP a new player in cancer metabolism: NSCLC cells internalize ATP in vitro and in vivo using multiple endocytic mechanisms. Molecular Cancer Research. 14, 1087-1096 (2016).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497, 633-637 (2013).
- Li, L., et al. The effect of the size of fluorescent dextran on its endocytic pathway. Cell Biology International. 39, 531-539 (2015).
- Yanagawa, Y., Matsumoto, M., Togashi, H. Enhanced dendritic cell antigen uptake via alpha2 adrenoceptor-mediated PI3K activation following brief exposure to noradrenaline. Journal of Immunology. 185, 5762-5768 (2010).
- Hoppe, H. C., et al. Antimalarial quinolines and artemisinin inhibit endocytosis in Plasmodium falciparum. Antimicrobial Agents & Chemotherapy. 48, 2370-2378 (2004).
- Chaudry, I. H. Does ATP cross the cell plasma membrane. Yale Journal of Biology & Medicine. 55, 1-10 (1982).
- Pant, H. C., Terakawa, S., Yoshioka, T., Tasaki, I., Gainer, H. Evidence for the utilization of extracellular [gamma-32P]ATP for the phosphorylation of intracellular proteins in the squid giant axon. Biochimica et Biophysica Acta. 582, 107-114 (1979).
- Chaudry, I. H., Baue, A. E. Further evidence for ATP uptake by rat tissues. Biochimica et Biophysica Acta. 628, 336-342 (1980).
- Koppenol, W. H., Bounds, P. L., Dang, C. V. Otto Warburg's contributions to current concepts of cancer metabolism. Nature Reviews Cancer. 11, 325-337 (2011).
- Dang, C. V. Links between metabolism and cancer. Genes & Development. 26, 877-890 (2012).
- Israelsen, W. J., Vander Heiden, M. G. ATP consumption promotes cancer metabolism. Cell. 143, 669-671 (2010).
- Koster, J. C., Permutt, M. A., Nichols, C. G. Diabetes and insulin secretion: the ATP-sensitive K+ channel (K ATP) connection. Diabetes. 54, 3065-3072 (2005).
- Szendroedi, J., et al. Muscle mitochondrial ATP synthesis and glucose transport/phosphorylation in type 2 diabetes. PLoS Medicine. 4, 154(2007).
- Miyamoto, S., et al. Mass spectrometry imaging reveals elevated glomerular ATP/AMP in diabetes/obesity and identifies sphingomyelin as a possible mediator. EBioMedicine. 7, 121-134 (2016).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved