このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
二軸の機械的特性評価と微細構造定量化のための三尖弁リーフレットの層マイクロダイセクション
要約
このプロトコルは、二軸機械的特性評価、偏光空間周波数領域イメージングベースのコラーゲン定量化、および三尖弁リーフレットの微小解剖を記述している。提供されたメソッドは、リーフレット層が全体的なリーフレットの動作にどのように寄与するかを解明します。
要約
三尖弁(TV)は、右心房から右心室への無酸素血液の一方向の流れを調節する。テレビは3つのリーフレットで構成されており、それぞれに独自の機械的挙動があります。3つのテレビリーフレット間のこれらのバリエーションは、心房(A)、海綿骨(S)、線維症(F)、および心室(V)である4つの解剖学的層を調べることによってさらに理解することができる。これらの層は3つのテレビリーフレットすべてに存在しますが、それぞれの機械的挙動にさらに影響を与える厚さと微細構造成分に違いがあります。
このプロトコルには、層固有の違いを解明するための4つのステップが含まれています:(i)無傷のテレビリーフレットの機械的およびコラーゲンファイバーアーキテクチャ挙動を特徴付ける、(ii)テレビリーフレットの複合層(A / SおよびF / V)を分離する、(iii)複合層に対して同じ特性評価を実行する、(iv) 事後処理 を実行する 組織学評価。この実験フレームワークは、無傷のテレビ組織をその複合層のそれぞれに直接比較することを独自に可能にする。その結果、テレビリーフレットの微細構造および生体力学的機能に関する詳細な情報をこのプロトコルで収集することができる。このような情報は、テレビ病の臨床的治療のためのガイダンスを提供しようとするテレビ計算モデルを開発するために潜在的に使用することができる。
概要
テレビは心臓の右心房と右心室の間にあります。心周期全体を通して、テレビは、テレビ前部リーフレット(TVAL)、テレビ後部リーフレット(TVPL)、およびTV中隔リーフレット(TVSL)の周期的な開閉を介して一方向血流を調節する。これらの小葉は複雑で、心房(A)、海綿腫(S)、線維症(F)、心室(V)の4つの異なる解剖学的層を有し、ユニークな微細構造成分を有する。心房および心室のエラスチン線維は、機械的負荷1の後に組織をその変形していない形状に回復させるのを助ける。対照的に、線維症は、リーフレット2の耐荷重能力に寄与する波打つコラーゲン線維の緻密なネットワークを含む。主にグリコサミノグリカンからなる海綿体は、心臓弁機能3の間に小葉層間の剪断を可能にすると仮説が立てられている。3つのリーフレットタイプはすべて同じ解剖学的層を持っていますが、リーフレット固有の機械的挙動に影響を与える層の厚さと構成比にはばらつきがあります。
研究者らは、平面的な機械的特徴付け、組織形態学的評価、およびコラーゲン線維アーキテクチャの光学的特徴付けを使用して、テレビリーフレットの特性を調査した。例えば、平面二軸機械的特性評価は、組織に垂直な変位を適用し、関連する力を記録することによって生理学的負荷をエミュレートしようとする。結果として得られた力-変位(または応力-ストレッチ)観測は、3つのTVリーフレットすべてが非線形で方向特異的な機械的挙動を示し、放射状組織方向におけるより見かけ上のリーフレット特異的な応答を示すことを明らかにした4,5,6。これらのリーフレット特異的挙動は、標準的な組織学的手法を用いて観察される微細構造特性の違いに由来すると考えられている6、7。さらに、第2高調波発生イメージング6、小角光散乱8、および偏光空間周波数領域イメージング7(pSFDI)は、これらの微細構造特性を理解することを目的としており、観察された組織レベルの機械的挙動に影響を与えるコラーゲン線維配向および繊維捲縮におけるリーフレット特有の違いを示している。これらの研究は、組織の微細構造と組織レベルの挙動におけるその役割についての我々の理解を著しく進歩させた。しかし、組織力学と基礎となる微細構造を実験的に結びつける際には、まだ多くの課題が残っています。
最近、本研究室では、2つの複合層(A/SとF/V)に分離されたテレビリーフレット層の機械的特性評価を、マイクロダイセクション技術を用いて行った9.その初期の研究は、層の機械的特性の違いを強調し、層状微細構造が組織の機械的挙動にどのように寄与するかについての洞察を提供するのに役立った。この調査により、テレビのリーフレットの微細構造の理解は向上しましたが、この手法にはいくつかの制限がありました。第一に、複合層の特性は無傷の組織と直接比較されず、力学と微細構造の関係の完全な理解の欠如につながった。第2に、複合層のコラーゲン線維構造は調べなかった。第三に、TVALの層のみが、他の2つのテレビリーフレットから複合層を収集することの困難さのために調査された。本明細書に記載される方法は、これらの制限を克服し、TVリーフレットおよびそれらの複合層の完全な特徴付けを提供する全体的な特徴付けフレームワークを提供する。
この論文では、2軸の機械的および微細構造的特性評価のために、3つのTVリーフレットをそれらの複合層(A / SおよびF / V)に分離するマイクロダイセクション技術について説明します10,11,12。この反復プロトコルには、(i)インタクトリーフレットの2軸機械的試験およびpSFDI特性評価、(ii)複合TV層を確実に得るための新規で再現可能な微小解剖技術、および(iii)複合TV層の2軸機械的試験およびpSFDI特性評価が含まれる。組織を、機械的試験のために様々な力比を有する二軸引張荷重に曝した。次いで、pSFDIを用いて、種々の負荷構成におけるコラーゲン線維配向および配向性を決定した。pSFDIは、ネイティブのコラーゲン線維アーキテクチャを維持し、負荷依存の解析を可能にし、第2高調波発生イメージングや小角光散乱などのコラーゲン線維アーキテクチャ解析のために組織を固定またはクリアする典型的な必要性を回避します。最後に、組織微細構造を視覚化するために標準的な組織学技術を用いて組織を調製した。この反復的で全体的なフレームワークにより、テレビリーフレットの機械的および微細構造的特性を複合層に直接比較することができます。
プロトコル
本明細書に記載されるすべての方法は、オクラホマ大学の施設動物ケアおよび使用委員会によって承認された。動物組織は、USDA承認の屠殺場から入手した。
1. 2軸機械特性評価
- 組織調製
- 冷凍庫、カミソリの刃、手術用ペン、鉗子、脱イオン(DI)水を入れたピペット、カッティングマットからテレビのチブレットを取り出します。室温DI水を2〜3滴使用してテレビのチラシを解凍する。
注:層微解剖のためのPBS誘発性の困難を避けるために、リン酸緩衝生理食塩水(PBS)の代わりにDI水が使用されます。 - 心室層(すなわち、弦楽挿入部を有する表面)を上向きにして、切断マット上に標本を平らに置く。径方向が Y方向と揃い、円周方向が X方向と揃うように試験片を置きます。
注: 円周方向はバルブの円周に沿って方向付けられます。 - 組織の弦帯挿入位置を調べる。非常に薄い(つまり透明な)領域を避けながら、大きな弦の挿入量を最小限に抑えながら、理想的には〜12 x 12 mmの領域を決定します(図1)。
- 心房表面(すなわち、弦の挿入のない表面)が上を向くように標本をひっくり返します。円周方向と半径方向のリーフレット方向が、それぞれ X 軸と Y 軸に揃っていることを確認します。
- 小葉組織から正方形の 12 x 12 mm の標本を切り取り、ステップ 1.1.3 で特定された大きな弦の挿入や薄い領域を避けます。リーフレット組織のトリミングされた部分を鉗子で取り除き、廃棄物容器に入れます。
- 大きな弦の挿入を完全に避けることができない場合は、正方形の標本の端に沿って組織を切断します。コードの挿入を避けることは、後の微小解剖の問題を防ぐのに役立つため重要です。
- 外科用ペンを使用して右上隅に小さな点を配置し、標本の向きを追跡します。インクを約 30 秒乾燥させます。
- 心室表面(すなわち、弦の挿入を有する表面)を上向きにして標本を反転させる。チラシから弦を伸ばし、カミソリの刃を使って挿入場所の近くで切断することによって、組織の背面にある弦の付着物をトリミングします。心房表面(すなわち、滑らかな表面)が上を向くように、試料をもう一度ひっくり返します。
- 冷凍庫、カミソリの刃、手術用ペン、鉗子、脱イオン(DI)水を入れたピペット、カッティングマットからテレビのチブレットを取り出します。室温DI水を2〜3滴使用してテレビのチラシを解凍する。
- 厚さ測定
- 非接触レーザー変位センサーを取得します。トリミングされた組織の近くにある切断マットの平らな部分に変位センサーをゼロにします。
警告: レーザーを目に直接当てないでください。 - 試料の中央領域にレーザーを配置します。リーフレット表面の下に閉じ込められた空気は、測定誤差を引き起こす可能性があるため、取り除きます。閉じ込められた空気を放出するには、ピンセットを使用して気泡を組織の端に押し込むか、組織の片隅を持ち上げます。
- 変位センサーのディスプレイに表示される厚さを記録します。試料の他の位置でさらに2つの測定を繰り返します。
- 前の手順で記録した 3 つの測定値を使用して、リーフレットの平均厚さを計算します。この値は、2 軸の機械的特性評価プロトコルを作成するときに使用します。
- 非接触レーザー変位センサーを取得します。トリミングされた組織の近くにある切断マットの平らな部分に変位センサーをゼロにします。
- 二軸テスターのセットアップと組織取り付け
- 試験システムのガイドラインに従って、37°CでDI水浴を調製し、 in vivo 生理学的条件下での温度を確保した。
- 鉗子、組織標本、取り付け金具、先端の細かい工具、液体シアノアクリレート接着剤、黒色塗装ガラスビーズ(直径:300-500μm)を取り出します。
メモ: 取り付け金具には、タイン、取り付けブリッジ、および取り付けゴムが含まれます。 - 組織標本を試験システムに取り付けます。組織の円周方向が X方向と揃っていることを確認し、これはステップ1.1.6で以前に配置したドットによって支援することができます。
注:ここで使用するタインは、組織端の長さ全体にわたって均等に間隔をあける必要があります。有効エッジ長は、無傷の組織では 10 mm、複合層では >3.3 mm に設定されます。
- 基準マーカーの配置
- 取り付けられた組織の中央3分の1の正方形領域を特定する。基準マーカーの配置には、この領域のおおよその角を使用します。
- ガラスビーズをオープンフェースの計量ボートに入れ、別の計量ボートに液体シアノアクリレート接着剤の小さなプールを作ります。先端の細かい工具の上部を少量の接着剤でコーティングします。計量ボートの側面に余分な接着剤を軽くたたく。
- 接着剤でコーティングされた先端を組織に静かに押し付けることによって、中央の3分の1の正方形配列の1つの角を作成します。鉗子を使用して、ガラスビーズをつかみ、接着剤ドットの上に慎重に置きます。ビーズの配置に役立てるために、二軸試験装置のカメラを使用してください。
- 正方形配列が完了するまで、ステップ 1.4.2 と 1.4.3 を繰り返して、3 つのビーズを追加します。ビーズがしっかりと取り付けられており、それぞれの接着剤ドットが接触したりくっついたりしていないことを確認します。組織を水浴に下げる前に接着剤を乾燥させる。
- ビーズがくっついている場合は、接着剤が乾くのを待ってから、鉗子を使用してビーズまたは接着剤を優しくつかみ、組織から引き抜きます。
メモ:接着剤とビーズが外れ、ビーズの配置を再試行できるはずです。
- ビーズがくっついている場合は、接着剤が乾くのを待ってから、鉗子を使用してビーズまたは接着剤を優しくつかみ、組織から引き抜きます。
- 前処理
- エッジの長さと厚さを持つ組織は、3%の予荷重で40 N/mのピーク膜張力Tピークに等二軸荷重を6回繰り返し、Tピーク10、ストレッチと回復時間をそれぞれ30秒×する力制御のプレコンディショニングプロトコルを作成します。
- 将来の計算のためにデータを一時的に格納する任意のテストディレクトリを構築します。 荷重速度 を 4.42 N/m に設定します。
- Preconditioning0 という名前の新しいテスト パラメーター セットを作成します。X軸とY軸の制御モードを強制的に設定し、制御機能をステップに設定します。荷重の大きさをTピークに関連する力、すなわち、fピーク=Tピーク・Sとする。L. 最初の繰り返しのみの予荷重の大きさをfピークの3%と定義し、ストレッチ期間と回復時間の両方を30秒と定義します。繰り返し回数を 10 と定義します。
注:計算されたピークの最初のピオラ-キルヒホッフ応力、すなわち Pピーク = Tピーク/tは、より薄い組織では200kPaを超える可能性があり、試験中に組織が引き裂かれる可能性があります。これらのシナリオでは、ピーク膜張力は、最大第1ピオラ・キルヒホフ応力200kPaに調整された。
- プレコンディショニングプロトコルを実行します。事前調整後、2軸試験プロトコルで使用するために試料の現在の X寸法と Y寸法を記録します。
- エッジの長さと厚さを持つ組織は、3%の予荷重で40 N/mのピーク膜張力Tピークに等二軸荷重を6回繰り返し、Tピーク10、ストレッチと回復時間をそれぞれ30秒×する力制御のプレコンディショニングプロトコルを作成します。
- 二軸テストプロトコルの作成と実行
- 所望の変位率を有する事前調整後の構成からピーク等二軸構成を達成するのに必要な時間を決定する。一定の変位率を考慮して、残りの荷重比の荷重時間を計算します(つまり、T XX:T YY = 1:0.5およびTXX:TYY = 0.5:1)。
- リニアアクチュエータを手動でジョギングして、所定の荷重比の目標力を一致させます。このプロセスを繰り返し、すべての積載比のリーフレット寸法を記録します。
- ステップ1.6.1で決定した時間内に、組織を事前調整後の構成からステップ1.6.2で記録された構成(すなわち、 TXX:TYY = 1:1、1:0.5、0.5:1)に二軸的に置換する変位制御試験プロトコルを準備する。各プロトコルに3つのロード/アンロードサイクルがあり、機械的挙動の再現性を確保します。
- 将来の計算のためにデータを格納するテストディレクトリを構築します。ディレクトリー名が現行標本と一致していることを確認します。
- 1:1 という名前の新しいテストパラメータセットを作成し、 X 軸と Y 軸の制御モードを変位に設定し、制御関数をランプに設定します。ストレッチの大きさを、ステップ 1.6.1 で記録された構成として定義します。最初の繰り返しのみの予荷重の大きさを fピーク の3%として定義し、ストレッチ期間と回復時間の両方をステップ1.6.1で記録した時間として定義します。繰り返し回数を 3 と定義します。
- 残りの荷重比(T XX:T YY = 1:0.5 および TXX:TYY = 0.5:1)に対して手順 1.6.3.2 を繰り返します。ただし、予荷重の大きさを適用不可と定義します。ストレッチの大きさ、ストレッチ期間、および回復時間が、ステップ 1.6.2 で記録した期間と一致していることを確認します。
注記: 応力解析とひずみ解析には、最終(3 回目)サイクルのデータのみが使用されます。
- 変位制御プロトコルを実行します。二軸試験の完了後、組織を予め調整後の寸法に戻す。
注:組織が裂け始めたら、テストを直ちに中止する必要があります。
- さらなる特性評価
- 組織をDI水に沈めたままにし、2軸試験システムに取り付けます。手順 2.1 ~ 2.3 の説明に従って pSFDI イメージングを実行します。
- ティッシュをアンマウントします。それが無傷の組織であるならば、ステップ3.1-3.7で説明したマイクロディスセクションに進みます。そうでない場合は、ステップ3.7に従って組織学を収集します。
注:DIウォーターバスは、同じ日内に後続の特性評価に使用できます。 - マイクロダイセクションの後に取得したA/S層とF/V層で手順1.2~1.7を繰り返します(手順3.1~3.6)。
注:層に対する試験プロトコルの繰り返しにより、無傷の組織をそれ自身の層に直接比較することができます。
- 二軸テストデータ後処理手順
- 取得した2軸試験画像のデジタル画像相関を行い、時間依存のマーカ位置を決定します。基準マーカーの変位を Eq (1) で計算します。5 5
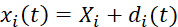 (1)
(1)
ここで、xi(t)、Xi、およびdi(t)は、時間依存の位置、初期(参照)位置、およびマーカーiの変位である。 - Eq (2)5に示すように、基準マーカーを4節点双線形有限要素と見なして変形勾配Fを計算する
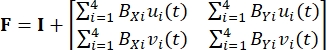 (2)
(2)
ここで、B XiとBYiはそれぞれX方向とY方向の節点iの形状関数の導関数であり、ui(t)とvi(t)はdi(t)の成分である:d i(t) = [u i(t), v i(t)]T。 - Eq (3)5 のように、記録された力を使用して、最初に適用されるピオラ-キルヒホッフ応力 P を計算します。
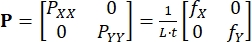 (3)
(3)
P XXおよびP YYは、PのX成分およびY成分である。Lおよびtは、組織端の長さおよび厚さである。f X と f Y は、X 方向と Y 方向に記録された力です。 - 必要に応じて、右コーシー-グリーン変形 C = F T/F、グリーン-ラグランジュひずみ E = (C - I)/2、コーシー応力 σ = J-1 PF T、および 2 番目のピオラ-キルヒホッフ応力 S = F-1P を含む他のひずみおよび応力メジャー 13 を決定します。
注: ここで、 I は 2 次恒等テンソルであり、 J = det(F) は変形勾配 F のヤコビアン です。
- 取得した2軸試験画像のデジタル画像相関を行い、時間依存のマーカ位置を決定します。基準マーカーの変位を Eq (1) で計算します。5 5
2. 偏光空間周波数領域イメージング
- システム準備
注:必要に応じて、以下のステップの前に基準マーカーを組織から除去することができる。- pSFDIデバイスを試料の中央に配置します(図2)。プロジェクタの電源を入れ、試料を490nm(シアン)の光で照らします。
- カメラソフトウェアを開き、カメラの視野を調べます。試料がフレームの中央にあり、視野内に完全に収まっていることを確認します。
- 取り付けられた標本が無傷の小葉である場合は、デジタル光処理 (DLP) プロジェクターの明るさを調整して、組織表面にグレアがなく組織が完全に照らされるようにします。試料が複合層の1つである場合、明るさを調整しないでください。
- 偏光子を全可動域にわたって回転させて、偏光子レンズのグレアや汚れを検出します。偏光子レンズは、必要に応じてマイクロファイバークロスで丁寧に清掃してください。
- データ収集
メモ: 次のデータ収集は、LabVIEWやPythonなどのソフトウェアを使用して自動化できます。- 偏光子をホームポジション(理想的には2軸試験軸の1つに揃える)に移動します。1つのグレースケール画像をキャプチャし、偏光子の位置(つまり、0°)でコンピュータに保存します。
- 偏光子を5°回転させ、別のグレースケール画像をキャプチャします。このプロセスを繰り返して、0°~180°の範囲の画像を5°刻みで37枚取得します。
注:最初のpSFDIイメージングシーケンスからの画像は、組織からの所望の光学応答を確実にするために予備的に分析することができる。手順については、ステップ 2.3 を参照してください。 - 他の所望の組織構成、例えば、二軸機械的試験のために考慮される装填プロトコルのピーク構成について、pSFDI画像化シーケンスを繰り返す。
- pSFDI データ後処理プロシージャー
メモ: 次の方法には、MATLAB プログラム言語の手順が含まれています。ただし、任意の優先言語 (Python、C++など) を代わりに使用できます。- MATLAB imread() 関数を使用して、取得した 37 個の画像のピクセル単位の強度を含む配列を作成します。便宜上、これらを n × m × 37 の 3 次元配列として配置します (n と m は 2 つの軸に沿ったピクセル数です)。
- ユーザー定義の grabit () 関数を使用して、組織の関心領域 (ROI) を定義します。
- Eq (4) のように、3 項のフーリエ級数を使用して、各 ROI ピクセルの強度対偏光子角度データを適合します。
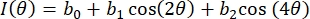 (4)
(4)
ここで、I(θ)は偏光子角度の関数としてのピクセル単位の強度であり、biはフーリエ定数である。標準の線形最小二乗回帰を使用して、b i を求めます。 - ピクセル単位のファイバー配向を、 I(θ) の最大値に関連付けられた偏光子角度として求めます。光学異方性(DOA)の次数は、Eq (5) を使用して計算します。
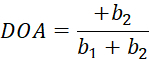 (5)
(5) - plot() と histogram() を使用して、取得した繊維配向と DOA 値を視覚化します。後で使用するために、処理された結果を保存します。
3. 三尖弁リーフレット複合層のマイクロディスセクション
- ワックスボードへの組織付着
- ワックスボード、DIウォーター、ピペット、メス、マイクロハサミ、薄い鉗子、湾曲した鉗子、太い鉗子、ピンなど、必要な材料を集めます。
注:このタイプの鉗子は、解剖を行うときにA / S層の薄い組織を非常に簡単に引き裂く可能性があるため、歯やグリップのないピンセットのみを使用してください。 - 2軸テスターから組織を取り外し、ステップ1.2で説明したレーザー変位センサーを使用してその厚さを測定します。ティッシュをワックスボードの上に置きます。
- 組織の心室側を調べて、大きな弦の挿入を確認します。解剖中にそれらを避けるために、これらの挿入の位置に注意してください(補足図S1)。参考までに写真を撮ってください。
- 心房を上に向けてワックスボード上に組織を平らに広げます。ピンを使用してティッシュをボードに貼り付けます。
- 組織の各隅に、組織から角度をつけて(見やすくするために)1本のピンを置き、組織をわずかに引き締めます(図3A)。これを時計回りまたは反時計回りの順序で行います。ピンが、ティッシュを取り付けるときにタインによって作成された穴の外側にあることを確認します。
- ピンの配置をわずかに調整して、組織が硬く、正方形の構成(図3B)になるようにして、組織が平らになり、層の微小解剖中にシフトしないようにします。
- 必要に応じて、解剖中に組織の側面に沿ってピンを配置し、組織をより伸ばす。追加のピンを配置して釣り上げるときは、解剖中に回避する必要があることに注意してください。
- ガラスビーズの基準マーカーを取り外します。
メモ: 次の手順はオプションです。添加されたDI水は、組織の水分補給を維持するのに役立ち、微小解剖を通して組織がそれ自身に固執するのを防ぎます。 - ピペットを用いて、DI水を組織の表面に置き、組織を完全に覆うようにする。解剖中は必要に応じてDI水を補給する。
- ワックスボード、DIウォーター、ピペット、メス、マイクロハサミ、薄い鉗子、湾曲した鉗子、太い鉗子、ピンなど、必要な材料を集めます。
- 最初のコーナーを作ります。
- 固定された標本の角を選択して解剖を開始します。大きな弦の挿入や非常に薄い領域は避けてください。
- 機械的試験の取り付け穴に沿ってメスを組織表面に軽くドラッグして、A/S層に切り込みを入れます(図3C)。カットの長さが 5 mm 以上で、カットの端が引き裂かれ始め、その下の F/V レイヤーが見えていることを確認します。
- 細い鉗子(鋭い先端なし)を使用して、切り口に沿ってしっかりとこすり、切り口の端を引き離します(補足図S2)。
- A/S レイヤーのカットが引き裂かれない場合は、メスで同じカットをもう一度軽くなぞり、これが開始するまで続けます。組織に深く(A/Sコンポジットレイヤーを過ぎて)深く切り込みすぎると、レイヤーをきれいに分離するのが難しくなるため、注意してください。
- 手順3.2と3.2.3を繰り返して、2番目のカットを最初のカットに垂直にします(図3D)。2 つのカットが接続され、角が形成されていることを確認します。
- 2つの切り込みが接続されていない場合は、2つの切り込みを隔てる組織の小さな領域の下に細いピンセットを通します(補足図S3)。その後、はさみを慎重に使用して組織を切断します。
- ティッシュを角から剥がします。
- 組織がF / V層から分離し始めるまで、薄い鉗子を使用して切り口に沿ってこすります。小さな組織が分離したらすぐに、ピンセットでつかみ、静かに引っ張って複合層をさらに分離します。
メモ:握るときは、必ず細いピンセットの先端を組織の端の先に置きます。そうしないと、誤って A/S コンポジットレイヤーに穴があく可能性があります。 - ティッシュを剥がし続け、コーナー用に作られた2つのカットの端に達するまで縫い目をこすります。このプロセス全体を通して、より大きなピンセットに切り替えて剥離プロセスのために組織をつかみ、A / S複合層の望ましくない裂け目や引き裂きを防ぎます。
- 最初に試みたコーナーの分離に大きな問題がある場合は、別のコーナーを出発点として試します (ステップ 3.2 に戻ります)。
- 組織がF / V層から分離し始めるまで、薄い鉗子を使用して切り口に沿ってこすります。小さな組織が分離したらすぐに、ピンセットでつかみ、静かに引っ張って複合層をさらに分離します。
- 切り込みを伸ばし、ティッシュを剥がし、2番目の角を作ります。
- メスの先端を各カットの底に置き、組織表面に沿って軽くドラッグして、最初の角用に作成した2つのカットを伸ばします(図4A)。すべての延長カットが少なくとも5mmであり、カットエクステンションが元のカットに接続され、タインまたは縫合穴をたどり続けることを確認します。
メモ:延長カットが深すぎる場合は、線維症の切片がA/S複合層で分離されていないことを確認するために、今後の剥離を注意深く監視する必要があります(図5A)。 - カットを伸ばし続け、片側が終わるまで縫い目をこすりながら、上部のコンポジットA / Sレイヤーを剥がします。組織が1つのカットに沿って完全に分離されるのを観察します;A/SとF/Vコンポジット層の間の継ぎ目がまっすぐであることを確認します(図4B)。
- ステップ3.2とステップ3.3の手順を繰り返して、完全に剥離した側の端に垂直な第2の角を作成します(図4C)。
- メスの先端を各カットの底に置き、組織表面に沿って軽くドラッグして、最初の角用に作成した2つのカットを伸ばします(図4A)。すべての延長カットが少なくとも5mmであり、カットエクステンションが元のカットに接続され、タインまたは縫合穴をたどり続けることを確認します。
- A/Sレイヤーを完全に分離します。
- 大きなコードの挿入を避けながら、残りのカットを延長します。最初のコーナーで採用された擦りと引っ張りのテクニックを使用して、A / S層とF / V層を分離し続けます。このプロセス中に発生する可能性のあるいくつかの考慮事項または問題を書き留めます。
- A/S分離領域からコードーデ挿入を除外する(図5B)のは、この除外によって実験特性評価に十分な大きさのA/S標本(>3.3mm)が許容される場合のみに限られます。
- 組織が裂けたり穴が開いたりした場合は、すぐに組織を分離するのをやめてください。ピンセットが引っかからないようにするには、はさみを穴の開いたところに置き、組織を中心から離します。欠陥が分離の継ぎ目に沿って形成される場合は、さらなる引き裂きを防ぐために、別の縁に沿って組織を分離し始めます(図5C)。
- 組織を分離している間に現れる可能性のある層間接続を探し、裂け目のリスクが高いことなく組織のさらなる分離を防ぎます(図5D)。これらは、はさみを使用して慎重に切断する必要がある細いが強いストランドであることを観察します。A/S レイヤーに穴を開けたり、F/V レイヤーに下向きに切断したりすると、分離が不均一になるため、避けてください。
- A/S層の可能な限り大きなサンプルが分離されるまで、このプロセスを続けます。手術用ペンを使用してサンプルの向きをマークします(図6A)。
- 大きなコードの挿入を避けながら、残りのカットを延長します。最初のコーナーで採用された擦りと引っ張りのテクニックを使用して、A / S層とF / V層を分離し続けます。このプロセス中に発生する可能性のあるいくつかの考慮事項または問題を書き留めます。
- 解剖を終える。
- はさみを使用して、残りの組織端の分離の継ぎ目に沿って切断します(図6B)。このカットができるだけ分離の継ぎ目に近いことを確認します。
- 分離した A/S コンポジットレイヤーをカッティングマットの上に平らに置きます。必要に応じて、メスを使用して組織の縁をまっすぐにし、2軸の機械的試験に適した正方形の組織形状を作成します。A/S層をDI水に入れ、テストの準備が整うまで置きます。
- ワックスボード上に残っているF/V層の向きをマークします。A/S層が取り除かれた領域から可能な限り大きな正方形を切り取り(図6C)、DI水に入れます。
- 組織学
- 組織学で使用するために、円周方向と半径方向に沿った2つの組織ストリップを切除します。インタクト層と複合層(すなわち、A / SおよびF / V)に異なるプロトコルを使用します。
- 無傷の層のために、ワックスボードに固定されたままの組織から標本を取り出す。組織のこの部分は解剖されておらず、無傷の小葉を表すため、タイン/縫合穴の外側の組織を使用してください。
- A/S および F/V 複合層については、組織学サンプルのテストとイメージングを完全に完了した後にのみ収集してください。二軸試験システムから試料を取り外し、切断マットの上に組織を平らに置き、カミソリ刃を使用して円周ストリップとラジアルストリップを切除します。
- 摘出したストリップを組織カセットに入れ、カセットを10%ホルマリンに沈める。
- 残りの組織を捨てる。洗浄コンパウンドを使用して解剖ツールを洗浄します( 材料表を参照)。
- 固定の24〜48時間後、カセットをエタノールに移し、そこで組織学処理および染色まで無期限に保存することができる。
注:この組織学的分析は、微小解剖が成功したことを確認することができる。 警告: 10% ホルマリンは、皮膚刺激や深刻な目の損傷の原因となります。また、吸入を介してアレルギー反応や癌を引き起こす可能性があります.取り扱いの際は、手袋、ゴーグル、白衣などの適切な個人用保護具を着用し、ヒュームフードなどの換気の良い場所でのみ使用してください。使用しないときは、保管容器がしっかりと閉じられていることを確認してください。
- 組織学で使用するために、円周方向と半径方向に沿った2つの組織ストリップを切除します。インタクト層と複合層(すなわち、A / SおよびF / V)に異なるプロトコルを使用します。
結果
マイクロディスセクションは、(商用の)二軸試験装置に取り付けることができる比較的均一な厚さのA / SおよびF / V試料を得る。無傷の小葉と2つの解剖された層の組織学分析は、組織が海綿状体と線維症の間の境界に沿って正しく分離されたかどうかを検証します(図7)。さらに、組織学顕微鏡写真を使用して、ImageJソフトウェアを使用して組織層の厚さと構成質量分率を...
ディスカッション
このプロトコルの重要なステップには、(i)層マイクロダイセクション、(ii)組織マウント、(iii)基準マーカーの配置、および(iv)pSFDIセットアップが含まれます。適切な層微小解剖は、本明細書に記載の方法の最も重要かつ困難な態様である。この技術を利用した調査を開始する前に、解剖は微小解剖技術と3つのテレビリーフレットすべてで長期的な練習をする必要があります。ディスセクター...
開示事項
著者らは、開示すべき利益相反はありません。
謝辞
この研究は、米国心臓協会の科学者開発助成金(16SDG27760143)と長老派健康財団の支援を受けました。KMCは、オクラホマ大学(OU)の学部研究機会プログラムと名誉研究見習いプログラムによって部分的に支援されました。DWLは、米国国立科学財団大学院研究フェローシップ(GRF 2019254233)と米国心臓協会/児童心臓財団博士前フェローシップ(賞#821298)によって部分的に支援されました。このサポートのすべては感謝して認められています。
資料
| Name | Company | Catalog Number | Comments |
| 10% Formalin Solution, Neutral Buffered | Sigma-Aldrich | HT501128-4L | |
| Alconox Detergent | Alconox | cleaning compound | |
| BioTester - Biaxial Tester | CellScale Biomaterials Testing | 1.5 N Load Cell Capacity | |
| Cutting Mat | Dahle | B0027RS8DU | |
| Deionized Water | N/A | ||
| Fine-Tipped Tool | HTI INSTRUMENTS | NSPLS-12 | |
| Forceps - Curved | Scientific Labwares | 16122 | |
| Forceps - Thick | Scientific Labwares | 161001078 | |
| Forceps - Thin | Scientific Labwares | 16127 | |
| LabJoy | CellScale Biomaterials Testing | Version 10.66 | |
| Laser Displacement Sensor | Keyence | IL-030 | |
| Liquid Cyanoacrylate Glue | Loctite | 2436365 | |
| MATLAB | MathWorks | Version 2020a | |
| Micro Scissors | HTI Instruments | CAS55C | |
| Pipette | Belmaks | 360758081051Y4 | |
| Polarized Spatial Frequency Domain Imaging Device | N/A | Made in-house using a digital light projector, linear polarizer, rotating polarizer mount, and charge-coupled device camera. See doi.org/10.1016/j.actbio.2019.11.028 (PMCID: PMC8101699) for more details. | |
| Scalpel | THINKPRICE | TP-SCALPEL-3010 | |
| Single Edge Industrial Razor Blades (Surgical Carbon Steel) | VWR International | H3515541105024 | |
| Surgical Pen | LabAider | LAB-Skin-6 | |
| T-Pins | Business Source | BSN32351 | |
| Wax Board | N/A | Made in-house using modeling wax and baking tray | |
| Weigh Boat | Pure Ponta | mdo-azoc-1030 |
参考文献
- Vesely, I. The role of elastin in aortic valve mechanics. Journal of Biomechanics. 31 (2), 115-123 (1998).
- Zhang, W., Ayoub, S., Liao, J., Sacks, M. S. A meso-scale layer-specific structural constitutive model of the mitral heart valve leaflets. Acta Biomaterialia. 32, 238-255 (2016).
- Stella, J. A., Sacks, M. S. On the biaxial mechanical properties of the layers of the aortic valve leaflet. Journal of Biomechanical Engineering. 129 (5), 757-766 (2007).
- Khoiy, K. A., Amini, R. On the biaxial mechanical response of porcine tricuspid valve leaflets. Journal of Biomechanical Engineering. 138 (10), 104504 (2016).
- Jett, S. V., et al. An investigation of the anisotropic mechanical properties and anatomical structure of porcine atrioventricular heart valves. Journal of the Mechanical Behavior of Biomedical Materials. 87, 155-171 (2018).
- Meador, W. D., et al. A detailed mechanical and microstructural analysis of ovine tricuspid valve leaflets. Acta Biomaterialia. 102, 100-113 (2020).
- Hudson, L. T., et al. A pilot study on linking tissue mechanics with load-dependent collagen microstructures in porcine tricuspid valve leaflets. Bioengineering. 7 (2), 60 (2020).
- Pant, A. D., et al. Pressure-induced microstructural changes in porcine tricuspid valve leaflets. Acta Biomaterialia. 67, 248-258 (2018).
- Kramer, K. E., et al. An investigation of layer-specific tissue biomechanics of porcine atrioventricular heart valve leaflets. Acta Biomaterialia. 96, 368-384 (2019).
- Ross, C. J., Laurence, D. W., Wu, Y., Lee, C. -. H. Biaxial mechanical characterizations of atrioventricular heart valves. Journal of Visualized Experiments: JoVE. (146), e59170 (2019).
- Goth, W., Lesicko, J., Sacks, M. S., Tunnell, J. W. Optical-based analysis of soft tissue structures. Annual Review of Biomedical Engineering. 18, 357-385 (2016).
- Jett, S. V., et al. Integration of polarized spatial frequency domain imaging (pSFDI) with a biaxial mechanical testing system for quantification of load-dependent collagen architecture in soft collagenous tissues. Acta Biomaterialia. 102, 149-168 (2020).
- Reddy, J. N. . An Introduction to Continuum Mechanics. , (2013).
- Duginski, G. A., Ross, C. J., Laurence, D. W., Johns, C. H., Lee, C. -. H. An investigation of the effect of freezing storage on the biaxial mechanical properties of excised porcine tricuspid valve anterior leaflets. Journal of the Mechanical Behavior of Biomedical Materials. 101, 103438 (2020).
- Salinas, S. D., Clark, M. M., Amini, R. Mechanical response changes in porcine tricuspid valve anterior leaflet under osmotic-induced swelling. Bioengineering. 6 (3), 70 (2019).
- Pokutta-Paskaleva, A., Sulejmani, F., DelRocini, M., Sun, W. Comparative mechanical, morphological, and microstructural characterization of porcine mitral and tricuspid leaflets and chordae tendineae. Acta Biomaterialia. 85, 241-252 (2019).
- Ross, C. J., et al. An investigation of the glycosaminoglycan contribution to biaxial mechanical behaviors of porcine atrioventricular heart valve leaflets. Journal of the Royal Society Interface. 16 (156), 0069 (2019).
- Sommer, G., Regitnig, P., Költringer, L., Holzapfel, G. A. Biaxial mechanical properties of intact and layer-dissected human carotid arteries at physiological and supraphysiological loadings. American Journal of Physiology-Heart and Circulatory Physiology. 298 (3), 898-912 (2009).
- Holzapfel, G. A., Sommer, G., Gasser, C., Regitnig, P. Determination of the layer-specific mechanical properties ofhuman coronary arteries with intimal thickening, and related constitutive modelling. American Journal of Physiology-Heart and Circulatory Physiology. 289 (5), 2048-2058 (2005).
- Sommer, G., et al. Multiaxial mechanical response and constitutive modeling of esophageal tissues: Impact on esophageal tissue engineering. Acta Biomaterialia. 9 (12), 9379-9391 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved