É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Microdisseção de camada de folhetos de válvulas tricúsplicas para caracterização mecânica biaxial e quantificação microestrutural
Neste Artigo
Resumo
Este protocolo descreve a caracterização mecânica biaxial, quantificação de colágeno baseada em imagens de frequência espacial polarizada e microdisseção de folhetos de válvula tricúspide. O método fornecido elucida como as camadas de folhetos contribuem para os comportamentos holísticos do folheto.
Resumo
A válvula tricúspide (TV) regula o fluxo unidirecional de sangue não desoxorado do átrio direito ao ventrículo direito. A TV é composta por três folhetos, cada um com comportamentos mecânicos únicos. Essas variações entre os três folhetos de TV podem ser ainda mais compreendidas examinando suas quatro camadas anatômicas, que são as atrialis (A), esponjosa (S), fibrosa (F) e ventricularis (V). Embora essas camadas estejam presentes nos três folhetos de TV, há diferenças em suas espessuras e constituintes microestruturais que influenciam ainda mais seus respectivos comportamentos mecânicos.
Este protocolo inclui quatro etapas para elucidar as diferenças específicas da camada: (i) caracterizar os comportamentos arquitetônicos de fibra mecânica e colágeno do folheto de TV intacto, (ii) separar as camadas compostas (A/S e F/V) do folheto de TV, (iii) realizar as mesmas caracterizações para as camadas compostas, e (iv) realizar pós-hoc avaliação histologia. Esta estrutura experimental permite exclusivamente a comparação direta do tecido de TV intacto com cada uma de suas camadas compostas. Como resultado, informações detalhadas sobre a microestrutura e a função biomecânica dos folhetos de TV podem ser coletadas com este protocolo. Essas informações podem potencialmente ser usadas para desenvolver modelos computacionais de TV que buscam fornecer orientação para o tratamento clínico da doença da TV.
Introdução
A TV está localizada entre o átrio direito e o ventrículo direito do coração. Ao longo do ciclo cardíaco, a TV regula o fluxo sanguíneo unidirecional através da abertura cíclica e fechamento do folheto anterior da TV (TVAL), do folheto posterior da TV (TVPL) e do folheto septal da TV (TVSL). Esses folhetos são complexos e têm quatro camadas anatômicas distintas — as atrialis (A), a esponjosa (S), a fibrosa (F) e a ventricular (V)— com constituintes microestruturais únicos. As fibras de elastina nos atrialis e ventricularis ajudam a restaurar o tecido à sua geometria não deformada após o carregamento mecânico1. Em contraste, a fibrosa contém uma densa rede de fibras de colágeno onduladas que contribuem para a capacidade de carga dos folhetos2. Consistindo principalmente de gllicosaminoglicanos, a esponngue foi hipótese para permitir a tesoura entre camadas de folheto durante a função da válvula cardíaca3. Embora todos os três tipos de folhetos tenham as mesmas camadas anatômicas, há variações nas espessuras das camadas e proporções constituintes que têm implicações para comportamentos mecânicos específicos de folhetos.
Pesquisadores têm explorado as propriedades dos folhetos de TV usando caracterizações mecânicas planar, avaliações histomorfológicas e caracterizações ópticas da arquitetura de fibra de colágeno. Por exemplo, caracterizações mecânicas biaxiais planar buscam emular o carregamento fisiológico aplicando deslocamentos perpendiculares ao tecido e registrando as forças associadas. As observações resultantes de deslocamento de força (ou estiramento de estresse) revelaram que todos os três folhetos de TV apresentam comportamentos mecânicos não lineares e específicos da direção com respostas mais aparentes específicas do folheto na direçãodo tecido radial 4,5,6. Acredita-se que esses comportamentos específicos de folhetos decorrem de diferenças nas propriedades microestruturais observadas utilizando técnicas histológicas padrão 6,7. Além disso, a imagem de segunda geração harmônica6, a dispersão de luz de pequeno ângulo8 e a imagem de domínio de frequência espacial polarizada7 (pSFDI) visam entender essas propriedades microestruturais e têm mostrado diferenças específicas de folhetos na orientação da fibra de colágeno e no crimp de fibras que têm implicações para os comportamentos mecânicos observados no nível do tecido. Esses estudos avançaram significativamente nossa compreensão da microestrutura tecidual e seu papel em comportamentos de nível tecidual. No entanto, ainda há muito a ser abordado na conexão experimental da mecânica tecidual e da microestrutura subjacente.
Recentemente, este laboratório realizou caracterizações mecânicas das camadas de folhetos de TV separadas em duas camadas compostas (A/S e F/V) utilizando uma técnica de microdisseção9. Esse trabalho anterior destacou diferenças nas propriedades mecânicas das camadas e ajudou a fornecer insights sobre como a microestrutura em camadas contribui para os comportamentos mecânicos do tecido. Embora essa investigação tenha melhorado nossa compreensão da microestrutura do folheto de TV, a técnica tinha várias limitações. Em primeiro lugar, as propriedades das camadas compostas não foram diretamente comparadas com o tecido intacto, levando à falta de compreensão completa da relação mecânica-microestrutura. Em segundo lugar, a arquitetura de fibra de colágeno das camadas compostas não foi examinada. Em terceiro lugar, apenas as camadas da TVAL foram investigadas devido a dificuldades na coleta das camadas compostas dos outros dois folhetos de TV. O método descrito aqui fornece um quadro de caracterização holística que supera essas limitações e fornece caracterizações completas dos folhetos de TV e suas camadas compostas.
Este artigo descreve a técnica de microdisseção que separa os três folhetos de TV em suas camadas compostas (A/S e F/V) para caracterizações mecânicas e microestruturais biaxiais 10,11,12. Este protocolo iterativo inclui (i) testes mecânicos biaxiais e caracterização pSFDI do folheto intacto, (ii) uma técnica de microdissecção nova e reprodutível para obter de forma confiável as camadas de TV composta, e (iii) testes mecânicos biaxial e caracterização pSFDI das camadas de TV compostas. O tecido foi exposto ao carregamento de tração biaxial com várias razões de força para testes mecânicos. Em seguida, o pSFDI foi usado para determinar a orientação e alinhamento da fibra de colágeno em várias configurações carregadas. o pSFDI preserva a arquitetura nativa da fibra de colágeno, permite análises dependentes de carga e contorna a necessidade típica de fixar ou limpar tecido para análise de arquitetura de fibra de colágeno, como em imagens de segunda geração harmônica ou dispersão de luz de pequeno ângulo. Finalmente, os tecidos foram preparados utilizando técnicas padrão de histologia para visualizar a microestrutura tecidual. Esta estrutura iterativa e holística permite a comparação direta das propriedades mecânicas e microestruturais do folheto de TV com suas camadas compostas.
Protocolo
Todos os métodos aqui descritos foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais da Universidade de Oklahoma. Os tecidos animais foram adquiridos de um matadouro aprovado pelo USDA.
1. Caracterização mecânica biaxial
- Preparação tecidual
- Recupere um folheto de TV do congelador, lâminas de barbear, uma caneta cirúrgica, fórceps, uma pipeta com água deionizada (DI) e um tapete de corte. Descongele o folheto de TV usando 2-3 gotas de água DI de temperatura ambiente.
NOTA: A água DI é usada em vez de soro fisiológico tamponado com fosfato (PBS) para evitar quaisquer dificuldades induzidas por PBS para a microdisseção da camada. - Coloque a amostra plana no tapete de corte com a camada ventricular (ou seja, a superfície com as inserções de chordae) voltada para cima. Posicione a amostra para que a direção radial se alinhe com a direção Y e a direção circunferencial se alinhe com a direção X.
NOTA: A direção circunferencial é orientada ao longo da circunferência da válvula. - Examine os locais de inserção do tecido. Determine uma área, idealmente ~12 x 12 mm, com a menor quantidade de inserções de chordae grandes, evitando áreas extremamente finas (ou seja, transparentes) (Figura 1).
- Vire a amostra sobre a superfície atrial (ou seja, a superfície sem inserções de chordae) está voltada para cima. Certifique-se de que as direções do folheto circunferencial e radial permaneçam alinhadas com os eixos X e Y, respectivamente.
- Corte uma amostra quadrada de 12 x 12 mm do tecido do folheto que evita as grandes inserções de chordae ou áreas finas identificadas na etapa 1.1.3. Remova as porções aparadas do tecido do folheto com as fórceps e coloque-as em um recipiente de resíduos.
- Se não for possível evitar completamente grandes inserções de chordae, corte os tecidos para que estejam ao longo da borda do espécime quadrado. Evitar inserções de chordae é importante, pois ajuda a prevenir problemas para a microdisseção posterior.
- Use uma caneta cirúrgica para colocar um pequeno ponto no canto superior direito para rastrear a orientação do espécime. Deixe a tinta secar por aproximadamente 30 s.
- Vire a amostra com a superfície ventricular (ou seja, a superfície com inserções de coro) voltada para cima. Corte os acessórios de coro na parte de trás do tecido, esticando o chordae do folheto e usando uma lâmina de barbear para cortar perto de seu local de inserção. Vire o espécime novamente para que a superfície atrial (ou seja, a superfície lisa) esteja voltada para cima.
- Recupere um folheto de TV do congelador, lâminas de barbear, uma caneta cirúrgica, fórceps, uma pipeta com água deionizada (DI) e um tapete de corte. Descongele o folheto de TV usando 2-3 gotas de água DI de temperatura ambiente.
- Medição da espessura
- Recupere um sensor de deslocamento a laser sem contato. Zero o sensor de deslocamento em uma seção plana do tapete de corte perto do tecido aparado.
ATENÇÃO: Não brilhe diretamente o laser nos olhos. - Posicione o laser sobre a região central do espécime. Remova o ar preso sob a superfície do folheto, pois pode causar erros de medição. Para liberar ar preso, use pinças para empurrar a bolha até a borda do tecido ou levantar um canto do tecido.
- Registre a espessura mostrada no visor do sensor de deslocamento. Repita mais duas medidas em outros locais da amostra.
- Calcular a espessura média do folheto utilizando as três medidas registradas na etapa anterior. Use esse valor ao criar os protocolos de caracterização mecânica biaxial.
- Recupere um sensor de deslocamento a laser sem contato. Zero o sensor de deslocamento em uma seção plana do tapete de corte perto do tecido aparado.
- Configuração do testador biaxial e montagem de tecido
- Prepare um banho d'água DI a 37 °C, seguindo as diretrizes do sistema de testes, para garantir a temperatura sob condições fisiológicas in vivo .
- Recuperar fórceps, a amostra de tecido, hardware de montagem, uma ferramenta de ponta fina, cola cianoacrila líquida e contas de vidro pintadas de preto (diâmetro: 300-500 μm).
NOTA: O hardware de montagem inclui as latas, a ponte de montagem e a borracha de montagem. - Monte a amostra de tecido para o sistema de testes. Certifique-se de que a direção circunferencial do tecido se alinha com a direção X, que pode ser assistida pelo ponto previamente colocado na etapa 1.1.6.
NOTA: As latas utilizadas aqui devem ser espaçadas uniformemente em todo o comprimento da borda do tecido. O comprimento efetivo da borda é definido como 10 mm para o tecido intacto e >3,3 mm para as camadas compostas.
- Colocação de marcador fiducial
- Identifique a região central de um terço quadrado do tecido montado. Use os cantos aproximados desta área para a colocação do marcador fiducial.
- Coloque contas de vidro em um barco de pesagem de rosto aberto e crie uma pequena piscina de cola cianoacrilato líquida em um barco de pesagem separado. Cubra a ferramenta de ponta fina com uma pequena quantidade de cola. Dab cola em excesso na lateral do barco de pesagem.
- Crie um canto da matriz quadrada central de um terço pressionando suavemente a ponta revestida de cola sobre o tecido. Usando fórceps, pegue uma conta de vidro e coloque-a cuidadosamente em cima do ponto de cola. Use a câmera do dispositivo de teste biaxial para ajudar na colocação das contas.
- Repita as etapas 1.4.2 e 1.4.3 para três contas adicionais até que a matriz quadrada seja concluída. Certifique-se de que as contas estão bem anexadas, e seus respectivos pontos de cola não estão tocando ou grudando. Seque a cola antes de baixar o tecido para o banho de água.
- Se as contas estiverem presas juntas, espere a cola secar, então use os fórceps para agarrar suavemente a conta ou cola e puxá-la do tecido.
NOTA: A cola e as contas devem sair, permitindo que a colocação das contas seja reaquetada.
- Se as contas estiverem presas juntas, espere a cola secar, então use os fórceps para agarrar suavemente a conta ou cola e puxá-la do tecido.
- Pré-condicionamento
- Crie um protocolo de pré-condicionamento controlado por força, no qual o tecido com comprimento e espessura da borda sofrerá seis repetições de carga equibiaxial para um pico de tensão de membrana de pico T pico de 40 N/m com uma pré-carga de 3% × pico T10 e tempos de estiramento e recuperação de 30 s cada.
- Construa um diretório de testes arbitrário que armazenará temporariamente os dados para cálculos futuros. Defina a taxa de carregamento em 4,42 N/m.
- Construa um novo parâmetro de teste com o nome Pré-condicionamento0. Defina os modos de controle do eixo X e do eixo Y para forçar e definir as funções de controle para passo. Defina a magnitude da carga como a força associada ao pico T, ou seja, fpeak = T peak · L. Defina a magnitude da pré-carga como 3% do pico f apenas para a primeira repetição e defina tanto a duração do estiramento quanto a duração da recuperação como 30 s. Defina o número de repetições como 10.
NOTA: O pico computado primeiro piola-kirchhoff estresse, ou seja, pico P = Tpico/t, pode exceder 200 kPa para tecidos mais finos, o que pode resultar em ruptura de tecido durante o teste. Nestes cenários, o pico de tensão da membrana foi ajustado para um primeiro estresse máximo de Piola-Kirchhoff de 200 kPa.
- Execute o protocolo de pré-condicionamento. Após o pré-condicionamento, registo as atuais dimensões X e Y da amostra para uso nos protocolos de teste biaxial.
- Crie um protocolo de pré-condicionamento controlado por força, no qual o tecido com comprimento e espessura da borda sofrerá seis repetições de carga equibiaxial para um pico de tensão de membrana de pico T pico de 40 N/m com uma pré-carga de 3% × pico T10 e tempos de estiramento e recuperação de 30 s cada.
- Criação e execução de protocolos de teste biaxial
- Determine o tempo necessário para alcançar o pico de configuração equibiaxial a partir da configuração pós-pré-condição com a taxa de deslocamento desejada. Considerando uma taxa de deslocamento constante, calcule os tempos de carregamento para as demais razões de carregamento (i.e., TXX:TYY = 1:0.5 e TXX:TYY = 0,5:1).
- Corra manualmente os atuadores lineares para combinar com as forças-alvo para uma determinada razão de carregamento. Repita este processo e regise as dimensões do folheto para todas as razões de carregamento.
- Prepare um protocolo de teste controlado por deslocamento que desloca biaxilmente o tecido da configuração pós-pré-condição para as configurações registradas na etapa 1.6.2 (ou seja, TXX:TYY = 1:1, 1:0.5, 0.5:1) dentro dos tempos determinados na etapa 1.6.1. Certifique-se de que cada protocolo tenha três ciclos de carga/descarga para repetibilidade do comportamento mecânico.
- Construa um diretório de testes que armazene os dados para cálculos futuros. Certifique-se de que o nome do diretório corresponda ao espécime atual.
- Construa um novo parâmetro de teste com o nome 1:1, defina os modos de controle do eixo X e do eixo Y para o deslocamento e defina as funções de controle como rampa. Defina a magnitude do estiramento como a configuração registrada na etapa 1.6.1. Defina a magnitude da pré-carga como 3% do pico f apenas para a primeira repetição, e defina tanto a duração do estiramento quanto a duração da recuperação como o tempo registrado na etapa 1.6.1. Defina o número de repetições como 3.
- Repita o passo 1.6.3.2 para as demais razões de carregamento (i.e., TXX:TYY = 1:0.5 e TXX:TYY = 0,5:1), exceto definir a magnitude da pré-carga como não aplicada. Certifique-se de que a magnitude do estiramento, a duração do estiramento e a duração da recuperação correspondam às registradas na etapa 1.6.2.
NOTA: Somente serão utilizados dados do ciclo final (terceiro) para análises de estresse e tensão.
- Execute os protocolos controlados por deslocamento. Após a conclusão dos testes biaxiais, devolva o tecido às suas dimensões pós-pré-condições.
NOTA: O teste deve ser imediatamente abortado se o tecido começar a rasgar.
- Outras caracterizações
- Deixe o tecido submerso em água DI e montado no sistema de testes biaxial. Realize imagens pSFDI conforme descrito nas etapas 2.1-2.3.
- Desmonte o tecido. Se for um tecido intacto, prossiga para a microdisseção descrita nas etapas 3.1-3.7. Se não, recolha histologia seguindo o passo 3.7.
NOTA: O banho de água DI pode ser usado para caracterizações subsequentes no mesmo dia. - Repetição de passos 1.2-1.7 com as camadas A/S e F/V adquiridas após a microdisseção (etapas 3.1-3.6).
NOTA: A repetição do protocolo de teste para as camadas permite a comparação direta do tecido intacto com suas próprias camadas.
- Procedimentos de pós-processamento de dados de teste biaxial
- Realize a correlação de imagem digital das imagens de teste biaxial adquiridas para determinar as posições de marcadores dependentes do tempo. Calcular os deslocamentos do marcador fiducial via Eq (1). 5
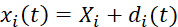 (1)
(1)
Aqui, xi(t), Xi e di(t) são o local dependente do tempo, o local inicial (referência) e o deslocamento do marcador i. - Calcule o gradiente de deformação F considerando os marcadores fiduciais como um elemento finito bilinear de quatro node, como mostrado em Eq (2)5
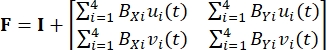 (2)
(2)
Onde BXi e BYi são os derivados das funções de forma para o nó i nas direções X e Y, respectivamente, e ui(t) e vi(t) são os componentes de di(t): di(t) = [ui(t), vi(t)]T. - Calcule o primeiro estresse Piola-Kirchhoff aplicado P usando as forças registradas, como em Eq (3)5
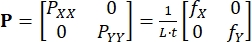 (3)
(3)
PXX e PYY são os componentes X e Y de P; L e t são o comprimento e espessura da borda do tecido; fX e fY são as forças registradas nas direções X e Y. - Determine outras medidas de tensão e estresse conforme necessário,13 que incluem a deformação cauqui-verde direito C = FT/F, a cepa Green-Lagrange E = (C - I)/2, o σ de estresse cauchy = J-1PFT, e o segundo estresse Piola-Kirchhoff S = F-1P.
NOTA: Aqui, eu sou um tensor de identidade de segunda ordem, e J = det(F) é o jacobiano do gradiente de deformação F.
- Realize a correlação de imagem digital das imagens de teste biaxial adquiridas para determinar as posições de marcadores dependentes do tempo. Calcular os deslocamentos do marcador fiducial via Eq (1). 5
2. Imagem polarizada do domínio da frequência espacial
- Preparação do sistema
NOTA: Se desejar, os marcadores fiduciais podem ser removidos do tecido antes das seguintes etapas.- Centralizar o dispositivo pSFDI sobre a amostra (Figura 2). Ligue o projetor e ilumine o espécime com 490 nm (ciano).
- Abra o software da câmera e inspecione o campo de visão da câmera. Certifique-se de que o espécime está centrado na estrutura e está completamente contido dentro do campo de visão.
- Se a amostra montada for um folheto intacto, ajuste o brilho do projetor de processamento de luz digital (DLP) para garantir que o tecido esteja totalmente iluminado sem brilhos na superfície do tecido. Não ajuste o brilho se o espécime for uma das camadas compostas.
- Gire o polarizador através de sua completa gama de movimento para detectar possíveis brilhos ou sujeira na lente polarizadora. Limpe cuidadosamente a lente polarizadora com um pano de microfibra, conforme necessário.
- Recolha de dados
NOTA: A seguinte coleta de dados pode ser automatizada usando software, como LabVIEW ou Python.- Mova o polarizador para sua posição de casa — idealmente alinhado com um dos eixos de teste biaxial. Capture uma imagem em escala de cinza e salve-a no computador com a localização do polarizador (ou seja, 0°).
- Gire o polarizador 5° e capture outra imagem em escala de cinza. Repita este processo para adquirir 37 imagens que variam de 0° a 180° com um incremento de 5°.
NOTA: As imagens da primeira sequência de imagens pSFDI podem ser analisadas preliminarmente para garantir a resposta óptica desejada do tecido. Consulte a etapa 2.3 para obter instruções. - Repita a sequência de imagens pSFDI para outras configurações de tecido desejadas, por exemplo, as configurações de pico dos protocolos de carregamento considerados para testes mecânicos biaxiais.
- procedimentos de pós-processamento de dados pSFDI
NOTA: O seguinte método inclui etapas para o idioma do programa MATLAB. No entanto, qualquer linguagem preferida (por exemplo, Python, C++) pode ser usada em seu lugar.- Use a função matlab imread() para construir arrays contendo as intensidades em termos de pixel das 37 imagens adquiridas. Para conveniência, organize-os como um n × m × matriz tridimensional de 37, onde n e m são os números de pixels ao longo dos dois eixos.
- Defina a região de interesse do tecido (ROI) usando a função grabit() definida pelo usuário.
- Ajuste os dados de ângulo de intensidade vs. polarizador para cada pixel ROI usando uma série Fourier de 3 term, como em Eq (4):
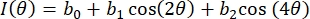 (4)
(4)
Aqui, I(φ) é a intensidade pixel-wise como uma função de ângulo polarizador, e bi são as constantes Fourier. Use a regressão linear padrão de menor quadrado para determinar bi. - Determine a orientação de fibra em termos de pixel como o ângulo polarizador associado ao valor máximo de I(φ). Calcular o grau de anisotropia óptica (DOA) via Eq (5).
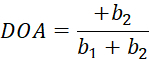 (5)
(5) - Use plot() e histograma() para visualizar a orientação de fibra adquirida e os valores DOA. Guarde os resultados processados para uso posterior.
3. Microdisseção de camadas compostas de folhetos de válvula tricúspide
- Fixação tecidual à placa de cera
- Reúna os materiais necessários: placa de cera, água DI, pipeta, bisturi, micro tesoura, fórceps finos, fórceps curvos, fórceps espessos e pinos.
NOTA: Use apenas pinças sem dentes ou apertos, pois fórceps deste tipo podem facilmente rasgar o tecido fino da camada A/S ao realizar a dissecção. - Desmonte o tecido do testador biaxial e meça sua espessura usando o sensor de deslocamento a laser descrito na etapa 1.2. Coloque o tecido na tábua de cera.
- Examine o lado ventricular do tecido para inserções de chordae grandes. Observe a posição dessas inserções para evitá-las durante a dissecção (Figura Suplementar S1). Tire uma foto para referência.
- Espalhe o tecido plano na placa de cera com os atrialis voltados para cima. Fixar o tecido à placa usando os pinos:
- Em cada canto do tecido, coloque um pino que está inclinado para longe do tecido (para melhor visualização) e puxe ligeiramente o tecido esticado (Figura 3A). Faça isso no sentido horário ou no sentido anti-horário. Certifique-se de que os pinos estão fora dos orifícios criados pelas latas ao montar o tecido.
- Ajuste ligeiramente a colocação do pino para garantir que o tecido esteja esticado e em uma configuração quadrada (Figura 3B) para que o tecido fique plano e não se desfiche durante a microdiscção da camada.
- Se necessário, coloque pinos ao longo da lateral do tecido durante a dissecação para esticar mais o tecido. Tenha em mente ao colocar e angling pinos adicionais que eles devem ser trabalhados ao redor durante a dissecação.
- Remova os marcadores fiduciais de contas de vidro.
NOTA: A etapa seguinte é opcional. A água DI adicionada ajuda a manter a hidratação tecidual e evita que o tecido grude em si mesmo durante toda a microdisseção. - Usando uma pipeta, coloque água DI na superfície do tecido para que cubra completamente o tecido de uma maneira semelhante a uma bolha. Reabastecer a água DI conforme necessário durante toda a dissecção.
- Reúna os materiais necessários: placa de cera, água DI, pipeta, bisturi, micro tesoura, fórceps finos, fórceps curvos, fórceps espessos e pinos.
- Faça o canto inicial.
- Selecione um canto do espécime fixado para iniciar a dissecção. Evite inserções de chordae grandes e áreas extremamente finas.
- Faça um corte na camada A/S arrastando levemente o bisturi sobre a superfície do tecido ao longo dos orifícios de montagem de testes mecânicos (Figura 3C). Certifique-se de que o corte tem pelo menos 5 mm de comprimento, e as bordas do corte começam a se separar, revelando a camada F/V por baixo.
- Use os fórceps finos (sem uma ponta afiada) para esfregar firmemente ao longo do corte e puxar as bordas do corte (Figura Suplementar S2).
- Se o corte na camada A/S não começar a se separar, rastreie levemente o mesmo corte novamente com o bisturi até que comece a fazer isso. Tenha cuidado para não cortar muito profundamente no tecido (além da camada composta A/S) pois torna mais difícil separar as camadas de forma limpa.
- Repita as etapas 3.2 e 3.2.3 para fazer um segundo corte perpendicular ao primeiro corte (Figura 3D). Certifique-se de que os dois cortes estão conectados e forme um canto.
- Se os dois cortes não estiverem conectados, execute as pinças finas sob a pequena área de tecido que separa os dois cortes (Figura Suplementar S3). Em seguida, use cuidadosamente a tesoura para cortar o tecido.
- Retire o tecido do canto.
- Esfregue ao longo dos cortes usando as fórceps finas até que o tecido comece a se separar da camada F/V. Assim que um pequeno pedaço de tecido for separado, segure-o com a pinça e puxe-o suavemente para separar ainda mais as camadas compostas.
NOTA: Coloque sempre a ponta da pinça fina além da borda do tecido ao agarrar. Caso contrário, eles poderiam acidentalmente fazer um buraco na camada composta A/S. - Continue descascando o tecido e esfregue a costura até chegar ao final dos dois cortes feitos para o canto. Durante todo esse processo, mude para pinças maiores para agarrar o tecido para o processo de descascamento para evitar rasgos e rasgos indesejados da camada composta A/S.
- Se a primeira curva tentada tem grandes problemas com a separação, tente um canto diferente como ponto de partida (volte ao passo 3.2).
- Esfregue ao longo dos cortes usando as fórceps finas até que o tecido comece a se separar da camada F/V. Assim que um pequeno pedaço de tecido for separado, segure-o com a pinça e puxe-o suavemente para separar ainda mais as camadas compostas.
- Estender cortes, descascar o tecido e fazer uma segunda curva.
- Estenda os dois cortes feitos para a primeira curva colocando a ponta do bisturi na parte inferior de cada corte e arrastando-a levemente ao longo da superfície tecidual (Figura 4A). Certifique-se de que todos os cortes de extensão são de pelo menos 5 mm e as extensões de corte se conectam aos cortes originais e continuam a seguir os orifícios de tine ou sutura.
NOTA: Se o corte de extensão for muito profundo, a casca futura deve ser monitorada de perto para garantir que as seções da fibrosa não sejam separadas com a camada composta A/S (Figura 5A). - Continue a estender os cortes e descasque a camada superior composta A/S para trás enquanto esfrega a costura até que um lado esteja terminado. Observe que o tecido será separado completamente ao longo de um corte; certifique-se de que a costura entre as camadas compostas A/S e F/V esteja reta (Figura 4B).
- Repita as instruções na etapa 3.2 e na etapa 3.3 para criar um segundo canto perpendicular até o final do lado totalmente descascado (Figura 4C).
- Estenda os dois cortes feitos para a primeira curva colocando a ponta do bisturi na parte inferior de cada corte e arrastando-a levemente ao longo da superfície tecidual (Figura 4A). Certifique-se de que todos os cortes de extensão são de pelo menos 5 mm e as extensões de corte se conectam aos cortes originais e continuam a seguir os orifícios de tine ou sutura.
- Separe completamente a camada A/S.
- Estenda os cortes restantes, evitando grandes inserções de chordae. Continue separando as camadas A/S e F/V usando as técnicas de esfregação e puxar empregadas para a primeira curva. Anote várias considerações ou problemas que podem surgir durante este processo:
- Exclua as inserções de chordae da área de separação A/S (Figura 5B) somente quando essa exclusão permitir uma amostra A/S grande o suficiente para caracterizações experimentais (>3,3 mm).
- Se o tecido rasgar ou um buraco se formar, pare de separar o tecido imediatamente. Para evitar que a pinça seja pega, coloque a tesoura em qualquer orifício que se forme e corte o tecido do centro. Se o defeito se formar ao longo da costura da separação, então comece a separar o tecido ao longo de outra borda para evitar novas rupturas (Figura 5C).
- Procure por conexões intercamadas que possam aparecer ao separar o tecido e evitar uma separação adicional do tecido sem um alto risco de rasgar (Figura 5D). Observe que estes são fios finos, mas fortes, que devem ser cuidadosamente cortados usando uma tesoura. Evite criar um orifício na camada A/S ou cortar para baixo na camada F/V, pois isso causaria uma separação desigual.
- Continue este processo até que a maior amostra possível da camada A/S tenha sido separada. Marque a orientação da amostra utilizando a caneta cirúrgica (Figura 6A).
- Estenda os cortes restantes, evitando grandes inserções de chordae. Continue separando as camadas A/S e F/V usando as técnicas de esfregação e puxar empregadas para a primeira curva. Anote várias considerações ou problemas que podem surgir durante este processo:
- Terminar a dissecação.
- Use a tesoura para cortar ao longo da costura de separação para a borda restante do tecido (Figura 6B). Certifique-se de que este corte está o mais próximo possível da costura de separação.
- Coloque a camada composta A/S separada plana no tapete de corte. Se necessário, use o bisturi para endireitar as bordas do tecido e criar uma forma de tecido quadrado adequada para testes mecânicos biaxiais. Coloque a camada A/S em água DI até que esteja pronta para ser testada.
- Marque a orientação da camada F/V que permanece na placa de cera. Corte a maior praça possível para fora da área onde a camada A/S foi removida (Figura 6C), em seguida, coloque-a em água DI.
- Histologia
- Extirpo duas tiras de tecido — alinhadas com as direções circunferenciais e radiais — para uso em histologia. Use protocolos diferentes para as camadas intactas e compostas (ou seja, A/S e F/V).
- Para a camada intacta, retire os espécimes do tecido que permanece preso à placa de cera. Use o tecido fora dos orifícios de tine/sutura, pois esta parte do tecido não foi dissecada e representará o folheto intacto.
- Para as camadas compostas A/S e F/V, somente colete amostras de histologia após completar totalmente seus testes e imagens. Desmonte a amostra do sistema de testes biaxiais, coloque o tecido plano em um tapete de corte, e extirja as tiras circunferenciais e radiais usando uma lâmina de barbear.
- Coloque as tiras excisadas em fitas de tecido e submerse as fitas em 10% de formalina.
- Descarte o tecido restante. Limpe as ferramentas de dissecção usando composto de limpeza (veja a Tabela de Materiais).
- Após 24-48 h de fixação, transfira as fitas para o etanol, onde podem ser armazenadas indefinidamente até o processamento e coloração da histologia.
NOTA: Esta análise histológica pode confirmar que a microdissecção é bem sucedida. ATENÇÃO: 10% de formalina causa irritação na pele e danos graves nos olhos. Também pode causar uma reação alérgica ou câncer através da inalação. Ao manusear, use equipamentos de proteção pessoal adequados, como luvas, óculos e um jaleco, e use apenas em espaços bem ventilados, como em um capô de fumaça. Quando não estiver em uso, certifique-se de que o recipiente de armazenamento está bem fechado.
- Extirpo duas tiras de tecido — alinhadas com as direções circunferenciais e radiais — para uso em histologia. Use protocolos diferentes para as camadas intactas e compostas (ou seja, A/S e F/V).
Resultados
A microdisseção produzirá amostras de A/S e F/V com espessuras relativamente uniformes que podem ser montadas em um dispositivo de teste biaxial (comercial). A análise histologia do folheto intacto e das duas camadas dissecadas verificará se o tecido foi corretamente separado ao longo da borda entre a esponjosa e a fibrosa (Figura 7). Além disso, os micrografos de histologia podem ser usados para determinar as espessuras da camada tecidual e frações de massa constituintes usando o so...
Discussão
As etapas críticas para o protocolo incluem: (i) a microdisseção da camada, (ii) a montagem do tecido, (iii) a colocação do marcador fiducial e (iv) a configuração pSFDI. A microdisseção de camada apropriada é o aspecto mais importante e difícil do método aqui descrito. Antes de iniciar uma investigação utilizando essa técnica, o dissector(s) deve ter prática de longo prazo com a técnica de microdisseção e todos os três folhetos de TV. O dissetor deve garantir que as amostras de camada composta sejam ...
Divulgações
Os autores não têm conflitos de interesse para divulgar.
Agradecimentos
Este trabalho foi apoiado pela American Heart Association Scientist Development Grant (16SDG27760143) e pela Presbyterian Health Foundation. O KMC foi apoiado em parte pelo Programa de Oportunidade de Pesquisa de Graduação da Universidade de Oklahoma (OU) e pelo Programa de Aprendizagem de Pesquisa de Honras da Universidade de Oklahoma (OU). A DWL foi apoiada em parte pela National Science Foundation Graduate Research Fellowship (GRF 2019254233) e pela American Heart Association/Children's Heart Foundation Predoctoral Fellowship (Prêmio #821298). Todo esse apoio é reconhecido com gratidão.
Materiais
| Name | Company | Catalog Number | Comments |
| 10% Formalin Solution, Neutral Buffered | Sigma-Aldrich | HT501128-4L | |
| Alconox Detergent | Alconox | cleaning compound | |
| BioTester - Biaxial Tester | CellScale Biomaterials Testing | 1.5 N Load Cell Capacity | |
| Cutting Mat | Dahle | B0027RS8DU | |
| Deionized Water | N/A | ||
| Fine-Tipped Tool | HTI INSTRUMENTS | NSPLS-12 | |
| Forceps - Curved | Scientific Labwares | 16122 | |
| Forceps - Thick | Scientific Labwares | 161001078 | |
| Forceps - Thin | Scientific Labwares | 16127 | |
| LabJoy | CellScale Biomaterials Testing | Version 10.66 | |
| Laser Displacement Sensor | Keyence | IL-030 | |
| Liquid Cyanoacrylate Glue | Loctite | 2436365 | |
| MATLAB | MathWorks | Version 2020a | |
| Micro Scissors | HTI Instruments | CAS55C | |
| Pipette | Belmaks | 360758081051Y4 | |
| Polarized Spatial Frequency Domain Imaging Device | N/A | Made in-house using a digital light projector, linear polarizer, rotating polarizer mount, and charge-coupled device camera. See doi.org/10.1016/j.actbio.2019.11.028 (PMCID: PMC8101699) for more details. | |
| Scalpel | THINKPRICE | TP-SCALPEL-3010 | |
| Single Edge Industrial Razor Blades (Surgical Carbon Steel) | VWR International | H3515541105024 | |
| Surgical Pen | LabAider | LAB-Skin-6 | |
| T-Pins | Business Source | BSN32351 | |
| Wax Board | N/A | Made in-house using modeling wax and baking tray | |
| Weigh Boat | Pure Ponta | mdo-azoc-1030 |
Referências
- Vesely, I. The role of elastin in aortic valve mechanics. Journal of Biomechanics. 31 (2), 115-123 (1998).
- Zhang, W., Ayoub, S., Liao, J., Sacks, M. S. A meso-scale layer-specific structural constitutive model of the mitral heart valve leaflets. Acta Biomaterialia. 32, 238-255 (2016).
- Stella, J. A., Sacks, M. S. On the biaxial mechanical properties of the layers of the aortic valve leaflet. Journal of Biomechanical Engineering. 129 (5), 757-766 (2007).
- Khoiy, K. A., Amini, R. On the biaxial mechanical response of porcine tricuspid valve leaflets. Journal of Biomechanical Engineering. 138 (10), 104504 (2016).
- Jett, S. V., et al. An investigation of the anisotropic mechanical properties and anatomical structure of porcine atrioventricular heart valves. Journal of the Mechanical Behavior of Biomedical Materials. 87, 155-171 (2018).
- Meador, W. D., et al. A detailed mechanical and microstructural analysis of ovine tricuspid valve leaflets. Acta Biomaterialia. 102, 100-113 (2020).
- Hudson, L. T., et al. A pilot study on linking tissue mechanics with load-dependent collagen microstructures in porcine tricuspid valve leaflets. Bioengineering. 7 (2), 60 (2020).
- Pant, A. D., et al. Pressure-induced microstructural changes in porcine tricuspid valve leaflets. Acta Biomaterialia. 67, 248-258 (2018).
- Kramer, K. E., et al. An investigation of layer-specific tissue biomechanics of porcine atrioventricular heart valve leaflets. Acta Biomaterialia. 96, 368-384 (2019).
- Ross, C. J., Laurence, D. W., Wu, Y., Lee, C. -. H. Biaxial mechanical characterizations of atrioventricular heart valves. Journal of Visualized Experiments: JoVE. (146), e59170 (2019).
- Goth, W., Lesicko, J., Sacks, M. S., Tunnell, J. W. Optical-based analysis of soft tissue structures. Annual Review of Biomedical Engineering. 18, 357-385 (2016).
- Jett, S. V., et al. Integration of polarized spatial frequency domain imaging (pSFDI) with a biaxial mechanical testing system for quantification of load-dependent collagen architecture in soft collagenous tissues. Acta Biomaterialia. 102, 149-168 (2020).
- Reddy, J. N. . An Introduction to Continuum Mechanics. , (2013).
- Duginski, G. A., Ross, C. J., Laurence, D. W., Johns, C. H., Lee, C. -. H. An investigation of the effect of freezing storage on the biaxial mechanical properties of excised porcine tricuspid valve anterior leaflets. Journal of the Mechanical Behavior of Biomedical Materials. 101, 103438 (2020).
- Salinas, S. D., Clark, M. M., Amini, R. Mechanical response changes in porcine tricuspid valve anterior leaflet under osmotic-induced swelling. Bioengineering. 6 (3), 70 (2019).
- Pokutta-Paskaleva, A., Sulejmani, F., DelRocini, M., Sun, W. Comparative mechanical, morphological, and microstructural characterization of porcine mitral and tricuspid leaflets and chordae tendineae. Acta Biomaterialia. 85, 241-252 (2019).
- Ross, C. J., et al. An investigation of the glycosaminoglycan contribution to biaxial mechanical behaviors of porcine atrioventricular heart valve leaflets. Journal of the Royal Society Interface. 16 (156), 0069 (2019).
- Sommer, G., Regitnig, P., Költringer, L., Holzapfel, G. A. Biaxial mechanical properties of intact and layer-dissected human carotid arteries at physiological and supraphysiological loadings. American Journal of Physiology-Heart and Circulatory Physiology. 298 (3), 898-912 (2009).
- Holzapfel, G. A., Sommer, G., Gasser, C., Regitnig, P. Determination of the layer-specific mechanical properties ofhuman coronary arteries with intimal thickening, and related constitutive modelling. American Journal of Physiology-Heart and Circulatory Physiology. 289 (5), 2048-2058 (2005).
- Sommer, G., et al. Multiaxial mechanical response and constitutive modeling of esophageal tissues: Impact on esophageal tissue engineering. Acta Biomaterialia. 9 (12), 9379-9391 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados