需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
三尖瓣瓣叶的层显微切割,用于双轴力学表征和微观结构定量
摘要
该协议描述了双轴力学表征,基于偏振空间频域成像的胶原定量以及三尖瓣小叶的显微解剖。提供的方法阐明了小叶层如何促进整体小叶行为。
摘要
三尖瓣(TV)调节未氧化血液从右心房到右心室的单向流动。电视由三张传单组成,每张传单都有独特的机械行为。通过检查三个电视传单之间的这些变化,可以通过检查它们的四个解剖层来进一步理解,即心房(A),海绵(S),纤维化(F)和室状(V)。虽然这些层存在于所有三个电视传单中,但它们的厚度和微观结构成分存在差异,进一步影响它们各自的机械行为。
该协议包括阐明层特异性差异的四个步骤:(i)表征完整电视传单的机械和胶原纤维结构行为,(ii)分离电视传单的复合层(A / S和F / V),(iii)对复合层进行相同的表征,以及(iv)进行 事后操作 组织学评估。这种实验框架独特地允许将完整的TV组织与其每个复合层直接进行比较。因此,可以使用该协议收集有关电视传单的微观结构和生物力学功能的详细信息。这些信息可以潜在地用于开发电视计算模型,旨在为电视疾病的临床治疗提供指导。
引言
电视位于心脏的右心房和右心室之间。在整个心脏周期中,电视通过电视前传单(TVAL),电视后传单(TVPL)和电视隔膜传单(TVSL)的循环打开和关闭来调节单向血流。这些小叶很复杂,有四个不同的解剖层 - 心房(A),海绵(S),纤维(F)和室状(V) - 具有独特的微观结构成分。心房和心室中的弹性蛋白纤维有助于在机械负荷1后将组织恢复到其未变形的几何形状。相反,纤维含有密集的起伏胶原纤维网络,有助于小叶2的承载能力。海绵主要由糖胺聚糖组成,据推测,在心脏瓣膜功能3期间,海绵体能够在小叶层之间剪切。虽然所有三种小叶类型都具有相同的解剖层,但层的厚度和组成比例存在差异,这对小叶特定的机械行为有影响。
研究人员使用平面机械表征,组织形态学评估和胶原纤维结构的光学表征来探索电视传单的性质。例如,平面双轴机械表征试图通过对组织施加垂直位移并记录相关力来模拟生理负荷。由此产生的力 -位移(或应力-拉伸)观察结果显示,所有三个 TV 小叶都表现出非线性、特定于方向的机械行为,在径向组织方向4,5,6 中具有更明显的小叶特异性响应。这些传单特异性行为被认为源于使用标准组织学技术观察到的微观结构性质的差异6,7。此外,二次谐波生成成像6,小角度光散射8和偏振空间频域成像7(pSFDI)旨在了解这些微观结构性质,并显示出胶原纤维取向和纤维压接的小叶特异性差异,这对观察到的组织水平机械行为有影响。这些研究显着推进了我们对组织微观结构及其在组织水平行为中的作用的理解。然而,在实验上连接组织力学和底层微观结构方面仍有许多问题有待解决。
最近,该实验室使用显微解剖技术对分离成两个复合层(A / S和F / V)的电视传单层进行了机械表征9。早期的工作突出了各层机械性能的差异,并有助于深入了解分层微观结构如何促进组织机械行为。虽然这项研究提高了我们对电视传单微观结构的理解,但该技术有几个局限性。首先,复合层的性质没有直接与完整组织进行比较,导致对力学- 微观结构关系缺乏完整的理解。其次,没有检查复合层的胶原纤维结构。第三,由于难以从其他两个电视传单中收集复合层,因此仅研究了TVAL的层。本文描述的方法提供了一个整体表征框架,克服了这些限制,并提供了电视传单及其复合层的完整表征。
本文介绍了将三个电视传单分离成复合层(A / S和F / V)以进行双轴机械和微观结构表征的显微解剖技术10,11,12。该 迭代 方案包括(i)完整传单的双轴力学测试和pSFDI表征,(ii)一种新颖且可重复的显微切割技术,以可靠地获得复合电视层,以及(iii)复合电视层的双轴力学测试和pSFDI表征。将组织暴露在具有各种力比的双轴拉伸载荷下进行机械测试。然后,使用pSFDI来确定胶原纤维在各种负载配置下的取向和取向。pSFDI保留了天然胶原纤维结构,允许负载依赖性分析,并规避了胶原纤维结构分析中固定或清除组织的典型需求,例如二次谐波发生成像或小角度光散射。最后,使用标准组织学技术制备组织,以可视化组织微观结构。这种迭代的整体框架允许将电视传单的机械和微观结构特性与其复合层直接进行比较。
研究方案
本文描述的所有方法均由俄克拉荷马大学机构动物护理和使用委员会批准。动物组织是从美国农业部批准的屠宰场获得的。
1. 双轴机械表征
- 组织准备
- 从冰箱、剃须刀片、手术笔、镊子、装有去离子(DI)水的移液器和切割垫中取出电视传单。使用2-3滴室温去离子水解冻电视传单。
注意:使用去离子水代替磷酸盐缓冲盐水(PBS),以避免PBS引起的层显微切割困难。 - 将标本平放在切割垫上,心室层(即脉络膜插入的表面)朝上。定位试样,使径向方向与 Y 方向对齐,圆周方向与 X 方向对齐。
注:圆周方向沿阀门的圆周方向定向。 - 检查组织的脊索插入位置。确定一个区域,理想情况下约为12 x 12 mm,大的脊索插入量最少,同时避免极薄(即透明)的区域(图1)。
- 将试样翻转过来,使心房表面(即没有胆道插入的表面)朝上。确保圆周和径向传单方向分别与 X 轴和 Y 轴对齐。
- 从小叶组织中切出一个正方形的12 x 12 mm标本,以避免在步骤1.1.3中确定的大脊索插入或薄区域。用镊子取出小叶组织的修剪部分,并将它们放入废物容器中。
- 如果不可能完全避免大的脊索插入,切开组织,使它们沿着方形标本的边缘。避免脊索插入很重要,因为它有助于防止以后的显微解剖出现问题。
- 使用手术笔在右上角放置一个小点,以跟踪标本的方向。让墨水干燥约30秒。
- 翻转标本时,心室表面(即带有弦插入的表面)朝上。修剪组织背面的脊弦附件,方法是从小叶中拉伸脊索,并使用剃须刀片在其插入位置附近切割。再次翻转标本,使心房表面(即光滑表面)朝上。
- 从冰箱、剃须刀片、手术笔、镊子、装有去离子(DI)水的移液器和切割垫中取出电视传单。使用2-3滴室温去离子水解冻电视传单。
- 厚度测量
- 取回非接触式激光位移传感器。将位移传感器放在修剪过的纸巾附近的切割垫的平坦部分上。
注意:不要将激光直接照射到眼睛中。 - 将激光放置在试样的中央区域。去除被困在传单表面下的空气,因为它会导致测量误差。要释放被困的空气,请使用镊子将气泡推到组织的边缘或抬起组织的一角。
- 记录位移传感器显示屏上显示的厚度。在试样的其他位置再重复两次测量。
- 使用上一步中记录的三个测量值计算平均传单厚度。在创建双轴机械表征协议时使用此值。
- 取回非接触式激光位移传感器。将位移传感器放在修剪过的纸巾附近的切割垫的平坦部分上。
- 双轴测试仪设置和组织安装
- 按照测试系统的指南,在37°C下准备去离子水浴,以确保 体内 生理条件下的温度。
- 取回镊子,组织标本,安装硬件,细尖工具,液态氰基丙烯酸酯胶水和涂有黑色的玻璃珠(直径:300-500μm)。
注:安装硬件包括齿、安装桥和安装橡胶。 - 将组织标本安装到测试系统上。确保组织的圆周方向与 X方向对齐,这可以通过先前在步骤1.1.6中放置的点来辅助。
注意:这里使用的齿应均匀地分布在整个组织边缘长度上。对于完整组织,有效边缘长度设置为10 mm,对于复合层,有效边缘长度设置为>3.3 mm。
- 基准标记放置
- 识别所安装组织的中央三分之一正方形区域。使用此区域的近似角进行基准标记放置。
- 将玻璃珠放在开放式称重船上,并在单独的称重船上形成一小池液态氰基丙烯酸酯胶水。用少量胶水涂在细尖工具的顶部。在称重船的侧面轻拍多余的胶水。
- 通过将涂有胶水的尖端轻轻按压在纸巾上,创建中央三分之一方形阵列的一个角。使用镊子,抓住一个玻璃珠,小心地把它放在胶点的顶部。使用双轴测试设备的相机帮助放置磁珠。
- 对另外三个磁珠重复步骤 1.4.2 和 1.4.3,直到方形阵列完成。确保珠子牢固地连接在一起,并且它们各自的胶点没有接触或粘在一起。在将组织放入水浴之前,先将胶水干燥。
- 如果珠子粘在一起,等待胶水干燥,然后用镊子轻轻抓住珠子或胶水并将其从纸巾上拉下来。
注:胶水和磁珠应脱落,以便重新尝试放置磁珠。
- 如果珠子粘在一起,等待胶水干燥,然后用镊子轻轻抓住珠子或胶水并将其从纸巾上拉下来。
- 预处理
- 创建一个力控制的预处理方案,其中具有边缘长度和厚度的组织将经历六次等双向加载,达到40 N / m的峰值膜张力 T峰 ,预加载为3%× T峰10,拉伸和恢复时间为30 s。
- 构造一个任意测试目录,该目录将临时存储数据以供将来计算。将 加载速率 设置为 4.42 N/m。
- 构造一个名为 "预处理"0 的新测试参数集。将 X 轴和 Y 轴控制模式设置为强制,并将控制功能设置为步进。将载荷大小定义为与 T峰相关的力,即 f峰 = T峰 · L. 仅将第一次重复的预载荷幅度定义为 f峰 的 3%,并将拉伸持续时间和恢复持续时间定义为 30 s。将重复次数定义为 10。
注意:对于较薄的组织,计算出的第一个皮奥拉-基尔霍夫应力峰,即 P峰 = T峰/t,可能超过200 kPa,这可能导致测试过程中组织撕裂。在这些情况下,将膜张力峰值调整为最大第一皮奥拉-基尔霍夫应力为200 kPa。
- 执行预处理协议。预处理后,记录试样的当前 X和 Y尺寸,以用于双轴测试方案。
- 创建一个力控制的预处理方案,其中具有边缘长度和厚度的组织将经历六次等双向加载,达到40 N / m的峰值膜张力 T峰 ,预加载为3%× T峰10,拉伸和恢复时间为30 s。
- 创建和执行双轴测试协议
- 确定从具有所需位移速率的预处理后配置实现峰值等偏置配置所需的时间。考虑恒定的位移率,计算剩余载荷比的载荷时间(即 ,TXX:TYY = 1:0.5 和 TXX:TYY = 0.5:1)。
- 手动点动线性致动器以匹配给定载荷比下的目标力。重复此过程并记录所有装载比率的传单尺寸。
- 准备置换控制的测试方案,在步骤1.6.1确定的时间内,将组织从预处理后配置双向置换到步骤1.6.2(即 TXX:TYY = 1:1,1:0.5,0.5:1)中记录的配置。确保每个协议有三个加载/卸载周期,以实现机械行为的可重复性。
- 构造一个测试目录,用于存储数据以供将来计算。确保目录名称与当前样本匹配。
- 构造一个名为 1:1 的新测试参数集,将 X 轴和 Y 轴控制模式设置为位移,并将控制函数设置为斜坡。将拉伸幅度定义为步骤 1.6.1 中记录的配置。仅在第一次重复时将预载荷幅度定义为 f峰值 的 3%,并将拉伸持续时间和恢复持续时间定义为步骤 1.6.1 中记录的时间。将重复次数定义为 3。
- 对剩余的载荷比(即 T XX:T YY = 1:0.5 和 TXX:TYY = 0.5)重复步骤 1.6.3.2,但将预载荷幅度定义为未施加的除外。确保拉伸幅度、拉伸持续时间和恢复持续时间与步骤 1.6.2 中记录的持续时间相匹配。
注:只有来自最终(第三)周期的数据才会用于应力和应变分析。
- 执行位移控制协议。完成双轴测试后,将组织恢复到其预处理后的尺寸。
注意:如果组织开始撕裂,应立即中止测试。
- 进一步表征
- 将组织浸没在去离子水中并安装到双轴测试系统上。按照步骤 2.1-2.3 中所述执行 pSFDI 成像。
- 解开纸巾。如果它是完整的组织,则继续进行步骤3.1-3.7中描述的显微解剖。如果没有,请按照步骤3.7收集组织学。
注意:DI水浴可用于当天的后续表征。 - 对显微切割后获取的 A/S 和 F/V 层重复步骤 1.2-1.7(步骤 3.1-3.6)。
注意:重复各层的测试方案,可以将完整组织与其自身的层直接进行比较。
- 双轴测试数据后处理程序
- 对采集的双轴测试图像进行数字图像关联,以确定与时间相关的标记位置。通过等式 (1) 计算基准标记位移。5
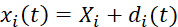 (1)
(1)
此处, xi(t)、 Xi 和 di(t) 是时间相关的位置、初始(参考)位置和标记 i 的位移。 - 通过将基准标记视为四节点双线性有限元来计算变形梯度 F,如 Eq (2)5 所示
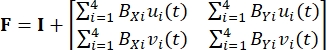 (二)
(二)
其中 ,BXi 和 BYi 分别是节点 i 在 X 和 Y 方向上的形状函数的导数, ui(t) 和 vi(t) 是 di(t) 的分量: di(t) = [ui(t), vi(t)]T。 - 使用记录的力计算所施加的第一个皮奥拉-基尔霍夫应力 P ,如等式 (3)5
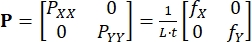 (三)
(三)
PXX 和 PYY 是 P 的 X 和 Y 分量; L 和 t 是组织边缘的长度和厚度; fX 和 fY 是在 X 和 Y 方向上记录的力。 - 根据需要确定其他应变和应力测量值,13 包括正确的柯西-格林变形 C = FT/F、格林-拉格朗日应变 E = (C - I)/2、柯西应力σ = J-1PFT,以及第二个皮奥拉-基尔霍夫应力 S = F-1P。
注意:这里, I 是二阶恒等张量, J = det(F) 是变形梯度 F 的雅可比矩阵。
- 对采集的双轴测试图像进行数字图像关联,以确定与时间相关的标记位置。通过等式 (1) 计算基准标记位移。5
2. 偏振空间频域成像
- 系统准备
注意:如果需要,可以在以下步骤之前从组织中去除基准标记物。- 将pSFDI装置置于试样上(图2)。打开投影仪并用490 nm(青色)光照亮标本。
- 打开相机软件并检查相机的视野。确保试样在框架中居中,并完全包含在视野内。
- 如果安装的标本是完整的传单,请调整数字光处理(DLP)投影仪的亮度,以确保组织完全照明,组织表面没有眩光。如果试样是复合层之一,则不要调整亮度。
- 在整个运动范围内旋转偏光片,以检测偏光镜片上可能的眩光或污垢。根据需要,用超细纤维布仔细清洁偏光镜片。
- 数据采集
注: 以下 数据 收集 可以 使用 软件 自动 化, 例如 LabVIEW 或 Python。- 将偏振片移动到其原位置 - 理想情况下与其中一个双轴测试轴对齐。捕获一张灰度图像,并将其保存到计算机,并带有偏振片位置(即0°)。
- 将偏振片旋转 5°并拍摄另一张灰度图像。重复此过程以 0° 至 180° 为增量获取 37 张图像。
注意:可以初步分析来自第一个pSFDI成像序列的图像,以确保来自组织的所需光学响应。有关说明,请参阅步骤 2.3。 - 对其他所需的组织配置重复pSFDI成像序列,例如,双轴力学测试所考虑的加载方案的峰配置。
- pSFDI数据后处理程序
注意:以下方法包括 MATLAB 程序语言的步骤。但是,可以使用任何首选语言(例如,Python,C++)来代替。- 使用 MATLAB imread() 函数构造包含 37 张采集图像的像素强度的数组。为方便起见,将它们排列为 n × m × 37 三维数组,其中 n 和 m 是沿两个轴的像素数。
- 使用用户定义的 抓斗 ()函数定义感兴趣的组织区域(ROI)。
- 使用 3 项傅里叶级数拟合每个 ROI 像素的强度与偏振角数据,如等式 (4):
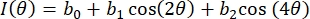 (四)
(四)
在这里, I(θ)是作为偏振角函数的像素强度, bi 是傅里叶常数。使用标准线性最小二乘回归来确定 bi。 - 将像素级光纤方向确定为与 I(θ) 最大值相关的偏振片角度。通过等式 (5) 计算光学各向异性 (DOA) 的程度。
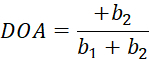 (5)
(5) - 使用 绘图() 和 直方图() 可视化获取的纤维取向和DOA值。保存处理后的结果供以后使用。
3. 三尖瓣小叶复合层的显微解剖
- 纸巾附着在蜡板上
- 收集所需的材料:蜡板,去离子水,移液器,手术刀,微剪刀,薄镊子,弯曲镊子,厚镊子和针。
注意:仅使用没有牙齿或夹具的镊子,因为这种类型的镊子在进行解剖时很容易撕裂A / S层的薄组织。 - 从双轴测试仪上取下组织,并使用步骤1.2中描述的激光位移传感器测量其厚度。将纸巾放在蜡板上。
- 检查组织的室侧是否有大的脉络膜插入。注意这些插入的位置,以避免在解剖过程中使用它们(补充图S1)。拍照留念。
- 将纸巾平放在蜡板上,心房朝上。使用销钉将纸巾固定在板上:
- 在组织的每个角落,放置一个远离组织的针(以便更好地观察),并稍微拉紧组织(图3A)。按顺时针或逆时针顺序执行此操作。确保销钉位于安装组织时齿形成的孔外。
- 稍微调整针脚的位置,以确保组织绷紧且呈正方形(图3B),以使组织平整且在层显微解剖期间不会移动。
- 如有必要,在解剖过程中沿着组织侧面放置针脚以进一步拉伸组织。在放置和倾斜其他针脚时,请记住,在解剖过程中必须对其进行处理。
- 取下玻璃珠基准标记。
注意:以下步骤是可选的。添加的去离子水有助于维持组织水合作用,并防止组织在整个显微解剖过程中粘附在自身上。 - 使用移液管,将去离子水放在组织表面上,使其以气泡状方式完全覆盖组织。在整个解剖过程中根据需要补充去离子水。
- 收集所需的材料:蜡板,去离子水,移液器,手术刀,微剪刀,薄镊子,弯曲镊子,厚镊子和针。
- 使初始角。
- 选择固定标本的一角以开始解剖。避免大的脊索插入和极薄的区域。
- 通过沿着机械测试的安装孔将手术刀轻轻拖到组织表面上,在A / S层中进行切割(图3C)。确保切口长度至少为 5 mm,切口的边缘开始拉开,露出下面的 F/V 层。
- 使用薄镊子(没有锋利的尖端)沿着切口牢固地摩擦并拉开切口的边缘(补充图S2)。
- 如果 A/S 层中的切口没有开始拉开,请用手术刀再次在同一切口上轻轻描摹,直到它开始这样做。注意不要切入组织太深(超过A / S复合层),因为这会使干净地分离层变得更加困难。
- 重复步骤 3.2 和 3.2.3,使第二个切割垂直于第一个切割(图 3D)。确保两个切口连接并形成一个拐角。
- 如果两个切口没有连接,则在分离两个切口的小面积组织下运行薄镊子(补充图S3)。然后,小心地用剪刀剪开纸巾。
- 从角落剥离组织。
- 使用薄镊子沿着切口摩擦,直到组织开始与F / V层分离。一旦分离出一小块组织,用镊子抓住它并轻轻拉动它以进一步分离复合层。
注意:抓握时,始终将薄镊子的尖端放在组织边缘之后。否则,他们可能会不小心在A / S复合层上戳一个洞。 - 继续剥离组织并揉搓接缝,直到它到达为角落做的两个切口的末端。在整个过程中,切换到较大的镊子以抓取剥离过程中的组织,以防止A / S复合层的意外撕裂和撕裂。
- 如果尝试的第一个角存在重大分离问题,请尝试使用其他角作为起点(返回到步骤 3.2)。
- 使用薄镊子沿着切口摩擦,直到组织开始与F / V层分离。一旦分离出一小块组织,用镊子抓住它并轻轻拉动它以进一步分离复合层。
- 扩大切口,剥离组织,然后做第二个角落。
- 通过将手术刀尖端放在每个切口的底部并沿着组织表面轻轻拖动,来扩展为第一个角而做的两个切口(图4A)。确保所有延伸切口至少为 5 mm,并且切口延伸段连接到原始切口并继续沿齿或缝合孔延伸。
注意:如果延伸切口太深,则必须密切监测即将发生的剥离,以确保纤维膜的部分不与A / S复合层分离(图5A)。 - 继续延长切口并向后剥离顶部的复合A / S层,同时摩擦接缝直到一面完成。观察组织将沿着一个切口完全分离;确保A / S和F / V复合层之间的接缝是直的(图4B)。
- 重复步骤3.2和步骤3.3中的说明,以创建垂直于完全剥离的一侧末端的第二个角(图4C)。
- 通过将手术刀尖端放在每个切口的底部并沿着组织表面轻轻拖动,来扩展为第一个角而做的两个切口(图4A)。确保所有延伸切口至少为 5 mm,并且切口延伸段连接到原始切口并继续沿齿或缝合孔延伸。
- 完全分离 A/S 层。
- 延长剩余的切口,同时避免大的肋骨插入。继续使用第一个角采用的摩擦和拉动技术来分离 A/S 和 F/V 层。记下在此过程中可能出现的几个注意事项或问题:
- 仅当这种排除允许A / S样品足够大以进行实验表征(>3.3 mm)时,才从A / S分离区域排除脊索插入(图5B)。
- 如果组织撕裂或形成孔洞,请立即停止分离组织。为了防止镊子被抓住,请将剪刀放在任何形成的孔中,并将组织从中心切开。如果缺陷沿着分离的接缝形成,则开始沿着另一条边缘分离组织以防止进一步撕裂(图5C)。
- 寻找分离组织时可能出现的层间连接,并防止组织的进一步分离,而不会有很高的撕裂风险(图5D)。观察这些是细而强的股线,必须用剪刀小心地剪开。避免在A / S层上形成孔或向下切入F / V层,因为这会导致不均匀的分离。
- 继续此过程,直到分离出 A/S 层的最大样本。使用手术笔标记样品的方向(图6A)。
- 延长剩余的切口,同时避免大的肋骨插入。继续使用第一个角采用的摩擦和拉动技术来分离 A/S 和 F/V 层。记下在此过程中可能出现的几个注意事项或问题:
- 完成解剖。
- 使用剪刀沿着分离缝切割剩余的组织边缘(图6B)。确保此切口尽可能靠近分离接缝。
- 将分离的 A/S 复合层平放在切割垫上。如有必要,使用手术刀拉直组织的边缘,并创建适合双轴力学测试的方形组织形状。将A / S层放入去离子水中,直到准备好进行测试。
- 标记蜡板上残留的 F/V 层的方向。从去除A / S层的区域(图6C)中切出最大的正方形,然后将其置于去离子水中。
- 组织学
- 切除两条组织条带 - 与周向和桡面方向对齐 - 用于组织学。对完整层和复合层(即 A/S 和 F/V)使用不同的协议。
- 对于完整的层,从仍然固定在蜡板上的组织中获取标本。使用齿/缝合孔外的组织,因为这部分组织尚未解剖,将代表完整的小叶。
- 对于A / S和F / V复合层,仅在完全完成测试和成像后收集组织学样本。从双轴测试系统中取出试样,将组织平放在切割垫上,然后使用剃须刀片切除周向条带和径向条带。
- 将切除的条带放入组织盒中,并将盒浸入10%福尔马林中。
- 丢弃剩余的组织。使用清洁剂清洁解剖工具(参见 材料表)。
- 固定24-48小时后,将盒转移到乙醇中,在那里它们可以无限期地储存,直到组织学处理和染色。
注意:此组织学分析可以确认显微解剖是成功的。 注意:10%福尔马林会引起皮肤刺激和严重的眼睛损伤。它也可能通过吸入引起过敏反应或癌症。处理时,请佩戴适当的个人防护设备,如手套、护目镜和实验室外套,并且只能在通风良好的空间(如通风橱)中使用。不使用时,请确保存储容器密闭。
- 切除两条组织条带 - 与周向和桡面方向对齐 - 用于组织学。对完整层和复合层(即 A/S 和 F/V)使用不同的协议。
结果
显微切割将产生厚度相对均匀的A / S和F / V试样,可以安装到(商业)双轴测试设备上。对完整小叶和两个解剖层的组织学分析将验证组织是否沿着海绵体和纤维化之间的边界正确分离(图7)。此外,组织学显微照片可用于使用ImageJ软件确定组织层厚度和组成质量分数。当产生的A / S样品太小而无法安装到双轴测试仪上时,就会发生解剖失败。这最常发生在剥皮过程中的A / S?...
讨论
该方案的关键步骤包括:(i)层显微切割,(ii)组织安装,(iii)基准标记物放置,以及(iv)pSFDI设置。适当的层显微解术是本文所述方法中最重要和最困难的方面。在使用这种技术开展调查之前,分界员应长期使用显微解剖技术和所有三份电视传单。分离器应确保复合层试样足够大(>3.3毫米)并具有均匀的厚度。应使用组织学来确认解剖始终具有准确的层分离。
对于组?...
披露声明
作者没有利益冲突要披露。
致谢
这项工作得到了美国心脏协会科学家发展补助金(16SDG27760143)和长老会健康基金会的支持。KMC得到了俄克拉荷马大学(OU)本科生研究机会计划和荣誉研究学徒计划的部分支持。DWL得到了美国国家科学基金会研究生研究奖学金(GRF 2019254233)和美国心脏协会/儿童心脏基金会博士前奖学金(第821298奖)的部分支持。所有这些支持都得到感谢。
材料
| Name | Company | Catalog Number | Comments |
| 10% Formalin Solution, Neutral Buffered | Sigma-Aldrich | HT501128-4L | |
| Alconox Detergent | Alconox | cleaning compound | |
| BioTester - Biaxial Tester | CellScale Biomaterials Testing | 1.5 N Load Cell Capacity | |
| Cutting Mat | Dahle | B0027RS8DU | |
| Deionized Water | N/A | ||
| Fine-Tipped Tool | HTI INSTRUMENTS | NSPLS-12 | |
| Forceps - Curved | Scientific Labwares | 16122 | |
| Forceps - Thick | Scientific Labwares | 161001078 | |
| Forceps - Thin | Scientific Labwares | 16127 | |
| LabJoy | CellScale Biomaterials Testing | Version 10.66 | |
| Laser Displacement Sensor | Keyence | IL-030 | |
| Liquid Cyanoacrylate Glue | Loctite | 2436365 | |
| MATLAB | MathWorks | Version 2020a | |
| Micro Scissors | HTI Instruments | CAS55C | |
| Pipette | Belmaks | 360758081051Y4 | |
| Polarized Spatial Frequency Domain Imaging Device | N/A | Made in-house using a digital light projector, linear polarizer, rotating polarizer mount, and charge-coupled device camera. See doi.org/10.1016/j.actbio.2019.11.028 (PMCID: PMC8101699) for more details. | |
| Scalpel | THINKPRICE | TP-SCALPEL-3010 | |
| Single Edge Industrial Razor Blades (Surgical Carbon Steel) | VWR International | H3515541105024 | |
| Surgical Pen | LabAider | LAB-Skin-6 | |
| T-Pins | Business Source | BSN32351 | |
| Wax Board | N/A | Made in-house using modeling wax and baking tray | |
| Weigh Boat | Pure Ponta | mdo-azoc-1030 |
参考文献
- Vesely, I. The role of elastin in aortic valve mechanics. Journal of Biomechanics. 31 (2), 115-123 (1998).
- Zhang, W., Ayoub, S., Liao, J., Sacks, M. S. A meso-scale layer-specific structural constitutive model of the mitral heart valve leaflets. Acta Biomaterialia. 32, 238-255 (2016).
- Stella, J. A., Sacks, M. S. On the biaxial mechanical properties of the layers of the aortic valve leaflet. Journal of Biomechanical Engineering. 129 (5), 757-766 (2007).
- Khoiy, K. A., Amini, R. On the biaxial mechanical response of porcine tricuspid valve leaflets. Journal of Biomechanical Engineering. 138 (10), 104504 (2016).
- Jett, S. V., et al. An investigation of the anisotropic mechanical properties and anatomical structure of porcine atrioventricular heart valves. Journal of the Mechanical Behavior of Biomedical Materials. 87, 155-171 (2018).
- Meador, W. D., et al. A detailed mechanical and microstructural analysis of ovine tricuspid valve leaflets. Acta Biomaterialia. 102, 100-113 (2020).
- Hudson, L. T., et al. A pilot study on linking tissue mechanics with load-dependent collagen microstructures in porcine tricuspid valve leaflets. Bioengineering. 7 (2), 60 (2020).
- Pant, A. D., et al. Pressure-induced microstructural changes in porcine tricuspid valve leaflets. Acta Biomaterialia. 67, 248-258 (2018).
- Kramer, K. E., et al. An investigation of layer-specific tissue biomechanics of porcine atrioventricular heart valve leaflets. Acta Biomaterialia. 96, 368-384 (2019).
- Ross, C. J., Laurence, D. W., Wu, Y., Lee, C. -. H. Biaxial mechanical characterizations of atrioventricular heart valves. Journal of Visualized Experiments: JoVE. (146), e59170 (2019).
- Goth, W., Lesicko, J., Sacks, M. S., Tunnell, J. W. Optical-based analysis of soft tissue structures. Annual Review of Biomedical Engineering. 18, 357-385 (2016).
- Jett, S. V., et al. Integration of polarized spatial frequency domain imaging (pSFDI) with a biaxial mechanical testing system for quantification of load-dependent collagen architecture in soft collagenous tissues. Acta Biomaterialia. 102, 149-168 (2020).
- Reddy, J. N. . An Introduction to Continuum Mechanics. , (2013).
- Duginski, G. A., Ross, C. J., Laurence, D. W., Johns, C. H., Lee, C. -. H. An investigation of the effect of freezing storage on the biaxial mechanical properties of excised porcine tricuspid valve anterior leaflets. Journal of the Mechanical Behavior of Biomedical Materials. 101, 103438 (2020).
- Salinas, S. D., Clark, M. M., Amini, R. Mechanical response changes in porcine tricuspid valve anterior leaflet under osmotic-induced swelling. Bioengineering. 6 (3), 70 (2019).
- Pokutta-Paskaleva, A., Sulejmani, F., DelRocini, M., Sun, W. Comparative mechanical, morphological, and microstructural characterization of porcine mitral and tricuspid leaflets and chordae tendineae. Acta Biomaterialia. 85, 241-252 (2019).
- Ross, C. J., et al. An investigation of the glycosaminoglycan contribution to biaxial mechanical behaviors of porcine atrioventricular heart valve leaflets. Journal of the Royal Society Interface. 16 (156), 0069 (2019).
- Sommer, G., Regitnig, P., Költringer, L., Holzapfel, G. A. Biaxial mechanical properties of intact and layer-dissected human carotid arteries at physiological and supraphysiological loadings. American Journal of Physiology-Heart and Circulatory Physiology. 298 (3), 898-912 (2009).
- Holzapfel, G. A., Sommer, G., Gasser, C., Regitnig, P. Determination of the layer-specific mechanical properties ofhuman coronary arteries with intimal thickening, and related constitutive modelling. American Journal of Physiology-Heart and Circulatory Physiology. 289 (5), 2048-2058 (2005).
- Sommer, G., et al. Multiaxial mechanical response and constitutive modeling of esophageal tissues: Impact on esophageal tissue engineering. Acta Biomaterialia. 9 (12), 9379-9391 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。