このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
紅藻生理機能を評価するための自己蛍光イメージング
要約
本プロトコルは、スペクトル分析に基づく紅藻におけるフィコビリタンパク質変化の段階的な自己蛍光イメージングおよび評価を記載する。これは、希少な材料しか利用できず、実験室条件下で細胞がゆっくりと成長するか、まったく成長しない場合に、極端な生息地への細胞の適応を評価するためのラベルフリーで非破壊的な方法です。
要約
紅藻(Rhodophyta)にはフィコビリタンパク質が含まれており、薄暗い光で生息地にコロニーを形成しますが、一部(たとえば、一部の Chroothece 種)は完全な日光の下でも発達する可能性があります。ほとんどのシャクナゲは赤ですが、青と赤のビリタンパク質(フィコシアニンとフィコエリスリン)の割合によっては青みがかったように見えるものもあります。異なるフィコビリタンパク質は、異なる波長の光を捕捉し、それをクロロフィルaに伝達することができるため、非常に異なる光条件下での光合成が可能になります。これらの色素は光の生息地の変化に反応し、それらの自家蛍光は生物学的プロセスの研究に役立ちます。 Chroothece mobilis をモデル生物として使用し、共焦点顕微鏡でスペクトルラムダスキャンモードを使用して、光合成色素の異なる単色光への適応を細胞レベルで研究し、種の最適な成長条件を推測しました。結果は、研究された株が洞窟から分離された場合でも、薄暗い光強度と中程度の光強度の両方に適応することを示しました。提示された方法は、極端な生息地に住んでいる人々に通常当てはまる、実験室条件下で成長しないかまたは非常にゆっくりと成長する光合成生物を研究するのに特に有用である。
概要
Chroothece属などの紅藻は、極端な生息地で成長する可能性があり、そこでは頻繁に顕著な環境変化に対処しなければなりません1。洪水や干ばつは、この属が見られる半乾燥地域で頻繁に発生し、一部の種は小川、崖、洞窟、さらには温泉水で報告されています2。しかし、ほとんどの場合、競争や放牧などの生物学的変数は、種を成長に最適な条件に追いやっています。これらの生物は培養が困難なことが多く、実験室条件下では成長しないか、成長が非常に遅いため、大きな制限の1つは利用可能なサンプルサイズです。したがって、非破壊的な方法または最小限のサンプル操作を伴う方法に従うことが非常に重要です3,4。
これらの過酷な環境で生き残るために必要な生理学的スキルは、光合成システムの変化を追跡することによって監視することができます。代謝メカニズム、光合成効率、および光または培養条件に対する感受性は、それらのエネルギー伝達またはトラップの正確な変化による色素蛍光発光プロファイルによって明らかにすることができる5、6、7、8。
細胞化合物の自家蛍光は、細胞診断のためのマーカーとして、または発光の変化を介した外部および内部シグナルに応答する細胞状態または代謝の自然な指標として使用することができる9。また、分類学的に異なる光合成生物群を区別するためにも用いることができる10。光合成微生物の系統発生的位置に応じて、異なる in vivo 蛍光の特徴を見つけることができます。そのため、光合成蛍光の インビボ 特性(蛍光吸収および発光スペクトルを含む)に基づく分類学的同定が何度か試みられている11、12。植物プランクトン分類群間の副色素の多様性のために、クロロフィルa(Chl a)蛍光が刺激される波長の違い、または発光スペクトルの違いは、分類法を推測するために使用することができます13。これらの標本の in vivo 蛍光励起および発光スペクトルは、藻類門だけでなく、光化学系の適応にも依存しています14。Chl aへのエネルギー移動の効率、または付属色素に対するChlaの比率、および細胞色素含有量は、成長条件に敏感です5。
紅藻、特に Chrootheceは、いくつかの副蛍光色素 - フィコビリタンパク質およびカロテノイドを有する。前者は葉緑体のチラコイドに付着したフィコビリソームに集中する。フィコビリタンパク質(フィコシアニン、フィコエリスリン、およびアロフィコシアニン)は、さまざまな波長の光を捕捉してChl aに伝達できるため、非常に異なる光と培養条件での光合成が可能になります15。たとえば、 Chroothece 種は洞窟内で成長したり、わずかに塩分の多い石灰質の流れにほとんど出現したりする可能性があります2。
単色光は、光合成生物の成長と色素組成に影響を与え、洞窟での光合成生物の成長を防止または制御することが研究されています。Mulecら赤色濃縮照明がシアノバクテリアの成長を促進することを示した, 藻類, と植物16.以前の研究では、緑色光がシアノバクテリアの色素組成に影響を与えることも報告されています17, 他の研究では、緑色光がほとんどの光合成生物の成長を妨げ、一部のシアノバクテリアはチラコイドの減少と弱い平均蛍光強度を示すことが明らかになりました18.
モデル生物としての Chroothece が過酷な条件を克服する能力を理解するために、培養細胞は増加する光強度と単色光(緑または赤)15にさらされ、洞窟の薄暗い条件(赤色光が優勢)にどのように対処するかを調べました。本明細書に提示されるプロトコルは、 Chrootheceのフィコビリタンパク質に対する上記の変数の効果を、それ自身の自己蛍光を用いて細胞レベルで再現する。
今日、蛍光は維管束植物、微細藻類、大型藻類、およびシアノバクテリアの生理学的応答を研究するためのツールとして一般的に使用されています13,14,16。分光共焦点蛍光顕微鏡は、実験室での低成長率に関連する問題や、関連する抽出および生化学的方法に十分なバイオマスを得ることの難しさを回避することにより、光合成標本の生理機能を単一細胞レベルで評価するためのin vivo研究に最適なツールです10、17、18、19、208.細胞を異なる培養条件下で2週間処理すると、ラムダスキャンプロファイルをin vivoで測定できます。共焦点イメージングによる励起の異なる波長が用いられているいくつかの出版物があるが3、4、10、17、ほとんどのフィコビリタンパク質およびChl aは、561nmの波長励起線を用いて検出することができ、検出される発光は570〜760nmの波長の範囲である。これらの基準は、共焦点イメージングによる市販の純粋な顔料(表1)を用いて以前に行われた分析10、および異なる藻類種20、21、22で得られた結果に基づいている。
| 顔料 | λFL最大 (nm) | λ エクスクセプタ (nm) | |||||||
| 351 | 364 | 458 | 476 | 488 | 514 | 543 | 633 | ||
| Chl a | 660.9-678.1 | 43.4 ± 1.8 | 11.2 ± 0.2 | 1.8 ± 0.05 | 2.0 ± 0.08 | 12.2 ± 0.7 | 6.0± 0.3 | 4.2 ± 0.16 | 80.7 ± 1.5 |
| R-PE | 569.2-583.3 | 5.9 ± 0.6 | 5.9 ± 0.16 | 11.1 ± 0.04 | 42.2±0.3 | 100.0 ± 0 | 90.0± 0.3 | 99.2 ± 0.08 | - |
| 652.1-668.6 | - | - | 1.5 ± 0.01 | 3.7 ± 0.04 | 26.7± 0.5 | 8.7 ± 0.16 | 11.1 ± 0.16 | 11.3 ± 0.2 | |
| C-PC | 636.2-676.4 | 2.3 ± 0.04 | 1.0 ± 0.01 | 0.6 ± 0.004 | 0.7 ± 0.008 | 2.0 ± 0.08 | 2.0 ± 0.04 | 3.3 ± 0.16 | 33.6± 0.9 |
| APC-XL | 667.3-683.8 | 15.1 ± 1.5 | 9.6 ± ±0.98 | 1.0 ± 0.04 | 1.2 ± 0.08 | 5.9 ± 0.7 | 4.1 ± 0.5 | 23.2 ± 3.5 | 91.4 ± 2.3 |
表1:ラムダスキャン分析の実行に使用される純粋な顔料情報。 この表は、すべての励起波長の共焦点イメージング分光光度法による異なる蛍光色素/顔料の発光ピークと肩/蛍光バンドの最大値、および顔料/蛍光色素による発光の割合を示しています。値は、= MFI * 100/255の式で計算しました。各値はSE±平均値(平均値±平均からの標準誤差)です。共焦点走査型レーザー顕微鏡の校正には純顔料を以下の1、2、10で使用した。クロロフィルaはスピ ナシアオレラセアから、R-フィコエリスリン(R-PE)はポルフィ ラテネラから、 C-フィコシアニン(C-PE)は スピルリナspから得られた。 全ての種を濾過蒸留水に溶解した。アロフィコシアニン-XL(APC-XL)は、硫酸アンモニウム(60%)およびリン酸カリウム(pH = 7)に溶解して38 mMの濃度を達成した マスティゴクラドゥスラミノサスから得られました。スキャンは、8ウェルカバーガラスボトムチャンバーを使用して、各顔料溶液(濃度1 mg / mL)400 μLで実行されました。
単一の励起波長の研究は、非常に有用な最初の近似です。ただし、この場合、蛍光シグナルにおける異なる複合体の相対的な寄与を解明する必要があり、他の方法の中でもとりわけ、いくつかの波長で蛍光比またはスペクトル分析を実行することをお勧めします。
プロトコル
藻類種 Chroothece mobilis が本研究に使用された。この種は、微細藻類Edaphic SEスペイン、MAESE 20.29培養コレクションから入手しました。プロトコルの概要を 図 1 に示します。
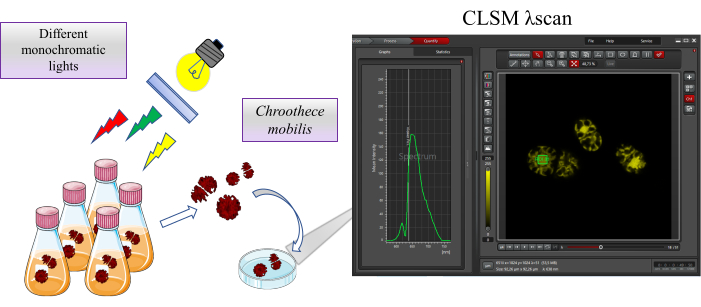
図1:研究の概要。 Chroothece mobilis は、異なる単色光などの極端な生息地条件下で2週間インキュベートされます。 Chrootheceの生理機能への影響は、共焦点レーザー走査顕微鏡を使用したフィコビリソームおよび光化学系に含まれるタンパク質の自家蛍光によって評価されます。 この図の拡大版を表示するには、ここをクリックしてください。
1. サンプル調製
- Chroothece mobilisの接種材料をSWES液体培地に移すことにより、コレクションの寒天培養物から調製する(表2)。
注:SWES「ゼーワッサー+エルデコクト+サルツェ」=海水媒体23。 - 目的の細胞密度が得られるまで、低白色光強度(LL:80 μM/m 2/s)条件下で振とうすることなく、20°Cで16:8の明暗日長ですべての培養物を2週間維持します(ステップ1.3を参照)。
注意: 成長光の条件は80μM / m2 / sの光強度(活性光合成放射、PAR)です。これらの条件は、低照度条件(コントロール)として用いられる。SWES培地の組成を 表2に示す。 - 1ウェルあたり1 mLを使用して、24ウェルプレートで細胞密度5 x 103 細胞/mLの指数関数的培養段階でさまざまな実験の接種を実施します。
注:ノイバウアーチャンバー24で細胞計数を行い、必要に応じてSWESで培養液を希釈します。
| SWES培地組成 | |
| コンポーネント | 濃度 |
| クノ3 | 1.98 ミリメートル |
| K2HPO4 | 115マイクロメートル |
| マグネシウム4 | 81マイクロメートル |
| ZnSO4, 7H2O | 17ナノメートル |
| MnSO4, 7H2O | 45ナノメートル |
| H3 BO3, 4H2O | 3.1ミリメートル |
| Co(NO3)2 | 17ミリメートル |
| Na2MoO4, 6H2O | 21ナノメートル |
| CuSO4, 2H2O | 0.1ナノメートル |
| FeSO4, 5H2O | 13マイクロメートル |
| EDTA, 7H2O | 11マイクロメートル |
| ビタミンB12 | 5μg |
| 土壌エキス | 30ミリリットル |
| ろ過された川の水 | 455ミリリットル |
表2:SWES培地組成。
2.極端な藻類の生息地条件の再現:緑と赤の単色光効果
- 前述の細胞密度で調製したストック培養液から細胞培養液を1 mL加え(ステップ1.2)、24ウェルプレートの各ウェルに接種する。
- 単色光の効果を再現するために、細胞培養物を2週間覆ったままにします。
- 506nmの波長にピークを有する緑色光が470〜570nmを通過できるようにする緑色フィルターを使用し(メーカーの仕様による; 材料表を参照)、それを培養物にさらす25。
- 590〜720nmの赤色光と678nmのピーク(メーカーの仕様による; 材料表を参照)を可能にする赤色フィルターを使用して、培養物25にさらします。
注意: 低白色光強度(LL:80 μM / m2 / s;材料表を参照)条件は、得られた効果を比較するための光強度コントロールとして使用されます。使用される光強度単位は、マイクロモル/秒および平方メートル(μmol m-2 s-1)または光合成光子束密度(PPFD)です。
3. 自家蛍光イメージング
メモ: イメージングソフトウェアのセットアップ( 材料の表を参照)を 図2に示します。
- レーザーを含む倒立共焦点レーザー走査型顕微鏡(CLSM; 材料の表を参照)のすべてのコンポーネントの電源を入れます。
- SWES増殖培地中の24ウェルプレートの各実験ウェルの細胞を35 mmガラスボトムディッシュ( 材料の表を参照)にマウントしてイメージングします。
- 63x/1.30 NAグリセロール浸漬対物レンズを選択し、グリセロールをレンズの上に置きます(材料表を参照)。
- ウェルプレートを顕微鏡ステージに置き、画像取得中に試料が動かないようにします。
- 標本を光路の中心に配置し、蛍光強度が最も高い平面を選択して細胞の中心に焦点を合わせます。
- 画像取得ソフトウェアを開き、取得モード26のドロップダウンリストからxyλを選択します。
- 561 nm DPSS、8ビットのダイナミックレンジ、1024 x 1024ピクセルまでのレーザーの励起線を選択します。
注:共焦点顕微鏡に561 nm DPSSレーザーまたは白色光レーザー(WLL)が搭載されていることを確認してください。 - 10 nm帯域幅の蛍光発光スペクトルと、570〜760 nmの範囲内の4 nmのラムダステップサイズを収集します。
- ピンホールを1 Airyユニットに設定し、ラムダスキャンアクイジションを実行します。
- このプロセスをさまざまな視野でできるだけ何度も繰り返して、統計分析のために許容できる量のデータを収集します(通常は10%未満の標準偏差22)。
- 異なる条件(赤と緑のライトの下)で最後の手順を繰り返し、データを保存します。
注:異なるサンプルと条件に同じ取得設定を使用して、統計分析を比較および実行します。

図2:ソフトウェアのセットアップ。 ラムダスキャンパラメータを設定するためのイメージングソフトウェアのユーザーインターフェイス。(a)左から右へ、ドロップダウンリストから取得モードxyλを選択し、プロトコルのステップ3.6に対応する、右の液浸レンズタイプを選択する。手順3.9の光路からフィルターをすべて取り外してください。(B)ラムダスキャンパラメータを設定するためのパネルは、プロトコルのステップ3.8に対応しています。(C) ステップ 3.10 でラムダスキャンを実行します。 この図の拡大版を表示するには、ここをクリックしてください。
4. クロテックスの生理機能を評価するためのパラメータ
- ラムダスキャンが取得されたら、ソフトウェアの上部にある 定量 ウィンドウをクリックして( 図3を参照)、収集された蛍光発光スペクトルを評価します。 [プロジェクトを開く ]ウィンドウに移動し、 xyλ ファイルを1つ選択します(図3)。
- イメージングソフトウェアで [スタックプロファイル解析 ]を選択します。
- 細胞の中心に4μm2の関心領域(ROI)を定義し、平均蛍光強度(MFI)を分析した。データを CSV 形式でエクスポートします。
注:黒いピクセルの存在を避け(選択したピクセルに正の値が含まれていることを確認するため)、常に同じサイズのROIを維持することが重要です。 - このプロセスをさまざまな条件下でさまざまなセルで繰り返して、統計分析を実行するのに十分なデータを生成します。
- CSVファイルを開いて、測定されたすべてのROIのフィコビリタンパク質とクロロフィルからさまざまな蛍光発光ピークを選択します。
- フィコエリスリン-フィコシアノビリン(PE-PCB;620 nm)、C-フィコシアニン(CPC;648 nm)、アロフィコシアニン(APC;660 nm)、クロロフィルa(Chl a;680 nm)の蛍光データをcsvファイルでそれぞれ選択します。
- 各フィコビリタンパク質とクロロフィルピークから得られたすべての最大蛍光値を含む新しいテーブルを作成し、データをグラフにプロットします。
- 統計分析を実行します。
- 得られたデータが正規性と等分散27を満たすかどうかを分析します。
- 最初の条件が真であれば、t検定分析27,28に進みます。そうでない場合は、マン・ホイットニーU検定29を実行します。
- p値<0.05での有意差を考えます。
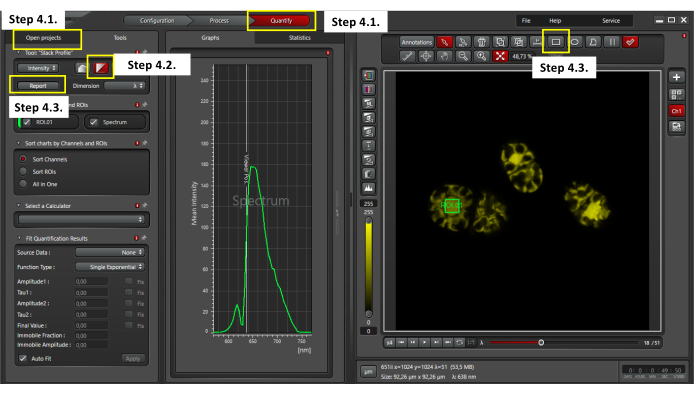
図3: クロステスの自家蛍光の評価。 自己蛍光解析を実行するには、開いているプロジェクトウィンドウで定量ウィンドウと1つのxyλファイルを選択してください(ステップ4.1)。[スタック プロファイルの視覚化] を選択します (手順 4.2)。セルの中央で4 μm2 ROIを選択し、レポートボタンをクリックしてラムダスキャンデータをCSV形式でエクスポートします(ステップ4.3)。 この図の拡大版を表示するには、ここをクリックしてください。
結果
クロロフィルaは一般に可視光の青と赤の波長を吸収しますが、フィコビリタンパク質は緑、黄、オレンジの波長7を使用します。これらの色素の自家蛍光により、実験および野外条件下でフィコビリタンパク質とクロロフィル挙動を研究する最初のアプローチが可能になります。
得られたデータを比較し、異なるグラフにプロットすることにより、平均...
ディスカッション
Chrootheceなどの一部の単細胞またはコロニーの紅藻は、in vitroでゆっくりと成長しますが、色素発光ピークの違いを検出できる共焦点顕微鏡でのスペクトル分析によって分析できる複数の自己蛍光化合物が含まれています。スペクトル共焦点蛍光顕微鏡法により、光合成生物の適応または順応を評価するためのin vivo研究を実施することができました8,10,17,18,19,20。
開示事項
著者は宣言する利益相反はありません。
謝辞
この研究は、スペイン経済競争力省とムルシア地域のセネカ財団が資金提供するプロジェクトTIN2015-68454-Rおよび20961 / PI / 18の一環として実施されました。ムルシア大学科学研究エリア統計支援セクションのアイリーン・エルナンデス・マルティネスとフランシスコ・ハビエル・イバニェス・ロペス(Sección de Apoyo Estadístico (SAE)、Área Científica y de Investigación(ACTI)、ムルシア大学(図1 はセルヴィエ・メディカル・アートの写真を使用して描かれました。セルヴィエによるセルヴィエ・メディカル・アートは、クリエイティブ・コモンズ 表示 3.0 非移植ライセンス (https://creativecommons.org/licenses/by/3.0/) でライセンスされています。
資料
| Name | Company | Catalog Number | Comments |
| µ-Dish 35 mm, high Glass Bottom | Ibidi | 81158 | - |
| 24 black well plate | Ibidi | 82406 | flat and clear bottom for high throughput microscopy |
| Algae Incubator | Panasonic | MLR-352-PE | |
| Confocal laser scanning microscope | Leica Microsystems | SP8 TCS | - |
| Flask | Fisher Scientific | 15380591 | Can be purchased in a local convenience store or online stores. |
| green filter | PNTA, LEE filters | - | Can be purchased in a local convenience store or online stores. |
| HC PL APO 63X/1.30 GLYC CORR CS2 | Leica Microsystems | 506353 | Glycerol immersion lens |
| Image acquisition software. LAS X | Leica Microsystems | SP8 TCS | - |
| Light source | Panasonic | FL40SSENW/37MLR-352-PE | |
| Quantum photoradiometer | DeltaOhm | DO 9721 | - |
| R software | R Core Team, 2020 | 4.0.2. | - |
| red filter | PNTA, LEE filters | - | Can be purchased in a local convenience store or online stores. |
| SWES medium | University of Murcia | - | - |
| Type G Immersion liquid | Leica Microsystems | 11513910 | Glycerol |
参考文献
- Vis, M. L., Necchi, O. . Freshwater Red Algae: Phylogeny, Taxonomy and Biogeography. , (2021).
- Aboal, M., et al. Diversity of Chroothece (Rhodophyta, Stylonematales) including two new species. European Journal of Phycology. 53 (2), 189-197 (2018).
- Millach, L., Obiol, A., Solé, A., Esteve, I. A novel method to analyse in vivo the physiological state and cell viability of phototrophic microorganisms by confocal laser scanning microscopy using a dual laser. Journal of Microscopy. 268 (1), 53-65 (2017).
- Millach, L., Villagrasa, E., Solé, A., Esteve, I. Combined confocal laser scanning microscopy techniques for a rapid assessment of the effect and cell viability of Scenedesmus sp. DE2009 under metal stress. Microscopy and Microanalysis. 25 (4), 998-1003 (2019).
- Poryvkina, L., Babichenko, S., Leeben, A. Analysis of phytoplankton pigments by excitation spectra of fluorescence. Proceedings of EARSeL-SIG-Workshop LIDAR. , (2000).
- Beutler, M., et al. A fluorometric method for the differentiation of algal populations in vivo and in situ. Photosynthesis Research. 72 (1), 39-53 (2002).
- Grigoryeva, N., Chistyakova, L. Fluorescence microscopic spectroscopy for investigation and monitoring of biological diversity and physiological state of cyanobacterial cultures. Cyanobacteria. , (2018).
- Grigoryeva, N. . Fluorescence Methods for Investigation of Living Cells and Microorganisms. , (2020).
- Roshchina, V. V. Vital autofluorescence: application to the study of plant living cells. International Journal of Spectroscopy. 2012, 5-18 (2012).
- Roldán, M., Thomas, F., Castel, S., Quesada, A., Hernández-Mariné, M. Noninvasive pigment identification in single cells from living phototrophic biofilms by confocal imaging spectrofluorometry. Applied and Environmental Microbiology. 70 (6), 3745-3750 (2004).
- Hense, B. A., Gais, P., Jütting, U., Scherb, H., Rodenacker, K. Use of fluorescence information for automated phytoplankton investigation by image analysis. Journal of Plankton Research. 30 (5), 587-606 (2008).
- Millie, D. F., Schofield, O. M., Kirkpatrick, G. J., Johnsen, G., Evens, T. J. Using absorbance and fluorescence spectra to discriminate microalgae. European Journal of Phycology. 37 (3), 313-322 (2002).
- Richardson, T. L., et al. Spectral fluorometric characterization of phytoplankton community composition using the Algae Online Analyser. Water Research. 44 (8), 2461-2472 (2010).
- Kieleck, C., Bousquet, B., Le Brun, G., Cariou, J., Lotrian, J. Laser induced fluorescence imaging: application to groups of macroalgae identification. Journal of Physics D: Applied Physics. 34 (16), 2561-2571 (2001).
- Coronado-Parra, T., Roldán, M., Aboal, M. Confocal microscopy in ecophysiological studies of algae: a door to understanding autofluorescence in red algae. Microscopy and Microanalysis. 28 (1), 218-226 (2022).
- Mulec, J., Kosi, G. Lampenflora algae and methods of growth control. Journal of Cave and Karst Studies. 71 (2), 109-115 (2009).
- Nelissen, B., De Baere, R., Wilmotte, A., De Wachter, R. Phylogenetic relationships of nonaxenic filamentous cyanobacterial strains based on 16S rRNA sequence analysis. Journal of Molecular Evolution. 42 (2), 194-200 (1996).
- Roldán, M., Oliva, F., Gónzalez Del Valle, M. A., Saiz-Jimenez, C., Hernández-Mariné, M. Does green light influence the fluorescence properties and structure of phototrophic biofilms. Applied and Environmental Microbiology. 72 (4), 3026-3031 (2006).
- Topinka, J. A., Bellows, W. K., Yentsch, C. S. Characterization of marine macroalgae by fluorescence signatures. International Journal of Remote Sensing. 11 (12), 2329-2335 (1990).
- Roldán, M., Ascaso, C., Wierzchos, J. Fluorescent fingerprints of endolithic phototrophic cyanobacteria living within halite rocks in the atacama desert. Applied and Environmental Microbiology. 80 (10), 2998-3006 (2014).
- Solé, A., Diestra, E., Esteve, I. Confocal laser scanning microscopy image analysis for cyanobacterial biomass determined at microscale level in different microbial mats. Microbial Ecology. 57 (4), 649-656 (2009).
- Ramírez, O., García, A., Rojas, R., Couve, A., Härtel, S. Confined displacement algorithm determines true and random colocalization in fluorescence microscopy. Journal of Microscopy. 239 (3), 173-183 (2010).
- Universität Gottingen-Georg-August. SAG Culture Collection of Algae. Universität Gottingen-Georg-August. , (2022).
- Zhang, M., et al. Improvement of cell counting method for Neubauer counting chamber. Journal of Clinical Laboratory Analysis. 34 (1), 23024 (2020).
- Wolf, E., Schüßler, A. Phycobiliprotein fluorescence of Nostoc punctiforme changes during the life cycle and chromatic adaptation: Characterization by spectral confocal laser scanning microscopy and spectral unmixing. Plant, Cell and Environment. 28 (4), 480-491 (2005).
- Zucker, R. M., Rigby, P., Clements, I., Salmon, W., Chua, M. Reliability of confocal microscopy spectral imaging systems: Use of multispectral beads. Cytometry Part A. 71 (3), 174-189 (2007).
- Field, A. M. . Discovering Statistics Using R. , (2013).
- Linnet, K. Limitations of the paired t-test for evaluation of method comparison data. Clinical Chemistry. 45 (2), 314-315 (1999).
- Rosner, B., Grove, D. Use of the Mann-Whitney U-test for clustered data. Statistics in Medicine. 18 (11), 1387-1400 (1999).
- Colin, L., et al. Imaging the living plant cell: from probes to quantification. The Plant Cell. 34 (1), 247-272 (2022).
- Borlinghaus, R. The white confical: continuous spectral tuning in excitation and emission. Optical Fluorescence Microscopy. , (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved