Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Kırmızı Alg Fizyolojisini Değerlendirmek için Otofloresan Görüntüleme
Bu Makalede
Özet
Bu protokol, spektral analize dayalı olarak kırmızı alglerdeki fikobiliprotein değişikliklerinin adım adım otofloresan görüntülemesini ve değerlendirilmesini açıklamaktadır. Bu, yalnızca kıt materyalin mevcut olduğu ve hücrelerin laboratuvar koşullarında yavaş büyüdüğü veya hiç büyümediği aşırı habitatlara hücresel adaptasyonu değerlendirmek için etiketsiz ve tahribatsız bir yöntemdir.
Özet
Kırmızı algler (Rhodophyta) fikobiliproteinler içerir ve habitatları loş ışıkla kolonileştirir, ancak bazıları (örneğin, bazı Chroothece türleri) tam güneş ışığında da gelişebilir. Çoğu rodofit kırmızıdır, ancak bazıları mavi ve kırmızı biliproteinlerin (fikosiyanin ve fikoeritrin) oranına bağlı olarak mavimsi görünebilir. Farklı fikobiliproteinler ışığı farklı dalga boylarında yakalayabilir ve çok farklı ışık koşulları altında fotosentezi mümkün kılan klorofil a'ya iletebilir. Bu pigmentler ışıktaki habitat değişikliklerine cevap verir ve otofloresanları biyolojik süreçleri incelemeye yardımcı olabilir. Chroothece mobilis'i model bir organizma olarak ve spektral lambda tarama modunu konfokal mikroskopta kullanarak, fotosentetik pigmentlerin farklı monokromatik ışıklara adaptasyonu, türlerin optimal büyüme koşullarını tahmin etmek için hücresel düzeyde incelenmiştir. Sonuçlar, incelenen suşun bir mağaradan izole edildiğinde bile, hem loş hem de orta ışık yoğunluklarına adapte olduğunu göstermiştir. Sunulan yöntem, laboratuvar koşullarında çok yavaş büyümeyen veya büyümeyen fotosentetik organizmaları incelemek için özellikle yararlıdır, bu genellikle aşırı habitatlarda yaşayanlar için geçerlidir.
Giriş
Chroothece cinsi gibi kırmızı algler, sıklıkla belirgin çevresel değişikliklerle başa çıkmak zorunda kaldıkları aşırı habitatlarda büyüyebilir1. Bu cinsin bulunabileceği yarı kurak bölgelerde sel ve kuraklıklar sık görülür ve bazı türler derelerde, uçurumlarda, mağaralarda ve hatta termal sularda bildirilmiştir2. Bununla birlikte, çoğu zaman, rekabet veya otlatma gibi biyolojik değişkenler, türleri büyümeleri için optimal olmayan koşullara yönlendirir. Bu organizmaların kültürlenmesi genellikle zor olduğundan ve laboratuvar koşullarında çok yavaş büyümediğinden veya çok yavaş büyüdüğünden, önemli bir sınırlama mevcut örneklem büyüklüğüdür. Bu nedenle, tahribatsız yöntemlerin veya minimum numune manipülasyonu içeren yöntemlerin izlenmesi çok önemlidir 3,4.
Bu zorlu ortamlarda hayatta kalmak için gereken fizyolojik beceriler, fotosentetik sistemlerindeki değişiklikleri takip ederek izlenebilir. Metabolik mekanizmalar, fotosentetik verimlilik ve ışığa veya kültür koşullarına duyarlılık, enerji transferlerindeki veya yakalamalarındaki doğru değişiklikler nedeniyle pigment floresan emisyon profilleri tarafından ortaya çıkarılabilir 5,6,7,8.
Hücresel bileşiklerin otofloresansı, sitodiagnostik için bir belirteç olarak veya emisyon9'daki değişiklikler yoluyla dış ve iç sinyallere yanıt olarak hücresel durumun veya metabolizmanın doğal bir göstergesi olarak kullanılabilir. Ayrıca taksonomik olarak farklı fotosentetik organizma gruplarını ayırt etmek için de kullanılabilir10. Fototrofik mikroorganizmaların filogenetik konumuna bağlı olarak, farklı in vivo floresan özellikleri bulunabilir. Bu nedenle, fototrofik floresanın in vivo özelliklerine (floresan absorpsiyonu ve emisyon spektrumları dahil) dayanan bir taksonomik tanımlama birkaç kez denenmiştir11,12. Fitoplankton taksonları arasındaki aksesuar pigmentlerindeki çeşitlilik nedeniyle, klorofil a (Chl a) floresansının uyarıldığı dalga boylarındaki farklılıklar veya emisyon spektrumlarındaki farklılıklar, taksonomi13'ü çıkarmak için kullanılabilir. Bu örneklerin in vivo floresan uyarımı ve emisyon spektrumları sadece alglerin filumuna değil, aynı zamanda fotosistem adaptasyonuna da bağlıdır14. Chl a'ya enerji transferinin etkinliği veya Chl a'nın aksesuar pigmentlere oranı ve hücresel pigment içeriği büyüme koşullarına duyarlıdır5.
Kırmızı algler, özellikle Chroothece, birkaç aksesuar floresan pigmente-fikobiliproteinler ve karotenoidlere sahiptir; kloroplastların tilakoidlerine bağlı fikobilizomlardaki eski konsantre. Fikobiliproteinler (fikosiyanin, fikoeritrin ve allofikoksiyanin) farklı dalga boylarında ışığı yakalayabilir ve Chl a'ya iletebilir, bu da çok farklı ışık ve kültür koşullarında fotosentezi mümkün kılar15. Örneğin, Chroothece türleri mağaraların içinde büyüyebilir veya hafif tuzlu kalkerli akarsularda neredeyse ortaya çıkabilir2.
Monokromatik ışıklar, fotosentetik organizmaların büyümesini ve pigment bileşimini etkiler ve mağaralarda fotosentetik organizmaların büyümesini önlemek veya kontrol etmek için çalışılmıştır. Mulec ve ark. kırmızı zenginleştirilmiş aydınlatmanın siyanobakterilerin, alglerin ve bitkilerin büyümesini desteklediğini göstermiştir16. Önceki çalışmalar ayrıca yeşil ışığın siyanobakterilerin pigment bileşimini etkilediğini bildirmiştir17, diğerleri ise yeşil ışığın çoğu fotosentetik organizmanın büyümesini önlediğini ve bazı siyanobakterilerin tilakoidlerde bir azalma gösterdiğini ve daha zayıf ortalama floresan yoğunluğu18 sergilediğini ortaya koymuştur.
Chroothece'nin zorlu koşulların üstesinden gelmek için model bir organizma olarak yeteneğini anlamak için, kültürlenmiş hücreler, mağaraların loş koşullarıyla (kırmızı ışığın baskın olduğu yerlerde) nasıl başa çıktığını görmek için artan ışık yoğunluklarına ve tek renkli ışığa (yeşil veya kırmızı)15 maruz kalmıştır. Burada sunulan protokol, yukarıda belirtilen değişkenlerin Chroothece'nin fikobiliproteinleri üzerindeki etkisini, kendi otofloresansını kullanarak hücresel düzeyde yeniden üretir.
Günümüzde, floresan yaygın olarak vasküler bitkilerin, mikroalglerin, makroalglerin ve siyanobakterilerin fizyolojik tepkilerini incelemek için bir araç olarak kullanılmaktadır13,14,16. Spektral konfokal floresan mikroskopi, fotosentetik örneklerin fizyolojisini tek hücre seviyesinde 10,17,18,19,20 olarak değerlendirmek için in vivo çalışmalar için, laboratuvardaki düşük büyüme hızıyla ilişkili sorunlardan ve ilgili ekstraksiyon ve biyokimyasal yöntemler için yeterli biyokütle elde etmedeki zorluklardan kaçınarak mükemmel bir araçtır8 . Hücreler 2 hafta boyunca farklı kültür koşulları altında tedavi edildikten sonra, lambda tarama profili in vivo olarak ölçülebilir. Konfokal görüntüleme ile farklı dalga boylarında uyarılmanın kullanıldığı birkaç yayın olmasına rağmen,çoğu fikobiliprotein ve Chl a, 561 nm dalga boyu uyarma çizgisi kullanılarak tespit edilebilir ve tespit edilen emisyon 570 ila 760 nm dalga boyu arasında değişir. Bu kriterler daha önce 10 ticari saf pigment ile konfokal görüntüleme ile yapılan bir analize (Tablo 1) ve farklı alg türlerinde elde edilen sonuçlara dayanmaktadır20,21,22.
| Pigmentler | λflmax (nm) | λ exc (nm) | |||||||
| 351 | 364 | 458 | 476 | 488 | 514 | 543 | 633 | ||
| Chl a | 660.9-678.1 | 43,4 ± 1,8 | 11.2 ± 0.2 | 1.8 ± 0.05 | 2.0 ± 0.08 | 12.2 ± 0.7 | 6.0 ± 0.3 | 4.2 ± 0.16 | 80,7 ± 1,5 |
| R-PE | 569.2-583.3 | 5.9 ± 0.6 | 5.9 ± 0.16 | 11.1 ± 0.04 | 42.2 ± 0.3 | 100,0 ± 0 | 90.0 ± 0.3 | 99.2 ± 0.08 | - |
| 652.1-668.6 | - | - | 1.5 ± 0.01 | 3.7 ± 0.04 | 26.7 ± 0.5 | 8.7 ± 0.16 | 11.1 ± 0.16 | 11.3 ± 0.2 | |
| C-PC | 636.2-676.4 | 2.3 ± 0.04 | 1.0 ± 0.01 | 0.6 ± 0.004 | 0.7 ± 0.008 | 2.0 ± 0.08 | 2.0 ± 0.04 | 3.3 ± 0.16 | 33.6 ± 0.9 |
| APC-XL | 667.3-683.8 | 15,1 ± 1,5 | 9.6 ± 0.98 | 1.0 ± 0.04 | 1.2 ± 0.08 | 5.9 ± 0.7 | 4.1 ± 0.5 | 23,2 ± 3,5 | 91,4 ± 2,3 |
Tablo 1: Lambda tarama analizini yürütmek için kullanılan saf pigment bilgileri. Bu tabloda, tüm uyarma dalga boyları için konfokal görüntüleme spektrofotometrisi ile farklı florokromların/pigmentlerin emisyon zirveleri ve omuz/floresan bant maksimumları ve pigmentler/florokromlar tarafından ışık emisyonunun yüzdesi gösterilmektedir. Değerler şu formülle hesaplanmıştır: = MFI*100/255. Her değer, SE'± ortalamasıdır (ortalamadan standart hata ±). Konfokal taramalı lazer mikroskobun kalibrasyonu için saf pigmentler aşağıdaki gibi kullanıldı 1,2,10. Klorofil a, Spinacia oleracea'dan, R-phycoerythrin (R-PE) Porphyra tenera'dan ve C-phycocyanin (C-PE) Spirulina sp'den elde edildi. Tüm türler filtrelenmiş damıtılmış suda çözüldü. Allophycocyanin-XL (APC-XL), 38 mM'lik bir konsantrasyon elde etmek için amonyum sülfat (% 60) ve potasyum fosfat (pH = 7) içinde çözünen Mastigocladus laminosus'tan elde edildi. Taramalar, her pigment çözeltisinin 400 μL'si (1 mg / mL konsantrasyonu) ile 8 iyi kaplanmış cam alt oda kullanılarak gerçekleştirildi.
Tek bir uyarma dalga boyunun incelenmesi oldukça yararlı bir ilk yaklaşımdır. Bununla birlikte, bu durumda, diğer yöntemlerin yanı sıra, birkaç dalga boyunda bir floresan oranı veya spektrum analizi yapılması önerilen floresan sinyalindeki farklı komplekslerin göreceli katkısını aydınlatmak gerekir.
Protokol
Bu çalışmada Chroothece mobilis alg türleri kullanılmıştır. Türler Microalgae Edaphic SE Spain, MAESE 20.29 kültür koleksiyonundan elde edilmiştir. Protokole genel bir bakış Şekil 1'de gösterilmiştir.
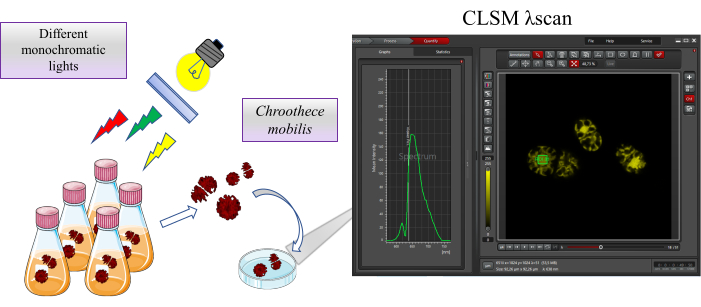
Şekil 1: Çalışmaya genel bakış. Chroothece mobilis , farklı monokromatik ışıklar gibi aşırı habitat koşulları altında 2 hafta boyunca inkübe edilir. Chroothece'nin fizyolojisi üzerindeki etkisi, konfokal lazer tarama mikroskobu kullanılarak fikobilizom ve fotosistemlerde bulunan proteinlerin otofloresansı ile değerlendirilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
1. Numune hazırlama
- Chroothece mobilis inokulumu, koleksiyonun agar kültüründen SWES sıvı ortamına aktarılarak hazırlanır (Tablo 2).
NOT: SWES "Seewasser + Erddekokt + Salze" = deniz suyu ortamı23. - Tüm kültürleri, düşük beyaz ışık yoğunluğu (LL: 80 μM / m 2 / s) koşullarında ve istenen hücre yoğunluğu elde edilene kadar titremeden 20 ° C'de16: 8 açık / koyu fotoperiyotla 2 hafta boyunca koruyun (bkz. adım 1.3).
NOT: Büyüme ışığı koşulları 80 μM/m2/s ışık yoğunluğudur (aktif fotosentetik radyasyon, PAR). Bu koşullar düşük ışık koşulları (kontrol) olarak kullanılır. SWES ortamının bileşimi Tablo 2'de verilmiştir. - Üstel kültür fazındaki farklı deneyler için, kuyu başına 1 mL kullanarak, 24 kuyucuklu bir plakada 5 x 103 hücre / mL hücre yoğunluğu ile aşılamalar yapın.
NOT: Neubauer odası24 ile hücre sayımı yapın ve gerektiğinde kültürü SWES ile seyreltin.
| SWES orta bileşim | |
| Parça | Konsantrasyon |
| KNO3 | 1,98 mM |
| K2HPO4 | 115 μM |
| MgSOSO4 | 81 μM |
| ZnSO4, 7H2O | 17 nM |
| MnSO4, 7H2O | 45 Nm |
| H3 BO3, 4H2O | 3,1 mM |
| Co(NO3)2 | 17 mM |
| Na 2 MoO4, 6H2O | 21 nM |
| CuSO4, 2H2O | 0,1 nM |
| FeSO4, 5H2O | 13 μM |
| EDTA, 7H2O | 11 μM |
| Vit B12 | 5 μg |
| Toprak özü | 30 mL |
| Filtrelenmiş nehir suyu | 455 mL |
Tablo 2: SWES orta bileşim.
2. Aşırı alg habitat koşullarının çoğaltılması: yeşil ve kırmızı tek renkli ışık efekti
- 24 delikli bir plakanın her bir kuyusunu aşılamak için yukarıda belirtilen hücre yoğunluğunda (adım 1.2) hazırlanan stok kültüründen 1 mL hücre kültürü ekleyin.
- Tek renkli ışık etkisini yeniden üretmek için hücre kültürünü 2 hafta boyunca kapalı tutun.
- Yeşil ışığın 470 ila 570 nm arasında 506 nm dalga boyunda bir tepe noktasıyla geçmesine izin veren yeşil filtreyi kullanın (üreticinin spesifikasyonlarına göre; Malzeme Tablosuna bakınız) ve kültür25'e maruz bırakın.
- 590 ila 720 nm arasında kırmızı ışığa izin veren ve 678 nm'de zirveye ulaşan kırmızı filtreyi kullanın (üreticinin spesifikasyonlarına göre; Malzeme Tablosuna bakınız) kültür25'e maruz bırakmak için.
NOT: Düşük beyaz ışık yoğunluğu (LL: 80 μM/m2/s; bkz. Malzeme Tablosu) koşulu, elde edilen etkileri karşılaştırmak için ışık yoğunluğu kontrolü olarak kullanılır. Kullanılan ışık yoğunluğu birimleri saniyede mikromol ve metrekare (μmol m-2 s-1) veya fotosentetik foton akısı yoğunluğudur (PPFD).
3. Otofloresan görüntüleme
NOT: Görüntüleme yazılımının kurulumu (bkz. Malzeme Tablosu) Şekil 2'de gösterilmiştir.
- Lazer de dahil olmak üzere ters çevrilmiş konfokal lazer tarama mikroskobunun (CLSM; bkz.
- SWES büyüme ortamındaki 24 delikli plakanın her bir deney kuyucuğundaki hücreleri, görüntüleme için 35 mm'lik bir cam alt kaba (bkz.
- 63x/1.30 NA gliserol daldırma hedefini seçin ve gliserolü lensin üzerine yerleştirin (bkz.
- Kuyu plakasını mikroskop aşamasına yerleştirin ve numunenin görüntü yakalama sırasında hareket etmediğinden emin olun.
- Numuneyi ışık yolunda ortalayın ve en yüksek floresan yoğunluğuna sahip düzlemi seçerek hücrenin merkezine odaklanın.
- Görüntü alma yazılımını açın ve edinme modu26'daki açılır listeden xyλ'yu seçin.
- Lazerin uyarma çizgisini 561 nm DPSS, 8 bit dinamik aralık ve 1024 x 1024 piksel olarak seçin.
NOT: Konfokal mikroskopta 561 nm DPSS lazer veya beyaz ışık lazeri (WLL) bulunduğundan emin olun. - Floresan emisyon spektrumlarını 10 nm bant genişliğinde ve 4 nm lambda adım boyutunu 570-760 nm aralığında toplayın.
- İğne deliğini 1 Airy ünitesine ayarlayın ve lambda tarama alımını çalıştırın.
- İstatistiksel analiz için kabul edilebilir miktarda veri toplamak için bu işlemi farklı görüş alanlarında mümkün olduğunca çok kez tekrarlayın (genellikle %10'dan düşük bir standart sapma22).
- Son adımı farklı koşullar altında (kırmızı ve yeşil ışıklar altında) tekrarlayın ve verileri kaydedin.
NOT: İstatistiksel analizi karşılaştırmak ve yürütmek için farklı numuneler ve koşullar için aynı toplama ayarlarını kullanın.

Şekil 2: Yazılım kurulumu. Lambda tarama parametrelerini ayarlamak için görüntüleme yazılımı kullanıcı arayüzü. (A) Soldan sağa, protokoldeki adım 3.6'ya karşılık gelen açılır listeden xyλ alma modunu seçmek ve protokoldeki adım 3.3'e karşılık gelen sağ daldırma lens tipini seçmek için. Adım 3.9'da ışık yolundan herhangi bir filtreyi çıkardığınızdan emin olun. (B) Lambda tarama parametrelerini ayarlama paneli, protokoldeki adım 3.8'e karşılık gelir. (C) Adım 3.10'da lambda taramasını çalıştırın. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
4. Chroothece'nin fizyolojisini değerlendirmek için parametreler
- Lambda taraması alındıktan sonra, toplanan floresan emisyon spektrumlarını değerlendirmek için yazılımın üst kısmındaki nicelik penceresine tıklayın ( Şekil 3'te gösterildiği gibi). Proje aç penceresine gidin ve bir xyλ dosyası seçin (Şekil 3).
- Görüntüleme yazılımında Yığın profili analizi'ni seçin.
- Ortalama floresan yoğunluğunu (MFI) analiz etmek için bir hücrenin merkezinde 4μm2'lik bir ilgi bölgesi (ROI) tanımlayın. Verileri CSV biçiminde dışa aktarın.
NOT: Siyah piksellerin varlığından kaçınmak (seçilen piksellerin pozitif değerler içerdiğinden emin olmak için) ve her zaman aynı boyutta bir YG'yi korumak önemlidir. - İstatistiksel analiz yapmak için yeterli veri üretmek için bu işlemi farklı koşullar altında farklı hücrelerle tekrarlayın.
- Ölçülen tüm yatırım getirilerinin fikobiliproteinlerinden ve klorofillerinden farklı floresan emisyon zirvelerini seçmek için CSV dosyalarını açın.
- csv dosyasında sırasıyla fikoeritrin-fikosiyanobilin (PE-PCB; 620 nm), C-fikosiyanin (CPC; 648 nm), allofikoksiyanin (APC; 660 nm) ve klorofil a (Chl a; 680 nm) floresan verilerini seçin.
- Her fikobiliprotein ve klorofil zirvesinden elde edilen tüm maksimum floresan değerlerini içeren yeni bir tablo oluşturun ve verileri bir grafiğe çizin.
- İstatistiksel analiz yapın.
- Elde edilen verilerin normallik ve homoscedastisite27'yi karşılayıp karşılamadığını analiz edin.
- İlk koşul doğruysa t-testi analizine27,28 devam edin. Değilse, bir Mann-Whitney U testi29 çalıştırın.
- P değerlerinde önemli olan farklılıkları göz önünde bulundurun <0.05.
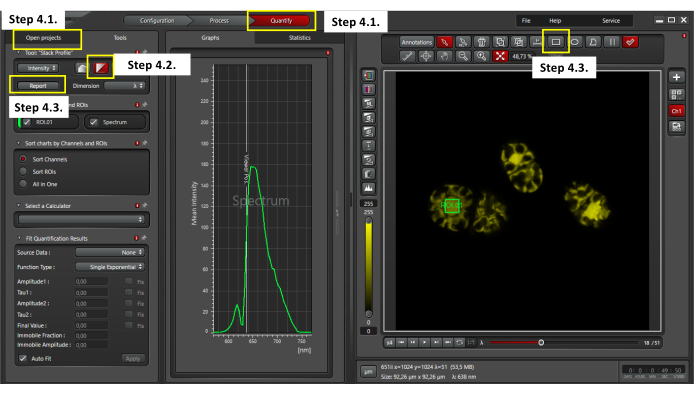
Şekil 3: Chroothece'nin otofloresansının değerlendirilmesi. Otofloresan analizini gerçekleştirmek için, açık projeler penceresinde nicelik penceresini ve bir xyλ dosyasını seçtiğinizden emin olun (adım 4.1); yığın profili görselleştirmesini seçin (adım 4.2); Bir hücrenin ortasında 4 μm2 yatırım getirisi seçin ve lambda tarama verilerini CSV biçiminde dışa aktarmak için rapor düğmesine tıklayın (adım 4.3). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Klorofil a genellikle görünür ışığın mavi ve kırmızı dalga boylarını emerken, fikobiliproteinler yeşil, sarı ve turuncu dalga boylarını kullanır7. Bu pigmentlerin otofloresansı, deneysel ve saha koşulları altında fikobiliproteinleri ve klorofil davranışını incelemek için ilk yaklaşımı mümkün kılar.
Elde edilen veriler karşılaştırılarak ve farklı grafikler üzerinde çizilerek, ortalama floresan yoğunluğundaki (MFI) önemli deği?...
Tartışmalar
Chroothece gibi bazı tek hücreli veya kolonyal kırmızı algler in vitro olarak yavaş büyür, ancak pigment emisyon zirvelerindeki farklılıkların tespit edilebildiği konfokal mikroskop altında spektral analiz ile analiz edilebilen çoklu otofloresan bileşikler içerir. Spektral konfokal floresan mikroskopisi, fotosentetik organizmaların adaptasyonunu veya iklimlendirilmesini değerlendirmek için in vivo çalışmalar yapmamızı sağlamıştır 8,10,17,18,19,20.
Açıklamalar
Yazarların beyan edecekleri herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu araştırma, İspanya Ekonomi ve Rekabet Edebilirlik Bakanlığı ve Murcia Bölgesi Séneca Vakfı tarafından finanse edilen TIN2015-68454-R ve 20961/PI/18 Projelerinin bir parçası olarak gerçekleştirilmiştir. Murcia Üniversitesi Bilimsel ve Araştırma Alanı İstatistiksel Destek Bölümü'nden Irene Hernández Martínez ve Francisco Javier Ibáñez López (Sección de Apoyo Estadístico (SAE), Área Científica y de Investigación (ACTI), Universidad de Murcia, (Şekil 1 , Servier Medical Art'tan resimler kullanılarak çizilmiştir. Servier Medical Art by Servier, Creative Commons Atıf 3.0 Taşınmamış Lisansı (https://creativecommons.org/licenses/by/3.0/) ile lisanslanmıştır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| µ-Dish 35 mm, high Glass Bottom | Ibidi | 81158 | - |
| 24 black well plate | Ibidi | 82406 | flat and clear bottom for high throughput microscopy |
| Algae Incubator | Panasonic | MLR-352-PE | |
| Confocal laser scanning microscope | Leica Microsystems | SP8 TCS | - |
| Flask | Fisher Scientific | 15380591 | Can be purchased in a local convenience store or online stores. |
| green filter | PNTA, LEE filters | - | Can be purchased in a local convenience store or online stores. |
| HC PL APO 63X/1.30 GLYC CORR CS2 | Leica Microsystems | 506353 | Glycerol immersion lens |
| Image acquisition software. LAS X | Leica Microsystems | SP8 TCS | - |
| Light source | Panasonic | FL40SSENW/37MLR-352-PE | |
| Quantum photoradiometer | DeltaOhm | DO 9721 | - |
| R software | R Core Team, 2020 | 4.0.2. | - |
| red filter | PNTA, LEE filters | - | Can be purchased in a local convenience store or online stores. |
| SWES medium | University of Murcia | - | - |
| Type G Immersion liquid | Leica Microsystems | 11513910 | Glycerol |
Referanslar
- Vis, M. L., Necchi, O. . Freshwater Red Algae: Phylogeny, Taxonomy and Biogeography. , (2021).
- Aboal, M., et al. Diversity of Chroothece (Rhodophyta, Stylonematales) including two new species. European Journal of Phycology. 53 (2), 189-197 (2018).
- Millach, L., Obiol, A., Solé, A., Esteve, I. A novel method to analyse in vivo the physiological state and cell viability of phototrophic microorganisms by confocal laser scanning microscopy using a dual laser. Journal of Microscopy. 268 (1), 53-65 (2017).
- Millach, L., Villagrasa, E., Solé, A., Esteve, I. Combined confocal laser scanning microscopy techniques for a rapid assessment of the effect and cell viability of Scenedesmus sp. DE2009 under metal stress. Microscopy and Microanalysis. 25 (4), 998-1003 (2019).
- Poryvkina, L., Babichenko, S., Leeben, A. Analysis of phytoplankton pigments by excitation spectra of fluorescence. Proceedings of EARSeL-SIG-Workshop LIDAR. , (2000).
- Beutler, M., et al. A fluorometric method for the differentiation of algal populations in vivo and in situ. Photosynthesis Research. 72 (1), 39-53 (2002).
- Grigoryeva, N., Chistyakova, L. Fluorescence microscopic spectroscopy for investigation and monitoring of biological diversity and physiological state of cyanobacterial cultures. Cyanobacteria. , (2018).
- Grigoryeva, N. . Fluorescence Methods for Investigation of Living Cells and Microorganisms. , (2020).
- Roshchina, V. V. Vital autofluorescence: application to the study of plant living cells. International Journal of Spectroscopy. 2012, 5-18 (2012).
- Roldán, M., Thomas, F., Castel, S., Quesada, A., Hernández-Mariné, M. Noninvasive pigment identification in single cells from living phototrophic biofilms by confocal imaging spectrofluorometry. Applied and Environmental Microbiology. 70 (6), 3745-3750 (2004).
- Hense, B. A., Gais, P., Jütting, U., Scherb, H., Rodenacker, K. Use of fluorescence information for automated phytoplankton investigation by image analysis. Journal of Plankton Research. 30 (5), 587-606 (2008).
- Millie, D. F., Schofield, O. M., Kirkpatrick, G. J., Johnsen, G., Evens, T. J. Using absorbance and fluorescence spectra to discriminate microalgae. European Journal of Phycology. 37 (3), 313-322 (2002).
- Richardson, T. L., et al. Spectral fluorometric characterization of phytoplankton community composition using the Algae Online Analyser. Water Research. 44 (8), 2461-2472 (2010).
- Kieleck, C., Bousquet, B., Le Brun, G., Cariou, J., Lotrian, J. Laser induced fluorescence imaging: application to groups of macroalgae identification. Journal of Physics D: Applied Physics. 34 (16), 2561-2571 (2001).
- Coronado-Parra, T., Roldán, M., Aboal, M. Confocal microscopy in ecophysiological studies of algae: a door to understanding autofluorescence in red algae. Microscopy and Microanalysis. 28 (1), 218-226 (2022).
- Mulec, J., Kosi, G. Lampenflora algae and methods of growth control. Journal of Cave and Karst Studies. 71 (2), 109-115 (2009).
- Nelissen, B., De Baere, R., Wilmotte, A., De Wachter, R. Phylogenetic relationships of nonaxenic filamentous cyanobacterial strains based on 16S rRNA sequence analysis. Journal of Molecular Evolution. 42 (2), 194-200 (1996).
- Roldán, M., Oliva, F., Gónzalez Del Valle, M. A., Saiz-Jimenez, C., Hernández-Mariné, M. Does green light influence the fluorescence properties and structure of phototrophic biofilms. Applied and Environmental Microbiology. 72 (4), 3026-3031 (2006).
- Topinka, J. A., Bellows, W. K., Yentsch, C. S. Characterization of marine macroalgae by fluorescence signatures. International Journal of Remote Sensing. 11 (12), 2329-2335 (1990).
- Roldán, M., Ascaso, C., Wierzchos, J. Fluorescent fingerprints of endolithic phototrophic cyanobacteria living within halite rocks in the atacama desert. Applied and Environmental Microbiology. 80 (10), 2998-3006 (2014).
- Solé, A., Diestra, E., Esteve, I. Confocal laser scanning microscopy image analysis for cyanobacterial biomass determined at microscale level in different microbial mats. Microbial Ecology. 57 (4), 649-656 (2009).
- Ramírez, O., García, A., Rojas, R., Couve, A., Härtel, S. Confined displacement algorithm determines true and random colocalization in fluorescence microscopy. Journal of Microscopy. 239 (3), 173-183 (2010).
- Universität Gottingen-Georg-August. SAG Culture Collection of Algae. Universität Gottingen-Georg-August. , (2022).
- Zhang, M., et al. Improvement of cell counting method for Neubauer counting chamber. Journal of Clinical Laboratory Analysis. 34 (1), 23024 (2020).
- Wolf, E., Schüßler, A. Phycobiliprotein fluorescence of Nostoc punctiforme changes during the life cycle and chromatic adaptation: Characterization by spectral confocal laser scanning microscopy and spectral unmixing. Plant, Cell and Environment. 28 (4), 480-491 (2005).
- Zucker, R. M., Rigby, P., Clements, I., Salmon, W., Chua, M. Reliability of confocal microscopy spectral imaging systems: Use of multispectral beads. Cytometry Part A. 71 (3), 174-189 (2007).
- Field, A. M. . Discovering Statistics Using R. , (2013).
- Linnet, K. Limitations of the paired t-test for evaluation of method comparison data. Clinical Chemistry. 45 (2), 314-315 (1999).
- Rosner, B., Grove, D. Use of the Mann-Whitney U-test for clustered data. Statistics in Medicine. 18 (11), 1387-1400 (1999).
- Colin, L., et al. Imaging the living plant cell: from probes to quantification. The Plant Cell. 34 (1), 247-272 (2022).
- Borlinghaus, R. The white confical: continuous spectral tuning in excitation and emission. Optical Fluorescence Microscopy. , (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır