Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Автофлуоресцентная визуализация для оценки физиологии красных водорослей
В этой статье
Резюме
Настоящий протокол описывает пошаговую автофлуоресцентную визуализацию и оценку изменений фикобилипротеина у красных водорослей на основе спектрального анализа. Это безымянный и неразрушающий метод оценки клеточной адаптации к экстремальным местам обитания, когда доступен только дефицитный материал, а клетки растут медленно или вообще не растут в лабораторных условиях.
Аннотация
Красные водоросли (Rhodophyta) содержат фикобилипротеины и колонизируют места обитания с тусклым светом, однако некоторые (например, некоторые виды Chroothece ) также могут развиваться при полном солнечном свете. Большинство родофитов красные, однако некоторые из них могут казаться голубоватыми, в зависимости от пропорции синих и красных билипротеинов (фикоцианина и фикоэритрина). Различные фикобилипротеины могут улавливать свет на разных длинах волн и передавать его хлорофиллу а, что делает возможным фотосинтез при самых разных условиях освещения. Эти пигменты реагируют на изменения среды обитания в свете, и их автофлуоресценция может помочь в изучении биологических процессов. Используя Chroothece mobilis в качестве модельного организма и режим спектрального лямбда-сканирования в конфокальном микроскопе, адаптация фотосинтетических пигментов к различным монохроматическим источникам света была изучена на клеточном уровне, чтобы угадать оптимальные условия роста вида. Результаты показали, что даже когда исследуемый штамм был изолирован из пещеры, он адаптировался как к тусклому, так и к среднему освещению. Представленный метод особенно полезен для изучения фотосинтезирующих организмов, которые не растут или растут очень медленно в лабораторных условиях, что обычно имеет место для тех, кто живет в экстремальных средах обитания.
Введение
Красные водоросли, такие как род Chroothece, могут расти в экстремальных местах обитания, где им часто приходится справляться с заметными изменениями окружающей среды1. Наводнения и засухи часты в полузасушливых регионах, где можно найти этот род, а некоторые виды были зарегистрированы в ручьях, скалах, пещерах или даже в термальных водах2. Однако в большинстве случаев биологические переменные, такие как конкуренция или выпас скота, низводят виды до неоптимальных условий для их роста. Поскольку эти организмы часто трудно культивировать и они либо не растут, либо растут очень медленно в лабораторных условиях, одним из основных ограничений является доступный размер выборки. Поэтому очень важно следовать неразрушающим методам или методам, которые предполагают минимальные манипуляции с образцом 3,4.
Физиологические навыки, необходимые для выживания в этих суровых условиях, можно контролировать, следя за изменениями в их фотосинтетических системах. Метаболические механизмы, эффективность фотосинтеза и чувствительность к свету или условиям культуры могут быть выявлены с помощью профилей излучения флуоресценции пигментов из-за точных изменений в их передаче энергии или улавливании 5,6,7,8.
Аутофлуоресценция клеточных соединений может быть использована в качестве маркера для цитодиагностики или в качестве естественного индикатора клеточного состояния или метаболизма в ответ на внешние и внутренние сигналы посредством изменений излучения9. Он также может быть использован для различения таксономически различных групп фотосинтезирующих организмов10. В зависимости от филогенетического положения фототрофных микроорганизмов можно обнаружить различные особенности флуоресценции in vivo. Таким образом, таксономическая идентификация, основанная на характеристиках фототрофной флуоресценции in vivo (включая спектры поглощения флуоресценции и излучения), была предпринята несколько раз11,12. Из-за разнообразия вспомогательных пигментов среди таксонов фитопланктона различия в длинах волн, на которых стимулируется флуоресценция хлорофилла a (Chl a), или различия в спектрах излучения могут быть использованы для выводатаксономии 13. Спектры возбуждения и излучения флуоресценции in vivo этих образцов зависят не только от типа водорослей, но и от адаптации фотосистемы14. Эффективность передачи энергии к Chl a, или отношение Chl a к вспомогательным пигментам, и содержание клеточного пигмента чувствительны к условиям роста5.
Красные водоросли, особенно Chroothece, имеют несколько дополнительных флуоресцентных пигментов - фикобилипротеинов и каротиноидов; Первые концентрируются в фикобилисомах, прикрепленных к тилакоидам хлоропластов. Фикобилипротеины (фикоцианин, фикоэритрин и аллофикоцианин) могут улавливать свет на разных длинах волн и передавать его Chl a, что делает возможным фотосинтез в самых разных условиях света и культуры15. Например, виды Chroothece могут расти внутри пещер или почти появляться в слегка соленых известковых ручьях2.
Монохроматические огни влияют на рост и пигментный состав фотосинтезирующих организмов и были изучены для предотвращения или контроля роста фотосинтезирующих организмов в пещерах. Mulec et al. показали, что освещение, обогащенное красным цветом, способствует росту цианобактерий, водорослей и растений16. В предыдущих исследованиях также сообщалось, что зеленый свет влияет на пигментный состав цианобактерий17, в то время как другие показали, что зеленый свет предотвращает рост большинства фотосинтезирующих организмов, а некоторые цианобактерии демонстрируют снижение тилакоидов и более слабую среднюю интенсивность флуоресценции18.
Чтобы понять способность Chroothece как модельного организма преодолевать суровые условия, культивируемые клетки подвергались воздействию увеличения интенсивности света и монохроматического света (зеленого или красного)15, чтобы увидеть, как он справляется с тусклыми условиями пещер (где преобладает красный свет). Протокол, представленный в настоящем описании, воспроизводит влияние вышеупомянутых переменных на фикобилипротеины Chroothece на клеточном уровне с использованием собственной автофлуоресценции.
В настоящее время флуоресценция широко используется в качестве инструмента для изучения физиологических реакций сосудистых растений, микроводорослей, макроводорослей и цианобактерий13,14,16. Спектральная конфокальная флуоресцентная микроскопия является превосходным инструментом для исследований in vivo для оценки физиологии фотосинтезирующих образцов на уровне отдельных клеток 10,17,18,19,20, избегая проблем, связанных с низкой скоростью роста в лаборатории и трудностями с получением достаточного количества биомассы для соответствующей экстракции и биохимических методов8 . После обработки клеток в различных условиях культивирования в течение 2 недель профиль лямбда-сканирования можно измерить in vivo. Хотя существует несколько публикаций, в которых использовались различные длины волн возбуждения с помощью конфокальной визуализации 3,4,10,17, большинство фикобилипротеинов и Chl a могут быть обнаружены с использованием линии возбуждения с длиной волны 561 нм, а обнаруженное излучение колеблется от 570 до 760 нм. Эти критерии были основаны на анализе, ранее проведенном 10 с коммерческими чистыми пигментами (таблица 1) с помощью конфокальной визуализации, и полученных результатах на различных видах водорослей20,21,22.
| Пигменты | λflmax (нм) | λ exc (нм) | |||||||
| 351 | 364 | 458 | 476 | 488 | 514 | 543 | 633 | ||
| Chl a | 660.9-678.1 | 43,4 ± 1,8 | 11.2 ± 0.2 | 1.8 ± 0.05 | 2.0 ± 0.08 | 12.2 ± 0.7 | 6.0 ± 0.3 | 4.2 ± 0.16 | 80,7 ± 1,5 |
| Р-ПЭ | 569.2-583.3 | 5.9 ± 0.6 | 5.9 ± 0.16 | 11.1 ± 0.04 | 42.2 ± 0.3 | 100.0 ± 0 | 90,0 ± 0,3 | 99.2 ± 0.08 | - |
| 652.1-668.6 | - | - | 1.5 ± 0.01 | 3.7 ± 0.04 | 26.7 ± 0.5 | 8.7 ± 0.16 | 11.1 ± 0.16 | 11.3 ± 0.2 | |
| С-ПК | 636.2-676.4 | 2.3 ± 0.04 | 1.0 ± 0.01 | 0,6 ± 0,004 | 0,7 ± 0,008 | 2.0 ± 0.08 | 2.0 ± 0.04 | 3.3 ± 0.16 | 33.6 ± 0.9 |
| БТР-XL | 667.3-683.8 | 15.1 ± 1.5 | 9.6 ± 0.98 | 1.0 ± 0.04 | 1.2 ± 0.08 | 5.9 ± 0.7 | 4.1 ± 0.5 | 23.2 ± 3.5 | 91,4 ± 2,3 |
Таблица 1: Информация о чистом пигменте, используемая для выполнения анализа лямбда-сканирования. В этой таблице показаны пики излучения и максимумы плеч / полос флуоресценции различных флуорохромов/пигментов с помощью спектрофотометрии конфокальной визуализации для всех длин волн возбуждения, а также процент светового излучения пигментов/флуорохромов. Значения рассчитывались по формуле: = MFI*100/255. Каждое значение является средним значением ± SE (среднее ± стандартной ошибки от среднего). Чистые пигменты были использованы для калибровки конфокального сканирующего лазерного микроскопа следующим образом: 1,2,10. Хлорофилл а был получен из Spinacia oleracea, R-фикоэритрин (R-PE) из Porphyra tenera и C-фикоцианин (C-PE) из Spirulina sp. Все виды растворяли в фильтрованной дистиллированной воде. Аллофикоцианин-XL (APC-XL) был получен из Mastigocladus laminosus, который растворяли в сульфате аммония (60%) и фосфате калия (pH = 7) для достижения концентрации 38 мМ. Сканирование проводили с 400 мкл каждого пигментного раствора (концентрация 1 мг / мл) с использованием 8-лунной стеклянной нижней камеры.
Изучение одной длины волны возбуждения является весьма полезным первым приближением. В этом случае, однако, необходимо выяснить относительный вклад различных комплексов в сигнал флуоресценции, что рекомендуется для выполнения коэффициента флуоресценции или спектрального анализа на нескольких длинах волн, среди других методов.
протокол
Для настоящего исследования был использован вид водорослей Chroothece mobilis . Вид был получен из коллекции культур Microalgae Edaphic SE Spain, MAESE 20.29. Обзор протокола показан на рисунке 1.
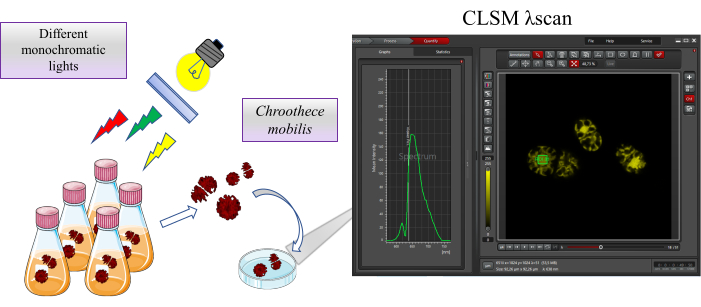
Рисунок 1: Обзор исследования. Chroothece mobilis инкубируется в экстремальных условиях обитания, таких как различные монохроматические огни, в течение 2 недель. Влияние на физиологию Chroothece оценивается путем автофлуоресценции белков, содержащихся в фикобилисомах и фотосистемах, с помощью конфокального лазерного сканирующего микроскопа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
1. Пробоподготовка
- Приготовьте инокулят Chroothece mobilis из агаровой культуры коллекции, перенеся его в жидкую среду SWES (табл. 2).
ПРИМЕЧАНИЕ: SWES "Seewasser + Erddekokt + Salze" = среда морской воды23. - Выдерживают все культуры в течение 2 недель с фотопериодом светлый/темный 16:8 при 20 °C в условиях низкой интенсивности белого света (LL: 80 мкМ/м2/с) и без встряхивания до тех пор, пока не будет получена желаемая плотность клеток (см. этап 1.3).
ПРИМЕЧАНИЕ: Условия освещения для роста составляют 80 мкМ / м2 / с интенсивность света (активное фотосинтетическое излучение, PAR). Эти условия используются в качестве условий низкой освещенности (контроль). Состав среды SWES приведен в таблице 2. - Проводите посевы для различных экспериментов в экспоненциальной фазе культивирования с плотностью клеток 5 x 103 клеток/мл в 24-луночном планшете, используя 1 мл на лунку.
ПРИМЕЧАНИЕ: Проведите подсчет клеток с помощью камерыНойбауэра 24 и при необходимости разбавьте культуру SWES.
| Средний состав SWES | |
| Компонент | Концентрация |
| КНО3 | 1,98 мМ |
| К2ГПО4 | 115 мкМ |
| МгСО4 | 81 мкМ |
| ZnSO4, 7H2O | 17 нМ |
| MnSO4, 7H2O | 45 Нм |
| H 3BO3, 4H2O | 3,1 мМ |
| Co(NO3)2 | 17 мМ |
| Na 2 MoO4, 6H2O | 21 нМ |
| CuSO4, 2H2O | 0,1 нМ |
| FeSO4, 5H2O | 13 мкМ |
| ЭДТА, 7Ч2О | 11 мкМ |
| Вит Б12 | 5 мкг |
| Экстракт почвы | 30 мл |
| Фильтрованная речная вода | 455 мл |
Таблица 2: Состав среды SWES.
2. Воспроизведение экстремальных условий обитания водорослей: зеленый и красный монохроматический световой эффект
- Добавьте 1 мл клеточной культуры из исходной культуры, приготовленной при вышеупомянутой плотности клеток (этап 1.2), чтобы инокулировать каждую лунку 24-луночной пластины.
- Держите клеточную культуру закрытой в течение 2 недель, чтобы воспроизвести монохроматический световой эффект.
- Используйте зеленый фильтр, который пропускает зеленый свет в диапазоне от 470 до 570 нм с пиком на длине волны 506 нм (в соответствии со спецификациями производителя; см. Таблицу материалов), и подвергните его воздействию культуры25.
- Используйте красный фильтр, который пропускает красный свет в диапазоне от 590 до 720 нм и пики при 678 нм (в соответствии со спецификациями производителя; см. Таблицу материалов), чтобы подвергнуть его воздействию культуры25.
ПРИМЕЧАНИЕ: Условие низкой интенсивности белого света (LL: 80 мкМ/м2/с; см. Таблицу материалов) используется в качестве регулятора интенсивности света для сравнения полученных эффектов. Используемыми единицами интенсивности света являются микромоль в секунду и квадратный метр (мкмоль, м-2 , с-1) или плотность потока фотосинтетических фотонов (PPFD).
3. Автофлуоресцентная визуализация
ПРИМЕЧАНИЕ: Настройка программного обеспечения для обработки изображений (см. Таблицу материалов) показана на рисунке 2.
- Включите все компоненты инвертированного конфокального лазерного сканирующего микроскопа (CLSM; см. Таблицу материалов), включая лазер.
- Смонтируйте ячейки из каждой экспериментальной лунки 24-луночной пластины в питательной среде SWES в стеклянную нижнюю чашку диаметром 35 мм (см. Таблицу материалов) для визуализации.
- Выберите иммерсионный объектив с глицерином 63x/1.30 NA и поместите глицерин поверх объектива (см. Таблицу материалов).
- Поместите луночную пластину на столик микроскопа и убедитесь, что образец не перемещается во время получения изображения.
- Отцентрируйте образец по световому пути и сфокусируйтесь на центре клетки, выбрав плоскость с наибольшей интенсивностью флуоресценции.
- Откройте программное обеспечение для получения изображений и выберите xyλ из выпадающего списка в режиме съемки26.
- Выберите линию возбуждения лазера на 561 нм DPSS, 8 бит динамического диапазона и 1024 x 1024 пикселей.
ПРИМЕЧАНИЕ: Убедитесь, что конфокальный микроскоп оснащен DPSS-лазером с длиной волны 561 нм или лазером белого света (WLL). - Соберите спектры флуоресцентного излучения в полосе пропускания 10 нм и размер шага лямбда 4 нм в диапазоне 570-760 нм.
- Установите точечное отверстие на 1 единицу Эйри и запустите сбор лямбда-сканирования.
- Повторите этот процесс как можно больше раз в разных полях зрения, чтобы собрать приемлемый объем данных для статистического анализа (обычно стандартное отклонение ниже 10%22).
- Повторите последний шаг в разных условиях (при красном и зеленом свете) и сохраните данные.
ПРИМЕЧАНИЕ: Используйте одни и те же настройки сбора данных для разных образцов и условий для сравнения и проведения статистического анализа.

Рисунок 2: Настройка программного обеспечения. Пользовательский интерфейс программного обеспечения для обработки изображений для настройки параметров лямбда-сканирования. (A) Слева направо, чтобы выбрать режим сбора данных xyλ из выпадающего списка, который соответствует шагу 3.6 в протоколе, и выбрать правый тип погружной линзы, соответствующий шагу 3.3 в протоколе. Убедитесь, что все фильтры удалены из светового тракта на шаге 3.9. (B) Панель настройки параметров лямбда-сканирования соответствует шагу 3.8 протокола. (C) Запустите лямбда-сканирование на шаге 3.10. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4. Параметры для оценки физиологии Chroothece
- После получения лямбда-сканирования щелкните окно количественной оценки в верхней части программного обеспечения (как показано на рисунке 3), чтобы оценить собранные спектры флуоресцентного излучения. Перейдите в окно Open project и выберите один файл xyλ (рисунок 3).
- Выберите Анализ профиля стека в программном обеспечении для обработки изображений.
- Определите область интереса (ROI) 4мкм2 в центре ячейки, чтобы проанализировать среднюю интенсивность флуоресценции (MFI). Экспортируйте данные в формате CSV.
ПРИМЕЧАНИЕ: Важно избегать присутствия черных пикселей (чтобы выбранные пиксели содержали положительные значения) и всегда поддерживать рентабельность инвестиций одинакового размера. - Повторите этот процесс с разными ячейками в разных условиях, чтобы получить достаточно данных для выполнения статистического анализа.
- Откройте файлы CSV, чтобы выбрать различные пики излучения флуоресценции из фикобилипротеинов и хлорофиллов всех измеренных ROI.
- Выберите данные флуоресценции фикоэритрина-фикоцианобилина (PE-PCB; 620 нм), C-фикоцианина (CPC; 648 нм), аллофикоцианина (APC; 660 нм) и хлорофилла a (Chl a; 680 нм) соответственно в файле csv.
- Создайте новую таблицу со всеми максимальными значениями флуоресценции, полученными от каждого пика фикобилипротеина и хлорофилла, и нанесите данные на график.
- Проведите статистический анализ.
- Проанализируйте, соответствуют ли полученные данные нормальности и гомоскедастичности27.
- Переходим к анализу t-критерия27,28, если выполняется первое условие. Если нет, запустите тест Mann-Whitney U29.
- Рассмотрим различия, значимые при значениях p <0,05.
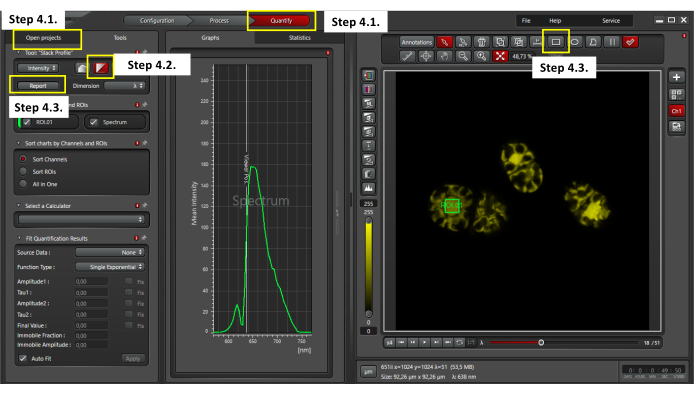
Рисунок 3: Оценка автофлуоресценции Chroothece. Чтобы выполнить автофлуоресцентный анализ, убедитесь, что в окне открытых проектов выбрано окно количественного определения и один файл xyλ (этап 4.1); выберите визуализацию профиля стека (шаг 4.2); выберите ROI 4мкм2 в центре ячейки и нажмите кнопку отчета, чтобы экспортировать данные лямбда-сканирования в формате CSV (шаг 4.3). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты
Хлорофилл a обычно поглощает синие и красные длины волн видимого света, тогда как фикобилипротеины используют зеленые, желтые и оранжевые длины волн7. Автофлуоресценция этих пигментов делает возможным первый подход к изучению фикобилипротеинов и поведения хлорофилла в эк...
Обсуждение
Некоторые одноклеточные или колониальные красные водоросли, такие как Chroothece, медленно растут in vitro, но содержат несколько автофлуоресцентных соединений, которые могут быть проанализированы с помощью спектрального анализа под конфокальным микроскопом, где могут быть обнаруж...
Раскрытие информации
У авторов нет конфликтов интересов, о которых можно было бы заявить.
Благодарности
Это исследование было проведено в рамках проектов TIN2015-68454-R и 20961/PI/18, финансируемых Министерством экономики и конкурентоспособности Испании и Фондом Сенека региона Мурсия. Ирен Эрнандес Мартинес и Франсиско Хавьер Ибаньес Лопес из Секции статистической поддержки научно-исследовательской области Университета Мурсии (Sección de Apoyo Estadístico (SAE), Área Científica y de Investigación (ACTI), Universidad de Murcia, (рис. 1 ) были нарисованы с использованием рисунков из Servier Medical Art. Servier Medical Art by Servier лицензируется лицензией Creative Commons Attribution 3.0 Unported License (https://creativecommons.org/licenses/by/3.0/)
Материалы
| Name | Company | Catalog Number | Comments |
| µ-Dish 35 mm, high Glass Bottom | Ibidi | 81158 | - |
| 24 black well plate | Ibidi | 82406 | flat and clear bottom for high throughput microscopy |
| Algae Incubator | Panasonic | MLR-352-PE | |
| Confocal laser scanning microscope | Leica Microsystems | SP8 TCS | - |
| Flask | Fisher Scientific | 15380591 | Can be purchased in a local convenience store or online stores. |
| green filter | PNTA, LEE filters | - | Can be purchased in a local convenience store or online stores. |
| HC PL APO 63X/1.30 GLYC CORR CS2 | Leica Microsystems | 506353 | Glycerol immersion lens |
| Image acquisition software. LAS X | Leica Microsystems | SP8 TCS | - |
| Light source | Panasonic | FL40SSENW/37MLR-352-PE | |
| Quantum photoradiometer | DeltaOhm | DO 9721 | - |
| R software | R Core Team, 2020 | 4.0.2. | - |
| red filter | PNTA, LEE filters | - | Can be purchased in a local convenience store or online stores. |
| SWES medium | University of Murcia | - | - |
| Type G Immersion liquid | Leica Microsystems | 11513910 | Glycerol |
Ссылки
- Vis, M. L., Necchi, O. . Freshwater Red Algae: Phylogeny, Taxonomy and Biogeography. , (2021).
- Aboal, M., et al. Diversity of Chroothece (Rhodophyta, Stylonematales) including two new species. European Journal of Phycology. 53 (2), 189-197 (2018).
- Millach, L., Obiol, A., Solé, A., Esteve, I. A novel method to analyse in vivo the physiological state and cell viability of phototrophic microorganisms by confocal laser scanning microscopy using a dual laser. Journal of Microscopy. 268 (1), 53-65 (2017).
- Millach, L., Villagrasa, E., Solé, A., Esteve, I. Combined confocal laser scanning microscopy techniques for a rapid assessment of the effect and cell viability of Scenedesmus sp. DE2009 under metal stress. Microscopy and Microanalysis. 25 (4), 998-1003 (2019).
- Poryvkina, L., Babichenko, S., Leeben, A. Analysis of phytoplankton pigments by excitation spectra of fluorescence. Proceedings of EARSeL-SIG-Workshop LIDAR. , (2000).
- Beutler, M., et al. A fluorometric method for the differentiation of algal populations in vivo and in situ. Photosynthesis Research. 72 (1), 39-53 (2002).
- Grigoryeva, N., Chistyakova, L. Fluorescence microscopic spectroscopy for investigation and monitoring of biological diversity and physiological state of cyanobacterial cultures. Cyanobacteria. , (2018).
- Grigoryeva, N. . Fluorescence Methods for Investigation of Living Cells and Microorganisms. , (2020).
- Roshchina, V. V. Vital autofluorescence: application to the study of plant living cells. International Journal of Spectroscopy. 2012, 5-18 (2012).
- Roldán, M., Thomas, F., Castel, S., Quesada, A., Hernández-Mariné, M. Noninvasive pigment identification in single cells from living phototrophic biofilms by confocal imaging spectrofluorometry. Applied and Environmental Microbiology. 70 (6), 3745-3750 (2004).
- Hense, B. A., Gais, P., Jütting, U., Scherb, H., Rodenacker, K. Use of fluorescence information for automated phytoplankton investigation by image analysis. Journal of Plankton Research. 30 (5), 587-606 (2008).
- Millie, D. F., Schofield, O. M., Kirkpatrick, G. J., Johnsen, G., Evens, T. J. Using absorbance and fluorescence spectra to discriminate microalgae. European Journal of Phycology. 37 (3), 313-322 (2002).
- Richardson, T. L., et al. Spectral fluorometric characterization of phytoplankton community composition using the Algae Online Analyser. Water Research. 44 (8), 2461-2472 (2010).
- Kieleck, C., Bousquet, B., Le Brun, G., Cariou, J., Lotrian, J. Laser induced fluorescence imaging: application to groups of macroalgae identification. Journal of Physics D: Applied Physics. 34 (16), 2561-2571 (2001).
- Coronado-Parra, T., Roldán, M., Aboal, M. Confocal microscopy in ecophysiological studies of algae: a door to understanding autofluorescence in red algae. Microscopy and Microanalysis. 28 (1), 218-226 (2022).
- Mulec, J., Kosi, G. Lampenflora algae and methods of growth control. Journal of Cave and Karst Studies. 71 (2), 109-115 (2009).
- Nelissen, B., De Baere, R., Wilmotte, A., De Wachter, R. Phylogenetic relationships of nonaxenic filamentous cyanobacterial strains based on 16S rRNA sequence analysis. Journal of Molecular Evolution. 42 (2), 194-200 (1996).
- Roldán, M., Oliva, F., Gónzalez Del Valle, M. A., Saiz-Jimenez, C., Hernández-Mariné, M. Does green light influence the fluorescence properties and structure of phototrophic biofilms. Applied and Environmental Microbiology. 72 (4), 3026-3031 (2006).
- Topinka, J. A., Bellows, W. K., Yentsch, C. S. Characterization of marine macroalgae by fluorescence signatures. International Journal of Remote Sensing. 11 (12), 2329-2335 (1990).
- Roldán, M., Ascaso, C., Wierzchos, J. Fluorescent fingerprints of endolithic phototrophic cyanobacteria living within halite rocks in the atacama desert. Applied and Environmental Microbiology. 80 (10), 2998-3006 (2014).
- Solé, A., Diestra, E., Esteve, I. Confocal laser scanning microscopy image analysis for cyanobacterial biomass determined at microscale level in different microbial mats. Microbial Ecology. 57 (4), 649-656 (2009).
- Ramírez, O., García, A., Rojas, R., Couve, A., Härtel, S. Confined displacement algorithm determines true and random colocalization in fluorescence microscopy. Journal of Microscopy. 239 (3), 173-183 (2010).
- Universität Gottingen-Georg-August. SAG Culture Collection of Algae. Universität Gottingen-Georg-August. , (2022).
- Zhang, M., et al. Improvement of cell counting method for Neubauer counting chamber. Journal of Clinical Laboratory Analysis. 34 (1), 23024 (2020).
- Wolf, E., Schüßler, A. Phycobiliprotein fluorescence of Nostoc punctiforme changes during the life cycle and chromatic adaptation: Characterization by spectral confocal laser scanning microscopy and spectral unmixing. Plant, Cell and Environment. 28 (4), 480-491 (2005).
- Zucker, R. M., Rigby, P., Clements, I., Salmon, W., Chua, M. Reliability of confocal microscopy spectral imaging systems: Use of multispectral beads. Cytometry Part A. 71 (3), 174-189 (2007).
- Field, A. M. . Discovering Statistics Using R. , (2013).
- Linnet, K. Limitations of the paired t-test for evaluation of method comparison data. Clinical Chemistry. 45 (2), 314-315 (1999).
- Rosner, B., Grove, D. Use of the Mann-Whitney U-test for clustered data. Statistics in Medicine. 18 (11), 1387-1400 (1999).
- Colin, L., et al. Imaging the living plant cell: from probes to quantification. The Plant Cell. 34 (1), 247-272 (2022).
- Borlinghaus, R. The white confical: continuous spectral tuning in excitation and emission. Optical Fluorescence Microscopy. , (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены