このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
出芽酵母における一倍体の交配効率の決定
要約
この研究では、酵母 サッカロマイセス・セレビシエ の交配効率を定量化するための堅牢な方法が説明されています。この方法は、スペシエーション研究における前接合体障壁の定量化に特に有用です。
要約
サッカロミセス・セレビシエは、遺伝学、進化学、分子生物学において広く使用されているモデル生物です。近年では、種分化に関連する問題を研究するための人気のあるモデル生物にもなっています。酵母のライフサイクルには、無性生殖段階と有性生殖段階の両方が含まれます。進化実験の容易さと生物の短い世代時間は、生殖障壁の進化の研究を可能にします。2つの嵌合タイプ(aとα)が嵌合してa/α二倍体を形成する効率は、嵌合効率と呼ばれます。一倍体間の交配効率の低下は、前接合体障壁を示しています。したがって、2つの一倍体間の生殖隔離の程度を定量化するには、交配効率を定量化する堅牢な方法が必要です。この目的のために、シンプルで再現性の高いプロトコルがここに提示されます。このプロトコルには、YPDプレート上のハプロイドのパッチ適用、等数のハプロイドの混合、単一コロニーの希釈とプレーティング、そして最後にドロップアウトプレート上のコロニー数に基づく効率の計算を含む4つの主要なステップが含まれます。栄養要求性マーカーは、一倍体と二倍体を明確に区別するために使用されます。
概要
一般に出芽酵母と呼ばれるサッカロミセスセレビシエは、単細胞真核生物です。交配タイプはaとαの2種類で、無性生殖周期と有性生殖周期の両方を示します。aおよびα交配タイプは一倍体であり、酵母の無性サイクルを表す周囲の環境に他の交配タイプがない場合、有糸分裂的に分裂する可能性があります。2つの交配タイプが近接している場合、それらは有糸分裂を停止し、融合して二倍体細胞を形成します。二倍体酵母は、栄養素が存在するときに有糸分裂するか、酢酸1などの非発酵性の貧弱な炭素源の存在下で窒素飢餓の条件下で減数分裂を起こすことができます。これにより胞子が形成され、良好な成長条件が得られるまで休眠状態が残ります。これらの胞子が発芽し、2つの一倍体タイプが一倍体プールに放出されると、ライフサイクルが完了します2,3(図1)。
酵母細胞の交配には、凝集、交配突起または「shmoo」の形成、それに続く細胞および核融合などのいくつかのステップが含まれます4,5。2 つの嵌合タイプ a と α は、それぞれ a 因子と α 因子を生成し、嵌合を開始します。これらの因子は、反対の交配型5の細胞表面に存在する受容体(Ste2およびSte3)に結合するポリペプチドフェロモンである。フェロモンの受容体への結合は、フェロモン応答経路、マイトジェン活性化プロテインキナーゼ(MAPK)シグナル伝達経路を開始する6、7、8。これは、G1期における細胞周期の停止をもたらし、代謝的に活性な固定期9をもたらす。その後、細胞は有糸分裂を停止し、交配に必要なタンパク質が合成されます。一倍体細胞は互いに向かって移動できないため、交尾投影または「shmoo」が交尾相手に向けられます。細胞が接触すると、細胞壁が分解され、細胞質内容物が融合して交配して二倍体細胞10,11を形成する。一倍体間の交配効率は、実験室で進化した株、および現存種間の種分化の尺度として使用されてきました12。
単純な真核生物であるため、酵母は複雑な真核生物に関連する多数の研究課題に最適なモデルです。そのような質問の1つは、種分化と生殖障壁の進化に関連しています13,14。有性生殖生物の場合、種はエルンストマイヤー15によって提案された生物種の概念(BSC)によって定義されます。この概念によれば、集団の2つの個体は、交配できず、生殖的に分離されている場合、2つの異なる種に属すると言われます。性的生殖周期の崩壊(配偶子の融合による接合子の形成、接合子の子孫への発達、および子孫の性的成熟の達成を含む)は、生殖隔離につながります。図1に示すように、S. cerevisiaeの生活環は有性生殖周期に匹敵します:a)2つの交配タイプaとαの融合は、有性生殖生物における配偶子の融合に似ています。b)二倍体が有糸分裂を受ける能力は、接合子が子孫に発達することと同等である。c)胞子形成を受けている二倍体は、配偶子形成のプロセスに匹敵します14。
前接合子の分離は、品揃え交配が観察されたときに起こります。遺伝的に異なる2つの a タイプと交配する平等な機会が与えられると、 α タイプは優先的に一方と他方よりも、またはその逆に交配します14。一倍体が異なる環境で進化した進化実験の場合、嵌合アッセイを行うことで、嵌合前の障壁の存在を判定することができる。祖先と比較した場合の交配効率の低下は、交配前の障壁の進化を示しています。接合後の分離は、二倍体が効果的な有糸分裂および/または胞子形成を受けて一倍体胞子を形成することができないために発生する可能性があります14。これらは、二倍体の増殖速度を測定し、胞子形成効率をそれぞれ計算することによって定量することができる。したがって、生殖障壁の進化を研究するためには、(a)交配効率、(b)二倍体の有糸分裂成長、および(c)二倍体の胞子形成効率を定量化するための堅牢な方法が必要です。本研究では、酵母株の交配効率を定量化する堅牢な方法が報告されています。
実験室での実験では、交配の発生を検出できる方法の1つは、栄養要件を補完する栄養要求性マーカーを使用することです。2つの交配タイプが2つの異なるアミノ酸に対して栄養要求性である場合、2つの交配タイプの融合によって形成された二倍体細胞のみが、両方のアミノ酸が不足している培地上で増殖することができる。したがって、栄養要求性マーカーは、定性的および定量的に交配を検出するのに有用である。減数分裂後の株の交配タイプを特定するには、定性的試験で十分です16。定量的試験は、交配経路に関与する遺伝子を研究しながら交配の減少を特定することに関心がある場合に不可欠です17,18。さらに、酵母が種分化研究でますます使用されるようになるにつれて、交配効率の定量化は前接合体バリアの尺度であるため、便利で再現性のある交配アッセイが必要です。
2つの酵母交配タイプ間の交配効率は、以前に定量化されています16、19、20。以前に使用された方法のほとんどは、いくつかのバリエーション16、21、22、23、24、25で設計が似ています。それらのいくつかは初期の対数期培養を使用し、他のいくつかは一倍体株の中期対数期の培養を使用します。2つの交配タイプが混在する比率にはばらつきがあります。ほとんどすべてのプロトコルはニトロセルロースメンブレンを使用しています。以前に成長させた培養物から採取した両方の交配タイプの懸濁液を混合し、YPDプレート上に置いたニトロセルロース膜上で濾過する。プロトコルの変形例の1つでは、一倍体懸濁液は、YPDプレート21に直接パッチが当てられる。2つの交配タイプのフェロモン産生に関与する遺伝子を扱う実験では、2つの交配タイプの懸濁液を作りながらフェロモンを外部から添加します24。
一倍体を混合した後、数時間(典型的には約5時間)インキュベーションした後、細胞を膜から洗い流し、希釈し、選択培地に播種する。1973年に報告された以前の方法の1つでは、接合子形成または交配の効率は、血球計算盤26を使用して顕微鏡下で出芽細胞、未出芽細胞、および交配ペアの数をカウントすることによって計算された。しかし、後に報告されたほとんどの方法は、一倍体と二倍体を区別するために栄養要求性マーカーを使用しています。交配効率は、細胞プール16、21、23における二倍体および一倍体細胞の数に対する二倍体細胞の割合として計算される。
しかし、種分化を研究するためのモデル生物として酵母を用いた多くの報告があるにもかかわらず、交配の効率を計算するための標準化されたプロトコルはこれまで文献で報告されていない。対数相の細胞は、交配効率の定量化には理想的ではない可能性があります。交配中、2倍体の細胞周期は停止するため、交尾中の細胞は分裂していません9。細胞周期が固定相27の細胞において同様に停止されることも知られているので、そのような細胞を使用することは、プロトコルをより再現性のあるものにすることができる。固定相細胞を混合し、交配のためにYPDプレート(すなわち、栄養的に豊富な環境)上に配置することができる。従来の手順では、ニトロセルロース膜と細胞の洗浄も必要であり、プロセスが煩雑で取り扱いエラーが発生しやすくなります。さらに、これまでに使用されたプロトコルは、1倍体の観点から交配効率を定量化します。ただし、生殖隔離を測定する場合、交配効率は、単一の一倍体ではなく、一倍体の特定の組み合わせについて定量化されます。
これらの課題を解決するため、本稿では、酵母の交配効率を再現性が高く、使いやすい堅牢な定量法について報告する。さらに、この方法とここで採用されている酵母株は、交配障壁の進化に対する遺伝子流動の影響を調べる研究にも使用できます。
この研究では、S. cerevisiaeの2つの異なる株が使用されました。株の1つはSK1バックグラウンドに由来します。これは、MAT遺伝子座の近くに栄養要求性マーカーを追加することによって私たちの研究室で修正されました。得られたハプロイドの遺伝子型を表128、29、30に提供する。SK1株では、一倍体はMAT遺伝子座の近くにTRP1遺伝子が挿入され、α半数体はMAT遺伝子座の近くにLEU2遺伝子が挿入されていました。ScAM株では、TRP1遺伝子とURA3遺伝子がそれぞれaとαの一倍体に挿入されていました。挿入位置は第III染色体のARS領域(Chr III:197378..197609)であった。ここで報告されたプロトコルでは、ゲノム上の任意の場所に栄養要求性マーカーで十分です。しかし、MAT遺伝子座の近くに栄養要求性マーカーを有するということは、これらの株が種分化に対する遺伝子流動の影響を調べる研究にも使用できることを意味する31,32。マーカーは、組換えによるマーカーの再シャッフルを防ぐために、MAT遺伝子座の近くに追加されました。したがって、このプロトコルは、種分化を含む研究における交配効率を定量化するために、また交配経路に関与するタンパク質を研究する際の交配効率の変化を特定するために使用することができます。
プロトコル
注:プロトコルには、(1)YPDプレート上の嵌合効率グリッドのハプロイドにパッチを当てる、(2)24時間のインキュベーション後に一倍体を等数で混合し、混合ハプロイドを数時間交配させる(この研究では7時間)、(3)混合細胞をYPDにプレーティングして、30°Cで7時間後に単一コロニーを単離する、 そして最後に、(4)栄養要求性マーカーを用いて形成される二倍体の数を決定する。これらの手順については、以下で詳しく説明します ( 図 2 も参照)。
1. 嵌合効率グリッドにおける一倍体のパッチング
- YPD寒天プレート(2%寒天、2%デキストロース、1%ペプトン、0.5%酵母エキス)でストリーキングすることにより、冷凍庫ストックからハプロイド a およびα を復活させ、30°Cで48時間増殖させて単離された単一コロニーを得ます。
- YPDプレートの単一コロニーを5 mLのYPD培地(2%デキストロース、1%ペプトン、0.5%酵母エキス)に接種し、250 rpmで振とうしながら30°Cで48時間インキュベートします。細胞はこの潜伏期間の後、成長の定常期にある。
- 新しいYPDプレートに嵌合効率グリッドを描きます。 図 2A に示すように、グリッドを 1 cm x 1.5 cm の長方形として 3 つのボックスに分割し、それぞれの寸法が 1 cm x 0.5 cm になるように描画します。
- 左端と右端の長方形に2つの交配タイプのYPD培養液を5 μLパッチします(図2B)。この体積は、各セクションに配置された約5 x 105 倍体細胞に相当します。プレートを30°Cで24時間インキュベートします。
注:グリッドの目的は、実験測定を正確にすることです(実験の細胞数など)。グリッドサイズは、実験的に扱いやすいほど小さいですが、(グリッドからセルを持ち上げるなど)簡単に操作でき、ドリフトや偶然のイベントの影響を受けにくいほど大きくなっています。
2.一倍体の混合と交配
注:24時間後(図2C)、2つの一倍体タイプの同数のセルが2つのグリッドから削り取られ、混合され、中央の長方形に配置されます(図2D)。
- 同数の細胞を混合するには、滅菌爪楊枝を使用して外箱に置かれたパッチの約1/3を取り除き、各一倍体について滅菌1.5 mLバイアルに20 μLの水に再懸濁します。
- この懸濁液5μLを2mLの水で希釈する。この希釈懸濁液のODを分光光度計を用いて600nmで測定する。その特定の株のOD値と1 ODの細胞数/ mLに基づいて、2つの株から同数の細胞を混合します。混合に必要な容量を計算し、個々の一倍体懸濁液の残りの15 μLから吸引します。
注:中央の長方形にパッチを当てるセルの数は、セルが単層を形成するようなものです。酵母細胞を半径2.58μm33の球体と考えると、1cm x 0.5cmの長方形の箱は、単層を形成するために約1.7 x 106細胞を必要とするであろう。交配のためにパッチされた細胞と2つの一倍体細胞グリッドの間に物理的な接触がないように注意する必要があります。同数の各タイプの一倍体細胞を混合する必要があるため、各株から8.5 x 105細胞が追加されます。細胞数は、OD測定に基づいて計算され、600nmにおける1ODが1×10の7細胞34とほぼ同等であることを考慮する。例えば、一倍体懸濁液のOD600が0.17であり、α半数体懸濁液のOD600が0.11である場合、各一倍体懸濁液の5μL中の細胞数を計算できる。各一倍体タイプの8.5 x 105細胞を確保するために、1.25 μLの一倍体と1.93 μLのα半数体懸濁液を混合します。 - 必要量の両方の一倍体を新鮮で滅菌済みの1.5 mLバイアルに入れ、ピペットを使用してよく混合します。この懸濁液の最終容量は一般に約6〜8μLです。 中央のグリッドでこのサスペンションにパッチを当てます。プレートを30°Cで7時間インキュベートし、一倍体が交尾するのに十分な時間待ちます(図2E)。
3. YPD寒天培地への混合細胞のめっき
- 7時間のインキュベーション期間の後、つまようじまたはピペットチップを使用して中央の長方形から細胞をこすり落とし、2 mLの滅菌水で希釈します。その後、細胞懸濁液をYPD寒天上に広げ、シングルコロニーを得た。単一コロニーを得るために必要な希釈係数を決定するには、掻き取り細胞が添加される最初のチューブのODを測定します。特定の希釈係数は、使用する細胞タイプ/株ごとに決定する必要があります。
注:たとえば、0.15のOD600は、2 mL懸濁液中の3 x 106細胞に相当します(1 OD = 1 x 107細胞/ mLを考慮)。YPDプレート上に数百のコロニーを得るために、細胞懸濁液を1:20で2回段階希釈し、次いで100μLの最終希釈液を拡散に使用する。 - プレーティング後、YPDプレートを30°Cで36〜48時間、単一のコロニーができるまでインキュベートします。データで統計的有意性を検出できることを確認するために、スクリーニングのために各交配実験から数百の個々のコロニーが得られることを確認してください(図2F)。
4. 栄養要求性マーカーを用いた二倍体のスクリーニング
- 得られたコロニーのどの割合が二倍体であるかを決定する。プレート上の二倍体コロニーを特定するには、 図2Gに示すように、株が栄養要求性であるアミノ酸を欠くダブルドロップアウトプレート(2%グルコース、0.66%窒素塩基、0.05%ダブルドロップアウトアミノ酸混合物、および2%寒天)に個別にストリーキングして単一コロニーを移します。プレートを30°Cで48時間インキュベートします。
注:コロニーは、レプリカメッキを使用してダブルドロップアウトプレートに転送することもできます。本研究では、SK1AM株の交配効率を定量する際にトリプトファンとロイシン(trp− leu−)ドロップアウト培地を使用し、ScAM株にはトリプトファンとウラシル(trp− ura−)ドロップアウト培地を使用しました。二倍体コロニーのみが、SK1AM株の TRP1 および LEU2 遺伝子とScAM株の TRP1 および URA3 遺伝子の両方の栄養要求性マーカーを有するため、二重ドロップアウトプレート上で増殖する。 - さらに、単一のドロップアウト培地(trp-またはleu-またはura-)でコロニーをストリークまたはレプリカプレートして、集団内の2種類の一倍体のそれぞれの頻度を定量化します。
- 嵌合効率η次のように計算します。
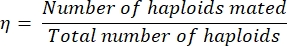 式 (1)
式 (1)
ここで、交配された一倍体の数は、二重ドロップアウトプレートで識別された二倍体の数の2倍に単純に等しい(各二倍体は2つの一倍体の交配から生じたため)。一倍体の総数は、縞模様の倍数体数の合計に縞模様の二倍体数の2倍を加えたものに等しくなります。
注:たとえば、ダブルドロップアウト培地で100個のコロニーをストリーキング/レプリカメッキした後、60個のコロニーのみが成長した場合、交配効率は75%として定量化できます(60 x 2の半数体が交配して60の二倍体を形成し、40の半数体が交尾しなかったため)。
結果
2種類の嵌合効率の定量化
ここで説明したプロトコルを使用して、2つの酵母株間(SK1AM aとSK1AMαの間、およびScAMaとScAMαの間の交配効率を定量化しました(図3A)。これらの実験では、2つの一倍体間の交配を少なくとも12回繰り返した。実験の繰り返しのそれぞれにおいて、少なくとも100個のコロニーが二重ド...
ディスカッション
S. cerevisiaeの交配効率の定量化は、交配経路に関与する遺伝子に関する研究や、交配行動に対する外部環境の影響を研究するために不可欠です。過去20年間で、S. cerevisiaeは種分化に関連する質問に対処するための人気のあるモデルにもなりました14,36,37,38。2つの交配タイプの存在と、...
開示事項
著者は、この作業に競合する利益がないことを宣言します。著者らは、SK1由来の株をすべての非営利目的で共有できることを嬉しく思います。
謝辞
この研究は、DBT / Wellcome Trust(インドアライアンス)助成金(IA / S / 19/2/504632)によって資金提供されました504632。A.M.は、インド政府の科学産業研究評議会(CSIR)によって上級研究員としてサポートされています(09/087(0873)/ 2017-EMR-I)。著者は、議論してくれたPaike Jayadeva Bhatに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Adenine | Sigma Life Science | A8626 | |
| Agar Powder regular grade for bacteriology | SRL | 19661 (0140186) | |
| Ammonium Sulphate, Hi-AR | HiMedia | GRM1273 | |
| D-(+)-glucose | Sigma Life Science | G8270 | |
| Glass Petri plates | HiMedia | PW008 | 90 mm x 15 mm dimension |
| L-Arginine | Sigma Life Science | A8094 | |
| L-Aspartic acid | Sigma Life Science | A7219 | |
| L-Histidine monochloride monohydrate | Sigma Life Science | H5659 | |
| L-Isoleucine | Sigma Aldrich | I2752 | |
| L-Leucine | Sigma Life Science | L8912 | |
| L-Lysine | Aldrich | 62840 | |
| L-Methionine | Sigma Life Science | M5308 | |
| L-Phenylalanine | Sigma Life Science | P5482 | |
| L-Threonine | Sigma Aldrich | T8625 | |
| L-Tyrosine | Sigma Life Science | T8566 | |
| L-Valine | Sigma Life Science | V0513 | |
| Mating efficiency grid | 1 cm x 1.5 cm rectangular grid drawn on the Petri plate | ||
| Microcentrifuge tubes | Tarsons | 500010 | |
| Peptone | HiMedia | RM001 | |
| Uracil | Sigma Life Science | U0750 | |
| Yeast Extract Powder | HiMedia | RM027 | |
| Yeast Nitrogen Base w/o Amino acids and Ammonium Sulphate | BD Difco | 233520 |
参考文献
- Neiman, A. M. Sporulation in the budding yeast Saccharomyces cerevisiae. Genetics. 189 (3), 737-765 (2011).
- Duina, A. A., Miller, M. E., Keeney, J. B. Budding yeast for budding geneticists: A primer on the Saccharomyces cerevisiae model system. Genetics. 197 (1), 33-48 (2014).
- Herskowitz, I. Life cycle of the budding yeast Saccharomyces cerevisiae. Microbiological Reviews. 52 (4), 536-553 (1988).
- Erdman, S., Lin, L., Malczynski, M., Snyder, M. Pheromone-regulated genes required for yeast mating differentiation. Journal of Cell Biology. 140 (3), 461-483 (1998).
- Merlini, L., Dudin, O., Martin, S. G. Mate and fuse: How yeast cells do it. Open Biology. 3 (3), 130008 (2013).
- Gustin, M. C., Albertyn, J., Alexander, M., Davenport, K. MAP kinase pathways in the yeast Saccharomyces cerevisiae. Microbiology and Molecular Biology Reviews. 62 (4), 1264-1300 (1998).
- Bardwell, L. A walk-through of the yeast mating pheromone response pathway. Peptides. 26 (2), 339-350 (2005).
- Reid, B. J., Hartwell, L. H. Regulation of mating in the cell cycle of Saccharomyces cerevisiae. Journal of Cell Biology. 75, 355-365 (1977).
- Williams, T. C., Peng, B., Vickers, C. E., Nielsen, L. K. The Saccharomyces cerevisiae pheromone-response is a metabolically active stationary phase for bio-production. Metabolic Engineering Communications. 3, 142-152 (2016).
- Bagnat, M., Simons, K. Cell surface polarization during yeast mating. Proceedings of the National Academy of Sciences of the United States of America. 99 (22), 14183-14188 (2002).
- Trueheart, J., Boeke, J. D., Fink, G. R. Two genes required for cell fusion during yeast conjugation: Evidence for a pheromone-induced surface protein. Molecular and Cellular Biology. 7 (7), 2316-2328 (1987).
- Sniegowski, P. D., Dombrowski, P. G., Fingerman, E. Saccharomyces cerevisiae and Saccharomyces paradoxus coexist in a natural woodland site in North America and display different levels of reproductive isolation from European conspecifics. FEMS Yeast Research. 1 (4), 299-306 (2002).
- Replansky, T., Koufopanou, V., Greig, D., Bell, G. Saccharomyces sensu stricto as a model system for evolution and ecology. Trends in Ecology and Evolution. 23 (9), 494-501 (2008).
- Greig, D. Reproductive isolation in Saccharomyces. Heredity. 102 (1), 39-44 (2009).
- Mayr, E. . Systematics and the Origin of Species, from the Viewpoint of a Zoologist. , (1999).
- Sprague, G. F. Assay of yeast mating reaction. Methods in Enzymology. 194, 77-93 (1991).
- McCaffrey, G., Clay, F. J., Kelsay, K., Sprague, G. F. Identification and regulation of a gene required for cell fusion during mating of the yeast Saccharomyces cerevisiae. Molecular and Cellular Biology. 7 (8), 2680-2690 (1987).
- Valtz, N., Peter, M., Herskowitz, I. FAR1 is required for oriented polarization of yeast cells in response to mating pheromones. Journal of Cell Biology. 131 (4), 863-873 (1995).
- Maclean, C. J., Greig, D. Prezygotic reproductive isolation between Saccharomyces cerevisiae and Saccharomyces paradoxus. BMC Evolutionary Biology. 8, 1 (2008).
- Murphy, H. A., Kuehne, H. A., Francis, C. A., Sniegowski, P. D. Mate choice assays and mating propensity differences in natural yeast populations. Biology Letters. 2 (4), 553-556 (2006).
- Leu, J. Y., Murray, A. W. Experimental evolution of mating discrimination in budding yeast. Current Biology. 16 (3), 280-286 (2006).
- Kim, J., Hirsch, J. P. A nucleolar protein that affects mating efficiency in Saccharomyces cerevisiae by altering the morphological response to pheromone. Genetics. 149 (2), 795-805 (1998).
- Jin, M., et al. Yeast dynamically modify their environment to achieve better mating efficiency. Science Signaling. 4 (186), (2011).
- Rogers, D. W., Denton, J. A., McConnell, E., Greig, D. Experimental evolution of species recognition. Current Biology. 25 (13), 1753-1758 (2015).
- McClure, A. W., Jacobs, K. C., Zyla, T. R., Lew, D. J. Mating in wild yeast: Delayed interest in sex after spore germination. Molecular Biology of the Cell. 29 (26), 3119-3127 (2018).
- Sena, E. P., Radin, D. N., Fogel, S. Synchronous mating in yeast. Proceedings of the National Academy of Sciences of the United States of America. 70 (5), 1373-1377 (1973).
- Werner-Washburne, M., Braun, E., Johnston, G. C., Singer, R. A. Stationary phase in the yeast Saccharomyces cerevisiae. Microbiology Reviews. 57 (2), 383-401 (1993).
- Johnston, S. A., Hopper, J. E. Isolation of the yeast regulatory gene GAL4 and analysis of its dosage effects on the galactose/melibiose regulon. Proceedings of the National Academy of Sciences of the United States of America. 79 (22), 6971-6975 (1982).
- Mahilkar, A. . Study of metabolic specialization leading to speciation, using yeast as a model system. , (2021).
- Blank, T. E., Woods, M. P., Lebo, C. M., Xin, P., Hopper, J. E. Novel Gal3 proteins showing altered Gal80p binding cause constitutive transcription of Gal4p-activated genes in Saccharomyces cerevisiae. Molecular and Cellular Biology. 17 (5), 2566-2575 (1997).
- Rice, W. R., Hostert, E. E. Laboratory experiments on speciation: What have we learned in 40 years. Evolution. 47 (6), 1637-1653 (1993).
- White, N. J., Snook, R. R., Eyres, I. The past and future of experimental speciation. Trends in Ecology and Evolution. 35 (1), 10-21 (2020).
- Milo, R., Jorgensen, P., Moran, U., Weber, G., Springer, M. BioNumbers--The database of key numbers in molecular and cell biology. Nucleic Acids Research. 38, 750-753 (2010).
- Domitrovic, T., et al. Structural and functional study of YER067W, a new protein involved in yeast metabolism control and drug resistance. PLoS One. 5 (6), 11163 (2010).
- Lindegren, C. C., Spiegelman, S., Lindegren, G. Mendelian inheritance of adaptive enzymes. Proceedings of the National Academy of Sciences of the United States of America. 30 (11), 346-352 (1944).
- Dettman, J. R., Sirjusingh, C., Kohn, L. M., Anderson, J. B. Incipient speciation by divergent adaptation and antagonistic epistasis in yeast. Nature. 447 (7144), 585-588 (2007).
- Jhuang, H. Y., Lee, H. Y., Leu, J. Y. Mitochondrial-nuclear co-evolution leads to hybrid incompatibility through pentatricopeptide repeat proteins. EMBO Reports. 18 (1), 87-101 (2017).
- Lee, H. Y., et al. Incompatibility of nuclear and mitochondrial genomes causes hybrid sterility between two yeast species. Cell. 135 (6), 1065-1073 (2008).
- Pronk, J. T. Auxotrophic yeast strains in fundamental and applied research. Applied and Environmental Microbiology. 68 (5), 2095-2100 (2002).
- Madhani, H. D. . From a to α: Yeast as a Model for Cellular Differentiation. , (2007).
- Huxley, C., Green, E. D., Dunham, I. Rapid assessment of S. cerevisiae mating type by PCR. Trends in Genetics. 6 (8), 236 (1990).
- Rang, C., Galen, J. E., Kaper, J. B., Chao, L. Fitness cost of the green fluorescent protein in gastrointestinal bacteria. Canadian Journal of Microbiology. 49 (9), 531-537 (2003).
- Tusso, S., Nieuwenhuis, B. P. S., Weissensteiner, B., Immler, S., Wolf, J. B. W. Experimental evolution of adaptive divergence under varying degrees of gene flow. Nature Ecology and Evolution. 5 (3), 338-349 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved