Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Saccharomyces cerevisiae'de Haploidlerin Çiftleşme Etkinliğinin Belirlenmesi
Bu Makalede
Özet
Bu çalışmada, maya Saccharomyces cerevisiae'de çiftleşme verimliliğinin ölçülmesi için sağlam bir yöntem açıklanmaktadır. Bu yöntem, türleşme çalışmalarında zigotik öncesi bariyerlerin nicelleştirilmesi için özellikle yararlıdır.
Özet
Saccharomyces cerevisiae, genetik, evrim ve moleküler biyolojide yaygın olarak kullanılan bir model organizmadır. Son yıllarda, türleşme ile ilgili problemleri incelemek için popüler bir model organizma haline gelmiştir. Mayanın yaşam döngüsü hem aseksüel hem de cinsel üreme aşamalarını içerir. Evrim deneylerinin gerçekleştirilmesinin kolaylığı ve organizmanın kısa üretim süresi, üreme engellerinin evriminin incelenmesine izin verir. İki çiftleşme tipinin (a ve α) a / α diploidi oluşturmak için çiftleştiği verimlilik, çiftleşme verimliliği olarak adlandırılır. Haploidler arasındaki çiftleşme verimliliğindeki herhangi bir azalma, zigotik öncesi bir bariyeri gösterir. Bu nedenle, iki haploid arasındaki üreme izolasyonunun derecesini ölçmek için, çiftleşme verimliliğini ölçmek için sağlam bir yöntem gereklidir. Bu amaçla, burada basit ve son derece tekrarlanabilir bir protokol sunulmaktadır. Protokol, haploidleri bir YPD plakasına yamalamak, haploidleri eşit sayıda karıştırmak, tek koloniler için seyreltmek ve kaplamak ve son olarak, bir bırakma plakasındaki kolonilerin sayısına göre verimliliği hesaplamak gibi dört ana adımı içerir. Toksotrofik belirteçler, haploidler ve diploidler arasındaki ayrımı açıkça yapmak için kullanılır.
Giriş
Genellikle tomurcuklanan maya olarak adlandırılan Saccharomyces cerevisiae, tek hücreli bir ökaryottur. A ve α olmak üzere iki çiftleşme tipi vardır ve hem aseksüel hem de cinsel üreme döngüleri sergiler. A ve α çiftleşme tipleri haploidlerdir ve mayanın aseksüel döngüsünü temsil eden çevredeki diğer çiftleşme tipinin yokluğunda mitotik olarak bölünebilir. İki çiftleşme tipi birbirine yakın olduğunda, mitotik olarak bölünmeyi durdururlar ve bir diploid hücre oluşturmak için kaynaşırlar. Diploid maya, besinler mevcut olduğunda mitotik olarak bölünebilir veya asetat1 gibi fermente edilemeyen zayıf bir karbon kaynağının varlığında azot açlığı koşulları altında mayoza uğrayabilir. Bu, uygun büyüme koşulları olana kadar uykuda kalan sporların oluşumuyla sonuçlanır. Bu sporlar çimlendiğinde yaşam döngüsü tamamlanır ve iki haploid tip haploid havuzuna geri salınır 2,3 (Şekil 1).
Maya hücrelerinin çiftleşmesi, aglutinasyon, çiftleşme projeksiyonu veya "shmoo" oluşumu, ardından hücre ve nükleer füzyon 4,5 gibi birkaç adımı içerir. İki çiftleşme tipi a ve α, çiftleşmeyi başlatmak için sırasıyla a-faktörü ve α-faktörü üretir. Bu faktörler, karşıt çiftleşme tipi5'in hücre yüzeyinde bulunan reseptörlere (Ste2 ve Ste3) bağlanan polipeptit feromonlardır. Feromonların reseptörlere bağlanması, feromon yanıt yolunu, mitojen ile aktive edilmiş protein kinaz (MAPK) sinyal iletim yolu 6,7,8'i başlatır. Bu, G1 fazında hücre döngüsünün tutuklanmasıyla sonuçlanır ve metabolik olarak aktif bir durağan faz9'a yol açar. Hücreler daha sonra mitotik olarak bölünmeyi durdurur ve çiftleşme için gerekli proteinler sentezlenir. Haploid hücreler birbirlerine doğru hareket edemediğinden, çiftleşme projeksiyonu veya "shmoo" çiftleşme partnerine yönlendirilir. Hücreler temas ettiğinde, hücre duvarı bozulur ve sitoplazmik içerikler kaynaşır, bu da bir diploid hücre10,11 oluşturmak üzere çiftleşmeye neden olur. Haploidler arasındaki çiftleşme verimliliği, laboratuvarda evrimleşmiş suşlarda ve mevcut türler arasında türleşmenin bir ölçüsü olarak kullanılmıştır12.
Basit bir ökaryotik organizma olan maya, karmaşık ökaryotik organizmalarla ilişkili çok sayıda araştırma sorusu için tercih edilen modeldir. Böyle bir soru, türleşme ve üreme engellerinin evrimi ile ilişkilidir13,14. Cinsel olarak üreyen organizmalar için, bir tür, Ernst Mayr15 tarafından önerilen biyolojik tür kavramı (BSC) ile tanımlanır. Bu konsepte göre, bir popülasyonun iki bireyinin, iç içe geçememeleri ve üreme yoluyla izole edilmeleri durumunda iki farklı türe ait oldukları söylenir. Cinsel üreme döngüsünün bozulması (gametlerin bir zigot oluşturmak için kaynaşmasını, zigotun bir döle dönüşmesini ve dölde cinsel olgunluğun elde edilmesini içerir) üreme izolasyonuna yol açar. Şekil 1'de gösterildiği gibi, S. cerevisiae'nin yaşam döngüsü cinsel üreme döngüsü ile karşılaştırılabilir: a) iki çiftleşme tipi a ve α'nin füzyonu, cinsel olarak üreyen organizmalarda gametlerin füzyonuna benzer; b) Diploidin mitotik bölünmeye uğrama yeteneği, soyuna dönüşen zigota eşdeğerdir; ve c) sporülasyona uğrayan diploid, gametogenez14 süreci ile karşılaştırılabilir.
Zigotik öncesi izolasyon, çeşitli çiftleşme gözlendiğinde ortaya çıkar. Genetik olarak farklı iki a tipi ile çiftleşmek için eşit bir fırsat verildiğinde, α bir tip tercihen biri diğeriyle çiftleşir veya bunun tersi de geçerlidir14. Haploidlerin farklı ortamlarda evrimleştiği evrim deneyleri söz konusu olduğunda, çiftleşme öncesi bir bariyerin varlığı, bir çiftleşme testi yapılarak belirlenebilir. Ataya kıyasla çiftleşme verimliliğindeki bir azalma, çiftleşme öncesi bir bariyerin evrimini gösterir. Post-zigotik izolasyon, diploidin haploid sporları oluşturmak için etkili mitotik bölünme ve / veya sporülasyona maruz kalmaması nedeniyle ortaya çıkabilir14. Bunlar, sırasıyla diploidlerin büyüme hızını ölçerek ve sporülasyon verimliliğini hesaplayarak ölçülebilir. Bu nedenle, üreme engellerinin evrimini incelemek için, (a) çiftleşme verimliliğini, (b) diploidin mitotik büyümesini ve (c) diploidin sporülasyon verimliliğini ölçmek için sağlam yöntemler gereklidir. Bu çalışmada, maya suşlarının çiftleşme verimliliğini ölçmek için sağlam bir yöntem bildirilmiştir.
Laboratuvar deneylerinde, çiftleşme oluşumunun tespit edilebilmesinin yollarından biri, beslenme gereksinimlerini tamamlayan oksitrofik belirteçlerin kullanılmasıdır. İki çiftleşme tipi iki farklı amino asit için oksirofik olduğunda, sadece iki çiftleşme tipinin füzyonu ile oluşan diploid hücre, her iki amino asitte de eksik olan bir ortamda büyüyebilir. Bu nedenle, öksotrofik belirteçler çiftleşmeyi hem kalitatif hem de kantitatif olarak tespit etmek için yararlıdır. Kalitatif bir test, mayoz16'dan sonra bir suşun çiftleşme tipini tanımlamak için yeterli olacaktır. Kantitatif testler, çiftleşme yolunda yer alan genleri incelerken çiftleşmedeki bir azalmayı tanımlamakla ilgilendiğinde önemlidir17,18. Ek olarak, mayanın türleşme çalışmalarında giderek daha fazla kullanılmasıyla, çiftleşme verimliliğinin nicelleştirilmesi zigotik öncesi bariyerin bir ölçüsü olduğundan, uygun ve tekrarlanabilir bir çiftleşme testi gereklidir.
İki maya çiftleşme türü arasındaki çiftleşme verimliliği daha önce 16,19,20 olarak ölçülmüştür. Daha önce kullanılan yöntemlerin çoğu, tasarımlarında birkaç varyasyonla benzerdir 16,21,22,23,24,25. Bazıları erken log faz kültürlerini kullanırken, diğerleri haploid suşların orta log faz kültürlerini kullanır. İki çiftleşme tipinin karıştırıldığı oranlarda farklılıklar vardır. Hemen hemen tüm protokoller nitroselüloz membran kullanır. Daha önce yetiştirilen kültürlerden alınan her iki çiftleşme tipinin süspansiyonları karıştırılır ve bir YPD plakası üzerine yerleştirilmiş bir nitroselüloz membran üzerine süzülür. Protokolün varyasyonlarından birinde, haploid süspansiyon doğrudan bir YPD plaka21 üzerine yamalanır. İki çiftleşme tipinin feromon üretiminde yer alan genlerle ilgili deneylerde, iki çiftleşme tipininsüspansiyonları 24 yapılırken feromonlar harici olarak eklenir.
Haploidleri karıştırdıktan sonra birkaç saat (tipik olarak yaklaşık 5 saat) inkübasyondan sonra, hücreler membrandan yıkanır, seyreltilir ve seçici ortam üzerine kaplanır. 1973'te bildirilen daha önceki yöntemlerden birinde, zigot oluşumunun veya çiftleşmenin etkinliği, hemositometre26 kullanılarak mikroskop altında tomurcuklanmış hücrelerin, tomurcuklanmamış hücrelerin ve çiftleşme çiftlerinin sayısını sayarak hesaplandı. Bununla birlikte, daha sonra bildirilen yöntemlerin çoğu, haploidleri ve diploidleri ayırt etmek için öksotrofik belirteçler kullanır. Çiftleşme verimliliği, hücresel havuzdaki diploid ve haploid hücrelerin sayısına göre diploid hücrelerin yüzdesiolarak hesaplanır: 16,21,23.
Bununla birlikte, türleşmeyi incelemek için mayayı model organizma olarak kullanan bir dizi rapora rağmen, çiftleşmenin verimliliğini hesaplamak için literatürde şimdiye kadar bildirilen standart bir protokol yoktur. Günlük fazındaki hücreler, çiftleşme verimliliğinin nicelleştirilmesi için ideal olmayabilir. Çiftleşme sırasında, iki haploidin hücre döngüsü tutuklanır ve bu nedenle çiftleşme sırasındaki hücreler9'a bölünmez. Hücre döngüsünün de durağan faz27'deki hücrelerde benzer şekilde tutuklandığı bilindiğinden, bu tür hücrelerin kullanılması protokolü daha tekrarlanabilir hale getirebilir. Sabit faz hücreleri, çiftleşme için YPD plakalarına (yani besleyici açıdan zengin bir ortama) karıştırılabilir ve yerleştirilebilir. Geleneksel prosedürler ayrıca bir nitroselüloz membran ve hücrelerin yıkanmasını gerektirir, bu da süreci hantal ve işleme hatalarına maruz bırakır. Ek olarak, bugüne kadar kullanılan protokoller, çiftleşme verimliliğini bir haploid cinsinden ölçer. Bununla birlikte, üreme izolasyonunu ölçerken, çiftleşme verimliliği, tek bir haploid yerine belirli bir haploid kombinasyonu için ölçülür.
Bu sorunları ele almak için, burada, mayada çiftleşme verimliliğinin ölçülmesi için yüksek oranda tekrarlanabilir ve kullanımı kolay sağlam bir yöntem sunuyoruz. Ayrıca, bu yöntem ve burada kullanılan maya suşları, gen akışının çiftleşme bariyerlerinin evrimi üzerindeki etkisini inceleyen çalışmalarda da kullanılabilir.
Bu çalışmada iki farklı S. cerevisiae suşu kullanılmıştır. Suşlardan biri SK1 arka planından türetilmiştir; bu, laboratuvarımızda MAT lokusunun yakınında oksotrofik belirteçler eklenerek modifiye edildi. Haploidlerin ortaya çıkan genotipleri Tablo 128,29,30'da verilmiştir. SK1 suşunda, bir haploid, TRP1 genini MAT lokusunun yanına yerleştirdi ve α haploid, MAT lokusunun yakınına LEU2 genine yerleştirildi. ScAM suşunda, TRP1 ve URA3 genleri sırasıyla a ve α haploidlere yerleştirildi. Yerleştirme yeri kromozom III'ün ARS bölgesindeydi (Chr III: 197378..197609). Burada bildirilen protokol için, genomun herhangi bir yerindeki öksotrofik belirteçler yeterli olacaktır. Bununla birlikte, MAT lokusunun yakınında öksotrofik belirteçlere sahip olmak, bu suşların gen akışının türleşme üzerindeki etkisini inceleyen çalışmalar için de kullanılabileceği anlamına gelir31,32. İşaretçiler, rekombinasyon nedeniyle belirteçlerin yeniden karıştırılmasını önlemek için MAT lokusuna yakın bir yere eklenmiştir. Bu nedenle, bu protokol, türleşmeyi içeren çalışmalarda çiftleşme verimliliğini ölçmek ve ayrıca çiftleşme yolunda yer alan proteinleri incelerken çiftleşme verimliliğinin değişimini tanımlamak için kullanılabilir.
Access restricted. Please log in or start a trial to view this content.
Protokol
NOT: Protokol genel olarak aşağıdaki adımları içerir: (1) çiftleşme verimliliği ızgaralarındaki haploidlerin bir YPD plakası üzerinde yamalanması, (2) 24 saatlik inkübasyondan sonra haploidlerin eşit sayıda karıştırılması ve karışık haploidlerin çiftleşmesi için birkaç saat verilmesi (bu çalışmada 7 saat), (3) 30 ° C'de 7 saat sonra tek kolonileri izole etmek için karışık hücrelerin YPD üzerine kaplanması, ve son olarak, (4) öxotrofik belirteçler kullanılarak oluşturulan diploidlerin sayısını belirlemek. Bu adımlar aşağıda ayrıntılı olarak ele alınmıştır (ayrıca bkz. Şekil 2).
1. Çiftleşme verimliliği ızgaralarında haploidlerin yamalanması
- Bir YPD agar plakasına (% 2 agar,% 2 dekstroz,% 1 pepton,% 0.5 maya ekstresi) çizgi çizerek haploidleri dondurucu stoklarından a ve α canlandırın ve izole edilmiş tek koloniler elde etmek için 30 ° C'de 48 saat boyunca büyümelerini sağlayın.
- YPD plakasından tek kolonileri 5 mL YPD ortamında (% 2 dekstroz,% 1 pepton,% 0.5 maya ekstraktı) aşılayın ve 250 rpm sallama ile 48 saat boyunca 30 ° C'de inkübe edin. Hücreler bu inkübasyon döneminden sonra büyümenin durağan fazındadır.
- Yeni bir YPD plakasına çiftleşme verimliliği ızgarası çizin. Izgarayı, Şekil 2A'da gösterildiği gibi, her biri 1 cm x 0,5 cm boyutlarında olacak şekilde üç kutuya bölünmüş 1 cm x 1,5 cm'lik bir dikdörtgen olarak çizin.
- En soldaki ve en sağdaki dikdörtgenlerdeki iki çiftleşme tipinin YPD kültürünün 5 μL yaması (Şekil 2B). Bu hacim, her bölümde ortaya konan kabaca 5 x 105 haploid hücreye karşılık gelir. Plakaları 30 ° C'de 24 saat boyunca inkübe edin.
NOT: Izgaranın amacı, deneysel ölçümleri (deneydeki hücre sayısı gibi) hassas hale getirmektir. Izgara boyutu, deneysel olarak izlenebilecek kadar küçüktür, ancak kolayca manipüle edilebilecek kadar büyüktür (bir ızgaradan hücreleri kaldırmak gibi) ve sürüklenme veya şans olaylarına duyarlı değildir.
2. Haploidlerin karıştırılması ve çiftleşmesi
NOT: 24 saat sonra (Şekil 2C), iki haploid tipte eşit sayıda hücre iki ızgaradan kazınır, karıştırılır ve orta dikdörtgene yerleştirilir (Şekil 2D).
- Eşit sayıda hücreyi karıştırmak için, steril bir kürdan kullanarak dış kutulara yerleştirilen yamanın yaklaşık 1 / 3'ünü çıkarın ve haploidlerin her biri için steril bir 1.5 mL şişede 20 μL suda tekrar askıya alın.
- Bu süspansiyonun 5 μL'sini 2 mL su içinde seyreltin. Bu seyreltilmiş süspansiyonun OD'sini 600 nm'de bir spektrofotometre kullanarak ölçün. Belirli bir suş için OD değerine ve 1 OD'deki hücre sayısına/mL'ye bağlı olarak, iki suştan eşit sayıda hücreyi karıştırın. Karıştırılması gereken hacmi hesaplayın ve bireysel haploid süspansiyonun kalan 15 μL'sinden aspire edin.
NOT: Orta dikdörtgene yamalanan hücre sayısı, hücrelerin tek katman oluşturacağı şekildedir. Maya hücresinin 2.58 μm33 yarıçaplı bir küre olduğu düşünüldüğünde, 1 cm x 0.5 cm'lik dikdörtgen bir kutunun tek katmanlı bir tabaka oluşturmak için yaklaşık 1.7 x 106 hücreye ihtiyacı olacaktır. Çiftleşme için yamalanan hücreler ile iki haploid hücre ızgarası arasında fiziksel bir temas olmadığından emin olmak için özen gösterilmelidir. Her haploid hücre tipinin eşit sayıda karıştırılması gerektiğinden, her suştan 8.5 x 105 hücre eklenir. Hücre sayısı, 600 nm'de 1 OD'nin yaklaşık 1 x 107 hücreye eşdeğer olduğu düşünülerek OD ölçümlerine göre hesaplanır34. Örneğin, bir haploid süspansiyonun OD 600'ü 0.17 ve α haploidin OD600'ü 0.11 ise, her haploid süspansiyonun 5 μL'sindeki hücre sayısı hesaplanabilir. Her haploid tipte 8.5 x 105 hücre sağlamak için, a haploidinin 1.25 μL'si ve α haploid süspansiyonlarının 1.93 μL'si karıştırılır. - Her iki haploidin gerekli hacimlerini taze ve steril 1,5 mL'lik bir şişeye ekleyin ve bir pipet kullanarak iyice karıştırın. Bu süspansiyonun son hacmi genellikle 6-8 μL civarındadır. Plakayı 7 saat boyunca 30 ° C'de inkübe edin, böylece haploidlerin çiftleşmesi için yeterli zaman tanıyın (Şekil 2E).
3. YPD agar üzerine karışık hücrelerin kaplanması
- 7 saatlik inkübasyon süresinden sonra, hücreleri bir kürdan veya pipet ucu kullanarak merkez dikdörtgenden kazıyın ve 2 mL steril suda seyreltin. Daha sonra, tek koloniler elde etmek için hücre süspansiyonunu YPD agar üzerine yayın. Tek koloniler elde etmek için gerekli seyreltme faktörünü belirlemek için, kazınmış hücrelerin eklendiği ilk tüpün OD'sini ölçün. Kullanılan her hücre tipi/suşu için spesifik seyreltme faktörlerinin belirlenmesi gerekir.
NOT: Örneğin, 0,15'lik bir OD600, 2 mL'lik bir süspansiyonda 3 x 106 hücreye karşılık gelir (1 OD = 1 x 107 hücre/mL dikkate alındığında). YPD plakasında birkaç yüz koloni elde etmek için, hücre süspansiyonu seri olarak iki kez 1:20'de seyreltilir ve daha sonra yayılma için son seyreltmenin 100 μL'si kullanılır. - Kaplamadan sonra, YPD plakalarını tek koloniler olana kadar 36-48 saat boyunca 30 ° C'de inkübe edin. Verilerde istatistiksel anlamlılığın tespit edilebilmesini sağlamak için tarama için her çiftleşme deneyinden birkaç yüz bireysel koloni elde edildiğinden emin olun (Şekil 2F).
4. Öksotrofik belirteçler kullanılarak diploidlerin taranması
- Elde edilen kolonilerin hangi kısmının diploid olduğunu belirleyin. Plaka üzerindeki diploid kolonileri tanımlamak için, tek kolonileri, Şekil 2G'de gösterildiği gibi, suşların öxotrofik olduğu amino asitlerden yoksun olan bir çift bırakma plakasına (% 2 glikoz,% 0.66 azot bazı,% 0.05 çift bırakma amino asit karışımı ve% 2 agar) ayrı ayrı çizerek aktarın. Plakaları 48 saat boyunca 30 ° C'de inkübe edin.
NOT: Koloniler, replika kaplama kullanılarak çift bırakma plakasına da aktarılabilir. Bu çalışmada, SK1AM suşlarının çiftleşme verimliliğini ölçerken triptofan ve lösin (trp-leu-) bırakma ortamı, ScAM suşları için triptofan ve urasil (trp-ura-) bırakma ortamı kullanılmıştır. Sadece diploid koloniler, her iki öksotrofik belirteçlere de sahip oldukları için çift bırakma plakasında büyür: SK1AM suşlarında TRP1 ve LEU2 genleri ve ScAM suşlarında TRP1 ve URA3 genleri. - Ek olarak, popülasyondaki iki haploid türünün her birinin sıklığını ölçmek için kolonileri tek bırakma ortamına (trp - veya leu - veya ura - plaka veya replika) çizgi veya replika.
- Çiftleşme verimliliğini η aşağıdaki gibi hesaplayın:
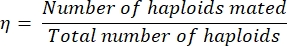 Eq (1)
Eq (1)
çiftleşen haploidlerin sayısının, çift bırakma plakasında tanımlanan diploid sayısının iki katına eşit olduğu durumlarda (çünkü her diploid iki haploidin çiftleşmesinden kaynaklanmıştır). Toplam haploid sayısı, çizgili haploid sayısının toplamına artı çizgili diploid sayısının iki katına eşittir.
NOT: Örneğin, 100 koloninin çift bırakma ortamına çizgilenmesi/replika kaplanmasından sonra sadece 60 koloni büyürse, çiftleşme verimliliği %75 olarak ölçülebilir (60 x 2 haploid, 60 diploidi oluşturmak için çiftleşti ve 40 haploid çiftleşmedi).
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
İki çiftleşme tipinin çiftleşme verimliliğinin ölçülmesi
Burada açıklanan protokol, SK1AM a ve SK1AM α arasındaki ve ScAMa ve ScAMα arasındaki iki maya suşu arasındaki çiftleşme verimliliğini ölçmek için kullanılmıştır (Şekil 3A). Bu deneylerde, iki haploid arasındaki çiftleşme en az 12 kez tekrarlandı. Deneyin tekrarlarının her birinde, en az 100 koloni çift bırakma o...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
S. cerevisiae'de çiftleşme verimliliğinin ölçülmesi, çiftleşme yollarında yer alan genlerle ilgili çalışmalar yapmak veya dış çevrenin çiftleşme davranışı üzerindeki etkisini incelemek için gereklidir. Son yirmi yılda, S. cerevisiae, türleşme 14,36,37,38 ile ilgili soruları ele almak için popüler bir model haline gelmiştir. İki çiftleşme tipinin...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar bu çalışmada birbiriyle çelişen çıkarları olmadığını beyan ederler. Yazarlar, SK1'den türetilmiş suşları tüm kar amacı gütmeyen kullanım için paylaşmaktan mutluluk duyarlar.
Teşekkürler
Bu çalışma, S.S.P.N.'ye DBT / Wellcome Trust (Hindistan İttifakı) hibesi (IA / 504632S / 19/2 / 504632) tarafından finanse edilmiştir. A.M., Hindistan Hükümeti Bilimsel ve Endüstriyel Araştırma Konseyi (CSIR) tarafından Kıdemli Araştırma Görevlisi olarak desteklenmektedir (09/087(0873)/2017-EMR-I). Yazarlar tartışmalar için Paike Jayadeva Bhat'a teşekkür eder.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Adenine | Sigma Life Science | A8626 | |
| Agar Powder regular grade for bacteriology | SRL | 19661 (0140186) | |
| Ammonium Sulphate, Hi-AR | HiMedia | GRM1273 | |
| D-(+)-glucose | Sigma Life Science | G8270 | |
| Glass Petri plates | HiMedia | PW008 | 90 mm x 15 mm dimension |
| L-Arginine | Sigma Life Science | A8094 | |
| L-Aspartic acid | Sigma Life Science | A7219 | |
| L-Histidine monochloride monohydrate | Sigma Life Science | H5659 | |
| L-Isoleucine | Sigma Aldrich | I2752 | |
| L-Leucine | Sigma Life Science | L8912 | |
| L-Lysine | Aldrich | 62840 | |
| L-Methionine | Sigma Life Science | M5308 | |
| L-Phenylalanine | Sigma Life Science | P5482 | |
| L-Threonine | Sigma Aldrich | T8625 | |
| L-Tyrosine | Sigma Life Science | T8566 | |
| L-Valine | Sigma Life Science | V0513 | |
| Mating efficiency grid | 1 cm x 1.5 cm rectangular grid drawn on the Petri plate | ||
| Microcentrifuge tubes | Tarsons | 500010 | |
| Peptone | HiMedia | RM001 | |
| Uracil | Sigma Life Science | U0750 | |
| Yeast Extract Powder | HiMedia | RM027 | |
| Yeast Nitrogen Base w/o Amino acids and Ammonium Sulphate | BD Difco | 233520 |
Referanslar
- Neiman, A. M. Sporulation in the budding yeast Saccharomyces cerevisiae. Genetics. 189 (3), 737-765 (2011).
- Duina, A. A., Miller, M. E., Keeney, J. B. Budding yeast for budding geneticists: A primer on the Saccharomyces cerevisiae model system. Genetics. 197 (1), 33-48 (2014).
- Herskowitz, I. Life cycle of the budding yeast Saccharomyces cerevisiae. Microbiological Reviews. 52 (4), 536-553 (1988).
- Erdman, S., Lin, L., Malczynski, M., Snyder, M. Pheromone-regulated genes required for yeast mating differentiation. Journal of Cell Biology. 140 (3), 461-483 (1998).
- Merlini, L., Dudin, O., Martin, S. G. Mate and fuse: How yeast cells do it. Open Biology. 3 (3), 130008(2013).
- Gustin, M. C., Albertyn, J., Alexander, M., Davenport, K. MAP kinase pathways in the yeast Saccharomyces cerevisiae. Microbiology and Molecular Biology Reviews. 62 (4), 1264-1300 (1998).
- Bardwell, L. A walk-through of the yeast mating pheromone response pathway. Peptides. 26 (2), 339-350 (2005).
- Reid, B. J., Hartwell, L. H. Regulation of mating in the cell cycle of Saccharomyces cerevisiae. Journal of Cell Biology. 75, 355-365 (1977).
- Williams, T. C., Peng, B., Vickers, C. E., Nielsen, L. K. The Saccharomyces cerevisiae pheromone-response is a metabolically active stationary phase for bio-production. Metabolic Engineering Communications. 3, 142-152 (2016).
- Bagnat, M., Simons, K. Cell surface polarization during yeast mating. Proceedings of the National Academy of Sciences of the United States of America. 99 (22), 14183-14188 (2002).
- Trueheart, J., Boeke, J. D., Fink, G. R. Two genes required for cell fusion during yeast conjugation: Evidence for a pheromone-induced surface protein. Molecular and Cellular Biology. 7 (7), 2316-2328 (1987).
- Sniegowski, P. D., Dombrowski, P. G., Fingerman, E. Saccharomyces cerevisiae and Saccharomyces paradoxus coexist in a natural woodland site in North America and display different levels of reproductive isolation from European conspecifics. FEMS Yeast Research. 1 (4), 299-306 (2002).
- Replansky, T., Koufopanou, V., Greig, D., Bell, G. Saccharomyces sensu stricto as a model system for evolution and ecology. Trends in Ecology and Evolution. 23 (9), 494-501 (2008).
- Greig, D. Reproductive isolation in Saccharomyces. Heredity. 102 (1), 39-44 (2009).
- Mayr, E. Systematics and the Origin of Species, from the Viewpoint of a Zoologist. , Harvard University Press. Cambridge, MA. (1999).
- Sprague, G. F. Assay of yeast mating reaction. Methods in Enzymology. 194, 77-93 (1991).
- McCaffrey, G., Clay, F. J., Kelsay, K., Sprague, G. F. Identification and regulation of a gene required for cell fusion during mating of the yeast Saccharomyces cerevisiae. Molecular and Cellular Biology. 7 (8), 2680-2690 (1987).
- Valtz, N., Peter, M., Herskowitz, I. FAR1 is required for oriented polarization of yeast cells in response to mating pheromones. Journal of Cell Biology. 131 (4), 863-873 (1995).
- Maclean, C. J., Greig, D. Prezygotic reproductive isolation between Saccharomyces cerevisiae and Saccharomyces paradoxus. BMC Evolutionary Biology. 8, 1(2008).
- Murphy, H. A., Kuehne, H. A., Francis, C. A., Sniegowski, P. D. Mate choice assays and mating propensity differences in natural yeast populations. Biology Letters. 2 (4), 553-556 (2006).
- Leu, J. Y., Murray, A. W. Experimental evolution of mating discrimination in budding yeast. Current Biology. 16 (3), 280-286 (2006).
- Kim, J., Hirsch, J. P. A nucleolar protein that affects mating efficiency in Saccharomyces cerevisiae by altering the morphological response to pheromone. Genetics. 149 (2), 795-805 (1998).
- Jin, M., et al. Yeast dynamically modify their environment to achieve better mating efficiency. Science Signaling. 4 (186), (2011).
- Rogers, D. W., Denton, J. A., McConnell, E., Greig, D. Experimental evolution of species recognition. Current Biology. 25 (13), 1753-1758 (2015).
- McClure, A. W., Jacobs, K. C., Zyla, T. R., Lew, D. J. Mating in wild yeast: Delayed interest in sex after spore germination. Molecular Biology of the Cell. 29 (26), 3119-3127 (2018).
- Sena, E. P., Radin, D. N., Fogel, S. Synchronous mating in yeast. Proceedings of the National Academy of Sciences of the United States of America. 70 (5), 1373-1377 (1973).
- Werner-Washburne, M., Braun, E., Johnston, G. C., Singer, R. A. Stationary phase in the yeast Saccharomyces cerevisiae. Microbiology Reviews. 57 (2), 383-401 (1993).
- Johnston, S. A., Hopper, J. E. Isolation of the yeast regulatory gene GAL4 and analysis of its dosage effects on the galactose/melibiose regulon. Proceedings of the National Academy of Sciences of the United States of America. 79 (22), 6971-6975 (1982).
- Mahilkar, A. Study of metabolic specialization leading to speciation, using yeast as a model system. , Indian Institute of Technology. Bombay, Mumbai. PhD thesis (2021).
- Blank, T. E., Woods, M. P., Lebo, C. M., Xin, P., Hopper, J. E. Novel Gal3 proteins showing altered Gal80p binding cause constitutive transcription of Gal4p-activated genes in Saccharomyces cerevisiae. Molecular and Cellular Biology. 17 (5), 2566-2575 (1997).
- Rice, W. R., Hostert, E. E. Laboratory experiments on speciation: What have we learned in 40 years. Evolution. 47 (6), 1637-1653 (1993).
- White, N. J., Snook, R. R., Eyres, I. The past and future of experimental speciation. Trends in Ecology and Evolution. 35 (1), 10-21 (2020).
- Milo, R., Jorgensen, P., Moran, U., Weber, G., Springer, M. BioNumbers--The database of key numbers in molecular and cell biology. Nucleic Acids Research. 38, 750-753 (2010).
- Domitrovic, T., et al. Structural and functional study of YER067W, a new protein involved in yeast metabolism control and drug resistance. PLoS One. 5 (6), 11163(2010).
- Lindegren, C. C., Spiegelman, S., Lindegren, G. Mendelian inheritance of adaptive enzymes. Proceedings of the National Academy of Sciences of the United States of America. 30 (11), 346-352 (1944).
- Dettman, J. R., Sirjusingh, C., Kohn, L. M., Anderson, J. B. Incipient speciation by divergent adaptation and antagonistic epistasis in yeast. Nature. 447 (7144), 585-588 (2007).
- Jhuang, H. Y., Lee, H. Y., Leu, J. Y. Mitochondrial-nuclear co-evolution leads to hybrid incompatibility through pentatricopeptide repeat proteins. EMBO Reports. 18 (1), 87-101 (2017).
- Lee, H. Y., et al. Incompatibility of nuclear and mitochondrial genomes causes hybrid sterility between two yeast species. Cell. 135 (6), 1065-1073 (2008).
- Pronk, J. T. Auxotrophic yeast strains in fundamental and applied research. Applied and Environmental Microbiology. 68 (5), 2095-2100 (2002).
- Madhani, H. D. From a to α: Yeast as a Model for Cellular Differentiation. , Cold Spring Harbor Laboratory Press. Long Island, New York. (2007).
- Huxley, C., Green, E. D., Dunham, I. Rapid assessment of S. cerevisiae mating type by PCR. Trends in Genetics. 6 (8), 236(1990).
- Rang, C., Galen, J. E., Kaper, J. B., Chao, L. Fitness cost of the green fluorescent protein in gastrointestinal bacteria. Canadian Journal of Microbiology. 49 (9), 531-537 (2003).
- Tusso, S., Nieuwenhuis, B. P. S., Weissensteiner, B., Immler, S., Wolf, J. B. W. Experimental evolution of adaptive divergence under varying degrees of gene flow. Nature Ecology and Evolution. 5 (3), 338-349 (2021).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır