Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Определение эффективности спаривания гаплоидов у Saccharomyces cerevisiae
В этой статье
Резюме
В данной работе описан робастный метод количественной оценки эффективности спаривания у дрожжей Saccharomyces cerevisiae . Этот метод особенно полезен для количественной оценки презиготных барьеров в исследованиях видообразования.
Аннотация
Saccharomyces cerevisiae является широко используемым модельным организмом в генетике, эволюции и молекулярной биологии. В последние годы он также стал популярным модельным организмом для изучения проблем, связанных с видообразованием. Жизненный цикл дрожжей включает в себя как бесполую, так и половую репродуктивную фазы. Легкость проведения эволюционных экспериментов и короткое время генерации организма позволяют изучать эволюцию репродуктивных барьеров. Эффективность, с которой два типа спаривания (a и α) спариваются с образованием диплоида a/α, называется эффективностью спаривания. Любое снижение эффективности спаривания между гаплоидами указывает на презиготный барьер. Таким образом, для количественной оценки степени репродуктивной изоляции между двумя гаплоидами требуется надежный метод количественной оценки эффективности спаривания. С этой целью здесь представлен простой и легко воспроизводимый протокол. Протокол включает в себя четыре основных этапа, которые включают в себя исправление гаплоидов на пластине YPD, смешивание гаплоидов в равных количествах, разбавление и покрытие для отдельных колоний и, наконец, расчет эффективности на основе количества колоний на пластине. Ауксотрофные маркеры используются, чтобы четко провести различие между гаплоидами и диплоидами.
Введение
Saccharomyces cerevisiae, обычно называемые почковающимися дрожжами, являются одноклеточными эукариотами. Он имеет два типа спаривания, a и α, и демонстрирует как бесполые, так и половые репродуктивные циклы. Типы спаривания a и α являются гаплоидами и могут митотически делиться в отсутствие другого типа спаривания в окружающей среде, который представляет собой бесполый цикл дрожжей. Когда два типа спаривания находятся в непосредственной близости, они перестают митотически делиться и сливаются, образуя диплоидную клетку. Диплоидные дрожжи могут либо делиться митотически при наличии питательных веществ, либо подвергаться мейозу в условиях азотного голодания в присутствии бедного источника углерода, который не поддается ферментации, такого как ацетат1. Это приводит к образованию спор, которые остаются в состоянии покоя до тех пор, пока не появятся благоприятные условия для роста. Жизненный цикл завершается, когда эти споры прорастают, и два гаплоидных типа высвобождаются обратно в гаплоидный пул 2,3 (рис. 1).
Спаривание дрожжевых клеток включает в себя несколько этапов, таких как агглютинация, образование проекции спаривания или «шму», за которой следует клеточный и ядерный синтез 4,5. Два типа спаривания a и α производят a-фактор и α-фактор соответственно, чтобы инициировать спаривание. Эти факторы представляют собой полипептидные феромоны, которые связываются с рецепторами (Ste2 и Ste3), присутствующими на поверхности клеток противоположного типаспаривания 5. Связывание феромонов с рецепторами инициирует путь феромонного ответа, путь передачи сигнала митоген-активируемой протеинкиназы (MAPK) 6,7,8. Это приводит к остановке клеточного цикла в фазе G1, что приводит к метаболически активной стационарной фазе9. Затем клетки перестают митотически делиться, и синтезируются белки, необходимые для спаривания. Поскольку гаплоидные клетки не могут двигаться навстречу друг другу, брачная проекция или «шму» направлена на партнера по спариванию. Когда клетки вступают в контакт, клеточная стенка разлагается, и цитоплазматическое содержимое сливается, в результате чего происходит спаривание с образованием диплоидной клетки10,11. Эффективность спаривания между гаплоидами использовалась в качестве меры видообразования в лабораторных штаммах, а также между существующими видами12.
Будучи простым эукариотическим организмом, дрожжи являются моделью выбора для большого количества исследовательских вопросов, связанных со сложными эукариотическими организмами. Один из таких вопросов связан с видообразованием и эволюцией репродуктивных барьеров13,14. Для организмов, размножающихся половым путем, вид определяется концепцией биологического вида (BSC), предложенной Эрнстом Майром15. Согласно этой концепции, две особи популяции считаются принадлежащими к двум разным видам, если они не могут скрещиваться и репродуктивно изолированы. Нарушение полового репродуктивного цикла (которое включает слияние гамет с образованием зиготы, развитие зиготы в потомство и достижение половой зрелости у потомства) приводит к репродуктивной изоляции. Как показано на рисунке 1, жизненный цикл S. cerevisiae сопоставим с половым репродуктивным циклом: а) слияние двух типов спаривания a и α аналогично слиянию гамет у организмов, размножающихся половым путем; б) способность диплоида подвергаться митотическому делению эквивалентна развитию зиготы в потомство; и в) диплоид, подвергающийся спороношению, сопоставим с процессом гаметогенеза14.
Презиготная изоляция происходит, когда наблюдается ассортативное спаривание. Имея равные возможности спариваться с двумя генетически разными типами , α тип предпочтительно спаривается с одним из них, а не с другим илинаоборот14. В случае эволюционных экспериментов, в которых гаплоиды эволюционировали в разных средах, наличие барьера перед спариванием можно определить, выполнив анализ спаривания. Снижение эффективности спаривания по сравнению с предком указывает на эволюцию барьера перед спариванием. Постзиготная изоляция может возникнуть из-за неспособности диплоида подвергаться эффективному митотическому делению и/или спороношению с образованием гаплоидных спор14. Они могут быть количественно оценены путем измерения скорости роста диплоидов и расчета эффективности спороношения, соответственно. Следовательно, для изучения эволюции репродуктивных барьеров требуются надежные методы количественной оценки (а) эффективности спаривания, (б) митотического роста диплоида и (в) эффективности спороношения диплоида. В этой работе сообщается о надежном методе количественной оценки эффективности спаривания штаммов дрожжей.
В лабораторных экспериментах одним из способов обнаружения возникновения спаривания является использование ауксотрофных маркеров, которые дополняют потребности в питании. Когда два типа спаривания являются ауксотрофными для двух разных аминокислот, только диплоидная клетка, образованная слиянием двух типов спаривания, может расти в среде, дефицитной для обеих аминокислот. Таким образом, ауксотрофные маркеры полезны для выявления спаривания как качественно, так и количественно. Качественного теста будет достаточно, чтобы определить тип спаривания штамма после мейоза16. Количественные тесты необходимы, когда кто-то заинтересован в выявлении сокращения спаривания при изучении генов, участвующих в пути спаривания17,18. Кроме того, поскольку дрожжи все чаще используются в исследованиях видообразования, необходим удобный и воспроизводимый анализ спаривания, поскольку количественная оценка эффективности спаривания является мерой презиготного барьера.
Эффективность спаривания между двумя типами спаривания дрожжей была количественно определена ранее16,19,20. Большинство ранее использовавшихся методов схожи по своей конструкции с несколькими вариациями 16,21,22,23,24,25. Некоторые из них используют культуры ранней логарифмической фазы, в то время как некоторые другие используют культуры средней логарифмической фазы гаплоидных штаммов. Существуют различия в соотношениях, в которых смешиваются два типа спаривания. Почти во всех протоколах используется нитроцеллюлозная мембрана. Суспензии обоих типов спаривания, взятые из ранее выращенных культур, смешивают и фильтруют на нитроцеллюлозную мембрану, помещенную на пластину YPD. В одном из вариантов протокола гаплоидная суспензия наносится непосредственно на пластину21 YPD. В экспериментах, связанных с генами, участвующими в производстве феромонов двух типов спаривания, феромоны добавляются извне при создании суспензий двух типов спаривания24.
После инкубации в течение нескольких часов (обычно около 5 часов) после смешивания гаплоидов клетки смываются с мембраны, разбавляются и наносятся на селективные среды. В одном из более ранних методов, о которых сообщалось в 1973 году, эффективность образования или спаривания зиготы рассчитывалась путем подсчета количества отпочковавшихся клеток, непочковавшихся клеток и спаривающихся пар под микроскопом с использованием гемоцитометра26. Однако большинство методов, о которых сообщалось позже, используют ауксотрофные маркеры для различения гаплоидов и диплоидов. Эффективность спаривания рассчитывается как процентное соотношение диплоидных клеток к количеству диплоидных и гаплоидных клеток в клеточном пуле 16,21,23.
Однако, несмотря на ряд сообщений об использовании дрожжей в качестве модельного организма для изучения видообразования, до сих пор в литературе не сообщалось стандартизированного протокола для расчета эффективности спаривания. Клетки в логарифмической фазе могут быть не идеальными для количественной оценки эффективности спаривания. Во время спаривания клеточный цикл двух гаплоидов останавливается, и, следовательно, клетки во время спаривания не делятся9. Поскольку также известно, что клеточный цикл аналогичным образом останавливается в клетках в стационарной фазе27, использование таких клеток может сделать протокол более воспроизводимым. Клетки неподвижной фазы можно смешивать и раскладывать на тарелках YPD (т.е. в богатой питательными веществами среде) для спаривания. Обычные процедуры также требуют нитроцеллюлозной мембраны и смывания клеток, что делает процесс громоздким и подверженным ошибкам. Кроме того, протоколы, используемые на сегодняшний день, количественно оценивают эффективность спаривания в пересчете на один гаплоид. Однако при измерении репродуктивной изоляции эффективность спаривания количественно определяется для конкретной комбинации гаплоидов, а не для одного гаплоида.
Чтобы решить эти проблемы, здесь мы сообщаем о надежном методе количественной оценки эффективности спаривания у дрожжей, который является высоковоспроизводимым и простым в использовании. Кроме того, этот метод и используемые здесь штаммы дрожжей также могут быть использованы в исследованиях, изучающих влияние потока генов на эволюцию брачных барьеров.
В этом исследовании использовались два разных штамма S. cerevisiae. Один из штаммов получен из фона SK1; это было изменено в нашей лаборатории путем добавления ауксотрофных маркеров вблизи локуса MAT. Полученные генотипы гаплоидов представлены в таблице 128,29,30. В штамме SK1 гаплоид a имел ген TRP1, вставленный рядом с локусом MAT, а гаплоид α имел ген LEU2, вставленный рядом с локусом MAT. В штамме ScAM гены TRP1 и URA3 были вставлены в гаплоиды a и α соответственно. Место вставки было в области ARS хромосомы III (Chr III: 197378..197609). Для протокола, представленного здесь, было бы достаточно ауксотрофных маркеров в любом месте генома. Однако наличие ауксотрофных маркеров вблизи локуса MAT означает, что эти штаммы также могут быть использованы для исследований, изучающих влияние потока генов на видообразование31,32. Маркеры были добавлены близко к локусу MAT, чтобы предотвратить перетасовку маркеров из-за рекомбинации. Следовательно, этот протокол может быть использован для количественной оценки эффективности спаривания в исследованиях, связанных с видообразованием, а также для выявления изменения эффективности спаривания при изучении белков, участвующих в пути спаривания.
протокол
ПРИМЕЧАНИЕ: Протокол в целом включает следующие этапы: (1) исправление гаплоидов в сетках эффективности спаривания на пластине YPD, (2) смешивание гаплоидов в равных количествах после 24-часовой инкубации и предоставление смешанным гаплоидам нескольких часов для спаривания (7 часов в этом исследовании), (3) покрытие смешанных клеток YPD для выделения отдельных колоний через 7 часов при 30 ° C, и, наконец, (4) определение количества диплоидов, образующихся с использованием ауксотрофных маркеров. Эти шаги подробно обсуждаются ниже (см. также рисунок 2).
1. Исправление гаплоидов в сетках эффективности спаривания
- Оживите гаплоиды А и α из запасов морозильной камеры, нанеся полосы на агаровую пластину YPD (2% агар, 2% декстроза, 1% пептон, 0,5% дрожжевого экстракта) и дайте им расти в течение 48 часов при 30 ° C, чтобы получить изолированные единичные колонии.
- Инокулируют отдельные колонии из планшета YPD в 5 мл среды YPD (2% декстрозы, 1% пептона, 0,5% дрожжевого экстракта) и инкубируют при 30 ° C в течение 48 часов при встряхивании 250 об / мин. После этого инкубационного периода клетки находятся в стационарной фазе роста.
- Нарисуйте сетку эффективности спаривания на свежей тарелке YPD. Нарисуйте сетку в виде прямоугольника размером 1 см x 1,5 см, разделенного на три прямоугольника так, чтобы каждый из них имел размеры 1 см x 0,5 см, как показано на рисунке 2A.
- Патч 5 мкл культуры YPD двух типов спаривания на крайнем левом и крайнем правом прямоугольниках (рис. 2B). Этот объем соответствует примерно 5 х 105 гаплоидных клеток, выложенных в каждой секции. Выдерживают пластины в течение 24 ч при 30 °C.
ПРИМЕЧАНИЕ: Цель сетки состоит в том, чтобы сделать экспериментальные измерения точными (например, количество клеток в эксперименте). Размер сетки достаточно мал, чтобы ее можно было экспериментально обрабатывать, но достаточно велик, чтобы ею можно было легко манипулировать (например, извлекать клетки из сетки), и она не подвержена дрейфу или случайным событиям.
2. Смешение гаплоидов и спаривание
ПРИМЕЧАНИЕ: Через 24 ч (рис. 2C) равное количество клеток двух гаплоидных типов соскребают с двух сеток, смешивают и укладывают в центральный прямоугольник (рис. 2D).
- Чтобы смешать равное количество клеток, удалите около 1/3 пластыря, который был положен во внешние коробки, с помощью стерильной зубочистки и ресуспендируйте в 20 мкл воды в стерильном флаконе объемом 1,5 мл для каждого из гаплоидов.
- Разведите 5 мкл этой суспензии в 2 мл воды. Измерьте OD этой разбавленной суспензии с помощью спектрофотометра на длине волны 600 нм. Смешайте равное количество клеток из двух штаммов, исходя из значения OD и количества клеток / мл в 1 OD для этого конкретного штамма. Рассчитайте объем, необходимый для смешивания, и аспирируйте его из оставшихся 15 мкл индивидуальной гаплоидной суспензии.
ПРИМЕЧАНИЕ: Количество ячеек, помещенных в центральный прямоугольник, таково, что ячейки образуют монослой. Учитывая, что дрожжевая клетка представляет собой сферу радиусом 2,58 мкм33, прямоугольной коробке размером 1 см х 0,5 см потребуется примерно 1,7 х 106 клеток для образования монослоя. Следует позаботиться о том, чтобы между клетками, заплатанными для спаривания, и двумя гаплоидными клеточными сетками не было физического соприкосновения. Поскольку необходимо смешать равное количество каждого типа гаплоидных клеток, от каждого штамма добавляют 8,5 х 105 клеток. Число ячеек рассчитывается на основе измерений ОД, считая, что 1 ОД при 600 нм приблизительно эквивалентен 1 x 107 ячеек34. Например, если OD600 гаплоидной суспензии равен 0,17, а OD гаплоидной α равен 0,11, можно рассчитать количество клеток в 5 мкл каждой гаплоидной суспензии. Чтобы обеспечить 8,5 х 105 клеток каждого гаплоидного типа, смешивают 1,25 мкл гаплоидных и 1,93 мкл α гаплоидных суспензий. - Добавьте необходимые объемы обоих гаплоидов в свежий и стерильный флакон объемом 1,5 мл и хорошо перемешайте с помощью пипетки. Конечный объем этой суспензии обычно составляет около 6–8 мкл. Заплатите эту суспензию в центральной сетке. Инкубируйте пластину при 30 °C в течение 7 часов, давая гаплоидам достаточно времени для спаривания (рис. 2E).
3. Покрытие смешанных клеток на агаре YPD
- После инкубационного периода в 7 ч соскребите клетки с центрального прямоугольника зубочисткой или наконечником пипетки и разведите в 2 мл стерильной воды. Затем распределите клеточную суспензию на агаре YPD, чтобы получить отдельные колонии. Чтобы определить коэффициент разбавления, необходимый для получения единичных колоний, измерьте OD первой пробирки, в которую добавляются очищенные клетки. Конкретные коэффициенты разбавления должны быть определены для каждого используемого типа/штамма клеток.
ПРИМЕЧАНИЕ: Например, OD600 0,15 соответствует 3 x 106 клеткам в суспензии объемом 2 мл (учитывая, что 1 OD = 1 x 107 клеток / мл). Чтобы получить несколько сотен колоний на пластине YPD, клеточную суспензию последовательно разбавляют в соотношении 1:20 дважды, а затем 100 мкл окончательного разведения используют для распространения. - После покрытия пластины YPD инкубируют при 30 ° C в течение 36–48 часов до образования единичных колоний. Убедитесь, что несколько сотен отдельных колоний получены из каждого эксперимента по спариванию для скрининга, чтобы обеспечить статистическую значимость данных (рис. 2F).
4. Скрининг на диплоиды с использованием ауксотрофных маркеров
- Определите, какая доля полученных колоний является диплоидной. Чтобы идентифицировать диплоидные колонии на пластине, перенесите одиночные колонии, нанеся их по отдельности на пластину с двойным выпадением (2% глюкозы, 0,66% азотного основания, 0,05% смеси аминокислот с двойным выпадением и 2% агара), в которой отсутствуют аминокислоты, для которых штаммы являются ауксотрофными, как показано на рисунке 2G. Инкубировать пластины при 30 °C в течение 48 часов.
ПРИМЕЧАНИЕ: Колонии также могут быть перенесены на пластину с двойным выпадением с использованием реплики. В этом исследовании триптофан и лейцин (trp-лей-) использовали для количественной оценки эффективности спаривания штаммов SK1AM, а триптофан и урацил (trp-ура-) использовали для штаммов ScAM. На пластине двойного выпадения растут только диплоидные колонии, поскольку они имеют оба ауксотрофных маркера: гены TRP1 и LEU2 в штаммах SK1AM и гены TRP1 и URA3 в штаммах ScAM. - Кроме того, полосы или реплики пластинчат колонии на одиночных средах (trp-, leu- или ura-), чтобы количественно оценить частоту каждого из двух видов гаплоидов в популяции.
- Рассчитайте эффективность спаривания, η, следующим образом:
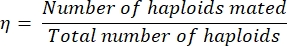 Эквалайзер (1)
Эквалайзер (1)
где число спаренных гаплоидов просто равно удвоенному числу диплоидов, идентифицированных на пластине двойного выпадения (поскольку каждый диплоид возник в результате спаривания двух гаплоидов). Общее количество гаплоидов равно сумме числа гаплоидов с полосами плюс удвоенное количество прожилок с диплоидами.
ПРИМЕЧАНИЕ: Например, если только 60 колоний вырастают после полос / репликации 100 колоний на среде с двойным выпадением, эффективность спаривания может быть количественно определена как 75% (поскольку 60 x 2 гаплоидов спариваются, образуя 60 диплоидов, а 40 гаплоидов не спариваются).
Результаты
Количественная оценка эффективности сопряжения двух типов сопряжения
Описанный здесь протокол был использован для количественной оценки эффективности спаривания между двумя штаммами дрожжей - между SK1AM a и SK1AM α и между ScAMa и ScAMα (рис. 3A<...
Обсуждение
Количественная оценка эффективности спаривания у S. cerevisiae имеет важное значение для проведения исследований, связанных с генами, участвующими в путях спаривания, или изучения влияния внешней среды на брачное поведение. В последние два десятилетия S. cerevisiae также стала популярн...
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих интересов в этой работе. Авторы рады поделиться штаммами, полученными из SK1, для всех некоммерческих целей.
Благодарности
Эта работа финансировалась за счет гранта DBT/Wellcome Trust (India Alliance) (IA/S/19/2/504632) для S.S. P.N. является научным сотрудником при поддержке гранта DBT/Wellcome Trust (India Alliance) (IA/S/19/2/504632). А.М. поддерживается Советом по научным и промышленным исследованиям (CSIR) правительства Индии в качестве старшего научного сотрудника (09/087(0873)/2017-EMR-I). Авторы благодарят Пайке Джаядева Бхат за обсуждения.
Материалы
| Name | Company | Catalog Number | Comments |
| Adenine | Sigma Life Science | A8626 | |
| Agar Powder regular grade for bacteriology | SRL | 19661 (0140186) | |
| Ammonium Sulphate, Hi-AR | HiMedia | GRM1273 | |
| D-(+)-glucose | Sigma Life Science | G8270 | |
| Glass Petri plates | HiMedia | PW008 | 90 mm x 15 mm dimension |
| L-Arginine | Sigma Life Science | A8094 | |
| L-Aspartic acid | Sigma Life Science | A7219 | |
| L-Histidine monochloride monohydrate | Sigma Life Science | H5659 | |
| L-Isoleucine | Sigma Aldrich | I2752 | |
| L-Leucine | Sigma Life Science | L8912 | |
| L-Lysine | Aldrich | 62840 | |
| L-Methionine | Sigma Life Science | M5308 | |
| L-Phenylalanine | Sigma Life Science | P5482 | |
| L-Threonine | Sigma Aldrich | T8625 | |
| L-Tyrosine | Sigma Life Science | T8566 | |
| L-Valine | Sigma Life Science | V0513 | |
| Mating efficiency grid | 1 cm x 1.5 cm rectangular grid drawn on the Petri plate | ||
| Microcentrifuge tubes | Tarsons | 500010 | |
| Peptone | HiMedia | RM001 | |
| Uracil | Sigma Life Science | U0750 | |
| Yeast Extract Powder | HiMedia | RM027 | |
| Yeast Nitrogen Base w/o Amino acids and Ammonium Sulphate | BD Difco | 233520 |
Ссылки
- Neiman, A. M. Sporulation in the budding yeast Saccharomyces cerevisiae. Genetics. 189 (3), 737-765 (2011).
- Duina, A. A., Miller, M. E., Keeney, J. B. Budding yeast for budding geneticists: A primer on the Saccharomyces cerevisiae model system. Genetics. 197 (1), 33-48 (2014).
- Herskowitz, I. Life cycle of the budding yeast Saccharomyces cerevisiae. Microbiological Reviews. 52 (4), 536-553 (1988).
- Erdman, S., Lin, L., Malczynski, M., Snyder, M. Pheromone-regulated genes required for yeast mating differentiation. Journal of Cell Biology. 140 (3), 461-483 (1998).
- Merlini, L., Dudin, O., Martin, S. G. Mate and fuse: How yeast cells do it. Open Biology. 3 (3), 130008 (2013).
- Gustin, M. C., Albertyn, J., Alexander, M., Davenport, K. MAP kinase pathways in the yeast Saccharomyces cerevisiae. Microbiology and Molecular Biology Reviews. 62 (4), 1264-1300 (1998).
- Bardwell, L. A walk-through of the yeast mating pheromone response pathway. Peptides. 26 (2), 339-350 (2005).
- Reid, B. J., Hartwell, L. H. Regulation of mating in the cell cycle of Saccharomyces cerevisiae. Journal of Cell Biology. 75, 355-365 (1977).
- Williams, T. C., Peng, B., Vickers, C. E., Nielsen, L. K. The Saccharomyces cerevisiae pheromone-response is a metabolically active stationary phase for bio-production. Metabolic Engineering Communications. 3, 142-152 (2016).
- Bagnat, M., Simons, K. Cell surface polarization during yeast mating. Proceedings of the National Academy of Sciences of the United States of America. 99 (22), 14183-14188 (2002).
- Trueheart, J., Boeke, J. D., Fink, G. R. Two genes required for cell fusion during yeast conjugation: Evidence for a pheromone-induced surface protein. Molecular and Cellular Biology. 7 (7), 2316-2328 (1987).
- Sniegowski, P. D., Dombrowski, P. G., Fingerman, E. Saccharomyces cerevisiae and Saccharomyces paradoxus coexist in a natural woodland site in North America and display different levels of reproductive isolation from European conspecifics. FEMS Yeast Research. 1 (4), 299-306 (2002).
- Replansky, T., Koufopanou, V., Greig, D., Bell, G. Saccharomyces sensu stricto as a model system for evolution and ecology. Trends in Ecology and Evolution. 23 (9), 494-501 (2008).
- Greig, D. Reproductive isolation in Saccharomyces. Heredity. 102 (1), 39-44 (2009).
- Mayr, E. . Systematics and the Origin of Species, from the Viewpoint of a Zoologist. , (1999).
- Sprague, G. F. Assay of yeast mating reaction. Methods in Enzymology. 194, 77-93 (1991).
- McCaffrey, G., Clay, F. J., Kelsay, K., Sprague, G. F. Identification and regulation of a gene required for cell fusion during mating of the yeast Saccharomyces cerevisiae. Molecular and Cellular Biology. 7 (8), 2680-2690 (1987).
- Valtz, N., Peter, M., Herskowitz, I. FAR1 is required for oriented polarization of yeast cells in response to mating pheromones. Journal of Cell Biology. 131 (4), 863-873 (1995).
- Maclean, C. J., Greig, D. Prezygotic reproductive isolation between Saccharomyces cerevisiae and Saccharomyces paradoxus. BMC Evolutionary Biology. 8, 1 (2008).
- Murphy, H. A., Kuehne, H. A., Francis, C. A., Sniegowski, P. D. Mate choice assays and mating propensity differences in natural yeast populations. Biology Letters. 2 (4), 553-556 (2006).
- Leu, J. Y., Murray, A. W. Experimental evolution of mating discrimination in budding yeast. Current Biology. 16 (3), 280-286 (2006).
- Kim, J., Hirsch, J. P. A nucleolar protein that affects mating efficiency in Saccharomyces cerevisiae by altering the morphological response to pheromone. Genetics. 149 (2), 795-805 (1998).
- Jin, M., et al. Yeast dynamically modify their environment to achieve better mating efficiency. Science Signaling. 4 (186), (2011).
- Rogers, D. W., Denton, J. A., McConnell, E., Greig, D. Experimental evolution of species recognition. Current Biology. 25 (13), 1753-1758 (2015).
- McClure, A. W., Jacobs, K. C., Zyla, T. R., Lew, D. J. Mating in wild yeast: Delayed interest in sex after spore germination. Molecular Biology of the Cell. 29 (26), 3119-3127 (2018).
- Sena, E. P., Radin, D. N., Fogel, S. Synchronous mating in yeast. Proceedings of the National Academy of Sciences of the United States of America. 70 (5), 1373-1377 (1973).
- Werner-Washburne, M., Braun, E., Johnston, G. C., Singer, R. A. Stationary phase in the yeast Saccharomyces cerevisiae. Microbiology Reviews. 57 (2), 383-401 (1993).
- Johnston, S. A., Hopper, J. E. Isolation of the yeast regulatory gene GAL4 and analysis of its dosage effects on the galactose/melibiose regulon. Proceedings of the National Academy of Sciences of the United States of America. 79 (22), 6971-6975 (1982).
- Mahilkar, A. . Study of metabolic specialization leading to speciation, using yeast as a model system. , (2021).
- Blank, T. E., Woods, M. P., Lebo, C. M., Xin, P., Hopper, J. E. Novel Gal3 proteins showing altered Gal80p binding cause constitutive transcription of Gal4p-activated genes in Saccharomyces cerevisiae. Molecular and Cellular Biology. 17 (5), 2566-2575 (1997).
- Rice, W. R., Hostert, E. E. Laboratory experiments on speciation: What have we learned in 40 years. Evolution. 47 (6), 1637-1653 (1993).
- White, N. J., Snook, R. R., Eyres, I. The past and future of experimental speciation. Trends in Ecology and Evolution. 35 (1), 10-21 (2020).
- Milo, R., Jorgensen, P., Moran, U., Weber, G., Springer, M. BioNumbers--The database of key numbers in molecular and cell biology. Nucleic Acids Research. 38, 750-753 (2010).
- Domitrovic, T., et al. Structural and functional study of YER067W, a new protein involved in yeast metabolism control and drug resistance. PLoS One. 5 (6), 11163 (2010).
- Lindegren, C. C., Spiegelman, S., Lindegren, G. Mendelian inheritance of adaptive enzymes. Proceedings of the National Academy of Sciences of the United States of America. 30 (11), 346-352 (1944).
- Dettman, J. R., Sirjusingh, C., Kohn, L. M., Anderson, J. B. Incipient speciation by divergent adaptation and antagonistic epistasis in yeast. Nature. 447 (7144), 585-588 (2007).
- Jhuang, H. Y., Lee, H. Y., Leu, J. Y. Mitochondrial-nuclear co-evolution leads to hybrid incompatibility through pentatricopeptide repeat proteins. EMBO Reports. 18 (1), 87-101 (2017).
- Lee, H. Y., et al. Incompatibility of nuclear and mitochondrial genomes causes hybrid sterility between two yeast species. Cell. 135 (6), 1065-1073 (2008).
- Pronk, J. T. Auxotrophic yeast strains in fundamental and applied research. Applied and Environmental Microbiology. 68 (5), 2095-2100 (2002).
- Madhani, H. D. . From a to α: Yeast as a Model for Cellular Differentiation. , (2007).
- Huxley, C., Green, E. D., Dunham, I. Rapid assessment of S. cerevisiae mating type by PCR. Trends in Genetics. 6 (8), 236 (1990).
- Rang, C., Galen, J. E., Kaper, J. B., Chao, L. Fitness cost of the green fluorescent protein in gastrointestinal bacteria. Canadian Journal of Microbiology. 49 (9), 531-537 (2003).
- Tusso, S., Nieuwenhuis, B. P. S., Weissensteiner, B., Immler, S., Wolf, J. B. W. Experimental evolution of adaptive divergence under varying degrees of gene flow. Nature Ecology and Evolution. 5 (3), 338-349 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены