Method Article
3CでAを取得する:学部生のための染色体コンフォメーションキャプチャ
要約
ここでは、染色体立体構造捕捉(3C)技術の適応を、学部生の関与と学習に重点を置いて詳細に紹介します。
要約
染色体コンフォメーションキャプチャ(3C)は、クロマチンの3次元構成の詳細な情報を提供する同様の技術(たとえば、Hi-C、4C、および5C、ここでは3C技術と呼びます)のファミリーを生み出した強力なツールです。3C技術は、がん細胞におけるクロマチン組織の変化のモニタリングから、遺伝子プロモーターとのエンハンサー接触の同定まで、幅広い研究で使用されています。これらの手法を用いた研究の多くは、複雑なサンプルタイプ(すなわち、シングルセル解析)でゲノム全体の大きな質問をしていますが、しばしば失われているのは、3C技術が幅広い研究に適用できる基本的な分子生物学的手法に基づいていることです。クロマチン構成の焦点を絞った質問に取り組むことにより、この最先端の手法を使用して、学部の研究と教育ラボの経験を向上させることができます。この論文は、3Cプロトコルを提示し、学部の研究および教育経験において主に学部機関で実施するための適応と強調点を提供します。
概要
生物のゲノムは、機能に必要なすべての遺伝子だけでなく、それらをいつどのように使用するかについてのすべての指示も保持しています。これにより、ゲノムへのアクセスを調節することは、細胞の最も重要な機能の1つになります。遺伝子機能を制御するメカニズムはたくさんあります。しかし、その基本レベルでは、遺伝子調節は、調節転写因子(トランス因子)がそれらの特定のDNA配列(シス調節配列)に結合する能力に帰着する。これは生来の能力ではありません。代わりに、核内のゲノムの構成/構造によって制御され、トランス因子1,2,3に対するシス調節配列の利用可能性/曝露を制御します。トランスファクターがシス調節配列を見つけることができない場合、トランスファクターは調節タスクを実行できません。これにより、ゲノムが核内でどのように構成されているかを理解することが重要な研究の源となっています。
間期には、核内の真核生物の染色体が核膜と核マトリックスに固定された独自のドメインを占めるため(図1)、染色体はスパゲッティの皿の上の麺ではなく、ピザのスライスのようになります。染色体は、染色体の部分をねじったりループしたりするタンパク質-DNA相互作用(クロマチン)によって部分的に凝縮されます。電子顕微鏡、三次元DNA蛍光in situハイブリダイゼーション(FISH)、およびDNAタグ付け技術(すなわち、蛍光および人工DNAメチル化)により、クロマチンの不活性ドメインは核周辺に沿って密集していることが見出されています4,5,6、一方、活性で凝縮性の低いクロマチンの一部は核の内部に見られます7,8,9、10.これらの実験は、染色体動態の広角図を提供するが、DNase11、12およびヌクレオソーム13、14、15の研究で観察された遺伝子前運動の周囲で局所的に起こる変化を捉えることはほとんどない。
より高解像度のクロマチン動態を解き放つ鍵は、3D染色体マッピング技術である3Cの定式化でした。3C技術自体は、クロマチンの架橋、制限酵素によるクロマチン消化、クロマチンライゲーション、DNA精製の4つの主要なステップで構成されています(図2)。次いで、このプロセスによって生成された新しい人工DNA断片を特徴づけて、直線的に離れたDNA断片間の密接な物理的関連を明らかにすることができる16。3C技術は、3Cの初期ステップを利用してより広いゲノム全体の質問をする複数のスピンオフ技術(Hi-C、4C、ChIP-Cなど)を作成するための基礎となりました。この3C技術ファミリーは、染色体がトポロジー関連ドメイン(TAD)と呼ばれる複数の個別の単位に編成されていることを特定しました。TADはゲノムにコードされており、ループのない境界に隣接するクロマチンループによって定義されます16、17、18、19。TAD境界は、CCCT結合因子(CTCF)と凝集力を含む2つの進化的に保存された遍在する因子によって維持され、別々のTAD内のループが相互作用するのを防ぎます16,20。ループは、トランスファクターとその調節配列との相互作用、ならびにCTCFおよび凝集力21によって媒介される。
3C技術を用いた多くの研究は、ゲノム全体の幅広い質問をし、複雑なサンプル収集技術を採用していますが、3C技術の定式化は基本的な分子生物学的手法に基づいています。これにより、3Cは学部の研究ラボと教育ラボの両方での展開に興味をそそられます。3C手法は、より小さな焦点を絞った質問に採用でき、質問の焦点と方向に応じて、スケールアップまたはスケールダウン(単一遺伝子22、染色体16、および/またはゲノム18)に本質的に柔軟です。この技術は、幅広いモデルシステム7、16、19、23にも適用されており、その使用において汎用性があることが証明されています。これにより、3Cは、学生が一般的な分子生物学技術の経験を積むと同時に、指示された質問に答える貴重な経験を積むことができるという点で、学部生にとって優れた技術になります。
ここに提示されるのは、以前に公開されたプロトコル24、25、26、27に基づく3Cライブラリ調製に適合したプロトコルである。このプロトコルは、約1×107細胞に最適化されていますが、わずか1×105細胞で3Cライブラリを生成しています。このプロトコルは汎用性が高いことが証明されており、ゼブラフィッシュ胚、ゼブラフィッシュ細胞株、および若年成人(YA)のカエノラブディティスエレガンス(回虫)から3Cライブラリを生成するために使用されています。このプロトコルは、哺乳類細胞株、およびさらに適応して酵母にも適切である必要があります。
これらの適応の目標は、学部生が3Cにアクセスしやすくすることです。学部の教育研究室で達成できるものと同様の技術を使用するように注意が払われています。3C技術は、学部生がベンチ、教室、および卒業後の努力において彼らの発達に役立つ基本的な分子生物学技術を学ぶための多くの学習機会を提供します。
プロトコル
1. プライマー設計
注:3Cプライマー設計ツールはオンラインで入手できます28。あるいは、カスタムプライマーを学生が設計することもできます(以下を参照)。
- プライマー位置の同定
- UCSCゲノムブラウザ(http://genome.ucsc.edu/)を開き、研究対象生物を選択し、3Cを使用して評価するゲノムの領域を検索します。
- 次のウィンドウで、ブラウザの下の マッピングとシーケンシング タブで、 Restr Enzymesをクリックして酵素トラックをアクティブにします。
- 使用する 制限酵素 を入力し、 表示モード を パックに設定します。[ 送信]をクリックします。
- バリエーションとリピートで、リピートマスカーが高密度に設定されていることを確認します。
- 規制サイトをガイドとして使用して、マスクされたリピート領域(黒いバー)内にない関心のあるサイトを特定します。制限部位を囲む上流と下流の両方の配列に隣接する300塩基対(bp)をハイライトするには、 位置(一番上のトラック )をクリックし、目的の長さ(~600 bp)までドラッグします。
- マウスを離すと、ポップアップボックスが表示されます。ゲノムの場所をメモし、[ ズームイン]をクリックして、ブラウザを選択範囲に再調整します。
- ブラウザーの上部リボンの [ 表示 ] タブの上にマウスを移動し、ドロップダウン メニューで [ DNA] を選択します。
- デフォルトのオプションのままにして、マスクされたシーケンスの指定に注意してください(それらを Nにするオプションがあります)。 [DNAを取得]をクリックします。
- 強調表示されたシーケンスがウィンドウに表示されます。この配列をコピーして Primer3 (https://primer3.ut.ee/) に貼り付けます。
- Primer3のデフォルト設定を使用して、プライマー の選択をクリックしてプライマーを生成します。
- 結果では、制限酵素の位置をメモし、制限部位が中央に位置する200〜500 bp PCR産物を作成するプライマーを選択します。
- これらのステップに続いて、目的の部位から1キロ塩基(kb)、2 kb、5 kb、10 kb、および20 kbの試験プライマーを設計します。
- 入力コントロールプライマーを設計するには、制限部位を欠く、つまり切断されない、関心のある部位から1〜2 kBの部位に対してこれらの手順を繰り返します。
- 機能的プライマーバリデーション
- プライマーの機能を検証するには、滴定されたプライマー濃度と精製されたゲノムDNAを使用してPCR反応を設定します。定量的または半定量的手段のいずれかを使用して、プライマーが期待される生成物を作成するかどうかを判断します。
- バリデーションに失敗したプライマーを再設計します。
2. 1日目
注:プロトコルは、クロマチン架橋後および核採取後に一時停止(-20°Cで凍結)することができます。ステップは、平均して、学部生で5-6時間かかります。
- ヤングアダルト(YA) C.エレガンス 核コレクション(Hanら29から適応)
- クロマチン架橋
- 50 mLコニカルチューブ内の30 mLのM9培地に5,000 YAワームを採取し、室温(RT)で400 × g で2分間回転させます。
- ワームペレットをM3でさらに9倍洗浄して、バクテリアを取り除きます。
- 上清を除去し、ワームペレットを2.7 mLの37%ホルムアルデヒド(2%最終)を含む47.3 mLのM9に再懸濁し、RTで30分間攪拌(ロッキングまたはナット)しながらインキュベートします。
注意: ホルムアルデヒドの取り扱いには注意し、適切な個人用保護具(PPEラボコート、適切な手袋、および目の保護具)を使用してドラフトの下で作業してください。ホルムアルデヒドは、目、鼻、喉、肺に影響を与える刺激物です。 - ワームを400 × g でRTで2分間回転させます。
- 上清を除去し、ワームペレットを50 mLの1 Mグリシンに再懸濁します。ワームを400 × g でRTで2分間回転させます。
- 核コレクション
- ワームペレットを6 mLのチルドNPバッファー(pH 7.5の50 mM HEPES、40 mM NaCl、90 mM KCl、2 mM EDTA、0.5mM EGTA、0.1% Tween 20、0.2 mM DTT、0.5 mM スペルミジン、0.25 mM スペルミン、1x完全プロテアーゼ阻害剤)に再懸濁します。
- ワーム懸濁液を7 mLのゆったりとした氷の上のダウンスに移します。サンプルを15倍に浸し、氷上で5分間保持します。
- ワーム懸濁液を7 mLのぴったりとフィットする氷上のダウンスに移します。サンプルを20倍に浸し、氷上で5分間保持します。
- ワーム懸濁液を清潔な15 mLコニカルチューブに移し、NPバッファーを合計10 mL(約4 mL)に加えます。
- ワームサスペンションを30秒間高い設定でボルテックスします。サンプルを氷上で5分間インキュベートします。
- 前の手順を繰り返します。
- ワーム懸濁液を100 × g で4°Cで5分間回転させます。
- 上清を新しい15 mLコニカルチューブに移します。
- サンプルにワームの破片がないか確認します。10 μLのサンプルを光学顕微鏡で可視化します。ワームの破片が存在する場合は、サンプルを2,000 × g で4°Cで5分間回転させ、ペレットを新しい10 mLのNPバッファーに再懸濁し、サンプルを100 × g で4°Cで5分間再度回転させます。 ペレットを廃棄し、上清にワームの破片がないか確認し、サンプルにワームの破片がなくなるまで繰り返します。
注:あるいは、40 μmのセルストレーナー(6x)に続いて20 μmのセルストレーナー(6x)を通してサンプルに濾すことによって、ワームの破片を除去することもできます。 - サンプルにワームの破片がない場合は、5 μLのサンプルを採取し、5 μLのメチルグリーンピロニン(核は青色になります)を追加し、血球計算盤で核を数えます。
- サンプルを2,000 × g で4°Cで5分間回転させます
- 上清を取り除き、サンプルを氷の上に置き、続行します。あるいは、核を急速凍結し、-80°Cで保存します。
- クロマチン架橋
- クロマチン消化
- 核を450 μLのきれいな水に再懸濁します。核を清潔な1.5 mLマイクロ遠心チューブに移します。
- 架橋サンプルに60 μLの10x DpnII制限酵素バッファーを加え、よく混ぜます。
注:架橋DNAを切断する他の制限酵素を使用することができる。 - 15 μLの10%ドデシル硫酸ナトリウム(SDS)を加えて核を透過処理し、攪拌(ロッキングまたはナット)しながら37°Cで1時間インキュベートします。
注意: SDSは刺激性であり、皮膚から摂取または吸収されると有毒です。取り扱いには注意し、適切なPPE(白衣、適切な手袋、目の保護具)を使用してください。 - 75 μLの20%Triton X-100を添加し、37°Cで1時間撹拌してSDSをクエンチします。
- 未消化コントロールとしてサンプルから10 μLを採取します。4°Cで保存してください。
- 400 U の DpnII を添加し、撹拌しながら 37 °C で一晩インキュベートします。
3. 2日目
注:平均して、学部生はこれらの手順を完了するのに5時間かかります。
- クロマチン消化
- さらに200 UのDpnIIを添加し、サンプルを攪拌しながら37°Cで4時間インキュベートして、架橋サンプルの完全な分解を確実にします。
- 消化コントロールとしてサンプルから10 μLのアリコートを採取します。
- サンプルを65°Cで20分間インキュベートすることにより(または製造元の指示に従って)制限酵素を熱失活します。手順 2.1.3 に進みます。
- 酵素が熱で失活できない場合は、80 μLの10% SDSを添加し、サンプルを65°Cで30分間インキュベートします。 次に、375 μLの20%トリトンX-100を加え、旋回させて混合します。サンプルを37°Cで1時間インキュベートし、ステップ2.2に進みます。
- クロマチンライゲーション
- サンプルを清潔な50 mLコニカルチューブに移し、サンプル量を分子グレードのH2Oで5.7 mLに調整し、旋回させて混合します。
- 700 μLの10x T4リガーゼバッファーを加え、スワーリングして混合します。
- 60 UのT4 DNAリガーゼを加え、渦巻きながら混合します。
- 16°Cで一晩インキュベートします。
4. 3日目
注:平均して、学部生がこれらの手順を完了するのに15〜30分かかります。一晩インキュベーションした後、サンプルを凍結することができます。
- タンパク質消化と逆架橋
- 3Cサンプルに30 μLのプロテイナーゼK(10 mg/mL)を加え、撹拌しながら65°Cで一晩インキュベートします。5 μLのプロテイナーゼK(10 mg/mL)を未消化および消化コントロールに加え、撹拌しながら65°Cで一晩インキュベートします。
5. 4日目
注:平均して、学部生がこれらの手順を完了するのに4〜5時間かかります。
- 3Cライブラリの精製
- 3Cサンプルに30 μLのRNase A(10 mg/mL)を加え、旋回させて混合します。サンプルを37°Cで45分間インキュベートします。
- サンプルにフェノール-クロロホルム7 mLを加え、振とうして混合します。
注意: フェノール-クロロホルムは皮膚や目の刺激性であり、接触を治療しないと火傷を引き起こす可能性があります。フェノール-クロロホルムは、適切な目の保護具と手袋(ニトリル)を備えたドラフトで使用する必要があります。 - サンプルをRTで3,270 × g で15分間遠心分離します。 水相を回収し、清潔な50 mLコニカルチューブに移します。等量のクロロホルムを加え、振とうしてサンプルを混合します。
- サンプルをRTで3,270 × g で15分間遠心分離します。 水相を回収し、清潔な50 mLコニカルチューブに移します。7.5 mLの分子グレードH2O、35 mLの100%エタノール、および(オプションで)7 μLのグリコーゲン(1 mg / mL)を追加します。振とうして混合し、サンプルが凍結するまで-80°Cでインキュベートします。
注意: サンプルが凍結するまでに1時間以上かかる場合があります。プロトコルはここで一時停止できます。- 3Cサンプルが凍結している間に、コントロールサンプルを精製します。コントロールサンプルに、分子グレードの水を使用して容量を500 μLに調整し、チューブをフリックして2 μLのRNase A(10 mg / mL)ミックスを追加します。
- チューブの底でサンプルを収集するために短時間回転します。サンプルを37°Cで45分間インキュベートします。
- 対照試料に、フェノール-クロロホルム1mLを加え、チューブを振って混合する。サンプルをRTで3,270 × g で15分間遠心分離します。 コントロールの水相を収集し、清潔な1.5 mLマイクロ遠心チューブに入れます。
- 等量のクロロホルムを加え、振とうしてサンプルを混合します。サンプルをRTで3,270 × g で15分間遠心分離します。 コントロールの水相を採取し、清潔な1.5 mLマイクロ遠心チューブに入れます。
- 1 mLの100%エタノールと2 μLのグリコーゲン(1 mg / mL)を追加します。振とうして混合し、-80°Cで30分間インキュベートします。
- サンプルを4°Cで3,270 × g で15分間遠心分離します。 上清を取り除き、冷やした70%エタノール750μLを加える。
- サンプルを4°Cで3,270 × g で10分間遠心分離します。 上清を除去し、サンプルを風乾します。ペレットを50 μLの分子グレードH2Oに再懸濁します。 凍結するか、ステップ6に進みます。
- サンプルを4°Cで3,270 × g で60分間遠心分離します。 上清を取り除き、冷やした70%エタノール10mLを加える。サンプルを振って混合することにより、DNAペレットを破壊して破壊します。
- サンプルを3,270 × g 、4°Cで30分間遠心分離します。 上清を取り除き、サンプルをRTで部分的に風乾させます。 上下にピペッティングして、ペレットを150 μLの10 mM Tris-HCl(pH 7.5)に再懸濁します。これが「3Cライブラリ」です。
注:サンプルを凍結するか、分析を続行します。
6. 5日目
注:平均して、学部生がこれらの手順を完了するのに1〜2時間かかります。
- コントロールプライマーの検量線を用いたサンプル品質の決定
- 3CサンプルとすべてのコントロールのDNA濃度を定量し、サンプルを30 μg/μLに調整します(濃度が許せば)。サンプルを2倍に4倍に希釈し、各サンプルに対して5回希釈します(1x、0.5x、0.25x、0.125x、0.0625x)。
注:定量が簡単にできない場合は、上記のようにサンプルを段階的に希釈して続行します。 - コントロールプライマーを使用して、希釈サンプルごとに3C、ゲノムコントロール、および消化コントロールのPCR反応を設定します:1 μLのDNA、10 μLの5x反応バッファー、1 μLの10 mM dNTP、1 μLの10 mMコントロールプライマー(順方向および逆方向の混合)、1 μLのTaqポリメラーゼ、および36 μLの水。
- PCRマシンに固有のソフトウェアの指示に従って、次のようにサイクリング条件を使用して標準曲線PCRプログラムをセットアップします:98°Cで30秒。98°Cで5秒、60°Cで5秒、72°Cで10秒の30サイクル。72°Cで1分間;4°Cホールド。
- ソフトウェアを使用して、サンプルの標準曲線を生成します。ソフトウェアが曲線を生成した後、PCR効率とR2 値に注意してください。
- 3CサンプルとすべてのコントロールのDNA濃度を定量し、サンプルを30 μg/μLに調整します(濃度が許せば)。サンプルを2倍に4倍に希釈し、各サンプルに対して5回希釈します(1x、0.5x、0.25x、0.125x、0.0625x)。
- DNA濃度の決定
- 3CサンプルのDNA濃度を決定するには、サンプルを既知の濃度のゲノムDNAサンプルと比較します。サンプルを30 ng/μLに希釈し、ゲノムコントロールを10 ng/μLから0.01 ng/μLまで2段階で段階的に希釈して、検量線を作成します。
注:定量が簡単にできない場合は、サンプルを1:10に希釈して続行します。 - コントロールプライマーを使用して、希釈サンプルごとに3C、ゲノムコントロール、および消化コントロールのPCR反応を設定します:1 μLのDNA、10 μLの5x反応バッファー、1 μLの10 mM dNTP、1 μLの10 mMコントロールプライマー(順方向および逆方向混合)、1 μLのTaqポリメラーゼ、および36 μLの水。
- PCRマシン専用のソフトウェアの指示に従って、次のようにサイクリング条件を使用して標準曲線PCRプログラムをセットアップします:98°Cで30秒。98°Cで5秒、60°Cで5秒、72°Cで10秒の30サイクル。72°Cで1分間;4°Cホールド。
- ソフトウェアを使用して、サンプルの標準曲線を生成し、3Cサンプルを曲線上にプロットします。3Cサンプルの存在量の位置を、既知の濃度のゲノムDNAの反応によって作成された標準曲線と比較し、3Cサンプルを30 ng / μLに調整します。
- 3CサンプルのDNA濃度を決定するには、サンプルを既知の濃度のゲノムDNAサンプルと比較します。サンプルを30 ng/μLに希釈し、ゲノムコントロールを10 ng/μLから0.01 ng/μLまで2段階で段階的に希釈して、検量線を作成します。
- クロマチン相互作用の有無の判定
- 30 ng の 3C サンプル、ゲノムコントロールサンプル、および消化コントロールサンプル (1 μL の DNA、10 μL の 5x 反応バッファー、1 μL の 10 mM dNTP、1 μL の 10 mM プライマー (順方向および逆方向混合)、1 μL の Taq ポリメラーゼ、および 36 μL の水) を使用して qPCR 反応を設定します。
注:反応は、コントロールプライマー、個々のゲノム遺伝子座のテストプライマー、およびクロマチン相互作用を決定するために使用されるテストプライマーの所望の組み合わせ(サイト「a」フォワードとサイト「b」リバース)を使用して設定する必要があります(図3)。 - PCRマシンのソフトウェアの指示に従って、PCRプログラムを次のようにセットアップします:98°Cで30秒。98°Cで5秒、60°Cで5秒、72°Cで10秒の40サイクル。72°Cで1分間;4°Cホールド。
- PCRを実行した後、増幅プロットを調べます。PCR反応が指数関数的な増幅を示し、サイクルごとに2倍になるようにします。
注:指数増幅を示さない反応は、それ以上分析することはできません。 - PCRマシンのソフトウェアの指示に従って、qPCR実験の閾値を定義します。
- すべてのサンプルのCt値をエクスポートします。
- 式(1)を用いて、未消化コントロール(UC)および消化コントロール(DC)サンプルからのテストプライマー(TP)およびコントロールプライマー(CP)Ct値を用いて消化効率を決定する。
消化率 = 100 -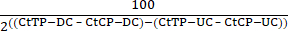 (1)
(1) - これらの値は80%-90%消化の範囲にあるべきです。これらの値を記録します(図4A)。
- 式(2)を使用して、テストプライマーの組み合わせ(TPC)とコントロールプライマー(CP)を使用して、未消化コントロール(UC)および3C(3C)サンプルからのCt値を使用して、相対的なクロマチン相互作用を決定します。
クロマチン相互作用 = 100 -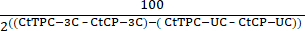 (2)
(2) - 各サンプルの値を、各テストプライマーの組み合わせの棒グラフにプロットします。
- 3Cサンプルのシグナルをコントロールサンプルと比較して、3Cサンプルがコントロールサンプル上で特定のクロマチン相互作用を豊富に含んでいるかどうかを判断します。コントロール上で濃縮を示す3Cサンプルは、条件付きで陽性と見なすことができ、サンガーシーケンシングを使用した検証が必要です(図4B)。
注:グラフデータを分析する際には、「コントロールテンプレート」を使用しない限り(議論を参照)、反応間の存在量(すなわち、あるプライマーセットから次のプライマーセットへ)を比較することはできないことを覚えておくことが重要です。
- 30 ng の 3C サンプル、ゲノムコントロールサンプル、および消化コントロールサンプル (1 μL の DNA、10 μL の 5x 反応バッファー、1 μL の 10 mM dNTP、1 μL の 10 mM プライマー (順方向および逆方向混合)、1 μL の Taq ポリメラーゼ、および 36 μL の水) を使用して qPCR 反応を設定します。
- 3C製品の識別
- PCR産物を1.5%アガロースゲル上で分析します。
- UVライトボックスまたはゲルドキュメンテーションシステムを使用して、PCR産物の正しいサイズのゲルを視覚化します。
注:適切に構築された3Cライブラリには多様なDNA断片が含まれており、プライマーの特異性に関する以前の検証にもかかわらず、3CライブラリからのPCR反応には多くのバンドが含まれる可能性があります(図5A)。これは、3Cライブラリの分析を妨げるものではありません。 - 予想されるフラグメントサイズに対応する産物バンドを切除し、市販キットまたは以下に概説する自家製のプロトコルの指示に従ってPCR産物のゲル抽出を実行します。
注意: UV光は既知の発がん性物質であり、UV光にさらされる時間を制限するように細心の注意を払う必要があります。耐紫外線性の目の保護具、標本シールド、手袋、および白衣を着用する必要があります。- 自家製の精製カートリッジを構築するには、0.5 mLチューブの底に針で穴を開けます。
- コットンボールから0.5 mLチューブの底に少量の綿を詰め、チューブの半分以下を満たします。
- 0.5 mLチューブを1.5 mLチューブに入れます。小さい方のチューブが、チューブ内ではなく、大きい方のチューブのリップにあることを確認してください。
- ゲル片を慎重に細かく切り、カートリッジの0.5 mLチューブに入れます。
- アセンブリを-20°Cの冷凍庫に5分間入れます。アセンブリをRTで13,000 × g で3分間回転させます。
- 抽出したDNAを入れた1.5 mLチューブをバッファーに保持し、アガロース破片を含む0.5 mLチューブを廃棄します。
- 精製されたDNAは、3Cフラグメントのフォワードプライマーおよびリバースプライマーを使用してサンガーシーケンシングに送ることができます。
- Blatを用いたクロマチン接触の同定
- シーケンシングが完了したら、サンプルがシーケンシングレポートに示されている品質管理基準を満たしているかどうかを判断します。
- QC に合格した配列の場合は、別のプラスミドエディター (ApE) などのシーケンシング編集プログラムで .seq ファイルと .ab1 (trace) ファイルを開き、.ab1 ファイルで明確なベース呼び出しピークがないか調べ、.seq ファイルで誤って呼び出されたピークを編集します。
- 編集した .seq ファイルを使用して、DpnII サイトを検索します。シーケンスの結果によっては、これは報告されたシーケンスの途中にあるはずです。
- 配列が予想される標的配列であるかどうかを判断するには、DpnII部位と、3Cについて試験したゲノム遺伝子座のフォワードプライマーに対応する上流配列の追加の30〜50 bpを強調表示します。この配列のBlat検索を標的種に対して実行します。ゲノム遺伝子座がプライマーの遺伝子座と一致していることを確認してください。
- リバースプライマー配列に対して上記の手順を繰り返し、戻ってきたゲノム遺伝子座がリバースプライマーの遺伝子座と一致することを確認します。
結果
この手順では、1つの実験的3Cサンプルと2つの対照サンプル(未消化および消化)が生成されます。これら3つのサンプルを用いて、qPCRを実施した。これらの結果から、消化効率を算出し(式1)、記録した(表1)。これらの計算から、3Cサンプルは、テストされた7つのゲノム遺伝子座にわたって約88%の消化効率(表1の平均)を有すると決定された。
次に、遺伝子座特異的プライマー(表2)とqPCRの組み合わせを使用して、サンプルを異なるゲノム遺伝子座間の長距離クロマチン接触の存在についてテストしました。これらの結果を使用して、対照プライマーセットに対する生成物存在量を計算(式 2)し、比較のためにグラフ化しました(図4)。これらのデータは、10の反応のうち8つが長距離相互作用の条件付き陽性であることを示しました。
次に、PCR反応をアガロースゲル上で実行しました。8つの条件付き陽性反応と1つの陰性反応について予想されるPCR産物をゲル精製し、サンガーシーケンシングに送りました。代表的な陽性反応(青矢印、青ボックス)と陰性反応(赤矢印、赤ボックス)の結果を示します(図5)。
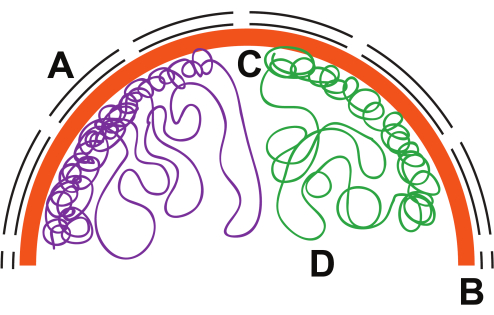
図1:核内の染色体構造。 核内の仮想的な染色体組織。(A)核エンベロープ、黒い線。(b)核ラミナ、オレンジ;(c)ヘテロクロマチン、圧縮系統;(D)ユークロマチン、ルーズループ。 この図の拡大版を表示するには、ここをクリックしてください。
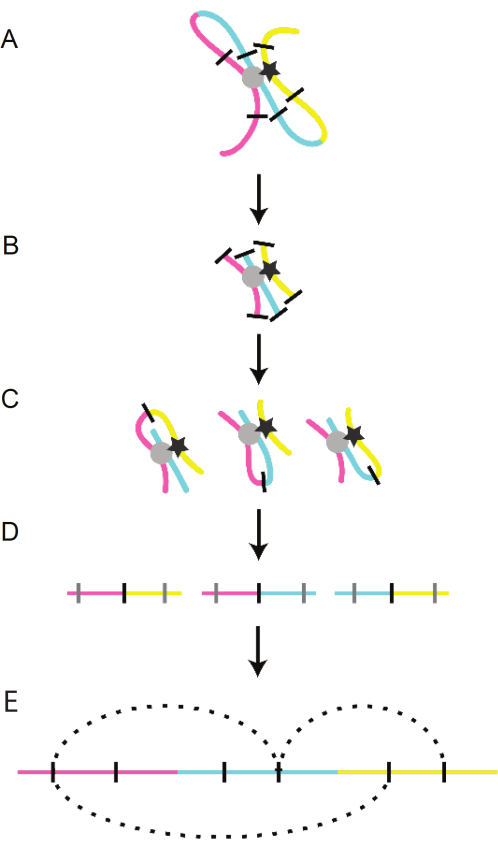
図2:3Cプロトコルの概略図。線状染色体の遠い部分(青、黄、ピンク)は、調節ループを介して核内で互いに接近します。(A)ループ構造は転写因子(灰色の円と黒い星)によって媒介されます。これらの相互作用は、化学的架橋によって維持されます。(B)ループは酵素消化によって切断されます(黒い線)。(C)離れたクロマチン片は、消化によって作られた固着端を通して一緒に結紮されます。(d)DNAがタンパク質から精製されている。(E)断片内の配列が同定され、ゲノムにマッピングされます。この図の拡大版を表示するには、ここをクリックしてください。
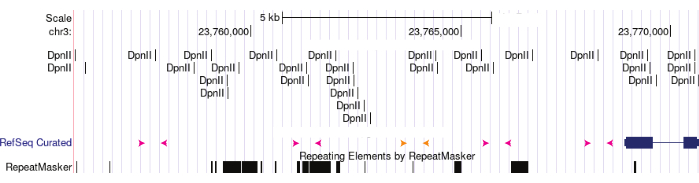
図3:3Cプライマースキーム。 3Cプライマーは、目的のゲノム位置からさまざまな距離にある制限部位を中心に設計されています。ピンク色の矢印は、DpnII部位を囲む実験用プライマーセットを表す。実験用プライマーを混合してマッチングさせ、その領域のクロマチンループを評価することができます。オレンジ色のプライマーは、DpnII部位を持たない陰性対照を表す。 この図の拡大版を表示するには、ここをクリックしてください。
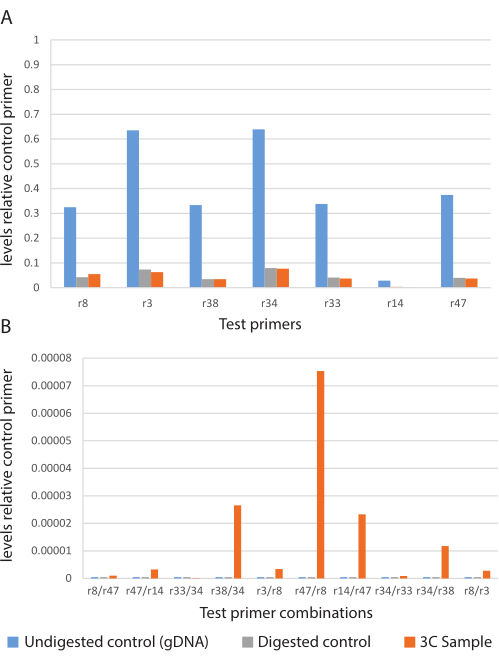
図4:3C実験の代表的なqPCRデータ。 3Cテストプライマーセットの相対的な存在量。(A)未消化コントロール(青)、消化コントロール(灰色)、および3Cサンプル(オレンジ)における生成物の相対存在量を示すコントロールグラフ。(b)前記3C実験;未消化コントロール(青)、消化コントロール(灰色)、および3Cサンプル(オレンジ)におけるテストプライマーの組み合わせからの生成物の相対存在量。 この図の拡大版を表示するには、ここをクリックしてください。
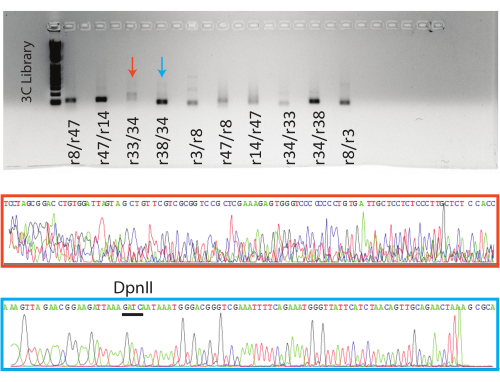
図5:3C qPCR産物の可視化。 一番上に、示されたサンプルを含むqPCRエンドポイント製品でゲル化します。下段に、示された反応についての代表的なサンガー配列トレースファイル。オレンジ色のサンプルは偽陽性の例であり( 図4、 r38/34を参照)、青色のサンプルは、トレースの上にDpnII部位が示されている真陽性の例です。 この図の拡大版を表示するには、ここをクリックしてください。
| 敷地 | %消化 |
| R8 | 86.98 |
| R3 | 88.44 |
| R38 | 89.64 |
| R34 | 87.55 |
| R33 | 87.85 |
| R14 | 86.97 |
| R47 | 89.45 |
表1:計算された消化効率。
| 名前 | 順序 | ゲノム遺伝子座 | ||
| r3 FWD | ACGCAAGTAAAATTGGTTTTTGACC | chrX:11361475 | ||
| r3 RVS | TTTCCTGAGCTCTTAACCATGTTTGC | chrX:11361561 | ||
| r38 FWD | TTACTTCTGAAGTAATTTTTTTCCCC | chrX:5859700 | ||
| r38 RVS | アガガグクガ | chrX:5859775 | ||
| r34 FWD | ATTTGTGGATTGCGTGGAGAGAGG | chrX:5429702 | ||
| r34 RVS | AATAATCCTCTTAACAAACGTGGCC | chrX:5429777 | ||
| r33 FWD | AAGAGTTGTCCAAAATAAATTGAGCTAAC | chrX:6296704 | ||
| r33 RVS | TTCAGAAAAGTAAACTTTGACTTGGAACG | chrX:6296807 | ||
| r14 FWD | AATTATCGATTTTTCCATCGCGCAG | chrX:8036367 | ||
| r14 RVS | ATTTCAATGAAAATGTAAAATTCCTTCTCTCTCTCT | chrX:8036427 | ||
| r47 FWD | ATCTAGACTTGATAATATTGTGTGTCCTC | chrX:9464939 | ||
| r47 RVS | AAGTTCTGCAACTGTTAGATGAATAACAC | chrX:9465064 | ||
| r8 FWD | GAGAATGTGTGTGTGTTAACTGAAAACTTG | chrX:11094257 | ||
| r8 RVS | TTACGAAATTTGGTTTTGGACC | chrX:11094362 | ||
| コントロールプライマーFWD | CAATCGTCTCGCTCACTTGTC | chrX:7608049 | ||
| コントロールプライマー RVS | GATGTGAGCACAAGGCACC | chrX:7608166 | ||
表2:代表的な3C実験のためのプライマー。
ディスカッション
3Cは、基本的な分子技術に根ざした強力な技術です。3Cを学部生で使用するのに非常に興味深い手法にしているのは、この基本的なツールの基盤です。近年、クロマチン動態をこのように広範囲に観測する研究が数多く行われているため、これらの結果を用いて、単一の遺伝子またはゲノム領域に関する焦点を絞った実験を考案することは、学部研究においてユニークで影響力のある実験を生み出す可能性を秘めています。多くの場合、このような実験は学部生には高度すぎると考えられていますが、慎重に計画すれば、簡単に達成できます。3Cライブラリによって捕捉されたクロマチン結合をプローブするように設計されたアッセイは、半定量的エンドポイントPCRから全ゲノムシーケンシングまでさまざまであることに注意することが重要です。実際、最初の3C論文16 からのデータはqPCRから生成された。この幅広いアッセイは、すべての3C技術が同じ製品(核内の3D結合を表すDNA断片のライブラリ)を生成するため、すべて使用できます。
ここに提示されるのは、学部生の研究者により適した、より柔軟で収容可能なプロトコルの適応です。上記の一時停止期間は、夜間の遅延を意味します。ただし、これらの一時停止は週末にまたがり、細胞や核の場合は数週間続く可能性があります。最も重要な考慮事項は、作業がいつ完了するかです。多くの場合、プロトコルでは、一時停止がオプションではない場合、時間に敏感な手順があります。いくつかのポイント(1日目と2日目)以外に、サンプルを停止して凍結する場所がたくさんあります。これらは、ラボ作業のスケジュールとタイミングを柔軟にする必要がある学部生と協力する場合に重要です。これらのストップをプロトコルにエンジニアリングすることに加えて、学部生はペアまたは3人または4人の小グループで作業することが奨励されています。このプロトコルでは、生徒がお互いをサポートし、バディシステムを作成して全員が安全に作業できるため、グループはうまく機能します。ラボワークも、他の人が関わるともっと楽しくなります。グループを使用すると、学生は同じプロトコルを実行しながら、クロマチンの構成に焦点を当てたさまざまな質問に取り組むこともできます。したがって、学生が別々のプロジェクトに取り組んでいる間でさえ、プロトコルは彼らの努力を結びつけます、そしてこれのために、彼らはお互いをサポートすることができます。
他の適応は、特定の特殊なツールや機器が必ずしもすべての学部機関にあるとは限らないという事実を回避することを目的としています。これらの機器には、qPCRサーモサイクラー、ゲルドキュメンテーションシステム、およびナノ体積分析計が含まれますが、これらに限定されません。確かに、これらの機器は便利ですが、必須ではありません。ここで、3Cの古典的な方法は、プライマー設計部分でも説明されています。これには、目的のゲノム遺伝子座を特定し、そこから、さらに離れたクロマチン接触点について他のゲノム遺伝子座を評価することが含まれます。この手法は、既知の陽性(接続)および負(非接続)遺伝子座が識別されるHi-Cを使用するデータセットなど、公開されたデータセットを使用する場合にもうまく機能します。これらの公開データセットを使用して実験を設計することは、クロマチン結合の同定が成功する可能性が通常高いため、教育ラボへのもう一つの大きな適応です。また、研究論文は授業で議論し、参考にすることができます。
このプロトコルは、修正qPCRアプローチを使用して、3C産物の形成を視覚化します。コントロールは、3C技術の成功に不可欠です。各実験では、サンプルコントロールとプライマーコントロールの両方を使用して、3C手順の完了を判断します。サンプルコントロールには、未消化コントロール(ゲノムDNA)および消化コントロールが含まれます。未消化コントロールは、プライマーセットのベースラインシグナルを決定し、消化効率を決定するために架橋消化コントロールとともに使用され、制限部位を横切るプライマーの生成物の低下が予想される。この値を未消化のコントロールと比較すると、サンプルがどれだけよく消化されたかがわかります。
PCR用のプライマーとしては、コントロールプライマーおよびテストプライマーが挙げられる。コントロールプライマーは、アッセイ対象のゲノム領域の近くにあり、制限部位を含まないプライマーセットです。これは、テストプライマーPCR産物の存在量を決定するためのベースラインを提供します。テストプライマーは、目的の特定のゲノム遺伝子座の制限部位に隣接するフォワードプライマーおよびリバースプライマーです(図3)。これらのプライマーセットを使用した反応を比較して消化効率を決定し、制限部位が切断された場合に生成物の存在量が低下するはずです。クロマチン組織を決定する際には、ある遺伝子座からの1つのテストプライマーを異なるゲノム遺伝子座からの別のテストプライマーとペアにして、これら2つの遺伝子座が3D空間で互いに近接しているかどうかを判断します。その場合、PCR産物は3Cサンプルをテンプレートとして使用してのみ見つかることが期待されます。
バリデーションされたプライマーでさえ失敗する傾向があることに注意することが重要です(図4:r14プライマーセット)。さらに、PCR産物は、対照反応およびクロマチン結合が予測されない反応(ライゲーションされていないため消化された対照など)で頻繁に同定されます。これらのインスタンスはシーケンスされ、サンガーQCに失敗するか、定義されたシーケンスなしで戻ります(図5)。さらに、従来の3C実験では、架橋、消化、ライゲーションされていないDNAサンプルである「コントロールテンプレート」が生成され、一定量のDNAで生成できるすべてのライゲーションフラグメントを表します。「コントロールテンプレート」は、2つのゲノム遺伝子座間でqPCRシグナルの強度を比較して、シグナルが真の相互作用を表すのか、それとも単なるランダムな関連を表すのかを判断する上で重要な役割を果たします。アッセイ対象のクロマチンの大部分を人工染色体の形で捕捉し、3Cサンプルと一緒に処理する必要があるため、「コントロールテンプレート」の作成には問題があります。そのような構造を確保することは実行不可能である可能性があり、それを作成することは学期プロジェクトの範囲外である可能性があります。これらの困難のため、コントロールプライマーの使用をお勧めします。コントロール入門書は、「コントロールテンプレート」のすべての機能を置き換えるものではありませんが、データを分析して「存在」または「不在」の判断を行う機会を提供します。
qPCRを行う場合は、等量のサンプルを使用することが重要です。これは、ナノドロップなどのナノ分光光度計を使用する場合でも、既知の濃度のゲノムDNAから標準曲線を生成し、3Cサンプルをその線に適合させることによって決定する必要があります。これらの金額は記録し、その後のPCRで使用する必要があります。PCR反応の質も重要です。PCRがqPCRで実行されると、生成物の存在量が蛍光を使用して測定され、記録されます。この記録は、増幅プロットでアクセスできます。プログラムが終了したら、増幅プロットをチェックし、反応(テンプレートなしコントロールを除く)にベースライン、指数、プラトー/飽和フェーズの3つのフェーズがあることを確認することが重要です。特に閾値を設定するために、反応が指数関数的位相を有することを確認することは重要である(下記参照)。さらに、連続希釈サンプルの場合、サンプルの希釈と一致するCt値のシフトが必要です(最高濃度は最も低いCt値を持ち、最も低い濃度は最高のCt値を持ちます)。増幅プロットにこの変化を反映していないサンプルは、新しい希釈を必要とするか、3Cサンプル形成に関するより大きな問題を示しています。最後に、検量線を生成する間、PCRソフトウェアはPCR効率とR2 値を計算します。PCR効率は90%より大きくなければならず、R2 値は0.99より大きくなければならない。これらの条件のいずれかが満たされない場合は、サンプルまたはPCRプライマーに問題がある可能性があります。
qPCR後、消化率および3C相互作用の存在は、各反応のqPCRを用いて計算することができる。これらを決定するには、まずPCR反応の閾値を設定する必要があります。これは通常、qPCRマシンに付属のソフトウェアを使用して行われます。閾値を設定すると、サンプルCt値の比較に使用されるPCR産物の濃度が定義されます。閾値は、増幅の指数関数的段階におけるPCR反応の増幅曲線を二等分する必要があります。指数関数的増幅を伴うPCR反応(この場合、コントロールプライマーとテストプライマー反応)のみが比較でき、これは反応が同じ速度でDNAを増幅し、忠実に比較できることを確認する唯一の方法であるためです。3Cグラフを分析すると、条件付き陽性反応は、対照サンプル、ゲノム制御、および消化制御よりも多くの生成物を有するものとして識別されます(図4B)。ただし、これらのサンプルは、PCR産物のゲル精製に続いてサンガーシーケンシングを使用してさらに検証する必要があります。
サンガーシーケンシング後、QCに合格したサンプルはBlatを使用して分析できます。この分析の目的は、サンプルが制限部位に隣接する両方の標的ゲノム遺伝子座(このプロトコルの場合はDpnII)の配列を持っているかどうかを判断することです。両方の配列が同定された場合、3Cフラグメントはバリデーション済みと見なすことができる。Blatの結果が期待される配列を返さない場合、これは一方または両方のプライマーが最適ではなく、偽陽性のqPCR結果をもたらすことを示している可能性があります。偽陽性サンプルのトレース ファイルには未定義のベース ピークがあり、Seq レポートにはほとんど "n" 個のベース コールが含まれます。
サンガーバリデーションは、人工PCR産物形成による偽陽性の可能性があるため、不可欠です。これらの偽陽性は、シーケンシング産物が期待される標的配列または適切な3Cフラグメントに特徴的なDpnII部位を持たない場合に特定できます(図5)。PCRフラグメントのシーケンシングは、実験のための別のデータポイントも提供し、3C技術が核内の3D空間に集まっている遠隔のゲノム遺伝子座を識別していることを学生に思い出させます。
3C技術は、柔軟で簡単な手順で学部生に豊富な基礎分子技術を提供します。この3C技術は、次世代シーケンシング(NGS)を組み込んだ他の3C技術の出発点でもあります。これらのタイプの実験は、学部生をバイオインフォマティクスの重要な側面にさらすことができ、ここで概説されている基本原則に根ざしています。学部での経験と関与は、若い科学者としての成功と発展の鍵です。これらの機会を提供することで、学部生は基本的な原則の理解を深めながら、最先端の技術や質問に取り組む自信を築くことができます。
開示事項
著者は利益相反を宣言しません。
謝辞
この作業は、助成金番号P20GM103430の国立衛生研究所の国立総合医学研究所のロードアイランド機関開発賞(IDeA)ネットワークオブバイオメディカルリサーチエクセレンスとブライアント健康行動科学センターによって部分的にサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| 37% Formaldehyde | Millapore-Sigma | F8775 | |
| 100% Ethanol | Millapore-Sigma | E7023 | |
| CaCl2 | MP Biomedical | 215350280 | |
| chloroform | Millapore-Sigma | C0549 | |
| cOmplete, EDTA-free Protease Inhibitor Cocktail | Millapore-Sigma | COEDTAF-RO | mixed to 50x in water. Diluted to 1x in Sucrose buffer and GB buffer fresh |
| Dithiothreitol (DTT) | Millapore-Sigma | D0632 | 1 M stock diluted to 500 µM in Sucrose buffer and GB buffer fresh |
| DpnII | NEB | R0543M | |
| Glycerol | Millapore-Sigma | G9012 | |
| glycine | Millapore-Sigma | G8898 | |
| glycogen | Millapore-Sigma | 10901393001 | |
| HEPES | Millapore-Sigma | H3375 | |
| KCl | Millapore-Sigma | P3911 | |
| KH2PO4 | Millapore-Sigma | P5655 | |
| methyl green pyronin | Millapore-Sigma | HT70116 | |
| MgAc2 | Thermoscientific | 1222530 | |
| Na2HPO4 | Millapore-Sigma | S5136 | |
| NaCl | Millapore-Sigma | S9888 | |
| phenol-chloroform | Millapore-Sigma | P3803 | |
| Pronase | Millapore-Sigma | 11459643001 | |
| Proteinase K | IBI Scientific | IB05406 | |
| qPCR Ready mix (Phire Taq etc) | Millapore-Sigma | KCQS07 | |
| RNase A | Millapore-Sigma | R6148 | |
| Sodium Acetate | Millapore-Sigma | S2889 | |
| sodium dodecyl sulfate (SDS) | Millapore-Sigma | L3771 | |
| Sucrose | Millapore-Sigma | S0389 | |
| T4 DNA Ligase | Promega | M1804 | |
| Tris-HCl | Millapore-Sigma | 108319 | |
| Triton X-100 | Millapore-Sigma | T9284 | |
| Trypsin-EDTA | Millapore-Sigma | T4049 |
参考文献
- McBryant, S. J., Adams, V. H., Hansen, J. C. Chromatin architectural proteins. Chromosome Research. 14 (1), 39-51 (2006).
- Nalabothula, N., et al. The chromatin architectural proteins HMGD1 and H1 bind reciprocally and have opposite effects on chromatin structure and gene regulation. BMC Genomics. 15, 92 (2014).
- John, S., et al. Chromatin accessibility pre-determines glucocorticoid receptor binding patterns. Nature Genetics. 43 (3), 264-268 (2011).
- Fawcett, D. W. On the occurrence of a fibrous lamina on the inner aspect of the nuclear envelope in certain cells of vertebrates. The American Journal of Anatomy. 119 (1), 129-145 (1966).
- Reddy, K. L., Zullo, J. M., Bertolino, E., Singh, H. Transcriptional repression mediated by repositioning of genes to the nuclear lamina. Nature. 452 (7184), 243-247 (2008).
- Finlan, L. E., et al. Recruitment to the nuclear periphery can alter expression of genes in human cells. PLoS Genetics. 4 (3), e1000039 (2008).
- Chambeyron, S., Da Silva, N. R., Lawson, K. A., Bickmore, W. A. Nuclear re-organisation of the Hoxb complex during mouse embryonic development. Development. 132 (9), 2215-2223 (2005).
- Chambeyron, S., Bickmore, W. A. Chromatin decondensation and nuclear reorganization of the HoxB locus upon induction of transcription. Genes and Development. 18 (10), 1119-1130 (2004).
- Mahy, N. L., Perry, P. E., Gilchrist, S., Baldock, R. A., Bickmore, W. A. Spatial organization of active and inactive genes and noncoding DNA within chromosome territories. The Journal of Cell Biology. 157 (4), 579-589 (2002).
- Mahy, N. L., Perry, P. E., Bickmore, W. A. Gene density and transcription influence the localization of chromatin outside of chromosome territories detectable by FISH. The Journal of Cell Biology. 159 (5), 753-763 (2002).
- Li, B., Carey, M., Workman, J. L. The role of chromatin during transcription. Cell. 128 (4), 707-719 (2007).
- Chen, A., Chen, D., Chen, Y. Advances of DNase-seq for mapping active gene regulatory elements across the genome in animals. Gene. 667, 83-94 (2018).
- Hughes, A. L., Rando, O. J. Mechanisms underlying nucleosome positioning in vivo. Annual Review of Biophysics. 43, 41-63 (2014).
- Weiner, A., Hughes, A., Yassour, M., Rando, O. J., Friedman, N. High-resolution nucleosome mapping reveals transcription-dependent promoter packaging. Genome Research. 20 (1), 90-100 (2010).
- Hughes, A. L., Jin, Y., Rando, O. J., Struhl, K. A functional evolutionary approach to identify determinants of nucleosome positioning: A unifying model for establishing the genome-wide pattern. Molecular Cell. 48 (1), 5-15 (2012).
- Dekker, J., Rippe, K., Dekker, M., Kleckner, N. Capturing chromosome conformation. Science. 295 (5558), 1306-1311 (2002).
- van Berkum, N. L., Dekker, J. Determining spatial chromatin organization of large genomic regions using 5C technology. Methods in Molecular Biology. 567, 189-213 (2009).
- Smith, E. M., Lajoie, B. R., Jain, G., Dekker, J. Invariant TAD boundaries constrain cell-type-specific looping interactions between promoters and distal elements around the CFTR locus. American Journal of Human Genetics. 98 (1), 185-201 (2016).
- Crane, E. E. Two inputs into C. elegans dosage compensation: Chromosome conformation and the miRNA-specific argonaute ALG-2. University of California, Berkeley. , (2012).
- Bell, A. C., West, A. G., Felsenfeld, G. The protein CTCF is required for the enhancer blocking activity of vertebrate insulators. Cell. 98 (3), 387-396 (1999).
- Cuadrado, A., et al. Specific contributions of cohesin-SA1 and cohesin-SA2 to TADs and polycomb domains in embryonic stem cells. Cell Reports. 27 (12), 3500-3510 (2019).
- Sarro, R., et al. Disrupting the three-dimensional regulatory topology of the Pitx1 locus results in overtly normal development. Development. 145 (7), (2018).
- Tolhuis, B., et al. Interactions among polycomb domains are guided by chromosome architecture. PLoS Genetics. 7 (3), e1001343 (2011).
- Splinter, E., de Wit, E., van de Werken, H. J. G., Klous, P., de Laat, W. Determining long-range chromatin interactions for selected genomic sites using 4C-seq technology: From fixation to computation. Methods. 58 (3), 221-230 (2012).
- Fernández-Miñán, A., Bessa, J., Tena, J. J., Gómez-Skarmeta, J. L. Chapter 21 - Assay for transposase-accessible chromatin and circularized chromosome conformation capture, two methods to explore the regulatory landscapes of genes in zebrafish. Methods in Cell Biology. 135, 413-430 (2016).
- Dekker, J. The three "C" s of chromosome conformation capture: controls, controls, controls. Nature Methods. 3 (1), 17-21 (2006).
- Hagège, H., et al. Quantitative analysis of chromosome conformation capture assays (3C-qPCR). Nature Protocols. 2 (7), 1722-1733 (2007).
- Lajoie, B. R., van Berkum, N. L., Sanyal, A., Dekker, J. My5C: Webtools for chromosome conformation capture studies. Nature Methods. 6 (10), 690-691 (2009).
- Han, M., Wei, G., McManus, C. E., Hillier, L. W., Reinke, V. Isolated C. elegans germ nuclei exhibit distinct genomic profiles of histone modification and gene expression. BMC Genomics. 20 (1), 500 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved