このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
腫瘍スフェロイドモデルにおける抗体依存性細胞傷害性の定量化:創薬への応用
要約
本稿では、抗腫瘍抗体の重要ながん細胞死滅機構であるADCC機構を調節する化合物を同定する方法について紹介する。NK細胞の細胞毒性効果は、トラスツズマブの存在下で乳がん細胞スフェロイドで測定されます。画像解析により、スフェロイドの生細胞と死細胞、および標的細胞が同定されます。
要約
腫瘍抗原を標的とするモノクローナル抗体を用いた免疫療法は、今やがん治療の主力となっています。抗体の臨床的に関連する作用機序の1つは、抗体依存性細胞傷害性(ADCC)であり、抗体はがん細胞に結合し、免疫系の細胞成分(ナチュラルキラー(NK)細胞など)に関与して腫瘍細胞を殺します。これらの治療法の有効性は、がん細胞の感受性や免疫細胞の効力を高めるアジュバント化合物を特定することで改善できる可能性があります。さらに、以前の状態またはがん関連症状に対して併用療法を受けたがん患者における未発見の薬物相互作用が、抗体療法の成功を決定する可能性があります。したがって、このような望ましくない薬物相互作用を排除する必要があります。これらの目標を念頭に置いて、がんADCCモデルを作成し、ADCC調節薬を見つけるための簡単なプロトコルをここに記述します。がん細胞スフェロイドなどの3Dモデルは、抗がん剤治療に対する腫瘍の in vivo 応答の予測において2D培養よりも優れているため、EGFPを発現するHER2+ JIMT-1乳がん細胞とNK92のスフェロイド共培養。CD16細胞株をセットアップし、HER2陽性乳がんに対して臨床的に承認されたモノクローナル抗体であるトラスツズマブで誘導しました。JIMT-1 スフェロイドは、細胞を撥水する U 底 96 ウェルプレートで形成しました。3日目に、NK細胞とトラスツズマブを添加した。次に、スフェロイドをアネキシンV-Alexa 647で染色してアポトーシス細胞死を測定し、自動顕微鏡でスフェロイドの末梢領域を定量しました。転移性癌に対してFDAによって承認された受容体チロシンキナーゼ阻害剤であるスニチニブがADCCをほぼ完全に廃止することを示すことによって、ADCC調節分子を同定するための私たちのアッセイの適用性が実証されています。スフェロイドの生成と画像取得および解析パイプラインは、がん細胞スフェロイド中のADCC調節化合物のハイスループットスクリーニングに対応しています。
概要
多細胞腫瘍スフェロイド(MCTS)は、接着細胞が凝集する傾向があるために形成される広く使用されている3次元(3D)モデルであり、がん細胞の生物学に関するメカニズムの洞察を得るための重要なツールです。これらは、液体ベースおよび足場ベースの3D培養1などの多数の技術によって、幅広い細胞タイプから生成できます。単層2Dモデルに対する主な利点は、腫瘍細胞の生物学的挙動、特に治療的逃避と薬剤耐性につながるメカニズムを模倣することにより、 in vivo 腫瘍の主な特徴、すなわち構造構成と低酸素状態を再現することです2。このように、MCTSは毒性と薬剤感受性の予測可能性を向上させることができるため、がんを3Dで研究するために広く使用されており、さまざまな種類のがんに有効な薬剤の開発を促進する可能性があります3。
あらゆる疾患を研究するには、関連性のある便利なモデルが決定的に必要です。がん免疫学研究のモデルを設定することは、免疫系が複数の細胞タイプで構成されているため、困難です。各細胞タイプには、いくつかのサブタイプと幅広い活性化状態があります。これらの異なる種類の免疫細胞は、がん細胞やその他の腫瘍成分と相互作用し、最終的に病気の転帰に影響を与えます。2D in vitro 細胞培養法では、翻訳可能性がなく、システムレベル(組織内など)で薬物の作用を予測できないため、これらの複雑な細胞間相互作用を再現できません4,5。さらに、マウスモデルには、ヒトとマウスの免疫系の根本的な違いにより、厳しい制限があります。したがって、3D培養システムは、現在利用可能なモデルのギャップを埋めることができ、代替方法を提供し、がん免疫学の理解を深めることができます6。具体的には、スフェロイドモデルは、免疫療法の試験に使用され、主に、スフェロイド標的に対する免疫細胞浸潤および抗腫瘍効果を増強するための薬物スクリーニングおよび治療用抗体の効率を評価するために使用される可能性がある7。さらに、間質細胞(リンパ球、マクロファージ、線維芽細胞など)とがん細胞との相互作用を研究し、新しい抗がん戦略を開発するための、さまざまな代謝および増殖状態の細胞で構成されるMCTSの可能性が十分に実証されています8。したがって、腫瘍微小環境の病態生理学を考慮して、薬物検査プロセスを強化するために、予測的で正確なプラットフォームを裏付けることが不可欠です。
乳がん(BC)は、世界中で女性で最も頻繁に診断されるがんです。この不均一性疾患の臨床分類は、エストロゲン(ER)およびプロゲステロン(PR)受容体(総称してホルモン受容体、HRと呼ばれる)などの膜貫通型受容体の存在と、ヒト上皮成長因子受容体2(HER2)タンパク質/がん遺伝子の過剰発現または増幅に基づいています。これらの受容体の免疫組織化学的発現に基づいて、管腔A(HR+/HER2-)、管腔B(HR+/HER2+)、HER2陽性(HR-/HER2+)、トリプルネガティブ乳がん(HR-/HER2-)の4つのサブタイプが一般的に認識されています。HER2+群はBC症例の10〜15%を占め、ERおよびPRが欠如し、管腔腫瘍と比較して予後が悪く、HER2 /neuタンパク質に対する特異的薬剤を必要とするという特徴があります9。
BCの発症は多段階のプロセスであり、早期診断は病気の治療を成功させるために不可欠です10。しかし、最近、個別化されたBC治療の選択肢(内分泌および抗HER2抗体療法など)が出現したにもかかわらず、BCは腫瘍医に挑戦し続けています。手術、化学療法、放射線療法と同様に、これらの個別化治療も重篤な副作用をもたらす可能性があり、患者はこれらの薬剤に対する耐性を発達させる可能性があるため、最善の戦略を決定することは長期的な課題となっています11,12。したがって、腫瘍とその微小環境の間の相互作用の理解を深めることは不可欠であり、さまざまなBCサブタイプの特異性を考慮に入れた新しい治療法の開発に新たな方向性を提供することが期待されています13。抗体薬物複合体、養子T細胞療法、ワクチン、新規HER2標的モノクローナル抗体(mAb)などの免疫療法の新しい波が、HER2発現腫瘍の幅広い患者集団で研究されています14。
例えば、トラスツズマブは、HER2+ BCの効率的な治療法です。トラスツズマブは、その作用機序の一部として、フラグメント結晶化性ガンマ受容体(FcγR)依存性活性を媒介します。FcγRは、Fcフラグメントに対する親和性と、Fcフラグメントが開始する免疫応答によって区別されます。ナチュラルキラー(NK)細胞のFcγRIIIa(CD16A)の活性化は、抗体依存性細胞傷害性(ADCC)の媒介に不可欠であり、マクロファージのFcγRIIa(CD32A)とFcγRIIIaの活性化は、抗体依存性細胞食作用(ADCP)を誘導する15。動物モデルを用いた研究では、FcγRI(CD64)およびFcγRIII(CD16)受容体を欠損したマウスは、腫瘍特異的抗原に対する防御免疫応答を開始できないことが示され、ADCCがモノクローナル抗体トラスツズマブ16の主要な作用機序である可能性が高いことが明らかになりました。
NK細胞はADCCによるがん細胞の死滅のために腫瘍細胞結合型Absに頼るため、Fc受容体の発現はトラスツズマブ17 による効率的な治療に不可欠です(図1)。さらに、それらの作用は、活性化および抑制性受容体、例えばキラー細胞免疫グロブリン様(KIR)受容体の刺激によって効率的にバランスがとれる18。
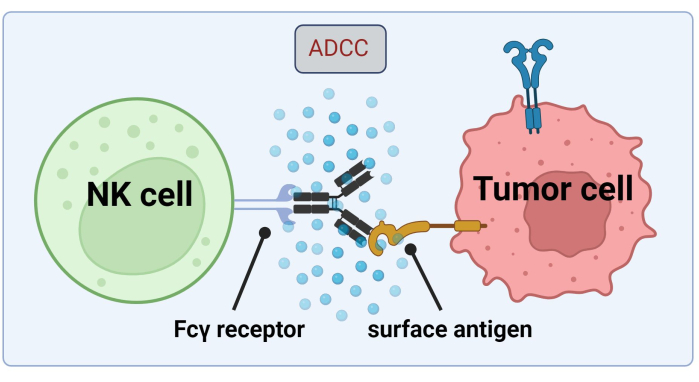
図 1.抗腫瘍反応におけるADCCのメカニズム。 ナチュラルキラー(NK)細胞のFcγ受容体は、がん細胞の表面抗原に結合していた抗体のFc領域を認識します。この免疫学的シナプスは、NK細胞の脱顆粒につながり、グランザイムやパーフォリンなどの細胞傷害性メディエーターを放出します。これらの分子は、細胞膜の細孔形成に寄与し、アポトーシス経路を活性化して、標的細胞のプログラムされた細胞死を引き起こします( Biorender.com で作成された画像)。 この図の拡大版をご覧になるには、ここをクリックしてください。
HER2+ BCの免疫療法開発は、発展途上の分野です。この場合、免疫系のさまざまな構成要素間の相互作用を考慮する必要があります。さらに、以前の出版物では、相乗効果のある組み合わせを特定するために、あらゆる種類の従来の治療法、免疫療法、または細胞療法を含む併用療法が広範囲にテストされています19。
HER2+ BCのいくつかの3Dモデルは、これまでに創薬に使用されてきました。例えば、Balalaevaらは、HER2を過剰発現するSKBR-3スフェロイドを使用して、HER2標的免疫毒素4D5scFv-PE40の細胞毒性を評価しました20。別の研究では、トラスツズマブおよび内分泌剤に応答する細胞増殖を測定するために、3DマトリゲルベースのHER2+ BC培養システムが確立されました21。これらの研究は、治療反応を臨床的に改善するための効果的な戦略を表す上で、HER2過剰発現がん細胞の腫瘍スフェロイドモデルの重要性を強調しています22。
私たちのグループは、マルチターゲットチロシンキナーゼ阻害剤であるスニチニブを、2D培養アッセイでJIMT-1 HER2+ BC細胞のトラスツズマブ依存性ADCCの阻害剤として同定しました。この研究により、スニチニブはオートファジーを誘導し、NK細胞の殺傷機能を損ない、HER2発現をダウンレギュレートし、JIMT-1細胞の表面接着を増強することが明らかになりました17。
本研究では、ハイスループットスクリーニングアプリケーションに用いる新規3DスフェロイドADCCモデル(NK.92.CD16+トラスツズマブ+JIMT-1-EGFPがん細胞)を確立し、上記の知見を検証するために、スニチニブをモデル化合物として使用しました。まず、JIMT-1細胞17 を発現するEGFPを作製し、これらの細胞からスフェロイドを増殖させた。ADCCはトラスツズマブとともにNK細胞によって誘導され、スフェロイドは試験化合物の存在下または非存在下で24時間培養されました(図2)。ADCCの定量は、ハイコンテント分析システムを用いたアポトーシスがん細胞死の検出(アネキシンV染色)に基づいています。
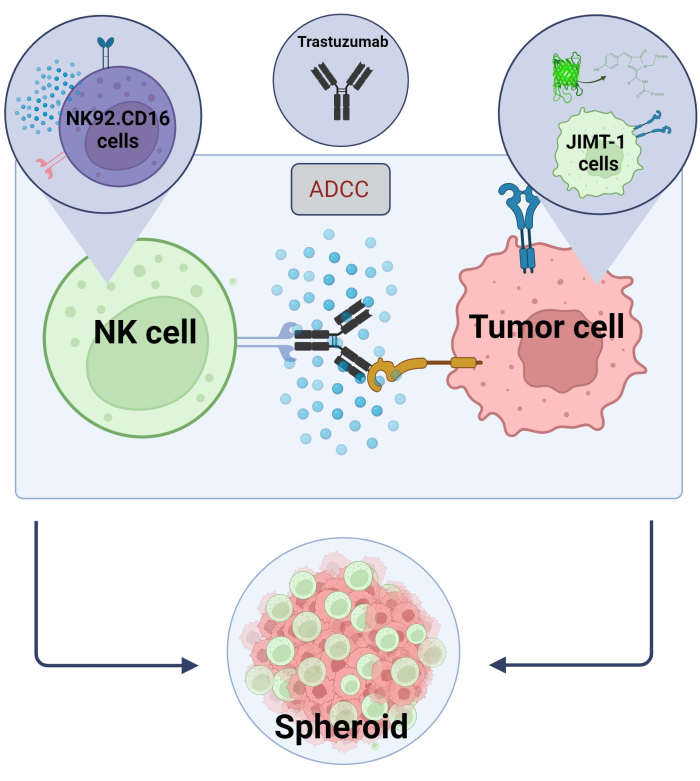
図 2.3Dスフェロイド共培養システムにおけるADCC。 私たちの実験設定は、2Dモデルと比較してin vivo 微小環境をより正確にモデル化できる3D回転楕円体システムに基づいています。JIMT-1 EGFP乳がん細胞を凹状の細胞忌避剤の底部に播種し、スフェロイドと呼ばれる丸い形の細胞クラスターを形成しました。次に、NK92を添加してADCCを開始しました。CD16ナチュラルキラー細胞(E:T比=20:1)および抗HER2モノクローナル抗体、トラスツズマブ。この実験モデルは、ADCC修飾試験化合物( Biorender.com で作成した画像)の同定に効率的で容易に適用できることが証明されています。 この図の拡大版をご覧になるには、ここをクリックしてください。
この方法でデータを取得できることは、リアルタイムに行うことができ、がん創薬におけるハイコンテントスクリーニングに用いるために統計的に頑健であることを実証しました。重要なことは、このモデルにより、より多くの化合物の広範なバリデーションが可能になり、関心のある複数のアッセイに適用できることです。
プロトコル
1. JIMT-1-enhanced fluorescent protein(EGFP)スフェロイドモデルのセットアップ
- U字型の撥細胞底を形成するには、96ウェルプレートを0.5%アガロース-PBS溶液(30 μL/ウェル)でコーティングします。プレートを室温で約30〜45分間インキュベートします。
- JIMT-1-EGFP細胞を2mLの滅菌PBSで2回洗浄する(JIMT1-EGFP細胞株の生成は以前の出版物17で報告されている)。細胞培養には、T25組織培養フラスコとJIMT-1培地(20%ウシ胎児血清(FBS)、0.3 U/mLインスリン(100 IU/mL、フムリンR)、および1%ペニシリン-ストレプトマイシンを添加したDMEM/F-12培地)を使用します。
- フラスコに2 mLのトリプシン-EDTAを加え、CO2 インキュベーターで10分間インキュベートします。
- フラスコをタップして、インキュベーション時間後にJIMT-1細胞が剥離したかどうかを確認します。
- 2 mLのJIMT-1培地を使用して消化を停止し、細胞懸濁液を15 mLのチューブに回収します。
- 0.4%トリパンブルー(色素80 μL + 細胞懸濁液20 μL)でビュルカーチャンバー内の細胞をカウントし、細胞数を20,000細胞/mLに調整します。
- 100 μL の細胞懸濁液(2000 細胞/ウェル)を 96 ウェルプレートの各ウェルにピペットで移します(1.1 に示すように 0.5% アガロース-PBS 溶液でプレコート)。
- CO2インキュベーターで37°Cで3日間のインキュベーション時間中に細胞を凝集させます。
- 倒立顕微鏡で回転楕円体のサイズと形状を定期的にチェックしてください。
2. HCSプレートのコーティング
注:プレートのガラス表面に JIMT-1-EGFP スフェロイドが付着するのを防ぐには、ハイコンテントスクリーニング(HCS)プレートのコーティングが重要です(そうしないと、ハイコンテント分析が不可能になります)。
- スフェロイド導入後3日目に、96ウェルハイコンテントスクリーニングプレートをPluronic-F127(DMSO中0.5%、50 μL/ウェル)でコーティングし、プレートを室温で45分間インキュベートします。
- コーティング液を吸引し、DMEM/F-12-無血清培地(100 μL/ウェル)でウェルを2回洗浄します。
3. HCSプレートへのスフェロイドの転写
- 1 mL のピペットを使用して、スフェロイドを 3 回に分けてガラス底 96 ウェル HCS プレートに移します。
4. JIMT-1 EGFPスフェロイドの試験化合物による前処理
- 10 μL/ウェルをピペッティングして試験化合物(例:DMSOで40 μMの濃度に希釈したスニチニブ)を添加し、10 μLの新鮮なJIMT-1培地をコントロール(CTL)ウェルに加えます。
- プレートをCO2 インキュベーターで37°Cで1時間インキュベートします。
5. エフェクターセルの添加によるADCCの誘導
注:CD16.176V.NK92細胞(以下、NK細胞と呼ぶ)を、20%FBS、1%MEM-NEAA、1%Na-ピルビン酸、1%グルタミン、1%ペニシリン-ストレプトマイシン、および100IU/mLのIL-2を添加したα-MEMで培養した。
- フラスコ内のNK細胞を15 mLチューブに集めます。トリパンブルー(色素80 μL + 細胞懸濁液20 μL)で細胞をカウントし、細胞密度をエフェクターとターゲット(E:T)の比率(40,000 NK細胞/ウェル)に調整します。
- NK細胞を10 μM Cell Tracker Blue(CTB、1 mLのα-MEM NK培地に1 μL)染色し、37°CのCO2 インキュベーターに1時間入れます。
- NK細胞を150 x g で室温で3分間2回遠心分離し、1 mLのα-MEM培地で余分な色素を洗浄します。
- NK細胞ペレットを1 mLの新鮮なJIMT-1培地に再懸濁します。
- JIMT-1培地に55 μL/ウェルのCTB染色NK細胞および55 μL/ウェルの10 μg/mL Abをピペッティングすることにより、染色したNK細胞を抗HER2抗体(Ab)(トラスツズマブ、滅菌蒸留H2Oに溶解)とともに、染色したNK細胞を標的のJIMT-1スフェロイドに加えます(ADCCに添加された処理の総量は110 μL/ウェル、最終スニチニブ濃度は20 μM)。
注:Ab濃度とE:T比の選択については、以前の出版物17に依存しました。スフェロイドにおけるADCCの誘導に最も効果的であるかを評価するために、異なるE:T比および濃度のトラスツズマブを用いて予備実験を実施しました(補足図S1)。 - 110 μL/ウェルの新鮮なJIMT-1培地をコントロール(CTL)ウェルに添加します。
- プレートを 37 °C の CO2 インキュベーターで 24 時間インキュベートします。
注:NK92細胞は非特異的な細胞傷害性機能を発揮することが知られているため、コントロールには、NK細胞単独およびアイソタイプコントロールまたはF(ab')2 Abの両方と共インキュベートしたJIMT-1細胞を使用します。ここでは、F(ab')2-トラスツズマブ(TR-F(ab')2)を陰性CTLとして使用しました。TR-F(ab')2 フラグメントは、Tóthら19 によって報告されたように調製され、5.5に記載されているように、NK細胞とともにトラスツズマブと同じ容量で添加されました。濃度は、トラスツズマブ23 の等モル濃度に相当する 6.6 μg/mL に調整しました。
6. スフェロイドのアネキシンV-647染色
- アポトーシス細胞死を測定するには、スフェロイドをAnnexin V-Alexa Fluor 647コンジュゲートでJIMT-1培地(1:100)中で50 μL/ウェルのピペッティングにより1時間染色します。
7. イメージング
注:プレートは、標的細胞にNKエフェクター細胞を添加してから24時間後にイメージングされます。イメージングには、ハイコンテントアナライザーと画像解析ソフトウェアが使用されます。
- プレートタイプ(Plate Type)オプションを使用して、プレートのリストからマイクロプレートのタイプを選択します。96ウェルハイコンテントスクリーニング(HCS)プレートを使用します。
- アッセイは、0.3開口数(NA)の10倍対物レンズのプレートで、 オートフォーカス と 対物レンズ のオプションをそれぞれ使用して行うため、2つのピークオートフォーカスを選択します。 Opt. Mode オプションで共焦点モードを選択し、 Bining オプションを使用してBinning 2を適用します。
- スフェロイドをイメージングする場合は、 チャンネル選択 オプションを使用して適切なチャンネルを選択します。EGFP形質導入JIMT-1細胞の検出にはEGFP(積分時間200ms、レーザー出力50%、スタック高さ2.0μm、例:488 nm em:500-550 nm)を選択し、アポトーシス細胞の検出にはAlexa 647(積分時間100 ms、レーザー出力50%、スタック高さ10.0 μm、例:640 nm em:650-760 nm)を使用します。スフェロイド内のNK細胞を可視化するには、DAPI(積分時間100 ms、レーザー出力50%、スタック高さ2.0 μm、例:405 nm em:435-480 nm)チャネルを選択します。
- [レイアウトの選択]オプションでは、スフェロイド内の細胞が顕微鏡の異なる焦点面上にある傾向があるため、Zスタックを選択します。10面(距離10μm)で回転楕円体領域全体をカバーするのに十分です。最初の平面と最後の平面の値をそれぞれ0μmと90μmに設定します。
注意: 測定を開始する前に、スナップショット機能でサンプル画像を撮影して、正しい設定を確認できます。 - Define Layoutオプションを使用して、イメージング用のウェルとフィールドの数を設定します。
8. ハイコンテント分析(HCA)
注意: Harmonyソフトウェアで画像を解析するか、好みのサードパーティソフトウェアを使用して画像をエクスポートして分析します。ADCC効率の分析では、アネキシンV 647の蛍光強度を測定します。ADCCによって死滅した標的細胞は、スフェロイドの末梢領域に現れます。したがって、アネキシンV陽性細胞は、このスフェロイド「リング」で測定されます。この方法を検証するために、異なるパラメータで分析を行い、どれが最も信頼性が高く、最良の結果が得られるかを評価しました(補足図S2)。ビデオでは、画像解析プロセスを段階的に示すために、ADCCウェルが示されています。
- Find Texture Regions オプションを使用して、JIMT-1細胞のEGFP蛍光によってスフェロイドを同定し、サイズ(> 25,000 μm2)でフィルターで除去します。
- [ 母集団を選択] オプションで境界オブジェクトを削除します。
- アネキシンV陽性(アポトーシス)細胞はスフェロイドの周辺に現れるため、領域 選択 オプション(外側境界-90%)で選択したこのアポトーシス「リング」のアネキシン強度を測定して、アポトーシス細胞死を決定します。
- アネキシンVの強度値を平均強度として表します。
結果
JIMT-1細胞を発現するEGFPを作製し、これらの細胞からスフェロイドを増殖させた。スニチニブは、ADCC17の経過に影響を与えることが以前に示されていたため、試験化合物として使用されました。スフェロイドを 72 時間凝集させました。3日目に、10μg/mLのトラスツズマブ(または等モル6.6μg/mL TR-F(ab')219)およびNK細胞(20:1)を、20μMのスニチニブ(1時間の前...
ディスカッション
過去数十年にわたってBCの治療が大幅に改善されたにもかかわらず、患者は依然として定期的に薬剤耐性を発症したり、否定的な副作用を経験したりしています24。BCに関連する高い罹患率と死亡率は、治療開発に実用的な新しい分子を特定するための堅牢なスクリーニングプラットフォームと同様に、根底にある分子メカニズムの継続的な調査を必要とします2...
開示事項
執筆者は、利益相反はないと宣言した。
謝辞
LVは、国立研究開発イノベーション局の助成金GINOP-2.3.2-15-2016-00010 TUMORDNS"、GINOP-2.3.2-15-2016-00048-STAYALIVE、OTKA K132193およびK147482から資金提供を受けました。このプロジェクトは、HUN-RENハンガリー研究ネットワークから資金提供を受けています。CD16.176V.NK-92細胞は、Dr. Kerry S. Campbell(Fox Chase Center, Philadelphia, PA, on behalf of Brink Biologics, lnc.San Diego, CA)は、世界中の特許によって保護されており、Nantkwest, lncによってライセンス供与されています。(www.nantkwest.com)。著者らは、NK-92細胞株とTR-F(ab')2の使用に関する支援と技術的なアドバイスをしてくれたGyörgy Vereb氏とÁrpád Szöőr氏に感謝しています。
資料
| Name | Company | Catalog Number | Comments |
| 96-well glass bottom Cell Carrier Ultra microplates | PerkinElmer, Waltham, MA, USA | LLC 6055302 | for spheroids measurements |
| 96-well tissue culture plates | TPP | 92096 | for cell seeding |
| α-MEM medium | Sigma | M8042 | in NK medium |
| Agarose | Sigma | A9539 | for spheroids seeding |
| Annexin V-Alexa Fluo 647 conjugate | Invitrogen-ThermoFisher Scientific | A23204 | for apoptosis measurement with HCS |
| CD16.176 V.NK-92 cells | Dr. Kerry S. Campbell (the Fox Chase Cancer Center, Philadelphia, PA on behalf of Brink Biologics, Inc. San Diego, CA) | ATCC CRL-2407 | for cell culture |
| Cell Tracker Blue | Invitrogen-Thermo Scientific, Waltham, MA, USA) | C2110 | for staining of NK cells |
| DMEM/F-12 medium | Sigma | D8437 | in JIMT1-EGFP medium |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | for coating HCS plate before transfering the spheroids |
| Fetal bovine serum (FBS) | Biosera | FB-1090/500 | JIMT-1-EGFP and NK medium |
| Glutamine | Gibco | 35,050–061 | in NK medium |
| GraphPad Prism 8.0.1 | GraphPad Software Inc., San Diego, CA, USA | for statistical analysis | |
| Harmony software | PerkinElmer, Waltham, MA, USA | for HCA | |
| IL-2 | Proleukin, Novartis Hungária Kft., Budapest, Hungary | PHC0026 | in NK medium |
| Insulin (Humulin R) | Eli Lilly | HI0219 | JIMT-1-EGFP medium |
| JIMT-1 breast cancer cells | for cell culture | ||
| MEM Non-essential Amino Acids (MEM-NEAA) | Gibco | 11,140–050 | in NK medium |
| Na-pyruvate | Lonza | BE13-115E | in NK medium |
| Opera Phenix High-Content Analysis equipment | PerkinElmer, Waltham, MA, USA | HH14001000 | for HCA |
| PBS (Posphate buffered saline) | Lonza | BE17-517Q | for washing the cells |
| Penicillin-Streptomycin | Biosera | LM-A4118 | JIMT-1-EGFP and NK medium |
| pLP-1, pLP-2, pLP-VSV-G, pWOXEGFP | Invitrogen, (Prof. József T zsér, University of Debrecen) zsér, University of Debrecen) | for JIMT-1-EGFP cell line | |
| Pluronic-F127 | Sigma | P2443 | for coating HCS plate before transfering the spheroids |
| Sunitinib malate | SigmaAldrich | PZ0012 | for treatments |
| Trastuzumab Ab (humanized anti-HER2 monoclonal antibody) | Herzuma®, EGIS Pharmaceuticals, Budapest, Hungary | NDC-63459-303-43 | for treatments |
| Trastuzumab-F(ab')2 | Gift from Prof. György Vereb and Árpád Szö r r | Department of Biophysics and Cell Biology, University of Debrecen | for treatments |
| Trypan blue 0.4% solution | Sigma | T8154 | for cell counting |
| Trypsin-EDTA 1X in PBS | Biosera | LM-T1706 | for cells detachment |
参考文献
- Jubelin, C., et al. Three-dimensional in vitro culture models in oncology research. Cell Biosci. 12 (1), 155 (2022).
- Mittler, F., et al. High-content monitoring of drug effects in a 3D spheroid model. Front Oncol. 7, 293 (2017).
- Badr-Eldin, S. M., Aldawsari, H. M., Kotta, S., Deb, P. K., Venugopala, K. N. Three-dimensional in vitro cell culture models for efficient drug discovery: Progress so far and future prospects. Pharmaceuticals (Basel). 15 (8), 926 (2022).
- Brancato, V., Oliveira, J. M., Correlo, V. M., Reis, R. L., Kundu, S. C. Could 3D models of cancer enhance drug screening. Biomaterials. 232, 119744 (2020).
- Pinto, B., Henriques, A. C., Silva, P. M. A., Bousbaa, H. Three-dimensional spheroids as in vitro preclinical models for cancer research. Pharmaceutics. 12 (12), 1186 (2020).
- Fitzgerald, A. A., Li, E., Weiner, L. M. 3D culture systems for exploring cancer immunology. Cancers (Basel). 13 (1), 56 (2020).
- Zanoni, M., et al. 3D tumor spheroid models for in vitro therapeutic screening: A systematic approach to enhance the biological relevance of data obtained. Sci Rep. 6, 19103 (2016).
- Boucherit, N., Gorvel, L., Olive, D. 3D tumor models and their use for the testing of immunotherapies. Front Immunol. 11, 603640 (2020).
- Li, Y., et al. Recent progress on immunotherapy for breast cancer: Tumor microenvironment, nanotechnology and more. Front Bioeng Biotechnol. 9, 680315 (2021).
- Lo Nigro, C., et al. NK-mediated antibody-dependent cell-mediated cytotoxicity in solid tumors: Biological evidence and clinical perspectives. Ann Transl Med. 7 (5), 105 (2019).
- Sun, Y. S., et al. Risk factors and preventions of breast cancer. Int J Biol Sci. 13 (11), 1387-1397 (2017).
- Liu, P. H., Wei, J. C., Wang, Y. H., Yeh, M. H. Female breast cancer incidence predisposing risk factors identification using nationwide big data: A matched nested case-control study in taiwan. BMC Cancer. 22 (1), 849 (2022).
- Burguin, A., Diorio, C., Durocher, F. Breast cancer treatments: Updates and new challenges. J Pers Med. 11 (8), 808 (2021).
- Costa, R. L. B., Czerniecki, B. J. Clinical development of immunotherapies for HER2(+) breast cancer: A review of HER2-directed monoclonal antibodies and beyond. NPJ Breast Cancer. 6, 10 (2020).
- Musolino, A., et al. Role of fcgamma receptors in HER2-targeted breast cancer therapy. J Immunother Cancer. 10 (1), e003171 (2022).
- Petricevic, B., et al. Trastuzumab mediates antibody-dependent cell-mediated cytotoxicity and phagocytosis to the same extent in both adjuvant and metastatic HER2/NEU breast cancer patients. J Transl Med. 11, 307 (2013).
- Guti, E., et al. The multitargeted receptor tyrosine kinase inhibitor sunitinib induces resistance of HER2 positive breast cancer cells to Trastuzumab-mediated ADCC. Cancer Immunol Immunother. 71 (9), 2151-2168 (2022).
- Barok, M., et al. Trastuzumab decreases the number of circulating and disseminated tumor cells despite Trastuzumab resistance of the primary tumor. Cancer Lett. 260 (1-2), 198-208 (2008).
- Toth, G., et al. The combination of Trastuzumab and Pertuzumab administered at approved doses may delay development of Trastuzumab resistance by additively enhancing antibody-dependent cell-mediated cytotoxicity. MAbs. 8 (7), 1361-1370 (2016).
- Ehlers, F. a. I., et al. ADCC-inducing antibody Trastuzumab and selection of KIR-HLA ligand mismatched donors enhance the NK cell anti-breast cancer response. Cancers (Basel). 13 (13), 3232 (2021).
- Gangadhara, S., Smith, C., Barrett-Lee, P., Hiscox, S. 3d culture of Her2+ breast cancer cells promotes AKT to MAPK switching and a loss of therapeutic response. BMC Cancer. 16, 345 (2016).
- Balalaeva, I. V., Sokolova, E. A., Puzhikhina, A. D., Brilkina, A. A., Deyev, S. M. Spheroids of Her2-positive breast adenocarcinoma for studying anticancer immunotoxins in vitro. Acta Naturae. 9 (1), 38-43 (2017).
- Selis, F., et al. Pegylated Trastuzumab fragments acquire an increased in vivo stability but show a largely reduced affinity for the target antigen. Int J Mol Sci. 17 (4), 491 (2016).
- Johnston, R. L., et al. High content screening application for cell-type specific behaviour in heterogeneous primary breast epithelial subpopulations. Breast Cancer Res. 18 (1), 18 (2016).
- Kandaswamy, C., Silva, L. M., Alexandre, L. A., Santos, J. M. High-content analysis of breast cancer using single-cell deep transfer learning. J Biomol Screen. 21 (3), 252-259 (2016).
- Esquer, H., Zhou, Q., Abraham, A. D., Labarbera, D. V. Advanced high-content-screening applications of clonogenicity in cancer. SLAS Discov. 25 (7), 734-743 (2020).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced Her2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved