Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Bir Tümör Sferoid Modelinde Antikora Bağımlı Hücresel Sitotoksisitenin Ölçülmesi: İlaç Keşfi Uygulaması
Bu Makalede
Özet
Burada, antitümör antikorların önemli bir kanser hücresi öldürme mekanizması olan ADCC mekanizmasını modüle eden bileşikleri tanımlamak için bir yöntem sunuyoruz. NK hücrelerinin sitotoksik etkisi, Trastuzumab varlığında meme kanseri hücre sferoidlerinde ölçülür. Görüntü analizi, sferoidlerdeki canlı ve ölü öldürücü ve hedef hücreleri tanımlar.
Özet
Tümör antijenlerini hedef alan monoklonal antikor bazlı immünoterapi artık kanser tedavisinin temel dayanağıdır. Antikorların klinik olarak ilgili etki mekanizmalarından biri, antikorun kanser hücrelerine bağlandığı ve tümör hücrelerini öldürmek için bağışıklık sisteminin hücresel bileşenini, örneğin doğal öldürücü (NK) hücreleri devreye soktuğu antikora bağımlı hücresel sitotoksisitedir (ADCC). Bu tedavilerin etkinliği, kanser hücrelerinin duyarlılığını veya bağışıklık hücrelerinin gücünü artıran adjuvan bileşiklerin tanımlanmasıyla geliştirilebilir. Ek olarak, önceki durumlar veya kanserle ilişkili semptomlar için birlikte ilaç verilen kanser hastalarında keşfedilmemiş ilaç etkileşimleri, antikor tedavisinin başarısını belirleyebilir; Bu nedenle, bu tür istenmeyen ilaç etkileşimlerinin ortadan kaldırılması gerekir. Bu hedefleri göz önünde bulundurarak, bir kanser ADCC modeli oluşturduk ve burada ADCC modüle edici ilaçları bulmak için basit bir protokol açıkladık. Kanser hücresi sferoidleri gibi 3D modeller, tümörlerin antikanser tedavilerine in vivo yanıtlarını tahmin etmede 2D kültürlerden daha üstün olduğundan, EGFP eksprese eden HER2 + JIMT-1 meme kanseri hücrelerinin ve NK92'nin sferoid ko-kültürleri. CD16 hücre hatları, HER2 pozitif meme kanserine karşı klinik olarak onaylanmış bir monoklonal antikor olan Trastuzumab ile kuruldu ve indüklendi. JIMT-1 sferoidlerinin hücre itici U-tabanlı 96 oyuklu plakalarda oluşmasına izin verildi. 3. günde, NK hücreleri ve Trastuzumab eklendi. Sferoidler daha sonra apoptotik hücre ölümünü ölçmek için Annexin V-Alexa 647 ile boyandı ve bu da sferoidlerin periferik bölgesinde otomatik bir mikroskopla ölçüldü. Testimizin ADCC modüle edici molekülleri tanımlamak için uygulanabilirliği, FDA tarafından metastatik kansere karşı onaylanan bir reseptör tirozin kinaz inhibitörü olan Sunitinib'in ADCC'yi neredeyse tamamen ortadan kaldırdığını göstererek gösterilmiştir. Sferoidlerin ve görüntü elde etme ve analiz boru hatlarının oluşturulması, kanser hücresi sferoidlerinde ADCC modüle edici bileşikler için yüksek verimli tarama ile uyumludur.
Giriş
Çok hücreli tümör sferoidleri (MCTS), yapışık hücrelerin kümelenme eğilimi nedeniyle oluşan, yaygın olarak kullanılan üç boyutlu (3D) modellerdir ve kanser hücresi biyolojisine mekanik içgörü kazandırmak için önemli bir aracı temsil eder. Sıvı bazlı ve iskele bazlı 3D kültürler gibi çok sayıda teknikle çok çeşitli hücre tiplerinden üretilebilirler1. Tek katmanlı 2D modellere göre en büyük avantajları, tümör hücrelerinin biyolojik davranışını, özellikle terapötik kaçışa ve ilaç direncine yol açan mekanizmaları taklit ederek in vivo tümörlerin temel özelliklerini, yani yapısal organizasyon ve hipoksiyi özetlemeleridir2. Bu nedenle, MCTS toksisite ve ilaç duyarlılığının öngörülebilirliğini artırabildiğinden, kanserleri 3D olarak incelemek için yaygın olarak kullanılırlar ve farklı kanser türleri için etkili ilaçların geliştirilmesini artırabilirler3.
Herhangi bir hastalığı incelemek için, ilgili ve uygun modellere kritik bir ihtiyaç vardır. Kanser immünolojisi çalışmaları için modeller oluşturmak zordur çünkü bağışıklık sistemi birden fazla hücre tipinden oluşur. Her hücre tipinin birkaç alt tipi ve geniş bir aktivasyon durumu yelpazesi vardır. Bu farklı bağışıklık hücresi tipleri, kanser hücreleri ve diğer tümör bileşenleri ile etkileşime girerek sonuçta hastalığın sonucunu etkiler. 2D in vitro hücre kültürü yöntemleri, çevrilebilirlikten yoksun oldukları ve bir ilacın sistem düzeyinde (örneğin dokularda) etkisini tahmin edemedikleri için bu karmaşık hücresel etkileşimleri özetlemekte başarısız olur4,5. Ayrıca, fare modelleri, insan ve fare bağışıklık sistemleri arasındaki temel farklılıklar nedeniyle ciddi sınırlamalara sahiptir. Bu nedenle, 3D kültür sistemleri, mevcut modellerdeki mevcut boşlukları doldurabilir, alternatif bir yöntem sağlayabilir ve kanser immünolojisi anlayışımızı geliştirebilir6. Spesifik olarak, sferoid modeller, immünoterapileri test etmek için, esas olarak immün hücre infiltrasyonunu ve sferoid hedeflere karşı anti-tümöral etkileri arttırmak için ilaç taramasının ve terapötik antikorların etkinliğini değerlendirmek için kullanılabilir7. Ayrıca, farklı metabolik ve proliferatif durumlardaki hücrelerden oluşan MCTS'nin stroma hücreleri (örneğin lenfositler, makrofajlar, fibroblastlar) ve kanser hücreleri arasındaki etkileşimleri inceleme ve yeni antikanser stratejilerinin geliştirilmesi için potansiyeli fazlasıyla gösterilmiştir8. Bu nedenle, tümör mikroçevresinin patofizyolojisini dikkate alarak, ilaç testi sürecini hızlandırmak için öngörücü ve doğru platformları desteklemek için hayati bir ihtiyaç vardır.
Meme kanseri (MK) tüm dünyada kadınlarda en sık teşhis edilen kanserdir. Bu heterojen hastalığın klinik sınıflandırması, transmembran reseptörlerinin varlığına dayanır., östrojen (ER) ve progesteron (PR) reseptörleri (topluca hormon reseptörleri, HR olarak adlandırılır) ve insan epidermal büyüme faktörü reseptörü 2 (HER2) proteininin aşırı ekspresyonu veya amplifikasyonu ile birlikte. Bu reseptörlerin immünohistokimyasal ekspresyonuna dayanarak, dört alt tip yaygın olarak tanınır: luminal A (HR+/HER2-), luminal B (HR+/HER2+), HER2-pozitif (HR-/HER2+) ve üçlü negatif meme kanseri (HR-/HER2-). HER2+ grubu, BC olgularının %10-15'ini oluşturur ve ER ve PR yokluğu ile yüksek HER2 ekspresyonu ile karakterizedir, luminal tümörlere kıyasla daha kötü prognoza sahiptir ve HER2/neu proteinine yönelik spesifik ilaçlar gerektirir9.
BC gelişimi çok aşamalı bir süreçtir ve hastalığın başarılı bir tedavisi için erken tanı şarttır10. Bununla birlikte, son zamanlarda ortaya çıkan kişiselleştirilmiş BC tedavi seçeneklerine (örneğin, endokrin ve anti-HER2 antikor tedavileri) rağmen, BC onkologları zorlamaya devam ediyor. Tıpkı cerrahi, kemoterapi ve radyoterapi gibi, bu kişiselleştirilmiş tedavilerin de ciddi yan etkileri olabilir ve hastalar bu ajanlara karşı direnç geliştirebilir, bu da en iyi stratejiyi belirlemeyi uzun vadeli bir zorluk haline getirir11,12. Bu nedenle, tümör ve mikroçevresi arasındaki etkileşimin daha iyi anlaşılması esastır ve farklı BC alt tiplerinin özelliklerini dikkate alan yeni tedavilerin geliştirilmesi için yeni yönler sağlaması beklenmektedir13. Antikor ilaç konjugatları, evlat edinen T hücresi tedavileri, aşılar ve yeni HER2'ye yönelik monoklonal antikorlar (mAb'ler) gibi yeni bir immünoterapi dalgası, HER2 eksprese eden tümörleri olan geniş bir hasta popülasyonunda incelenmektedir14.
Örneğin trastuzumab, HER2+ BC için etkili bir tedavi yöntemini temsil eder. Etki şeklinin bir parçası olarak, Trastuzumab, fragman kristalleşebilir gama reseptörüne (FcγR) bağlı aktivitelere aracılık eder. FcγR'ler, Fc fragmanına olan afiniteleri ve başlattıkları bağışıklık tepkisi ile ayırt edilir. Doğal öldürücü (NK) hücreler üzerinde FcγRIIIa'nın (CD16A) aktive edilmesi, antikora bağımlı hücresel sitotoksisiteye (ADCC) aracılık etmek için çok önemlidir, makrofajlarda FcγRIIa (CD32A) ve FcγRIIIa'yı tetiklemek antikora bağımlı hücresel fagositozu (ADCP) indükler15. Hayvan modelleri üzerinde yapılan çalışmalar, FcγRI (CD64) ve FcγRIII (CD16) reseptörlerinden yoksun farelerin, tümöre özgü antijenlere karşı koruyucu bağışıklık tepkileri başlatamadığını gösterdi ve bu da ADCC'nin muhtemelen mAb Trastuzumab16 için önemli bir etki mekanizması olduğunu ortaya koydu.
NK hücreleri, ADCC tarafından kanser hücresinin öldürülmesi için tümör hücresine bağlı Abs'ye başvurduğundan, Fc reseptörlerinin ekspresyonu Trastuzumab17 ile etkili bir tedavi için kritik öneme sahiptir (Şekil 1). Ayrıca, etkileri, aktive edici ve inhibitör reseptörlerin, örneğin Öldürücü hücreli immünoglobulin benzeri (KIR) reseptörlerin uyarılmasıyla verimli bir şekilde dengelenir18.
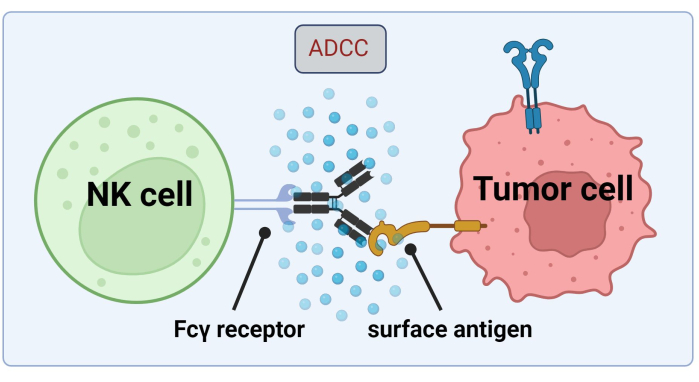
Şekil 1. Bir antitümör yanıtı bağlamında ADCC'nin mekanizması. Doğal öldürücü (NK) bir hücrenin Fcγ reseptörü, daha önce bir kanser hücresi üzerindeki bir yüzey antijenine bağlanmış olan bir antikorun Fc bölgesini tanır. Bu immünolojik sinaps, granzimler ve perforin gibi sitotoksik mediatörleri serbest bırakan NK hücresinin degranülasyonuna yol açar. Bu moleküller hücre zarında gözenek oluşumuna katkıda bulunur ve hedef hücrenin programlanmış hücre ölümüne neden olan apoptotik yolları aktive eder ( Biorender.com ile oluşturulan görüntü). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
HER2+ BC için immünoterapi geliştirme, gelişen bir alanı temsil etmektedir. Bu durumda, bağışıklık sisteminin çeşitli bileşenleri arasındaki etkileşimler göz önünde bulundurulmalıdır. Ayrıca, önceki yayınlar, sinerji yaratan kombinasyonları tanımlamak için her türlü geleneksel, immün veya hücre tedavisini içeren kombinasyon tedavilerini kapsamlı bir şekilde test etmiştir19.
HER2+ BC'nin birkaç 3D modeli daha önce ilaç keşfi için kullanılmıştır. Örneğin, Balalaeva ve ark. HER2 hedefli immünotoksin 4D5scFv-PE4020'nin sitotoksisitesini değerlendirmek için HER2'yi aşırı eksprese eden SKBR-3 sferoidlerini kullandılar. Başka bir çalışmada, Trastuzumab ve endokrin ajanlara yanıt olarak hücre büyümesini ölçmek için 3D Matrigel tabanlı bir HER2+ BC kültür sistemi kurulmuştur21. Bu çalışmalar, terapötik yanıtları klinik olarak iyileştirmek için etkili bir stratejiyi temsil etmede HER2 aşırı eksprese eden kanser hücrelerinin tümör sferoid modellerinin önemini vurgulamaktadır22.
Grubumuz daha önce çok hedefli bir tirozin kinaz inhibitörü olan Sunitinib'i, 2D kültür tahlilinde JIMT-1 HER2 + BC hücrelerinde Trastuzumab'a bağımlı ADCC'nin bir inhibitörü olarak tanımladı. Çalışma, Sunitinib'in otofajiyi indüklediğini ve NK hücrelerinin öldürme fonksiyonunu bozduğunu, HER2 ekspresyonunu aşağı regüle ettiğini ve JIMT-1 hücrelerinin yüzey bağlanmasını arttırdığınıortaya koydu 17.
Burada, yüksek verimli tarama uygulamaları için kullanılmak üzere yeni bir 3D, küresel ADCC modeli (NK.92.CD16 + Trastuzumab + JIMT-1-EGFP kanser hücreleri) oluşturduk ve yukarıda belirtilen bulguları doğrulamak için Sunitinib bir model bileşik olarak kullanıldı. İlk olarak, JIMT-1 hücrelerini17 eksprese eden EGFP ürettik ve bu hücrelerden sferoidler büyüttük. ADCC, Trastuzumab ile birlikte NK hücreleri tarafından indüklendi ve sferoidler, 24 saat boyunca test bileşiklerinin varlığında veya yokluğunda kültürde tutuldu (Şekil 2). ADCC'nin miktar tayini, bir Yüksek İçerik Analiz sistemi kullanılarak apoptotik kanser hücresi ölümünün (Annexin V boyama) saptanmasına dayanır.
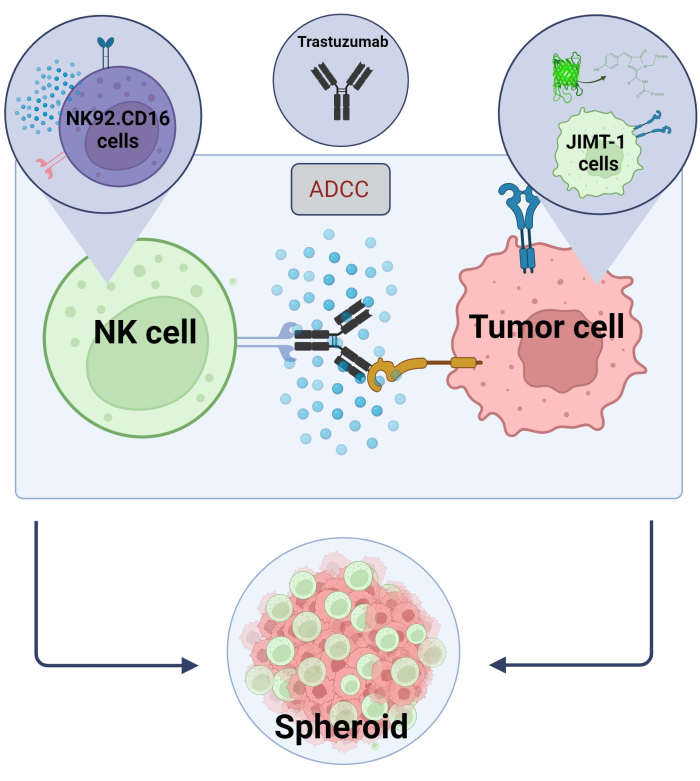
Şekil 2. 3D küresel ko-kültür sisteminde ADCC. Deneysel ayarlarımız, 2B modellere kıyasla in vivo mikro ortamı daha doğru bir şekilde modelleyebilen bir 3B küresel sisteme dayanmaktadır. JIMT-1 EGFP meme kanseri hücreleri, sferoid adı verilen yuvarlak şekilli bir hücresel küme oluşturmak için içbükey bir hücre kovucu tabana ekildi. ADCC daha sonra NK92 eklenerek başlatıldı. CD16 doğal öldürücü hücreler (E:T oranı = 20:1) ve bir anti-HER2 monoklonal antikoru olan Trastuzumab. Deneysel modelin, ADCC modifiye edici test bileşiklerinin tanımlanması için verimli ve kolayca uygulanabilir olduğu kanıtlanmıştır ( Biorender.com ile oluşturulan görüntü). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Bu şekilde veri elde etmenin gerçek zamanlı olarak yapılabileceğini ve kanser ilacı keşfinde yüksek içerikli taramada kullanım için istatistiksel olarak sağlam olduğunu gösterdik. Daha da önemlisi, bu model daha büyük bir bileşik setinin genişletilmiş bir doğrulamasına izin verir ve ilgilenilen birkaç tahlillere uygulanabilir.
Protokol
1. JIMT-1 ile geliştirilmiş floresan protein (EGFP) sferoid modelinin kurulması
- U şeklinde hücre itici bir taban oluşturmak için, 96 oyuklu plakayı %0.5 agaroz-PBS çözeltisi (30 μL/oyuk) ile kaplayın. Plakayı oda sıcaklığında yaklaşık 30-45 dakika inkübe edin.
- JIMT-1-EGFP hücrelerini 2 mL steril PBS ile iki kez yıkayın (JIMT1-EGFP hücre hattının oluşumu önceki bir yayındabildirilmiştir 17). Hücre kültürü için T25 doku kültürü şişeleri ve JIMT-1 ortamı (% 20 fetal sığır serumu (FBS), 0.3 U / mL insülin (100 IU / mL, Humulin R) ve% 1 penisilin-streptomisin ile desteklenmiş DMEM / F-12 ortamı) kullanın.
- Şişeye 2 mL tripsin-EDTA ekleyin ve bir CO2 inkübatörde 10 dakika inkübe edin.
- İnkübasyon süresinden sonra JIMT-1 hücrelerinin ayrılıp ayrılmadığını kontrol etmek için şişeye dokunun.
- Sindirimi durdurmak ve hücre süspansiyonunu 15 mL'lik bir tüpte toplamak için 2 mL JIMT-1 ortamı kullanın.
- %0.4 tripan mavisi (80 μL boya + 20 μL hücre süspansiyonu) içeren bir Bürker odasındaki hücreleri sayın ve hücre sayısını 20.000 hücre/mL olarak ayarlayın.
- 96 oyuklu plakanın her bir oyuğuna 100 μL hücre süspansiyonu (2000 hücre / kuyu) pipetleyin (1.1'de belirtildiği gibi% 0.5 agaroz-PBS çözeltisi ile önceden kaplanmış).
- Bir CO2 inkübatöründe 37 ° C'de 3 günlük bir inkübasyon süresi boyunca hücrelerin bir araya toplanmasına izin verin.
- Ters çevrilmiş bir mikroskopla sferoidlerin boyutunu ve şeklini düzenli olarak kontrol edin.
2. HCS plakasının kaplanması
NOT: JIMT-1-EGFP kürelerinin plakanın cam yüzeyine yapışmasını önlemek için, Yüksek İçerikli Tarama (HCS) plakasının kaplanması çok önemlidir (aksi takdirde yüksek içerik analizi mümkün olmazdı).
- Sferoidlerin indüksiyonundan sonraki 3. günde, 96 oyuklu yüksek içerikli eleme plakasını Pluronic-F127 (DMSO'da %0,5, 50 μL/kuyu) ile kaplayın ve plakayı oda sıcaklığında 45 dakika inkübe edin.
- Kaplama solüsyonunu aspire edin ve kuyucukları DMEM / F-12-serum içermeyen ortam (100 μL / kuyu) ile iki kez yıkayın.
3. Sferoidlerin HCS plakasına aktarılması
- 1 mL'lik bir pipet kullanarak, sferoidleri üç kopya halinde cam tabanlı 96 oyuklu HCS plakasına aktarın.
4. JIMT-1 EGFP sferoidlerinin test bileşikleri ile ön işlemi
- Test bileşiğini ekleyin (ör., 10 μL/kuyucuk pipetleyerek DMSO içinde 40 μM konsantrasyonda seyreltilmiş Sunitinib) ve kontrol (CTL) kuyucuklarına 10 μL taze JIMT-1 ortamı ekleyin.
- Plakayı 37 °C'de bir CO2 inkübatörde 1 saat inkübe edin.
5. Efektör hücrelerin eklenmesiyle ADCC'nin indüksiyonu
NOT: CD16.176V.NK92 hücreleri (bundan böyle NK hücreleri olarak anılacaktır),% 20 FBS,% 1 MEM-NEAA,% 1 Na-piruvat,% 1 glutamin,% 1 penisilin-streptomisin ve 100 IU / mL IL-2 ile takviye edilmiş α-MEM içinde kültürlenmiştir.
- Şişedeki NK hücrelerini 15 mL'lik bir tüpte toplayın. Tripan mavisi (80 μL boya + 20 μL hücre süspansiyonu) ile hücreleri sayın ve hücre yoğunluğunu 20: 1 efektör-hedef (E: T) oranına (40.000 NK hücre / kuyu) ayarlayın.
- NK hücrelerini 10 μM Cell Tracker Blue (CTB, 1 mL α-MEM NK ortamında 1 μL) ile boyayın ve 1 saat boyunca 37 °C'de bir CO2 inkübatörüne yerleştirin.
- Boyanın fazlalığını 1 mL α-MEM ortamı ile yıkamak için NK hücrelerini oda sıcaklığında 3 dakika boyunca 150 x g'da iki kez santrifüjleyin.
- NK hücre peletini 1 mL taze JIMT-1 ortamında yeniden süspanse edin.
- Boyanmış NK hücrelerini, anti-HER2 antikoru (Ab) (steril damıtılmış H2O içinde çözülmüş Trastuzumab) ile birlikte, 55 μL / CTB ile boyanmış NK hücreleri ve 55 μL / kuyu 10 μg / mL Ab'yi JIMT-1 ortamında pipetleyerek hedef JIMT-1 sferoidlerine ekleyin (ADCC için eklenen toplam tedavi hacmi 110 μL / kuyu ve nihai Sunitinib konsantrasyonu 20 μM'dir).
NOT: Ab konsantrasyonu ve E:T oranının seçimi için önceki yayınımız17'ye güvendik. Sferoidlerde ADCC'yi indüklemede hangisinin en etkili olduğunu değerlendirmek için farklı E: T oranları ve Trastuzumab konsantrasyonları ile ön deneyler yapıldı (Ek Şekil S1). - Kontrol (CTL) kuyularına 110 μL/kuyu taze JIMT-1 ortamı ekleyin.
- Plakayı 37 °C'de bir CO2 inkübatörde 24 saat inkübe edin.
NOT: NK92 hücrelerinin spesifik olmayan sitotoksik fonksiyonlar sergilediği bilindiğinden, kontrol için hem tek başına hem NK hücreleri hem de bir izotip kontrolü veya bir F(ab')2 Ab ile birlikte inkübe edilmiş JIMT-1 hücrelerini kullanın. Burada negatif CTL olarak F(ab')2-Trastuzumab (TR-F(ab')2) kullanıldı. TR-F(ab')2 fragmanı, Tóth ve ark.19 tarafından bildirildiği gibi hazırlandı ve 5.5'te tarif edildiği gibi NK hücreleri ile birlikte Trastuzumab ile aynı cilde eklendi. Konsantrasyon, Trastuzumab23 ile eşmolar konsantrasyona karşılık gelen 6.6 μg / mL'ye ayarlandı.
6. Annexin V-647 sferoidlerin boyanması
- Apoptotik hücre ölümünü ölçmek için, sferoidleri Annexin V-Alexa Fluor 647 konjugatı ile JIMT-1 ortamında (1:100) 50 μL/kuyucuk pipetleyerek 1 saat boyayın.
7. Görüntüleme
NOT: Plaka, NK efektör hücrelerinin hedef hücrelere eklenmesinden 24 saat sonra görüntülenir. Görüntüleme için bir Yüksek İçerik Analizörü ve bir görüntü analiz yazılımı kullanılır.
- Plaka Tipi seçeneğini kullanarak plaka listesinden mikroplaka tipini seçin. 96 oyuklu Yüksek İçerikli Tarama (HCS) plakası kullanın.
- Test, sırasıyla Otomatik Odaklama ve Objektif seçenekleri kullanılarak 0,3 sayısal açıklığa (NA) sahip 10x objektifli plakalarda gerçekleştirilirken İki Tepe otomatik netlemeyi seçin. Opt. Mod seçeneği ile konfokal modu seçin ve Gruplama seçeneğini kullanarak Binning 2'yi uygulayın.
- Görüntüleme sferoidleri için, Kanal Seçimi seçeneğini kullanarak uygun kanalları seçin. EGFP ile iletilen JIMT-1 hücrelerini tespit etmek için EGFP'yi seçin (entegrasyon süresi 200 ms, lazer gücü %50, yığın yüksekliği 2.0 μm; örn: 488 nm em: 500-550 nm) ve apoptotik hücreleri tespit etmek için Alexa 647 kullanın (entegrasyon süresi 100 ms, lazer gücü %50, yığın yüksekliği 10.0 μm; örn: 640 nm em: 650-760 nm). Küreler içindeki NK hücrelerini görselleştirmek için aşağıdaki kanalı seçin: DAPI (entegrasyon süresi 100 ms, lazer gücü %50, yığın yüksekliği 2.0 μm; örn: 405 nm em: 435-480 nm).
- Düzen Seçimi seçeneğinde, sferoidlerdeki hücreler mikroskobun farklı odak düzlemlerinde olma eğiliminde olduğundan Z-yığınlarını seçin. Tüm küresel bölgeyi kaplamak için 10 düzlem (10 μm mesafeli) yeterlidir. İlk düzlemin ve son düzlemin değerlerini sırasıyla 0 μm ve 90 μm olarak ayarlayın.
NOT: Ölçüme başlamadan önce, doğru ayarları kontrol etmek için anlık görüntü işleviyle örnek görüntüler çekilebilir. - Düzeni Tanımla seçeneğini kullanarak görüntüleme için kuyu ve alan sayısını ayarlayın.
8. Yüksek içerik analizi (HCA)
NOT: Görüntüleri Harmony yazılımıyla analiz edin veya tercih edilen bir üçüncü taraf yazılımı kullanarak analiz için görüntüleri dışa aktarın. ADCC verimliliğinin analizi için, Annexin V 647'nin floresan yoğunluğu ölçülür. ADCC tarafından öldürülen hedef hücreler, sferoidlerin periferik bölgesinde ortaya çıkar. Bu nedenle, Annexin V pozitif hücreler bu küresel "halkada" ölçülür. Bu yöntemi doğrulamak için, hangisinin en güvenilir olduğunu ve en iyi sonuçları verdiğini değerlendirmek için farklı parametrelerle analizler yapıldı (Ek Şekil S2). Görüntü analizi sürecini adım adım göstermek için videoda bir ADCC kuyusu gösterilmektedir.
- Doku Bölgelerini Bul seçeneğini kullanarak JIMT-1 hücrelerinin EGFP floresansına göre sferoidleri tanımlayın ve boyuta göre filtreleyin (> 25.000μm2).
- Kenarlık nesnelerini Nüfus Seç seçeneğiyle kaldırın.
- Annexin V pozitif (apoptotik) hücreler sferoidlerin çevresinde göründüğünden, apoptotik hücre ölümünü belirlemek için Bölge Seç seçeneği (dış sınır -% 90) ile seçilen bu apoptotik 'Halka'daki Annexin yoğunluğunu ölçün.
- Annexin V yoğunluk değerlerini ortalama yoğunluk olarak ifade edin.
Sonuçlar
EGFP eksprese eden JIMT-1 hücreleri üretildi ve bu hücrelerden sferoidler büyütüldü. Sunitinib, daha önce ADCC17'nin seyrini etkilediği gösterildiği için bir test bileşiği olarak kullanıldı. Sferoidlerin 72 saat boyunca kümelenmesine izin verildi. 3. günde, 10 μg/mL Trastuzumab (veya eşmolar 6.6 μg/mL TR-F(ab')219) ve NK hücreleri (20:1), 20 μM Sunitinib (1 saat ön tedavi) varlığında veya yokluğunda sferoidlere toplam 24 saat süreyle ...
Tartışmalar
Son birkaç on yılda BC tedavisinde önemli gelişmelere rağmen, hastalar hala düzenli olarak ilaç direnci geliştirmekte veya olumsuz yan etkiler yaşamaktadır24. BC ile bağlantılı yüksek morbidite ve mortalite, terapötik gelişim için eyleme geçirilebilecek yeni molekülleri tanımlamak için sağlam tarama platformları gibi, altta yatan moleküler mekanizmaların sürekli araştırılmasını gerektirir25. Bu stratejiler, hücre kültürüne dayalı translas...
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmemişlerdir.
Teşekkürler
LV, Ulusal Araştırma, Geliştirme ve İnovasyon Ofisi hibelerinden fon aldı GINOP-2.3.2-15-2016-00010 TUMORDNS", GINOP-2.3.2-15-2016-00048-STAYALIVE, OTKA K132193 ve K147482. Bu proje HUN-REN Macar Araştırma Ağı'ndan fon almıştır. CD16.176V.NK-92 hücreleri, Dr. Kerry S. Campbell'dan (Fox Chase Center, Philadelphia, PA, Brink Biologics, lnc. San Diego, CA), dünya çapında patentlerle korunmaktadır ve Nantkwest, lnc tarafından lisanslanmıştır. (www.nantkwest.com). Yazarlar, NK-92 hücre hattı ve TR-F(ab')2'nin kullanımındaki yardımları ve teknik tavsiyeleri için György Vereb ve Árpád Szöőr'e müteşekkirdir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 96-well glass bottom Cell Carrier Ultra microplates | PerkinElmer, Waltham, MA, USA | LLC 6055302 | for spheroids measurements |
| 96-well tissue culture plates | TPP | 92096 | for cell seeding |
| α-MEM medium | Sigma | M8042 | in NK medium |
| Agarose | Sigma | A9539 | for spheroids seeding |
| Annexin V-Alexa Fluo 647 conjugate | Invitrogen-ThermoFisher Scientific | A23204 | for apoptosis measurement with HCS |
| CD16.176 V.NK-92 cells | Dr. Kerry S. Campbell (the Fox Chase Cancer Center, Philadelphia, PA on behalf of Brink Biologics, Inc. San Diego, CA) | ATCC CRL-2407 | for cell culture |
| Cell Tracker Blue | Invitrogen-Thermo Scientific, Waltham, MA, USA) | C2110 | for staining of NK cells |
| DMEM/F-12 medium | Sigma | D8437 | in JIMT1-EGFP medium |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | for coating HCS plate before transfering the spheroids |
| Fetal bovine serum (FBS) | Biosera | FB-1090/500 | JIMT-1-EGFP and NK medium |
| Glutamine | Gibco | 35,050–061 | in NK medium |
| GraphPad Prism 8.0.1 | GraphPad Software Inc., San Diego, CA, USA | for statistical analysis | |
| Harmony software | PerkinElmer, Waltham, MA, USA | for HCA | |
| IL-2 | Proleukin, Novartis Hungária Kft., Budapest, Hungary | PHC0026 | in NK medium |
| Insulin (Humulin R) | Eli Lilly | HI0219 | JIMT-1-EGFP medium |
| JIMT-1 breast cancer cells | for cell culture | ||
| MEM Non-essential Amino Acids (MEM-NEAA) | Gibco | 11,140–050 | in NK medium |
| Na-pyruvate | Lonza | BE13-115E | in NK medium |
| Opera Phenix High-Content Analysis equipment | PerkinElmer, Waltham, MA, USA | HH14001000 | for HCA |
| PBS (Posphate buffered saline) | Lonza | BE17-517Q | for washing the cells |
| Penicillin-Streptomycin | Biosera | LM-A4118 | JIMT-1-EGFP and NK medium |
| pLP-1, pLP-2, pLP-VSV-G, pWOXEGFP | Invitrogen, (Prof. József T zsér, University of Debrecen) zsér, University of Debrecen) | for JIMT-1-EGFP cell line | |
| Pluronic-F127 | Sigma | P2443 | for coating HCS plate before transfering the spheroids |
| Sunitinib malate | SigmaAldrich | PZ0012 | for treatments |
| Trastuzumab Ab (humanized anti-HER2 monoclonal antibody) | Herzuma®, EGIS Pharmaceuticals, Budapest, Hungary | NDC-63459-303-43 | for treatments |
| Trastuzumab-F(ab')2 | Gift from Prof. György Vereb and Árpád Szö r r | Department of Biophysics and Cell Biology, University of Debrecen | for treatments |
| Trypan blue 0.4% solution | Sigma | T8154 | for cell counting |
| Trypsin-EDTA 1X in PBS | Biosera | LM-T1706 | for cells detachment |
Referanslar
- Jubelin, C., et al. Three-dimensional in vitro culture models in oncology research. Cell Biosci. 12 (1), 155 (2022).
- Mittler, F., et al. High-content monitoring of drug effects in a 3D spheroid model. Front Oncol. 7, 293 (2017).
- Badr-Eldin, S. M., Aldawsari, H. M., Kotta, S., Deb, P. K., Venugopala, K. N. Three-dimensional in vitro cell culture models for efficient drug discovery: Progress so far and future prospects. Pharmaceuticals (Basel). 15 (8), 926 (2022).
- Brancato, V., Oliveira, J. M., Correlo, V. M., Reis, R. L., Kundu, S. C. Could 3D models of cancer enhance drug screening. Biomaterials. 232, 119744 (2020).
- Pinto, B., Henriques, A. C., Silva, P. M. A., Bousbaa, H. Three-dimensional spheroids as in vitro preclinical models for cancer research. Pharmaceutics. 12 (12), 1186 (2020).
- Fitzgerald, A. A., Li, E., Weiner, L. M. 3D culture systems for exploring cancer immunology. Cancers (Basel). 13 (1), 56 (2020).
- Zanoni, M., et al. 3D tumor spheroid models for in vitro therapeutic screening: A systematic approach to enhance the biological relevance of data obtained. Sci Rep. 6, 19103 (2016).
- Boucherit, N., Gorvel, L., Olive, D. 3D tumor models and their use for the testing of immunotherapies. Front Immunol. 11, 603640 (2020).
- Li, Y., et al. Recent progress on immunotherapy for breast cancer: Tumor microenvironment, nanotechnology and more. Front Bioeng Biotechnol. 9, 680315 (2021).
- Lo Nigro, C., et al. NK-mediated antibody-dependent cell-mediated cytotoxicity in solid tumors: Biological evidence and clinical perspectives. Ann Transl Med. 7 (5), 105 (2019).
- Sun, Y. S., et al. Risk factors and preventions of breast cancer. Int J Biol Sci. 13 (11), 1387-1397 (2017).
- Liu, P. H., Wei, J. C., Wang, Y. H., Yeh, M. H. Female breast cancer incidence predisposing risk factors identification using nationwide big data: A matched nested case-control study in taiwan. BMC Cancer. 22 (1), 849 (2022).
- Burguin, A., Diorio, C., Durocher, F. Breast cancer treatments: Updates and new challenges. J Pers Med. 11 (8), 808 (2021).
- Costa, R. L. B., Czerniecki, B. J. Clinical development of immunotherapies for HER2(+) breast cancer: A review of HER2-directed monoclonal antibodies and beyond. NPJ Breast Cancer. 6, 10 (2020).
- Musolino, A., et al. Role of fcgamma receptors in HER2-targeted breast cancer therapy. J Immunother Cancer. 10 (1), e003171 (2022).
- Petricevic, B., et al. Trastuzumab mediates antibody-dependent cell-mediated cytotoxicity and phagocytosis to the same extent in both adjuvant and metastatic HER2/NEU breast cancer patients. J Transl Med. 11, 307 (2013).
- Guti, E., et al. The multitargeted receptor tyrosine kinase inhibitor sunitinib induces resistance of HER2 positive breast cancer cells to Trastuzumab-mediated ADCC. Cancer Immunol Immunother. 71 (9), 2151-2168 (2022).
- Barok, M., et al. Trastuzumab decreases the number of circulating and disseminated tumor cells despite Trastuzumab resistance of the primary tumor. Cancer Lett. 260 (1-2), 198-208 (2008).
- Toth, G., et al. The combination of Trastuzumab and Pertuzumab administered at approved doses may delay development of Trastuzumab resistance by additively enhancing antibody-dependent cell-mediated cytotoxicity. MAbs. 8 (7), 1361-1370 (2016).
- Ehlers, F. a. I., et al. ADCC-inducing antibody Trastuzumab and selection of KIR-HLA ligand mismatched donors enhance the NK cell anti-breast cancer response. Cancers (Basel). 13 (13), 3232 (2021).
- Gangadhara, S., Smith, C., Barrett-Lee, P., Hiscox, S. 3d culture of Her2+ breast cancer cells promotes AKT to MAPK switching and a loss of therapeutic response. BMC Cancer. 16, 345 (2016).
- Balalaeva, I. V., Sokolova, E. A., Puzhikhina, A. D., Brilkina, A. A., Deyev, S. M. Spheroids of Her2-positive breast adenocarcinoma for studying anticancer immunotoxins in vitro. Acta Naturae. 9 (1), 38-43 (2017).
- Selis, F., et al. Pegylated Trastuzumab fragments acquire an increased in vivo stability but show a largely reduced affinity for the target antigen. Int J Mol Sci. 17 (4), 491 (2016).
- Johnston, R. L., et al. High content screening application for cell-type specific behaviour in heterogeneous primary breast epithelial subpopulations. Breast Cancer Res. 18 (1), 18 (2016).
- Kandaswamy, C., Silva, L. M., Alexandre, L. A., Santos, J. M. High-content analysis of breast cancer using single-cell deep transfer learning. J Biomol Screen. 21 (3), 252-259 (2016).
- Esquer, H., Zhou, Q., Abraham, A. D., Labarbera, D. V. Advanced high-content-screening applications of clonogenicity in cancer. SLAS Discov. 25 (7), 734-743 (2020).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced Her2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır