Method Article
中空糸膜を用いた発酵液からの中鎖脂肪酸の連続液液抽出
要約
発酵ブロスから中鎖脂肪酸(MCFA)を連続的かつ選択的に抽出するために、中空糸膜を含む液液抽出(LLE)システムが開発されました。LLEシステムは、短鎖脂肪酸とアルコールを含むブロスから高いMCFA特異性を達成します。また、MCFAはストリッピング溶液に濃縮され、製品の回収を容易にします。
要約
中鎖脂肪酸(MCFA、炭素長:C6-C12)は、グリーン抗菌剤、食品成分、動物飼料添加物、化粧品、香料、医薬品、構造化脂質など、さまざまな産業用途に役立つ高価値プラットフォームケミカルです。現在、ほとんどのMCFAは、東南アジアと南アメリカを原産地とするパーム油とココナッツ油から生産されています。ヤシやココナッツの果実を収穫する従来のアプローチは、これらの地域でかなりの生態系被害を引き起こします。そのため、研究者は、低価値の基質(メタノール、エタノール、乳酸など)または有機廃棄物を原料として使用して、MCFAをより持続可能に生成するための生物学的アプローチ(精密発酵や開放培養発酵など)を開発しています。Microbial Chain-Elongation(CE)は、短鎖脂肪酸(SCFA、炭素長:C1-C5)を工業的に関連性のある速度でこれらのMCFAのサブセットに変換する、急速に成熟するオープンカルチャー発酵プラットフォームです。しかし、MCFA産物の連続 的なin situ 抽出は、製品の阻害を回避するためだけでなく、純粋で使用可能な形でのMCFAの回収を促進するためにも必要です。中空糸膜と標的抽出剤混合物を使用した液液抽出(LLE)は、SCFAを含む発酵ブロスからMCFA製品を選択的に抽出するための堅牢なアプローチであることが証明されています。ここでは、参照発酵システムとしてCEを使用し、抽出剤システムとして鉱物油中の3%(w / v)トリオクチルホスフィンオキシドを使用して、連続的なMCFA除去のためのLLEの適用を実証しています。吉草酸(C5)からカプリル酸(C8)までの脂肪酸をSCFA含有ブロスから選択的に除去し、セミバッチアルカリストリッピング溶液で高力価まで濃縮して下流処理を行います。
概要
中鎖脂肪酸(MCFA)は、6個(C6)から12個(C12)の炭素からなる鎖長からなる高価値のビルディングブロック化学物質です。MCFAは、食品、動物飼料、医薬品、化粧品、香料、抗菌剤、化学合成などに工業的に使用されています1,2,3。現在、ほとんどのMCFAは、東南アジアと南アメリカから供給されたパーム油とココナッツ油に由来しています4,5。パーム油とココナッツオイルの生産に関連する深刻な生態系の損傷は、利害関係者や一般の人々によく認識されています。研究者は、低価値の基質または有機廃棄物を原料として使用して、より持続可能にMCFAを生成するための生物学的アプローチ(例えば、精密および開放培養発酵)を探求しています6,7。MCFAを持続的に生産する方法の1つは、微生物連鎖伸長(CE)と呼ばれるプロセスを使用して有機廃棄物の流れをアップサイクルすることです。この二次発酵バイオプロセスは、嫌気性オープンカルチャーマイクロバイオームの多様性を利用するという点で嫌気性消化に似ていますが、CEシステムはメタン生成を促進する代わりに、メタン生成経路を意図的に抑制します。水素を消費する古細菌によって炭素を最大限CH4に還元できず、H2を10-4気圧未満に維持できないマイクロバイオームでは、通常は長鎖カルボン酸塩を酢酸に分解するβ酸化反応(例:C6 → C4 → C2)→→は、還元化合物(すなわち、 電子供与体)エタノールや乳酸などが供給される8.この代謝では、伸長している脂肪酸分子が電子受容体として機能します。したがって、嫌気性消化のように炭素長が1(CH4)の製品を生成する代わりに、CEプロセスでは炭素長が6〜8の範囲のMCFAを生成します。大規模で成長している市場は、これらのグリーンプラットフォームケミカルを受け入れる準備ができています。しかし、これまでのところ、CEプロセスは、炭素長が8炭素を超えるMCFAをかなりの速度で生成することが示されていません。
これらのMCFAの効率的な抽出は、目的の製品の回収だけでなく、製品の阻害を防ぎ、マイクロバイオームをより多くのMCFAの産生に向けて推進するためにも重要です1。MCFAの濃度が増加すると、MCFA代謝が阻害され、熱力学的に好ましくなくなります。MCFAを連続的に取り外すことで、生産率が維持されます。また、SCFAは鎖伸長プロセスの下部構造として機能するため、発酵ブロスからSCFAを除去すべきではありません。標的抽出剤混合物は、SCFAを含む発酵ブロスからMCFA製品を選択的に抽出する必要があります。
ここでは、疎水性のポリプロピレン前方中空糸膜抽出器、選択的有機抽出液(トリオクチルホスフィンオキシド[TOPO]9,10,11)を含む液液抽出(LLE)システムを使用して、SCFA含有発酵ブロスからMCFAを連続的に抽出する堅牢で実用的なアプローチが実証されています)、および後方中空糸膜抽出器。LLEシステムの上流には、バイオマスを保持し、膜の汚れを軽減するためにセルガードフィルターが設置されています。MCFAは、発酵ブロス水溶液(通常はpH設定値<5.8)から有機抽出液(すなわち、鉱油中の3%TOPO(w / v))にプロトン化した形で前方抽出され、次にアルカリ性ストリッピング溶液(pH = 9)に逆抽出されます。そこで脱プロトン化され、下流処理のために高力価に濃縮されます。特定のpH設定値は、LLEプロセスの各フェーズ間の濃度勾配を決定し、発酵ブロスからストリッピング溶液へのMCFAの正味の移動を確実にするため、不可欠です。前方抽出および後方抽出メンブレンを使用したLLEは、アルコールとSCFAの共抽出を最小限に抑えながら、高い抽出速度を達成します。有機溶媒アジュバントであるTOPOは、MCFA複合体の形成を可能にします。これらの錯体は水よりも有機相に溶けやすいため、MCFAの選択性が高くなります。また、LLEプロセスは、ディスカッションのセクションで議論する既存のアプローチに関連する多くの欠点を回避します。このLLEアプローチを使用した長期的な実装は、複数の研究で実証されています9,10,11。このアプローチは、微生物鎖伸長によるMCFA産生を伴うアプリケーションに特に適していますが、有機抽出システムはカスタマイズできるため、同様の化学的特性を持つ化合物を選択的に分離する必要がある他のアプリケーションにも有用です。
プロトコル
この研究で使用した試薬、消耗品、および機器は、 材料表に記載されています。
1. バイオリアクターと液液抽出システムの構築と統合
- 有機相抽出液とリザーバーを調製します。
- 60 gのトリオクチルホスフィンオキシド(TOPO)をマグネティックスタープレートとスターラーを使用して鉱物油に溶解することにより、2 Lの有機相抽出溶液を調製します。
- 抽出溶液を2 Lのガラスリザーバー(つまり、Schottボトル)に加えます。
- リザーバーをマグネチックスタープレートの上に置きます(図1A)。LLEの連続運転中の推奨混合速度は150-250rpmです。
- 抽出液リザーバー用の3ポートキャップを準備します。
- ディップチューブを最初のポートに取り付けて、前方抽出メンブレン(FEM)に抽出溶液を供給するアウトフローポートとして機能します(図1B)。
- 後方抽出メンブレン(BEM)からの抽出溶液のリターンポートとして機能する2番目のポートを取り付けます(図1C)。
- 大気に開放された3番目のポートを追加して、ダイヤフラムポンプによって引き起こされる圧力変動を減衰させます。
- ダイヤフラムポンプを抽出膜に接続します。
- ポリテトラフルオロエチレン(PTFE)ダイヤフラムポンプヘッドを備えた100rpmの可変速ポンプドライブをリザーバーに隣接して配置します(図1D)。
- 抽出液リザーバーの流出ポート(図1A)をダイヤフラムポンプの入口に接続し、次にダイヤフラムポンプの出口をフレキシブルポンプチューブ(サイズ16、18など)を使用してFEMの基部にあるシェル側の入口(図1B)に接続します。
- フレキシブルポンプチューブ(例:サイズ18)を使用して、FEM上部のシェル側出口をBEMの底部にあるシェル側入口(図1C)に接続します。
- フレキシブルポンプチューブ(サイズ16、18など)を使用して、BEMの上部にあるシェル側の出口を抽出溶液リザーバーのリターンポート(図1A)に接続します。
注:このシステムコンポーネントは、FEMの発酵ブロスから抽出されたMCFAをBEMのストリッピング溶液に移します。
- 水相ストリッピング溶液とリザーバーを準備します。
- 0.5 Mホウ酸溶液をNaOHを用いてpH 9に調整し、3.25 Lの水相ストリッピング溶液を調製します。
- マグネチックスターバー付きの3.5Lガラスリザーバーに溶液を注ぎます。
- リザーバーをマグネチックスタープレートの上に置きます(図1E)。
- ストリッピング溶液リザーバー用の4ポートキャップを準備します。
- ディップチューブを最初のポートに取り付けて、BEMにストリッピングソリューションを供給するアウトフローポートとして機能します。
- Yフィッティングを含む第2のポートを、(1)BEMからのストリッピング溶液のリターンフローポートとして機能し、(2)pH制御システムからのNaOH添加物のエントレインメントストリームとして機能するように取り付けます。
- NaOHの添加とMCFAの蓄積によって引き起こされる体積の増加を説明するために、大気に開放された3番目のポートを追加します。
- pHコントローラーのpHプローブを収容するための4番目のポートを提供します。
- ストリッピング溶液リザーバーにpH制御システムを設置します。
- pH 9 の設定値を持つ pH 制御システムをストリッピング溶液リザーバーと統合します (図 1F)。pHコントローラーのベース溶液として5 M NaOHを使用し、収集されたMCFAを打ち消します。
- pHプローブをストリッピング溶液のリザーバーポートに挿入し、ストリッピング溶液に懸濁します。
注:このpH制御システムは酸性溶液を必要としません。
- バイオリアクター接続ポートを準備します。
- 液液抽出(LLE)システムに接続するために、バイオリアクターの2つのポート(アウトフローポートとリターンフローポート)を指定します(図1G、H)。
- ディップチューブをアウトフローポートに接続します。MCFAに富むブロスは、流出ポートのバイオリアクターからLLEシステムにポンプで送られます。
注:ブロスは、最初に抽出膜の前に中空糸膜フィルターに入り、細胞やその他の固形物を除去して汚れを防ぎます。 - リターンフローポートにティーフィッティングを挿入して、(1)FEMからリサイクルされたMCFA枯渇ブロスと(2)中空糸メンブレンフィルターからのセル含有リテートを受け取ります。
- 中空糸メンブレンフィルターを取り付けます。
- バイオリアクターに隣接して300rpmの可変速ポンプドライブを配置します(図1I)。
- 親水性中空糸メンブレン(図1J)をペリスタルティックポンプの上のリングスタンドに貼り付けます。
- ポンプドライブに、大(サイズ17など)と小(サイズ16など)の2つの蠕動ポンプヘッドを積み重ねます。
注:大きい方のポンプヘッドは中空糸メンブレンフィルターに接続されており、透過液の流量がFEMに供給される流量よりも大きくなるようにします。そうでない場合、透過液は生成されるよりも速く消費され、真空が形成されます。 - バイオリアクターのアウトフローポートを、フレキシブルポンプチューブ(サイズ17など)を使用して大きなポンプヘッドインレットに接続します。
- フレキシブルポンプチューブ(サイズ17など)を使用して、大きなポンプヘッド出口をフィルターの基部にあるチューブ側の入口にある親水性中空糸メンブレンフィルターに接続します。
- フィルターの上部シェル側ポートにキャップをして、空気の流入を防ぎます。
注:MCFAに富むブロス(細胞を含む)は、中空糸チューブを通って流れ上がり、バイオリアクターに戻ります。透明なブロス(無細胞)は、0.2 μmの親水性ポリエーテルスルホン(PES)メンブレンを通過し、フィルターのシェル側に集まります。
- FEM を接続します。
- 最初の疎水性中空糸膜モジュール(FEM)をポンプの上のリングスタンドに取り付けます(図1B)。
- シェル側出口の親水性中空糸メンブレンフィルター(図1J)を、フレキシブルポンプチューブ(サイズ16、18など)を使用して小さなポンプヘッド入口に接続します。
- フレキシブルポンプチューブ(サイズ16、18など)を使用して、小さなポンプヘッド出口をモジュールの基部にあるチューブ側入口のFEMに接続します。
- 圧力計(図1K)と流量制限バルブ(図1L)をカップリングフィッティングとティーフィッティングを使用してFEMのチューブ側出口に接続します。
- FEMのチューブ側出口をバイオリアクターのリターンポートにフレキシブルポンプチューブ(例:サイズ18)を使用して接続します。
注:このシステムコンポーネントは、MCFAを透明な発酵ブロスから抽出溶液に移し、次に透明なブロスをバイオリアクターに戻します。
- BEMを接続します。
- 蠕動ポンプヘッド(サイズ16など)を備えた300rpmの可変速ポンプドライブをバイオリアクターに隣接して設置します(図1M)。
- 2 番目の疎水性中空糸メンブレン モジュールを、ペリスタルティック ポンプの上のリング スタンドに取り付けます (図 1C)。
- フレキシブルポンプチューブ(サイズ16、18など)を使用して、ストリッピング溶液リザーバーの流出ポートを蠕動ポンプ入口に接続し、ポンプ出口をBEMの基部にあるチューブ側入口に接続します。
- 圧力計と流量制限バルブをカップリングフィッティングとティーフィッティングを使用して、BEMのチューブ側出口に接続します。
- フレキシブルポンプチューブ(サイズ16、18など)を使用して、BEMの上部にあるチューブ側の出口をストリッピング溶液リザーバーのリターンフローポートに接続します。
注:このシステムコンポーネントは、抽出溶液からBEM内のストリッピング溶液にMCFAを転送し、次にストリッピング溶液をそのリザーバーに戻します。
2.液液抽出システムの運転開始
- 水性位相線をプライミングして循環させます。
- ストリッピング溶液の蠕動ポンプ/BEM(図1M)をオンにし、ポンプ速度を25〜250 mL・min-1の一定の流量になるように設定します。BEMは、比較的広い範囲の流量に対応できます。十分な MCFA 抽出を確保するために、最初は控えめに高い流量から始めます。流量は、ポンプ機器とチューブの耐用年数を延ばすために、運転中に後から徐々に減らすことができます。
注:流速は、バイオリアクターブロスにMCFAが蓄積するほど遅くてはなりません(代表的な結果を参照)。 - BEM のシェル側出口 (図 1C) にあるニードルバルブをゆっくりと閉じて、背圧を ~5 psig に設定します。
- バイオリアクター/FEM蠕動ポンプ(図1I)をオンにし、ポンプ速度を25〜250 mL・min-1の一定の流量になるように設定します。FEMは、比較的広い範囲の流量に対応できます。十分な MCFA 抽出を確保するために、最初は控えめに高い流量から始めます。流量は、ポンプ機器とチューブの耐用年数を延ばすために、運転中に後から徐々に減らすことができます。
注:流速は、バイオリアクターブロスにMCFAが蓄積するほど遅くてはなりません(代表的な結果のセクションを参照)。 - FEM のシェル側出口 (図 1B) にあるニードルバルブをゆっくりと閉じて、背圧を ~5 psig に設定します。
- リターンフローラインを目視で確認して、フローが一定であること、およびラインがプライミングされていることを確認します。
- 透明なブロスが中空糸メンブレンフィルターのシェル側に集まっていることを確認します(図1J)。
注:FEMを充填し、中空糸メンブレンフィルターとFEMの間に安定した流れを確立するには、数時間かかります。流速は、バイオリアクターブロスにMCFAが蓄積するほど低くてはなりません(代表的な結果のセクションを参照)。
- ストリッピング溶液の蠕動ポンプ/BEM(図1M)をオンにし、ポンプ速度を25〜250 mL・min-1の一定の流量になるように設定します。BEMは、比較的広い範囲の流量に対応できます。十分な MCFA 抽出を確保するために、最初は控えめに高い流量から始めます。流量は、ポンプ機器とチューブの耐用年数を延ばすために、運転中に後から徐々に減らすことができます。
- 有機相線を下塗りして循環させます。
- 有機相抽出液ダイアフラムポンプ(図1D)をオンにし、ポンプ速度を5.0〜50 mL・min-1の一定の流量になるように設定します。有機相抽出の圧力を最小限に抑え、クロスオーバーのリスクを最小限に抑えるために、最初は控えめに低い流量から始めます。必要に応じて、後で運転中に流量を段階的に増やして、抽出効率を向上させることができます
- FEM と BEM がいっぱいになるまで待ちます。
- 抽出液リザーバーのリターンフローポートを目視で確認し、一定の流量を確保します。
- 有機相溶液がストリッピング溶液または発酵ブロスラインに交差していないことを確認します。クロスオーバーが起こっている場合、有機相の小さな液滴が見られます。このような場合は、ダイヤフラムポンプの速度を下げ、必要に応じてFEMまたはBEMの背圧をわずかに上げます。10 psigを超えないようにしてください。
注:膜のクロスオーバーを防ぐために、有機相線をプライミングする前に、水性相線内で流れと背圧を確立することが重要です。
- バイオリアクターからMCFAを連続的に抽出します。
- LLE システムが完全に動作している必要があります。バイオリアクターの運転中もシステムを連続的に稼働させます。
- バイオリアクター内のMCFA濃度を毎日測定して、MCFAの十分な抽出を確保します。バイオリアクター内のMCFA濃度が上昇した場合、それは通常、FEMを通る発酵ブロスの流量が不十分であることを示しています。また、汚れやメンテナンスの必要性により膜フラックスが減少していることを示している場合もあります(ステップ2.6を参照)。
注:SCFAおよびMCFA濃度は、Geら11によって記載された方法に従ってガスクロマトグラフィーを介して測定することができる。
- ストリッピング溶液リザーバー内のMCFA蓄積を監視します。
- バッチサイクル中、ストリッピング溶液中のMCFA濃度を毎日測定します。LLEシステムは、MFCAをバイオリアクターからストリッピング溶液に連続的に移送し、時間の経過とともにMCFA濃度を増加させます。このプロセスは、高いMCFA力価を生成するために長期間実行できます。MCFAの体積生産率(mM C·L-1·d-1)は、式111を使用して推定できます。
注:体積生産率=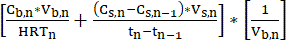 (式1)
(式1)
どこ:
Cb,n= n日目の発酵ブロス中のMCFA濃度、mM C
cs,n= n日目のストリッピング溶液中のMCFA濃度、mM C
Cs,n-1= n-1日目のストリッピング溶液中のMCFA濃度、mM C
Vs,n= n日目のストリッピング溶液の量, L
Vb,n= n日目の発酵液の量(バイオリアクター容量)、L
HRTn= n, d 日目のバイオリアクターの水力保持時間
Tn= n日目, d
Tn-1 = n-1日目、d - 安定した動作を確保するために、測定時点間のMCFA濃度の変化を測定し、式211を適用することにより、LLEシステムの抽出速度(mMCC・d-1)を定期的に計算します。
注: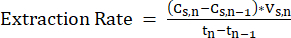 (式2)
(式2)
どこ:
cs,n= n日目のストリッピング溶液中のMCFA濃度、mM C
Cs,n-1= n-1日目のストリッピング溶液中のMCFA濃度、mM C
Vs,n= n日目のストリッピング溶液の量, L
Tn= n日目, d
Tn-1 = n-1日目、d - 抽出溶液からの適切な転写速度を維持するには、MCFA濃度が飽和度80%に達する前に、ストリッピング溶液を新しいバッチと交換します。
注:n-カプロン酸の最大溶解度は10.3g・L-1 は 25 °C で、 n-カプリル酸の L-1 は 0.67 g·25°CでのL-1 。
- バッチサイクル中、ストリッピング溶液中のMCFA濃度を毎日測定します。LLEシステムは、MFCAをバイオリアクターからストリッピング溶液に連続的に移送し、時間の経過とともにMCFA濃度を増加させます。このプロセスは、高いMCFA力価を生成するために長期間実行できます。MCFAの体積生産率(mM C·L-1·d-1)は、式111を使用して推定できます。
- ストリッピング液を交換してください。
- ダイヤフラムポンプをオフにします(図1D)。
- ストリッピング溶液の蠕動ポンプをオフにします(図1M)。
- ホースclを使用しますamp BEMのチューブ側の入口とチューブ側の出口をcl 。
- pH制御システムの電源を切り、ポート接続を取り付けたまま(可能な場合)ストリッピング溶液リザーバーキャップを取り外します。
- ストリッピング溶液リザーバーを取り出します(図1E)。
- ストリッピング溶液リザーバーを、NaOHを使用してpH 9に調整した0.5 Mホウ酸水溶液の新しいバッチと交換します(ステップ1.4を参照)。キャップをリザーバーに再度取り付けます。
- ホースclを取り外しますamp BEMのチューブ側インレットとチューブ側アウトレットから。
- ストリッピング溶液の蠕動ポンプ(図1M)をオンにし、続いてダイヤフラムポンプ(図1D)をオンにします。これでシステムの動作が復旧しました。
- メンブレンのメンテナンス。
- FEMとBEMは、3か月に1回、清掃のためにLLEシステムから取り外します。3か月は控えめに見積もられた推定清掃頻度です。
注:アプリケーションによっては、ユーザーはメンブレンを多かれ少なかれ頻繁に清掃する場合があります。メンブレンの性能低下の兆候は、代表的な結果のセクションで説明されています。メンテナンス中は、ポンプとpHコントローラーの電源を切る必要があります。クリーニング手順は、メンブレンの製造元が提供する必要があります。 - LLEシステムから液体を、有機相抽出溶液ラインから始めて、発酵ブロスライン、ストリッピング溶液ラインの順に、別々の容器に排出します。
- メンブレンを洗浄して再度取り付けたら、液体をそれぞれのリザーバーに戻します。
- 上記の方法を使用して LLE システムを再起動します (ステップ 2.1 から 2.2 を参照)。
- FEMとBEMは、3か月に1回、清掃のためにLLEシステムから取り外します。3か月は控えめに見積もられた推定清掃頻度です。
結果
良好な MCFA 抽出結果は、アルカリ性水相ストリッピング溶液中の MCFA 生成物の着実な蓄積 (図 2) と、発酵ブロス中の比較的安定した MCFA 濃度 (データ未示者) によって示されます。 図 2 は、連続 LLE 操作中のストリッピング溶液の 3 つのセミバッチサイクルを示しています。サイクルは、バッチ置換段階(図2:24日目、46日目、68日目)とMCFA蓄積段階(図2:0〜24日目、25〜46日目、47〜68日目)の2つの段階で構成されます。この特定の発酵およびLLEシステムでは、サイクル期間は約20〜24日でした。ただし、サイクル期間は、バイオリアクターの量、生物学的生産性、ストリッピング溶液の量、中空糸膜の面積、LLEシステム内の液体再循環速度など、複数の要因に依存するため、アプリケーションによって異なります。バッチサイクル中、発酵ブロス中に存在するさまざまな低分子有機酸(フミン酸、フルボ酸など)の低レベルの共抽出により、ストリッピング溶液の色が透明から黄褐色に変わることがあります(図3)。MCFA抽出の否定的な結果は、ストリッピング溶液中のMCFA製品の蓄積が遅く、発酵ブロス中のMCFA濃度が事前に確立されたベースラインと比較して上昇することによって示されます。
カプロン酸の生物学的生産性は、これらの発酵プロセスにおいて、一般にカプリレートよりも高くなります。したがって、カプロン酸はカプリレートと比較してストリッピング溶液中により速い速度で蓄積するのが一般的です。また、 図2に示すように、アセテートや酪酸などのSCFAは、ストリッピング溶液に少量で集まるのが普通です。鉱油中のTOPOは、SCFAよりもMCFAに対する親和性が高いため、MCFAが選択的に除去されます。Saboeら12、Kaurら13、Carvajal-Arroyoら14、およびGeら11による研究では、水溶液を含む複数のアプリケーションにおいて、TOPOの脂肪酸に対する高い選択性が実証されました。第 2 バッチ・サイクルにおける MCFA と SCFA の分割比率を 図 4 に示します。バッチサイクルの数日後には、MCFA:SCFAの分割比が40:1を超えることが予想されます。MCFA:SCFAの分割比は、抽出プロセスが疑似定常状態に近づくにつれて横ばいになります。数日経ってもレシオ>40を達成できない場合は、TOPO抽出剤が劣化または溶出していることを示しています。これが発生した場合は、新しい抽出溶液を調製する必要があります(ステップ1.1を参照)。プラトー期後に比率が減少する場合、これはMCFAが飽和点の80%を超えて蓄積されたことを示しています。これが発生した場合は、新しいストリッピング溶液を準備する必要があります(ステップ1.4を参照)
MCFA 抽出効率の低下は、LLE システム内の流量が不十分であることが原因である可能性があります。 図5では、発酵ブロスとストリッピング溶液の循環ラインでポンプ速度を下げて、液体の再循環速度の低下がMCFA抽出効率に与える影響を示しています。抽出効率は、バイオリアクターによって生成された総MCFAとLLEによって抽出されたMCFAに対する、ストリッピング溶液で抽出されたMCFAの割合として定義されます。通常の運転では、85%を超える抽出効率が期待できます(図5、1-14日目)。ポンプ速度が遅い場合(図5、14日目)、それに応じて抽出効率が低下します。適切なポンプ速度が回復すると、抽出効率が回復するまでに数日かかる場合があります。これは、ストリッピング溶液(高い)と発酵ブロス(低い)の抽出速度の違いによって引き起こされる、抽出溶液中のMCFAの定常状態濃度の低下によって引き起こされる可能性があります。
(1)メンブレンの汚れ、(2)閉塞によるLLEシステムの各段階での流体の流れの制限、(3)メンブレンコンタクタでのガスポケットの形成、(4)ストリッピング溶液中のMCFA濃度が飽和点に近づくことを可能にするなど、他のいくつかの要因が抽出効率の低下に寄与する可能性があります。メンブレンファウリングは、初期条件と比較してメンブレンフラックスが経時的に減少することによって示されます。FEMではバイオフィルムが形成される可能性は低いですが、細胞の破片やその他の懸濁物質の蓄積によりファウリングが発生する可能性があります。また、BEM は無菌ですが、メンブレンコンタクターまたはチューブ内の脂肪酸塩が時間の経過とともに沈殿するため、流れが妨げられる可能性があります。ただし、メンブレンコンタクタの定期的なメンテナンスとクリーニング(ステップ2.6を参照)により、汚れや塩分沈殿の問題が発生するのを防ぐ必要があります。不適切な配置により、メンブレンコンタクタの上部シェル側にガスポケットが形成されることがあります。メンブレンコンタクタは、シェル側の出口ポートが最高点にあることを確認し、形成されたガスがコンタクタから逃げるように、垂直からわずかに傾ける必要があります。LLEシステム内の流体の流れは、ガスポケットを洗い流すために、請負業者の下部から上部に流れるように構成されています。最後に、抽出溶液からBEM中のストリッピング溶液へのMCFAの移動は、ストリッピング溶液中のMCFA濃度が非常に高いと減少します。この問題は、ストリッピング ソリューションをより頻繁に交換することで解決できます。
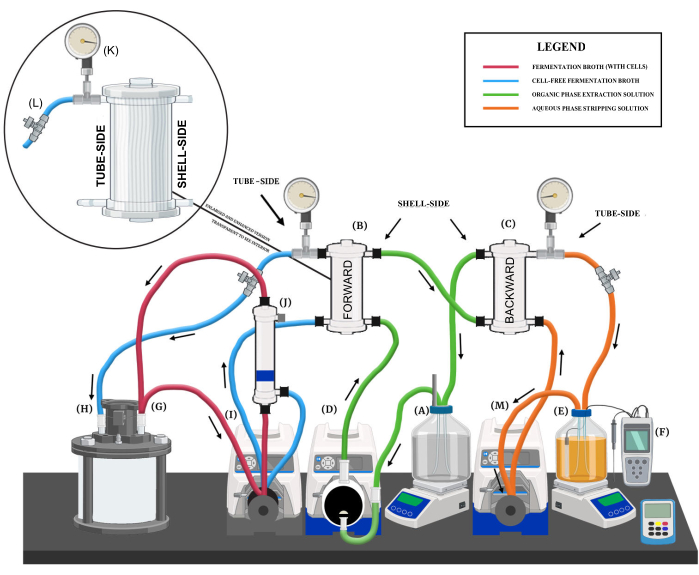
図1:液液抽出システムの概要。 主要なシステムコンポーネント、さまざまな流体回路、および流れ方向を示す図式レンダリング。主なシステム構成部品は、(A)有機相抽出液リザーバー、(B)前方交換膜、(C)後方交換膜、(D)抽出液ダイアフラムポンプ、(E)水相剥離液リザーバー、(F)pH制御システム、(G)バイオリアクターアウトフローポート、(H)バイオリアクターリターンフローポート、(I)前方交換メンブレン・中空糸メンブレンフィルター蠕動ポンプ、(J)中空糸メンブレンフィルター、 (K)圧力計、(L)ニードルバルブ、(M)ストリッピング液蠕動ポンプ。 この図の拡大版を表示するには、ここをクリックしてください。
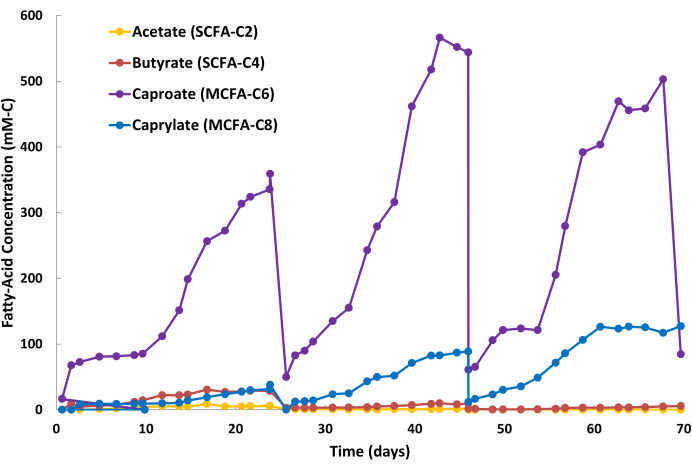
図2:ストリッピング溶液中の脂肪酸の蓄積。 連続液液抽出操作中のストリッピング溶液の3バッチサイクルにおける短鎖脂肪酸と中鎖脂肪酸濃度を示すデータ。 この図の拡大版を表示するには、ここをクリックしてください。

図3:抽出後のストリッピング液の色の変化。 バッチサイクル前(バッチ前)とバッチサイクル後(バッチ後)の水相ストリッピング溶液の色の変化を示す写真。 この図の拡大版を表示するには、ここをクリックしてください。
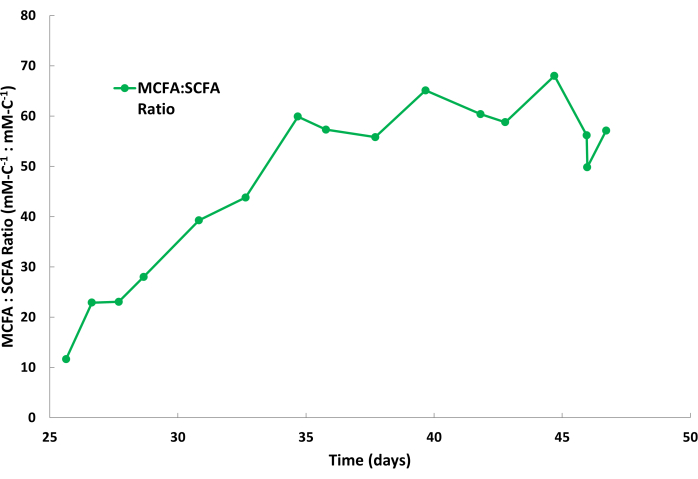
図4:ストリッピング溶液中の脂肪酸比率。 連続液液抽出操作中のストリッピング溶液のバッチサイクルにおける中鎖脂肪酸と短鎖脂肪酸の比率を示すデータ。 この図の拡大版を表示するには、ここをクリックしてください。
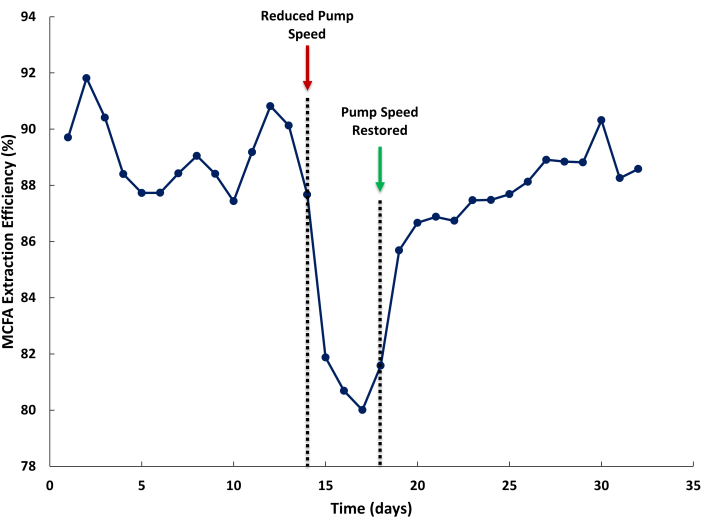
図5:抽出効率に対するメンブレン流量の影響。 前方および後方交換メンブレンを通る不十分な流速が、運転中の中鎖脂肪酸抽出効率に及ぼす影響を示すデータ。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
生物学的に生産されたMCFAは、SCFAやアルコール2などのさまざまな有機化合物と混合物で一般的に見られます。そのため、それらを回収し、有効に活用するためには、選択的な分離プロセスが必要です。ここで開発されたLLEシステムは、SCFAとアルコールを保存しながら、これらの混合物からMCFAを連続的に選択的に抽出します。この機能により、LLEシステムは、MCFA、SCFA、およびアルコールが主要な代謝産物を構成する微生物鎖伸長などの発酵アプリケーションに特に適しています8。具体的には、LLEシステムは、MCFAを除去して生成物の阻害を防ぐことで鎖伸長プロセスを進行させ、SCFAとアルコール反応物を発酵ブロスに残してその後の生物学的変換を可能にします。LLEシステムは、特定の抽出溶液を変更することにより、他のアプリケーション用にカスタマイズできます。例えば、発酵中に生成されたSCFAの連続抽出は、抽出液混合物からTOPOを除去することにより、同じLLEシステムを使用して達成できます。
したがって、LLE法の重要性は、他の方法と比較して、これらのバイオプロセシングおよびバイオテクノロジーアプリケーションに対してより堅牢なMCFA抽出技術を提供することにあります。非混和性液体を用いた in situ 二相性抽出は、発酵ブロス15からMCFAを抽出する別のアプローチである。ただし、このアプローチは比較的非効率的です。エマルジョン層は、水相(すなわち、発酵ブロス)と有機相との間に形成され、物質移動速度を著しく制限します。相層間の界面流体の混合が最小限であることも、物質移動を制限します。別の欠点は、微生物細胞が有機相と直接接触しているため、同調、阻害、および細胞死を引き起こすことである15。最後に、 in situ 二相性抽出では、有機相を除去および置換するための頻繁なメンテナンスが必要です。
バイオリアクター内で高い希釈速度を適用することは、製品の阻害を回避するための別の方法である16。高い希釈率は、バイオリアクター内で高い反応物濃度を維持することにより、高い生産性を達成することができます。しかし、このアプローチは、バイオマスのウォッシュアウト、大量の排水の発生、および高い基質損失(すなわち、SCFAおよびアルコール)に寄与し、その結果、収率が低くなるため、不利である。これらの欠点は、固定化バイオマスと排水リサイクルを使用して軽減できますが、これらの介入はシステムの複雑さを増します17。最後に、製品ストリーム中のMCFA濃度が希薄であるため、MCFAは非効率的でコストがかかります。
新しい抽出アプローチには、有機相と水相を物理的に分離する単一の前方抽出膜を使用してMCFAを連続的に蒸留し、それによって微生物バイオマスを保持および保護することが含まれる可能性があります。MCFAは選択的に有機相に抽出され、その後蒸留されます。ラフィネートは、抽出膜に連続的にリサイクルできます。しかし、連続蒸留は、特に実験室では技術的に困難であり、長期間の運転中に化学抽出剤の劣化や損失を引き起こす可能性があります。蒸留はまた、有機相およびMCFA生成物の熱劣化を引き起こす可能性がある18。
LLE プロセスでは、いくつかの重要な機能と処理ステップを組み込むことで、これらの代替アプローチに関連する多くの欠点を回避します。まず、親水性の中空糸メンブレンフィルターは、バイオマス細胞(生体触媒)をFEB中の抽出液への曝露から保護すると同時に、LLEシステム内の汚れや固体の蓄積を低減する透明なMCFAリッチな濾液を提供するという2つの目的を果たします。次に、液体のクロスオーバーを防ぐために、各メンブレンコンタクタのチューブ側に背圧を発生させるニードルバルブを組み込みました。この予防措置により、膜貫通圧力勾配がわずかに維持され、FEMおよびBEMのシェル側から水性チューブ側への疎水性有機溶媒の望ましくない漏れが防止されます。また、液体の流れはFEMとBEMのベースから上部に平行に流れるように構成されており、メンブレンモジュール内に溜まる可能性のある気泡の閉じ込めを防ぎ、移送効率の低下やキャリーオーバーの原因となります。さらに、この方法では、耐薬品性PTFEポンプヘッドを備えたダイヤフラムポンプを使用して、腐食性のMCFA含有抽出液をポンプで送り込み、抽出プロセスを損なう可能性のある腐食や故障からシステムを保護します。最後に、pH制御されたアルカリ性ストリッピング溶液は、LLEシステムを介してバイオリアクターからストリッピング溶液リザーバーにMCFAを高速で連続的に移送できるpH勾配を維持します。これにより、MCFAは脱プロトン化して高力価に蓄積し、下流の製品の回収が容易になります。
このLLE法は、ラボスケールのバイオリアクター(最大6 Lの作業容量)からの連続MCFA抽出に適しており、いくつかの研究1,9,11,19で長期運転が検証されています。LLE法は、より大規模なアプリケーション14(すなわち、パイロットスケールのバイオリアクター)にも適用できますが、比例スケールのメンブレンと流体処理装置が必要です。ただし、この方法には、主にメンテナンスとシステムの複雑さの領域で、いくつかの制限があります。このプロセスは連続的に動作するように設計されているため、メンブレンモジュールとポンプは頻繁に保守する必要があり、その結果、かなりのダウンタイムが発生します。別の欠点は、ストリッピング溶液が比較的大量のNaOHとホウ酸を必要とすることです。さらに、MCFAは腐食性があり、特定のLLEシステムコンポーネントを時間の経過とともに劣化させます。たとえば、プラスチック製のコネクタとメンブレンハウジングがもろくなり、操作中に交換が必要になる場合があります。最後に、LLEシステムの流体処理ネットワークは複雑で、漏れが発生しやすい多くの接続ポイントが関与しています。ただし、これらの制限と欠点のほとんどは、連続的な膜分離プロセスに典型的なものであり、予想する必要があります。
全体として、このLLEプロトコールは、選択的MCFA抽出のための堅牢で効率的なアプローチを提供し、さまざまな分野の研究を前進させる意味を持ちます。この方法は、発酵中の細胞外代謝産物のin-situ回収のための精密発酵の分野で多くの関連アプリケーションを見つける可能性があります。LLEは、ポストラン遠心分離、マイクロろ過、ウルトラろ過、バッチで行われる溶媒抽出など、従来のダウンストリーム処理(DSP)アプローチに代わる低コストの代替手段となる可能性があります。実際、DSPは、工業的な発酵プロセスにおいて主要なコスト要因となることがよくあります。LLEを使用した連続製品抽出は、連続発酵も可能にし、従来のバッチまたはフェッドバッチアプローチと比較して、操作の生産性と実行時間効率を劇的に向上させる可能性があります。また、将来の研究では、深部共晶溶媒やイオン液体など、有機溶媒以外の抽出媒体を調査する可能性があります。最後に、このプロトコルに記載されているLLEシステムは、実験室環境での実験目的を目的としていました。したがって、エネルギー要件、膜面積、および全体的な抽出収率と速度を削減するための最適化研究にはまだかなりの余地があります。
開示事項
利益相反はありません。
謝辞
著者は、ジョージア大学の農業試験場から提供された技術的および財政的支援に感謝したいと思います。さらに、著者らは、プロセスサンプルの分析に協力してくれたSamuel Ogundipe氏、Ronald Pegg博士、Joon Hyuk Suh博士に感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| 10 L Media Bottle | Duran | 218018658 | |
| 3.5 L Media Bottle | Duran | 218016957 | |
| Boric acid, 99.5%, | ThermoScientific (Fisher Scientific) | 327132500 | |
| Hydrophilic MINIKROS 20CM 0.2UM PES 1MM 1.5TC X 3/4TC | Repligen | N02-P20U-10-N | |
| L/S Variable-Speed Pump Drive; 100 rpm | MasterFlex (VWR) | MFLX07528-10 | |
| L/S Variable-Speed Pump Drive; 300 rpm | MasterFlex (VWR) | MFLX07528-20 | |
| Light Mineral Oil, NF (4 Liters) (CAS: 8042-47-5) | Thomas Scientific | C761Z18 | |
| Liqui-Cel 2.5x8 X50 membrane CO2, PP Housing Viton O-rings (0.5-3 gpm (0.1-0.7 m3/h)), 1/4-in FNPT connections | 3M | LC-02508X50-G453 | |
| Magnetic Stirrer, 20 L Capacity, 110 V | Cole-Parmer | EW-04661-29 | |
| Masterflex L/S Precision Pump Tubing, Tygon, Size 14 | MasterFlex (VWR) | MFLX06402-14 | Specific tubing size will depend on application. |
| Masterflex L/S Precision Pump Tubing, Tygon, Size 16 | MasterFlex (VWR) | MFLX06402-16 | Specific tubing size will depend on application. |
| Masterflex L/S Precision Pump Tubing, Tygon, Size 17 | MasterFlex (VWR) | MFLX06402-17 | Specific tubing size will depend on application. |
| Masterflex L/S Precision Pump Tubing, Tygon, Size 18 | MasterFlex (VWR) | MFLX06402-18 | Specific tubing size will depend on application. |
| MasterFlex L/S Standard Pump Head for Precision Tubing L/S 14, Polycarbonate Housing, CRS Rotor | MasterFlex (VWR) | MFLX07014-20 | Specific pump head size will depend on application. |
| MasterFlex L/S Standard Pump Head for Precision Tubing L/S 14, Polycarbonate Housing, CRS Rotor | MasterFlex (VWR) | MFLX07014-20 | Specific pump head size will depend on application. |
| MasterFlex L/S Standard Pump Head for Precision Tubing L/S 16, Polycarbonate Housing, CRS Rotor | MasterFlex (VWR) | MFLX07016-20 | Specific pump head size will depend on application. |
| MasterFlex L/S Standard Pump Head for Precision Tubing L/S 17, Polycarbonate Housing, CRS Rotor | MasterFlex (VWR) | MFLX07017-20 | Specific pump head size will depend on application. |
| MasterFlex L/S Standard Pump Head for Precision Tubing L/S 18, Polycarbonate Housing, CRS Rotor | MasterFlex (VWR) | MFLX07018-20 | Specific pump head size will depend on application. |
| MasterFlex PTFE-diaphragm pump head, 10 to 100 mL/min | MasterFlex (VWR) | MFLX07090-62 | |
| Oakton 220 pH/ORP/Temperature Controller, 1/8 DIN | Spectrum Laboratory Products | 664-12595-E1 | |
| Oakton 220 pH/ORP/Temperature Controller, 1/8 DIN | Spectrum Laboratory Products | 664-12595-E1 | |
| Oakton Female BNC-to-Stripped Wire Adapter | Spectrum Laboratory Products | 664-12592-E1 | |
| pH Probe with BNC Connector | ThermoScientific | 10010-788 | Any pH probe with a BNC connector will suffice. |
| Precision Flow-Adjustment Valve, White Polypropylene, 1/4 NPT Male x Male | McMaster-Carr | 7792K57 | |
| ProConnex Fittings Kits - A | Repligen | ACPX-KT2-01N | Compatible with Hydrophilic MINIKROS Filter |
| ProConnex Fittings Kits - B | Repligen | ACPX-KT1-01N | Compatible with Hydrophilic MINIKROS Filter |
| Sodium Hydroxide Pellets for Analysis | Sigma Aldrich | 1.06498 | |
| Stainless-Steel Pressure Gauge 0-60 psi Stainless Steel 1/4" NPT 2.5" Face Dial | NA | XJ-219 | Any comparable pressure gauge covering 0-60 psig range will suffice. |
| Trioctylphosphine oxide (TOPO) | Sigma-Aldrich | 346187-100G |
参考文献
- Palomo-Briones, R., et al. Near-neutral ph increased n-caprylate production in a microbiome with product inhibition of methanogenesis. Chem Eng J. 446, 137170 (2022).
- Wang, J., Yin, Y. Biological production of medium-chain carboxylates through chain elongation: An overview. Biotechnol Adv. 55, 107882 (2022).
- Watanabe, S., Tsujino, S. Applications of medium-chain triglycerides in foods. Front Nutr. 9, 802805 (2022).
- Meijaard, E., et al. The environmental impacts of palm oil in context. Nat Plants. 6 (12), 1418-1426 (2020).
- Meijaard, E., Abrams, J. F., Juffe-Bignoli, D., Voigt, M., Sheil, D. Coconut oil, conservation and the conscientious consumer. Curr Bio. 30 (13), R757-R758 (2020).
- Angenent, L. T., Magdalena, J. A., Jeon, B. S., Usack, J. G. Eco-mimicry opens new doors for bioprocess engineers. Joule. 4 (10), 2074-2077 (2020).
- Shahab, R. L., et al. A heterogeneous microbial consortium producing short-chain fatty acids from lignocellulose. Science. 369 (6507), 1214 (2020).
- Magdalena, J. A., Angenent, L. T., Usack, J. G. The measurement, application, and effect of oxygen in microbial fermentations: Focusing on methane and carboxylate production. Fermentation. 8 (4), 138 (2022).
- Agler, M. T., Spirito, C. M., Usack, J. G., Werner, J. J., Angenent, L. T. Development of a highly specific and productive process for n-caproic acid production: Applying lessons from methanogenic microbiomes. Water Sci Technol. 69 (1), 62-68 (2013).
- Gildemyn, S., et al. Upgrading syngas fermentation effluent using Clostridium kluyveri in a continuous fermentation. Biotechnol Biofuels. 10 (1), 83 (2017).
- Ge, S., Usack, J. G., Spirito, C. M., Angenent, L. T. Long-term n-caproic acid production from yeast-fermentation beer in an anaerobic bioreactor with continuous product extraction. Env Sci Technol. 49 (13), 8012-8021 (2015).
- Saboe, P. O., et al. In situ recovery of bio-based carboxylic acids. Green Chem. 20 (8), 1791-1804 (2018).
- Kaur, G., et al. Reactive extraction for in-situ carboxylate recovery from mixed culture fermentation. Biochem Eng J. 160, 107641 (2020).
- Carvajal-Arroyo, J. M., et al. Production and extraction of medium-chain carboxylic acids at a semi-pilot scale. Chem Eng J. 416, 127886 (2021).
- Choi, K., et al. In situ biphasic extractive fermentation for hexanoic acid production from sucrose by Megasphaera elsdenii NCIMB 702410. Appl Biochem Biotechnol. 171 (5), 1094-1107 (2013).
- Grootscholten, T., Steinbusch, K., Hamelers, H., Buisman, C. Improving medium chain fatty acid productivity using chain elongation by reducing the hydraulic retention time in an upflow anaerobic filter. Bioresour Technol. 136, 735-738 (2013).
- Grootscholten, T., Dal Borgo, F. K., Hamelers, H., Buisman, C. Promoting chain elongation in mixed culture acidification reactors by addition of ethanol. Biomass Bioenergy. 48, 10-16 (2013).
- Cermak, S. C., Evangelista, R. L., Kenar, J. A. Distillation of natural fatty acids and their chemical derivatives. Distillation-Advances from Modeling to Applications Chapter. 5, 109-142 (2012).
- Agler, M. T., Spirito, C. M., Usack, J. G., Werner, J. J., Angenent, L. T. Chain elongation with reactor microbiomes: Upgrading dilute ethanol to medium-chain carboxylates. Energy Environ Sci. 5 (8), 8189-8192 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved