Method Article
Orta Zincirli Yağ Asitlerinin İçi Boş Fiber Membranlar Kullanılarak Fermantasyon Suyundan Sürekli Sıvı-Sıvı Ekstraksiyonu
Bu Makalede
Özet
Fermantasyon suyundan orta zincirli yağ asitlerini (MCFA'lar) sürekli ve seçici olarak ekstrakte etmek için içi boş lif membranları içeren bir sıvı-sıvı ekstraksiyon (LLE) sistemi geliştirilmiştir. LLE sistemi, kısa zincirli yağ asitleri ve alkoller içeren et sularından yüksek MCFA özgüllükleri elde eder. Ayrıca, MCFA'lar, ürün geri kazanımını kolaylaştırmak için bir sıyırma çözeltisinde konsantre edilir.
Özet
Orta zincirli yağ asitleri (MCFA'lar; karbon uzunlukları: C6-C12), yeşil antimikrobiyaller, gıda katkı maddeleri, hayvan yemi katkı maddeleri, kozmetikler, kokular, farmasötikler ve yapılandırılmış lipitler dahil olmak üzere çeşitli endüstriyel uygulamalara hizmet eden yüksek değerli platform kimyasallarıdır. Şu anda, çoğu MCFA, Güneydoğu Asya ve Güney Amerika menşeli hurma ve hindistancevizi yağından üretilmektedir. Palmiye ve hindistancevizi meyvelerinin toplanmasına yönelik geleneksel yaklaşım, bu bölgelerde önemli ekolojik hasara neden olmaktadır. Bu nedenle araştırmacılar, hammadde olarak düşük değerli substratlar (örneğin metanol, etanol, laktat) veya organik atıklar kullanarak MCFA'ları daha sürdürülebilir bir şekilde üretmek için biyolojik yaklaşımlar (örneğin, hassas ve açık kültür fermantasyonları) geliştiriyorlar. Mikrobiyal zincir uzaması (CE), kısa zincirli yağ asitlerini (SCFA'lar; karbon uzunlukları: C1-C5) endüstriyel olarak ilgili oranlarda bu MCFA'ların bir alt kümesine dönüştüren, hızla olgunlaşan bir açık kültür fermantasyon platformudur. Bununla birlikte, MCFA ürünlerinin sürekli yerinde ekstraksiyonu, yalnızca ürün inhibisyonunu önlemek için değil, aynı zamanda MCFA'ların saf ve kullanılabilir bir formda geri kazanımını kolaylaştırmak için de gereklidir. İçi boş fiber membranlar ve hedefe yönelik ekstrakt edici karışımlar kullanan sıvı-sıvı ekstraksiyonu (LLE), MCFA ürünlerini SCFA'lar içeren fermantasyon et sularından seçici olarak ekstrakte etmek için sağlam bir yaklaşım olduğunu kanıtlamıştır. Burada, sürekli MCFA giderimi için LLE uygulaması, referans fermantasyon sistemi olarak CE ve özütleyici sistem olarak mineral yağda %3 (a/h) trioktilfosfin oksit kullanılarak gösterilmiştir. Valerik asitten (C5) kaprilik aside (C8) kadar değişen yağ asitleri, SCFA içeren et sularından seçici olarak çıkarılır ve sonraki işlemler için yarı kesikli bir alkali sıyırma çözeltisinde yüksek titrelere konsantre edilir.
Giriş
Orta zincirli yağ asitleri (MCFA'lar), altı (C6) ila on iki (C12) karbon arasında değişen zincir uzunlukları içeren yüksek değerli yapı taşı kimyasallarıdır. MCFA'ların gıdalarda, hayvan yemlerinde, ilaçlarda, kozmetiklerde, kokularda, antimikrobiyal ajanlarda ve kimyasal sentezde endüstriyel uygulamaları vardır 1,2,3. Şu anda, çoğu MCFA, Güneydoğu Asya ve Güney Amerika'dan elde edilen hurma ve hindistancevizi yağından elde edilmektedir 4,5. Palmiye ve hindistancevizi yağı üretimiyle ilişkili ciddi ekolojik hasar, paydaşlar ve genel halk tarafından iyi bilinmektedir. Araştırmacılar, hammadde olarak düşük değerli substratlar veya organik atıklar kullanarak MCFA'ları daha sürdürülebilir bir şekilde üretmek için biyolojik yaklaşımları (örneğin, hassas ve açık kültür fermantasyonları) araştırıyorlar 6,7. MCFA'ları üretmenin sürdürülebilir bir yolu, mikrobiyal zincir uzaması (CE) adı verilen bir süreç kullanarak organik atık akışlarını ileri dönüştürmektir. Bu ikincil fermantasyon biyoprosesi, anaerobik açık kültür mikrobiyomlarının çok yönlülüğünden yararlanması bakımından anaerobik sindirime benzer, ancak metan oluşumunu teşvik etmek yerine, CE sistemleri metanojenik yolu kasıtlı olarak bastırır. Karbonun maksimum olarakCH4'e indirgenemediği veyaH2'nin hidrojen tüketen arkeler tarafından 10-4 atm'nin altında tutulamadığı bir mikrobiyomda, normalde daha uzun zincirli karboksilatları asetata (örneğin, C6 → C4 → C2) parçalayacak olan β-oksidasyon reaksiyonu, indirgenmiş bir bileşik olduğu sürece tersine çevrilebilir (örneğin, C4 →→ C6, vb.), elektron vericisi) etanol veya laktat gibi8 verilir. Bu metabolizmada, uzama geçiren yağ asidi molekülü elektron alıcısı olarak görev yapar. Bu nedenle, anaerobik çürütmede olduğu gibi karbon uzunluğu bir (CH4) olan bir ürün üretmek yerine, CE işlemi, karbon uzunlukları altı ila sekiz arasında değişen MCFA'lar üretir. Büyük ve büyüyen bir pazar bu yeşil platform kimyasallarını almaya hazır. Bununla birlikte, şimdiye kadar, CE işleminin, kayda değer oranlarda sekiz karbonu aşan karbon uzunluklarına sahip MCFA'lar ürettiği gösterilmemiştir.
Bu MCFA'ların verimli bir şekilde ekstraksiyonu, yalnızca istenen ürünün geri kazanılması için değil, aynı zamanda ürün inhibisyonunu önlemek ve mikrobiyomu daha fazla MCFA üretmeye itmek için de önemlidir1. MCFA'ların konsantrasyonu arttıkça, MCFA metabolizması inhibe edilir ve termodinamik olarak daha az elverişli hale gelir. MCFA'ları sürekli olarak kaldırarak, üretim oranları korunur. Ayrıca, SCFA'lar zincir uzama işlemi için alt yapılar olarak hizmet ettiğinden, fermantasyon suyundan çıkarılmamalıdırlar. Hedeflenen özütleyici karışımları, MCFA ürünlerini SCFA'lar içeren fermantasyon sularından seçici olarak ekstrakte etmelidir.
Burada, hidrofobik, polipropilen ileri içi boş fiber membran ekstraktörü, seçici bir organik özütleyici çözeltisi (trioktilfosfin oksit [TOPO]9,10,11) ve geriye doğru içi boş fiber membran çıkarıcı. Biyokütleyi korumak ve membran kirlenmesini azaltmak için LLE sisteminin yukarısına bir hücre koruma filtresi monte edilmiştir. MCFA'lar, protonlanmış formlarında, sulu fermantasyon suyundan (tipik olarak bir pH ayar noktası <5.8 ile) bir organik özütleyici çözeltisine (yani, mineral yağda% 3 TOPO (a / h)) ekstrakte edilir ve daha sonra geriye doğru bir alkali sıyırma çözeltisine (pH = 9) ekstrakte edilir, burada protondan arındırılırlar ve aşağı akış işleme için yüksek titrelere konsantre olurlar. Belirli pH ayar noktaları önemlidir, çünkü LLE prosesinin her bir aşaması arasındaki konsantrasyon gradyanını belirlerler ve MCFA'ların fermantasyon suyundan sıyırma çözeltisine net bir transferini sağlarlar. İleri ve geri ekstraksiyon membranları kullanan LLE, alkolleri ve SCFA'ların birlikte ekstraksiyonunu en aza indirirken yüksek ekstraksiyon oranlarına ulaşır. Organik çözücü adjuvanı TOPO, MCFA komplekslerinin oluşumunu sağlar. Bu kompleksler organik fazlarda sudan daha fazla çözünür ve bu da yüksek MCFA seçiciliği ile sonuçlanır. LLE süreci, Tartışma bölümünde tartışılacak olan mevcut yaklaşımlarla ilişkili birçok dezavantajı da ortadan kaldırır. Bu LLE yaklaşımını kullanarak uzun vadeli uygulama çok sayıda çalışmada gösterilmiştir 9,10,11. Bu yaklaşım, mikrobiyal zincir uzaması yoluyla MCFA üretimini içeren uygulamalar için özellikle uygun olsa da, organik özütleyici sistemi özelleştirilebildiği için benzer kimyasal özelliklere sahip bileşiklerin seçici olarak ayrılmasını gerektiren diğer uygulamalarda da yararlıdır.
Protokol
Bu çalışmada kullanılan reaktifler, sarf malzemeleri ve ekipman Malzeme Tablosunda listelenmiştir.
1. Biyoreaktör ve sıvı-sıvı ekstraksiyon sisteminin oluşturulması ve entegre edilmesi
- Organik faz ekstraksiyon çözeltisini ve rezervuarı hazırlayın.
- 60 g trioktilfosfin oksidi (TOPO) manyetik bir karıştırma plakası ve bir karıştırıcı kullanarak mineral yağda çözerek 2 L organik faz ekstraksiyon çözeltisi hazırlayın.
- Ekstraksiyon solüsyonunu 2 L'lik bir cam hazneye (yani Schott şişesi) ekleyin.
- Rezervuarı manyetik bir karıştırma plakasına yerleştirin (Şekil 1A). Sürekli LLE çalışması sırasında önerilen karıştırma hızı 150-250 rpm'dir.
- Ekstraksiyon çözeltisi rezervuarı için üç portlu bir kapak hazırlayın.
- İleri ekstraksiyon membranına (FEM) ekstraksiyon çözeltisi sağlayan bir çıkış portu olarak hizmet etmek için ilk porta bir daldırma tüpü takın (Şekil 1B).
- Geriye doğru ekstraksiyon membranından (BEM) ekstraksiyon çözeltisi için bir dönüş portu görevi görecek ikinci bir port takın (Şekil 1C).
- Diyaframlı pompanın neden olduğu basınç dalgalanmalarını azaltmak için atmosfere açık üçüncü bir bağlantı noktası ekleyin.
- Diyaframlı pompayı ekstraksiyon membranlarına bağlayın.
- Rezervuarın yanına politetrafloroetilen (PTFE) diyaframlı pompa kafası ile donatılmış 100 rpm değişken hızlı bir pompa sürücüsü yerleştirin (Şekil 1D).
- Ekstraksiyon çözeltisi rezervuar çıkış çıkış portunu (Şekil 1A) diyaframlı pompanın girişine ve ardından diyaframlı pompanın çıkışını esnek pompa hortumunu (örn. boyut 16, 18) kullanarak FEM'in tabanındaki kabuk tarafı girişine (Şekil 1B) bağlayın.
- Esnek pompa hortumu (örn. 1 boyutu) kullanarak FEM'in üst kısmındaki kabuk tarafındaki çıkışı BEM'in tabanındaki kabuk tarafındaki girişe (Şekil 18C) bağlayın.
- Esnek pompa hortumu (örn. boyut 1, 16) kullanarak BEM'in üst kısmındaki kabuk tarafı çıkışını ekstraksiyon çözeltisi rezervuarındaki dönüş portuna (Şekil 16A) bağlayın.
NOT: Bu sistem bileşeni, FEM'deki fermantasyon suyundan ekstrakte edilen MCFA'ları BEM'deki sıyırma çözeltisine aktarır.
- Sulu faz sıyırma çözeltisini ve rezervuarı hazırlayın.
- 0,5 M borik asit çözeltisi alarak ve NaOH kullanarak pH 9'a ayarlayarak 3,25 L sulu fazlı sıyırma çözeltisi hazırlayın.
- Çözeltiyi manyetik karıştırma çubuklu 3,5 L'lik bir cam hazneye dökün.
- Rezervuarı manyetik bir karıştırma plakasına yerleştirin (Şekil 1E).
- Sıyırma çözeltisi rezervuarı için dört portlu bir kapak hazırlayın.
- BEM'e sıyırma çözümü sağlayan bir çıkış portu olarak hizmet etmek için ilk porta bir daldırma borusu takın.
- (1) BEM'den sıyırma çözeltisinin geri akış portu olarak hizmet etmek ve (2) pH kontrol sisteminden NaOH ilaveleri için bir sürüklenme akışı görevi görmek için bir Y-bağlantı parçası içeren ikinci bir port takın.
- NaOH ilaveleri ve MCFA birikiminin neden olduğu hacim artışını hesaba katmak için atmosfere açık üçüncü bir port ekleyin.
- pH kontrol cihazının pH probunu yerleştirmek için dördüncü bir bağlantı noktası sağlayın.
- Sıyırma çözeltisi rezervuarına bir pH kontrol sistemi kurun.
- pH 9 ayar noktasına sahip bir pH kontrol sistemini sıyırma çözeltisi rezervuarına entegre edin (Şekil 1F). Toplanan MCFA'lara karşı koymak için pH kontrol cihazı ile baz çözelti olarak 5 M NaOH kullanın.
- pH probunu sıyırma çözeltisi rezervuar portundan geçirin ve sıyırma çözeltisinde askıya alın.
NOT: Bu pH kontrol sistemi asit çözeltisi gerektirmez.
- Biyoreaktör bağlantı portlarını hazırlayın.
- Sıvı-sıvı ekstraksiyon (LLE) sistemi ile bağlantı için biyoreaktörde bir çıkış çıkış portu ve bir dönüş akış portu olmak üzere iki port belirleyin (Şekil 1G,H).
- Çıkış çıkış portuna bir daldırma borusu bağlayın. MCFA açısından zengin et suyu, çıkış portundaki biyoreaktörden LLE sistemine pompalanacaktır.
NOT: Et suyu, kirlenmeyi önlemek için hücreleri ve diğer katıları uzaklaştırmak için ekstraksiyon zarlarından önce içi boş fiber membran filtreye girer. - Aşağıdakileri almak için dönüş akışı portuna bir tişört bağlantısı yerleştirin: (1) FEM'den geri dönüştürülen MCFA tükenmiş et suyu ve (2) içi boş fiber membran filtreden hücre içeren retentat.
- İçi boş fiber membran filtreyi takın.
- Biyoreaktörün yanına 300 rpm değişken hızlı bir pompa sürücüsü yerleştirin (Şekil 1I).
- Hidrofilik içi boş fiber membranı (Şekil 1J) peristaltik pompanın üzerindeki bir halka standına sabitleyin.
- Pompa sürücüsüne büyük (örn. 17 numara) ve küçük (16 numara) iki peristaltik pompa kafası istifleyin.
NOT: Daha büyük pompa kafası, süzüntü akış hızının FEM'e beslenen akış hızından daha büyük olmasını sağlamak için içi boş fiber membran filtreye bağlanır. Durum böyle olmasaydı, süzüntü üretildiğinden daha hızlı tüketilir ve bir vakum oluşmasına neden olurdu. - Biyoreaktördeki çıkış çıkış portunu esnek pompa hortumu (örn. boyut 17) kullanarak büyük pompa kafası girişine bağlayın.
- Büyük pompa kafası çıkışını, esnek pompa hortumu (örn. 17 numara) kullanarak filtrenin tabanındaki tüp tarafındaki girişteki hidrofilik içi boş fiber membran filtreye bağlayın.
- Hava akışını önlemek için filtrenin üst kabuk tarafındaki portunu kapatın.
NOT: MCFA açısından zengin et suyu (hücreler içeren) içi boş lif tüplerinden akacak ve biyoreaktöre geri dönecektir. Berrak et suyu (hücresiz) 0,2 μm hidrofilik polietersülfon (PES) membranından geçecek ve filtrenin kabuk tarafında toplanacaktır.
- FEM'i bağlayın.
- İlk hidrofobik içi boş fiber membran modülünü (FEM) pompanın üzerindeki bir halka standına takın (Şekil 1B).
- Kabuk tarafındaki çıkıştaki hidrofilik içi boş fiber membran filtreyi (Şekil 1J) esnek pompa hortumu (örn. boyut 16, 18) kullanarak küçük pompa kafası girişine bağlayın.
- Küçük pompa kafası çıkışını, esnek pompa hortumu (örn. 16, 18 numara) kullanarak modülün tabanındaki tüp tarafındaki girişteki FEM'e bağlayın.
- Basınç göstergesini (Şekil 1K) ve akış kısıtlama valfini (Şekil 1L) bir bağlantı parçası ve tee-bağlantı parçası kullanarak FEM'in boru tarafındaki çıkışına bağlayın.
- FEM'in tüp tarafındaki çıkışını esnek pompa hortumu (örn. 18 numara) kullanarak biyoreaktördeki dönüş portuna bağlayın.
NOT: Bu sistem bileşeni, MCFA'ları berrak fermantasyon suyundan ekstraksiyon çözeltisine aktarır ve ardından berrak suyu biyoreaktöre geri döndürür.
- BEM'i bağlayın.
- Biyoreaktörün yanına peristaltik bir pompa kafası (örn. 300 numara) ile donatılmış 16 rpm değişken hızlı bir pompa sürücüsünü yerleştirin (Şekil 1M).
- İkinci hidrofobik içi boş fiber membran modülünü peristaltik pompanın üzerindeki bir halka standına takın (Şekil 1C).
- Esnek pompa hortumu (örn. boyut 16, 18) kullanarak sıyırma çözeltisi rezervuar çıkış portunu peristaltik pompa girişine ve pompa çıkışını BEM'in tabanındaki tüp tarafı girişine bağlayın.
- Basınç göstergesini ve akış kısıtlama valfini, bir bağlantı parçası ve tee-bağlantı parçası kullanarak BEM'in boru tarafındaki çıkışına bağlayın.
- BEM'in üst kısmındaki boru tarafındaki çıkışı, esnek pompa hortumu (örn. boyut 16, 18) kullanarak sıyırma çözeltisi rezervuar dönüş akış portuna bağlayın.
NOT: Bu sistem bileşeni, MCFA'ları ekstraksiyon solüsyonundan BEM'deki sıyırma solüsyonuna aktarır ve ardından sıyırma solüsyonunu rezervuarına geri döndürür.
2. Sıvı-sıvı ekstraksiyon sisteminin çalışmasının başlatılması
- Sulu faz çizgilerini astarlayın ve dolaştırın.
- Sıyırma solüsyonu peristaltik pompasını/BEM'i açın (Şekil 1M) ve pompa hızını 25-250 mL·min-1 arasında sabit bir akış hızı elde edecek şekilde ayarlayın. BEM, nispeten geniş bir akış hızı aralığını barındırabilir. Yeterli MCFA ekstraksiyonunu sağlamak için başlangıçta muhafazakar olarak yüksek bir akış hızıyla başlayın. Pompa ekipmanının ve hortumunun hizmet ömrünü uzatmak için akış hızı daha sonra çalışma sırasında kademeli olarak azaltılabilir.
NOT: Akış hızı, biyoreaktör suyunda MCFA birikimine izin verecek kadar düşük olmamalıdır (bkz. - ~1 psig'lik bir geri basınç oluşturmak için BEM'in kabuk tarafındaki çıkışındaki iğneli valfi yavaşça kapatın (Şekil 5C).
- Biyoreaktör/FEM peristaltik pompasını açın (Şekil 1I) ve pompa hızını 25-250 mL·min-1 arasında sabit bir akış hızı elde edecek şekilde ayarlayın. FEM, nispeten geniş bir akış hızı aralığını barındırabilir. Yeterli MCFA ekstraksiyonunu sağlamak için başlangıçta muhafazakar olarak yüksek bir akış hızıyla başlayın. Pompa ekipmanının ve hortumunun hizmet ömrünü uzatmak için akış hızı daha sonra çalışma sırasında kademeli olarak azaltılabilir.
NOT: Akış hızı, biyoreaktör suyunda MCFA birikimine izin verecek kadar düşük olmamalıdır (Temsili Sonuçlar bölümüne bakın). - ~1 psig'lik bir geri basınç oluşturmak için FEM'in kabuk tarafındaki çıkışındaki iğneli valfi yavaşça kapatın (Şekil 5B).
- Sabit bir akış sağlamak ve hatların astarlandığından emin olmak için dönüş akış hatlarını görsel olarak kontrol edin.
- Berrak et suyunun içi boş fiber membran filtrenin kabuk tarafında toplandığını doğrulayın (Şekil 1J).
NOT: FEM'in doldurulması ve içi boş fiber membran filtre ile FEM arasında sabit bir akış sağlanması birkaç saat sürecektir. Akış hızı, biyoreaktör suyunda MCFA birikimine izin verecek kadar düşük olmamalıdır (Temsili Sonuçlar bölümüne bakın).
- Sıyırma solüsyonu peristaltik pompasını/BEM'i açın (Şekil 1M) ve pompa hızını 25-250 mL·min-1 arasında sabit bir akış hızı elde edecek şekilde ayarlayın. BEM, nispeten geniş bir akış hızı aralığını barındırabilir. Yeterli MCFA ekstraksiyonunu sağlamak için başlangıçta muhafazakar olarak yüksek bir akış hızıyla başlayın. Pompa ekipmanının ve hortumunun hizmet ömrünü uzatmak için akış hızı daha sonra çalışma sırasında kademeli olarak azaltılabilir.
- Organik faz hatlarını astarlayın ve dolaştırın.
- Organik faz ekstraksiyon çözeltisi diyafram pompasını açın (Şekil 1D) ve 5.0-50 mL·min-1 arasında sabit bir akış hızı elde etmek için pompa hızını ayarlayın. Organik faz ekstraksiyonundaki basıncı en aza indirmek ve çaprazlama riskini en aza indirmek için başlangıçta muhafazakar olarak düşük bir akış hızıyla başlayın. Gerekirse, ekstraksiyon verimliliğini artırmak için akış hızı daha sonra çalışma sırasında kademeli olarak artırılabilir
- FEM ve BEM dolana kadar bekleyin.
- Sabit akışı sağlamak için ekstraksiyon çözeltisi rezervuarındaki dönüş akış portunu görsel olarak kontrol edin.
- Sıyırma çözeltisine veya fermantasyon suyu hatlarına hiçbir organik faz çözeltisinin geçmediğini doğrulayın. Bir çaprazlama meydana gelirse, organik fazın küçük damlacıkları görülebilir. Böyle bir durumda, diyaframlı pompa hızını azaltın ve FEM veya BEM'deki geri basıncı uygun şekilde hafifçe artırın. 10 psig'yi aşmayın.
NOT: Membran çaprazlamasını önlemek için, organik faz hatlarını astarlamadan önce sulu faz hatları içinde akış ve geri basınç oluşturmak önemlidir.
- MCFA'ları biyoreaktörden sürekli olarak çıkarın.
- LLE sistemi tam olarak çalışır durumda olmalıdır. Biyoreaktör çalışması sırasında sistemin sürekli çalışmasına izin verin.
- MCFA'ların yeterli ekstraksiyonunu sağlamak için biyoreaktördeki MCFA konsantrasyonlarını günlük olarak ölçün. Biyoreaktörde yüksek MCFA konsantrasyonları meydana gelirse, bu genellikle fermantasyon suyunun FEM boyunca yetersiz akış hızlarını gösterir. Ayrıca, kirlenme ve bakım ihtiyacı nedeniyle azalan membran akısını da gösterebilir (bkz. adım 2.6).
NOT: SCFA ve MCFA konsantrasyonları, Ge ve ark.11 tarafından açıklanan yönteme göre gaz kromatografisi ile ölçülebilir.
- Sıyırma çözeltisi rezervuarındaki MCFA birikimini izleyin.
- Parti döngüsü sırasında sıyırma çözeltisi içindeki MCFA konsantrasyonunu günlük olarak ölçün. LLE sistemi, MFCA'ları biyoreaktörden sıyırma çözeltisine sürekli olarak aktararak zaman içinde MCFA konsantrasyonunu artırır. Proses, yüksek MCFA titreleri üretmek için uzun süreler boyunca çalışabilir. MCFA'ların hacimsel üretim hızı (mM C·L-1·d-1) Denklem 111 kullanılarak tahmin edilebilir.
NOT: Hacimsel Üretim Hızı =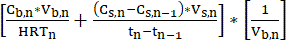 (Eşitlik 1)
(Eşitlik 1)
nerede:
Cb,n, mM C gününde fermantasyon suyundaki MCFA konsantrasyonu
Cs,n= Gün n, mM C'deki sıyırma çözeltisindeki MCFA konsantrasyonu
Cs,n-1 = n-1, mM C gününde sıyırma çözeltisindeki MCFA konsantrasyonu
Vs,n= Gün n, L sıyırma çözeltisinin hacmi
Vb,n= n, L günündeki fermantasyon suyu hacmi (biyoreaktör hacmi)
HRTn= Biyoreaktörün n, d gününde hidrolik tutma süresi
Tn= Gün n, d
Tn-1= Gün n-1, d - Kararlı çalışmayı sağlamak için, ölçüm zaman noktaları arasındaki MCFA konsantrasyonundaki değişikliği ölçerek ve Denklem 211'i uygulayarak LLE sisteminin ekstraksiyon hızını (mM C·d-1) periyodik olarak hesaplayın.
NOT: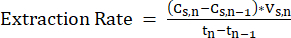 (Eşitlik 2)
(Eşitlik 2)
nerede:
Cs,n= Gün n, mM C'deki sıyırma çözeltisindeki MCFA konsantrasyonu
Cs,n-1 = n-1, mM C gününde sıyırma çözeltisindeki MCFA konsantrasyonu
Vs,n= Gün n, L sıyırma çözeltisinin hacmi
Tn= Gün n, d
Tn-1= Gün n-1, d - Ekstraksiyon çözeltisinden yeterli transfer hızlarını korumak için, MCFA konsantrasyonu %80 doygunluğa ulaşmadan önce sıyırma çözeltisini yeni bir parti ile değiştirin.
NOT: N-kaproik asidin maksimum çözünürlüğü 10.3 g· 25 ° C'de L-1 ve n-kaprilik asidinki 0.67 g· 25 °C'de L-1 .
- Parti döngüsü sırasında sıyırma çözeltisi içindeki MCFA konsantrasyonunu günlük olarak ölçün. LLE sistemi, MFCA'ları biyoreaktörden sıyırma çözeltisine sürekli olarak aktararak zaman içinde MCFA konsantrasyonunu artırır. Proses, yüksek MCFA titreleri üretmek için uzun süreler boyunca çalışabilir. MCFA'ların hacimsel üretim hızı (mM C·L-1·d-1) Denklem 111 kullanılarak tahmin edilebilir.
- Sıyırma solüsyonunu değiştirin.
- Diyaframlı pompayı kapatın (Şekil 1D).
- Sıyırma solüsyonu peristaltik pompasını kapatın (Şekil 1M).
- BEM'in boru tarafındaki girişini ve boru tarafındaki çıkışını sıkıştırmak için hortum kelepçeleri kullanın.
- pH kontrol sistemini kapatın ve port bağlantılarını takılı tutarken (mümkünse) sıyırma çözeltisi rezervuar kapağını çıkarın.
- Sıyırma çözeltisi haznesini çıkarın (Şekil 1E).
- Sıyırma çözeltisi rezervuarını, NaOH kullanılarak pH 9'a ayarlanmış taze bir sulu 0,5 M borik asit çözeltisi partisi ile değiştirin (bkz. adım 1.4). Kapağı hazneye yeniden takın.
- Hortum kelepçelerini BEM'in boru tarafındaki girişinden ve boru tarafındaki çıkışından çıkarın.
- Sıyırma solüsyonu peristaltik pompasını (Şekil 1M) ve ardından diyaframlı pompayı (Şekil 1D) açın. Sistem çalışması şimdi geri yüklendi.
- Membran bakımı.
- Temizlik için FEM ve BEM'i her üç ayda bir LLE sisteminden çıkarın. Üç ay, muhafazakar bir tahmini temizleme sıklığıdır.
NOT: Uygulamaya bağlı olarak, kullanıcılar membranları daha fazla veya daha az sıklıkta temizleyebilir. Azalan membran performansının belirtileri Temsili Sonuçlar bölümünde açıklanmıştır. Bakım sırasında pompalar ve pH kontrol cihazı kapatılmalıdır. Temizleme talimatları membran üreticisi tarafından sağlanmalıdır. - Sıvıları LLE sisteminden organik faz ekstraksiyon çözeltisi hatlarından başlayarak, ardından fermantasyon suyu hatları ve sıyırma çözeltisi hatlarından başlayarak ayrı kaplara boşaltın.
- Membranlar temizlendikten ve yeniden takıldıktan sonra, sıvıları ilgili rezervuarlarına geri koyun.
- Yukarıda açıklanan yaklaşımı kullanarak LLE sistemini yeniden başlatın (bkz. adım 2.1-2.2).
- Temizlik için FEM ve BEM'i her üç ayda bir LLE sisteminden çıkarın. Üç ay, muhafazakar bir tahmini temizleme sıklığıdır.
Sonuçlar
Pozitif MCFA ekstraksiyon sonuçları, alkali sulu faz sıyırma çözeltisinde (Şekil 2) MCFA ürünlerinin sabit bir birikimi ve fermantasyon suyunda nispeten stabil MCFA konsantrasyonları (veriler gösterilmemiştir) ile gösterilir. Şekil 2 , sürekli LLE çalışması sırasında sıyırma çözeltisinin üç yarı parti döngüsünü göstermektedir. Bir döngü iki aşamadan oluşur: parti değiştirme aşaması (Şekil 2: Gün 24, Gün 46 ve Gün 68) ve MCFA biriktirme aşaması (Şekil 2: Gün 0-24, Gün 25-46, Gün 47-68). Bu özel fermantasyon ve LLE sistemi için döngü süresi yaklaşık 20-24 gündü. Bununla birlikte, döngü süresi, biyoreaktör hacmi, biyolojik üretkenlik, sıyırma çözeltisi hacmi, içi boş fiber membran alanı ve LLE sistemi içindeki sıvı devridaim oranları dahil olmak üzere birçok faktöre bağlı olduğundan uygulamalar arasında farklılık gösterecektir. Bir parti döngüsü sırasında, fermantasyon suyunda bulunan çeşitli küçük organik asitlerin (örneğin, hümik asit, fulvik asitler) düşük seviyeli birlikte ekstraksiyonu nedeniyle sıyırma çözeltisinin rengi berraktan sarımsı-kahverengiye değişebilir (Şekil 3). Negatif MCFA ekstraksiyon sonuçları, sıyırma çözeltisinde MCFA ürünlerinin yavaş birikmesi ve önceden belirlenmiş taban çizgisine göre fermantasyon suyunda yüksek MCFA konsantrasyonları ile gösterilir.
Kaproatın biyolojik üretkenliği, bu fermantasyon işlemleri sırasında genellikle kaprilattan daha yüksektir; Bu nedenle, kaproatın sıyırma çözeltisinde kaprilata kıyasla daha hızlı birikmesi yaygındır. Ayrıca, asetat ve bütirat gibi SCFA'ların, Şekil 2'de görüldüğü gibi sıyırma çözeltisinde daha düşük miktarlarda toplanması normaldir. Mineral yağdaki TOPO, MCFA'lar için SCFA'lardan daha yüksek bir afiniteye sahiptir, bu da MCFA'ların seçici olarak uzaklaştırılmasına neden olur. Saboe ve ark.12, Kaur ve ark.13, Carvajal-Arroyo ve ark.14 ve Ge ve ark.11 tarafından yapılan çalışmalar, sulu çözeltiler içeren çoklu uygulamalarda TOPO'nun yağ asitleri için yüksek seçiciliğini göstermiştir. İkinci parti döngüsü sırasında MCFA'ların SCFA'lara bölümlenme oranı Şekil 4'te gösterilmektedir. Bir toplu iş döngüsüne birkaç gün içinde 40:1'den büyük MCFA:SCFA bölümleme oranları beklenebilir. MCFA:SCFA bölümleme oranı, ekstraksiyon işlemi sözde kararlı bir duruma yaklaştıkça plato yapacaktır. Birkaç gün sonra >40 oranlarına ulaşılamazsa, bu, TOPO özütleyicisinin bozulduğunu veya ayrıldığını gösterir. Böyle bir durumda, yeni bir ekstraksiyon çözeltisi hazırlanmalıdır (bkz. adım 1.1). Plato fazını takiben oran azalırsa, bu, MCFA'ların doyma noktalarının %80'inden fazla biriktiğini gösterir. Böyle bir durumda, yeni bir sıyırma çözeltisi hazırlanmalıdır (bkz. adım 1.4)
Düşük MCFA ekstraksiyon verimliliği, LLE sistemi içindeki yetersiz akış hızlarından kaynaklanabilir. Şekil 5'te, azalan sıvı devridaim hızlarının MCFA ekstraksiyon verimliliği üzerindeki etkisini göstermek için fermantasyon suyu ve sıyırma çözeltisi sirkülasyon hattında pompalama hızı azaltılmıştır. Ekstraksiyon verimliliği, biyoreaktör tarafından üretilen toplam MCFA'lara ve LLE tarafından ekstrakte edilen MCFA'lara göre sıyırma çözeltisinde ekstrakte edilen MCFA'nın yüzdesi olarak tanımlanır. Normal çalışma sırasında %85'ten daha yüksek ekstraksiyon verimlilikleri beklenebilir (Şekil 5, Gün 1-14). Pompa hızı düşük olduğunda (Şekil 5, Gün 14), yanıt olarak ekstraksiyon verimliliği düşer. Yeterli bir pompa hızı geri kazanıldığında, ekstraksiyon verimliliğinin geri kazanılması birkaç gün sürebilir. Bu, sıyırma çözeltisinin ekstraksiyon oranlarındaki farkın (fermantasyon suyundan (daha düşük) (daha yüksek) neden olduğu ekstraksiyon çözeltisindeki MCFA'ların kararlı durum konsantrasyonundaki bir azalmadan kaynaklanabilir.
(1) membran kirlenmesi, (2) tıkanıklıklar nedeniyle LLE sisteminin her aşamasında kısıtlı sıvı akışı, (3) membran kontaktörlerinde gaz ceplerinin oluşumu ve (4) sıyırma çözeltisindeki MCFA konsantrasyonlarının doyma noktalarına yaklaşmasına izin verilmesi dahil olmak üzere diğer birçok faktör ekstraksiyon verimliliğinin azalmasına katkıda bulunabilir. Membran kirlenmesi, başlangıç koşullarına göre zaman içinde membran akısının azalması ile gösterilir. FEM'de biyofilm oluşumu olası olmasa da, hücre kalıntılarının ve diğer askıda katı maddelerin birikmesi nedeniyle kirlenme meydana gelebilir. Ayrıca, BEM aseptik iken, membran kontaktörü veya boru içindeki yağ asidi tuzlarının zamanla çökelmesi nedeniyle akış engellenebilir. Bununla birlikte, membran kontaktörlerinin rutin bakımı ve temizliği (bkz. adım 2.6), kirlenme ve tuz çökeltme sorunlarının oluşmasını engellemelidir. Yanlış konumlandırma nedeniyle bazen membran kontaktörlerinin üst kabuk tarafında gaz cepleri oluşur. Membran kontaktörleri, kabuk tarafı çıkış portunun en yüksek noktada olmasını sağlamak için dikeyden hafifçe eğilmeli ve oluşan herhangi bir gazın kontaktörden kaçmasına izin vermelidir. LLE sistemindeki sıvı akışı, gaz ceplerinin dışarı atılmasına yardımcı olmak için yüklenicilerin altından üstüne doğru akacak şekilde yapılandırılmıştır. Son olarak, ekstraksiyon çözeltisinden BEM'deki sıyırma çözeltisine MCFA transferi, sıyırma çözeltisindeki çok yüksek MCFA konsantrasyonlarında azaltılır. Bu sorun, sıyırma solüsyonunun daha sık değiştirilmesiyle giderilebilir.
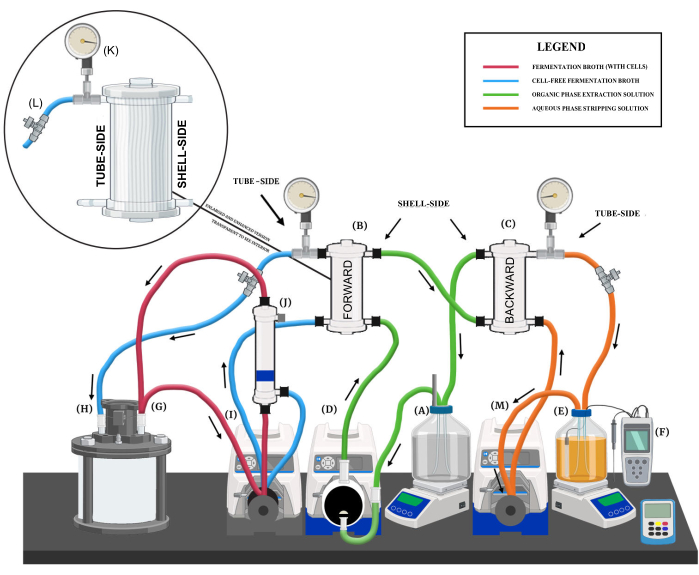
Şekil 1: Sıvı-sıvı ekstraksiyon sistemine genel bakış. Ana sistem bileşenlerini, çeşitli akışkan devrelerini ve akış yönlerini gösteren diyagramatik bir işleme. Ana sistem bileşenleri aşağıdaki gibi etiketlenmiştir: (A) organik faz ekstraksiyon çözeltisi rezervuarı, (B) ileri değişim membranı, (C) geri değişim membranı, (D) ekstraksiyon çözeltisi diyafram pompası, (E) sulu faz sıyırma çözeltisi rezervuarı, (F) pH kontrol sistemi, (G) biyoreaktör çıkış çıkış portu, (H) biyoreaktör dönüş akış portu, (I) ileri değişim membranı ve içi boş fiber membran filtre peristaltik pompa, (J) içi boş fiber membran filtre, (K) basınç göstergesi, (L) iğneli valf ve (M) sıyırma çözeltisi peristaltik pompa. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
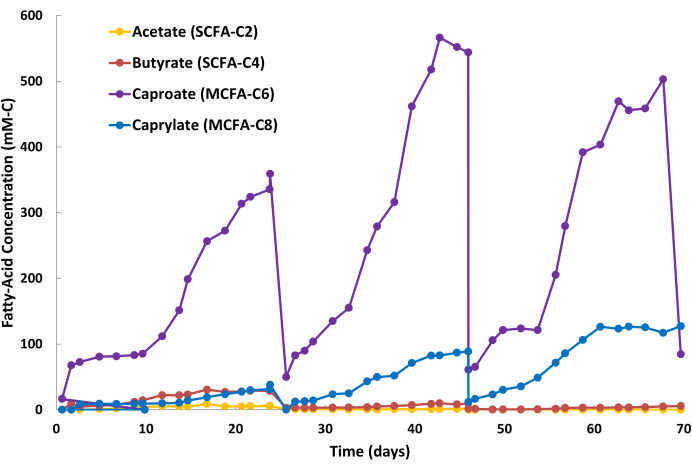
Şekil 2: Sıyırma çözeltisinde yağ asidi birikimi. Sürekli sıvı-sıvı ekstraksiyon işlemi sırasında sıyırma çözeltisinin üç parti döngüsü sırasında kısa zincirli yağ asitleri ve orta zincirli yağ asidi konsantrasyonlarını gösteren veriler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Ekstraksiyondan sonra sıyırma çözeltisi renk değişimi. Sulu faz sıyırma çözeltisinin renk değişimini gösteren bir fotoğraf, bir parti döngüsünden önce (yani, parti öncesi) ve sonrasında (yani parti sonrası). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
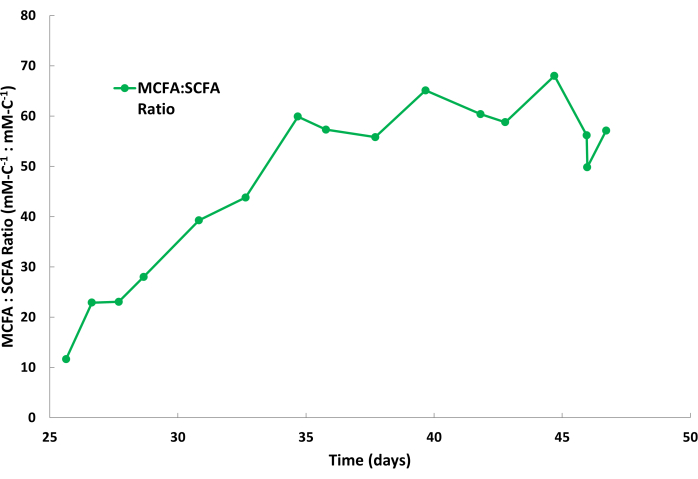
Şekil 4: Sıyırma çözeltisindeki yağ asidi oranları. Sürekli sıvı-sıvı ekstraksiyon işlemi sırasında sıyırma çözeltisinin bir parti döngüsü sırasında orta zincirli yağ asitlerinin kısa zincirli yağ asitlerine oranını gösteren veriler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
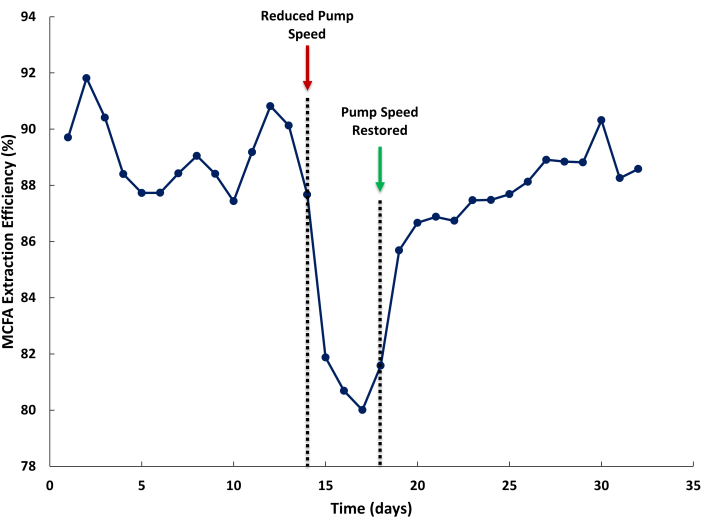
Şekil 5: Membran akış hızlarının ekstraksiyon verimliliği üzerindeki etkisi. İleri ve geri değişim membranından geçen yetersiz akış hızlarının çalışma sırasında orta zincirli yağ asidi ekstraksiyon verimliliği üzerindeki etkisini gösteren veriler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Biyolojik olarak üretilen MCFA'lar, SCFA'lar ve alkoller2 dahil olmak üzere çeşitli organik bileşiklerle birlikte karışımlarda yaygın olarak bulunur. Sonuç olarak, bunları geri kazanmak ve etkili bir şekilde kullanmak için seçici bir ayırma işlemi gereklidir. Burada geliştirilen LLE sistemi, SCFA'ları ve alkolleri korurken bu karışımlardan MCFA'ları sürekli olarak seçici olarak çıkarır. Bu işlevsellik, LLE sistemini, MCFA'ların, SCFA'ların ve alkollerin birincil metabolitleri8 oluşturduğu mikrobiyal zincir uzaması gibi fermantasyon uygulamaları için özellikle uygun hale getirir. Spesifik olarak, LLE sistemi, MCFA'ları çıkararak, ürün inhibisyonunu1 önleyerek, SCFA ve alkol reaktanları müteakip biyolojik dönüşüm için fermantasyon suyunda bırakarak zincir uzama işleminin ilerlemesine izin verir. LLE sistemi, özel ekstraksiyon çözümü değiştirilerek diğer uygulamalar için özelleştirilebilir. Örneğin, fermantasyon sırasında üretilen SCFA'ların sürekli ekstraksiyonu, ekstrakt edici çözelti karışımından TOPO'nun çıkarılmasıyla aynı LLE sistemi kullanılarak elde edilebilir.
Bu nedenle, LLE yönteminin önemi, bu biyoişleme ve biyoteknoloji uygulamaları için diğer yöntemlere kıyasla daha sağlam bir MCFA ekstraksiyon tekniği sağlamasında yatmaktadır. Karışmayan sıvılarla yerinde bifazik ekstraksiyon, MCFA'ların fermantasyon suyu15'ten ekstrakte edilmesine yönelik başka bir yaklaşımdır. Ancak, bu yaklaşım nispeten verimsizdir. Sulu faz (yani fermantasyon suyu) ile organik faz arasında emülsiyon tabakaları oluşur ve kütle transfer hızlarını ciddi şekilde sınırlar. Faz katmanları arasındaki minimum arayüzey sıvısı karışımı da kütle transferini sınırlar. Diğer bir dezavantaj, mikrobiyal hücrelerin organik faz ile doğrudan temas halinde olması, sürüklenmeye, inhibisyona ve hücre ölümüne neden olmasıdır15. Son olarak, yerinde bifazik ekstraksiyon, organik fazın çıkarılması ve değiştirilmesi için sık sık bakım gerektirir.
Biyoreaktör içinde yüksek seyreltme oranları uygulamak, ürün inhibisyonunu önlemenin başka bir yöntemidir16. Yüksek seyreltme oranları, biyoreaktörde yüksek reaktan konsantrasyonlarını koruyarak yüksek üretkenlik sağlayabilir. Bununla birlikte, bu yaklaşım dezavantajlıdır çünkü biyokütlenin yıkanmasına, büyük atık su hacimlerinin oluşmasına ve yüksek substrat kayıplarına (yani SCFA'lar ve alkoller) katkıda bulunur ve bu da düşük verimle sonuçlanır. Bu dezavantajlar, hareketsiz hale getirilmiş biyokütle ve atık su geri dönüşümü kullanılarak azaltılabilir, ancak bu müdahaleler sistem karmaşıklığına katkıda bulunur17. Son olarak, ürün akışındaki MCFA konsantrasyonu seyreltiktir, bu da MCFA'yı verimsiz ve maliyetli hale getirir.
Yeni bir ekstraksiyon yaklaşımı, MCFA'ların organik ve sulu fazları fiziksel olarak ayıran ve böylece mikrobiyal biyokütleyi koruyan ve koruyan tek bir ileri ekstraksiyon membranı ile sürekli olarak damıtılmasını içerebilir. MCFA'lar seçici olarak organik faza ekstrakte edilecek ve daha sonra damıtılacaktır. Rafinat, ekstraksiyon membranına sürekli olarak geri dönüştürülebilir. Bununla birlikte, sürekli damıtma, özellikle laboratuvar ortamlarında teknik olarak zordur ve uzun süreli çalışma sırasında kimyasal özütleyicinin bozulmasına veya kaybolmasına neden olabilir. Damıtma ayrıca organik fazın ve MCFA ürünlerinin18 termal bozunmasına neden olabilir.
LLE süreci, birkaç kritik özellik ve işleme adımını bir araya getirerek bu alternatif yaklaşımlarla ilişkili birçok dezavantajı önler. İlk olarak, hidrofilik içi boş fiber membran filtre, biyokütle hücrelerini (biyokatalizörler) FEB'deki ekstrakt çözeltisine maruz kalmaktan korumak gibi ikili bir amaca hizmet ederken, LLE sisteminde kirlenmeyi ve katı birikimini azaltan berrak bir MCFA açısından zengin süzüntü sağlar. İkinci olarak, sıvı geçişini önlemek için, her bir membran kontaktörünün boru tarafında geri basınç oluşturmak için iğneli valfler ekledik. Bu önlem, hidrofobik organik çözücünün FEM ve BEM'deki kabuk tarafından sulu tüp tarafına istenmeyen sızıntısını önleyerek hafif bir transmembran basınç gradyanını korur. Ek olarak, sıvı akışları, membran modüllerinin içinde toplanabilecek gaz kabarcıklarının sıkışmasını önlemek için tabandan FEM ve BEM'in tepesine paralel olarak akacak şekilde yapılandırılır, bu da transfer verimliliğini azaltır ve taşınmaya neden olur. Ayrıca, bu yöntem, aşındırıcı MCFA içeren özütleyici çözeltiyi pompalamak için kimyasal olarak dirençli bir PTFE pompa kafasına sahip bir diyaframlı pompa kullanır ve sistemi, ekstraksiyon işlemini tehlikeye atabilecek korozyon ve arızalardan korur. Son olarak, pH kontrollü alkali sıyırma çözeltisi, MCFA'ların LLE sistemi boyunca biyoreaktörden sıyırma çözeltisi rezervuarına yüksek oranlarda sürekli transferine izin veren bir pH gradyanını korur, burada MCFA'lar protondan arındırılır ve yüksek titrelerde birikerek aşağı akış ürün geri kazanımını kolaylaştırır.
Bu LLE yöntemi, laboratuvar ölçekli biyoreaktörlerden (6 L çalışma hacmine kadar) sürekli MCFA ekstraksiyonu için uygundur ve çeşitli çalışmalardauzun süreli çalışma için doğrulanmıştır 1,9,11,19. LLE yöntemi, daha büyük ölçekli uygulamalar14 (yani pilot ölçekli biyoreaktörler) için de uygulanabilir, ancak orantılı olarak ölçeklendirilmiş membranlar ve sıvı işleme ekipmanı gerektirir. Bununla birlikte, yöntemin, esas olarak bakım ve sistem karmaşıklığı alanında bazı sınırlamaları vardır. Proses sürekli çalışacak şekilde tasarlandığından, membran modüllerine ve pompalara sık sık bakım yapılması gerekir ve bu da önemli arıza sürelerine neden olur. Diğer bir dezavantaj, sıyırma çözeltisinin nispeten büyük miktarlarda NaOH ve borik asit gerektirmesidir. Ayrıca, MCFA'lar aşındırıcıdır ve belirli LLE sistem bileşenlerinin zamanla bozulmasına neden olur. Örneğin, plastik konektörler ve membran muhafazası kırılgan hale gelebilir ve çalışma sırasında değiştirilmesi gerekebilir. Son olarak, LLE sistemindeki akışkan taşıma ağı karmaşıktır ve sızıntı oluşmasına yatkın birçok bağlantı noktası içerir. Bununla birlikte, bu sınırlamaların ve dezavantajların çoğu, sürekli membran ayırma prosesleri için tipiktir ve beklenmelidir.
Genel olarak, bu LLE protokolü, çeşitli alanlardaki araştırmaları ilerletmek için etkileri olan seçici MCFA ekstraksiyonu için sağlam ve verimli bir yaklaşım sunar. Yöntem, fermantasyon sırasında hücre dışı metabolit ürünlerinin yerinde geri kazanımı için hassas fermantasyon alanında birçok ilgili uygulama bulabilir. LLE, çalışma sonrası santrifüjleme, mikro ve ultra filtreleme veya partiler halinde gerçekleştirilen solvent ekstraksiyonları gibi geleneksel aşağı akış işleme (DSP) yaklaşımlarına göre daha düşük maliyetli bir alternatif olabilir. Gerçekten de, DSP genellikle endüstriyel fermantasyon işlemlerinde önemli bir maliyet faktörünü temsil eder. LLE kullanılarak sürekli ürün ekstraksiyonu, geleneksel parti veya beslemeli parti yaklaşımlarına kıyasla operasyonların üretkenliğini ve çalışma zamanı verimliliğini önemli ölçüde artırarak sürekli fermantasyonları da mümkün kılabilir. Ayrıca, gelecekteki araştırmalar, derin ötektik çözücüler veya iyonik sıvılar gibi organik çözücüler dışındaki ekstrakt ortamlarını araştırabilir. Son olarak, bu protokolde açıklanan LLE sistemi, laboratuvar ortamında deneysel amaçlar için tasarlanmıştır; Bu nedenle, enerji gereksinimlerini, membran alanını ve genel ekstraksiyon verimlerini ve oranlarını azaltmak için optimizasyon çalışmaları için hala önemli bir alan bulunmaktadır.
Açıklamalar
Çıkar çatışması yoktur.
Teşekkürler
Yazarlar, Georgia Üniversitesi'ndeki Tarımsal Deney İstasyonu tarafından sağlanan teknik ve finansal desteğe teşekkür etmek ister. Ayrıca yazarlar, proses numunelerinin analizindeki yardımları için Samuel Ogundipe, Dr. Ronald Pegg ve Dr. Joon Hyuk Suh'a teşekkür etmek istiyor.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 10 L Media Bottle | Duran | 218018658 | |
| 3.5 L Media Bottle | Duran | 218016957 | |
| Boric acid, 99.5%, | ThermoScientific (Fisher Scientific) | 327132500 | |
| Hydrophilic MINIKROS 20CM 0.2UM PES 1MM 1.5TC X 3/4TC | Repligen | N02-P20U-10-N | |
| L/S Variable-Speed Pump Drive; 100 rpm | MasterFlex (VWR) | MFLX07528-10 | |
| L/S Variable-Speed Pump Drive; 300 rpm | MasterFlex (VWR) | MFLX07528-20 | |
| Light Mineral Oil, NF (4 Liters) (CAS: 8042-47-5) | Thomas Scientific | C761Z18 | |
| Liqui-Cel 2.5x8 X50 membrane CO2, PP Housing Viton O-rings (0.5-3 gpm (0.1-0.7 m3/h)), 1/4-in FNPT connections | 3M | LC-02508X50-G453 | |
| Magnetic Stirrer, 20 L Capacity, 110 V | Cole-Parmer | EW-04661-29 | |
| Masterflex L/S Precision Pump Tubing, Tygon, Size 14 | MasterFlex (VWR) | MFLX06402-14 | Specific tubing size will depend on application. |
| Masterflex L/S Precision Pump Tubing, Tygon, Size 16 | MasterFlex (VWR) | MFLX06402-16 | Specific tubing size will depend on application. |
| Masterflex L/S Precision Pump Tubing, Tygon, Size 17 | MasterFlex (VWR) | MFLX06402-17 | Specific tubing size will depend on application. |
| Masterflex L/S Precision Pump Tubing, Tygon, Size 18 | MasterFlex (VWR) | MFLX06402-18 | Specific tubing size will depend on application. |
| MasterFlex L/S Standard Pump Head for Precision Tubing L/S 14, Polycarbonate Housing, CRS Rotor | MasterFlex (VWR) | MFLX07014-20 | Specific pump head size will depend on application. |
| MasterFlex L/S Standard Pump Head for Precision Tubing L/S 14, Polycarbonate Housing, CRS Rotor | MasterFlex (VWR) | MFLX07014-20 | Specific pump head size will depend on application. |
| MasterFlex L/S Standard Pump Head for Precision Tubing L/S 16, Polycarbonate Housing, CRS Rotor | MasterFlex (VWR) | MFLX07016-20 | Specific pump head size will depend on application. |
| MasterFlex L/S Standard Pump Head for Precision Tubing L/S 17, Polycarbonate Housing, CRS Rotor | MasterFlex (VWR) | MFLX07017-20 | Specific pump head size will depend on application. |
| MasterFlex L/S Standard Pump Head for Precision Tubing L/S 18, Polycarbonate Housing, CRS Rotor | MasterFlex (VWR) | MFLX07018-20 | Specific pump head size will depend on application. |
| MasterFlex PTFE-diaphragm pump head, 10 to 100 mL/min | MasterFlex (VWR) | MFLX07090-62 | |
| Oakton 220 pH/ORP/Temperature Controller, 1/8 DIN | Spectrum Laboratory Products | 664-12595-E1 | |
| Oakton 220 pH/ORP/Temperature Controller, 1/8 DIN | Spectrum Laboratory Products | 664-12595-E1 | |
| Oakton Female BNC-to-Stripped Wire Adapter | Spectrum Laboratory Products | 664-12592-E1 | |
| pH Probe with BNC Connector | ThermoScientific | 10010-788 | Any pH probe with a BNC connector will suffice. |
| Precision Flow-Adjustment Valve, White Polypropylene, 1/4 NPT Male x Male | McMaster-Carr | 7792K57 | |
| ProConnex Fittings Kits - A | Repligen | ACPX-KT2-01N | Compatible with Hydrophilic MINIKROS Filter |
| ProConnex Fittings Kits - B | Repligen | ACPX-KT1-01N | Compatible with Hydrophilic MINIKROS Filter |
| Sodium Hydroxide Pellets for Analysis | Sigma Aldrich | 1.06498 | |
| Stainless-Steel Pressure Gauge 0-60 psi Stainless Steel 1/4" NPT 2.5" Face Dial | NA | XJ-219 | Any comparable pressure gauge covering 0-60 psig range will suffice. |
| Trioctylphosphine oxide (TOPO) | Sigma-Aldrich | 346187-100G |
Referanslar
- Palomo-Briones, R., et al. Near-neutral ph increased n-caprylate production in a microbiome with product inhibition of methanogenesis. Chem Eng J. 446, 137170 (2022).
- Wang, J., Yin, Y. Biological production of medium-chain carboxylates through chain elongation: An overview. Biotechnol Adv. 55, 107882 (2022).
- Watanabe, S., Tsujino, S. Applications of medium-chain triglycerides in foods. Front Nutr. 9, 802805 (2022).
- Meijaard, E., et al. The environmental impacts of palm oil in context. Nat Plants. 6 (12), 1418-1426 (2020).
- Meijaard, E., Abrams, J. F., Juffe-Bignoli, D., Voigt, M., Sheil, D. Coconut oil, conservation and the conscientious consumer. Curr Bio. 30 (13), R757-R758 (2020).
- Angenent, L. T., Magdalena, J. A., Jeon, B. S., Usack, J. G. Eco-mimicry opens new doors for bioprocess engineers. Joule. 4 (10), 2074-2077 (2020).
- Shahab, R. L., et al. A heterogeneous microbial consortium producing short-chain fatty acids from lignocellulose. Science. 369 (6507), 1214 (2020).
- Magdalena, J. A., Angenent, L. T., Usack, J. G. The measurement, application, and effect of oxygen in microbial fermentations: Focusing on methane and carboxylate production. Fermentation. 8 (4), 138 (2022).
- Agler, M. T., Spirito, C. M., Usack, J. G., Werner, J. J., Angenent, L. T. Development of a highly specific and productive process for n-caproic acid production: Applying lessons from methanogenic microbiomes. Water Sci Technol. 69 (1), 62-68 (2013).
- Gildemyn, S., et al. Upgrading syngas fermentation effluent using Clostridium kluyveri in a continuous fermentation. Biotechnol Biofuels. 10 (1), 83 (2017).
- Ge, S., Usack, J. G., Spirito, C. M., Angenent, L. T. Long-term n-caproic acid production from yeast-fermentation beer in an anaerobic bioreactor with continuous product extraction. Env Sci Technol. 49 (13), 8012-8021 (2015).
- Saboe, P. O., et al. In situ recovery of bio-based carboxylic acids. Green Chem. 20 (8), 1791-1804 (2018).
- Kaur, G., et al. Reactive extraction for in-situ carboxylate recovery from mixed culture fermentation. Biochem Eng J. 160, 107641 (2020).
- Carvajal-Arroyo, J. M., et al. Production and extraction of medium-chain carboxylic acids at a semi-pilot scale. Chem Eng J. 416, 127886 (2021).
- Choi, K., et al. In situ biphasic extractive fermentation for hexanoic acid production from sucrose by Megasphaera elsdenii NCIMB 702410. Appl Biochem Biotechnol. 171 (5), 1094-1107 (2013).
- Grootscholten, T., Steinbusch, K., Hamelers, H., Buisman, C. Improving medium chain fatty acid productivity using chain elongation by reducing the hydraulic retention time in an upflow anaerobic filter. Bioresour Technol. 136, 735-738 (2013).
- Grootscholten, T., Dal Borgo, F. K., Hamelers, H., Buisman, C. Promoting chain elongation in mixed culture acidification reactors by addition of ethanol. Biomass Bioenergy. 48, 10-16 (2013).
- Cermak, S. C., Evangelista, R. L., Kenar, J. A. Distillation of natural fatty acids and their chemical derivatives. Distillation-Advances from Modeling to Applications Chapter. 5, 109-142 (2012).
- Agler, M. T., Spirito, C. M., Usack, J. G., Werner, J. J., Angenent, L. T. Chain elongation with reactor microbiomes: Upgrading dilute ethanol to medium-chain carboxylates. Energy Environ Sci. 5 (8), 8189-8192 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır