Method Article
الاستخراج السائل السائل المستمر للأحماض الدهنية متوسطة السلسلة من مرق التخمير باستخدام أغشية الألياف المجوفة
In This Article
Summary
تم تطوير نظام استخراج السائل السائل (LLE) الذي يتضمن أغشية الألياف المجوفة لاستخراج الأحماض الدهنية متوسطة السلسلة (MCFAs) بشكل مستمر وانتقائي من مرق التخمير. يحقق نظام LLE خصائص MCFA عالية من المرق الذي يحتوي على الأحماض الدهنية قصيرة السلسلة والكحول. أيضا ، تتركز MCFAs في حل تجريد لتسهيل استعادة المنتج.
Abstract
الأحماض الدهنية متوسطة السلسلة (MCFAs ؛ أطوال الكربون: C6-C12) هي مواد كيميائية عالية القيمة تخدم مجموعة متنوعة من التطبيقات الصناعية ، بما في ذلك مضادات الميكروبات الخضراء والمكونات الغذائية ومضافات الأعلاف الحيوانية ومستحضرات التجميل والعطور والمستحضرات الصيدلانية والدهون المهيكلة. حاليا ، يتم إنتاج معظم MCFAs من زيت النخيل وجوز الهند من جنوب شرق آسيا وأمريكا الجنوبية. النهج التقليدي لحصاد النخيل وجوز الهند يسبب أضرارا بيئية كبيرة في هذه المناطق. لذلك ، يقوم الباحثون بتطوير مناهج بيولوجية (مثل الدقة وتخمير الاستزراع المفتوح) لتوليد MCFAs بشكل أكثر استدامة باستخدام ركائز منخفضة القيمة (مثل الميثانول والإيثانول واللاكتات) أو النفايات العضوية كمواد وسيطة. استطالة السلسلة الميكروبية (CE) هي منصة تخمير مفتوحة النضج بسرعة تحول الأحماض الدهنية قصيرة السلسلة (SCFAs ؛ أطوال الكربون: C1-C5) إلى مجموعة فرعية من MCFAs بمعدلات ذات صلة صناعية. ومع ذلك ، فإن الاستخراج المستمر في الموقع لمنتجات MCFA ضروري ليس فقط لتجنب تثبيط المنتج ولكن أيضا لتسهيل استعادة MCFAs في شكل نقي وقابل للاستخدام. أثبت استخراج السائل السائل (LLE) باستخدام أغشية الألياف المجوفة ومخاليط الاستخراج المستهدفة نهجا قويا لاستخراج منتجات MCFA بشكل انتقائي من مرق التخمير الذي يحتوي على SCFAs. هنا ، يتم توضيح تطبيق LLE لإزالة MCFA المستمرة باستخدام CE كنظام تخمير مرجعي و 3٪ (وزن / حجم) أكسيد ثلاثي أوكتيل فوسفين في الزيوت المعدنية كنظام استخراج. تتم إزالة الأحماض الدهنية التي تتراوح من حمض الفاليريك (C5) إلى حمض الكابريليك (C8) بشكل انتقائي من المرق المحتوي على SCFA وتتركز إلى التتر العالي في محلول تجريد قلوي شبه دفعي للمعالجة النهائية.
Introduction
الأحماض الدهنية متوسطة السلسلة (MCFAs) هي مواد كيميائية لبنة بناء عالية القيمة تتكون من أطوال سلسلة تتراوح من ستة (C6) إلى اثني عشر (C12) كربون. MCFAs لها تطبيقات صناعية في الأغذية والأعلاف الحيوانية والمستحضرات الصيدلانية ومستحضرات التجميل والعطور والعوامل المضادة للميكروبات والتخليق الكيميائي1،2،3. حاليا ، تستمد معظم MCFAs من زيت النخيل وجوز الهند الذي يتم الحصول عليه من جنوب شرق آسيا وأمريكا الجنوبية 4,5. إن الضرر البيئي الشديد المرتبط بإنتاج زيت النخيل وجوز الهند معترف به جيدا من قبل أصحاب المصلحة وعامة الناس. يستكشف الباحثون النهج البيولوجية (على سبيل المثال ، الدقة وتخمير الثقافة المفتوحة) لتوليد MCFAs بشكل أكثر استدامة باستخدام ركائز منخفضة القيمة أو نفايات عضوية كمواد وسيطة 6,7. تتمثل إحدى الطرق المستدامة لإنتاج MCFAs في إعادة تدوير تيارات النفايات العضوية باستخدام عملية تسمى استطالة السلسلة الميكروبية (CE). تشبه هذه العملية الحيوية للتخمير الثانوي الهضم اللاهوائي من حيث أنها تستغل تنوع الميكروبات اللاهوائية المفتوحة ، ولكن بدلا من تعزيز تكوين الميثان ، تقوم أنظمة CE بقمع مسار الميثان عمدا. في الميكروبيوم حيث لا يمكن تقليل الكربون إلى الحد الأقصى إلى CH4 ، ولا H2 الذي يتم الحفاظ عليه أقل من 10-4 ضغط جوي بواسطة العتائق المستهلكة للهيدروجين ، يمكن عكس تفاعل الأكسدة β الذي من شأنه عادة تكسير الكربوكسيلات ذات السلسلة الأطول إلى أسيتات (على سبيل المثال ، C6 → C4 → C2) (على سبيل المثال ، C2 → C4 → C6 ، إلخ) ، طالما أن المركب المختزل (أي ، يتم توفير مانح الإلكترون) مثل الإيثانول أو اللاكتات8. في هذا التمثيل الغذائي ، يعمل جزيء الأحماض الدهنية الذي يخضع للاستطالة كمستقبل للإلكترونات. وبالتالي ، بدلا من توليد منتج بطول كربون واحد (CH4) كما هو الحال في الهضم اللاهوائي ، تولد عملية CE MCFAs بأطوال كربون تتراوح من ستة إلى ثمانية. سوق كبير ومتنامي جاهز لاستقبال هذه المواد الكيميائية ذات المنصات الخضراء. ومع ذلك ، حتى الآن ، لم يثبت أن عملية CE تنتج MCFAs بأطوال كربون تتجاوز ثمانية كربون بمعدلات ملموسة.
يعد الاستخراج الفعال ل MCFAs مهما ليس فقط لاستعادة المنتج المطلوب ولكن أيضا لمنع تثبيط المنتج ودفع الميكروبيوم نحو إنتاج المزيد من MCFAs1. مع زيادة تركيز MCFAs ، يتم تثبيط استقلاب MCFA ويصبح أقل ملاءمة من الناحية الديناميكية الحرارية. عن طريق إزالة MCFAs بشكل مستمر ، يتم الحفاظ على معدلات الإنتاج. أيضا ، نظرا لأن SCFAs تعمل كهياكل تحتية لعملية استطالة السلسلة ، فلا ينبغي إزالتها من مرق التخمير. يجب أن تستخرج مخاليط المستخلص المستهدفة منتجات MCFA بشكل انتقائي من مرق التخمير التي تحتوي على SCFAs.
هنا ، يتم إظهار نهج قوي وعملي لاستخراج MCFAs باستمرار من مرق التخمير المحتوي على SCFA باستخدام نظام استخراج السائل السائل (LLE) الذي يشتمل على مستخرج غشاء مجوف من مادة البولي بروبيلين الأمامية الكارهة للماء ، وهو محلول مستخلص عضوي انتقائي (أكسيد ثلاثي أوكتيل فوسفين [TOPO] 9،10،11) ، ومستخرج غشاء من الألياف المجوفة للخلف. يتم تركيب مرشح واقي خلوي في المنبع لنظام LLE للاحتفاظ بالكتلة الحيوية وتخفيف تلوث الغشاء. يتم استخراج MCFAs إلى الأمام ، في شكلها البروتوني ، من مرق التخمير المائي (عادة مع نقطة ضبط الأس الهيدروجيني <5.8) إلى محلول مستخرج عضوي (أي 3٪ TOPO (w / v) في الزيوت المعدنية) ثم يتم استخراجها للخلف في محلول تجريد قلوي (pH = 9) ، حيث يتم إزالة البروتون والتركيز على التتر العالي للمعالجة النهائية. تعد نقاط ضبط الأس الهيدروجيني الخاصة ضرورية لأنها تملي تدرج التركيز بين كل مرحلة من مراحل عملية LLE ، مما يضمن نقلا صافيا ل MCFAs من مرق التخمير إلى محلول التجريد. يحقق LLE باستخدام أغشية الاستخراج الأمامية والخلفية معدلات استخراج عالية مع تقليل الكحول والاستخراج المشترك ل SCFAs. تمكن مادة المذيبات العضوية المساعدة ، توبو ، من تكوين مجمعات MCFA. هذه المجمعات أكثر قابلية للذوبان في المراحل العضوية من الماء ، مما يؤدي إلى انتقائية MCFA عالية. تتجنب عملية LLE أيضا العديد من العيوب المرتبطة بالنهج الحالية ، والتي ستتم مناقشتها في قسم المناقشة. تم إثبات التنفيذ طويل الأجل باستخدام نهج LLE هذا في دراسات متعددة9،10،11. في حين أن هذا النهج مناسب بشكل خاص للتطبيقات التي تنطوي على إنتاج MCFA عن طريق استطالة السلسلة الميكروبية ، إلا أنه مفيد أيضا في التطبيقات الأخرى التي تتطلب فصلا انتقائيا للمركبات التي تمتلك خواص كيميائية مماثلة لأنه يمكن تخصيص نظام الاستخراج العضوي.
Protocol
يتم سرد الكواشف والمواد الاستهلاكية والمعدات المستخدمة في هذه الدراسة في جدول المواد.
1. بناء ودمج المفاعل الحيوي ونظام استخراج السائل السائل
- تحضير محلول استخراج الطور العضوي والخزان.
- تحضير 2 لتر من محلول استخراج الطور العضوي عن طريق إذابة 60 جم من أكسيد ثلاثي أوكتيل فوسفين (TOPO) في الزيت المعدني باستخدام لوحة تحريك مغناطيسية ومحرك.
- أضف محلول الاستخراج إلى خزان زجاجي سعة 2 لتر (أي زجاجة شوت).
- ضع الخزان على لوحة تحريك مغناطيسية (الشكل 1 أ). سرعة الخلط الموصى بها أثناء التشغيل المستمر LLE هي 150-250 دورة في الدقيقة.
- قم بإعداد غطاء ثلاثي المنافذ لخزان محلول الاستخراج.
- قم بتوصيل أنبوب غمس بالمنفذ الأول ليكون بمثابة منفذ تدفق خارجي يوفر محلول استخراج لغشاء الاستخراج الأمامي (FEM) (الشكل 1 ب).
- قم بتثبيت منفذ ثان ليكون بمثابة منفذ إرجاع لمحلول الاستخراج من غشاء الاستخراج الخلفي (BEM) (الشكل 1C).
- أضف منفذا ثالثا ، مفتوحا على الغلاف الجوي ، لتخفيف تقلبات الضغط التي تسببها مضخة الحجاب الحاجز.
- قم بتوصيل مضخة الحجاب الحاجز بأغشية الاستخراج.
- ضع محرك مضخة متغير السرعة 100 دورة في الدقيقة مزود برأس مضخة غشاء متعدد تترافلورو إيثيلين (PTFE) بجوار الخزان (الشكل 1 د).
- قم بتوصيل منفذ التدفق الخارجي لخزان محلول الاستخراج (الشكل 1A) بمدخل مضخة الحجاب الحاجز ثم مخرج مضخة الحجاب الحاجز إلى مدخل جانب القشرة عند قاعدة FEM (الشكل 1B) باستخدام أنبوب المضخة المرن (على سبيل المثال ، الحجم 16 ، 18).
- قم بتوصيل مخرج جانب الغلاف في الجزء العلوي من FEM بالمدخل الجانبي للصدفة عند قاعدة BEM (الشكل 1C) باستخدام أنبوب مضخة مرن (على سبيل المثال ، الحجم 18).
- قم بتوصيل مخرج جانب الغلاف في الجزء العلوي من BEM بمنفذ الإرجاع في خزان محلول الاستخراج (الشكل 1 أ) باستخدام أنابيب ضخ مرنة (على سبيل المثال ، الحجم 16 ، 18).
ملاحظة: ينقل مكون النظام هذا MCFAs المستخرجة من مرق التخمير في FEM إلى محلول التجريد في BEM.
- تحضير محلول تجريد الطور المائي والخزان.
- تحضير 3.25 L من محلول تجريد الطور المائي عن طريق أخذ محلول حمض البوريك 0.5 M وتعديله إلى الرقم الهيدروجيني 9 باستخدام NaOH.
- صب المحلول في خزان زجاجي سعة 3.5 لتر مع شريط تحريك مغناطيسي.
- ضع الخزان على لوحة تحريك مغناطيسية (الشكل 1E).
- قم بإعداد غطاء بأربعة منافذ لخزان محلول التجريد.
- قم بتوصيل أنبوب غمس بالمنفذ الأول ليكون بمثابة منفذ تدفق خارجي يوفر حل تجريد ل BEM.
- قم بتثبيت منفذ ثان يشتمل على Y مناسب ل (1) يعمل كمنفذ تدفق عائد لمحلول التجريد من BEM و (2) يعمل كتيار احتجاز لإضافات NaOH من نظام التحكم في الأس الهيدروجيني.
- إضافة منفذ ثالث، مفتوح على الغلاف الجوي، لمراعاة الزيادة في الحجم الناجمة عن إضافات هيدروكسيد الصوديوم وتراكم MCFA.
- توفير منفذ رابع لاستيعاب مسبار الأس الهيدروجيني لوحدة التحكم في الأس الهيدروجيني.
- قم بتركيب نظام التحكم في الأس الهيدروجيني في خزان محلول التجريد.
- دمج نظام التحكم في الأس الهيدروجيني مع نقطة ضبط الأس الهيدروجيني 9 مع خزان محلول التجريد (الشكل 1F). استخدم 5 M NaOH كحل أساسي مع وحدة التحكم في الأس الهيدروجيني لمواجهة MCFAs المجمعة.
- أدخل مسبار الأس الهيدروجيني من خلال منفذ خزان محلول التجريد وعلقه في محلول التجريد.
ملاحظة: لا يتطلب نظام التحكم في الأس الهيدروجيني هذا محلولا حمضيا.
- تحضير منافذ توصيل المفاعل الحيوي.
- تعيين منفذين ، منفذ تدفق خارجي ومنفذ تدفق عائد ، في المفاعل الحيوي للتوصيل بنظام استخراج السائل السائل (LLE) (الشكل 1G ، H).
- قم بتوصيل أنبوب غمس بمنفذ التدفق الخارجي. سيتم ضخ المرق الغني ب MCFA من المفاعل الحيوي في منفذ التدفق الخارجي إلى نظام LLE.
ملاحظة: يدخل المرق أولا إلى مرشح غشاء الألياف المجوفة قبل أغشية الاستخراج لإزالة الخلايا والمواد الصلبة الأخرى لمنع القاذورات. - أدخل نقطة الإنطلاق في منفذ تدفق العودة لاستقبال: (1) مرق مستنفد من MCFA معاد تدويره من FEM و (2) مرق يحتوي على خلية من مرشح غشاء الألياف المجوفة.
- قم بتركيب مرشح غشاء الألياف المجوفة.
- ضع محرك مضخة متغير السرعة 300 دورة في الدقيقة بجوار المفاعل الحيوي (الشكل 1I).
- قم بتثبيت غشاء الألياف المجوفة المحب للماء (الشكل 1J) على حامل حلقي فوق المضخة التمعجية.
- قم بتكديس رأسي مضخة تمعجيين على محرك المضخة ، كبير (على سبيل المثال ، الحجم 17) وصغير (على سبيل المثال ، الحجم 16).
ملاحظة: يتم توصيل رأس المضخة الأكبر بمرشح الغشاء المصنوع من الألياف المجوفة لضمان أن معدل التدفق المتخلل أكبر من معدل التدفق الذي يغذي FEM. إذا لم يكن الأمر كذلك ، استهلاك النفاذية بشكل أسرع مما يتم إنتاجه ، مما يتسبب في تكوين فراغ. - قم بتوصيل منفذ التدفق الخارجي في المفاعل الحيوي بمدخل رأس المضخة الكبير باستخدام أنابيب مضخة مرنة (على سبيل المثال ، الحجم 17).
- قم بتوصيل مخرج رأس المضخة الكبير بمرشح الغشاء المصنوع من الألياف المجوفة المحبة للماء عند مدخل جانب الأنبوب عند قاعدة المرشح باستخدام أنبوب مضخة مرن (على سبيل المثال ، الحجم 17).
- قم بتغطية المنفذ العلوي لجانب الغلاف للمرشح لمنع تدفق الهواء.
ملاحظة: سوف يتدفق المرق الغني ب MCFA (الذي يحتوي على خلايا) عبر أنابيب الألياف المجوفة ويعود إلى المفاعل الحيوي. سوف يمر المرق الصافي (الخالي من الخلايا) عبر غشاء البولي إيثر سلفون (PES) المحب للماء 0.2 ميكرومتر ويتجمع على جانب قشرة الفلتر.
- قم بتوصيل FEM.
- قم بتثبيت أول وحدة غشاء مجوفة كارهة للماء (FEM) على حامل حلقي فوق المضخة (الشكل 1 ب).
- قم بتوصيل مرشح غشاء الألياف المجوفة المحب للماء (الشكل 1J) عند مخرج جانب الغلاف بمدخل رأس المضخة الصغير باستخدام أنابيب مضخة مرنة (على سبيل المثال ، الحجم 16 ، 18).
- قم بتوصيل مخرج رأس المضخة الصغير ب FEM عند مدخل جانب الأنبوب عند قاعدة الوحدة باستخدام أنبوب مضخة مرن (على سبيل المثال ، الحجم 16 ، 18).
- قم بتوصيل مقياس الضغط (الشكل 1K) وصمام تقييد التدفق (الشكل 1L) بمخرج جانب الأنبوب ل FEM باستخدام تركيبات اقتران وتركيب نقطة الإنطلاق.
- قم بتوصيل مخرج جانب الأنبوب ل FEM بمنفذ الإرجاع في المفاعل الحيوي باستخدام أنابيب ضخ مرنة (على سبيل المثال ، الحجم 18).
ملاحظة: ينقل مكون النظام هذا MCFAs من مرق التخمير الصافي إلى محلول الاستخراج ثم يعيد المرق الصافي إلى المفاعل الحيوي.
- قم بتوصيل BEM.
- ضع محرك مضخة متغير السرعة 300 دورة في الدقيقة مزود برأس مضخة تمعجية (على سبيل المثال ، الحجم 16) بجوار المفاعل الحيوي (الشكل 1M).
- قم بتثبيت وحدة الغشاء المجوفة الثانية الكارهة للماء على حامل حلقي فوق المضخة التمعجية (الشكل 1C).
- قم بتوصيل منفذ التدفق الخارجي لخزان محلول التجريد بمدخل المضخة التمعجية ومخرج المضخة بالمدخل الجانبي للأنبوب عند قاعدة BEM باستخدام أنابيب مضخة مرنة (على سبيل المثال ، الحجم 16 ، 18).
- قم بتوصيل مقياس الضغط وصمام تقييد التدفق بمخرج جانب الأنبوب ل BEM باستخدام تركيبات اقتران وتركيب نقطة الإنطلاق.
- قم بتوصيل المخرج الجانبي للأنبوب في الجزء العلوي من BEM بمنفذ تدفق عودة خزان محلول التجريد باستخدام أنابيب ضخ مرنة (على سبيل المثال ، الحجم 16 ، 18).
ملاحظة: ينقل مكون النظام هذا MCFAs من محلول الاستخراج إلى محلول التجريد في BEM ثم يعيد محلول التجريد إلى خزانه.
2. بدء تشغيل نظام استخراج السائل السائل
- رئيس وتعميم خطوط الطور المائي.
- قم بتشغيل المضخة التمعجية لمحلول التجريد / BEM (الشكل 1M) واضبط سرعة المضخة لتحقيق معدل تدفق ثابت بين 25-250 mL · min-1. يمكن أن يستوعب BEM مجموعة كبيرة نسبيا من معدلات التدفق. ابدأ بمعدل تدفق مرتفع بشكل متحفظ في البداية لضمان استخراج MCFA الكافي. يمكن تقليل معدل التدفق بشكل تدريجي لاحقا أثناء التشغيل لإطالة عمر خدمة معدات المضخة والأنابيب.
ملاحظة: يجب ألا تكون سرعة التدفق منخفضة جدا بحيث تسمح بتراكم MCFAs في مرق المفاعل الحيوي (انظر النتائج التمثيلية). - أغلق صمام الإبرة ببطء عند مخرج جانب القشرة ل BEM (الشكل 1C) لإنشاء ضغط خلفي يبلغ ~ 5 رطل لكل بوصة مربعة.
- قم بتشغيل المفاعل الحيوي / المضخة التمعجية FEM (الشكل 1I) واضبط سرعة المضخة لتحقيق معدل تدفق ثابت بين 25-250 مل · دقيقة -1. يمكن أن تستوعب FEM مجموعة كبيرة نسبيا من معدلات التدفق. ابدأ بمعدل تدفق مرتفع بشكل متحفظ في البداية لضمان استخراج MCFA الكافي. يمكن تقليل معدل التدفق بشكل تدريجي لاحقا أثناء التشغيل لإطالة عمر خدمة معدات المضخة والأنابيب.
ملاحظة: يجب ألا تكون سرعة التدفق منخفضة جدا بحيث تسمح بتراكم MCFAs في مرق المفاعل الحيوي (انظر قسم النتائج التمثيلية). - أغلق صمام الإبرة ببطء عند مخرج جانب القشرة ل FEM (الشكل 1 ب) لإنشاء ضغط خلفي ~ 5 رطل لكل بوصة مربعة.
- تحقق بصريا من خطوط التدفق المرتجع لضمان تدفق مستمر وأن الخطوط قد تم تجهيزها.
- تحقق من جمع المرق الصافي داخل جانب القشرة من مرشح غشاء الألياف المجوفة (الشكل 1J).
ملاحظة: سوف يستغرق الأمر عدة ساعات لملء FEM وإنشاء تدفق ثابت بين مرشح غشاء الألياف المجوف و FEM. يجب ألا تكون سرعة التدفق منخفضة جدا بحيث تسمح بتراكم MCFAs في مرق المفاعل الحيوي (انظر قسم النتائج التمثيلية).
- قم بتشغيل المضخة التمعجية لمحلول التجريد / BEM (الشكل 1M) واضبط سرعة المضخة لتحقيق معدل تدفق ثابت بين 25-250 mL · min-1. يمكن أن يستوعب BEM مجموعة كبيرة نسبيا من معدلات التدفق. ابدأ بمعدل تدفق مرتفع بشكل متحفظ في البداية لضمان استخراج MCFA الكافي. يمكن تقليل معدل التدفق بشكل تدريجي لاحقا أثناء التشغيل لإطالة عمر خدمة معدات المضخة والأنابيب.
- رئيس وتعميم خطوط المرحلة العضوية.
- قم بتشغيل مضخة الحجاب الحاجز بمحلول استخراج الطور العضوي (الشكل 1D) واضبط سرعة المضخة لتحقيق معدل تدفق ثابت بين 5.0-50 mL ·min-1. ابدأ بمعدل تدفق منخفض بشكل متحفظ في البداية لتقليل الضغط في استخراج المرحلة العضوية وتقليل مخاطر التقاطع. إذا لزم الأمر ، يمكن زيادة معدل التدفق بشكل تدريجي لاحقا أثناء التشغيل لتحسين كفاءة الاستخراج
- انتظر حتى يتم ملء FEM و BEM.
- تحقق بصريا من منفذ التدفق المرتجع في خزان محلول الاستخراج لضمان التدفق المستمر.
- تحقق من عدم عبور أي محلول طور عضوي إلى محلول التجريد أو خطوط مرق التخمير. في حالة حدوث تقاطع ، يمكن رؤية قطرات صغيرة من المرحلة العضوية. إذا حدث هذا ، فقم بتقليل سرعة مضخة الحجاب الحاجز وزيادة الضغط الخلفي قليلا عند FEM أو BEM حسب الاقتضاء. لا تتجاوز 10 رطل لكل بوصة مربعة.
ملاحظة: لمنع تقاطع الغشاء ، من المهم إنشاء تدفق وضغط خلفي داخل خطوط الطور المائي قبل تحضير خطوط الطور العضوي.
- استخراج MCFAs باستمرار من المفاعل الحيوي.
- يجب أن يعمل نظام LLE بكامل طاقته. السماح للنظام بالعمل بشكل مستمر أثناء تشغيل المفاعل الحيوي.
- قياس تركيزات MCFA في المفاعل الحيوي يوميا لضمان الاستخراج الكافي من MCFAs. في حالة حدوث تركيزات MCFA مرتفعة في المفاعل الحيوي ، يشير ذلك عادة إلى معدلات تدفق غير كافية لمرق التخمير عبر FEM. قد يشير أيضا إلى انخفاض تدفق الغشاء بسبب القاذورات والحاجة إلى الصيانة (انظر الخطوة 2.6).
ملاحظة: يمكن قياس تركيزات SCFA و MCFA عن طريق كروماتوغرافيا الغاز وفقا للطريقة التي وصفها Ge et al.11.
- مراقبة تراكم MCFA في خزان محلول التجريد.
- قم بقياس تركيز MCFA داخل محلول التجريد يوميا أثناء دورة الدفعات. ينقل نظام LLE باستمرار MFCAs من المفاعل الحيوي إلى محلول التجريد ، مما يزيد من تركيز MCFA بمرور الوقت. يمكن تشغيل العملية لفترات طويلة لإنتاج عيار MCFA عالي. يمكن تقدير معدل الإنتاج الحجمي ل MCFAs (mM C · L-1 · d-1) باستخدام المعادلة 111.
ملاحظة: معدل الإنتاج الحجمي =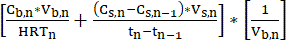 (مكافئ 1)
(مكافئ 1)
أين:
Cb,n = تركيز MCFA في مرق التخمير في اليوم n ، mM C
Cs ، n = تركيز MCFA في محلول التجريد في اليوم n ، mM C
Cs ، n-1 = تركيز MCFA في محلول التجريد في اليوم n-1 ، mM C
Vs، n = حجم محلول التجريد في اليوم n ، L
Vb، n = حجم مرق التخمير (حجم المفاعل الحيوي) في اليوم n ، L
HRTn = وقت الاحتفاظ الهيدروليكي للمفاعل الحيوي في اليوم n ، d
Tn = اليوم n ، d
Tn-1 = اليوم n-1 ، d - لضمان التشغيل المستقر ، احسب بشكل دوري معدل الاستخراج (mM C · d-1) لنظام LLE عن طريق قياس التغير في تركيز MCFA بين نقاط وقت القياس وتطبيق المعادلة 211.
ملاحظة: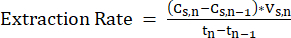 (مكافئ 2)
(مكافئ 2)
أين:
Cs ، n = تركيز MCFA في محلول التجريد في اليوم n ، mM C
Cs ، n-1 = تركيز MCFA في محلول التجريد في اليوم n-1 ، mM C
Vs، n = حجم محلول التجريد في اليوم n ، L
Tn = اليوم n ، d
Tn-1 = اليوم n-1 ، d - للحفاظ على معدلات نقل كافية من محلول الاستخراج ، استبدل محلول التجريد بدفعة جديدة قبل أن يصل تركيز MCFA إلى 80٪ تشبع.
ملاحظة: الحد الأقصى للذوبان في حمض n-caproic هو 10.3 جم · L-1 عند 25 درجة مئوية ، وحمض n-caprylic هو 0.67 جم · L-1 عند 25 درجة مئوية.
- قم بقياس تركيز MCFA داخل محلول التجريد يوميا أثناء دورة الدفعات. ينقل نظام LLE باستمرار MFCAs من المفاعل الحيوي إلى محلول التجريد ، مما يزيد من تركيز MCFA بمرور الوقت. يمكن تشغيل العملية لفترات طويلة لإنتاج عيار MCFA عالي. يمكن تقدير معدل الإنتاج الحجمي ل MCFAs (mM C · L-1 · d-1) باستخدام المعادلة 111.
- استبدل محلول التجريد.
- قم بإيقاف تشغيل مضخة الحجاب الحاجز (الشكل 1 د).
- قم بإيقاف تشغيل المضخة التمعجية بمحلول التجريد (الشكل 1M).
- استخدم مشابك الخرطوم لربط مدخل جانب الأنبوب ومخرج جانب الأنبوب ل BEM.
- قم بإيقاف تشغيل نظام التحكم في الأس الهيدروجيني وإزالة غطاء خزان محلول التجريد مع الحفاظ على توصيلات المنفذ متصلة (إن أمكن).
- يسلب خزان محلول التجريد (الشكل 1E).
- استبدل خزان محلول التجريد بمجموعة جديدة من محلول حمض البوريك المائي 0.5 M المعدل إلى الرقم الهيدروجيني 9 باستخدام NaOH (انظر الخطوة 1.4). أعد تثبيت الغطاء على الخزان.
- قم بإزالة مشابك الخرطوم من المدخل الجانبي للأنبوب ومخرج جانب الأنبوب ل BEM.
- قم بتشغيل المضخة التمعجية بمحلول التجريد (الشكل 1M) ، متبوعة بمضخة الحجاب الحاجز (الشكل 1D). تمت استعادة تشغيل النظام الآن.
- صيانة الأغشية.
- قم بإزالة FEM و BEM من نظام LLE مرة كل ثلاثة أشهر للتنظيف. ثلاثة أشهر هو تردد التنظيف المقدر المتحفظ.
ملاحظة: اعتمادا على التطبيق ، يمكن للمستخدمين تنظيف الأغشية بشكل متكرر أو أقل. يتم وصف علامات انخفاض أداء الغشاء في قسم النتائج التمثيلية. أثناء الصيانة ، يجب إيقاف تشغيل المضخات ووحدة التحكم في الأس الهيدروجيني. يجب توفير تعليمات التنظيف من قبل الشركة المصنعة للغشاء. - قم بتصريف السوائل من نظام LLE في حاويات منفصلة ، بدءا من خطوط محلول الاستخراج العضوي ، متبوعا بخطوط مرق التخمير ، وخطوط محلول التجريد.
- بمجرد تنظيف الأغشية وإعادة تركيبها ، أعد السوائل إلى الخزانات الخاصة بها.
- أعد تشغيل نظام LLE باستخدام النهج الموضح أعلاه (انظر الخطوات 2.1-2.2).
- قم بإزالة FEM و BEM من نظام LLE مرة كل ثلاثة أشهر للتنظيف. ثلاثة أشهر هو تردد التنظيف المقدر المتحفظ.
النتائج
يشار إلى نتائج استخراج MCFA الإيجابية من خلال تراكم ثابت لمنتجات MCFA في محلول تجريد الطور المائي القلوي (الشكل 2) وتركيزات MCFA مستقرة نسبيا في مرق التخمير (البيانات غير معروضة). يوضح الشكل 2 ثلاث دورات شبه دفعية لمحلول التجريد أثناء التشغيل المستمر ل LE. تتكون الدورة من مرحلتين: مرحلة استبدال الدفعات (الشكل 2: اليوم 24 واليوم 46 واليوم 68) ومرحلة تراكم MCFA (الشكل 2: الأيام 0-24 ، الأيام 25-46 ، الأيام 47-68). بالنسبة لنظام التخمير ونظام LLE الخاص هذا ، كانت مدة الدورة حوالي 20-24 يوما. ومع ذلك ، ستختلف مدة الدورة بين التطبيقات ، لأنها تعتمد على عوامل متعددة ، بما في ذلك حجم المفاعل الحيوي ، والإنتاجية البيولوجية ، وحجم محلول التجريد ، ومنطقة غشاء الألياف المجوفة ، ومعدلات إعادة تدوير السائل داخل نظام LLE. أثناء دورة الدفعات ، قد يتغير لون محلول التجريد من شفاف إلى بني مصفر بسبب الاستخراج المشترك منخفض المستوى للعديد من الأحماض العضوية الصغيرة (مثل حمض الهيوميك وأحماض الفولفيك) الموجودة في مرق التخمير (الشكل 3). يشار إلى نتائج استخراج MCFA السلبية من خلال التراكم البطيء لمنتجات MCFA في محلول التجريد وتركيزات MCFA المرتفعة في مرق التخمير بالنسبة إلى خط الأساس المحدد مسبقا.
الإنتاجية البيولوجية للكابروات أعلى بشكل عام من الكابريلات خلال عمليات التخمير هذه. لذلك ، من الشائع أن يتراكم الكابروات بمعدل أسرع في محلول التجريد مقارنة بالكابريلات. أيضا ، من الطبيعي أن تتجمع SCFAs ، مثل الأسيتات والزبدة ، في محلول التجريد بكميات أقل ، كما هو موضح في الشكل 2. يحتوي TOPO الموجود في الزيت المعدني على تقارب أعلى مع MCFAs مقارنة ب SCFAs ، مما يؤدي إلى إزالة انتقائية ل MCFAs. أظهرت الدراسات التي أجراها Saboe et al.12 و Kaur et al.13 و Carvajal-Arroyo et al.14 و Ge et al.11 انتقائية TOPO العالية للأحماض الدهنية في تطبيقات متعددة تتضمن محاليل مائية. يظهر الشكل 4 نسبة تقسيم MCFAs إلى SCFAs خلال دورة الدفعة الثانية. يمكن للمرء أن يتوقع نسب تقسيم MCFA: SCFA أكبر من 40: 1 عدة أيام في دورة الدفعة. سوف تستقر نسبة تقسيم MCFA: SCFA مع اقتراب عملية الاستخراج من حالة شبه مستقرة. إذا تعذر تحقيق النسب >40 بعد عدة أيام ، فهذا يشير إلى أن مستخرج TOPO قد تدهور أو انخفض. في حالة حدوث ذلك ، يجب إعداد محلول استخراج جديد (انظر الخطوة 1.1). إذا انخفضت النسبة بعد مرحلة الهضبة ، فهذا يشير إلى أن MCFAs قد تراكمت بعد 80٪ من نقطة تشبعها. في حالة حدوث ذلك ، يجب إعداد حل تجريد جديد (انظر الخطوة 1.4)
يمكن أن يكون سبب انخفاض كفاءة استخراج MCFA هو عدم كفاية معدلات التدفق داخل نظام LLE. في الشكل 5 ، تم تقليل سرعة الضخ في مرق التخمير وخط دوران محلول التجريد لتوضيح تأثير انخفاض معدلات إعادة تدوير السائل على كفاءة استخراج MCFA. يتم تعريف كفاءة الاستخراج على أنها النسبة المئوية ل MCFA المستخرجة في محلول التجريد بالنسبة إلى إجمالي MCFAs التي ينتجها المفاعل الحيوي بالإضافة إلى MCFAs المستخرجة بواسطة LLE. يمكن للمرء أن يتوقع كفاءات استخراج أكبر من 85٪ أثناء التشغيل العادي (الشكل 5 ، اليوم 1-14). عندما تكون سرعة المضخة منخفضة (الشكل 5 ، اليوم 14) ، تنخفض كفاءة الاستخراج استجابة لذلك. عند استعادة سرعة المضخة المناسبة ، قد يستغرق الأمر عدة أيام حتى تتعافى كفاءة الاستخراج. يمكن أن يحدث هذا بسبب انخفاض تركيز الحالة المستقرة ل MCFAs في محلول الاستخراج الناجم عن التفاضل في معدلات استخراج محلول التجريد (أعلى) من مرق التخمير (أقل).
يمكن أن تساهم عدة عوامل أخرى في تقليل كفاءة الاستخراج ، بما في ذلك (1) تلوث الغشاء ، (2) تدفق السوائل المقيد في كل مرحلة من مراحل نظام LLE بسبب الانسداد ، (3) تكوين جيوب الغاز في قواطع الغشاء ، و (4) السماح لتركيزات MCFA في محلول التجريد بالاقتراب من نقاط التشبع. يشار إلى تلوث الغشاء من خلال تقليل تدفق الغشاء بمرور الوقت بالنسبة للظروف الأولية. في حين أن تكوين الأغشية الحيوية غير مرجح في FEM ، يمكن أن يحدث القاذورات بسبب تراكم بقايا الخلايا والمواد الصلبة العالقة الأخرى. أيضا ، في حين أن BEM معقم ، يمكن إعاقة التدفق بسبب ترسيب أملاح الأحماض الدهنية داخل قواطع الغشاء أو الأنابيب بمرور الوقت. ومع ذلك ، فإن الصيانة والتنظيف الروتينيين للموصلات الغشائية (انظر الخطوة 2.6) يجب أن تحول دون حدوث مشاكل التلوث وترسيب الملح. تتشكل جيوب الغاز أحيانا على الجانب العلوي من قواطع الغشاء بسبب الوضع غير الصحيح. يجب إمالة قواطع الغشاء قليلا من الوضع الرأسي لضمان أن يكون منفذ مخرج جانب الغلاف في أعلى نقطة ، مما يسمح لأي غاز يتشكل بالهروب من الموصل. يتم تكوين تدفق السوائل في نظام LLE للتدفق من أسفل إلى أعلى المقاولين للمساعدة في طرد جيوب الغاز. أخيرا ، يتضاءل نقل MCFA من محلول الاستخراج إلى محلول التجريد في BEM عند تركيزات MCFA عالية جدا في محلول التجريد. يمكن معالجة هذه المشكلة عن طريق استبدال حل التجريد بشكل متكرر.
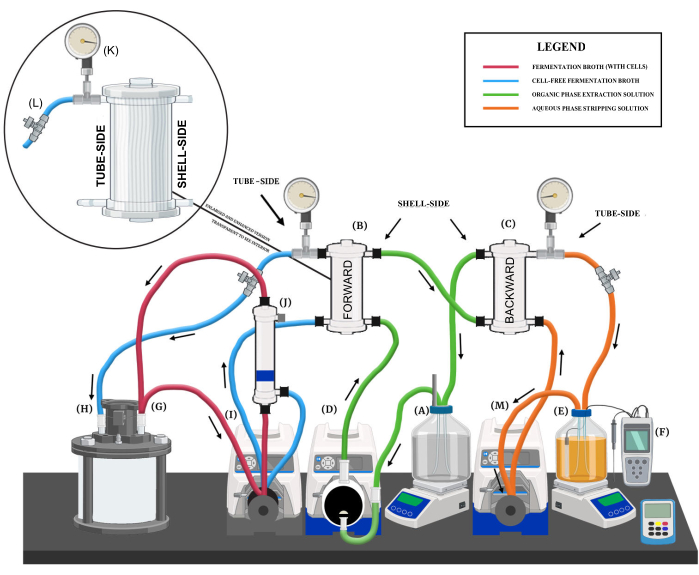
الشكل 1: نظرة عامة على نظام استخلاص السائل والسائل. عرض تخطيطي يوضح مكونات النظام الرئيسية ودوائر السوائل المختلفة واتجاهات التدفق. يتم تمييز مكونات النظام الرئيسية على النحو التالي: (أ) خزان محلول استخراج الطور العضوي ، (ب) غشاء التبادل الأمامي ، (ج) غشاء التبادل الخلفي ، (د) مضخة الحجاب الحاجز بمحلول الاستخراج ، (ه) خزان محلول تجريد الطور المائي ، (F) نظام التحكم في الأس الهيدروجيني ، (G) منفذ التدفق الخارجي للمفاعل الحيوي ، (H) منفذ تدفق عودة المفاعل الحيوي ، (I) غشاء التبادل الأمامي والمضخة التمعجية لمرشح غشاء الألياف المجوفة ، (J) مرشح غشاء الألياف المجوفة ، (K) مقياس الضغط ، (L) صمام إبرة ، و (M) مضخة تمعجية بمحلول التجريد. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
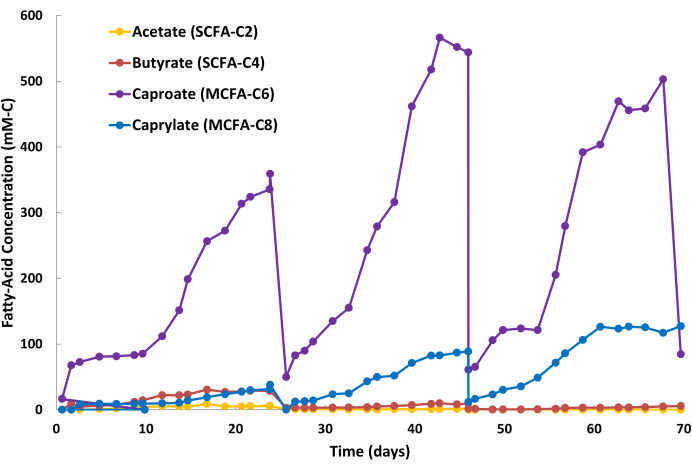
الشكل 2: تراكم الأحماض الدهنية في محلول التجريد. تظهر البيانات الأحماض الدهنية قصيرة السلسلة وتركيزات الأحماض الدهنية متوسطة السلسلة خلال ثلاث دورات دفعية من محلول التجريد أثناء عملية الاستخلاص المستمر للسائل والسائل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: تجريد المحلول يتغير لونه بعد الاستخراج. صورة توضح تغير لون محلول تجريد الطور المائي قبل (أي ما قبل الدفعة) وبعد (أي بعد الدفعة) دورة الدفعة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
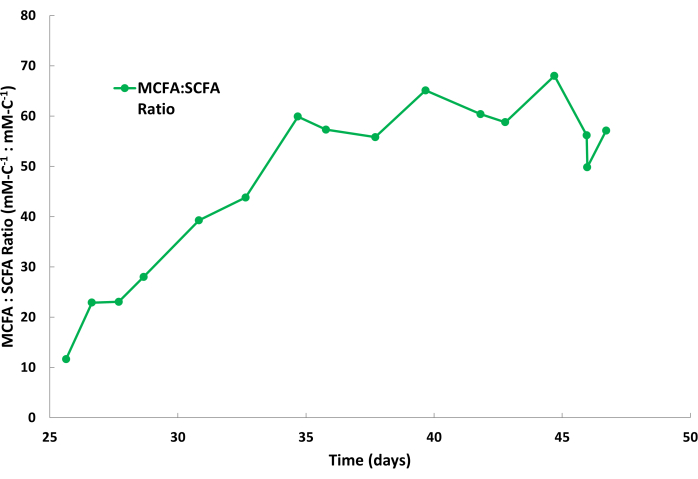
الشكل 4: نسب الأحماض الدهنية في محلول التجريد. تظهر البيانات نسبة الأحماض الدهنية متوسطة السلسلة إلى الأحماض الدهنية قصيرة السلسلة خلال دورة دفعية لمحلول التجريد أثناء عملية الاستخلاص المستمر للسائل والسائل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
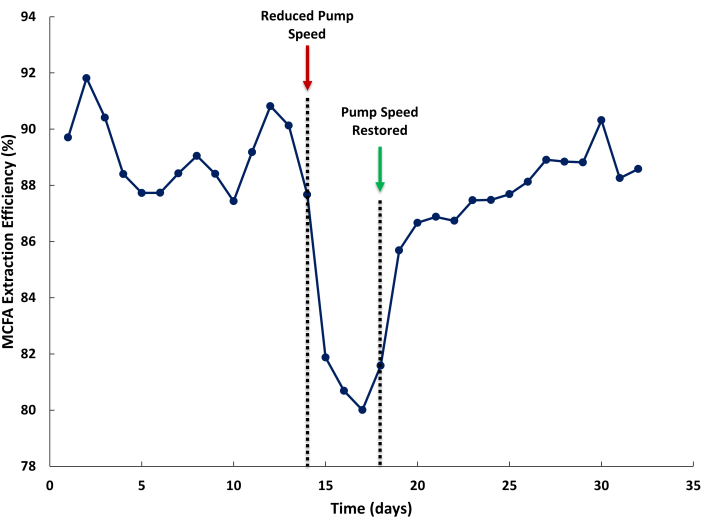
الشكل 5: تأثير معدلات تدفق الغشاء على كفاءة الاستخراج. تظهر البيانات تأثير معدلات التدفق غير الكافية من خلال غشاء التبادل الأمامي والخلفي على كفاءة استخلاص الأحماض الدهنية متوسطة السلسلة أثناء التشغيل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
توجد MCFAs المنتجة بيولوجيا بشكل شائع في مخاليط جنبا إلى جنب مع المركبات العضوية المختلفة ، بما في ذلك SCFAs والكحول2. وبالتالي ، فإن عملية الفصل الانتقائي ضرورية لاستعادتها واستخدامها بفعالية. يستخرج نظام LLE الذي تم تطويره هنا بشكل انتقائي MCFAs من هذه الخلائط بشكل مستمر مع الحفاظ على SCFAs والكحول. هذه الوظيفة تجعل نظام LLE مناسبا بشكل خاص لتطبيقات التخمير ، مثل استطالة السلسلة الميكروبية ، حيث تشكل MCFAs و SCFAs والكحوليات المستقلبات الأولية8. على وجه التحديد ، يسمح نظام LLE لعملية استطالة السلسلة بالمضي قدما عن طريق إزالة MCFAs ، ومنع تثبيط المنتج1 ، مع ترك SCFA والمواد المتفاعلة الكحولية في مرق التخمير للتحويل البيولوجي اللاحق. يمكن تخصيص نظام LLE لتطبيقات أخرى عن طريق تعديل حل الاستخراج المحدد. على سبيل المثال ، يمكن تحقيق الاستخراج المستمر ل SCFAs المنتجة أثناء التخمير باستخدام نفس نظام LLE عن طريق إزالة TOPO من خليط محلول المستخرج.
ومن ثم ، تكمن أهمية طريقة LLE في توفير تقنية استخراج MCFA أكثر قوة لتطبيقات المعالجة الحيوية والتكنولوجيا الحيوية هذه مقارنة بالطرق الأخرى. يعد الاستخراج ثنائي الطور في الموقع بالسوائل غير القابلة للامتزاج طريقة أخرى لاستخراج MCFAs من مرق التخمير15. ومع ذلك ، فإن هذا النهج غير فعال نسبيا. تتشكل طبقات المستحلب بين الطور المائي (أي مرق التخمير) والمرحلة العضوية ، مما يحد بشدة من معدلات نقل الكتلة. الحد الأدنى من خلط السوائل البينية بين طبقات الطور يحد أيضا من نقل الكتلة. عيب آخر هو أن الخلايا الميكروبية على اتصال مباشر بالمرحلة العضوية ، مما يتسبب في الانحباس والتثبيط وموت الخلايا15. أخيرا ، يتطلب الاستخراج ثنائي الطور في الموقع صيانة متكررة لإزالة واستبدال المرحلة العضوية.
يعد تطبيق معدلات تخفيف عالية داخل المفاعل الحيوي طريقة أخرى لتجنب تثبيط المنتج16. يمكن أن تحقق معدلات التخفيف العالية إنتاجية عالية من خلال الحفاظ على تركيزات عالية من المواد المتفاعلة في المفاعل الحيوي. ومع ذلك ، فإن هذا النهج غير موات لأنه يساهم في غسل الكتلة الحيوية ، وتوليد كميات كبيرة من النفايات السائلة ، وخسائر عالية في الركيزة (أي SCFAs والكحول) ، مما يؤدي إلى انخفاض الغلة. يمكن التخفيف من هذه العيوب باستخدام الكتلة الحيوية المجمدة وإعادة تدوير النفايات السائلة ، لكن هذه التدخلات تضيف إلى تعقيد النظام17. أخيرا ، يتم تخفيف تركيز MCFA في تيار المنتج ، مما يجعل MCFA غير فعال ومكلف.
يمكن أن يتضمن نهج الاستخراج الجديد التقطير المستمر ل MCFAs بغشاء استخراج أمامي واحد يفصل فيزيائيا بين المرحلتين العضوية والمائية ، وبالتالي الاحتفاظ بالكتلة الحيوية الميكروبية وحمايتها. سيتم استخراج MCFAs بشكل انتقائي في المرحلة العضوية ثم تقطيرها. يمكن إعادة تدوير الرافينات باستمرار إلى غشاء الاستخراج. ومع ذلك ، فإن التقطير المستمر يمثل تحديا تقنيا ، خاصة في البيئات المختبرية ، وقد يتسبب في تدهور أو فقدان المستخرج الكيميائي أثناء التشغيل على المدى الطويل. قد يتسبب التقطير أيضا في تدهور حراري للمرحلة العضوية ومنتجات MCFA18.
تتجنب عملية LLE العديد من العيوب المرتبطة بهذه الأساليب البديلة من خلال دمج العديد من الميزات الهامة وخطوات المعالجة. أولا ، يخدم مرشح الغشاء المصنوع من الألياف المجوفة المحبة للماء الغرض المزدوج المتمثل في حماية خلايا الكتلة الحيوية (المحفزات الحيوية) من التعرض لمحلول الاستخراج في FEB مع توفير ترشيح واضح غني ب MCFA يقلل من التلوث والتراكم الصلب في نظام LLE. ثانيا ، لمنع تقاطع السائل ، قمنا بدمج صمامات إبرة لخلق ضغط خلفي على جانب الأنبوب لكل قواطع غشاء. يحافظ هذا الاحتياط على تدرج طفيف في الضغط عبر الغشاء ، مما يمنع التسرب غير المرغوب فيه للمذيب العضوي الكارهة للماء من جانب القشرة إلى جانب الأنبوب المائي في FEM و BEM. بالإضافة إلى ذلك ، يتم تكوين تيارات السائل لتتدفق بالتوازي من القاعدة إلى أعلى FEM و BEM لمنع انحباس فقاعات الغاز التي يمكن أن تتجمع داخل وحدات الغشاء ، مما يقلل من كفاءة النقل ويسبب الترحيل. علاوة على ذلك ، تستخدم هذه الطريقة مضخة غشائية برأس مضخة PTFE مقاومة كيميائيا لضخ محلول المستخرج المحتوي على MCFA المسبب للتآكل ، مما يحمي النظام من التآكل والأعطال التي قد تعرض عملية الاستخراج للخطر. أخيرا ، يحافظ محلول التجريد القلوي الذي يتم التحكم فيه بالأس الهيدروجيني على تدرج الأس الهيدروجيني الذي يسمح بالنقل المستمر ل MCFAs عبر نظام LLE بمعدلات عالية من المفاعل الحيوي إلى خزان محلول التجريد ، حيث تتحلل بروتونات MCFAs وتتراكم إلى عيارات عالية ، مما يسهل استعادة المنتج النهائي.
طريقة LLE هذه مناسبة للاستخراج المستمر MCFA من المفاعلات الحيوية على نطاق المختبر (حتى حجم عمل 6 لتر) وقد تم التحقق من صحتها للتشغيل طويل الأمد في العديد من الدراسات1،9،11،19. يمكن أيضا تطبيق طريقة LLE للتطبيقات واسعة النطاق14 (أي المفاعلات الحيوية على نطاق تجريبي) ولكنها تتطلب أغشية متدرجة نسبيا ومعدات مناولة السوائل. ومع ذلك ، فإن الطريقة لها بعض القيود ، خاصة في مجال الصيانة وتعقيد النظام. نظرا لأن العملية مصممة للعمل بشكل مستمر ، يجب صيانة وحدات الغشاء والمضخات بشكل متكرر ، مما يؤدي إلى فترات تعطل كبيرة. عيب آخر هو أن محلول التجريد يتطلب كميات كبيرة نسبيا من هيدروكسيد الصوديوم وحمض البوريك. علاوة على ذلك ، فإن MCFAs أكالة وتتسبب في تدهور بعض مكونات نظام LLE بمرور الوقت. على سبيل المثال ، قد تصبح الموصلات البلاستيكية ومبيت الغشاء هشة ، مما يتطلب الاستبدال أثناء التشغيل. أخيرا ، شبكة معالجة السوائل في نظام LLE معقدة ، وتشمل العديد من نقاط الاتصال المعرضة لحدوث تسربات. ومع ذلك ، فإن معظم هذه القيود والعيوب نموذجية لعمليات الفصل المستمر للأغشية ويجب توقعها.
بشكل عام ، يقدم بروتوكول LLE هذا نهجا قويا وفعالا لاستخراج MCFA الانتقائي ، والذي له آثار على تطوير البحث في مجالات متنوعة. يمكن أن تجد الطريقة العديد من التطبيقات ذات الصلة في مجال التخمير الدقيق لاستعادة منتجات الأيض خارج الخلية في الموقع أثناء التخمير. يمكن أن يكون LLE بديلا أقل تكلفة لنهج المعالجة النهائية التقليدية (DSP) ، مثل الطرد المركزي بعد التشغيل ، أو الترشيح الدقيق والفائق، أو عمليات استخراج المذيبات التي يتم إجراؤها على دفعات. في الواقع ، غالبا ما يمثل DSP محركا رئيسيا للتكلفة في عمليات التخمير الصناعي. قد يؤدي الاستخراج المستمر للمنتج باستخدام LLE أيضا إلى تمكين عمليات التخمير المستمرة ، مما يحسن بشكل كبير إنتاجية العمليات وكفاءات وقت التشغيل مقارنة بنهج الدفعات التقليدية أو الدفعات المغذية. أيضا ، يمكن للبحوث المستقبلية التحقيق في الوسائط المستخرجة بخلاف المذيبات العضوية ، مثل المذيبات سهلة الانصهار العميقة أو السوائل الأيونية. وأخيرا، فإن نظام LLE الموصوف في هذا البروتوكول مخصص للأغراض التجريبية في بيئة مختبرية؛ وبالتالي ، لا يزال هناك مجال كبير لدراسات التحسين لتقليل متطلبات الطاقة ، ومنطقة الغشاء ، وعوائد ومعدلات الاستخراج الإجمالية.
Disclosures
لا يوجد تضارب في المصالح.
Acknowledgements
يود المؤلفون أن يشكروا الدعم التقني والمالي الذي قدمته محطة التجارب الزراعية في جامعة جورجيا. بالإضافة إلى ذلك ، يريد المؤلفون أن يشكروا صموئيل أوغونديب والدكتور رونالد بيغ والدكتور جون هيوك سوه على مساعدتهم في تحليل عينات العملية.
Materials
| Name | Company | Catalog Number | Comments |
| 10 L Media Bottle | Duran | 218018658 | |
| 3.5 L Media Bottle | Duran | 218016957 | |
| Boric acid, 99.5%, | ThermoScientific (Fisher Scientific) | 327132500 | |
| Hydrophilic MINIKROS 20CM 0.2UM PES 1MM 1.5TC X 3/4TC | Repligen | N02-P20U-10-N | |
| L/S Variable-Speed Pump Drive; 100 rpm | MasterFlex (VWR) | MFLX07528-10 | |
| L/S Variable-Speed Pump Drive; 300 rpm | MasterFlex (VWR) | MFLX07528-20 | |
| Light Mineral Oil, NF (4 Liters) (CAS: 8042-47-5) | Thomas Scientific | C761Z18 | |
| Liqui-Cel 2.5x8 X50 membrane CO2, PP Housing Viton O-rings (0.5-3 gpm (0.1-0.7 m3/h)), 1/4-in FNPT connections | 3M | LC-02508X50-G453 | |
| Magnetic Stirrer, 20 L Capacity, 110 V | Cole-Parmer | EW-04661-29 | |
| Masterflex L/S Precision Pump Tubing, Tygon, Size 14 | MasterFlex (VWR) | MFLX06402-14 | Specific tubing size will depend on application. |
| Masterflex L/S Precision Pump Tubing, Tygon, Size 16 | MasterFlex (VWR) | MFLX06402-16 | Specific tubing size will depend on application. |
| Masterflex L/S Precision Pump Tubing, Tygon, Size 17 | MasterFlex (VWR) | MFLX06402-17 | Specific tubing size will depend on application. |
| Masterflex L/S Precision Pump Tubing, Tygon, Size 18 | MasterFlex (VWR) | MFLX06402-18 | Specific tubing size will depend on application. |
| MasterFlex L/S Standard Pump Head for Precision Tubing L/S 14, Polycarbonate Housing, CRS Rotor | MasterFlex (VWR) | MFLX07014-20 | Specific pump head size will depend on application. |
| MasterFlex L/S Standard Pump Head for Precision Tubing L/S 14, Polycarbonate Housing, CRS Rotor | MasterFlex (VWR) | MFLX07014-20 | Specific pump head size will depend on application. |
| MasterFlex L/S Standard Pump Head for Precision Tubing L/S 16, Polycarbonate Housing, CRS Rotor | MasterFlex (VWR) | MFLX07016-20 | Specific pump head size will depend on application. |
| MasterFlex L/S Standard Pump Head for Precision Tubing L/S 17, Polycarbonate Housing, CRS Rotor | MasterFlex (VWR) | MFLX07017-20 | Specific pump head size will depend on application. |
| MasterFlex L/S Standard Pump Head for Precision Tubing L/S 18, Polycarbonate Housing, CRS Rotor | MasterFlex (VWR) | MFLX07018-20 | Specific pump head size will depend on application. |
| MasterFlex PTFE-diaphragm pump head, 10 to 100 mL/min | MasterFlex (VWR) | MFLX07090-62 | |
| Oakton 220 pH/ORP/Temperature Controller, 1/8 DIN | Spectrum Laboratory Products | 664-12595-E1 | |
| Oakton 220 pH/ORP/Temperature Controller, 1/8 DIN | Spectrum Laboratory Products | 664-12595-E1 | |
| Oakton Female BNC-to-Stripped Wire Adapter | Spectrum Laboratory Products | 664-12592-E1 | |
| pH Probe with BNC Connector | ThermoScientific | 10010-788 | Any pH probe with a BNC connector will suffice. |
| Precision Flow-Adjustment Valve, White Polypropylene, 1/4 NPT Male x Male | McMaster-Carr | 7792K57 | |
| ProConnex Fittings Kits - A | Repligen | ACPX-KT2-01N | Compatible with Hydrophilic MINIKROS Filter |
| ProConnex Fittings Kits - B | Repligen | ACPX-KT1-01N | Compatible with Hydrophilic MINIKROS Filter |
| Sodium Hydroxide Pellets for Analysis | Sigma Aldrich | 1.06498 | |
| Stainless-Steel Pressure Gauge 0-60 psi Stainless Steel 1/4" NPT 2.5" Face Dial | NA | XJ-219 | Any comparable pressure gauge covering 0-60 psig range will suffice. |
| Trioctylphosphine oxide (TOPO) | Sigma-Aldrich | 346187-100G |
References
- Palomo-Briones, R., et al. Near-neutral ph increased n-caprylate production in a microbiome with product inhibition of methanogenesis. Chem Eng J. 446, 137170 (2022).
- Wang, J., Yin, Y. Biological production of medium-chain carboxylates through chain elongation: An overview. Biotechnol Adv. 55, 107882 (2022).
- Watanabe, S., Tsujino, S. Applications of medium-chain triglycerides in foods. Front Nutr. 9, 802805 (2022).
- Meijaard, E., et al. The environmental impacts of palm oil in context. Nat Plants. 6 (12), 1418-1426 (2020).
- Meijaard, E., Abrams, J. F., Juffe-Bignoli, D., Voigt, M., Sheil, D. Coconut oil, conservation and the conscientious consumer. Curr Bio. 30 (13), R757-R758 (2020).
- Angenent, L. T., Magdalena, J. A., Jeon, B. S., Usack, J. G. Eco-mimicry opens new doors for bioprocess engineers. Joule. 4 (10), 2074-2077 (2020).
- Shahab, R. L., et al. A heterogeneous microbial consortium producing short-chain fatty acids from lignocellulose. Science. 369 (6507), 1214 (2020).
- Magdalena, J. A., Angenent, L. T., Usack, J. G. The measurement, application, and effect of oxygen in microbial fermentations: Focusing on methane and carboxylate production. Fermentation. 8 (4), 138 (2022).
- Agler, M. T., Spirito, C. M., Usack, J. G., Werner, J. J., Angenent, L. T. Development of a highly specific and productive process for n-caproic acid production: Applying lessons from methanogenic microbiomes. Water Sci Technol. 69 (1), 62-68 (2013).
- Gildemyn, S., et al. Upgrading syngas fermentation effluent using Clostridium kluyveri in a continuous fermentation. Biotechnol Biofuels. 10 (1), 83 (2017).
- Ge, S., Usack, J. G., Spirito, C. M., Angenent, L. T. Long-term n-caproic acid production from yeast-fermentation beer in an anaerobic bioreactor with continuous product extraction. Env Sci Technol. 49 (13), 8012-8021 (2015).
- Saboe, P. O., et al. In situ recovery of bio-based carboxylic acids. Green Chem. 20 (8), 1791-1804 (2018).
- Kaur, G., et al. Reactive extraction for in-situ carboxylate recovery from mixed culture fermentation. Biochem Eng J. 160, 107641 (2020).
- Carvajal-Arroyo, J. M., et al. Production and extraction of medium-chain carboxylic acids at a semi-pilot scale. Chem Eng J. 416, 127886 (2021).
- Choi, K., et al. In situ biphasic extractive fermentation for hexanoic acid production from sucrose by Megasphaera elsdenii NCIMB 702410. Appl Biochem Biotechnol. 171 (5), 1094-1107 (2013).
- Grootscholten, T., Steinbusch, K., Hamelers, H., Buisman, C. Improving medium chain fatty acid productivity using chain elongation by reducing the hydraulic retention time in an upflow anaerobic filter. Bioresour Technol. 136, 735-738 (2013).
- Grootscholten, T., Dal Borgo, F. K., Hamelers, H., Buisman, C. Promoting chain elongation in mixed culture acidification reactors by addition of ethanol. Biomass Bioenergy. 48, 10-16 (2013).
- Cermak, S. C., Evangelista, R. L., Kenar, J. A. Distillation of natural fatty acids and their chemical derivatives. Distillation-Advances from Modeling to Applications Chapter. 5, 109-142 (2012).
- Agler, M. T., Spirito, C. M., Usack, J. G., Werner, J. J., Angenent, L. T. Chain elongation with reactor microbiomes: Upgrading dilute ethanol to medium-chain carboxylates. Energy Environ Sci. 5 (8), 8189-8192 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved