Method Article
Extração Líquida-Líquida Contínua de Ácidos Graxos de Cadeia Média a partir de Caldo de Fermentação Usando Membranas de Fibra Oca
Neste Artigo
Resumo
Um sistema de extração líquido-líquido (LLE) envolvendo membranas de fibra oca foi desenvolvido para extrair contínua e seletivamente ácidos graxos de cadeia média (AGCMs) do caldo de fermentação. O sistema LLE atinge altas especificidades de AGCM de caldos contendo ácidos graxos de cadeia curta e álcoois. Além disso, os MCFAs são concentrados em uma solução de decapagem para facilitar a recuperação do produto.
Resumo
Os ácidos graxos de cadeia média (MCFAs; comprimentos de carbono: C6-C12) são produtos químicos de plataforma de alto valor que atendem a uma variedade de aplicações industriais, incluindo antimicrobianos verdes, ingredientes alimentícios, aditivos para ração animal, cosméticos, fragrâncias, produtos farmacêuticos e lipídios estruturados. Atualmente, a maioria dos MCFAs é produzida a partir de óleo de palma e coco originários do Sudeste Asiático e da América do Sul. A abordagem convencional para a colheita de frutos de palma e coco causa danos ecológicos consideráveis nessas regiões. Portanto, os pesquisadores estão desenvolvendo abordagens biológicas (por exemplo, fermentações de precisão e cultura aberta) para gerar MCFAs de forma mais sustentável usando substratos de baixo valor (por exemplo, metanol, etanol, lactato) ou resíduos orgânicos como matéria-prima. O alongamento da cadeia microbiana (CE) é uma plataforma de fermentação de cultura aberta de maturação rápida que converte ácidos graxos de cadeia curta (SCFAs; comprimentos de carbono: C1-C5) em um subconjunto desses MCFAs a taxas industrialmente relevantes. No entanto, a extração in situ contínua de produtos MCFA é necessária não apenas para evitar a inibição do produto, mas também para facilitar a recuperação de MCFA em uma forma pura e utilizável. A extração líquido-líquido (LLE) usando membranas de fibra oca e misturas de extratores direcionadas provou ser uma abordagem robusta para extrair seletivamente produtos MCFA de caldos de fermentação contendo SCFAs. Aqui, a aplicação de LLE para remoção contínua de MCFA é demonstrada usando CE como sistema de fermentação de referência e óxido de trioctilfosfina a 3% (p / v) em óleo mineral como sistema extrator. Os ácidos graxos que variam de ácido valérico (C5) a ácido caprílico (C8) são removidos seletivamente de caldos contendo SCFA e concentrados em altos títulos em uma solução de decapagem alcalina semi-batelada para processamento a jusante.
Introdução
Os ácidos graxos de cadeia média (MCFAs) são produtos químicos de bloco de construção de alto valor que compreendem comprimentos de cadeia que variam de seis (C6) a doze (C12) carbonos. Os AGCMs têm aplicações industriais em alimentos, rações animais, produtos farmacêuticos, cosméticos, fragrâncias, agentes antimicrobianos e síntese química 1,2,3. Atualmente, a maioria dos AGCMs deriva do óleo de palma e coco proveniente do Sudeste Asiático e da América do Sul 4,5. Os graves danos ecológicos associados à produção de óleo de palma e coco são bem reconhecidos pelas partes interessadas e pelo público em geral. Os pesquisadores estão explorando abordagens biológicas (por exemplo, fermentações de precisão e cultura aberta) para gerar MCFAs de forma mais sustentável usando substratos de baixo valor ou resíduos orgânicos como matéria-prima 6,7. Uma maneira sustentável de produzir MCFAs é reciclar fluxos de resíduos orgânicos usando um processo chamado alongamento da cadeia microbiana (CE). Este bioprocesso de fermentação secundária é semelhante à digestão anaeróbica, pois explora a versatilidade dos microbiomas anaeróbicos de cultura aberta, mas em vez de promover a formação de metano, os sistemas CE suprimem deliberadamente a via metanogênica. Em um microbioma onde o carbono não pode ser reduzido ao máximo para CH4, nem H2 mantido abaixo de 10-4 atm por archaea consumidoras de hidrogênio, a reação de β-oxidação que normalmente quebraria carboxilatos de cadeia mais longa em acetato (por exemplo, C6 → C4 → C2) pode ser revertida (por exemplo, C2 → C4 → C6, etc.), desde que um composto reduzido (ou seja, doador de elétrons), como etanol ou lactato, é fornecido8. Nesse metabolismo, a molécula de ácido graxo que sofre alongamento serve como aceptor de elétrons. Assim, em vez de gerar um produto com um comprimento de carbono de um (CH4) como na digestão anaeróbica, o processo CE gera MCFAs com comprimentos de carbono variando de seis a oito. Um mercado grande e crescente está pronto para receber esses produtos químicos de plataforma verde. No entanto, até agora, o processo CE não demonstrou produzir MCFAs com comprimentos de carbono superiores a oito carbonos a taxas apreciáveis.
A extração eficiente desses AGCMs é importante não apenas para a recuperação do produto desejado, mas também para evitar a inibição do produto e impulsionar o microbioma para a produção de mais AGCMs1. À medida que a concentração de AGCMs aumenta, o metabolismo dos AGCM é inibido e se torna menos termodinamicamente favorável. Ao remover os AGCMs continuamente, as taxas de produção são mantidas. Além disso, como os SCFAs servem como subestruturas para o processo de alongamento da cadeia, eles não devem ser removidos do caldo de fermentação. As misturas de extratores direcionados devem extrair seletivamente os produtos MCFA de caldos de fermentação contendo SCFAs.
Aqui, uma abordagem robusta e prática é demonstrada para extrair continuamente MCFAs de caldo de fermentação contendo SCFA usando um sistema de extração líquido-líquido (LLE) compreendendo um extrator de membrana de fibra oca hidrofóbico de polipropileno, uma solução extratora orgânica seletiva (óxido de trioctilfosfina [TOPO] 9 , 10 , 11) e um extrator de membrana de fibra oca para trás. Um filtro de proteção de célula a montante do sistema LLE é instalado para reter a biomassa e mitigar a incrustação da membrana. Os AGCMs são extraídos para frente, em sua forma protonada, do caldo de fermentação aquosa (normalmente com um ponto de ajuste de pH <5,8) para uma solução extratora orgânica (ou seja, 3% de TOPO (p / v) em óleo mineral) e, em seguida, extraídos para trás em uma solução de remoção alcalina (pH = 9), onde desprotonados e concentrados em altos títulos para processamento a jusante. Os pontos de ajuste de pH específicos são essenciais porque ditam o gradiente de concentração entre cada fase do processo LLE, garantindo uma transferência líquida de MCFAs do caldo de fermentação para a solução de decapagem. O LLE usando membranas de extração para frente e para trás atinge altas taxas de extração, minimizando a co-extração de álcoois e SCFAs. O adjuvante de solvente orgânico, TOPO, permite a formação de complexos MCFA. Esses complexos são mais solúveis em fases orgânicas do que em água, resultando em alta seletividade de AGCM. O processo LLE também evita as muitas desvantagens associadas às abordagens existentes, que serão discutidas na seção Discussão. A implementação a longo prazo usando essa abordagem LLE foi demonstrada em vários estudos 9,10,11. Embora essa abordagem seja particularmente adequada para aplicações que envolvem a produção de MCFA por meio do alongamento da cadeia microbiana, ela também é útil em outras aplicações que exigem separação seletiva de compostos que possuem propriedades químicas semelhantes, pois o sistema de extração orgânica pode ser personalizado.
Protocolo
Os reagentes, consumíveis e equipamentos usados neste estudo estão listados na Tabela de Materiais.
1. Construção e integração do biorreator e do sistema de extração líquido-líquido
- Preparar a solução de extracção em fase orgânica e o reservatório.
- Preparar 2 L de solução de extracção em fase orgânica dissolvendo 60 g de óxido de trioctilfosfina (TOPO) em óleo mineral utilizando uma placa de agitação magnética e um agitador.
- Adicione a solução de extração a um reservatório de vidro de 2 L (ou seja, frasco Schott).
- Coloque o reservatório em uma placa de agitação magnética (Figura 1A). A velocidade de mistura recomendada durante a operação LLE contínua é de 150-250 rpm.
- Prepare uma tampa de três portas para o reservatório da solução de extração.
- Conecte um tubo de imersão à primeira porta para servir como uma porta de saída que fornece solução de extração para a membrana de extração direta (FEM) (Figura 1B).
- Fixe uma segunda porta para servir como porta de retorno para a solução de extração da membrana de extração reversa (BEM) (Figura 1C).
- Adicione uma terceira porta, aberta para a atmosfera, para amortecer as flutuações de pressão causadas pela bomba de diafragma.
- Conecte a bomba de diafragma às membranas de extração.
- Coloque um acionamento de bomba de velocidade variável de 100 rpm equipado com um cabeçote de bomba de diafragma de politetrafluoretileno (PTFE) adjacente ao reservatório (Figura 1D).
- Conecte a porta de saída do reservatório da solução de extração (Figura 1A) à entrada da bomba de diafragma e, em seguida, a saída da bomba de diafragma à entrada do lado do invólucro na base do FEM (Figura 1B) usando a tubulação flexível da bomba (por exemplo, tamanho 16, 18).
- Conecte a saída do lado do invólucro na parte superior do FEM à entrada do lado do invólucro na base do BEM (Figura 1C) usando uma tubulação de bomba flexível (por exemplo, tamanho 18).
- Conecte a saída do lado do invólucro na parte superior do BEM à porta de retorno no reservatório da solução de extração (Figura 1A) usando tubulação de bomba flexível (por exemplo, tamanho 16, 18).
NOTA: Este componente do sistema transfere MCFAs extraídos do caldo de fermentação no FEM para a solução de decapagem no BEM.
- Preparar a solução de extracção em fase aquosa e o reservatório.
- Preparar 3,25 L de solução de decapagem em fase aquosa tomando uma solução de ácido bórico 0,5 M e ajustando-a a pH 9 com NaOH.
- Despeje a solução em um reservatório de vidro de 3,5 L com uma barra de agitação magnética.
- Coloque o reservatório em uma placa de agitação magnética (Figura 1E).
- Prepare uma tampa de quatro portas para o reservatório da solução de decapagem.
- Conecte um tubo de imersão à primeira porta para servir como uma porta de saída que fornece solução de decapagem para o BEM.
- Afixe uma segunda porta compreendendo um encaixe em Y para (1) servir como porta de fluxo de retorno da solução de decapagem do BEM e (2) servir como um fluxo de arrastamento para adições de NaOH do sistema de controle de pH.
- Adicione uma terceira porta, aberta à atmosfera, para explicar o aumento no volume causado pelas adições de NaOH e acúmulo de MCFA.
- Forneça uma quarta porta para acomodar a sonda de pH do controlador de pH.
- Instale um sistema de controle de pH no reservatório da solução de decapagem.
- Integrar um sistema de controle de pH com um ponto de ajuste de pH 9 com o reservatório da solução de decapagem (Figura 1F). Use NaOH 5 M como solução base com o controlador de pH para neutralizar os AGCMs coletados.
- Insira a sonda de pH através da porta do reservatório da solução de decapagem e suspenda-a na solução de decapagem.
NOTA: Este sistema de controle de pH não requer uma solução ácida.
- Prepare as portas de conexão do biorreator.
- Designe duas portas, uma porta de saída e uma porta de retorno, no biorreator para conexão com o sistema de extração líquido-líquido (LLE) (Figura 1G,H).
- Conecte um tubo de imersão à porta de saída. O caldo rico em MCFA será bombeado do biorreator na porta de saída para o sistema LLE.
NOTA: O caldo entra primeiro no filtro de membrana de fibra oca antes das membranas de extração para remover as células e outros sólidos para evitar incrustações. - Insira um encaixe em T na porta de fluxo de retorno para receber: (1) caldo empobrecido com MCFA reciclado do FEM e (2) retentado contendo células do filtro de membrana de fibra oca.
- Instale o filtro de membrana de fibra oca.
- Coloque um acionamento de bomba de velocidade variável de 300 rpm adjacente ao biorreator (Figura 1I).
- Fixe a membrana de fibra oca hidrofílica (Figura 1J) em um suporte de anel acima da bomba peristáltica.
- Empilhe dois cabeçotes de bomba peristáltica no acionamento da bomba, grande (por exemplo, tamanho 17) e pequeno (por exemplo, tamanho 16).
NOTA: A cabeça da bomba maior é conectada ao filtro de membrana de fibra oca para garantir que a vazão do permeado seja maior do que a vazão que alimenta o FEM. Se não fosse esse o caso, o permeado seria consumido mais rápido do que é produzido, causando a formação de vácuo. - Conecte a porta de saída no biorreator à entrada do cabeçote da bomba grande usando tubulação de bomba flexível (por exemplo, tamanho 17).
- Conecte a saída grande do cabeçote da bomba ao filtro de membrana de fibra oca hidrofílica na entrada do lado do tubo na base do filtro usando uma tubulação de bomba flexível (por exemplo, tamanho 17).
- Tampe a porta superior do lado da concha do filtro para evitar o influxo de ar.
NOTA: O caldo rico em MCFA (contendo células) fluirá através dos tubos de fibra oca e retornará ao biorreator. O caldo claro (sem células) passará pela membrana hidrofílica de polietersulfona (PES) de 0,2 μm e se acumulará no lado do invólucro do filtro.
- Conecte o FEM.
- Fixe o primeiro módulo de membrana de fibra oca hidrofóbica (FEM) em um suporte de anel acima da bomba (Figura 1B).
- Conecte o filtro de membrana de fibra oca hidrofílica (Figura 1J) na saída do lado do invólucro à entrada do cabeçote da bomba pequena usando tubulação de bomba flexível (por exemplo, tamanho 16, 18).
- Conecte a saída do cabeçote da bomba pequena ao FEM na entrada do lado do tubo na base do módulo usando uma tubulação de bomba flexível (por exemplo, tamanho 16, 18).
- Conecte o manômetro (Figura 1K) e a válvula de restrição de fluxo (Figura 1L) à saída do lado do tubo do FEM usando um encaixe de acoplamento e um encaixe em T.
- Conecte a saída do lado do tubo do FEM à porta de retorno no biorreator usando tubulação de bomba flexível (por exemplo, tamanho 18).
NOTA: Este componente do sistema transfere os AGCMs do caldo de fermentação clara para a solução de extração e, em seguida, retorna o caldo claro para o biorreator.
- Conecte o BEM.
- Coloque um acionamento de bomba de velocidade variável de 300 rpm equipado com um cabeçote de bomba peristáltica (por exemplo, tamanho 16) adjacente ao biorreator (Figura 1M).
- Fixe o segundo módulo de membrana de fibra oca hidrofóbica em um suporte de anel acima da bomba peristáltica (Figura 1C).
- Conecte a porta de saída do reservatório da solução de decapagem à entrada da bomba peristáltica e a saída da bomba à entrada do lado do tubo na base do BEM usando tubulação de bomba flexível (por exemplo, tamanho 16, 18).
- Conecte o manômetro e a válvula de restrição de fluxo à saída do lado do tubo do BEM usando um encaixe de acoplamento e um encaixe em T.
- Conecte a saída do lado do tubo na parte superior do BEM à porta de retorno do fluxo de retorno do reservatório da solução de decapagem usando uma tubulação de bomba flexível (por exemplo, tamanho 16, 18).
NOTA: Este componente do sistema transfere os AGCMs da solução de extração para a solução de extração no BEM e, em seguida, retorna a solução de extração ao seu reservatório.
2. Iniciando a operação do sistema de extração líquido-líquido
- Preparar e circular as linhas de fase aquosa.
- Ligue a bomba peristáltica de solução de decapagem/BEM (Figura 1M) e ajuste a velocidade da bomba para atingir uma vazão constante entre 25-250 mL·min-1. O BEM pode acomodar uma gama relativamente grande de caudais. Comece com uma taxa de fluxo conservadoramente alta inicialmente para garantir extração suficiente de MCFA. A vazão pode ser reduzida incrementalmente posteriormente durante a operação para prolongar a vida útil do equipamento e da tubulação da bomba.
NOTA: A velocidade do fluxo não deve ser tão baixa a ponto de permitir o acúmulo de MCFAs no caldo do biorreator (ver Resultados representativos). - Feche lentamente a válvula de agulha na saída do lado do invólucro do BEM (Figura 1C) para estabelecer uma contrapressão de ~ 5 psig.
- Ligue o biorreator/bomba peristáltica FEM (Figura 1I) e defina a velocidade da bomba para atingir uma vazão constante entre 25-250 mL·min-1. O FEM pode acomodar uma faixa relativamente grande de vazões. Comece com uma taxa de fluxo conservadoramente alta inicialmente para garantir extração suficiente de MCFA. A vazão pode ser reduzida incrementalmente posteriormente durante a operação para prolongar a vida útil do equipamento e da tubulação da bomba.
NOTA: A velocidade do fluxo não deve ser tão baixa a ponto de permitir o acúmulo de MCFAs no caldo do biorreator (consulte a seção Resultados representativos). - Feche lentamente a válvula de agulha na saída do lado do invólucro do FEM (Figura 1B) para estabelecer uma contrapressão de ~ 5 psig.
- Verifique visualmente as linhas de fluxo de retorno para garantir um fluxo constante e que as linhas foram preparadas.
- Verifique se o caldo claro é coletado dentro do lado do invólucro do filtro de membrana de fibra oca (Figura 1J).
NOTA: Levará várias horas para encher o FEM e estabelecer um fluxo constante entre o filtro de membrana de fibra oca e o FEM. A velocidade do fluxo não deve ser tão baixa que permita o acúmulo de MCFAs no caldo do biorreator (consulte a seção Resultados representativos).
- Ligue a bomba peristáltica de solução de decapagem/BEM (Figura 1M) e ajuste a velocidade da bomba para atingir uma vazão constante entre 25-250 mL·min-1. O BEM pode acomodar uma gama relativamente grande de caudais. Comece com uma taxa de fluxo conservadoramente alta inicialmente para garantir extração suficiente de MCFA. A vazão pode ser reduzida incrementalmente posteriormente durante a operação para prolongar a vida útil do equipamento e da tubulação da bomba.
- Prepare e circule as linhas de fase orgânica.
- Ligue a bomba de diafragma da solução de extração em fase orgânica (Figura 1D) e ajuste a velocidade da bomba para atingir uma vazão constante entre 5.0-50 mL·min-1. Comece com uma taxa de fluxo conservadoramente baixa inicialmente para minimizar a pressão na extração em fase orgânica e minimizar o risco de cruzamento. Se necessário, a taxa de fluxo pode ser aumentada gradualmente mais tarde durante a operação para melhorar a eficiência da extração
- Aguarde até que o FEM e o BEM sejam preenchidos.
- Verifique visualmente a porta de retorno no reservatório da solução de extração para garantir um fluxo constante.
- Verifique se nenhuma solução de fase orgânica está passando para a solução de decapagem ou linhas de caldo de fermentação. Se um cruzamento estiver ocorrendo, pequenas gotículas da fase orgânica podem ser vistas. Se isso acontecer, diminua a velocidade da bomba de diafragma e aumente ligeiramente a contrapressão no FEM ou BEM, conforme apropriado. Não exceda 10 psig.
NOTA: Para evitar o cruzamento da membrana, é importante estabelecer o fluxo e a contrapressão dentro das linhas de fase aquosa antes de preparar as linhas de fase orgânica.
- Extraia continuamente MCFAs do biorreator.
- O sistema LLE deve estar totalmente operacional. Permita que o sistema funcione continuamente durante a operação do biorreator.
- Medir diariamente as concentrações de AGCM no biorreator para garantir uma extração suficiente de AGCM. Se ocorrerem concentrações elevadas de MCFA no biorreator, isso geralmente indica taxas de fluxo insuficientes do caldo de fermentação através do FEM. Também pode indicar diminuição do fluxo de membrana devido à incrustação e à necessidade de manutenção (consulte a etapa 2.6).
NOTA: As concentrações de AGCC e AGCM podem ser medidas por cromatografia gasosa de acordo com o método descrito por Ge et al.11.
- Monitore o acúmulo de AGCM no reservatório da solução de decapagem.
- Meça a concentração de AGCM na solução de decapagem diariamente durante o ciclo do lote. O sistema LLE transfere continuamente MFCAs do biorreator para a solução de decapagem, aumentando a concentração de MCFA ao longo do tempo. O processo pode ser executado por longos períodos para produzir altos títulos de MCFA. A taxa de produção volumétrica de AGCMs (mM C·L-1·d-1) pode ser estimada usando a Equação 111.
NOTA: Taxa de produção volumétrica =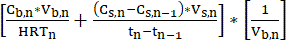 (Eq. 1)
(Eq. 1)
onde:
Cb,n= concentração de AGCM no caldo de fermentação no dia n, mM C
Cs,n= concentração de AGCMs na solução de extracção no dia n, mM C
Cs,n-1= concentração de AGCM na solução de decapagem no dia n-1, mM C
Vs,n= Volume da solução de decapagem no dia n, L
Vb,n= Volume do caldo de fermentação (volume do biorreator) no dia n, L
HRTn= Tempo de retenção hidráulica do biorreator no dia n, d
Tn= Dia n, d
Tn-1= Dia n-1, d - Para garantir uma operação estável, calcule periodicamente a taxa de extração (mM C·d-1) do sistema LLE medindo a mudança na concentração de MCFA entre os pontos de medição e aplicando a Equação 211.
NOTA: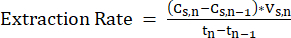 (Eq. 2)
(Eq. 2)
onde:
Cs,n= concentração de AGCMs na solução de extracção no dia n, mM C
Cs,n-1= concentração de AGCM na solução de decapagem no dia n-1, mM C
Vs,n= Volume da solução de decapagem no dia n, L
Tn= Dia n, d
Tn-1= Dia n-1, d - Para manter taxas de transferência adequadas da solução de extração, substitua a solução de decapagem por um novo lote antes que a concentração de AGCM atinja 80% de saturação.
NOTA: A solubilidade máxima do ácido n-capróico é de 10,3 g · L-1 a 25 °C, e o do ácido n-caprílico é de 0,67 g· L-1 a 25 °C.
- Meça a concentração de AGCM na solução de decapagem diariamente durante o ciclo do lote. O sistema LLE transfere continuamente MFCAs do biorreator para a solução de decapagem, aumentando a concentração de MCFA ao longo do tempo. O processo pode ser executado por longos períodos para produzir altos títulos de MCFA. A taxa de produção volumétrica de AGCMs (mM C·L-1·d-1) pode ser estimada usando a Equação 111.
- Substitua a solução de decapagem.
- Desligue a bomba de diafragma (Figura 1D).
- Desligue a bomba peristáltica da solução de decapagem (Figura 1M).
- Use mangueira clamps para clamp a entrada do lado do tubo e a saída do lado do tubo do BEM.
- Desligue o sistema de controle de pH e remova a tampa do reservatório da solução de decapagem, mantendo as conexões da porta conectadas (se possível).
- Retire o reservatório da solução de decapagem (Figura 1E).
- Substitua o reservatório da solução de extração por um novo lote de solução aquosa de ácido bórico 0,5 M ajustada para pH 9 usando NaOH (consulte a etapa 1.4). Recoloque a tampa no reservatório.
- Remova a mangueira clamps da entrada do lado do tubo e da saída do lado do tubo do BEM.
- Ligue a bomba peristáltica da solução de decapagem (Figura 1M), seguida da bomba de diafragma (Figura 1D). A operação do sistema agora é restaurada.
- Manutenção da membrana.
- Remova o FEM e o BEM do sistema LLE uma vez a cada três meses para limpeza. Três meses é uma frequência de limpeza estimada conservadora.
NOTA: Dependendo da aplicação, os usuários podem limpar as membranas com mais ou menos frequência. Os sinais de diminuição do desempenho da membrana são descritos na seção Resultados Representativos. Durante a manutenção, as bombas e o controlador de pH devem ser desligados. As instruções de limpeza devem ser fornecidas pelo fabricante da membrana. - Drene os líquidos do sistema LLE em recipientes separados, começando com as linhas de solução de extração em fase orgânica, seguidas pelas linhas de caldo de fermentação e as linhas de solução de decapagem.
- Depois que as membranas forem limpas e reinstaladas, retorne os líquidos aos seus respectivos reservatórios.
- Reinicie o sistema LLE usando a abordagem descrita acima (consulte as etapas 2.1-2.2).
- Remova o FEM e o BEM do sistema LLE uma vez a cada três meses para limpeza. Três meses é uma frequência de limpeza estimada conservadora.
Resultados
Os resultados positivos da extração de AGCMs são indicados por um acúmulo constante de produtos de AGCM na solução de remoção de fase aquosa alcalina (Figura 2) e concentrações relativamente estáveis de AGCM no caldo de fermentação (dados não mostrados). A Figura 2 ilustra três ciclos de semi-lote da solução de decapagem durante a operação contínua de LLE. Um ciclo compreende dois estágios: o estágio de substituição do lote (Figura 2: Dia 24, Dia 46 e Dia 68) e o estágio de acumulação de AGCM (Figura 2: Dias 0-24, Dias 25-46, Dias 47-68). Para este sistema particular de fermentação e LLE, a duração do ciclo foi de aproximadamente 20-24 dias. A duração do ciclo varia entre as aplicações, no entanto, pois depende de vários fatores, incluindo volume do biorreator, produtividade biológica, volume da solução de decapagem, área da membrana de fibra oca e taxas de recirculação de líquido dentro do sistema LLE. Durante um ciclo de batelada, a solução de decapagem pode mudar de cor de transparente para marrom-amarelado devido à co-extração de baixo nível de vários pequenos ácidos orgânicos (por exemplo, ácido húmico, ácidos fúlvicos) presentes no caldo de fermentação (Figura 3). Os resultados negativos da extração de AGCM são indicados por um acúmulo lento de produtos de AGCM na solução de decapagem e concentrações elevadas de AGCM no caldo de fermentação em relação à linha de base pré-estabelecida.
A produtividade biológica do caproato é geralmente maior do que o caprilato durante esses processos de fermentação; portanto, é comum que o caproato se acumule em uma taxa mais rápida na solução de decapagem em comparação com o caprilato. Além disso, é normal que os AGCCs, como acetato e butirato, se acumulem na solução de decapagem em quantidades menores, como visto na Figura 2. O TOPO no óleo mineral tem uma afinidade maior para MCFAs do que para SCFAs, o que causa remoção seletiva dos MCFAs. Estudos de Saboe et al.12, Kaur et al.13, Carvajal-Arroyo et al.14 e Ge et al.11 demonstraram a alta seletividade do TOPO para ácidos graxos em múltiplas aplicações envolvendo soluções aquosas. A taxa de particionamento de MCFAs para SCFAs durante o segundo ciclo de lote é mostrada na Figura 4. Pode-se esperar taxas de particionamento MCFA:SCFA maiores que 40:1 vários dias em um ciclo de lote. A razão de partição MCFA:SCFA se estabilizará à medida que o processo de extração se aproximar de um estado pseudo-estacionário. Se as proporções >40 não puderem ser alcançadas após vários dias, isso sugere que o extrator TOPO se degradou ou eluiu. Se isso ocorrer, uma nova solução de extração deve ser preparada (consulte a etapa 1.1). Se a razão diminuir após a fase de platô, isso sugere que os AGCMs se acumularam além de 80% de seu ponto de saturação. Se isso ocorrer, uma nova solução de decapagem deve ser preparada (consulte a etapa 1.4)
A baixa eficiência de extração de MCFA pode ser causada por taxas de fluxo insuficientes dentro do sistema LLE. Na Figura 5, a velocidade de bombeamento foi reduzida no caldo de fermentação e na linha de circulação da solução de decapagem para ilustrar o impacto da diminuição das taxas de recirculação de líquidos na eficiência de extração do MCFA. A eficiência de extração é definida como a porcentagem de MCFA extraído na solução de decapagem em relação ao total de MCFAs produzidos pelo biorreator mais os MCFAs extraídos pelo LLE. Pode-se esperar eficiências de extração superiores a 85% durante a operação normal (Figura 5, Dia 1-14). Quando a velocidade da bomba é baixa (Figura 5, Dia 14), a eficiência de extração diminui em resposta. Quando uma velocidade adequada da bomba é restaurada, pode levar vários dias para que a eficiência da extração se recupere. Isso pode ser causado por uma redução na concentração no estado estacionário de MCFAs na solução de extração causada pelo diferencial nas taxas de extração da solução de decapagem (mais alto) do que o caldo de fermentação (mais baixo).
Vários outros fatores podem contribuir para a diminuição da eficiência de extração, incluindo (1) incrustação da membrana, (2) fluxo de fluido restrito em cada estágio do sistema LLE devido a bloqueios, (3) a formação de bolsas de gás nos contatores da membrana e (4) permitindo que as concentrações de MCFA na solução de decapagem se aproximem de seus pontos de saturação. A incrustação da membrana é indicada por uma redução do fluxo da membrana ao longo do tempo em relação às condições iniciais. Embora a formação de biofilme seja improvável no FEM, a incrustação pode ocorrer devido ao acúmulo de detritos celulares e outros sólidos suspensos. Além disso, embora o BEM seja asséptico, o fluxo pode ser obstruído devido à precipitação de sais de ácidos graxos dentro do contator de membrana ou tubulação ao longo do tempo. No entanto, a manutenção e limpeza de rotina dos contatores de membrana (consulte a etapa 2.6) devem evitar o desenvolvimento de problemas de incrustação e precipitação de sal. Bolsas de gás às vezes se formam no lado superior do invólucro dos contatores de membrana devido ao posicionamento inadequado. Os contatores de membrana devem ser ligeiramente inclinados da vertical para garantir que a porta de saída do lado do invólucro esteja no ponto mais alto, permitindo que qualquer gás que se forme escape do contator. O fluxo de fluido no sistema LLE é configurado para fluir de baixo para cima dos empreiteiros para ajudar a limpar as bolsas de gás. Finalmente, a transferência de AGCM da solução de extração para a solução de remoção no BEM é diminuída em concentrações muito altas de AGCM na solução de extração. Esse problema pode ser corrigido substituindo a solução de decapagem com mais frequência.
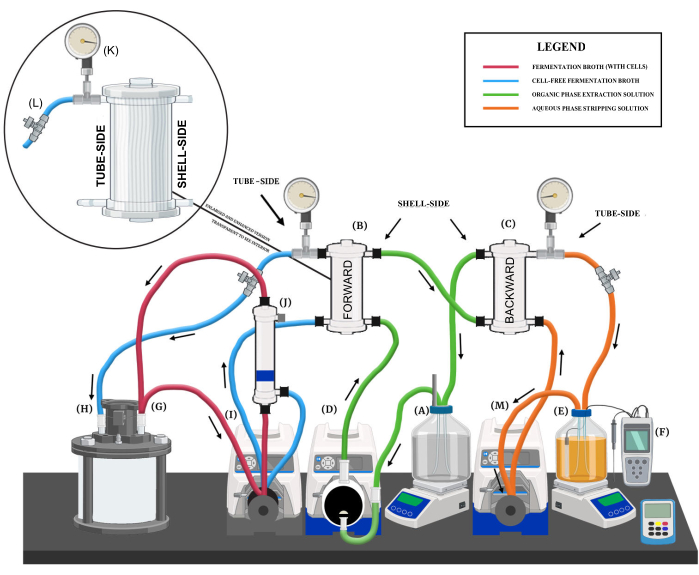
Figura 1: Visão geral do sistema de extração líquido-líquido. Uma renderização diagramática mostrando os principais componentes do sistema, os vários circuitos de fluido e as direções do fluxo. Os principais componentes do sistema são rotulados da seguinte forma: (A) reservatório de solução de extração em fase orgânica, (B) membrana de troca direta, (C) membrana de troca reversa, (D) bomba de diafragma de solução de extração, (E) reservatório de solução de decapagem em fase aquosa, (F) sistema de controle de pH, (G) porta de saída do biorreator, (H) porta de retorno do biorreator, (I) membrana de troca direta e bomba peristáltica de filtro de membrana de fibra oca, (J) filtro de membrana de fibra oca, (K) manômetro, (L) válvula de agulha e (M) bomba peristáltica de solução de decapagem. Clique aqui para ver uma versão maior desta figura.
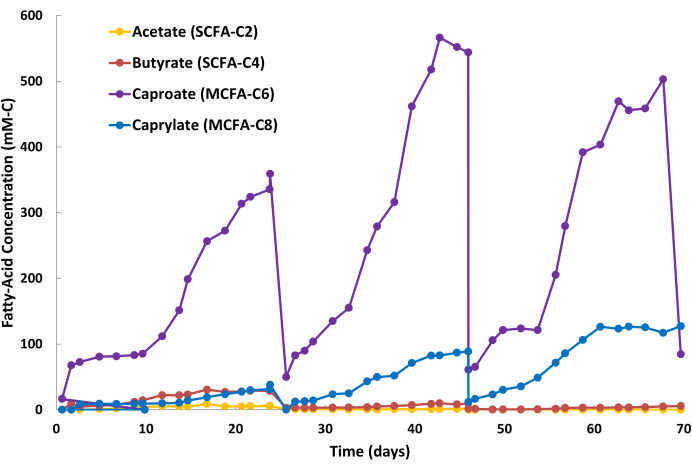
Figura 2: Acúmulo de ácidos graxos na solução de decapagem. Dados que mostrem as concentrações de ácidos gordos de cadeia curta e de ácidos gordos de cadeia média durante três ciclos de lotes da solução de decapagem durante a operação de extracção líquido-líquido contínua. Clique aqui para ver uma versão maior desta figura.

Figura 3: Mudança de cor da solução de decapagem após a extração. Uma fotografia mostrando a mudança de cor da solução de decapagem da fase aquosa antes (ou seja, pré-lote) e depois (ou seja, pós-lote) de um ciclo de lote. Clique aqui para ver uma versão maior desta figura.
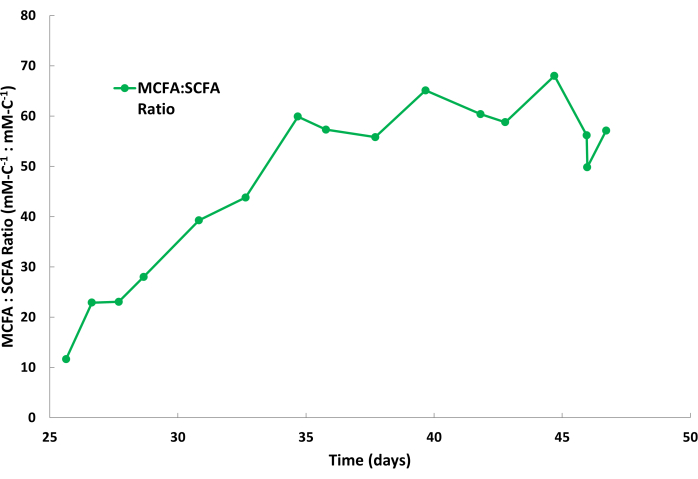
Figura 4: Proporções de ácidos graxos na solução de decapagem. Dados que mostram a proporção de ácidos graxos de cadeia média e ácidos graxos de cadeia curta durante um ciclo descontínuo da solução de decapagem durante a operação de extração líquida-líquido contínua. Clique aqui para ver uma versão maior desta figura.
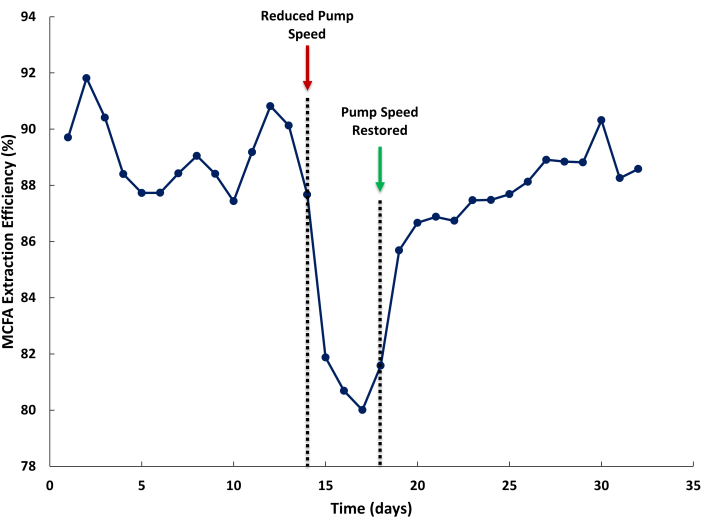
Figura 5: Efeito das taxas de fluxo da membrana na eficiência da extração. Dados que mostram o efeito de taxas de fluxo insuficientes através da membrana de troca para frente e para trás na eficiência de extração de ácidos graxos de cadeia média durante a operação. Clique aqui para ver uma versão maior desta figura.
Discussão
Os AGCMs produzidos biologicamente são comumente encontrados em misturas ao lado de vários compostos orgânicos, incluindo AGCC e álcoois2. Consequentemente, um processo de separação seletiva é necessário para recuperá-los e utilizá-los de forma eficaz. O sistema LLE desenvolvido aqui extrai seletivamente MCFAs dessas misturas continuamente enquanto conserva SCFAs e álcoois. Essa funcionalidade torna o sistema LLE particularmente adequado para aplicações de fermentação, como alongamento da cadeia microbiana, onde MCFAs, SCFAs e álcoois constituem os metabólitos primários8. Especificamente, o sistema LLE permite que o processo de alongamento da cadeia prossiga removendo MCFAs, evitando a inibição do produto1, enquanto deixa o SCFA e os reagentes de álcool no caldo de fermentação para posterior conversão biológica. O sistema LLE pode ser personalizado para outras aplicações, modificando a solução de extração específica. Por exemplo, a extração contínua de SCFAs produzidos durante a fermentação pode ser obtida usando o mesmo sistema LLE, removendo o TOPO da mistura da solução extratora.
Portanto, a importância do método LLE reside em fornecer uma técnica de extração MCFA mais robusta para essas aplicações de bioprocessamento e biotecnologia em comparação com outros métodos. A extração bifásica in situ com líquidos não miscíveis é outra abordagem para extrair MCFAs do caldo de fermentação15. No entanto, essa abordagem é relativamente ineficiente. As camadas de emulsão se formam entre a fase aquosa (ou seja, caldo de fermentação) e a fase orgânica, limitando severamente as taxas de transferência de massa. A mistura mínima de fluidos interfaciais entre as camadas de fase também limita a transferência de massa. Outra desvantagem é que as células microbianas estão em contato direto com a fase orgânica, causando arrastamento, inibição e morte celular15. Finalmente, a extração bifásica in situ requer manutenção frequente para remover e substituir a fase orgânica.
A aplicação de altas taxas de diluição dentro do biorreator é outro método para evitar a inibição do produto16. Altas taxas de diluição podem atingir alta produtividade mantendo altas concentrações de reagentes no biorreator. No entanto, essa abordagem é desvantajosa porque contribui para a lavagem da biomassa, a geração de grandes volumes de efluentes e altas perdas de substrato (ou seja, SCFAs e álcoois), resultando em baixos rendimentos. Essas desvantagens podem ser mitigadas usando biomassa imobilizada e reciclagem de efluentes, mas essas intervenções aumentam a complexidade do sistema17. Finalmente, a concentração de AGCM no fluxo do produto é diluída, tornando os AGCM ineficientes e caros.
Uma nova abordagem de extração poderia envolver a destilação contínua dos MCFAs com uma única membrana de extração direta que separa fisicamente as fases orgânica e aquosa, retendo e protegendo assim a biomassa microbiana. Os AGCMs seriam extraídos seletivamente para a fase orgânica e depois destilados. O refinado pode ser continuamente reciclado para a membrana de extração. A destilação contínua, no entanto, é tecnicamente desafiadora, especialmente em ambientes de laboratório, e pode causar a deterioração ou perda do extrator químico durante a operação de longo prazo. A destilação também pode causar degradação térmica da fase orgânica e dos produtos MCFA18.
O processo LLE evita muitas das desvantagens associadas a essas abordagens alternativas, incorporando vários recursos críticos e etapas de processamento. Primeiro, o filtro de membrana hidrofílico de fibra oca serve ao duplo propósito de proteger as células de biomassa (os biocatalisadores) da exposição à solução extratora no FEB, ao mesmo tempo em que fornece um filtrado claro rico em MCFA que reduz a incrustação e o acúmulo de sólidos no sistema LLE. Em segundo lugar, para evitar o cruzamento de líquidos, incorporamos válvulas de agulha para criar contrapressão no lado do tubo de cada contator de membrana. Essa precaução mantém um leve gradiente de pressão transmembrana, evitando vazamento indesejável do solvente orgânico hidrofóbico do lado do invólucro para o lado do tubo aquoso no FEM e BEM. Além disso, os fluxos de líquido são configurados para fluir em paralelo da base para o topo do FEM e BEM para evitar o aprisionamento de bolhas de gás que podem se acumular dentro dos módulos de membrana, reduzindo a eficiência da transferência e causando carry-over. Além disso, este método usa uma bomba de diafragma com um cabeçote de bomba de PTFE quimicamente resistente para bombear a solução extratora corrosiva contendo MCFA, protegendo o sistema contra corrosão e avarias que possam comprometer o processo de extração. Finalmente, a solução de decapagem alcalina controlada por pH mantém um gradiente de pH que permite a transferência contínua de MCFAs através do sistema LLE em altas taxas do biorreator para o reservatório da solução de decapagem, onde os MCFAs desprotonados e se acumulam em altos títulos, facilitando a recuperação do produto a jusante.
Este método LLE é apropriado para extração contínua de AGCM de biorreatores em escala laboratorial (até um volume de trabalho de 6 L) e foi validado para operação de longo prazo em vários estudos 1,9,11,19. O método LLE também pode ser aplicado para aplicações em larga escala14 (ou seja, biorreatores em escala piloto), mas requer membranas proporcionalmente dimensionadas e equipamentos de manuseio de fluidos. No entanto, o método tem algumas limitações, principalmente na área de manutenção e complexidade do sistema. Como o processo é projetado para operar continuamente, os módulos de membrana e as bombas devem ser reparados com frequência, resultando em tempos de inatividade consideráveis. Outra desvantagem é que a solução de decapagem requer quantidades relativamente grandes de NaOH e ácido bórico. Além disso, os MCFAs são corrosivos e fazem com que certos componentes do sistema LLE se deteriorem com o tempo. Por exemplo, conectores de plástico e o invólucro da membrana podem se tornar quebradiços, exigindo substituição durante a operação. Finalmente, a rede de manuseio de fluidos no sistema LLE é complexa, envolvendo muitos pontos de conexão que podem desenvolver vazamentos. A maioria dessas limitações e desvantagens, no entanto, são típicas de processos contínuos de separação por membrana e devem ser esperadas.
No geral, este protocolo LLE oferece uma abordagem robusta e eficiente para a extração seletiva de AGCM, o que tem implicações para o avanço da pesquisa em diversos campos. O método pode encontrar muitas aplicações relevantes no campo da fermentação de precisão para recuperação in-situ de produtos metabólitos extracelulares durante a fermentação. O LLE pode ser uma alternativa de baixo custo às abordagens convencionais de processamento downstream (DSP), como centrifugação pós-execução, micro e ultrafiltração ou extrações de solventes realizadas em lotes. De fato, o DSP geralmente representa um importante fator de custo nos processos de fermentação industrial. A extração contínua de produtos usando LLE também pode permitir fermentações contínuas, melhorando drasticamente a produtividade das operações e a eficiência do tempo de execução em comparação com as abordagens convencionais de batelada ou batelada alimentada. Além disso, pesquisas futuras podem investigar outros meios extratores além de solventes orgânicos, como solventes eutéticos profundos ou líquidos iônicos. Por fim, o sistema LLE descrito neste protocolo foi projetado para fins experimentais em ambiente de laboratório; Assim, ainda há espaço considerável para estudos de otimização para reduzir os requisitos de energia, a área da membrana e os rendimentos e taxas gerais de extração.
Divulgações
Não há conflito de interesses.
Agradecimentos
Os autores gostariam de agradecer o apoio técnico e financeiro fornecido pela Estação Experimental Agrícola da Universidade da Geórgia. Além disso, os autores querem agradecer a Samuel Ogundipe, Dr. Ronald Pegg e Dr. Joon Hyuk Suh por sua ajuda na análise de amostras de processo.
Materiais
| Name | Company | Catalog Number | Comments |
| 10 L Media Bottle | Duran | 218018658 | |
| 3.5 L Media Bottle | Duran | 218016957 | |
| Boric acid, 99.5%, | ThermoScientific (Fisher Scientific) | 327132500 | |
| Hydrophilic MINIKROS 20CM 0.2UM PES 1MM 1.5TC X 3/4TC | Repligen | N02-P20U-10-N | |
| L/S Variable-Speed Pump Drive; 100 rpm | MasterFlex (VWR) | MFLX07528-10 | |
| L/S Variable-Speed Pump Drive; 300 rpm | MasterFlex (VWR) | MFLX07528-20 | |
| Light Mineral Oil, NF (4 Liters) (CAS: 8042-47-5) | Thomas Scientific | C761Z18 | |
| Liqui-Cel 2.5x8 X50 membrane CO2, PP Housing Viton O-rings (0.5-3 gpm (0.1-0.7 m3/h)), 1/4-in FNPT connections | 3M | LC-02508X50-G453 | |
| Magnetic Stirrer, 20 L Capacity, 110 V | Cole-Parmer | EW-04661-29 | |
| Masterflex L/S Precision Pump Tubing, Tygon, Size 14 | MasterFlex (VWR) | MFLX06402-14 | Specific tubing size will depend on application. |
| Masterflex L/S Precision Pump Tubing, Tygon, Size 16 | MasterFlex (VWR) | MFLX06402-16 | Specific tubing size will depend on application. |
| Masterflex L/S Precision Pump Tubing, Tygon, Size 17 | MasterFlex (VWR) | MFLX06402-17 | Specific tubing size will depend on application. |
| Masterflex L/S Precision Pump Tubing, Tygon, Size 18 | MasterFlex (VWR) | MFLX06402-18 | Specific tubing size will depend on application. |
| MasterFlex L/S Standard Pump Head for Precision Tubing L/S 14, Polycarbonate Housing, CRS Rotor | MasterFlex (VWR) | MFLX07014-20 | Specific pump head size will depend on application. |
| MasterFlex L/S Standard Pump Head for Precision Tubing L/S 14, Polycarbonate Housing, CRS Rotor | MasterFlex (VWR) | MFLX07014-20 | Specific pump head size will depend on application. |
| MasterFlex L/S Standard Pump Head for Precision Tubing L/S 16, Polycarbonate Housing, CRS Rotor | MasterFlex (VWR) | MFLX07016-20 | Specific pump head size will depend on application. |
| MasterFlex L/S Standard Pump Head for Precision Tubing L/S 17, Polycarbonate Housing, CRS Rotor | MasterFlex (VWR) | MFLX07017-20 | Specific pump head size will depend on application. |
| MasterFlex L/S Standard Pump Head for Precision Tubing L/S 18, Polycarbonate Housing, CRS Rotor | MasterFlex (VWR) | MFLX07018-20 | Specific pump head size will depend on application. |
| MasterFlex PTFE-diaphragm pump head, 10 to 100 mL/min | MasterFlex (VWR) | MFLX07090-62 | |
| Oakton 220 pH/ORP/Temperature Controller, 1/8 DIN | Spectrum Laboratory Products | 664-12595-E1 | |
| Oakton 220 pH/ORP/Temperature Controller, 1/8 DIN | Spectrum Laboratory Products | 664-12595-E1 | |
| Oakton Female BNC-to-Stripped Wire Adapter | Spectrum Laboratory Products | 664-12592-E1 | |
| pH Probe with BNC Connector | ThermoScientific | 10010-788 | Any pH probe with a BNC connector will suffice. |
| Precision Flow-Adjustment Valve, White Polypropylene, 1/4 NPT Male x Male | McMaster-Carr | 7792K57 | |
| ProConnex Fittings Kits - A | Repligen | ACPX-KT2-01N | Compatible with Hydrophilic MINIKROS Filter |
| ProConnex Fittings Kits - B | Repligen | ACPX-KT1-01N | Compatible with Hydrophilic MINIKROS Filter |
| Sodium Hydroxide Pellets for Analysis | Sigma Aldrich | 1.06498 | |
| Stainless-Steel Pressure Gauge 0-60 psi Stainless Steel 1/4" NPT 2.5" Face Dial | NA | XJ-219 | Any comparable pressure gauge covering 0-60 psig range will suffice. |
| Trioctylphosphine oxide (TOPO) | Sigma-Aldrich | 346187-100G |
Referências
- Palomo-Briones, R., et al. Near-neutral ph increased n-caprylate production in a microbiome with product inhibition of methanogenesis. Chem Eng J. 446, 137170 (2022).
- Wang, J., Yin, Y. Biological production of medium-chain carboxylates through chain elongation: An overview. Biotechnol Adv. 55, 107882 (2022).
- Watanabe, S., Tsujino, S. Applications of medium-chain triglycerides in foods. Front Nutr. 9, 802805 (2022).
- Meijaard, E., et al. The environmental impacts of palm oil in context. Nat Plants. 6 (12), 1418-1426 (2020).
- Meijaard, E., Abrams, J. F., Juffe-Bignoli, D., Voigt, M., Sheil, D. Coconut oil, conservation and the conscientious consumer. Curr Bio. 30 (13), R757-R758 (2020).
- Angenent, L. T., Magdalena, J. A., Jeon, B. S., Usack, J. G. Eco-mimicry opens new doors for bioprocess engineers. Joule. 4 (10), 2074-2077 (2020).
- Shahab, R. L., et al. A heterogeneous microbial consortium producing short-chain fatty acids from lignocellulose. Science. 369 (6507), 1214 (2020).
- Magdalena, J. A., Angenent, L. T., Usack, J. G. The measurement, application, and effect of oxygen in microbial fermentations: Focusing on methane and carboxylate production. Fermentation. 8 (4), 138 (2022).
- Agler, M. T., Spirito, C. M., Usack, J. G., Werner, J. J., Angenent, L. T. Development of a highly specific and productive process for n-caproic acid production: Applying lessons from methanogenic microbiomes. Water Sci Technol. 69 (1), 62-68 (2013).
- Gildemyn, S., et al. Upgrading syngas fermentation effluent using Clostridium kluyveri in a continuous fermentation. Biotechnol Biofuels. 10 (1), 83 (2017).
- Ge, S., Usack, J. G., Spirito, C. M., Angenent, L. T. Long-term n-caproic acid production from yeast-fermentation beer in an anaerobic bioreactor with continuous product extraction. Env Sci Technol. 49 (13), 8012-8021 (2015).
- Saboe, P. O., et al. In situ recovery of bio-based carboxylic acids. Green Chem. 20 (8), 1791-1804 (2018).
- Kaur, G., et al. Reactive extraction for in-situ carboxylate recovery from mixed culture fermentation. Biochem Eng J. 160, 107641 (2020).
- Carvajal-Arroyo, J. M., et al. Production and extraction of medium-chain carboxylic acids at a semi-pilot scale. Chem Eng J. 416, 127886 (2021).
- Choi, K., et al. In situ biphasic extractive fermentation for hexanoic acid production from sucrose by Megasphaera elsdenii NCIMB 702410. Appl Biochem Biotechnol. 171 (5), 1094-1107 (2013).
- Grootscholten, T., Steinbusch, K., Hamelers, H., Buisman, C. Improving medium chain fatty acid productivity using chain elongation by reducing the hydraulic retention time in an upflow anaerobic filter. Bioresour Technol. 136, 735-738 (2013).
- Grootscholten, T., Dal Borgo, F. K., Hamelers, H., Buisman, C. Promoting chain elongation in mixed culture acidification reactors by addition of ethanol. Biomass Bioenergy. 48, 10-16 (2013).
- Cermak, S. C., Evangelista, R. L., Kenar, J. A. Distillation of natural fatty acids and their chemical derivatives. Distillation-Advances from Modeling to Applications Chapter. 5, 109-142 (2012).
- Agler, M. T., Spirito, C. M., Usack, J. G., Werner, J. J., Angenent, L. T. Chain elongation with reactor microbiomes: Upgrading dilute ethanol to medium-chain carboxylates. Energy Environ Sci. 5 (8), 8189-8192 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados