Method Article
Continuous Liquid-Liquid Extraction of Medium-Chain Fatty Acids from Fermentation Broth Using Hollow-Fiber Membranes
요약
발효액에서 중쇄 지방산(MCFA)을 지속적이고 선택적으로 추출하기 위해 중공사막을 포함하는 액체-액체 추출(LLE) 시스템이 개발되었습니다. LLE 시스템은 단쇄 지방산과 알코올을 함유한 육수액에서 높은 MCFA 특이성을 달성합니다. 또한 MCFA는 제품 회수를 용이하게 하기 위해 스트리핑 용액에 집중되어 있습니다.
초록
중쇄 지방산(MCFA, 탄소 길이: C6-C12)은 녹색 항균제, 식품 성분, 동물 사료 첨가제, 화장품, 향료, 의약품 및 구조 지질을 포함한 다양한 산업 응용 분야에 사용되는 고부가가치 플랫폼 화학 물질입니다. 현재 대부분의 MCFA는 동남아시아와 남미에서 원산지인 팜유와 코코넛유를 원료로 생산됩니다. 야자나무와 코코넛 열매를 수확하는 기존의 접근 방식은 이 지역에서 상당한 생태계 파괴를 일으킵니다. 따라서 연구자들은 저부가가치 기질(예: 메탄올, 에탄올, 젖산) 또는 유기 폐기물을 공급 원료로 사용하여 보다 지속 가능한 방식으로 MCFA를 생성하기 위한 생물학적 접근 방식(예: 정밀 및 개방 배양 발효)을 개발하고 있습니다. 미생물 사슬 신장(CE)은 빠르게 성숙하는 개방형 배양 발효 플랫폼으로, 단쇄 지방산(SCFA, 탄소 길이: C1-C5)을 산업적으로 적절한 속도로 이러한 MCFA의 하위 집합으로 변환합니다. 그러나 MCFA 산물의 지속적인 현장 추출은 산물 억제를 피할 뿐만 아니라 순수하고 사용 가능한 형태로 MCFA를 회수하는 데 필요합니다. 중공사막과 표적 추출제 혼합물을 사용하는 액체-액체 추출(LLE)은 SCFA가 포함된 발효액에서 MCFA 제품을 선택적으로 추출하는 강력한 접근 방식임이 입증되었습니다. 여기에서 지속적인 MCFA 제거를 위한 LLE의 적용은 CE를 기준 발효 시스템으로 사용하고 미네랄 오일의 3%(w/v) 트리옥틸포스핀 옥사이드를 추출 시스템으로 사용하여 시연됩니다. 발레르산(C5)에서 카프릴산(C8)에 이르는 지방산은 SCFA 함유 육수에서 선택적으로 제거되고 다운스트림 처리를 위한 반배치 알칼리성 스트리핑 용액에서 높은 역가로 농축됩니다.
서문
중쇄 지방산(MCFA)은 6개(C6)에서 12개(C12)에 이르는 사슬 길이로 구성된 고부가가치 빌딩 블록 화학 물질입니다. MCFA는 식품, 동물 사료, 제약, 화장품, 향료, 항균제 및 화학 합성 1,2,3의 산업 응용 분야를 가지고 있습니다. 현재 대부분의 MCFA는 동남아시아와 남아메리카에서 공급되는 팜유와 코코넛유에서 추출합니다 4,5. 팜유와 코코넛 오일 생산과 관련된 심각한 생태계 피해는 이해 관계자와 일반 대중에게 잘 알려져 있습니다. 연구원들은 저부가가치 기질 또는 유기 폐기물을 공급 원료로 사용하여 보다 지속 가능한 방식으로 MCFA를 생성하기 위한 생물학적 접근 방식(예: 정밀 및 개방 배양 발효)을 모색하고 있습니다 6,7. MCFA를 생산하는 지속 가능한 방법 중 하나는 미생물 사슬 신장(CE)이라는 프로세스를 사용하여 유기 폐기물 흐름을 업사이클링하는 것입니다. 이 2차 발효 바이오 공정은 혐기성 개방형 배양 마이크로바이옴의 다양성을 활용한다는 점에서 혐기성 소화와 유사하지만, CE 시스템은 메탄 형성을 촉진하는 대신 의도적으로 메탄생성 경로를 억제합니다. 탄소를 CH4 로 최대한 환원 할 수 없거나 수소를 소비하는 고세균에 의해 H2 가 10-4 atm 이하로 유지되는 미생물 군집에서는, 일반적으로 더 긴 사슬 카르복실 레이트를 아세테이트 (예 : C6 → C4 → C2→→)로 분해하는 β 산화 반응은 환원 된 화합물 (즉, Electron donor)에 에탄올 또는 젖산염 등이 공급된다8. 이 신진 대사에서 신장을 겪는 지방산 분자는 전자 수용체 역할을합니다. 따라서 혐기성 소화에서와 같이 탄소 길이가 1(CH4)인 제품을 생성하는 대신 CE 공정은 탄소 길이가 6에서 8 사이인 MCFA를 생성합니다. 규모가 크고 성장하는 시장은 이러한 친환경 플랫폼 화학 물질을 받아들일 준비가 되어 있습니다. 그러나 지금까지 CE 공정은 탄소 길이가 8개의 탄소를 초과하는 MCFA를 상당한 속도로 생성하지 않는 것으로 나타났습니다.
이러한 MCFA를 효율적으로 추출하는 것은 원하는 산물의 회수뿐만 아니라 산물 억제를 방지하고 마이크로바이옴이 더 많은 MCFA를 생성하도록 유도하는 데에도 중요합니다1. MCFA의 농도가 증가함에 따라 MCFA 대사가 억제되고 열역학적으로 덜 유리해집니다. MCFA를 지속적으로 제거함으로써 생산 속도를 유지할 수 있습니다. 또한 SCFA는 사슬 신장 과정의 하부 구조 역할을 하기 때문에 발효액에서 제거해서는 안 됩니다. 표적 추출제 혼합물은 SCFA가 포함된 발효액에서 MCFA 제품을 선택적으로 추출해야 합니다.
여기에서는 소수성 폴리프로필렌 전방 중공사 멤브레인 추출기, 선택적 유기 추출제 용액(trioctylphosphine oxide [TOPO]9,10,11)으로 구성된 액체-액체 추출(LLE) 시스템을 사용하여 SCFA 함유 발효액에서 MCFA를 연속적으로 추출하는 강력하고 실용적인 접근 방식을 보여줍니다.), 및 역방향 중공 섬유 멤브레인 추출기. LLE 시스템의 상류에 셀 가드 필터가 설치되어 바이오매스를 유지하고 멤브레인 오염을 완화합니다. MCFA는 수성 발효액(일반적으로 pH 설정점 <5.8)에서 양성자 형태로 순방향 추출된 후 유기 추출액(즉, 미네랄 오일의 3% TOPO(w/v))으로 추출된 다음 알칼리성 스트리핑 용액(pH = 9)으로 역방향으로 추출된 후 탈양성자화되어 다운스트림 처리를 위해 높은 역가로 농축됩니다. 특정 pH 설정점은 LLE 공정의 각 단계 사이의 농도 구배를 결정하여 발효액에서 스트리핑 용액으로 MCFA의 순 전달을 보장하기 때문에 필수적입니다. 전방 및 후방 추출 멤브레인을 사용하는 LLE는 알코올과 SCFA의 동시 추출을 최소화하면서 높은 추출 속도를 달성합니다. 유기 용매 보조제인 TOPO는 MCFA 복합체의 형성을 가능하게 합니다. 이러한 복합체는 물보다 유기 상에 더 잘 용해되어 MCFA 선택성이 높습니다. LLE 프로세스는 또한 토론 섹션에서 논의될 기존 접근 방식과 관련된 많은 단점을 방지합니다. 이 LLE 접근법을 사용한 장기 구현은 여러 연구에서 입증되었습니다 9,10,11. 이 접근법은 미생물 사슬 신장을 통한 MCFA 생산과 관련된 응용 분야에 특히 적합하지만, 유기 추출제 시스템을 맞춤화할 수 있기 때문에 유사한 화학적 특성을 가진 화합물의 선택적 분리가 필요한 다른 응용 분야에서도 유용합니다.
프로토콜
이 연구에 사용된 시약, 소모품 및 장비는 재료 표에 나열되어 있습니다.
1. 생물 반응기 및 액체-액체 추출 시스템 구축 및 통합
- 유기상 추출 용액과 저장소를 준비합니다.
- 마그네틱 교반판과 교반기를 사용하여 트리옥틸포스핀 옥사이드(TOPO) 60g을 미네랄 오일에 용해시켜 2L의 유기상 추출 용액을 준비합니다.
- 추출 용액을 2L 유리 저장통(즉, Schott 병)에 추가합니다.
- 저장소를 자기 교반 플레이트에 놓습니다(그림 1A). 연속 LLE 작동 중 권장되는 혼합 속도는 150-250rpm입니다.
- 추출 용액 저장소를 위한 3포트 캡을 준비합니다.
- 딥 튜브를 첫 번째 포트에 부착하여 전방 추출막(FEM)에 추출 용액을 공급하는 유출 포트 역할을 합니다(그림 1B).
- BEM(Backward Extraction Membrane)에서 추출 용액의 회수 포트 역할을 하는 두 번째 포트를 부착합니다(그림 1C).
- 대기에 개방된 세 번째 포트를 추가하여 다이어프램 펌프로 인한 압력 변동을 완화합니다.
- 다이어프램 펌프를 추출 멤브레인에 연결합니다.
- 폴리테트라플루오로에틸렌(PTFE) 다이어프램 펌프 헤드가 장착된 100rpm 가변 속도 펌프 드라이브를 저장소에 인접하게 배치합니다(그림 1D).
- 추출 용액 저장소 유출 포트(그림 1A)를 다이어프램 펌프의 입구에 연결한 다음 다이어프램 펌프의 출구를 유연한 펌프 튜브(예: 크기 16, 18)를 사용하여 FEM 바닥의 쉘 쪽 입구(그림 1B)에 연결합니다.
- 플렉시블 펌프 튜빙(예: 크기 18)을 사용하여 FEM 상단의 쉘 측 배출구를 BEM 하단의 쉘 측 입구(그림 1C)에 연결합니다.
- 유연한 펌프 튜브(예: 크기 16, 18)를 사용하여 BEM 상단의 쉘 측 배출구를 추출 용액 저장소(그림 1A)의 리턴 포트에 연결합니다.
참고: 이 시스템 구성 요소는 FEM의 발효액에서 추출한 MCFA를 BEM의 스트리핑 용액으로 전달합니다.
- 수성 위상 스트리핑 용액과 저장소를 준비합니다.
- 3.25M 붕산 용액을 취하고 NaOH를 사용하여 pH 9로 조정하여 0.5L의 수성 상 박리 용액을 준비합니다.
- 자석 교반 막대가 있는 3.5L 유리 용기에 용액을 붓습니다.
- 저장소를 자기 교반 플레이트에 놓습니다(그림 1E).
- 스트리핑 용액 저장소를 위한 4포트 캡을 준비합니다.
- 딥 튜브를 첫 번째 포트에 부착하여 BEM에 스트리핑 용액을 공급하는 유출 포트 역할을 합니다.
- (1) BEM에서 스트리핑 용액의 회수 흐름 포트 역할을 하고 (2) pH 제어 시스템으로부터의 NaOH 첨가를 위한 동반 스트림 역할을 하는 Y-피팅을 포함하는 두 번째 포트를 부착합니다.
- NaOH 첨가 및 MCFA 축적으로 인한 부피 증가를 설명하기 위해 대기에 개방된 세 번째 포트를 추가합니다.
- pH 컨트롤러의 pH 프로브를 수용할 수 있는 네 번째 포트를 제공합니다.
- 스트리핑 용액 저장소에 pH 제어 시스템을 설치합니다.
- pH 9의 설정점을 가진 pH 제어 시스템을 스트리핑 용액 저장소와 통합합니다(그림 1F). 수집된 MCFA를 중화시키기 위해 pH 컨트롤러와 함께 5M NaOH를 기본 용액으로 사용하십시오.
- 스트리핑 용액 저장소 포트를 통해 pH 프로브를 삽입하고 스트리핑 용액에 현탁합니다.
참고: 이 pH 제어 시스템에는 산성 용액이 필요하지 않습니다.
- 바이오리액터 연결 포트를 준비합니다.
- 액체-액체 추출(LLE) 시스템과의 연결을 위해 바이오리액터에 두 개의 포트(유출 포트와 회수 흐름 포트)를 지정합니다(그림 1G,H).
- 딥 튜브를 유출 포트에 연결합니다. MCFA가 풍부한 육수는 유출 포트의 생물 반응기에서 LLE 시스템으로 펌핑됩니다.
알림: 육수는 추출 멤브레인보다 먼저 중공사막 필터로 들어가 세포 및 기타 고형물을 제거하여 오염을 방지합니다. - 리턴 플로우 포트에 티 피팅을 삽입하여 (1) FEM에서 재활용된 MCFA 고갈 육수액과 (2) 중공사 멤브레인 필터에서 세포 함유 잔류물을 받습니다.
- 중공사 멤브레인 필터를 설치합니다.
- 300rpm 가변 속도 펌프 드라이브를 바이오리액터에 인접하게 배치합니다(그림 1I).
- 친수성 중공사막(그림 1J)을 연동 펌프 위의 링 스탠드에 부착합니다.
- 펌프 드라이브에 두 개의 연동 펌프 헤드를 대형(예: 크기 17) 및 소형(예: 크기 16)으로 쌓습니다.
알림: 더 큰 펌프 헤드는 중공사 멤브레인 필터에 연결되어 투과 유량이 FEM으로 공급되는 유량보다 크도록 합니다. 그렇지 않으면 투과물이 생성되는 것보다 더 빨리 소모되어 진공이 형성됩니다. - 유연한 펌프 튜브(예: 크기 17)를 사용하여 생물반응기의 배출 포트를 대형 펌프 헤드 입구에 연결합니다.
- 유연한 펌프 튜브(예: 크기 17)를 사용하여 필터 바닥의 튜브 측 입구에서 대형 펌프 헤드 출구를 친수성 중공사 멤브레인 필터에 연결합니다.
- 공기 유입을 방지하기 위해 필터의 상단 쉘 쪽 포트를 캡합니다.
참고: MCFA가 풍부한 육수(세포 포함)는 중공사 튜브를 통해 위로 흘러 생물반응기로 돌아갑니다. 맑은 국물(cell-free)은 0.2μm 친수성 폴리에테르설폰(PES) 멤브레인을 통과하여 필터의 쉘 쪽에 모입니다.
- FEM을 연결합니다.
- 첫 번째 소수성 중공사막 모듈(FEM)을 펌프 위의 링 스탠드에 부착합니다(그림 1B).
- 유연한 펌프 튜브(예: 크기 16, 18)를 사용하여 쉘 측 출구의 친수성 중공사막 필터(그림 1J)를 작은 펌프 헤드 입구에 연결합니다.
- 유연한 펌프 튜브(예: 크기 16, 18)를 사용하여 모듈 바닥의 튜브 쪽 입구에 있는 작은 펌프 헤드 출구를 FEM에 연결합니다.
- 커플링 피팅과 티 피팅을 사용하여 압력 게이지(그림 1K)와 유량 제한 밸브(그림 1L)를 FEM의 튜브 측 배출구에 연결합니다.
- 플렉시블 펌프 튜빙(예: 크기 18)을 사용하여 FEM의 튜브 측 배출구를 바이오리액터의 리턴 포트에 연결합니다.
참고: 이 시스템 구성 요소는 맑은 발효액에서 추출 용액으로 MCFA를 옮긴 다음 맑은 육수를 생물 반응기로 되돌려 보냅니다.
- BEM을 연결합니다.
- 연동 펌프 헤드(예: 크기 16)가 장착된 300rpm 가변 속도 펌프 드라이브를 생물 반응기에 인접하게 배치합니다(그림 1M).
- 두 번째 소수성 중공사 멤브레인 모듈을 연동 펌프 위의 링 스탠드에 부착합니다(그림 1C).
- 플렉시블 펌프 튜빙(예: 크기 16, 18)을 사용하여 스트리핑 용액 저장소 유출 포트를 연동 펌프 입구에 연결하고 펌프 출구를 BEM 바닥의 튜브 측 입구에 연결합니다.
- 커플링 피팅과 T자형 피팅을 사용하여 압력계와 유량 제한 밸브를 BEM의 튜브 측 배출구에 연결합니다.
- 유연한 펌프 튜브(예: 크기 16, 18)를 사용하여 BEM 상단의 튜브 측 배출구를 스트리핑 용액 저장소 회수 흐름 포트에 연결합니다.
참고: 이 시스템 구성 요소는 추출 용액의 MCFA를 BEM의 스트리핑 용액으로 전송한 다음 스트리핑 용액을 저장소로 되돌려 보냅니다.
2. 액체-액체 추출 시스템의 작동 시작
- 수성 위상 라인을 프라이밍하고 순환시킵니다.
- 스트리핑 용액 연동 펌프/BEM(그림 1M)을 켜고 펌프 속도를 설정하여 25-250mL·min-1 사이의 일정한 유속을 달성합니다. BEM은 비교적 넓은 범위의 유량을 수용할 수 있습니다. 충분한 MCFA 추출을 보장하기 위해 처음에는 보수적으로 높은 유속으로 시작합니다. 유량은 펌프 장비 및 튜브의 서비스 수명을 연장하기 위해 나중에 작동 중에 점진적으로 감소할 수 있습니다.
참고: 유속은 바이오리액터 브로트에 MCFA가 축적될 수 있을 정도로 낮아서는 안 됩니다(대표 결과 참조). - BEM의 쉘 쪽 출구에서 니들 밸브를 천천히 닫아(그림 1C) ~5psig의 배압을 설정합니다.
- 생물반응기/FEM 연동 펌프(그림 1I)를 켜고 펌프 속도를 설정하여 25-250mL·min-1 사이의 일정한 유속을 달성합니다. FEM은 비교적 넓은 범위의 유량을 수용할 수 있습니다. 충분한 MCFA 추출을 보장하기 위해 처음에는 보수적으로 높은 유속으로 시작합니다. 유량은 펌프 장비 및 튜브의 서비스 수명을 연장하기 위해 나중에 작동 중에 점진적으로 감소할 수 있습니다.
참고: 유속은 생물반응기 혼합물에 MCFA가 축적될 수 있을 정도로 낮아서는 안 됩니다(대표 결과 섹션 참조). - FEM의 쉘 쪽 출구에서 니들 밸브를 천천히 닫아(그림 1B) ~5psig의 배압을 설정합니다.
- 리턴 플로우 라인을 육안으로 확인하여 일정한 흐름과 라인이 프라이밍되었는지 확인합니다.
- 중공사 멤브레인 필터의 쉘 쪽에 맑은 국물이 모였는지 확인합니다(그림 1J).
참고: FEM을 채우고 중공 섬유 멤브레인 필터와 FEM 사이에 안정적인 흐름을 설정하는 데 몇 시간이 걸립니다. 유속은 바이오리액터 브로트에 MCFA가 축적될 수 있을 정도로 낮아서는 안 됩니다(대표 결과 섹션 참조).
- 스트리핑 용액 연동 펌프/BEM(그림 1M)을 켜고 펌프 속도를 설정하여 25-250mL·min-1 사이의 일정한 유속을 달성합니다. BEM은 비교적 넓은 범위의 유량을 수용할 수 있습니다. 충분한 MCFA 추출을 보장하기 위해 처음에는 보수적으로 높은 유속으로 시작합니다. 유량은 펌프 장비 및 튜브의 서비스 수명을 연장하기 위해 나중에 작동 중에 점진적으로 감소할 수 있습니다.
- 유기상선을 프라이밍하고 순환시킵니다.
- 유기상 추출 용액 다이어프램 펌프(그림 1D)를 켜고 펌프 속도를 설정하여 5.0-50mL·min-1 사이의 일정한 유속을 달성합니다. 처음에는 보수적으로 낮은 유속으로 시작하여 유기상 추출의 압력을 최소화하고 교차 오버의 위험을 최소화합니다. 필요한 경우 추출 효율성을 개선하기 위해 나중에 작동 중에 유속을 점진적으로 증가시킬 수 있습니다
- FEM 및 BEM이 채워질 때까지 기다립니다.
- 추출 용액 저장소의 회수 흐름 포트를 육안으로 확인하여 일정한 흐름을 보장합니다.
- 유기상 용액이 스트리핑 용액 또는 발효액 라인으로 교차하지 않는지 확인합니다. 교차가 발생하는 경우 유기상의 작은 방울을 볼 수 있습니다. 이 경우 다이어프램 펌프 속도를 줄이고 FEM 또는 BEM에서 배압을 적절하게 약간 높입니다. 10psig를 초과하지 마십시오.
알림: 멤브레인 교차를 방지하려면 유기상 라인을 프라이밍하기 전에 수성 상 라인 내에서 흐름과 배압을 설정하는 것이 중요합니다.
- 생물반응기에서 MCFA를 지속적으로 추출합니다.
- LLE 시스템이 완전히 작동해야 합니다. 생물 반응기 작동 중에 시스템이 계속 실행되도록 합니다.
- MCFA의 충분한 추출을 보장하기 위해 매일 생물반응기에서 MCFA 농도를 측정합니다. 생물 반응기에서 MCFA 농도가 상승하는 경우, 이는 일반적으로 FEM을 통한 발효액의 유속이 충분하지 않음을 나타냅니다. 또한 오염 및 유지 보수의 필요성으로 인한 멤브레인 플럭스 감소를 나타낼 수 있습니다(2.6단계 참조).
참고: SCFA 및 MCFA 농도는 Ge et al.11에 설명된 방법에 따라 가스 크로마토그래피를 통해 측정할 수 있습니다.
- 스트리핑 용액 저장소의 MCFA 축적을 모니터링합니다.
- 배치 주기 동안 매일 스트리핑 용액 내 MCFA 농도를 측정합니다. LLE 시스템은 생물반응기에서 스트리핑 용액으로 MFCA를 지속적으로 전달하여 시간이 지남에 따라 MCFA 농도를 증가시킵니다. 이 공정은 높은 MCFA 역가를 생성하기 위해 장기간 실행될 수 있습니다. MCFAs의 체적 생산 속도(mM C·L-1·d-1)는 수학식 111을 사용하여 추정할 수 있습니다.
참고: 체적 생산률 =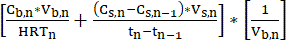 (식 1)
(식 1)
어디:
Cb,n = n 일 발효액의 MCFA 농도, mM C
Cs,n= n일 스트리핑 용액의 MCFA 농도, mM C
Cs,n-1 = n-1 일 스트리핑 용액의 MCFA 농도, mM C
Vs,n = n 일, L의 스트리핑 용액 부피
Vb,n = n 일째의 발효 육수 부피 (생물 반응기 부피), L
HRTn= n일, d일 때 바이오리액터의 수압 머무름 시간
Tn= n일, d
Tn-1= n-1일, d - 안정적인 작동을 위해 측정 시점 간의 MCFA 농도 변화를 측정하고 방정식 211을 적용하여 LLE 시스템의 추출 속도(mM C·d-1)를 주기적으로 계산합니다.
참고: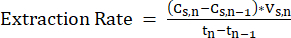 (식 2)
(식 2)
어디:
Cs,n= n일 스트리핑 용액의 MCFA 농도, mM C
Cs,n-1 = n-1 일 스트리핑 용액의 MCFA 농도, mM C
Vs,n = n 일, L의 스트리핑 용액 부피
Tn= n일, d
Tn-1= n-1일, d - 추출 용액에서 적절한 전달 속도를 유지하려면 MCFA 농도가 80% 포화도에 도달하기 전에 스트리핑 용액을 새 배치로 교체하십시오.
참고 : n- 카프로산의 최대 용해도는 10.3g · 25 °C에서 L-1, n- 카 프릴산의 L-1은 0.67 g · 25 °C에 L-1.
- 배치 주기 동안 매일 스트리핑 용액 내 MCFA 농도를 측정합니다. LLE 시스템은 생물반응기에서 스트리핑 용액으로 MFCA를 지속적으로 전달하여 시간이 지남에 따라 MCFA 농도를 증가시킵니다. 이 공정은 높은 MCFA 역가를 생성하기 위해 장기간 실행될 수 있습니다. MCFAs의 체적 생산 속도(mM C·L-1·d-1)는 수학식 111을 사용하여 추정할 수 있습니다.
- 스트리핑 용액을 교체합니다.
- 다이어프램 펌프를 끕니다(그림 1D).
- 스트리핑 용액 연동 펌프를 끕니다(그림 1M).
- 호스 클램프를 사용하여 BEM의 튜브 측 입구와 튜브 측 출구를 클램프 체결합니다.
- pH 제어 시스템을 끄고 포트 연결을 연결된 상태로 유지하면서 스트리핑 용액 저장소 캡을 제거합니다(가능한 경우).
- 스트리핑 용액 저장소를 제거합니다(그림 1E).
- 스트리핑 용액 저장소를 NaOH를 사용하여 pH 9로 조정된 0.5M 붕산 수용액의 새로운 배치로 교체합니다(단계 1.4 참조). 저장소에 캡을 다시 부착합니다.
- BEM의 튜브 측 입구와 튜브 측 출구에서 호스 클램프를 제거합니다.
- 스트리핑 용액 연동 펌프(그림 1M)를 켠 다음 다이어프램 펌프(그림 1D)를 켭니다. 이제 시스템 작동이 복원되었습니다.
- 멤브레인 유지 보수.
- 청소를 위해 3개월에 한 번씩 LLE 시스템에서 FEM 및 BEM을 제거합니다. 3개월은 보수적으로 예상되는 청소 빈도입니다.
알림: 응용 분야에 따라 사용자는 멤브레인을 더 자주 또는 덜 자주 청소할 수 있습니다. 멤브레인 성능 저하의 징후는 대표 결과 섹션에 설명되어 있습니다. 유지 보수 중에는 펌프와 pH 컨트롤러를 꺼야 합니다. 청소 지침은 멤브레인 제조업체에서 제공해야 합니다. - LLE 시스템의 액체를 유기상 추출 용액 라인부터 시작하여 발효수 라인 및 스트리핑 용액 라인으로 이어지는 별도의 용기로 배출합니다.
- 멤브레인을 청소하고 다시 설치하면 액체를 해당 저장소로 되돌립니다.
- 위에서 설명한 방법을 사용하여 LLE 시스템을 다시 시작합니다(2.1-2.2단계 참조).
- 청소를 위해 3개월에 한 번씩 LLE 시스템에서 FEM 및 BEM을 제거합니다. 3개월은 보수적으로 예상되는 청소 빈도입니다.
결과
긍정적인 MCFA 추출 결과는 알칼리 수용성 스트리핑 용액(그림 2)에 MCFA 산물이 꾸준히 축적되고 발효액에서 상대적으로 안정적인 MCFA 농도로 표시됩니다(데이터 표시되지 않음). 그림 2 는 연속 LLE 작동 중 스트리핑 용액의 3가지 반배치 사이클을 보여줍니다. 주기는 배치 교체 단계(그림 2: 24일, 46일, 68일)와 MCFA 축적 단계(그림 2: 0-24일, 25-46일, 47-68일)의 두 단계로 구성됩니다. 이 특정 발효 및 LLE 시스템의 경우 사이클 기간은 약 20-24일이었습니다. 그러나 사이클 기간은 생물반응기 부피, 생물학적 생산성, 스트리핑 용액 부피, 중공사막 면적 및 LLE 시스템 내 액체 재순환 속도를 포함한 여러 요인에 따라 달라지기 때문에 응용 분야마다 다릅니다. 배치 주기 동안 스트리핑 용액은 발효액에 존재하는 다양한 작은 유기산(예: 부식산, 펄빅산)의 낮은 수준의 동시 추출로 인해 투명에서 황갈색으로 변할 수 있습니다(그림 3). 부정적인 MCFA 추출 결과는 스트리핑 용액에 MCFA 산물이 천천히 축적되고 발효액의 MCFA 농도가 사전 설정된 기준선에 비해 높아지는 것으로 나타납니다.
카프로에이트의 생물학적 생산성은 일반적으로 이러한 발효 과정에서 카프릴레이트보다 높습니다. 따라서, 카프로에이트는 카프릴레이트에 비해 스트리핑 용액에서 더 빠른 속도로 축적되는 것이 일반적입니다. 또한 그림 2에서 볼 수 있듯이 아세테이트 및 부티레이트와 같은 SCFA가 스트리핑 용액에 더 적은 양으로 축적되는 것은 정상입니다. 미네랄 오일의 TOPO는 SCFA보다 MCFA에 대한 친화력이 더 높기 때문에 MCFA가 선택적으로 제거됩니다. Saboe et al.12, Kaur et al.13, Carvajal-Arroyo et al.14 및 Ge et al.11의 연구는 수용액과 관련된 여러 응용 분야에서 지방산에 대한 TOPO의 높은 선택성을 입증했습니다. 두 번째 배치 주기 동안 MCFA와 SCFA의 파티셔닝 비율은 그림 4에 나와 있습니다. 배치 주기에 며칠 동안 MCFA:SCFA 분할 비율이 40:1 이상일 것으로 예상할 수 있습니다. MCFA:SCFA 분할 비율은 추출 과정이 의사 정상 상태에 가까워짐에 따라 정체됩니다. 며칠 후에도 >40의 비율에 도달할 수 없는 경우 이는 TOPO 추출제가 분해되었거나 용리되었음을 의미합니다. 이 경우 새 추출 용액을 준비해야 합니다(1.1단계 참조). 안정기 이후 비율이 감소하면 MCFA가 포화점의 80% 이상 축적되었음을 나타냅니다. 이 경우 새로운 스트리핑 용액을 준비해야 합니다(1.4단계 참조)
낮은 MCFA 추출 효율은 LLE 시스템 내의 불충분한 유속으로 인해 발생할 수 있습니다. 그림 5에서는 발효액 및 스트리핑 용액 순환 라인에서 펌핑 속도를 감소시켜 액체 재순환 속도 감소가 MCFA 추출 효율에 미치는 영향을 보여줍니다. 추출 효율은 생물반응기에 의해 생성된 총 MCFA에 LE에 의해 추출된 MCFA에 대한 스트리핑 용액에서 추출된 MCFA의 백분율로 정의됩니다. 정상 작동 시 85% 이상의 추출 효율을 기대할 수 있습니다(그림 5, 1-14일). 펌프 속도가 낮으면(그림 5, 14일차) 이에 따라 추출 효율이 감소합니다. 적절한 펌프 속도가 복원되면 추출 효율이 회복되는 데 몇 일이 걸릴 수 있습니다. 이는 발효액(낮음)보다 스트리핑 용액의 추출 속도(높음)의 차이에 의해 유발되는 추출 용액에서 MCFA의 정상 상태 농도 감소로 인해 발생할 수 있습니다.
(1) 멤브레인 오염, (2) 막힘으로 인한 LLE 시스템의 각 단계에서의 유체 흐름 제한, (3) 멤브레인 접촉기에 가스 포켓 형성, (4) 스트리핑 용액의 MCFA 농도가 포화점에 접근하도록 하는 등 여러 가지 다른 요인이 추출 효율 감소에 기여할 수 있습니다. 멤브레인 오염은 초기 조건에 비해 시간이 지남에 따라 멤브레인 플럭스가 감소하는 것으로 나타납니다. FEM에서 생물막이 형성될 가능성은 낮지만, 세포 파편 및 기타 부유 물질의 축적으로 인해 오염이 발생할 수 있습니다. 또한 BEM은 무균이지만 시간이 지남에 따라 멤브레인 접촉기 또는 튜브 내에 지방산염이 침전되어 흐름이 차단될 수 있습니다. 그러나 멤브레인 접촉기의 일상적인 유지 관리 및 청소(2.6단계 참조)는 오염 및 염분 침전 문제가 발생하는 것을 방지해야 합니다. 가스 포켓은 부적절한 위치로 인해 멤브레인 접촉기의 상단 쉘 쪽에 형성되는 경우가 있습니다. 멤브레인 접촉기는 쉘 측 출구 포트가 가장 높은 지점에 있도록 수직에서 약간 기울어져 형성되는 모든 가스가 접촉기를 빠져나갈 수 있도록 해야 합니다. LLE 시스템의 유체 흐름은 가스 포켓을 씻어내는 데 도움이 되도록 도급업체의 하단에서 상단으로 흐르도록 구성됩니다. 마지막으로, 추출 용액에서 BEM의 스트리핑 용액으로의 MCFA 전달은 스트리핑 용액의 매우 높은 MCFA 농도에서 감소합니다. 이 문제는 스트리핑 용액을 더 자주 교체하여 해결할 수 있습니다.
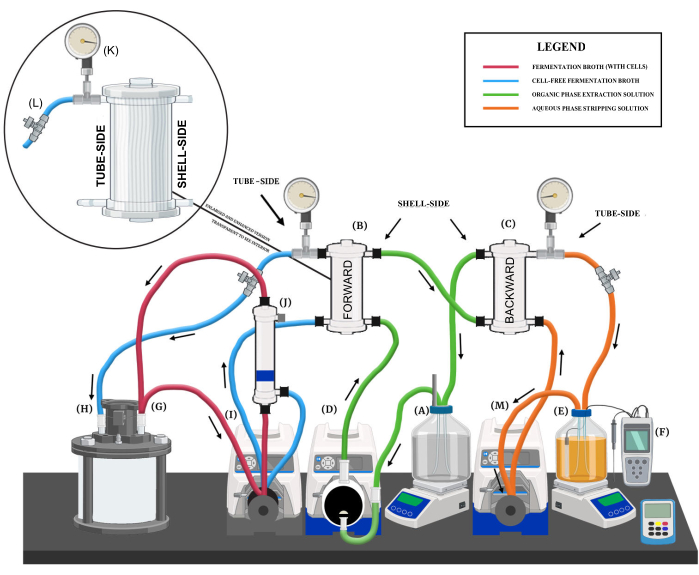
그림 1: 액체-액체 추출 시스템의 개요. 주요 시스템 구성 요소, 다양한 유체 회로 및 흐름 방향을 보여주는 다이어그램 렌더링입니다. 주요 시스템 구성 요소는 다음과 같이 표시됩니다: (A) 유기상 추출 용액 저장소, (B) 전방 교환 멤브레인, (C) 역방향 교환 멤브레인, (D) 추출 용액 다이어프램 펌프, (E) 수성 상 스트리핑 용액 저장소, (F) pH 제어 시스템, (G) 생물 반응기 유출 포트, (H) 생물 반응기 회수 흐름 포트, (I) 순방향 교환막 및 중공 섬유 멤브레인 필터 연동 펌프, (J) 중공사 멤브레인 필터, (K) 압력계, (L) 니들 밸브 및 (M) 스트리핑 용액 연동 펌프. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
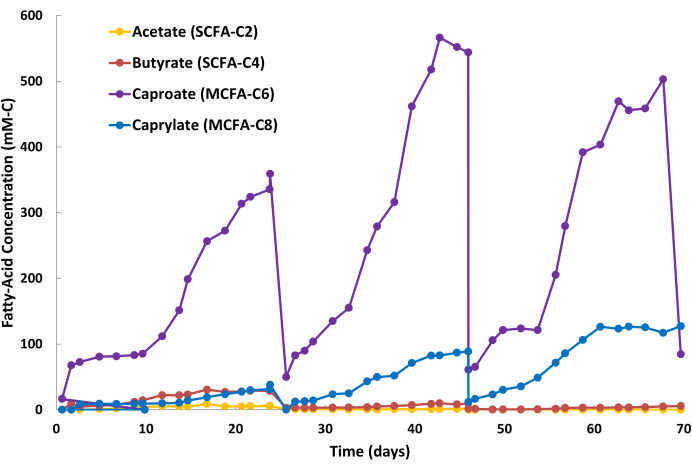
그림 2: 스트리핑 용액의 지방산 축적. 연속 액체-액체 추출 작업 중 스트리핑 용액의 3회 배치 주기 동안 단쇄 지방산 및 중쇄 지방산 농도를 보여주는 데이터. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 추출 후 스트리핑 용액 색상 변화. 배치 사이클 전(즉, 배치 전) 및 후(즉, 배치 후)의 수성 상 스트리핑 용액의 색상 변화를 보여주는 사진. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
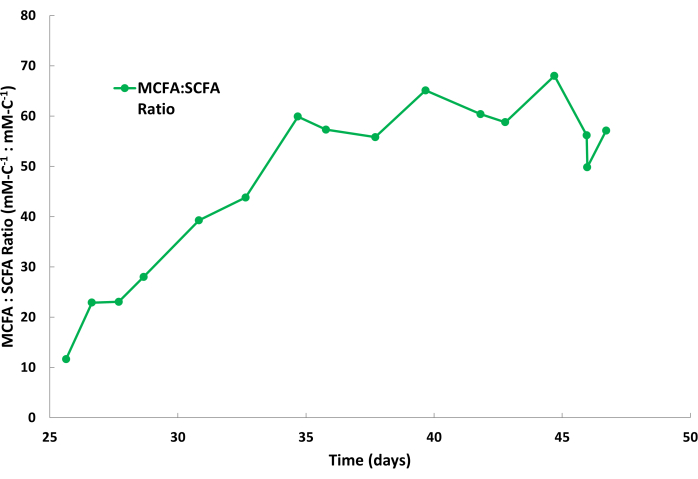
그림 4: 스트리핑 용액의 지방산 비율. 연속 액체-액체 추출 작업 중 스트리핑 용액의 배치 주기 동안 중쇄 지방산과 단쇄 지방산의 비율을 보여주는 데이터. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
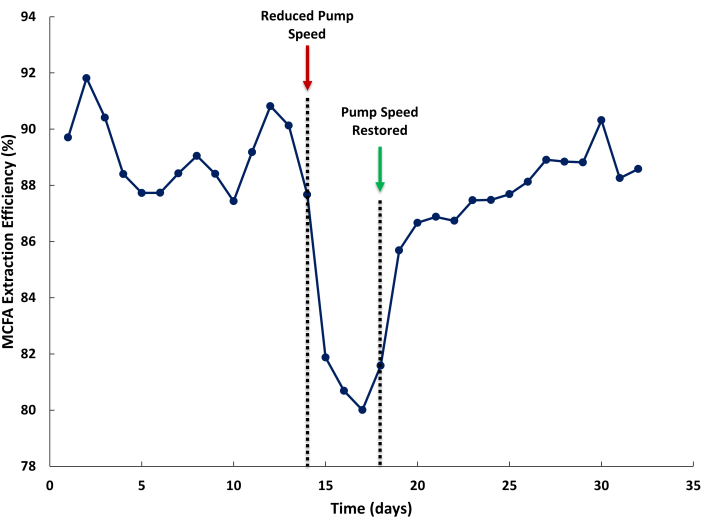
그림 5: 멤브레인 유속이 추출 효율에 미치는 영향. 작동 중 중쇄 지방산 추출 효율에 대한 전방 및 후방 교환막을 통한 불충분한 유속의 영향을 보여주는 데이터. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
생물학적으로 생산된 MCFA는 일반적으로 SCFA 및 알코올을 포함한 다양한 유기 화합물과 함께 혼합물에서 발견됩니다2. 결과적으로, 이를 효과적으로 복구하고 활용하기 위해 선택적 분리 과정이 필요합니다. 여기에서 개발된 LLE 시스템은 SCFA와 알코올을 보존하면서 이러한 혼합물에서 MCFA를 연속적으로 선택적으로 추출합니다. 이러한 기능성으로 인해 LLE 시스템은 MCFA, SCFA 및 알코올이 주요 대사 산물을 구성하는 미생물 사슬 신장과 같은 발효 응용 분야에 특히 적합합니다8. 특히, LLE 시스템은 MCFA를 제거하여 사슬 신장 공정을 진행하고, 제품 억제1을 방지하는 동시에 SCFA 및 알코올 반응물을 발효액에 남겨 두어 후속 생물학적 전환을 가능하게 합니다. LLE 시스템은 특정 추출 솔루션을 수정하여 다른 애플리케이션에 맞게 사용자 정의할 수 있습니다. 예를 들어, 추출제 용액 혼합물에서 TOPO를 제거함으로써 동일한 LLE 시스템을 사용하여 발효 중에 생성된 SCFA의 연속 추출을 달성할 수 있습니다.
따라서 LLE 분석법의 중요성은 다른 방법에 비해 이러한 바이오프로세싱 및 생명공학 응용 분야에 더 강력한 MCFA 추출 기술을 제공한다는 데 있습니다. 비혼화성 액체를 사용한 현장 바이페이식 추출은 발효액에서 MCFA를 추출하는 또 다른 접근법이다15. 그러나 이 방법은 상대적으로 비효율적입니다. 에멀젼 층은 수성 단계(즉, 발효 육수)와 유기 단계 사이에 형성되어 질량 전달 속도를 심각하게 제한합니다. 위상 층 사이의 최소한의 계면 유체 혼합도 물질 전달을 제한합니다. 또 다른 단점은 미생물 세포가 유기 단계와 직접 접촉하여 혼입, 억제 및 세포 사멸을 유발한다는 것입니다15. 마지막으로, in situ biphasic 추출은 유기상을 제거하고 교체하기 위해 빈번한 유지 관리가 필요합니다.
생물반응기 내에서 높은 희석률을 적용하는 것은 생성물 억제를 피하기 위한 또 다른 방법이다16. 높은 희석 속도는 생물 반응기에서 높은 반응물 농도를 유지함으로써 높은 생산성을 달성할 수 있습니다. 그러나 이 접근 방식은 바이오매스 유실, 대량의 폐수 생성, 높은 기판 손실(즉, SCFA 및 알코올)에 기여하여 수율이 낮아지기 때문에 불리합니다. 이러한 단점은 고정화된 바이오매스와 폐수 재활용을 사용하여 완화할 수 있지만, 이러한 개입은 시스템 복잡성을 가중시킨다17. 마지막으로, 제품 스트림의 MCFA 농도가 희석되어 MCFA가 비효율적이고 비용이 많이 듭니다.
새로운 추출 방식에는 유기상과 수성상을 물리적으로 분리하는 단일 전방 추출 멤브레인으로 MCFA를 지속적으로 증류하여 미생물 바이오매스를 유지하고 보호하는 것이 포함될 수 있습니다. MCFA는 유기 상태로 선택적으로 추출된 다음 증류됩니다. 라피네이트는 추출 멤브레인으로 지속적으로 재활용될 수 있습니다. 그러나 연속 증류는 특히 실험실 환경에서 기술적으로 까다로우며 장기간 작동 중에 화학 추출제의 성능 저하 또는 손실을 유발할 수 있습니다. 증류는 또한 유기상 및 MCFA 생성물의 열적 분해를 유발할 수 있다18.
LLE 프로세스는 몇 가지 중요한 기능과 처리 단계를 통합하여 이러한 대체 접근 방식과 관련된 많은 단점을 방지합니다. 첫째, 친수성 중공사막 필터는 바이오매스 셀(생체 촉매)이 FEB의 추출 용액에 노출되지 않도록 보호하는 동시에 LLE 시스템의 오염 및 고체 축적을 줄이는 투명한 MCFA가 풍부한 여과액을 제공하는 이중 목적을 제공합니다. 둘째, 액체 교차를 방지하기 위해 니들 밸브를 통합하여 각 멤브레인 접촉기의 튜브 쪽에 배압을 생성했습니다. 이 예방 조치는 약간의 막횡단 압력 구배를 유지하여 FEM 및 BEM에서 쉘 측에서 수성 튜브 측으로 소수성 유기 용매가 원치 않는 누출을 방지합니다. 또한 액체 흐름은 멤브레인 모듈 내부에 쌓일 수 있는 가스 기포의 갇힘을 방지하기 위해 FEM 및 BEM의 바닥에서 상단으로 병렬로 흐르도록 구성되어 전달 효율성을 감소시키고 캐리오버를 유발합니다. 또한 이 방법은 내화학성 PTFE 펌프 헤드가 있는 다이어프램 펌프를 사용하여 부식성 MCFA 함유 추출제 용액을 펌핑하여 추출 공정을 손상시킬 수 있는 부식 및 고장으로부터 시스템을 보호합니다. 마지막으로, pH 제어 알칼리 스트리핑 용액은 pH 구배를 유지하여 바이오리액터에서 LLE 시스템을 통해 MCFA를 고속으로 스트리핑 용액 저장소로 지속적으로 전달할 수 있으며, 여기서 MCFA는 탈양성자화되어 높은 역가로 축적되어 다운스트림 제품 회수를 용이하게 합니다.
이 LLE 분석법은 실험실 규모의 바이오리액터(최대 6L의 작업 용량)에서 연속적인 MCFA 추출에 적합하며 여러 연구에서 장기 작동이 가능한 것으로 검증되었습니다 1,9,11,19. LLE 분석법은 또한 더 큰 규모의 어플리케이션(14)(즉, 파일럿 스케일 바이오리액터)에 적용될 수 있지만, 비례적으로 스케일된 멤브레인 및 유체 처리 장비를 필요로 한다. 그러나 이 방법에는 주로 유지 관리 및 시스템 복잡성 영역에서 몇 가지 제한 사항이 있습니다. 이 공정은 지속적으로 작동하도록 설계되었기 때문에 멤브레인 모듈과 펌프를 자주 정비해야 하므로 상당한 가동 중지 시간이 발생합니다. 또 다른 단점은 스트리핑 용액에 상대적으로 많은 양의 NaOH와 붕산이 필요하다는 것입니다. 또한 MCFA는 부식성이 있어 특정 LLE 시스템 구성 요소가 시간이 지남에 따라 성능이 저하됩니다. 예를 들어, 플라스틱 커넥터와 멤브레인 하우징이 부서지기 쉬워져 작동 중에 교체가 필요할 수 있습니다. 마지막으로, LLE 시스템의 유체 처리 네트워크는 복잡하며 누출이 발생할 수 있는 많은 연결 지점이 포함되어 있습니다. 그러나 이러한 제한 사항 및 단점의 대부분은 연속 멤브레인 분리 공정에서 전형적이며 예상해야 합니다.
전반적으로 이 LLE 프로토콜은 선택적 MCFA 추출을 위한 강력하고 효율적인 접근 방식을 제공하며, 이는 다양한 분야의 연구를 발전시키는 데 영향을 미칩니다. 이 방법은 발효 중 세포 외 대사 산물의 현장 회수를 위한 정밀 발효 분야에서 많은 관련 응용 분야를 찾을 수 있습니다. LLE는 실행 후 원심분리, 마이크로 여과 및 한외 여과 또는 배치로 수행되는 용매 추출과 같은 기존 다운스트림 처리(DSP) 접근 방식에 대한 저렴한 대안이 될 수 있습니다. 실제로 DSP는 산업 발효 공정에서 주요 비용 동인인 경우가 많습니다. LLE를 사용한 연속 제품 추출은 또한 연속 발효를 가능하게 하여 기존 배치 또는 유가식 접근 방식에 비해 작업의 생산성과 실행 시간 효율성을 크게 향상시킬 수 있습니다. 또한 향후 연구에서는 심층 공융 용매 또는 이온 액체와 같은 유기 용매 이외의 추출 매체를 조사할 수 있습니다. 마지막으로, 이 프로토콜에 설명된 LLE 시스템은 실험실 환경에서 실험 목적으로 고안되었습니다. 따라서 에너지 요구량, 멤브레인 면적, 전체 추출 수율 및 속도를 줄이기 위한 최적화 연구의 여지가 여전히 상당합니다.
공개
이해 상충이 없습니다.
감사의 말
저자들은 조지아 대학의 농업 실험 기지에서 제공하는 기술 및 재정적 지원에 감사를 표하고자 합니다. 또한 저자들은 공정 샘플 분석에 도움을 준 Samuel Ogundipe, Dr. Ronald Pegg 및 Dr. Joon Hyuk Suh에게 감사의 뜻을 전합니다.
자료
| Name | Company | Catalog Number | Comments |
| 10 L Media Bottle | Duran | 218018658 | |
| 3.5 L Media Bottle | Duran | 218016957 | |
| Boric acid, 99.5%, | ThermoScientific (Fisher Scientific) | 327132500 | |
| Hydrophilic MINIKROS 20CM 0.2UM PES 1MM 1.5TC X 3/4TC | Repligen | N02-P20U-10-N | |
| L/S Variable-Speed Pump Drive; 100 rpm | MasterFlex (VWR) | MFLX07528-10 | |
| L/S Variable-Speed Pump Drive; 300 rpm | MasterFlex (VWR) | MFLX07528-20 | |
| Light Mineral Oil, NF (4 Liters) (CAS: 8042-47-5) | Thomas Scientific | C761Z18 | |
| Liqui-Cel 2.5x8 X50 membrane CO2, PP Housing Viton O-rings (0.5-3 gpm (0.1-0.7 m3/h)), 1/4-in FNPT connections | 3M | LC-02508X50-G453 | |
| Magnetic Stirrer, 20 L Capacity, 110 V | Cole-Parmer | EW-04661-29 | |
| Masterflex L/S Precision Pump Tubing, Tygon, Size 14 | MasterFlex (VWR) | MFLX06402-14 | Specific tubing size will depend on application. |
| Masterflex L/S Precision Pump Tubing, Tygon, Size 16 | MasterFlex (VWR) | MFLX06402-16 | Specific tubing size will depend on application. |
| Masterflex L/S Precision Pump Tubing, Tygon, Size 17 | MasterFlex (VWR) | MFLX06402-17 | Specific tubing size will depend on application. |
| Masterflex L/S Precision Pump Tubing, Tygon, Size 18 | MasterFlex (VWR) | MFLX06402-18 | Specific tubing size will depend on application. |
| MasterFlex L/S Standard Pump Head for Precision Tubing L/S 14, Polycarbonate Housing, CRS Rotor | MasterFlex (VWR) | MFLX07014-20 | Specific pump head size will depend on application. |
| MasterFlex L/S Standard Pump Head for Precision Tubing L/S 14, Polycarbonate Housing, CRS Rotor | MasterFlex (VWR) | MFLX07014-20 | Specific pump head size will depend on application. |
| MasterFlex L/S Standard Pump Head for Precision Tubing L/S 16, Polycarbonate Housing, CRS Rotor | MasterFlex (VWR) | MFLX07016-20 | Specific pump head size will depend on application. |
| MasterFlex L/S Standard Pump Head for Precision Tubing L/S 17, Polycarbonate Housing, CRS Rotor | MasterFlex (VWR) | MFLX07017-20 | Specific pump head size will depend on application. |
| MasterFlex L/S Standard Pump Head for Precision Tubing L/S 18, Polycarbonate Housing, CRS Rotor | MasterFlex (VWR) | MFLX07018-20 | Specific pump head size will depend on application. |
| MasterFlex PTFE-diaphragm pump head, 10 to 100 mL/min | MasterFlex (VWR) | MFLX07090-62 | |
| Oakton 220 pH/ORP/Temperature Controller, 1/8 DIN | Spectrum Laboratory Products | 664-12595-E1 | |
| Oakton 220 pH/ORP/Temperature Controller, 1/8 DIN | Spectrum Laboratory Products | 664-12595-E1 | |
| Oakton Female BNC-to-Stripped Wire Adapter | Spectrum Laboratory Products | 664-12592-E1 | |
| pH Probe with BNC Connector | ThermoScientific | 10010-788 | Any pH probe with a BNC connector will suffice. |
| Precision Flow-Adjustment Valve, White Polypropylene, 1/4 NPT Male x Male | McMaster-Carr | 7792K57 | |
| ProConnex Fittings Kits - A | Repligen | ACPX-KT2-01N | Compatible with Hydrophilic MINIKROS Filter |
| ProConnex Fittings Kits - B | Repligen | ACPX-KT1-01N | Compatible with Hydrophilic MINIKROS Filter |
| Sodium Hydroxide Pellets for Analysis | Sigma Aldrich | 1.06498 | |
| Stainless-Steel Pressure Gauge 0-60 psi Stainless Steel 1/4" NPT 2.5" Face Dial | NA | XJ-219 | Any comparable pressure gauge covering 0-60 psig range will suffice. |
| Trioctylphosphine oxide (TOPO) | Sigma-Aldrich | 346187-100G |
참고문헌
- Palomo-Briones, R., et al. Near-neutral ph increased n-caprylate production in a microbiome with product inhibition of methanogenesis. Chem Eng J. 446, 137170 (2022).
- Wang, J., Yin, Y. Biological production of medium-chain carboxylates through chain elongation: An overview. Biotechnol Adv. 55, 107882 (2022).
- Watanabe, S., Tsujino, S. Applications of medium-chain triglycerides in foods. Front Nutr. 9, 802805 (2022).
- Meijaard, E., et al. The environmental impacts of palm oil in context. Nat Plants. 6 (12), 1418-1426 (2020).
- Meijaard, E., Abrams, J. F., Juffe-Bignoli, D., Voigt, M., Sheil, D. Coconut oil, conservation and the conscientious consumer. Curr Bio. 30 (13), R757-R758 (2020).
- Angenent, L. T., Magdalena, J. A., Jeon, B. S., Usack, J. G. Eco-mimicry opens new doors for bioprocess engineers. Joule. 4 (10), 2074-2077 (2020).
- Shahab, R. L., et al. A heterogeneous microbial consortium producing short-chain fatty acids from lignocellulose. Science. 369 (6507), 1214 (2020).
- Magdalena, J. A., Angenent, L. T., Usack, J. G. The measurement, application, and effect of oxygen in microbial fermentations: Focusing on methane and carboxylate production. Fermentation. 8 (4), 138 (2022).
- Agler, M. T., Spirito, C. M., Usack, J. G., Werner, J. J., Angenent, L. T. Development of a highly specific and productive process for n-caproic acid production: Applying lessons from methanogenic microbiomes. Water Sci Technol. 69 (1), 62-68 (2013).
- Gildemyn, S., et al. Upgrading syngas fermentation effluent using Clostridium kluyveri in a continuous fermentation. Biotechnol Biofuels. 10 (1), 83 (2017).
- Ge, S., Usack, J. G., Spirito, C. M., Angenent, L. T. Long-term n-caproic acid production from yeast-fermentation beer in an anaerobic bioreactor with continuous product extraction. Env Sci Technol. 49 (13), 8012-8021 (2015).
- Saboe, P. O., et al. In situ recovery of bio-based carboxylic acids. Green Chem. 20 (8), 1791-1804 (2018).
- Kaur, G., et al. Reactive extraction for in-situ carboxylate recovery from mixed culture fermentation. Biochem Eng J. 160, 107641 (2020).
- Carvajal-Arroyo, J. M., et al. Production and extraction of medium-chain carboxylic acids at a semi-pilot scale. Chem Eng J. 416, 127886 (2021).
- Choi, K., et al. In situ biphasic extractive fermentation for hexanoic acid production from sucrose by Megasphaera elsdenii NCIMB 702410. Appl Biochem Biotechnol. 171 (5), 1094-1107 (2013).
- Grootscholten, T., Steinbusch, K., Hamelers, H., Buisman, C. Improving medium chain fatty acid productivity using chain elongation by reducing the hydraulic retention time in an upflow anaerobic filter. Bioresour Technol. 136, 735-738 (2013).
- Grootscholten, T., Dal Borgo, F. K., Hamelers, H., Buisman, C. Promoting chain elongation in mixed culture acidification reactors by addition of ethanol. Biomass Bioenergy. 48, 10-16 (2013).
- Cermak, S. C., Evangelista, R. L., Kenar, J. A. Distillation of natural fatty acids and their chemical derivatives. Distillation-Advances from Modeling to Applications Chapter. 5, 109-142 (2012).
- Agler, M. T., Spirito, C. M., Usack, J. G., Werner, J. J., Angenent, L. T. Chain elongation with reactor microbiomes: Upgrading dilute ethanol to medium-chain carboxylates. Energy Environ Sci. 5 (8), 8189-8192 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유