Method Article
げっ歯類の脊髄へのオプトエレクトロニクスデバイスの移植
* これらの著者は同等に貢献しました
要約
このプロトコルは、脊髄手術を行うための外科的手順と、げっ歯類の脊髄上に光学シャンクを移植して固定するための外科的手順を詳述しています。
要約
ニューロモデュレーションは、診断、調節、および治療のアプリケーションを提供できます。脳では広範な研究が行われてきましたが、脊髄の調節は比較的未解明のままです。本質的に繊細で可動性のある脊髄組織は、神経プローブの正確な移植を困難にする制約を課しています。近年、ニューロモデュレーションデバイス、特にフレキシブルバイオエレクトロニクスの進歩にもかかわらず、デバイス埋め込みの外科的複雑さにより、脊髄での使用を拡大する機会は限られています。ここでは、げっ歯類の脊髄とインターフェースするカスタムメイドの光電子デバイスの移植用に特別に調整された一連の外科的プロトコルを提供します。ここでは、2つの異なる外科的移植方法を使用して、脊髄の特定のセグメントに光学シャンクを配置して固定する手順について詳しく説明します。これらの方法は、光刺激のために脊髄との直接接触が必要な場合とそうでない場合がある、さまざまなデバイスやアプリケーション向けに最適化されています。方法論を解明するために、皮膚を切開する前に、まず脊椎の解剖学的構造を参照して目立つランドマークを特定します。げっ歯類の頸椎に光学シャンクを固定するための外科的手順が実証されています。次に、光学シャンクに接続されたオプトエレクトロニクスデバイスを脊髄から離れた皮下空間に固定し、不必要な直接接触を最小限に抑えるための手順が概説されます。インプラントを受けた動物と偽手術を受けた動物を比較した行動研究では、インプラント後7日で光学シャンクが後肢または前肢の機能に悪影響を及ぼさなかったことが示されています。本研究は、さまざまな脊髄インターベンションの調査を目的とした将来の研究で使用するための神経調節ツールキットを広げます。
概要
脊髄は、運動行動の調整から呼吸などの恒常性プロセスの調節まで、さまざまな重要な中枢神経系機能を促進します1,2。脊髄を横切る回路の高度なネットワークの役割を解明するには、電気刺激、記録、薬物送達、または標的領域3,4,5,6への光刺激のいずれであっても、インターフェースが必要です。このような尋問7,8,9,10,11を可能にする装置が開発されているが、脊髄4への慢性的な移植には特殊な外科的技術が必要である。特に、脊髄および関連する椎骨は、伸展および曲げなどの自然な動きによって引き起こされる機械的変形に対する感受性が増している8,12,13。脊髄のこれらのユニークな特性により、埋め込まれたプローブが長期間にわたって特定のセグメントで安定し、機能し、固定されたままであることを保証することは本質的に困難になります。
本明細書では、脊髄の標的セグメントに光学シャンクを挿入し固定するための外科的プロトコルが記載されている(図1A)。特に頸部とのインターフェースは独自の課題をもたらすことが示されているため9、移植手順はC5頸部領域で具体的に実証されています。頸椎の複雑さは、そのより深い位置と豊富な筋肉組織から生じると仮定されています。この特性は、脊髄の残りの部分に沿ってそれほど目立たないものです。いずれにせよ、このプロトコルで概説されている手順は、さまざまな脊髄領域にわたる手術に適応できるように設計されています。皮膚の上から識別可能な顕著な解剖学的「ランドマーク」を使用して脊髄セグメントを位置特定および識別するための段階的な指示が提供されています(図1B)。次に、このプロトコルでは、外科的移植のための2つの技術を解明します:1つは脊髄との直接接触を必要とするプローブ用に調整され、もう1つは直接接触を必要としないプローブ用に調整されます。記載されている手順は、げっ歯類の生存手術の訓練を受けた研究者なら誰でも再現できるように設計されています。
このプロトコルには、C5 頸部レベルにフレキシブル光学シャンクが取り付けられたオプトエレクトロニクス デバイス (18 mm x 13 mm) を埋め込むための段階的な手順が含まれています。埋め込み型デバイスは、C5の尾側に皮下固定され、脊髄の光刺激が発生すると点灯するマイクロスケールの発光ダイオード(μLED)インジケーターで構成されており、デバイスの機能のライブフィードバックを提供します。埋め込まれた光学シャンクが自然な運動機能に及ぼす影響は、インプラントを受けたげっ歯類で評価され、偽の手術を受けたげっ歯類と比較されました。結果は、プローブが着床後7日で動物の自然な後肢および前肢の機能に悪影響を及ぼさないことを示しています。
プロトコル
すべての手続きは、カナダ動物管理協議会のガイドラインに従って実施され、ブリティッシュコロンビア大学動物管理委員会が監督しました。体重350-450g、生後6-8ヶ月齢の雌Long-Evansラットをグループ飼育し(21°C;12時間:12時間の光サイクル)、手術の前後に標準的なげっ歯類の食事療法 を自由に摂取した 。本試験に用いた試薬および装置の詳細は、 資料表に記載されています。
1. 術前準備
- オートクレーブを使用してすべての手術器具を滅菌します。
- イソフルラン(誘導用5%、メンテナンス用2%)を1 L / minの流量で酸素中で供給して動物に麻酔をかけます。
- 動物を誘導チャンバーから加熱パッドに移し、すぐにイソフルランノーズコーンを接続します。動物が麻酔の外科的平面の下にあることを確認することにより、両足のつま先つま先つまみ反射が完全に失われていることを確認します。
- 図2Aに示すように、耳の付け根からラットの背中を剃ります。
- 目には無菌眼軟 ?? をたっぷりと塗り、ブプレノルフィン(0.03 mg / kgに希釈)と10 mLの授乳リンガーを皮下(体温まで温めた)に注射します。.
- 剃った部分を消毒外科用スクラブ(クロルヘキシジン)で拭き、続いてイソプロピルアルコールを剃った領域の中心から円を描くように拭き、円の直径を広げます。石鹸/アルコールのプロセスをさらに2回繰り返します。
- 動物を定位固定装置フレームに固定し、安定性のために潤滑されたイヤーバーを使用して頭を配置します(図2A)。
注:手順全体を通じて、一貫して熱サポートを提供し、つま先つまみ反射を介して麻酔の深さを確認し、バイタルサインを監視します。 - 動物の上に滅菌外科用ドレープを置きます。
2.頸髄曝露
- 滅菌鉗子を使用して、頭蓋骨の基部を触診することから始めます。頭蓋骨の基部近くで吻側に伸びる顕著な棘突起を感じてください。これが C214 です(図 1B と 図 2B)。
- C2 への尾側の触診を進めて、T215 として識別可能な、特に鋭く尖った棘突起を見つけます (図 1B および 図 2C)。
- メスを使用して、C2から始まり、尾側に約1.5cm伸びる皮膚に切開を作成します(図2D)。
注:切開サイズは、サイズが異なる動物によって異なる場合があります。解剖学的ランドマークの識別を事前に確認し、それに応じて進めてください。 - 皮下脂肪層をメスで丁寧に切り込み、無傷の背側の筋肉を露出させます。
- 背側の筋肉が露出したら、2つのAdson鉗子を使用して正中線から引き離して鈍的解剖を行います(図2E)。
注:出血を最小限に抑えるために、筋肉を切るのではなく、鈍的解剖(筋線維を引き離す)を行うことが重要です。背側の筋肉組織を適切に露出すると、ボール状の筋肉が現れるはずです(図2G)。この筋肉はC2を完全に覆い、C3を部分的に覆っています。 - ロンジャーと滅菌鉗子を使用して、皮膚のフラップを直ちに切開領域に尾側に持ち上げます。ロンゲールを使用して、小さな皮下ポケットを作成します-これがデバイスの場所になります(図2F)。
注意: 皮下ポケットは、デバイス自体よりも大きくする必要があります。外科医は、皮下ポケットを開く際の制御と視認性を向上させるために、動物を正面に向けて位置を変えることをお勧めします。 - リトラクターを配置して脊柱を露出させます(図2G)。
- ロンゲールを使用して、椎骨を覆っている残りの筋肉や組織をすべて取り除き、脊髄セグメントの特定を開始します。ボール状の筋肉のすぐ尾側にはC4があり、次にC5とC6が続きます(図2G-I)。完了したら、手術部位を滅菌生理食塩水ですすぎ、滅菌ガーゼで乾かします。
注:ボール状の筋肉はC2を完全に包み込み、部分的にC3の上に伸びています。それに直接尾側にある脊髄セグメントは、最小限の接触でC4と呼ばれます。 - プローブの意図された目的に応じて椎弓切除術を実施します。
- 薄層の下のプローブの場合、C5およびC6で側方椎弓切除術を行い、将来のプローブ配置のために薄層に横方向の開口部を作成します(図2H、 補足図1A)。
- 椎弓板上のプローブについては、C5の内側椎弓切除術を行い、棘突起の外側の側面を取り除かないようにします-プローブ配置のための内側経路を露出させるだけです(図2I、 補足図1B)。
- 椎弓切除術の後、滅菌生理食塩水でその領域を洗い流し、滅菌ガーゼで乾燥させて骨の破片を取り除きます。
注:椎弓切除術を行うときは、臍帯の損傷を防ぐために、ロンジャーを骨に押し付け、下向きの動きを避けることが重要です。
3.デバイスの硬膜外留置
- 滅菌デバイスをプラスチック製の先端滅菌鉗子(図3A)で保持し、ステップ2.9の前半に作られた皮下開口部の内側に打ち込みます。
注意: デバイスの無菌性を維持するためには、非滅菌の手袋/ツールでデバイスに触れないようにすることが重要です。デバイスの配置と皮膚の下の配置には、指定された滅菌鉗子を使用してください。 - デバイスを隣接する筋肉層に縫合または接着して、デバイスを固定します(図3B)。
注意: デバイスを筋肉に縫合する場合は、非吸収性縫合糸を使用してください。そうしないと、デバイスは体内で縫合糸が吸収された後に動きやすくなります。接着剤を使用する場合は、接着剤/接着剤の長期安定性と生体適合性を確保してください。信頼性の高い固定ポイントを確保するために、デバイスを皮下脂肪/脂肪層に固定しないでください。- この手順に進む前に、デバイス本体の位置を計画してください。デバイスは恒久的に固定されるため、デバイスが脊髄の目的のレベルに近すぎたり遠すぎたりすると、プローブの配置(ステップ3.4)に問題が発生する可能性があります。
- リトラクターを脊髄の周りに置き、プローブを脊髄に配置するための適切な窓を開きます。
- プローブの配置:
- 薄層の下のプローブの配置:プラスチック先端の鉗子を使用して、手順5.9.1(図3D)で作成した横方向のチャネルを介してプローブをスライドさせることにより、(C5およびC6)薄層の下にプローブを慎重に挿入します。
- 脊髄上のプローブの配置:
- プラスチック製の先端鉗子を使用してプローブを調整し、ステップ5でC2.9.2で作成した内側窓の上にプローブの先端を位置合わせして上に配置します(図3C)。
- 滅菌された小さな、できればセラミック製の容器で、歯科用セメント粉末1スクープ、ハイテクグリース3滴、および触媒1滴を混合してセメントを調製します。粘性のある粘稠度が得られるまで、滅菌爪楊枝と混合します。
注:手術を行っていない1人がセメントを準備することを強くお勧めします。これにより、外科医はプローブを所定の位置に保持し、セメントを塗布する直前に目的の領域を乾燥させることができます。この手順は時間的制約があります。セメントを準備する前に、外科医がプローブの位置を確認してください。触媒を塗布すると、セメントが厚くなりすぎて骨と効果的に結合できなくなります。手術前にセメントを使用して練習し、プローブ/骨に配置する前に適切な一貫性を達成していることを確認してください。 - 椎骨の目的のセメント領域を完全に乾燥させて、信頼性の高いアンカーポイントを作ります。プローブの先端に1〜2滴の歯科用セメントを塗布し、目的の椎骨レベル(この場合はC4)の上に置く必要があります(図3C、D)。
注:セメンチングする前に、椎骨をできるだけ乾燥させることが重要です。そうしないと、セメントが付着せず、プローブが固定されません。 - 30秒間一時停止し、セメントにそっと触れて硬化したことを確認します。
- セメントが完全に硬化しない場合は、さらに20秒待ってから、プローブが骨にしっかりと固定されるまで、新しくできたセメントを再度塗布します。
注:セメントは、手触りが硬くなって硬くなると適切に接着されています。
注意: セメントが液体すぎるときにセメントを塗布すると、椎骨の間の脊髄組織にセメントが浸透する可能性があります。これが発生した場合は、セメントがよりガムのような粘稠度になるまで約10秒待ってから、鉗子を優しく使用して脊髄と接触したセメントを取り除きます。
4. 術後の処置
- 手術が完了したら、5-0ビクリル縫合糸を使用して切開部位を縫合します。動物を定位固定装置から静かに取り出し、加熱された回収チャンバーに移します。手術後最初の3〜5日間は、柔らかく湿らせたチャウ、おやつ、ヒドロゲル水を動物に与えます。
- 手術後の最初の週は、動物を1日2回徹底的に監視します。ブプレノルフィンと温めた乳酸リンゲル注射を1日2回、その後2日間、または痛みの兆候が続く場合はそれ以上投与します。.動物が臨床的な健康上の懸念を示さなくなるまで、毎日のチェックを続けます。その後、少なくとも週に一度は動物の様子を確認してください。
- (オプション)手術と切開部の閉鎖後に、体内のデバイスの位置を視覚的に示すために、デバイスの周囲を皮膚に輪郭を描きます(図4A)。
注:この手順は、アンテナ結合が重要な外部送信機を介してワイヤレスで電力を供給する必要があるデバイス、またはスキン16、17、18を介して補充する必要がある薬物送達ポンプなど、デバイスが外部アクセスを必要とする場合に特に有用である。
結果
補足図2に示す詳細な機能図を有する光電子デバイスを、4匹のLong Evansラットに移植した。補足図3は、埋め込みの準備ができた最終的なオプトエレクトロニクスデバイスを示しています。他の3匹は偽の手術を受け、これにはC5で内側椎弓切除術が含まれ、デバイスを埋め込むことなく行われました。このオプトエレクトロニクスデバイスは、先端にμLEDが埋め込まれたフレキシブルプローブで構成されており、内蔵のLEDドライバーによって作動しました。LEDドライバは、プログラム可能なファームウェアを備えたマイクロコントローラによって制御されます。また、皮膚のすぐ下の筋肉層に縫合されたデバイス本体も構成されていました。パリレンC(~10μm)の層を化学気相成長法(CVD)を用いて装置全体に蒸着します。ポリジメチルシロキサン(PDMS)の第2層(~800μm)がオプトエレクトロニクスデバイス本体(補足図3)を覆い、組織との柔らかい界面を形成しました。プローブの先端はC4に固定され、μLEDはC5の上に浮かんでいます。μLEDインジケータは、光学シャンクのμLEDと同時に点灯するデバイス(皮膚の下から見える光)で利用され、デバイスの機能のライブ検証のために使用されました。動物は、手術後7日間監視され、長期にわたるパフォーマンスの持続的な信頼性を確認しました(図4B)。
動物の運動機能は、マルティネス野外運動評価尺度19を用いて評価した。オープンフィールド行動を評価するために、治療群を知らない2人の訓練を受けた観察者が、手術前と手術後3日目、5日目、7日目にテストを実施しました。データ収集後、Mann-Whitney U検定を実施して、インプラント群と偽群との間の前肢と後肢の両方のスコアについて、各時点での差を決定しました。私たちの分析では、7日目までにインプラント群と偽群で同様の前肢機能スコアが示されています(図5A)。同様に、すべての時点において、後肢スコアの群間に統計的に有意な差はなかった(図5B)。
移植後7日後に死後検証を行い、プローブとデバイス本体が所定の位置に留まっていたかどうかを確認しました。縫合糸または装置の目に見える剥離は見つかりませんでした。さらに、デバイス本体を引っ張っても、組織からの剥離は引き起こされませんでした(補足図4A)。次に、以前に解剖して縫合した筋肉を脊髄上に露出させ、プローブが脊髄上にしっかりと固定されたままであることが確認されました(補足図4B)。デバイス本体と同様に、プローブヘッドはセメンチングポイントに対して連続的に引き戻され、プローブと薄層の機械的ジョイントへの取り付けが評価されました。
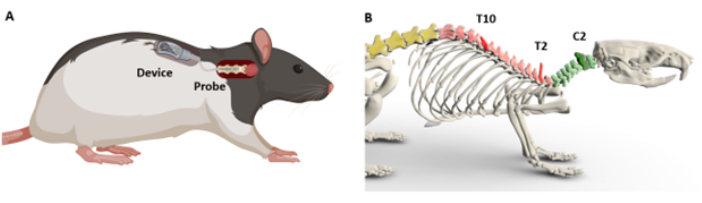
図1:デバイスの埋め込みと解剖学的ランドマークの概略図(A)脊髄上のプローブの配置とデバイスの皮下配置のデモンストレーション。(B)脊髄のレベルを決定するために使用されるランドマークを示す3Dモデル。参照用に、C2、T2、およびT10の棘突起が示されています。暗い色は対応するレベルを示します。この図の拡大版を表示するには、ここをクリックしてください。
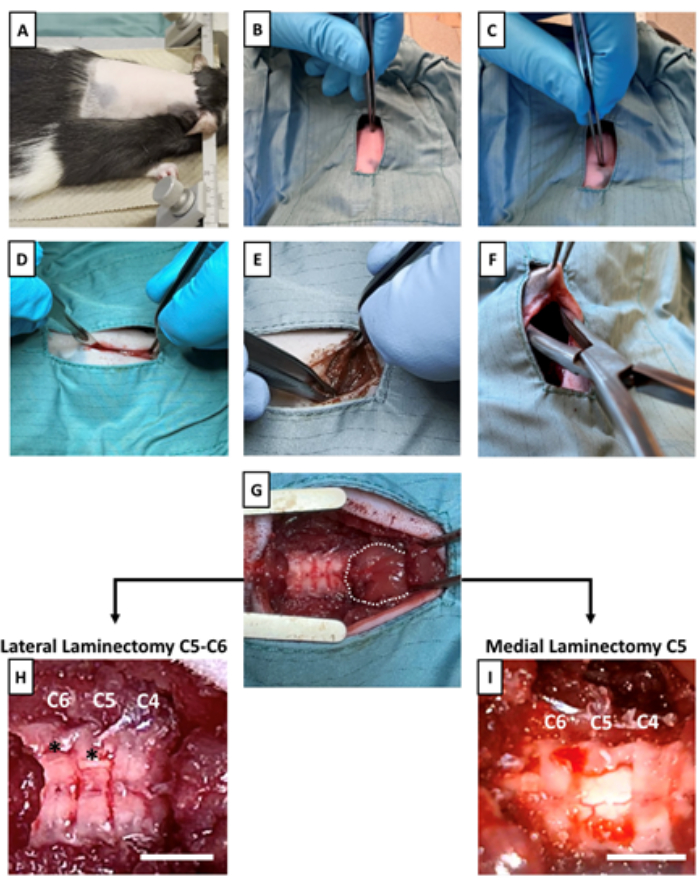
図2:脊髄を露出させ、皮下ポケットを準備します。 (A)定位固定装置は動物に配置されています。(B)触診によりC2棘突起と(C)T2棘突起を同定します。(D)皮膚と皮下脂肪層を切開して、頸部レベルの関心のある点の背側の筋肉組織を露出させます。(E)背側の筋肉組織の鈍的解剖を通じて、頸椎が露出します。(F)埋め込み型デバイスの尾側を切開部位に固定するために、皮下ポケットが作成されます。(G)リトラクターは、頸椎とボール状の筋肉を露出させるために適切な解剖後に配置され、C2を完全に覆い、C3を部分的に覆います。破線はボール状の筋肉を示しています。頸髄が露出したら、(H)椎骨の下にプローブを配置するためにC5とC6の2つの側方椎弓切除術を行うか、(I)椎骨の上にプローブを配置するためにC5で内側椎弓切除術を行います。アスタリスクは、側方椎弓切除術の部位を示します。スケールバー= 3 mm。この図の拡大版を表示するには、ここをクリックしてください。
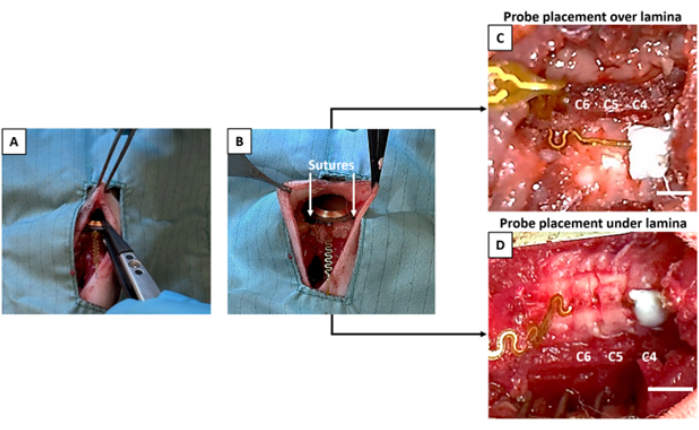
図3:デバイスの埋め込みとプローブの配置。 (A)デバイスは皮下ポケットに入れられます。(B)デバイスは筋肉組織に縫合されます。(C)プローブは、内側椎弓切除術を受けたC5椎弓板の上に固定されています。(D)デバイスは、外側椎弓切除術を受けたC5およびC6層の下に配置されます。(C)と(D)の両方で、プローブの先端は無傷のC4でセメントで固定されています。スケールバー= 3 mm。 この図の拡大版を表示するには、ここをクリックしてください。
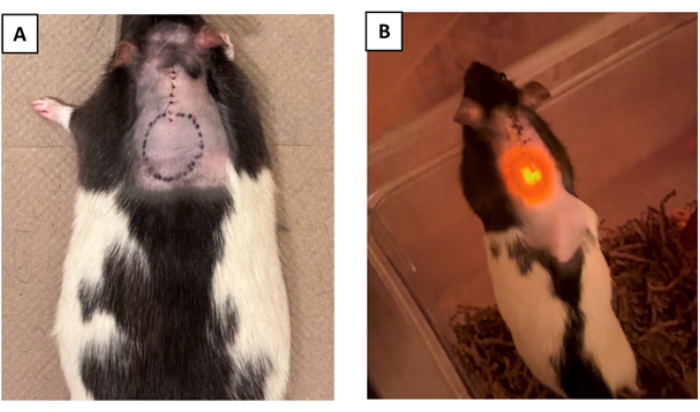
(A)デバイスの位置は、手術後の識別を容易にするために、縫合後に皮膚上にオプションでマーキングすることができます。(B)図は着床後の動物を示しています。デバイスの機能は、皮膚の下に見えるインジケーターμLEDを観察し、デバイスの正常な動作を確認することで検証されました(動物の右側にある隆起は、デバイス本体が埋め込まれている場所です)。この図の拡大版を表示するには、ここをクリックしてください。
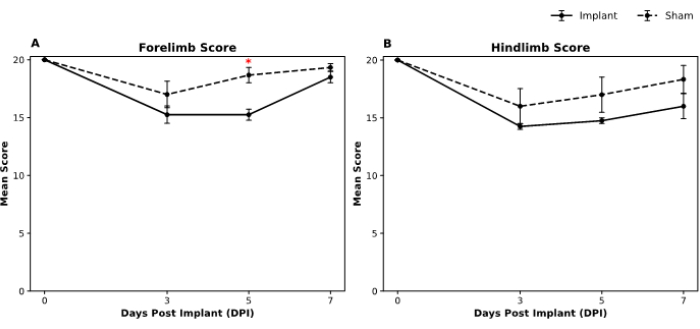
図5:マルティネスのオープンフィールド行動スコアは、前肢と後肢のパフォーマンスについて、偽グループとインプラントグループで経時 的に評価されています。プロットは、移植後 (DPI) の 0 日、3 日、5 日、7 日の 4 つの時点における (A) 前肢と (B) 後肢のオープンフィールド評価の平均行動スコアを示しています。エラーバーは、平均の標準誤差(SEM)を表します。偽グループとインプラントグループ間の有意差(p < 0.05)は、特定の時点でアスタリスク(*)で示されています。図の凡例は点線で示されている偽のグループを示し、インプラントグループは実線で示されています。偽サンプルサイズはn = 3で、インプラントはn = 4でした。ノンパラメトリックなマンホイットニーU検定を使用して、各時点におけるグループ間の差の有意性を評価しました。 この図の拡大版を表示するには、ここをクリックしてください。
補足図1:椎弓切除術の図。 破線は、(A)椎骨の下にプローブを留置するための2つの外側椎弓切除術、および(B)椎骨上にプローブを留置するための内側椎弓切除術のために切除する領域を示す。 このファイルをダウンロードするには、ここをクリックしてください。
補足図2:オプトエレクトロニクスデバイスの概略図。 デバイスの詳細なブロック図を示します。左上のブロックは、ワイヤレス給電受信機アンテナ共振LCタンクを示しています。受信電力は整流され、低ドロップアウト電圧レギュレータ(LDO)に供給されます。マイクロコントローラユニットは、プログラムされたパラメータに基づいてデバイスを自動的にアクティブにし、LEDドライバはプローブに埋め込まれた任意のμLEDに電力を供給します。 このファイルをダウンロードするには、ここをクリックしてください。
補足図3:オプトエレクトロニクスデバイス。 生体適合性カプセル化を先端に1μLEDの光学シャンクに接続された最終的な光電子デバイス。破線の長方形はμLEDの位置を示しています。 このファイルをダウンロードするには、ここをクリックしてください。
補足図4:デバイスの安定性の事後分析検証。 移植から7日後、(A)デバイス本体は、埋め込まれたのと同じ位置で筋肉組織に縫合されたままであり、(B)セメントで固定されたプローブはC4ラミナの上に固定されたままでした。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
脊髄の神経調節および治療的介入は、しばしば、精密で標的を絞ったセグメント3,4,7,13にプローブを配置する必要がある。脊髄の固有の可動性を考えると、慢性的な研究を可能にするためには、プローブを確実に固定する必要があります。特定のアプリケーションに基づいて、プローブが脊髄と物理的に接触しているかどうか、または可能であれば接触を減らして炎症組織の反応を軽減できるかどうかを制御することが重要になる場合があります。したがって、2つの方法のそれぞれについての外科的ステップが説明される。このプロトコルでは、C5の脊髄の頸部にプローブを配置する方法を具体的に詳しく説明しています。それにもかかわらず、脊髄のT2またはT10について記載されたランドマークを使用して、プローブは、椎骨が露出した後、それぞれT2またはT10からカウントダウンすることにより、胸部または腰部上の正確な位置に同様に配置することができる。さらに、脊髄組織の損傷を最小限に抑えるために、接続されたプローブに比べて大きくて硬いことが多いデバイス本体を、脊髄から離れた皮下空間に固定しました。
プローブと結合されたデバイスを埋め込むには、いくつかの重要なポイントがあります。まず、プローブをセメントで固定する前に、デバイス本体の位置を決定することが重要です。これにより、プローブの先端とデバイス本体の間の距離が最適化され、プローブの張力が軽減されるだけでなく、プローブのねじれや変位などを引き起こす可能性のある余分なプローブの長さを回避できます。基本的に、目標は、プローブの長さが、デバイス本体が配置されている皮下空間からプローブがセメントで固定されている標的の脊髄領域までの距離とほぼ同じであることを確認することです。さまざまなプローブの長さを試験する末期外科手術を行うことで、対象部位に最適なサイズを決定することができます。
無菌性を維持するために、皮下ポケットへの挿入中に皮膚の外層に接触しないように、デバイスを慎重に取り扱う必要があります。.このような接触は、デバイスの無菌性を損ない、術後感染につながる可能性があります。さらに、鉗子でデバイスを保持するときにデバイスに加えられる力の量を最小限に抑えることが重要であり、これは通常、薄い保護層、絶縁性、および滅菌層であるコーティングの損傷を防ぐために20,21。コーティングを剥がすと、回路が短くなったり、動物に電気ショックを引き起こしたり、体内で炎症反応を引き起こしたりするなど、デバイスの寿命が大幅に短くなる可能性があります。プラスチック製の先端鉗子でデバイスを扱うと、このような合併症を減らすのに役立つ場合があります。
デバイスを軟部組織に縫合する場合、皮下脂肪組織への縫合を避けることが重要です。予備試験で観察されたように、脂肪層は破裂しやすいため、縫合糸の信頼できる固定点ではありません。代わりに、デバイス本体は、非吸収性縫合糸を使用して皮下腔の隣接する筋肉層に縫合され、デバイスを体内に恒久的に配置されました。一方、プローブを棘突起に固定する場合は、セメントを塗布する前に、プローブを固定する場所が乾燥していることを確認することが重要です。骨やプローブが濡れていると硬化時間が長くなり、プロセスが完全に失敗する可能性があります。
埋め込み型デバイスには、埋め込み手術の前に慎重に対処する必要があるいくつかの重要な考慮事項があります。(1)デバイスの電気的に活性な部分は、絶縁パッシベーション層によってカプセル化されなければなりません。パッシベーション層の剥奪は、デバイスの機能障害を引き起こす可能性があります。(2)埋め込み型は、施設の動物プロトコルに従って徹底的に滅菌する必要があります。(3)デバイスと神経プローブまたは刺激シャンクとの間の接合部は、確実に形成されなければなりません。接続は、絶え間ない動物の動きによる反復可能な機械的ストレスを受けます。(4)デバイスに取り付けられた神経プローブまたは刺激シャンクは、さまざまなポイントでスナップしないように十分に柔軟で伸縮性がある必要があります。
記載されたプロトコルは、異なるサイズの動物モデルにデバイスを埋め込むために拡張されてもよい。解剖学的ランドマークを特定した後、記載された外科的方法は、脊髄の標的セグメントで任意の神経プローブまたは刺激シャンクを固定し、それらに関連する制御モジュールを埋め込むように系統的にカスタマイズすることができる。ただし、アプリケーションによっては、このペーパーに埋め込まれたものとは異なるサイズ、材料、および厚さを持つデバイスが異なる場合があります。たとえば、外部制御モジュールに接続されたデバイスには、追加の考慮事項が必要です。さらに、このプロトコルは光遺伝学的刺激用に調整されていますが、薬物送達や電気刺激/記録などの他の神経調節アプリケーションには、わずかに異なる外科的手順が必要であることに注意する必要があります。具体的には、これらのアプリケーションでは、硬膜下の脊髄との直接接触を確保するために硬膜下移植が必要です7.しかし、光遺伝学の場合、げっ歯類の硬膜は光の透過を著しく妨げず、光源を硬膜外に配置することができるため、組織との密接な接触は通常不要である10。
開示事項
著者には利益相反はありません。
謝辞
S.S.は、ブリティッシュコロンビア大学の4年間の博士課程フェローシップによって部分的に資金提供されています。AMは、カナダ保健研究所(CIHR)のカナダ大学院奨学金-修士号によって部分的にサポートされています。D.S.は、Michael Smith Health Research British Columbia Scholar Awardからの資金提供を認めています。この研究は、カナダ政府のNew Frontiers in Research Fund - Transformation(NFRFT-2020-00238)から一部資金提供を受けました。 図 1 の回路図は Biorender.com を使用して生成し、3D モデルは sketchfab.com の許可を得て取得しました。
資料
| Name | Company | Catalog Number | Comments |
| Adson Forceps | Fine Science Tools | 11027-12 | |
| Alm 3 Point Retractor | Fine Science Tools | 17010-10 | |
| Buprenorphine / Vetergesic | CDMV | 124918 | Manufacturer provides at 0.3 mg/mL but must be diluted to 0.03 mg/kg for use in rats |
| Chlorhexidine 2% Solution | Partnar | PCH-020 | |
| Curved Long Hemostat Forceps | KaamKaaj Tools | 14.5 | Curved Long Hemostat Forceps with A Stainless Steel Ratchet Locking Tweezer |
| CVD Parylene Machine: SCS Labcoter 2 | Specialty Coating Systems | PDS 2010 | |
| Dental Cement - Catalyst | Parkell, Inc | S371 | |
| Dental Cement - Metabond | Parkell, Inc | S398 | |
| Dental Cement - Powder | Parkell, Inc | S396 | |
| Forceps with Replaceable Plastic Tips | Fine Science Tools | 11980-13 | |
| Friedman-Pearson Rongeurs | Fine Science Tools | 16121-14 | |
| Isoflurane USP | Fresenius Kabi | CP0406V2 | Provided at 5% for induction and 2% for mainentance through precision vaporizer |
| Isopropyl Alcohol 70% | McKesson | 350600 | |
| Lacri-Lube Sterile Eye Ointment | Refresh | ||
| Long Evans Rats | Charles River Laboratories | 6 | |
| Low temperature solder paste | Chip Quik Inc. | 11.38 | |
| Magnets | Radial Magnets, Inc. | 0.53 | Magnet Neodymium Iron Boron (NdFeB) N35 (3.00 mm x 1.00 mm) |
| Olsen-Hegar Needle Holders with Suture Cutters | Fine Science Tools | 12002-12 | |
| PDMS: SYLGARD 184 | Sigma Aldrich | 761036 | |
| Scalpel Blades - #15 | Fine Science Tools | 10015-00 | |
| Scalpel Handle - #3 | Fine Science Tools | 10003-12 | |
| Solder flux | Chip Quik Inc. | 14.25 | |
| Stereotaxic Frame | David Kopf Instruments | Model 900 | |
| Sterile Kwik-Sil Adhesive | World Precision Instruments | KWIK-SIL-S | |
| UV Flashlight | Vansky | 19.99 | |
| Wireless Charger | Nilkin | NKT06 | |
| Wireless Charging coil | TDK Corporation | WT202012-15F2-ID |
参考文献
- Osseward, P. J., Pfaff, S. L. Cell type and circuit modules in the spinal cord. Curr Opin Neurobiol. 56, 175-184 (2019).
- Alilain, W. J., et al. Light-induced rescue of breathing after spinal cord injury. J Neurosci. 28 (46), 11862-11870 (2008).
- Geng, Y., et al. Advances in optogenetics applications for central nervous system injuries. J Neurotrauma. 40 (13-14), 1297-1316 (2023).
- Montgomery, K. L., Iyer, S. M., Christensen, A. J., Deisseroth, K., Delp, S. L. Beyond the brain: Optogenetic control in the spinal cord and peripheral nervous system. Sci Transl Med. 8 (337), 5 (2016).
- Tan, T., Watts, S. W., Davis, R. P. Drug delivery: Enabling technology for drug discovery and development. iPRECIO Micro infusion pump: Programmable, refillable, and implantable. Front Pharmacol. 2, 44 (2011).
- Suehiro, K., et al. Ecto-domain phosphorylation promotes functional recovery from spinal cord injury. Sci Rep. 4 (1), 4972 (2014).
- Harland, B., et al. A subdural bioelectronic implant to record electrical activity from the spinal cord in freely moving rats. Adv Sci (Weinh). 9 (20), 2105913 (2022).
- Wang, Y., et al. Flexible and fully implantable upconversion device for wireless optogenetic stimulation of the spinal cord in behaving animals. Nanoscale. 12 (4), 2406-2414 (2020).
- Grajales-Reyes, J. G., et al. Surgical implantation of wireless, battery-free optoelectronic epidural implants for optogenetic manipulation of spinal cord circuits in mice. Nat Protoc. 16 (6), 3072-3088 (2021).
- Kathe, C., et al. Wireless closed-loop optogenetics across the entire dorsoventral spinal cord in mice. Nat Biotechnol. 40 (2), 198-208 (2022).
- Hogan, M. K., et al. A wireless spinal stimulation system for ventral activation of the rat cervical spinal cord. Sci Rep. 11 (1), 14900 (2021).
- Lu, C., et al. Flexible and stretchable nanowire-coated fibers for optoelectronic probing of spinal cord circuits. Sci Adv. 3 (3), e1600955 (2017).
- Chen, Y., et al. How is flexible electronics advancing neuroscience research. Biomaterials. 268, 120559 (2021).
- Keomani, E., et al. A murine model of cervical spinal cord injury to study post-lesional respiratory neuroplasticity. J Vis Exp. (87), e51235 (2014).
- Chaterji, S., Barik, A., Sathyamurthy, A. Intraspinal injection of adeno-associated viruses into the adult mouse spinal cord. STAR Protoc. 2 (3), 100786 (2021).
- Agrawal, D. R., et al. Conformal phased surfaces for wireless powering of bioelectronic microdevices. Nat Biomed Eng. 1 (3), 0043 (2017).
- Park, S. I., et al. Stretchable multichannel antennas in soft wireless optoelectronic implants for optogenetics. Proc Natl Acad Sci. 113 (50), E8169-E8177 (2016).
- Manoufali, M., Bialkowski, K., Mohammed, B., Abbosh, A. Wireless power link based on inductive coupling for brain implantable medical devices. IEEE Antennas and Wirel Propaga Lett. 17 (1), 160-163 (2018).
- Martinez, M., Brezun, J. M., Bonnier, L., Xerri, C. A new rating scale for open-field evaluation of behavioral recovery after cervical spinal cord injury in rats. J Neurotrauma. 26 (7), 1043-1053 (2009).
- Yang, Y., et al. Preparation and use of wireless reprogrammable multilateral optogenetic devices for behavioral neuroscience. Nat Protoc. 17 (4), 1073-1096 (2022).
- Yang, Y., et al. Wireless multilateral devices for optogenetic studies of individual and social behaviors. Nat Neurosci. 24 (7), 1035-1045 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved