Method Article
Impianto di dispositivi optoelettronici nel midollo spinale del roditore
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo descrive in dettaglio una procedura chirurgica per l'esecuzione della chirurgia del midollo spinale e per l'impianto e il fissaggio di un gambo ottico sopra il midollo spinale nei roditori.
Abstract
La neuromodulazione può fornire applicazioni diagnostiche, modulatorie e terapeutiche. Mentre un ampio lavoro è stato condotto nel cervello, la modulazione del midollo spinale rimane relativamente inesplorata. Il tessuto del midollo spinale, intrinsecamente delicato e mobile, impone vincoli che rendono difficile l'impianto preciso delle sonde neurali. Nonostante i recenti progressi nei dispositivi di neuromodulazione, in particolare nella bioelettronica flessibile, le opportunità di espanderne l'uso nel midollo spinale sono state limitate dalle complessità chirurgiche dell'impianto di dispositivi. In questo caso, forniamo una serie di protocolli chirurgici su misura per l'impianto di un dispositivo optoelettronico su misura che si interfaccia con il midollo spinale nei roditori. I passaggi per posizionare e ancorare un gambo ottico su un segmento specifico del midollo spinale tramite due diversi metodi di impianto chirurgico sono descritti in dettaglio qui. Questi metodi sono ottimizzati per una vasta gamma di dispositivi e applicazioni, che possono richiedere o meno il contatto diretto con il midollo spinale per la stimolazione ottica. Per chiarire la metodologia, si fa riferimento all'anatomia vertebrale per identificare i punti di riferimento prominenti prima di eseguire un'incisione cutanea. Vengono dimostrati i passaggi chirurgici per fissare un gambo ottico sopra il rachide cervicale nei roditori. Vengono quindi delineate le procedure per fissare il dispositivo optoelettronico collegato al gambo ottico in uno spazio sottocutaneo lontano dal midollo spinale, riducendo al minimo il contatto diretto non necessario. Gli studi comportamentali che confrontano gli animali che hanno ricevuto gli impianti con quelli sottoposti a interventi chirurgici fittizi indicano che i gambi ottici non hanno influenzato negativamente la funzione degli arti posteriori o anteriori sette giorni dopo l'impianto. Il presente lavoro amplia il kit di strumenti di neuromodulazione per l'uso in studi futuri volti a studiare vari interventi del midollo spinale.
Introduzione
Il midollo spinale facilita una serie di funzioni essenziali del sistema nervoso centrale, dal coordinamento dei comportamenti motori alla regolazione dei processi omeostatici come la respirazione 1,2. Per chiarire il ruolo della sofisticata rete di circuiti attraverso il midollo spinale sono necessarie interfacce, sia per la stimolazione elettrica, la registrazione, la somministrazione di farmaci o la stimolazione ottica in aree mirate 3,4,5,6. Sebbene siano stati sviluppati dispositivi per consentire tali interrogatori 7,8,9,10,11, sono necessarie tecniche chirurgiche specializzate per il loro impianto cronico nel midollo spinale4. In particolare, il midollo spinale e le vertebre associate hanno una maggiore suscettibilità alle deformazioni meccaniche causate da movimenti naturali come l'estensione e la flessione 8,12,13. Queste caratteristiche uniche del midollo spinale rendono intrinsecamente difficile garantire che le sonde impiantate rimangano stabili, funzionali e fissate in un segmento specifico per lunghi periodi di tempo.
In questo articolo, viene descritto un protocollo chirurgico per l'inserimento e il fissaggio di un gambo ottico in un segmento mirato del midollo spinale (Figura 1A). Poiché è stato dimostrato che l'interfacciamento con la regione cervicale in particolare introduce sfide uniche9, le fasi di impianto sono specificamente dimostrate sulla regione cervicale C5. Si ipotizza che la complessità del rachide cervicale derivi dal suo posizionamento più profondo e dall'abbondanza di muscolatura, una caratteristica non così prominente lungo il resto del midollo spinale. Indipendentemente da ciò, le procedure descritte in questo protocollo sono progettate per essere adattabili per interventi chirurgici in varie regioni del midollo spinale. Vengono fornite istruzioni dettagliate per localizzare e identificare i segmenti del midollo spinale utilizzando "punti di riferimento" anatomici pronunciati identificabili da sopra la pelle (Figura 1B). Il protocollo chiarisce quindi due tecniche per l'impianto chirurgico: una su misura per le sonde che richiedono il contatto diretto con il midollo spinale e un'altra per le sonde che potrebbero non richiedere il contatto diretto. I passaggi descritti sono progettati per essere riprodotti da qualsiasi ricercatore con formazione in chirurgia della sopravvivenza dei roditori.
Questo protocollo comprende istruzioni dettagliate per l'impianto di un dispositivo optoelettronico (18 mm x 13 mm) con un gambo ottico flessibile attaccato sopra il livello cervicale C5. Il dispositivo impiantabile è fissato per via sottocutanea caudale a C5 ed è costituito da un indicatore a diodo a emissione di luce (μLED) su microscala, che si illumina quando si verifica la stimolazione ottica del midollo spinale, fornendo un feedback in tempo reale della funzionalità del dispositivo. L'effetto del gambo ottico impiantato sulla funzione motoria naturale è stato valutato su roditori che avevano ricevuto impianti ed è stato confrontato con roditori con interventi chirurgici fittizi. I risultati indicano che le sonde non influenzano negativamente la naturale funzione degli arti posteriori e anteriori dell'animale sette giorni dopo l'impianto.
Protocollo
Tutte le procedure sono state condotte secondo le linee guida del Canadian Council for Animal Care e supervisionate dal Comitato per la cura degli animali dell'Università della British Columbia. Le femmine di ratto Long-Evans, del peso di 350-450 g e di età compresa tra 6 e 8 mesi, sono state alloggiate in gruppo (21 °C; 12 h:12 h ciclo di luce) e hanno avuto accesso ad libitum a una dieta standard per roditori prima e dopo l'intervento chirurgico. I dettagli dei reagenti e delle attrezzature utilizzate per questo studio sono elencati nella Tabella dei materiali.
1. Preparazione pre-operatoria
- Sterilizzare tutti gli strumenti chirurgici utilizzando un'autoclave.
- Anestetizzare l'animale con isoflurano (5% per induzione e 2% per mantenimento) somministrato in ossigeno ad una portata di 1 L/min.
- Trasferire l'animale dalla camera di induzione a un termoforo e collegare prontamente il cono di naso dell'isoflurano. Verificare che l'animale sia sotto un piano chirurgico di anestesia assicurando una completa perdita del riflesso di pizzicamento delle dita dei piedi su entrambe le gambe.
- Radere la parte posteriore del ratto partendo dalla base delle orecchie, come mostrato nella Figura 2A.
- Applicare una generosa quantità di unguento sterile sugli occhi e iniettare buprenorfina (diluita a 0,03 mg/kg) e 10 ml di ringer lattato per via sottocutanea (riscaldata a temperatura corporea).
- Pulire l'area rasata con uno scrub chirurgico antisettico (clorexidina) seguito da alcol isopropilico con un movimento circolare partendo dal centro dell'area rasata e allargando il diametro del cerchio. Ripeti il processo sapone/alcol altre due volte.
- Fissare l'animale in un telaio stereotassico, posizionando la testa utilizzando barre auricolari lubrificate per la stabilità (Figura 2A).
NOTA: Durante l'intera procedura, fornire costantemente supporto termico, verificare la profondità dell'anestesia tramite il riflesso di pizzicamento delle dita dei piedi e monitorare i segni vitali. - Posizionare un telo chirurgico sterile sopra l'animale.
2. Esposizione del midollo spinale cervicale
- Usando una pinza sterile, inizia palpando la base del cranio. Sentire un processo spinoso prominente che si estende rostrocaudalmente vicino alla base del cranio; questo è C214 (Figure 1B e Figura 2B).
- Procedere con la palpazione caudale a C2 per trovare un processo spinoso notevolmente acuto e appuntito, identificabile come T215 (Figure 1B e Figura 2C).
- Utilizzando un bisturi, creare un'incisione nella pelle, partendo da C2 e estendendosi caudalmente per circa 1,5 cm (Figura 2D).
NOTA: La dimensione dell'incisione può variare tra animali di dimensioni diverse. Assicurarsi in anticipo dell'identificazione dei punti di riferimento anatomici e procedere di conseguenza. - Tagliare con cura lo strato adiposo sottocutaneo con il bisturi per esporre la muscolatura dorsale sottostante intatta.
- Una volta che i muscoli dorsali sono esposti, eseguire la dissezione smussata separandoli dalla linea mediana utilizzando due pinze Adson (Figura 2E).
NOTA: È importante eseguire la dissezione contundente (separando le fibre muscolari) piuttosto che tagliare i muscoli per ridurre al minimo il sanguinamento. Un'adeguata esposizione della muscolatura dorsale dovrebbe rivelare un muscolo a forma di palla (Figura 2G). Questo muscolo copre completamente il C2 e copre parzialmente il C3. - Utilizzando rongeur e pinze sterili, sollevare immediatamente un lembo di pelle caudale all'area incisa. Utilizzare i rongeurs per creare una piccola tasca sottocutanea: questa sarà la posizione del dispositivo (Figura 2F).
NOTA: La tasca sottocutanea deve essere più grande del dispositivo stesso. Si raccomanda che il chirurgo o i chirurghi si riposizionino in modo da affrontare l'animale anteriormente per migliorare il controllo e la visibilità durante l'apertura della tasca sottocutanea. - Posizionare un divaricatore per esporre la colonna vertebrale (Figura 2G).
- Usando i rongeurs, rimuovi eventuali muscoli o tessuti rimanenti che coprono le vertebre e inizia a identificare i segmenti del midollo spinale. Immediatamente caudale al muscolo a forma di palla c'è C4, seguito da C5 e C6 (Figura 2G-I). Una volta completato, sciacquare l'area chirurgica con soluzione fisiologica sterile e asciugare con una garza sterile.
NOTA: Il muscolo a forma di palla avvolge completamente C2 e si estende parzialmente su C3. Il segmento del midollo spinale direttamente caudale ad esso, con un contatto minimo, è designato come C4. - Eseguire laminectomie a seconda dello scopo previsto della sonda.
- Per una sonda sotto la lamina, eseguire una laminectomia laterale a C5 e C6, creando un'apertura lateralizzata nella lamina per il futuro posizionamento della sonda (Figura 2H, Figura 1A supplementare).
- Per una sonda sopra la lamina, eseguire una laminectomia mediale di C5, assicurandosi di non rimuovere gli aspetti laterali del processo spinoso, esponendo semplicemente un percorso mediale per il posizionamento della sonda (Figura 2I, Figura 1B supplementare).
- Dopo la laminectomia, sciacquare la regione con soluzione fisiologica sterile e asciugare con una garza sterile per rimuovere eventuali detriti ossei.
NOTA: Quando si esegue la laminectomia, è fondamentale spingere i rongeur contro l'osso ed evitare qualsiasi movimento verso il basso per evitare danni al cordone.
3. Posizionamento epidurale del dispositivo
- Tenere il dispositivo sterile con una pinza sterile con punta in plastica (Figura 3A) e inserirlo all'interno dell'apertura sottocutanea praticata in precedenza al punto 2.9.
NOTA: È fondamentale evitare di toccare il dispositivo con guanti/strumenti non sterili per mantenere la sterilità del dispositivo. Utilizzare una pinza sterile designata per il posizionamento del dispositivo e il posizionamento sotto la pelle. - Sutura o incolla il dispositivo allo strato muscolare vicino per mantenerlo sicuro (Figura 3B).
NOTA: Utilizzare suture non assorbibili se si sutura il dispositivo ai muscoli. In caso contrario, il dispositivo è soggetto a movimenti dopo l'assorbimento della sutura nel corpo. Se si utilizza la colla, garantire la stabilità e la biocompatibilità a lungo termine della colla/adesivo. Evitare di fissare il dispositivo allo strato adiposo sottocutaneo per garantire punti di ancoraggio affidabili.- Pianificare la posizione del corpo del dispositivo prima di procedere con questo passaggio. Poiché il dispositivo sarà fissato in modo permanente, possono sorgere problemi con il posizionamento della sonda (passaggio 3.4) se il dispositivo si trova troppo vicino o troppo lontano dal livello desiderato al midollo spinale.
- Posizionare il divaricatore attorno al midollo spinale e aprire una finestra adatta per posizionare la sonda sul midollo spinale.
- Posizionamenti delle sonde:
- Posizionamento della sonda sotto la lamina: inserire con cautela la sonda utilizzando una pinza con punta in plastica sotto le lamine (C5 e C6) facendola scorrere attraverso i canali lateralizzati realizzati al punto 2.9.1 (Figura 3D).
- Posizionamento della sonda sopra il midollo spinale:
- Regolare la sonda utilizzando una pinza con punta in plastica per allinearla e posizionarla sulla parte superiore della finestra mediale creata in C5 al punto 2.9.2 (Figura 3C).
- In un contenitore sterile, piccolo e preferibilmente di ceramica, preparare il cemento mescolando un misurino di polvere di cemento dentale, 3 gocce di grasso ad alta tecnologia e una goccia di catalizzatore. Mescolare con stuzzicadenti sterili fino a ottenere una consistenza viscosa.
NOTA: Si raccomanda vivamente che una persona che non sta eseguendo l'intervento chirurgico prepari il cemento in modo che il chirurgo possa tenere la sonda in posizione e asciugare l'area desiderata immediatamente prima di applicare il cemento. Questo passaggio è sensibile al fattore tempo. Assicurarsi che il chirurgo posizioni la sonda prima di preparare il cemento. Una volta applicato il catalizzatore, il cemento si addenserà troppo per legarsi efficacemente con l'osso in caso di ritardo. Esercitarsi con il cemento prima dell'intervento chirurgico per assicurarsi di ottenere la giusta consistenza prima di posizionarlo sulla sonda/osso. - Asciugare completamente l'area di cementazione prevista sulle vertebre per creare un punto di ancoraggio affidabile. Applicare 1-2 gocce di cemento dentale sulla punta della sonda, che deve essere posizionata sopra il livello vertebrale previsto, in questo caso C4 (Figura 3C, D).
NOTA: È fondamentale che le vertebre siano il più asciutte possibile prima della cementazione. In caso contrario, il cemento non aderirà e la sonda non sarà fissata. - Mettere in pausa per 30 s e toccare delicatamente il cemento per verificare che sia indurito.
- Se il cemento non è completamente indurito, attendere altri 20 s e riapplicare il cemento appena fatto fino a quando la sonda non è saldamente fissata all'osso.
NOTA: Il cemento si è incollato correttamente quando diventa duro e rigido al tatto.
ATTENZIONE: L'applicazione del cemento quando è troppo liquido può provocarne l'infiltrazione nel tessuto del midollo spinale tra le vertebre. In tal caso, attendere circa 10 secondi affinché il cemento si addensi fino a ottenere una consistenza più simile a una gomma prima di utilizzare delicatamente una pinza per rimuovere il cemento che è entrato in contatto con il midollo spinale.
4. Procedure post-chirurgiche
- Una volta completato l'intervento chirurgico, suturare il sito di incisione utilizzando suture vicryl 5-0. Rimuovere delicatamente l'animale dall'apparato stereotassico e trasferirlo in una camera di recupero riscaldata. Per i primi 3-5 giorni dopo l'intervento, fornire all'animale cibo morbido e inumidito, dolcetti e acqua idrogel.
- Monitorare attentamente l'animale due volte al giorno durante la prima settimana dopo l'intervento. Somministrare buprenorfina e iniezioni di Ringer lattato riscaldate due volte al giorno per i successivi 2 giorni, o più a lungo se persistono segni di dolore. Continuare i controlli giornalieri fino a quando l'animale non mostra problemi clinici di salute. Successivamente, controlla l'animale almeno una volta alla settimana.
- (Facoltativo) Delineare il perimetro del dispositivo sulla pelle dopo l'intervento chirurgico e la chiusura dell'incisione per un'indicazione visiva della posizione del dispositivo nel corpo (Figura 4A).
NOTA: Questo passaggio è particolarmente utile quando il dispositivo richiede l'accesso esterno, come dispositivi che devono essere alimentati in modalità wireless tramite un trasmettitore esterno in cui l'accoppiamento dell'antenna è fondamentale, o pompe di erogazione del farmaco che devono essere ricaricate attraverso la pelle 16,17,18.
Risultati
Un dispositivo optoelettronico con il suo dettagliato diagramma funzionale mostrato nella Figura 2 supplementare è stato impiantato in quattro ratti Long Evans. La Figura 3 supplementare mostra il dispositivo optoelettronico finale pronto per l'impianto. Altri tre animali sono stati sottoposti a interventi chirurgici fittizi, che hanno comportato una laminectomia mediale al C5 senza impianto di dispositivo. Il dispositivo optoelettronico consisteva in una sonda flessibile con un μLED incorporato sulla punta, che veniva attivato da un driver LED integrato. Il driver LED è controllato da un microcontrollore con firmware programmabile. Consisteva anche in un corpo del dispositivo che veniva suturato allo strato muscolare immediatamente sotto la pelle. Uno strato di Parylene-C (~10 μm) viene depositato sull'intero dispositivo mediante deposizione chimica da vapore (CVD). Un secondo strato di polidimetilsilossano (PDMS) (~800 μm) ha ricoperto il corpo del dispositivo optoelettronico (Figura 3 supplementare) per formare un'interfaccia morbida con il tessuto. La punta della sonda è stata fissata a C4 con il μLED che si librava su C5. Sul dispositivo è stato utilizzato un indicatore μLED (con la sua luce visibile da sotto la pelle) che si accendeva contemporaneamente con il μLED del gambo ottico per la verifica in tempo reale della funzionalità del dispositivo. Gli animali sono stati monitorati per un periodo di 7 giorni dopo l'intervento chirurgico per confermare l'affidabilità duratura delle loro prestazioni nel tempo (Figura 4B).
Le funzioni motorie degli animali sono state valutate utilizzando la scala di valutazione locomotoria Martinez in campo aperto19. Per valutare il comportamento in campo aperto, due osservatori addestrati che non erano a conoscenza dei gruppi di trattamento hanno condotto i test prima delle operazioni e nei giorni tre, cinque e sette dopo l'intervento. Dopo la raccolta dei dati, è stato condotto il test U di Mann-Whitney per determinare le differenze in ogni punto temporale sia per i punteggi degli arti anteriori che per quelli posteriori tra i gruppi implantare e sham. La nostra analisi indica un punteggio simile alla funzione degli arti anteriori nei gruppi implant e sham entro il settimo giorno (Figura 5A). Allo stesso modo, non ci sono state differenze statisticamente significative tra i gruppi per i punteggi degli arti posteriori in tutti i punti temporali (Figura 5B).
La verifica post-mortem è stata eseguita 7 giorni dopo l'impianto per confermare se la sonda e il corpo del dispositivo erano rimasti in posizione. Non è stato trovato alcun distacco visibile della sutura o del dispositivo. Inoltre, tirando il corpo del dispositivo non ne ha causato il distacco dal tessuto (Figura 4A supplementare). I muscoli precedentemente sezionati e suturati sono stati quindi esposti sopra il midollo spinale ed è stato confermato che le sonde sono rimaste saldamente cementate sul midollo spinale (Figura 4B supplementare). Analogamente al corpo del dispositivo, la testa della sonda è stata tirata indietro successivamente contro il punto di cementazione per valutarne l'attacco al giunto meccanico sonda-lamina.
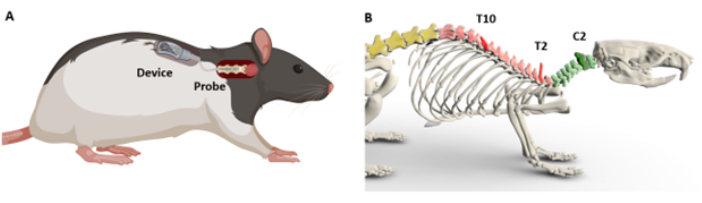
Figura 1: Panoramica schematica dell'impianto del dispositivo e dei punti di riferimento anatomici. (A) Dimostrazione del posizionamento della sonda sul midollo spinale e del posizionamento sottocutaneo del dispositivo. (B) Modello 3D che indica i punti di riferimento utilizzati per determinare i livelli del midollo spinale. I processi spinosi C2, T2 e T10 sono mostrati come riferimento. I colori più scuri indicano il livello corrispondente. Clicca qui per visualizzare una versione più grande di questa figura.
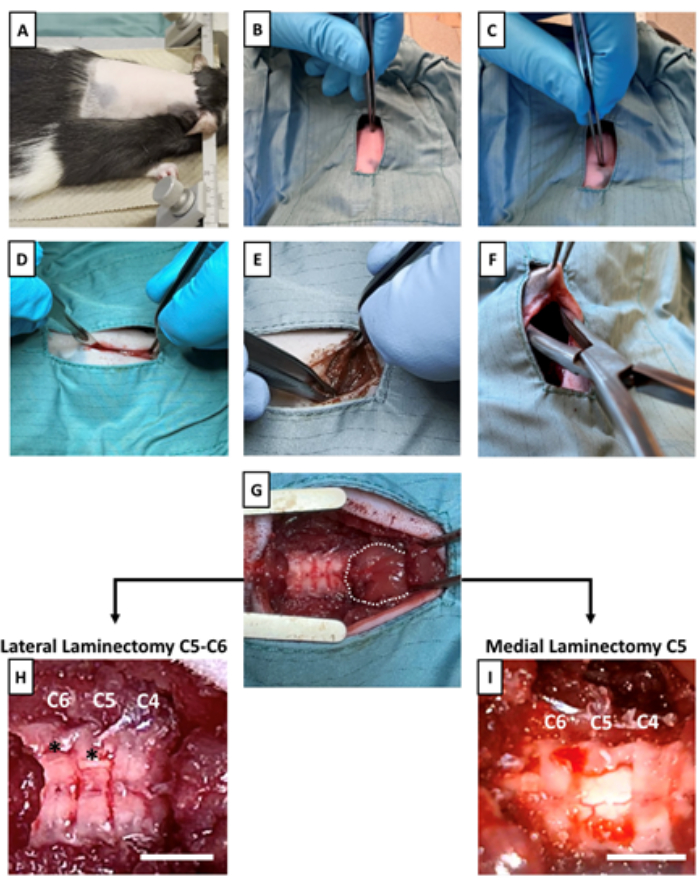
Figura 2: Esposizione del midollo spinale e preparazione di una tasca sottocutanea. (A) Lo stereotassico è posizionato sull'animale. (B) Il processo spinoso C2 e (C) il processo spinoso T2 sono identificati tramite palpazione. (D) Viene praticata un'incisione attraverso la pelle e lo strato adiposo sottocutaneo per esporre la muscolatura dorsale nel punto di interesse a livello cervicale. (E) Attraverso la dissezione smussata della muscolatura dorsale, le vertebre cervicali sono esposte. (F) Viene creata una tasca sottocutanea per fissare il dispositivo impiantabile caudale al sito di incisione. (G) Dopo un'adeguata dissezione, dopo un'adeguata dissezione, viene posizionato un divaricatore per esporre le vertebre cervicali e il muscolo a forma di palla, coprendo completamente il C2 e mascherando parzialmente il C3. La linea tratteggiata indica il muscolo a forma di palla. Una volta che il midollo spinale cervicale è stato esposto, (H) vengono eseguite due laminectomie laterali a C5 e C6 per il posizionamento della sonda sotto le vertebre, oppure (I) la laminectomia mediale viene eseguita a C5 per il posizionamento della sonda sopra le vertebre. Gli asterischi indicano la sede della laminectomia laterale. Barre della scala = 3 mm. Clicca qui per visualizzare una versione più grande di questa figura.
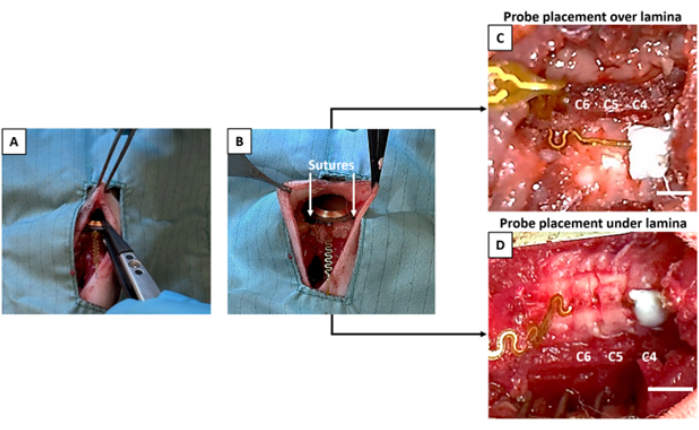
Figura 3: Impianto del dispositivo e posizionamento della sonda. (A) Il dispositivo è inserito nella tasca sottocutanea. (B) Il dispositivo è suturato alla muscolatura. (C) La sonda è fissata sopra la lamina C5, che ha ricevuto la laminectomia mediale. (D) Il dispositivo è posizionato sotto la lamina C5 e C6, entrambe sottoposte a laminectomia laterale. Sia in (C) che in (D), la punta della sonda è cementata in un C4 intatto. Barre della scala = 3 mm. Clicca qui per visualizzare una versione più grande di questa figura.
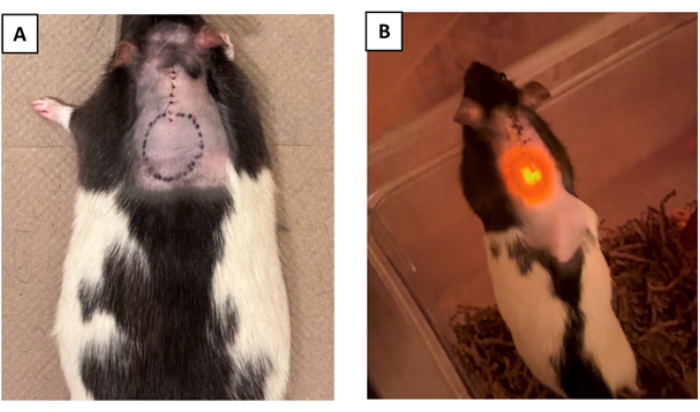
Figura 4: Marcatura del dispositivo e verifica della funzionalità dopo l'intervento chirurgico. (A) La posizione del dispositivo può essere facoltativamente contrassegnata sulla pelle dopo la sutura per facilitarne l'identificazione dopo l'intervento chirurgico. (B) La figura raffigura un animale post-impianto. La funzionalità del dispositivo è stata convalidata osservando l'indicatore μLED visibile sotto la pelle, che conferma il corretto funzionamento del dispositivo (la protuberanza sul lato destro dell'animale è il punto in cui viene impiantato il corpo del dispositivo). Clicca qui per visualizzare una versione più grande di questa figura.
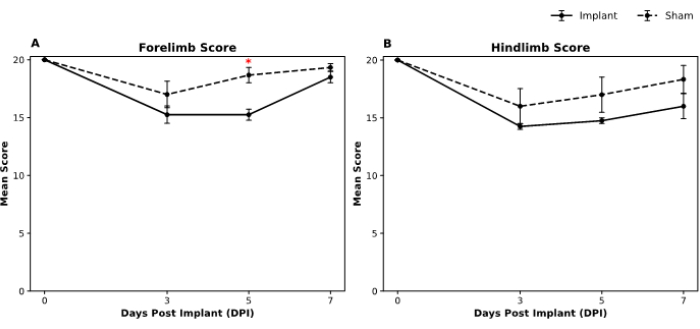
Figura 5: Punteggi comportamentali Martinez in campo aperto nei gruppi sham e implant per le prestazioni degli arti anteriori e posteriori nel tempo. I grafici illustrano i punteggi comportamentali medi per (A) valutazioni in campo aperto degli arti anteriori e (B) degli arti posteriori in quattro punti temporali: 0 (basale), 3 giorni, 5 giorni e 7 giorni dopo l'impianto (DPI). Le barre di errore rappresentano l'errore standard della media (SEM). Le differenze significative (p < 0,05) tra i gruppi sham e implantare sono indicate con asterischi (*) in momenti specifici. La legenda della figura indica i gruppi fittizi visualizzati dalla linea tratteggiata, mentre il gruppo dell'impianto è mostrato dalla linea continua. La dimensione del campione fittizio era n = 3 e l'impianto era n = 4. Il test U di Mann-Whitney non parametrico è stato utilizzato per valutare la significatività delle differenze tra i gruppi in ogni punto temporale. Clicca qui per visualizzare una versione più grande di questa figura.
Figura supplementare 1: Illustrazione della laminectomia. Le linee tratteggiate indicano le regioni da resecare per (A) due laminectomie laterali per il posizionamento della sonda sotto le vertebre e (B) laminectomia mediale per il posizionamento della sonda sopra le vertebre. Clicca qui per scaricare questo file.
Figura supplementare 2: Schema del dispositivo optoelettronico. Viene mostrato lo schema a blocchi dettagliato del dispositivo. Il blocco in alto a sinistra raffigura un serbatoio LC risonante con antenna del ricevitore di alimentazione wireless. La potenza ricevuta viene raddrizzata e immessa in un regolatore di tensione a bassa caduta di tensione (LDO). Un'unità a microcontrollore attiva automaticamente il dispositivo in base ai parametri programmati e un driver LED alimenta tutti i μLED incorporati nella sonda. Clicca qui per scaricare questo file.
Figura supplementare 3: Dispositivo optoelettronico. Il dispositivo optoelettronico finale con incapsulamento biocompatibile collegato a un gambo ottico composto da 1 μLED sulla punta. Il rettangolo tratteggiato rappresenta la posizione del μLED. Clicca qui per scaricare questo file.
Figura supplementare 4: Verifica post-mortem della stabilità del dispositivo. Sette giorni dopo l'impianto, (A) il corpo del dispositivo era rimasto suturato alla muscolatura nella stessa posizione in cui era stato impiantato e (B) la sonda cementata era rimasta fissata sopra la lamina C4. Clicca qui per scaricare questo file.
Discussione
La neuromodulazione e gli interventi terapeutici del midollo spinale richiedono spesso il posizionamento di sonde in segmenti precisi e mirati 3,4,7,13. Data la mobilità intrinseca del midollo spinale, la sonda deve essere fissata in modo affidabile per consentire studi cronici. In base all'applicazione specifica, può essere importante controllare se la sonda è a contatto fisico con il midollo spinale o se il contatto può essere ridotto per ridurre la risposta infiammatoria del tessuto quando possibile. Pertanto, vengono descritte le fasi chirurgiche per ciascuna delle due metodiche. Il protocollo descrive in dettaglio come posizionare una sonda nel segmento cervicale del midollo spinale a C5. Tuttavia, utilizzando il punto di riferimento descritto per T2 o T10 del midollo spinale, la sonda può essere posizionata in modo simile in una posizione precisa sopra la regione toracica o lombare contando le vertebre da T2 o T10, rispettivamente, una volta che sono state esposte. Inoltre, per ridurre al minimo i danni al tessuto del midollo spinale, abbiamo fissato il corpo del dispositivo, che è spesso più grande e più rigido rispetto alla sonda collegata, in uno spazio sottocutaneo lontano dal midollo spinale.
Ci sono alcuni punti critici per l'impianto del dispositivo accoppiato alla sonda. Innanzitutto, è fondamentale decidere la posizione del corpo del dispositivo prima di cementare la sonda. Ciò garantisce che la distanza tra la punta della sonda e il corpo del dispositivo sia ottimizzata per ridurre la tensione sulla sonda ed evitare di avere una lunghezza extra della sonda, che può, ad esempio, causare la torsione o lo spostamento della sonda. In sostanza, l'obiettivo è garantire che la lunghezza della sonda sia simile alla distanza tra lo spazio sottocutaneo in cui è posizionato il corpo del dispositivo e la regione del midollo spinale mirata in cui è cementata la sonda. Eseguendo procedure di chirurgia terminale in cui vengono testate varie lunghezze della sonda, è possibile determinare la dimensione ottimale per un segmento mirato.
Per mantenere la sterilità, il dispositivo deve essere maneggiato con cura per evitare il contatto con lo strato esterno della pelle durante l'inserimento nella tasca sottocutanea. Tale contatto può compromettere la sterilità del dispositivo, portando potenzialmente a infezioni post-operatorie. Inoltre, è importante ridurre al minimo la quantità di forza applicata al dispositivo quando lo si tiene con una pinza per evitare di danneggiarne il rivestimento, che in genere è un sottile strato protettivo, isolante e sterile 20,21. La rimozione del rivestimento può ridurre drasticamente la durata del dispositivo, ad esempio, accorciando il circuito, causando scosse elettriche all'animale e/o provocando una risposta infiammatoria nel corpo. Maneggiare il dispositivo con una pinza a punta in plastica può aiutare a ridurre tali complicazioni.
Quando si sutura il dispositivo sui tessuti molli, è importante evitare di suturare il tessuto adiposo sottocutaneo. Come osservato nelle prove preliminari, gli strati di grasso non sono un punto di ancoraggio affidabile per le suture poiché sono inclini a rompersi. Invece, il corpo del dispositivo è stato suturato a uno strato muscolare adiacente nello spazio sottocutaneo utilizzando suture non assorbibili per il posizionamento permanente del dispositivo nel corpo. D'altra parte, quando si fissa la sonda ai processi spinosi, è importante assicurarsi che il sito a cui viene fissata la sonda sia asciutto prima di applicare il cemento. L'osso/sonda bagnati prolunga il tempo di polimerizzazione e può causare il completo fallimento del processo.
Ci sono alcune considerazioni critiche associate a un dispositivo impiantabile che devono essere affrontate con attenzione prima dell'intervento chirurgico di impianto. (1) Le parti elettricamente attive del dispositivo devono essere incapsulate da uno strato isolante di passivazione. Qualsiasi deprivazione nello strato passivante potrebbe causare un guasto funzionale del dispositivo. (2) L'impiantabile deve essere accuratamente sterilizzato secondo il protocollo animale della struttura. (3) La giunzione tra il dispositivo e le sonde neurali o i gambi stimolatori deve essere formata in modo sicuro. La connessione subirà sollecitazioni meccaniche ripetibili dovute ai costanti movimenti degli animali. (4) Le sonde neurali o i gambi stimolatori attaccati al dispositivo devono essere sufficientemente flessibili ed estensibili da evitare che si spezzino in vari punti.
Il protocollo descritto può essere esteso a dispositivi impiantabili in modelli animali di diverse dimensioni. Dopo aver identificato i punti di riferimento anatomici, i metodi chirurgici descritti possono essere metodicamente personalizzati per fissare eventuali sonde neurali o stinchi stimolatori su segmenti mirati del midollo spinale e impiantare i moduli di controllo associati. Tuttavia, a seconda dell'applicazione, dispositivi diversi possono avere dimensioni, materiali e spessori diversi da quello impiantato in questa carta; Ad esempio, i dispositivi collegati a un modulo di controllo esterno richiedono ulteriori considerazioni. Inoltre, va notato che mentre questo protocollo è adattato per la stimolazione optogenetica, altre applicazioni neuromodulatorie, come la somministrazione di farmaci o la stimolazione/registrazione elettrica, richiedono procedure chirurgiche leggermente diverse. In particolare, queste applicazioni richiedono l'impianto subdurale per garantire il contatto diretto con il midollo spinale sotto la dura madre7. Tuttavia, per l'optogenetica, il contatto intimo con il tessuto è in genere non necessario perché la dura madre del roditore non ostacola in modo significativo la penetrazione della luce, il che consente di posizionare le sorgenti luminose per via epidurale10.
Divulgazioni
Gli autori non hanno conflitti di interesse.
Riconoscimenti
S.S. è parzialmente finanziato da una borsa di dottorato quadriennale dell'Università della British Columbia. A.M. è parzialmente supportato da una borsa di studio per laureati canadesi - Master del Canadian Institute of Health Research (CIHR). D.S. riconosce il finanziamento del Michael Smith Health Research British Columbia Scholar Award. Questo lavoro è stato parzialmente finanziato dal New Frontiers in Research Fund - Transformation del governo canadese (NFRFT-2020-00238). Lo schema nella Figura 1 è stato generato utilizzando Biorender.com e il modello 3D è stato ottenuto con l'autorizzazione di sketchfab.com.
Materiali
| Name | Company | Catalog Number | Comments |
| Adson Forceps | Fine Science Tools | 11027-12 | |
| Alm 3 Point Retractor | Fine Science Tools | 17010-10 | |
| Buprenorphine / Vetergesic | CDMV | 124918 | Manufacturer provides at 0.3 mg/mL but must be diluted to 0.03 mg/kg for use in rats |
| Chlorhexidine 2% Solution | Partnar | PCH-020 | |
| Curved Long Hemostat Forceps | KaamKaaj Tools | 14.5 | Curved Long Hemostat Forceps with A Stainless Steel Ratchet Locking Tweezer |
| CVD Parylene Machine: SCS Labcoter 2 | Specialty Coating Systems | PDS 2010 | |
| Dental Cement - Catalyst | Parkell, Inc | S371 | |
| Dental Cement - Metabond | Parkell, Inc | S398 | |
| Dental Cement - Powder | Parkell, Inc | S396 | |
| Forceps with Replaceable Plastic Tips | Fine Science Tools | 11980-13 | |
| Friedman-Pearson Rongeurs | Fine Science Tools | 16121-14 | |
| Isoflurane USP | Fresenius Kabi | CP0406V2 | Provided at 5% for induction and 2% for mainentance through precision vaporizer |
| Isopropyl Alcohol 70% | McKesson | 350600 | |
| Lacri-Lube Sterile Eye Ointment | Refresh | ||
| Long Evans Rats | Charles River Laboratories | 6 | |
| Low temperature solder paste | Chip Quik Inc. | 11.38 | |
| Magnets | Radial Magnets, Inc. | 0.53 | Magnet Neodymium Iron Boron (NdFeB) N35 (3.00 mm x 1.00 mm) |
| Olsen-Hegar Needle Holders with Suture Cutters | Fine Science Tools | 12002-12 | |
| PDMS: SYLGARD 184 | Sigma Aldrich | 761036 | |
| Scalpel Blades - #15 | Fine Science Tools | 10015-00 | |
| Scalpel Handle - #3 | Fine Science Tools | 10003-12 | |
| Solder flux | Chip Quik Inc. | 14.25 | |
| Stereotaxic Frame | David Kopf Instruments | Model 900 | |
| Sterile Kwik-Sil Adhesive | World Precision Instruments | KWIK-SIL-S | |
| UV Flashlight | Vansky | 19.99 | |
| Wireless Charger | Nilkin | NKT06 | |
| Wireless Charging coil | TDK Corporation | WT202012-15F2-ID |
Riferimenti
- Osseward, P. J., Pfaff, S. L. Cell type and circuit modules in the spinal cord. Curr Opin Neurobiol. 56, 175-184 (2019).
- Alilain, W. J., et al. Light-induced rescue of breathing after spinal cord injury. J Neurosci. 28 (46), 11862-11870 (2008).
- Geng, Y., et al. Advances in optogenetics applications for central nervous system injuries. J Neurotrauma. 40 (13-14), 1297-1316 (2023).
- Montgomery, K. L., Iyer, S. M., Christensen, A. J., Deisseroth, K., Delp, S. L. Beyond the brain: Optogenetic control in the spinal cord and peripheral nervous system. Sci Transl Med. 8 (337), 5 (2016).
- Tan, T., Watts, S. W., Davis, R. P. Drug delivery: Enabling technology for drug discovery and development. iPRECIO Micro infusion pump: Programmable, refillable, and implantable. Front Pharmacol. 2, 44 (2011).
- Suehiro, K., et al. Ecto-domain phosphorylation promotes functional recovery from spinal cord injury. Sci Rep. 4 (1), 4972 (2014).
- Harland, B., et al. A subdural bioelectronic implant to record electrical activity from the spinal cord in freely moving rats. Adv Sci (Weinh). 9 (20), 2105913 (2022).
- Wang, Y., et al. Flexible and fully implantable upconversion device for wireless optogenetic stimulation of the spinal cord in behaving animals. Nanoscale. 12 (4), 2406-2414 (2020).
- Grajales-Reyes, J. G., et al. Surgical implantation of wireless, battery-free optoelectronic epidural implants for optogenetic manipulation of spinal cord circuits in mice. Nat Protoc. 16 (6), 3072-3088 (2021).
- Kathe, C., et al. Wireless closed-loop optogenetics across the entire dorsoventral spinal cord in mice. Nat Biotechnol. 40 (2), 198-208 (2022).
- Hogan, M. K., et al. A wireless spinal stimulation system for ventral activation of the rat cervical spinal cord. Sci Rep. 11 (1), 14900 (2021).
- Lu, C., et al. Flexible and stretchable nanowire-coated fibers for optoelectronic probing of spinal cord circuits. Sci Adv. 3 (3), e1600955 (2017).
- Chen, Y., et al. How is flexible electronics advancing neuroscience research. Biomaterials. 268, 120559 (2021).
- Keomani, E., et al. A murine model of cervical spinal cord injury to study post-lesional respiratory neuroplasticity. J Vis Exp. (87), e51235 (2014).
- Chaterji, S., Barik, A., Sathyamurthy, A. Intraspinal injection of adeno-associated viruses into the adult mouse spinal cord. STAR Protoc. 2 (3), 100786 (2021).
- Agrawal, D. R., et al. Conformal phased surfaces for wireless powering of bioelectronic microdevices. Nat Biomed Eng. 1 (3), 0043 (2017).
- Park, S. I., et al. Stretchable multichannel antennas in soft wireless optoelectronic implants for optogenetics. Proc Natl Acad Sci. 113 (50), E8169-E8177 (2016).
- Manoufali, M., Bialkowski, K., Mohammed, B., Abbosh, A. Wireless power link based on inductive coupling for brain implantable medical devices. IEEE Antennas and Wirel Propaga Lett. 17 (1), 160-163 (2018).
- Martinez, M., Brezun, J. M., Bonnier, L., Xerri, C. A new rating scale for open-field evaluation of behavioral recovery after cervical spinal cord injury in rats. J Neurotrauma. 26 (7), 1043-1053 (2009).
- Yang, Y., et al. Preparation and use of wireless reprogrammable multilateral optogenetic devices for behavioral neuroscience. Nat Protoc. 17 (4), 1073-1096 (2022).
- Yang, Y., et al. Wireless multilateral devices for optogenetic studies of individual and social behaviors. Nat Neurosci. 24 (7), 1035-1045 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon