Method Article
Implantation de dispositifs optoélectroniques dans la moelle épinière des rongeurs
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole détaille une procédure chirurgicale pour effectuer une chirurgie de la moelle épinière et pour implanter et fixer une tige optique sur la moelle épinière chez les rongeurs.
Résumé
La neuromodulation peut fournir des applications diagnostiques, modulatrices et thérapeutiques. Bien que des travaux approfondis aient été menés dans le cerveau, la modulation de la moelle épinière reste relativement inexplorée. Le tissu de la moelle épinière, intrinsèquement délicat et mobile, impose des contraintes qui rendent difficile l’implantation précise de sondes neurales. Malgré les progrès récents dans les dispositifs de neuromodulation, en particulier la bioélectronique flexible, les possibilités d’étendre leur utilisation dans la moelle épinière ont été limitées par les complexités chirurgicales de l’implantation du dispositif. Ici, nous fournissons une série de protocoles chirurgicaux adaptés spécifiquement à l’implantation d’un dispositif optoélectronique sur mesure qui s’interface avec la moelle épinière chez les rongeurs. Les étapes de mise en place et d’ancrage d’une tige optique sur un segment spécifique de la moelle épinière via deux méthodes d’implantation chirurgicale différentes sont détaillées ici. Ces méthodes sont optimisées pour une gamme variée de dispositifs et d’applications, qui peuvent ou non nécessiter un contact direct avec la moelle épinière pour la stimulation optique. Pour élucider la méthodologie, l’anatomie vertébrale est d’abord référencée pour identifier les points de repère proéminents avant de faire une incision cutanée. Les étapes chirurgicales pour fixer une tige optique sur la colonne cervicale chez les rongeurs sont démontrées. Des procédures sont ensuite décrites pour fixer le dispositif optoélectronique connecté à la tige optique dans un espace sous-cutané éloigné de la moelle épinière, minimisant ainsi les contacts directs inutiles. Des études comportementales comparant les animaux recevant les implants à ceux subissant des chirurgies fictives indiquent que les tiges optiques n’ont pas affecté négativement la fonction des membres postérieurs ou antérieurs sept jours après l’implantation. Le présent travail élargit la boîte à outils de neuromodulation pour une utilisation dans de futures études visant à étudier diverses interventions de la moelle épinière.
Introduction
La moelle épinière facilite une gamme de fonctions essentielles du système nerveux central, de la coordination des comportements moteurs à la régulation des processus homéostatiques tels que la respiration 1,2. L’élucidation du rôle du réseau sophistiqué de circuits à travers la moelle épinière nécessite des interfaces, que ce soit pour la stimulation électrique, l’enregistrement, l’administration de médicaments ou la stimulation optique vers des zones ciblées 3,4,5,6. Bien que des dispositifs aient été développés pour permettre de tels interrogatoires 7,8,9,10,11, des techniques chirurgicales spécialisées sont nécessaires pour leur implantation chronique dans la moelle épinière4. En particulier, la moelle épinière et les vertèbres associées ont une susceptibilité accrue aux déformations mécaniques causées par des mouvements naturels tels que l’extension et la flexion 8,12,13. Ces caractéristiques uniques de la moelle épinière rendent intrinsèquement difficile de s’assurer que les sondes implantées restent stables, fonctionnelles et fixées à un segment spécifique sur de longues périodes.
Dans le présent document, un protocole chirurgical est décrit pour l’insertion et la fixation d’une tige optique dans un segment ciblé de la moelle épinière (Figure 1A). Étant donné qu’il a été démontré que l’interfaçage avec la région cervicale en particulier présente des défis uniques9, les étapes d’implantation sont spécifiquement démontrées sur la région cervicale C5. On postule que la complexité de la colonne cervicale provient de son positionnement plus profond et de l’abondance de la musculature, une caractéristique moins proéminente le long du reste de la moelle épinière. Quoi qu’il en soit, les procédures décrites dans ce protocole sont conçues pour être adaptables aux chirurgies dans diverses régions de la moelle épinière. Des instructions par étapes sont fournies pour localiser et identifier les segments de la moelle épinière à l’aide de « repères » anatomiques prononcés identifiables sur la peau (figure 1B). Le protocole élucide ensuite deux techniques d’implantation chirurgicale : l’une adaptée aux sondes qui nécessitent un contact direct avec la moelle épinière, et l’autre pour les sondes qui peuvent ne pas nécessiter de contact direct. Les étapes décrites sont conçues pour être reproduites par tout chercheur ayant une formation en chirurgie de survie des rongeurs.
Ce protocole comprend des instructions étape par étape pour l’implantation d’un dispositif optoélectronique (18 mm x 13 mm) avec une tige optique flexible attachée au-dessus du niveau cervical C5. Le dispositif implantable est fixé sous-cutanéement caudale à C5 et se compose d’un indicateur de diode électroluminescente à micro-échelle (μLED), qui s’allume lors d’une stimulation optique de la moelle épinière, fournissant un retour en direct sur le fonctionnement du dispositif. L’effet de la tige optique implantée sur la fonction motrice naturelle a été évalué sur des rongeurs ayant reçu des implants et a été comparé à des rongeurs ayant subi des chirurgies fictives. Les résultats indiquent que les sondes n’affectent pas négativement la fonction naturelle des membres postérieurs et antérieurs de l’animal sept jours après l’implantation.
Protocole
Toutes les procédures ont été menées conformément aux lignes directrices du Conseil canadien de protection des animaux et supervisées par le Comité de protection des animaux de l’Université de la Colombie-Britannique. Des rats Long-Evans femelles, pesant de 350 à 450 g et âgés de 6 à 8 mois, ont été logés en groupe (21 °C ; cycle de lumière de 12 h à 12 h) et ont eu accès ad libitum à un régime alimentaire standard pour rongeurs avant et après l’opération. Les détails des réactifs et de l’équipement utilisés pour cette étude sont énumérés dans la table des matériaux.
1. Préparation préopératoire
- Stérilisez tous les outils chirurgicaux à l’aide d’un autoclave.
- Anesthésier l’animal avec de l’isoflurane (5% pour l’induction et 2% pour l’entretien) délivré dans de l’oxygène à un débit de 1 L/min.
- Transférez l’animal de la chambre d’induction dans un coussin chauffant et connectez rapidement le cône nasal de l’isoflurane. Vérifiez que l’animal est sous anesthésie chirurgicale en assurant une perte complète du réflexe de pincement des orteils sur les deux pattes.
- Rasez le dos du rat en commençant par la base des oreilles, comme illustré sur la figure 2A.
- Appliquez une quantité généreuse de pommade oculaire stérile sur les yeux et injectez de la buprénorphine (diluée à 0,03 mg/kg) et 10 mL de sonneries lactées par voie sous-cutanée (réchauffée à la température du corps).
- Essuyez la zone rasée avec un gommage chirurgical antiseptique (chlorhexidine) suivi d’alcool isopropylique dans un mouvement circulaire en commençant par le centre de la zone rasée et en élargissant le diamètre du cercle. Répétez le processus savon/alcool deux fois de plus.
- Fixez l’animal dans un cadre stéréotaxique, en positionnant la tête à l’aide de barres d’oreille lubrifiées pour plus de stabilité (figure 2A).
REMARQUE : Tout au long de la procédure, fournissez systématiquement un soutien thermique, vérifiez la profondeur de l’anesthésie par réflexe de pincement des orteils et surveillez les signes vitaux. - Placez un champ chirurgical stérile sur l’animal.
2. Exposition de la moelle épinière cervicale
- À l’aide d’une pince stérile, commencez par palper la base du crâne. Sentez une apophyse épineuse proéminente qui s’étend rostrocaudalement près de la base du crâne ; il s’agit de C214 (figures 1B et figure 2B).
- Procédez avec la palpation caudale à C2 pour trouver une apophyse épineuse particulièrement nette et pointue, identifiable comme T215 (Figures 1B et Figure 2C).
- À l’aide d’un scalpel, créez une incision dans la peau, à partir de C2 et en s’étendant vers la caudale sur environ 1,5 cm (Figure 2D).
REMARQUE : La taille de l’incision peut varier entre les animaux de différentes tailles. Assurez-vous d’identifier les repères anatomiques à l’avance et procédez en conséquence. - Coupez soigneusement la couche adipeuse sous-cutanée avec le scalpel pour exposer la musculature dorsale sous-jacente intacte.
- Une fois les muscles dorsaux exposés, effectuez une dissection contondante en les écartant de la ligne médiane à l’aide de deux pinces Adson (Figure 2E).
REMARQUE : Il est important d’effectuer une dissection contondante (séparer les fibres musculaires) plutôt que de couper les muscles pour minimiser les saignements. Une exposition adéquate de la musculature dorsale devrait révéler un muscle en forme de boule (Figure 2G). Ce muscle couvre complètement C2 et partiellement C3. - À l’aide de rongeurs et de pinces stériles, soulevez un lambeau de peau immédiatement caudale jusqu’à la zone incisée. Utilisez des rongeurs pour créer une petite poche sous-cutanée - ce sera l’emplacement du dispositif (Figure 2F).
REMARQUE : La poche sous-cutanée doit être plus grande que l’appareil lui-même. Il est recommandé que le(s) chirurgien(s) se repositionne pour faire face à l’animal vers l’avant afin d’améliorer le contrôle et la visibilité lors de l’ouverture de la poche sous-cutanée. - Placez un écarteur pour exposer la colonne vertébrale (Figure 2G).
- À l’aide de rongeurs, retirez tous les muscles ou tissus restants recouvrant les vertèbres et commencez à identifier les segments de la moelle épinière. C4 est immédiatement caudale au muscle en forme de boule, suivie de C5 et C6 (Figure 2G-I). Une fois terminé, rincez la zone chirurgicale avec une solution saline stérile et séchez avec de la gaze stérile.
REMARQUE : Le muscle en forme de boule enveloppe entièrement C2 et s’étend partiellement sur C3. Le segment de la moelle épinière directement caudale à celui-ci, avec un contact minimal, est désigné par C4. - Effectuer des laminectomies en fonction de l’usage prévu de la sonde.
- Pour une sonde sous la lame, effectuez une laminectomie latérale en C5 et C6, en créant une ouverture latéralisée dans la lame pour le placement futur de la sonde (Figure 2H, Figure supplémentaire 1A).
- Pour une sonde sur la lame, effectuez une laminectomie médiale de C5, en veillant à ne pas enlever les aspects latéraux de l’apophyse épineuse, exposant simplement une voie médiale pour le placement de la sonde (Figure 2I, Figure supplémentaire 1B).
- Après la laminectomie, rincez la région avec une solution saline stérile et séchez avec de la gaze stérile pour éliminer tous les débris osseux.
REMARQUE : Lors de la réalisation de la laminectomie, il est essentiel de pousser les rongeurs contre l’os et d’éviter tout mouvement vers le bas pour éviter d’endommager le cordon.
3. Mise en place de l’appareil par péridurale
- Tenez le dispositif stérile à l’aide d’une pince stérile à pointe en plastique (Figure 3A) et enfoncez-le à l’intérieur de l’ouverture sous-cutanée pratiquée précédemment à l’étape 2.9.
REMARQUE : Il est essentiel d’éviter de toucher l’appareil avec des gants/outils non stériles pour maintenir la stérilité de l’appareil. Utilisez des pinces stériles désignées pour placer l’appareil et le positionner sous la peau. - Suturez ou collez l’appareil à la couche musculaire voisine pour le maintenir en place (Figure 3B).
REMARQUE : Utilisez des sutures non résorbables si vous suturez l’appareil aux muscles. Sinon, l’appareil est sujet au mouvement après l’absorption des sutures dans le corps. Si vous utilisez de la colle, assurez-vous de la stabilité à long terme et de la biocompatibilité de la colle/de l’adhésif. Évitez de fixer l’appareil à la couche graisseuse/adipeuse sous-cutanée pour assurer des points d’ancrage fiables.- Planifiez la position du corps de l’appareil avant de procéder à cette étape. Étant donné que l’appareil sera fixé de manière permanente, des problèmes de placement de la sonde (étape 3.4) peuvent survenir si l’appareil est situé trop près ou trop loin du niveau souhaité au niveau souhaité de la moelle épinière.
- Placez l’écarteur autour de la moelle épinière et ouvrez une fenêtre appropriée pour placer la sonde sur la moelle épinière.
- Emplacements des sondes :
- Placement de la sonde sous la lame : Insérez soigneusement la sonde à l’aide d’une pince à pointe en plastique sous les lames (C5 et C6) en la faisant glisser à travers les canaux latéralisés réalisés à l’étape 2.9.1 (Figure 3D).
- Placement de la sonde sur la moelle épinière :
- Ajustez la sonde à l’aide d’une pince à pointe en plastique pour aligner et placez la pointe de la sonde sur le dessus de la fenêtre médiane créée en C5 à l’étape 2.9.2 (Figure 3C).
- Dans un récipient stérile, petit et de préférence en céramique, préparez le ciment en mélangeant une cuillère de poudre de ciment dentaire, 3 gouttes de graisse de haute technologie et une goutte de catalyseur. Mélanger avec des cure-dents stériles jusqu’à l’obtention d’une consistance visqueuse.
REMARQUE : Il est fortement recommandé qu’une personne qui n’effectue pas la chirurgie prépare le ciment afin que le chirurgien puisse maintenir la sonde en place et sécher la zone souhaitée immédiatement avant d’appliquer le ciment. Cette étape est urgente. Assurez-vous que le chirurgien positionne la sonde avant de préparer le ciment. Une fois le catalyseur appliqué, le ciment s’épaissira trop pour se lier efficacement à l’os s’il y a un délai. Entraînez-vous avec le ciment avant la chirurgie pour vous assurer d’obtenir la bonne consistance avant de le placer sur la sonde/l’os. - Séchez complètement la zone de cimentation prévue sur les vertèbres pour créer un point d’ancrage fiable. Appliquez 1 à 2 gouttes de ciment dentaire à l’extrémité de la sonde, qui doit être placée au-dessus du niveau vertébral prévu, dans ce cas, C4 (Figure 3C,D).
REMARQUE : Il est essentiel que les vertèbres soient aussi sèches que possible avant le cimentage. Sinon, le ciment n’adhérera pas et la sonde ne sera pas sécurisée. - Faites une pause de 30 secondes et touchez doucement le ciment pour vérifier qu’il est durci.
- Si le ciment n’est pas complètement durci, attendez 20 secondes supplémentaires et réappliquez du ciment fraîchement fabriqué jusqu’à ce que la sonde soit solidement fixée à l’os.
REMARQUE : Le ciment s’est bien collé lorsqu’il devient dur et rigide au toucher.
ATTENTION : L’application du ciment alors qu’il est trop liquide peut le faire s’infiltrer dans le tissu de la moelle épinière entre les vertèbres. Si cela se produit, attendez environ 10 secondes pour que le ciment s’épaississe jusqu’à une consistance plus semblable à celle d’une gomme avant d’utiliser doucement une pince pour enlever le ciment qui est entré en contact avec la moelle épinière.
4. Procédures post-chirurgicales
- Une fois la chirurgie terminée, suturez le site d’incision à l’aide de sutures vicryl 5-0. Retirez délicatement l’animal de l’appareil stéréotaxique et transférez-le dans une chambre de récupération chauffée. Pendant les 3 à 5 premiers jours après la chirurgie, fournissez à l’animal de la nourriture douce et humidifiée, des friandises et de l’eau hydrogelée.
- Surveillez attentivement l’animal deux fois par jour au cours de la première semaine suivant la chirurgie. Administrez de la buprénorphine et des injections de Ringer lactées réchauffées deux fois par jour pendant les 2 jours suivants, ou plus longtemps si les signes de douleur persistent. Continuez les contrôles quotidiens jusqu’à ce que l’animal ne présente aucun problème de santé clinique. Par la suite, vérifiez l’animal au moins une fois par semaine.
- (Facultatif) Décrivez le périmètre de l’instrument sur la peau après l’intervention chirurgicale et la fermeture de l’incision pour obtenir une indication visuelle de l’emplacement de l’appareil dans le corps (Figure 4A).
REMARQUE : Cette étape est particulièrement utile lorsque l’appareil nécessite un accès externe, tels que des appareils nécessitant d’être alimentés sans fil via un émetteur externe où le couplage d’antenne est essentiel, ou des pompes d’administration de médicament qui doivent être remplies par la peau 16,17,18.
Résultats
Un dispositif optoélectronique dont le schéma fonctionnel détaillé est illustré à la figure supplémentaire 2 a été implanté chez quatre rats Long Evans. La figure supplémentaire 3 montre le dispositif optoélectronique final prêt à être implanté. Trois autres animaux ont subi des chirurgies simulées, qui impliquaient une laminectomie médiale à C5 sans implantation du dispositif. Le dispositif optoélectronique se composait d’une sonde flexible avec une LED intégrée à l’extrémité qui était activée par un pilote de LED intégré. Le pilote LED est contrôlé par un microcontrôleur avec micrologiciel programmable. Il se composait également d’un corps de dispositif qui était suturé à la couche musculaire immédiatement sous la peau. Une couche de parylène-C (~10 μm) est déposée sur l’ensemble du dispositif par dépôt chimique en phase vapeur (CVD). Une deuxième couche de polydiméthylsiloxane (PDMS) (~800 μm) recouvrait le corps du dispositif optoélectronique (figure supplémentaire 3) pour former une interface molle avec le tissu. L’extrémité de la sonde a été fixée à C4 avec la LED stationnaire au-dessus de C5. Un indicateur LED a été utilisé sur l’appareil (avec sa lumière visible sous la peau) qui s’est allumé simultanément avec la LED de la tige optique pour une vérification en direct du fonctionnement de l’appareil. Les animaux ont été suivis pendant une période de 7 jours après l’intervention chirurgicale afin de confirmer la fiabilité soutenue de leurs performances dans le temps (Figure 4B).
Les fonctions motrices des animaux ont été évaluées à l’aide de l’échelle d’évaluation locomotrice en champ ouvertMartinez 19. Pour évaluer le comportement en plein champ, deux observateurs formés qui n’étaient pas au courant des groupes de traitement ont effectué les tests avant les opérations ainsi que les troisième, cinquième et septième jours après l’opération. Après la collecte des données, le test U de Mann-Whitney a été effectué pour déterminer les différences à chaque point temporel pour les scores des membres antérieurs et postérieurs entre les groupes implant et simulé. Notre analyse indique un score similaire de la fonction des membres antérieurs dans les groupes d’implants et de simulacres au septième jour (Figure 5A). De même, il n’y avait pas de différences statistiquement significatives entre les groupes pour les scores des membres postérieurs à tous les points temporels (figure 5B).
Une vérification post-mortem a été effectuée 7 jours après l’implantation pour confirmer si la sonde et le corps du dispositif étaient restés en place. Aucun détachement visible de la suture ou du dispositif n’a été trouvé. De plus, le fait de tirer sur le corps de l’appareil n’a pas provoqué son détachement du tissu (figure supplémentaire 4A). Les muscles précédemment disséqués et suturés ont ensuite été exposés sur la moelle épinière, et il a été confirmé que les sondes restaient solidement cimentées sur la moelle épinière (figure supplémentaire 4B). Semblable au corps de l’appareil, la tête de la sonde a été tirée successivement vers l’arrière contre le point de cimentation pour évaluer sa fixation à l’articulation mécanique sonde-lame.
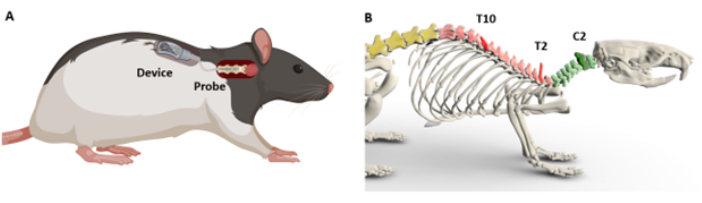
Figure 1 : Vue d’ensemble schématique de l’implantation du dispositif et des repères anatomiques. (A) Démonstration du placement de la sonde sur la moelle épinière et du placement sous-cutané du dispositif. (B) Modèle 3D indiquant les points de repère utilisés pour déterminer les niveaux de la moelle épinière. Les apophyses épineuses C2, T2 et T10 sont indiquées à titre de référence. Les couleurs plus foncées indiquent le niveau correspondant. Veuillez cliquer ici pour voir une version agrandie de cette figure.
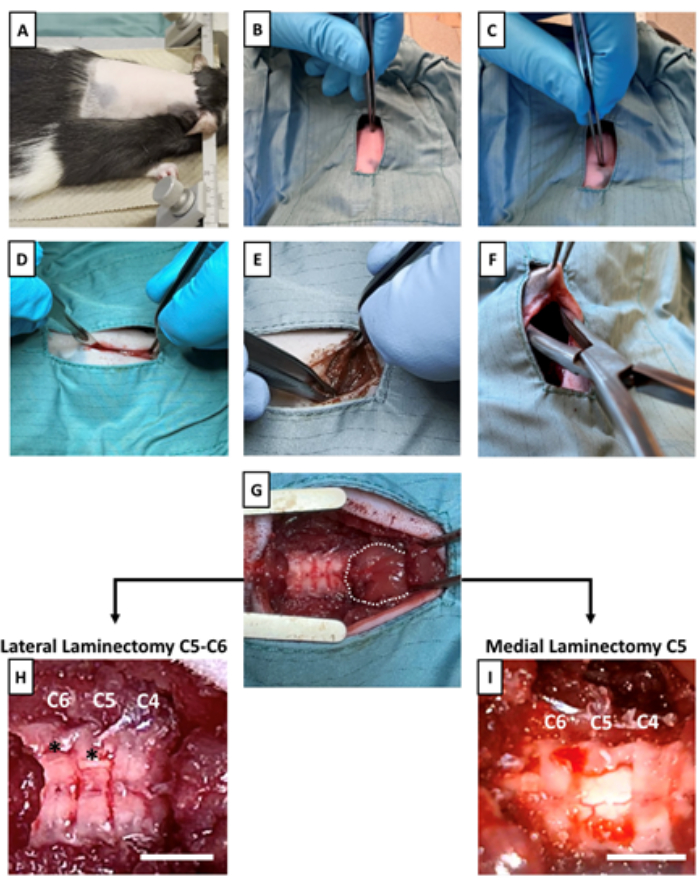
Figure 2 : Exposition de la moelle épinière et préparation d’une poche sous-cutanée. (A) Le stéréotaxique est positionné sur l’animal. (B) L’apophyse épineuse C2 et (C) l’apophyse épineuse T2 sont identifiées par palpation. (D) Une incision à travers la peau et la couche adipeuse sous-cutanée est pratiquée pour exposer la musculature dorsale au point d’intérêt au niveau cervical. (E) Par une dissection émoussée de la musculature dorsale, les vertèbres cervicales sont exposées. (F) Une poche sous-cutanée est créée pour fixer le dispositif implantable caudale au site d’incision. (G) Un écarteur est placé après une dissection adéquate pour exposer les vertèbres cervicales et le muscle en forme de boule, recouvrant complètement C2 et masquant partiellement C3. La ligne pointillée indique le muscle en forme de boule. Une fois que la moelle épinière cervicale a été exposée, soit (H) deux laminectomies latérales en C5 et C6 sont effectuées pour placer la sonde sous les vertèbres, soit (I) une laminectomie médiale est pratiquée en C5 pour placer la sonde sur les vertèbres. Les astérisques indiquent le site de la laminectomie latérale. Barres d’échelle = 3 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
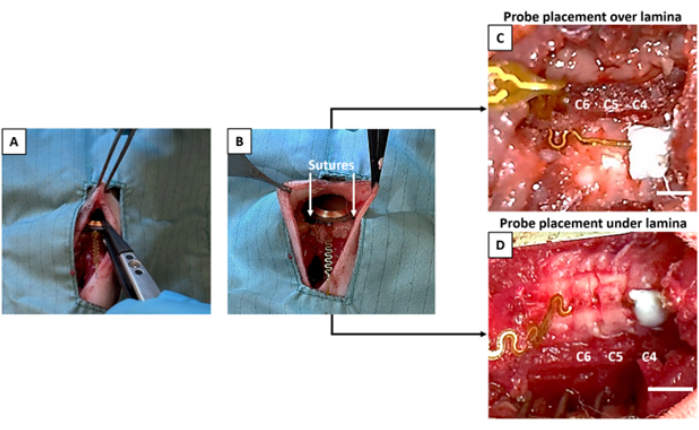
Figure 3 : Implantation du dispositif et placement de la sonde. (A) Le dispositif est placé dans la poche sous-cutanée. (B) Le dispositif est suturé à la musculature. (C) La sonde est fixée au-dessus de la lame C5, qui a subi une laminectomie médiale. (D) Le dispositif est placé sous les lames C5 et C6 qui ont toutes deux reçu une laminectomie latérale. Dans les deux cas (C) et (D), l’extrémité de la sonde est cimentée à un C4 intact. Barres d’échelle = 3 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
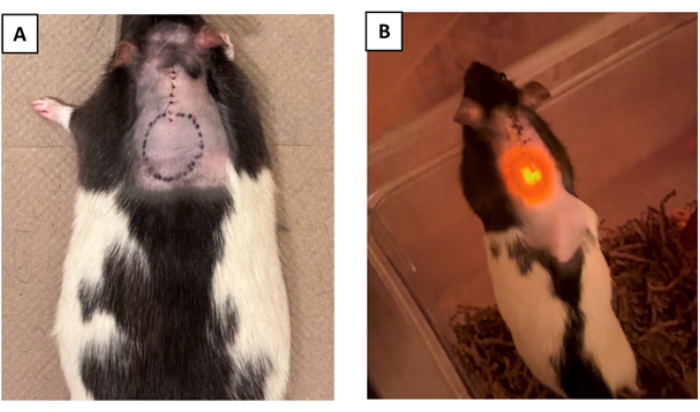
Figure 4 : Marquage de l’appareil et vérification de sa fonctionnalité après l’opération. (A) L’emplacement du dispositif peut être éventuellement marqué sur la peau après la suture pour faciliter son identification après l’opération. (B) La figure représente un animal post-implantation. La fonctionnalité de l’appareil a été validée par l’observation de l’indicateur μLED visible sous la peau, confirmant le bon fonctionnement de l’appareil (la bosse sur le côté droit de l’animal est l’endroit où le corps de l’appareil est implanté). Veuillez cliquer ici pour voir une version agrandie de cette figure.
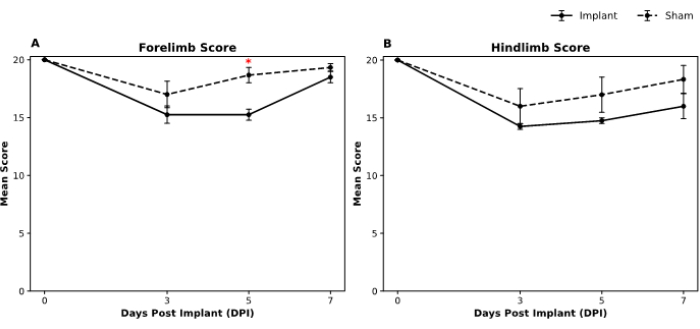
Figure 5 : Scores comportementaux en champ ouvert de Martinez dans les groupes simulés et implants pour les performances des membres antérieurs et postérieurs au fil du temps. Les graphiques illustrent les scores comportementaux moyens pour (A) les évaluations en plein champ des membres antérieurs et (B) des membres postérieurs en plein champ à travers quatre points temporels : 0 (ligne de base), 3 jours, 5 jours et 7 jours après l’implantation (DPI). Les barres d’erreur représentent l’erreur type de la moyenne (SEM). Les différences significatives (p < 0,05) entre les groupes placebo et implantaire sont indiquées par des astérisques (*) à des moments précis. La légende de la figure indique les groupes de trompe-l’œil représentés par la ligne pointillée, tandis que le groupe d’implants est représenté par la ligne continue. La taille de l’échantillon fictif était de n = 3 et l’implant était de n = 4. Le test non paramétrique en U de Mann-Whitney a été utilisé pour évaluer l’importance des différences entre les groupes à chaque point temporel. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure supplémentaire 1 : Illustration de la laminectomie. Les lignes pointillées indiquent les régions à réséquer pour (A) deux laminectomies latérales pour le placement de la sonde sous les vertèbres, et (B) une laminectomie médiale pour le placement de la sonde sur les vertèbres. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 2 : Schéma du dispositif optoélectronique. Le schéma fonctionnel détaillé de l’appareil est illustré. Le bloc en haut à gauche représente un récepteur d’alimentation sans fil, une antenne, un réservoir LC résonant. La puissance reçue est redressée et introduite dans un régulateur de tension à faible chute de tension (LDO). Une unité de microcontrôleur active automatiquement l’appareil en fonction des paramètres programmés, et un pilote de LED alimente toutes les LED intégrées dans la sonde. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 3 : Dispositif optoélectronique. Le dispositif optoélectronique final avec encapsulation biocompatible connecté à une tige optique comprenant 1 μLED à l’extrémité. Le rectangle pointillé représente l’emplacement de la LED. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 4 : Vérification post-mortem de la stabilité du dispositif. Sept jours après l’implantation, (A) le corps du dispositif était resté suturé à la musculature dans la même position qu’il avait été implanté, et (B) la sonde cimentée était restée fixée au-dessus de la lame C4. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
La neuromodulation et les interventions thérapeutiques de la moelle épinière nécessitent souvent le placement de sondes dans des segments précis et ciblés 3,4,7,13. Compte tenu de la mobilité inhérente de la moelle épinière, la sonde doit être sécurisée de manière fiable pour permettre des études chroniques. En fonction de l’application spécifique, il peut être important de contrôler si la sonde est en contact physique avec la moelle épinière ou si le contact peut être réduit pour réduire la réponse inflammatoire du tissu lorsque cela est possible. Par conséquent, les étapes chirurgicales de chacune des deux méthodes sont décrites. Le protocole détaille spécifiquement comment placer une sonde dans le segment cervical de la moelle épinière en C5. Néanmoins, en utilisant le point de repère décrit pour T2 ou T10 de la moelle épinière, la sonde peut être placée de la même manière à un endroit précis sur la région thoracique ou lombaire en comptant les vertèbres à partir de T2 ou T10, respectivement, une fois qu’elles sont exposées. De plus, pour minimiser les lésions du tissu de la moelle épinière, nous avons fixé le corps de l’appareil, qui est souvent plus grand et plus rigide que la sonde connectée, dans un espace sous-cutané à l’écart de la moelle épinière.
Il y a quelques points critiques à l’implantation du dispositif couplé à la sonde. Tout d’abord, il est essentiel de décider de l’emplacement du corps de l’appareil avant de cimenter la sonde. Cela permet d’optimiser la distance entre la pointe de la sonde et le corps de l’appareil afin de réduire la tension sur la sonde et d’éviter d’avoir une longueur de sonde supplémentaire, ce qui peut, par exemple, provoquer une torsion ou un déplacement de la sonde. Essentiellement, l’objectif est de s’assurer que la longueur de la sonde est similaire à la distance entre l’espace sous-cutané où le corps du dispositif est placé et la région de la moelle épinière ciblée où la sonde est cimentée. En effectuant des procédures de chirurgie terminale dans lesquelles différentes longueurs de sonde sont testées, la taille optimale peut être déterminée pour un segment ciblé.
Pour maintenir la stérilité, le dispositif doit être manipulé avec précaution afin d’éviter tout contact avec la couche externe de la peau lors de l’insertion dans la poche sous-cutanée. Un tel contact peut compromettre la stérilité de l’appareil, ce qui peut entraîner une infection postopératoire. De plus, il est important de minimiser la quantité de force appliquée à l’appareil lorsque vous le tenez avec une pince pour éviter d’endommager son revêtement, qui est généralement une fine couche protectrice, isolante et stérile20,21. Le retrait du revêtement peut réduire considérablement la durée de vie de l’appareil, par exemple en raccourcissant le circuit, en provoquant un choc électrique chez l’animal et/ou en provoquant une réponse inflammatoire dans le corps. La manipulation de l’appareil avec des pinces à pointe en plastique peut aider à réduire ces complications.
Lors de la suture du dispositif sur les tissus mous, il est important d’éviter de suturer sur le tissu adipeux sous-cutané. Comme observé dans les essais préliminaires, les couches de graisse ne sont pas un point d’ancrage fiable pour les sutures car elles sont sujettes à la rupture. Au lieu de cela, le corps du dispositif a été suturé à une couche musculaire adjacente dans l’espace sous-cutané à l’aide de sutures non résorbables pour le placement permanent du dispositif dans le corps. D’autre part, lors de la fixation de la sonde aux apophyses épineuses, il est important de s’assurer que le site auquel la sonde est fixée est sec avant d’appliquer le ciment. L’os/sonde humide prolonge le temps de durcissement et peut entraîner l’échec complet du processus.
Il y a certaines considérations critiques associées à un dispositif implantable qui doivent être soigneusement prises en compte avant la chirurgie d’implantation. (1) Les parties électriquement actives de l’appareil doivent être encapsulées par une couche de passivation isolante. Toute privation dans la couche passivante peut entraîner une défaillance fonctionnelle du dispositif. (2) L’implantable doit être soigneusement stérilisé conformément au protocole de l’établissement pour les animaux. (3) La jonction entre l’appareil et les sondes neurales ou les tiges de stimulation doit être solidement formée. La connexion subira des contraintes mécaniques reproductibles en raison des mouvements constants des animaux. (4) Les sondes neurales ou les tiges de stimulation fixées à l’appareil doivent être suffisamment souples et extensibles pour éviter de se casser en divers points.
Le protocole décrit peut être étendu à des dispositifs d’implantation dans des modèles animaux de différentes tailles. Après avoir identifié les repères anatomiques, les méthodes chirurgicales décrites peuvent être méthodiquement personnalisées pour fixer des sondes neurales ou des tiges de stimulation sur des segments ciblés de la moelle épinière et implanter leurs modules de contrôle associés. Cependant, selon l’application, différents appareils peuvent avoir des tailles, des matériaux et des épaisseurs différents de celui implanté dans ce papier ; Par exemple, les appareils connectés à un module de commande externe nécessitent des considérations supplémentaires. De plus, il convient de noter que si ce protocole est conçu pour la stimulation optogénétique, d’autres applications neuromodulatrices, telles que l’administration de médicaments ou la stimulation/enregistrement électrique, nécessitent des procédures chirurgicales légèrement différentes. Plus précisément, ces applications nécessitent une implantation sous-durale pour assurer un contact direct avec la moelle épinière sous la dure-mère7. Cependant, pour l’optogénétique, le contact intime avec les tissus est généralement inutile car la dure-mère de rongeur n’entrave pas de manière significative la pénétration de la lumière, ce qui permet de placer les sources lumineuses de manière épidurale10.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts.
Remerciements
S.S. est financé en partie par une bourse de doctorat de quatre ans de l’Université de la Colombie-Britannique. A.M. est en partie financée par une bourse d’études supérieures du Canada à la maîtrise des Instituts de recherche en santé du Canada (IRSC). D.S. reconnaît le financement de la bourse Michael Smith Health Research British Columbia Scholar. Ces travaux ont été financés en partie par le Fonds Nouvelles frontières en recherche - Transformation (NFRFT-2020-00238) du gouvernement du Canada. Le schéma de la figure 1 a été généré à l’aide de Biorender.com, et le modèle 3D a été obtenu avec la permission de sketchfab.com.
matériels
| Name | Company | Catalog Number | Comments |
| Adson Forceps | Fine Science Tools | 11027-12 | |
| Alm 3 Point Retractor | Fine Science Tools | 17010-10 | |
| Buprenorphine / Vetergesic | CDMV | 124918 | Manufacturer provides at 0.3 mg/mL but must be diluted to 0.03 mg/kg for use in rats |
| Chlorhexidine 2% Solution | Partnar | PCH-020 | |
| Curved Long Hemostat Forceps | KaamKaaj Tools | 14.5 | Curved Long Hemostat Forceps with A Stainless Steel Ratchet Locking Tweezer |
| CVD Parylene Machine: SCS Labcoter 2 | Specialty Coating Systems | PDS 2010 | |
| Dental Cement - Catalyst | Parkell, Inc | S371 | |
| Dental Cement - Metabond | Parkell, Inc | S398 | |
| Dental Cement - Powder | Parkell, Inc | S396 | |
| Forceps with Replaceable Plastic Tips | Fine Science Tools | 11980-13 | |
| Friedman-Pearson Rongeurs | Fine Science Tools | 16121-14 | |
| Isoflurane USP | Fresenius Kabi | CP0406V2 | Provided at 5% for induction and 2% for mainentance through precision vaporizer |
| Isopropyl Alcohol 70% | McKesson | 350600 | |
| Lacri-Lube Sterile Eye Ointment | Refresh | ||
| Long Evans Rats | Charles River Laboratories | 6 | |
| Low temperature solder paste | Chip Quik Inc. | 11.38 | |
| Magnets | Radial Magnets, Inc. | 0.53 | Magnet Neodymium Iron Boron (NdFeB) N35 (3.00 mm x 1.00 mm) |
| Olsen-Hegar Needle Holders with Suture Cutters | Fine Science Tools | 12002-12 | |
| PDMS: SYLGARD 184 | Sigma Aldrich | 761036 | |
| Scalpel Blades - #15 | Fine Science Tools | 10015-00 | |
| Scalpel Handle - #3 | Fine Science Tools | 10003-12 | |
| Solder flux | Chip Quik Inc. | 14.25 | |
| Stereotaxic Frame | David Kopf Instruments | Model 900 | |
| Sterile Kwik-Sil Adhesive | World Precision Instruments | KWIK-SIL-S | |
| UV Flashlight | Vansky | 19.99 | |
| Wireless Charger | Nilkin | NKT06 | |
| Wireless Charging coil | TDK Corporation | WT202012-15F2-ID |
Références
- Osseward, P. J., Pfaff, S. L. Cell type and circuit modules in the spinal cord. Curr Opin Neurobiol. 56, 175-184 (2019).
- Alilain, W. J., et al. Light-induced rescue of breathing after spinal cord injury. J Neurosci. 28 (46), 11862-11870 (2008).
- Geng, Y., et al. Advances in optogenetics applications for central nervous system injuries. J Neurotrauma. 40 (13-14), 1297-1316 (2023).
- Montgomery, K. L., Iyer, S. M., Christensen, A. J., Deisseroth, K., Delp, S. L. Beyond the brain: Optogenetic control in the spinal cord and peripheral nervous system. Sci Transl Med. 8 (337), 5 (2016).
- Tan, T., Watts, S. W., Davis, R. P. Drug delivery: Enabling technology for drug discovery and development. iPRECIO Micro infusion pump: Programmable, refillable, and implantable. Front Pharmacol. 2, 44 (2011).
- Suehiro, K., et al. Ecto-domain phosphorylation promotes functional recovery from spinal cord injury. Sci Rep. 4 (1), 4972 (2014).
- Harland, B., et al. A subdural bioelectronic implant to record electrical activity from the spinal cord in freely moving rats. Adv Sci (Weinh). 9 (20), 2105913 (2022).
- Wang, Y., et al. Flexible and fully implantable upconversion device for wireless optogenetic stimulation of the spinal cord in behaving animals. Nanoscale. 12 (4), 2406-2414 (2020).
- Grajales-Reyes, J. G., et al. Surgical implantation of wireless, battery-free optoelectronic epidural implants for optogenetic manipulation of spinal cord circuits in mice. Nat Protoc. 16 (6), 3072-3088 (2021).
- Kathe, C., et al. Wireless closed-loop optogenetics across the entire dorsoventral spinal cord in mice. Nat Biotechnol. 40 (2), 198-208 (2022).
- Hogan, M. K., et al. A wireless spinal stimulation system for ventral activation of the rat cervical spinal cord. Sci Rep. 11 (1), 14900 (2021).
- Lu, C., et al. Flexible and stretchable nanowire-coated fibers for optoelectronic probing of spinal cord circuits. Sci Adv. 3 (3), e1600955 (2017).
- Chen, Y., et al. How is flexible electronics advancing neuroscience research. Biomaterials. 268, 120559 (2021).
- Keomani, E., et al. A murine model of cervical spinal cord injury to study post-lesional respiratory neuroplasticity. J Vis Exp. (87), e51235 (2014).
- Chaterji, S., Barik, A., Sathyamurthy, A. Intraspinal injection of adeno-associated viruses into the adult mouse spinal cord. STAR Protoc. 2 (3), 100786 (2021).
- Agrawal, D. R., et al. Conformal phased surfaces for wireless powering of bioelectronic microdevices. Nat Biomed Eng. 1 (3), 0043 (2017).
- Park, S. I., et al. Stretchable multichannel antennas in soft wireless optoelectronic implants for optogenetics. Proc Natl Acad Sci. 113 (50), E8169-E8177 (2016).
- Manoufali, M., Bialkowski, K., Mohammed, B., Abbosh, A. Wireless power link based on inductive coupling for brain implantable medical devices. IEEE Antennas and Wirel Propaga Lett. 17 (1), 160-163 (2018).
- Martinez, M., Brezun, J. M., Bonnier, L., Xerri, C. A new rating scale for open-field evaluation of behavioral recovery after cervical spinal cord injury in rats. J Neurotrauma. 26 (7), 1043-1053 (2009).
- Yang, Y., et al. Preparation and use of wireless reprogrammable multilateral optogenetic devices for behavioral neuroscience. Nat Protoc. 17 (4), 1073-1096 (2022).
- Yang, Y., et al. Wireless multilateral devices for optogenetic studies of individual and social behaviors. Nat Neurosci. 24 (7), 1035-1045 (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon