Method Article
Implantation optoelektronischer Geräte in das Rückenmark von Nagetieren
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt ein chirurgisches Verfahren zur Durchführung einer Rückenmarksoperation und zur Implantation und Befestigung eines optischen Schaftes über dem Rückenmark bei Nagetieren.
Zusammenfassung
Die Neuromodulation kann diagnostische, modulatorische und therapeutische Anwendungen bieten. Während umfangreiche Arbeiten im Gehirn durchgeführt wurden, ist die Modulation des Rückenmarks noch relativ unerforscht. Das von Natur aus empfindliche und bewegliche Rückenmarksgewebe stellt Einschränkungen dar, die die präzise Implantation von neuralen Sonden zu einer Herausforderung machen. Trotz der jüngsten Fortschritte bei Neuromodulationsgeräten, insbesondere bei der flexiblen Bioelektronik, sind die Möglichkeiten, ihren Einsatz im Rückenmark zu erweitern, durch die chirurgische Komplexität der Geräteimplantation begrenzt. Hier bieten wir eine Reihe von chirurgischen Protokollen an, die speziell auf die Implantation eines maßgeschneiderten optoelektronischen Geräts zugeschnitten sind, das bei Nagetieren mit dem Rückenmark verbunden ist. Die Schritte zum Platzieren und Verankern eines optischen Schaftes auf einem bestimmten Segment des Rückenmarks über zwei verschiedene chirurgische Implantationsmethoden werden hier detailliert beschrieben. Diese Methoden sind für eine Vielzahl von Geräten und Anwendungen optimiert, die für die optische Stimulation einen direkten Kontakt mit dem Rückenmark erfordern können oder auch nicht. Um die Methodik zu verdeutlichen, wird zunächst die Wirbelanatomie referenziert, um markante Orientierungspunkte zu identifizieren, bevor ein Hautschnitt vorgenommen wird. Es werden die chirurgischen Schritte zur Sicherung eines optischen Schaftes über der Halswirbelsäule bei Nagetieren demonstriert. Anschließend werden Verfahren zur Befestigung des optoelektronischen Geräts, das mit dem optischen Schaft verbunden ist, in einem subkutanen Raum vom Rückenmark entfernt beschrieben, wodurch unnötiger direkter Kontakt minimiert wird. Verhaltensstudien, in denen Tiere, die die Implantate erhielten, mit denen verglichen wurden, die sich einer Scheinoperation unterzogen wurden, deuten darauf hin, dass die optischen Schäfte die Funktion der Hinter- oder Vordergliedmaßen sieben Tage nach der Implantation nicht negativ beeinflussten. Die vorliegende Arbeit erweitert das Instrumentarium der Neuromodulation für den Einsatz in zukünftigen Studien, die darauf abzielen, verschiedene Interventionen des Rückenmarks zu untersuchen.
Einleitung
Das Rückenmark ermöglicht eine Reihe von wesentlichen Funktionen des zentralen Nervensystems, von der Koordination motorischer Verhaltensweisen bis hin zur Regulierung homöostatischer Prozesse wie der Atmung 1,2. Um die Rolle des ausgeklügelten Schaltkreisnetzwerks im gesamten Rückenmark aufzuklären, sind Schnittstellen erforderlich, sei es für die elektrische Stimulation, die Aufzeichnung, die Verabreichung von Medikamenten oder die optische Stimulation von Zielbereichen 3,4,5,6. Obwohl Vorrichtungen entwickelt wurden, um solche Befragungen zu ermöglichen 7,8,9,10,11, sind für ihre chronische Implantation in das Rückenmark spezielle chirurgische Techniken erforderlich 4. Insbesondere das Rückenmark und die zugehörigen Wirbel weisen eine erhöhte Anfälligkeit für mechanische Verformungen auf, die durch natürliche Bewegungen wie Streckung und Beugung verursacht werden 8,12,13. Diese einzigartigen Eigenschaften des Rückenmarks machen es zu einer intrinsischen Herausforderung, sicherzustellen, dass die implantierten Sonden über längere Zeiträume stabil, funktionsfähig und in einem bestimmten Segment gesichert bleiben.
Darin wird ein chirurgisches Protokoll zum Einsetzen und Fixieren eines optischen Schaftes in einem Zielsegment des Rückenmarks beschrieben (Abbildung 1A). Da sich gezeigt hat, dass insbesondere die Schnittstelle zum zervikalen Bereich einzigartige Herausforderungen mit sich bringt9, werden die Implantationsschritte speziell im zervikalen Bereich des C5 demonstriert. Es wird postuliert, dass die Komplexität der Halswirbelsäule aus ihrer tieferen Positionierung und dem Reichtum an Muskulatur entsteht, eine Eigenschaft, die im Rest des Rückenmarks nicht so ausgeprägt ist. Unabhängig davon sind die in diesem Protokoll beschriebenen Verfahren so konzipiert, dass sie für Operationen in verschiedenen Rückenmarksregionen angepasst werden können. Es werden schrittweise Anweisungen zur Lokalisierung und Identifizierung von Rückenmarkssegmenten unter Verwendung ausgeprägter anatomischer "Orientierungspunkte" gegeben, die über der Haut erkennbar sind (Abbildung 1B). Das Protokoll erläutert dann zwei Techniken für die chirurgische Implantation: eine für Sonden, die einen direkten Kontakt mit dem Rückenmark erfordern, und eine andere für Sonden, die möglicherweise keinen direkten Kontakt benötigen. Die beschriebenen Schritte sind so konzipiert, dass sie von jedem Forscher mit einer Ausbildung in der Überlebenschirurgie von Nagetieren reproduziert werden können.
Dieses Protokoll umfasst eine Schritt-für-Schritt-Anleitung für die Implantation eines optoelektronischen Geräts (18 mm x 13 mm) mit einem angebrachten flexiblen optischen Schaft über der Gebärmutterhalshöhe C5. Das implantierbare Gerät wird subkutan kaudal zu C5 befestigt und besteht aus einem mikroskaligen Leuchtdiodenindikator (μLED), der aufleuchtet, wenn eine optische Stimulation des Rückenmarks stattfindet, und eine Live-Rückmeldung über die Funktionalität des Geräts liefert. Die Wirkung des implantierten optischen Schaftes auf die natürliche Motorik wurde an Nagetieren, die Implantate erhalten hatten, untersucht und mit Nagetieren mit Scheinoperationen verglichen. Die Ergebnisse deuten darauf hin, dass die Sonden die natürliche Funktion der Hinter- und Vordergliedmaßen des Tieres sieben Tage nach der Implantation nicht beeinträchtigen.
Protokoll
Alle Verfahren wurden gemäß den Richtlinien des Canadian Council for Animal Care durchgeführt und vom Tierpflegeausschuss der University of British Columbia überwacht. Weibliche Long-Evans-Ratten mit einem Gewicht von 350-450 g und einem Alter von 6-8 Monaten wurden in Gruppen untergebracht (21 °C; 12 h:12 h leichter Zyklus) und erhielten vor und nach der Operation ad libitum Zugang zu einer Standarddiät von Nagetieren. Die Einzelheiten zu den für diese Studie verwendeten Reagenzien und Geräten sind in der Materialtabelle aufgeführt.
1. Präoperative Vorbereitung
- Sterilisieren Sie alle chirurgischen Instrumente mit einem Autoklaven.
- Betäuben Sie das Tier mit Isofluran (5 % für die Induktion und 2 % für die Erhaltung), das in Sauerstoff mit einer Durchflussrate von 1 l/min verabreicht wird.
- Übertragen Sie das Tier aus der Induktionskammer auf ein Heizkissen und schließen Sie umgehend den Isofluran-Nasenkonus an. Stellen Sie sicher, dass sich das Tier in einer chirurgischen Narkose befindet, indem Sie sicherstellen, dass der Zehenkneifreflex an beiden Beinen vollständig verloren geht.
- Rasieren Sie den Rücken der Ratte beginnend an der Basis der Ohren, wie in Abbildung 2A gezeigt.
- Tragen Sie eine großzügige Menge steriler Augensalbe auf die Augen auf und injizieren Sie Buprenorphin (verdünnt auf 0,03 mg/kg) und 10 ml Laktationsringer subkutan (auf Körpertemperatur erwärmt).
- Wischen Sie den rasierten Bereich mit einem antiseptischen chirurgischen Peeling (Chlorhexidin) ab, gefolgt von Isopropylalkohol in kreisenden Bewegungen, beginnend in der Mitte des rasierten Bereichs und mit Erweiterung des Kreisdurchmessers. Wiederholen Sie den Seifen-/Alkoholvorgang noch zwei weitere Male.
- Befestigen Sie das Tier in einem stereotaktischen Rahmen und positionieren Sie den Kopf mit geschmierten Ohrstangen, um die Stabilität zu gewährleisten (Abbildung 2A).
HINWEIS: Bieten Sie während des gesamten Eingriffs konsequent thermische Unterstützung, überprüfen Sie die Anästhesietiefe über den Zehenkneifreflex und überwachen Sie die Vitalfunktionen. - Legen Sie ein steriles OP-Tuch auf das Tier.
2. Freilegung des zervikalen Rückenmarks
- Beginnen Sie mit einer sterilen Pinzette mit dem Abtasten der Schädelbasis. Fühlen Sie nach einem markanten Dornfortsatz, der sich rostrocaudal in der Nähe der Schädelbasis erstreckt; dies ist C214 (Abbildungen 1B und Abbildung 2B).
- Fahren Sie mit der Palpation kaudal zu C2 fort, um einen auffällig scharfen und spitzen Dornfortsatz zu finden, der als T215 erkennbar ist (Abbildungen 1B und Abbildung 2C).
- Setzen Sie mit einem Skalpell einen Schnitt in die Haut, der bei C2 beginnt und sich ca. 1,5 cm nach kaudal erstreckt (Abbildung 2D).
HINWEIS: Die Schnittgröße kann bei Tieren unterschiedlicher Größe variieren. Stellen Sie sicher, dass die anatomischen Orientierungspunkte im Voraus identifiziert werden und gehen Sie entsprechend vor. - Schneiden Sie mit dem Skalpell vorsichtig durch die subkutane Fettschicht, um die intakte darunterliegende Rückenmuskulatur freizulegen.
- Sobald die dorsalen Muskeln freigelegt sind, führen Sie eine stumpfe Dissektion durch, indem Sie sie mit zwei Adson-Pinzetten von der Mittellinie auseinanderziehen (Abbildung 2E).
HINWEIS: Es ist wichtig, eine stumpfe Dissektion durchzuführen (die Muskelfasern auseinander zu ziehen), anstatt die Muskeln zu durchtrennen, um Blutungen zu minimieren. Bei ausreichender Freilegung der Rückenmuskulatur sollte ein kugelförmiger Muskel zum Vorschein kommen (Abbildung 2G). Dieser Muskel bedeckt C2 vollständig und C3 teilweise. - Heben Sie mit Rongeuren und sterilen Pinzetten einen Hautlappen unmittelbar kaudal auf den eingeschnittenen Bereich an. Verwenden Sie Rongeure, um eine kleine subkutane Tasche zu erstellen – dies ist die Position für das Gerät (Abbildung 2F).
HINWEIS: Die Unterhauttasche sollte größer sein als das Gerät selbst. Es wird empfohlen, dass der/die Chirurg(en) sich so positioniert, dass er dem Tier nach vorne zugewandt ist, um die Kontrolle und Sichtbarkeit beim Öffnen der subkutanen Tasche zu verbessern. - Platzieren Sie einen Retraktor, um die Wirbelsäule freizulegen (Abbildung 2G).
- Entfernen Sie mit Hilfe von Rongeuren alle verbleibenden Muskeln oder Gewebe, die die Wirbel bedecken, und beginnen Sie, die Segmente des Rückenmarks zu identifizieren. Unmittelbar kaudal des kugelförmigen Muskels befindet sich C4, gefolgt von C5 und C6 (Abbildung 2G-I). Sobald Sie fertig sind, spülen Sie den Operationsbereich mit steriler Kochsalzlösung ab und trocknen Sie ihn mit steriler Gaze ab.
HINWEIS: Der kugelförmige Muskel umhüllt C2 vollständig und erstreckt sich teilweise über C3. Das direkt kaudal davon liegende Rückenmarkssegment mit minimalem Kontakt wird als C4 bezeichnet. - Führen Sie Laminektomien je nach Verwendungszweck der Sonde durch.
- Für eine Sonde unter der Lamina wird eine laterale Laminektomie an C5 und C6 durchgeführt, wobei eine lateralisierte Öffnung in der Lamina für die zukünftige Sondenplatzierung entsteht (Abbildung 2H, Ergänzende Abbildung 1A).
- Bei einer Sonde über der Lamina ist eine mediale Laminektomie von C5 durchzuführen, wobei darauf geachtet wird, dass die lateralen Aspekte des Dornfortsatzes nicht entfernt werden, sondern lediglich ein medialer Weg für die Sondenplatzierung freigelegt wird (Abbildung 2I, Ergänzende Abbildung 1B).
- Spülen Sie den Bereich nach der Laminektomie mit steriler Kochsalzlösung ab und trocknen Sie ihn mit steriler Gaze, um Knochenreste zu entfernen.
HINWEIS: Bei der Durchführung der Laminektomie ist es wichtig, die Rongeure gegen den Knochen zu drücken und Abwärtsbewegungen zu vermeiden, um eine Beschädigung des Rückenmarks zu vermeiden.
3. Epidurale Platzierung des Geräts
- Halten Sie das sterile Gerät mit einer sterilen Pinzette mit Kunststoffspitze (Abbildung 3A) und führen Sie es in die subkutane Öffnung, die Sie zuvor in Schritt 2.9 vorgenommen haben.
HINWEIS: Es ist wichtig, das Gerät nicht mit unsterilen Handschuhen/Werkzeugen zu berühren, um die Sterilität des Geräts zu erhalten. Verwenden Sie eine dafür vorgesehene sterile Pinzette für die Platzierung und Positionierung des Geräts unter der Haut. - Nähen oder kleben Sie das Gerät mit der benachbarten Muskelschicht, um es sicher zu halten (Abbildung 3B).
HINWEIS: Verwenden Sie nicht resorbierbare Nähte, wenn Sie das Gerät an die Muskeln nähen. Andernfalls neigt das Gerät nach der Nahtaufnahme im Körper zu Bewegungen. Bei Verwendung von Klebstoff ist auf die Langzeitstabilität und Biokompatibilität des Klebers/Klebstoffs zu achten. Vermeiden Sie es, das Gerät an der subkutanen Fett-/Fettschicht zu befestigen, um zuverlässige Verankerungspunkte zu gewährleisten.- Planen Sie die Körperposition des Geräts, bevor Sie mit diesem Schritt fortfahren. Da das Gerät dauerhaft befestigt wird, kann es zu Problemen bei der Sondenplatzierung (Schritt 3.4) kommen, wenn das Gerät zu nah oder zu weit von der gewünschten Höhe am Rückenmark entfernt platziert wird.
- Platzieren Sie den Retraktor um das Rückenmark und öffnen Sie ein geeignetes Fenster, um die Sonde auf das Rückenmark zu legen.
- Platzieren der Sonden:
- Platzierung der Sonde unter der Lamina: Führen Sie die Sonde vorsichtig mit einer Pinzette mit Kunststoffspitze unter die Laminae (C5 und C6) ein, indem Sie sie durch die in Schritt 2.9.1 gemachten lateralisierten Kanäle schieben (Abbildung 3D).
- Platzierung der Sonde über dem Rückenmark:
- Richten Sie die Sonde mit einer Pinzette mit Kunststoffspitze aus und platzieren Sie die Sondenspitze auf dem medialen Fenster, das in Schritt 2.9.2 bei C5 erstellt wurde (Abbildung 3C).
- Bereiten Sie in einem sterilen, kleinen und vorzugsweise keramischen Behälter Zement vor, indem Sie einen Messlöffel Zahnzementpulver, 3 Tropfen High-Tech-Fett und einen Tropfen Katalysator mischen. Mit sterilen Zahnstochern mixen, bis eine zähflüssige Konsistenz erreicht ist.
HINWEIS: Es wird dringend empfohlen, dass eine Person, die die Operation nicht durchführt, den Zement vorbereitet, damit der Chirurg die Sonde an Ort und Stelle halten und den gewünschten Bereich unmittelbar vor dem Auftragen des Zements trocknen kann. Dieser Schritt ist zeitkritisch. Stellen Sie sicher, dass der Chirurg die Sonde positioniert, bevor er den Zement vorbereitet. Sobald der Katalysator aufgetragen ist, verdickt sich der Zement zu stark, um sich effektiv mit dem Knochen zu verbinden, wenn es zu einer Verzögerung kommt. Üben Sie vor der Operation mit dem Zement, um sicherzustellen, dass die richtige Konsistenz erreicht wird, bevor Sie ihn auf die Sonde/den Knochen legen. - Trocknen Sie die vorgesehene Zementstelle an den Wirbeln vollständig, um einen zuverlässigen Ankerpunkt zu schaffen. Tragen Sie 1-2 Tropfen Zahnzement auf die Spitze der Sonde auf, die auf der vorgesehenen Wirbelebene, in diesem Fall C4, platziert werden sollte (Abbildung 3C,D).
HINWEIS: Es ist wichtig, dass die Wirbel vor dem Zementieren so trocken wie möglich sind. Andernfalls haftet der Zement nicht und die Sonde wird nicht gesichert. - Halten Sie eine Pause von 30 Sekunden ein und berühren Sie den Zement vorsichtig, um sicherzustellen, dass er ausgehärtet ist.
- Wenn der Zement nicht vollständig ausgehärtet ist, warten Sie weitere 20 s und tragen Sie erneut frisch hergestellten Zement auf, bis die Sonde fest am Knochen befestigt ist.
HINWEIS: Der Zement hat sich richtig verklebt, wenn er sich hart und steif anfühlt.
ACHTUNG: Das Auftragen des Zements, während er zu flüssig ist, kann dazu führen, dass er in das Rückenmarksgewebe zwischen den Wirbeln eindringt. In diesem Fall lassen Sie den Zement etwa 10 s lang zu einer gummiartigeren Konsistenz eindicken, bevor Sie den Zement, der mit dem Rückenmark in Kontakt gekommen ist, vorsichtig mit einer Pinzette entfernen.
4. Postoperative Eingriffe
- Sobald die Operation abgeschlossen ist, vernähen Sie die Inzisionsstelle mit 5-0 Vicryl-Nähten. Nehmen Sie das Tier vorsichtig aus dem stereotaktischen Gerät und bringen Sie es in eine beheizte Auffangkammer. In den ersten 3-5 Tagen nach der Operation versorgen Sie das Tier mit weichem, angefeuchtetem Futter, Leckerlis und Hydrogelwasser.
- Überwachen Sie das Tier in der ersten Woche nach der Operation zweimal täglich gründlich. Verabreichen Sie Buprenorphin und erwärmte Ringer-Injektionen mit Laktat zweimal täglich für die folgenden 2 Tage oder länger, wenn die Anzeichen von Schmerzen anhalten. Setzen Sie die täglichen Kontrollen fort, bis das Tier keine klinischen Gesundheitsprobleme mehr zeigt. Kontrollieren Sie das Tier danach mindestens einmal pro Woche.
- (Fakultativ) Skizzieren Sie den Geräteumfang auf der Haut nach der Operation und dem Inzisionsverschluss, um eine visuelle Anzeige der Position des Geräts im Körper zu erhalten (Abbildung 4A).
HINWEIS: Dieser Schritt ist besonders nützlich, wenn das Gerät externen Zugriff benötigt, z. B. Geräte, die drahtlos über einen externen Sender mit Strom versorgt werden müssen, bei denen die Antennenkopplung kritisch ist, oder Arzneimittelabgabepumpen, die über die Haut nachgefüllt werden müssen 16,17,18.
Ergebnisse
Ein optoelektronisches Gerät mit seinem detaillierten Funktionsdiagramm, das in der ergänzenden Abbildung 2 dargestellt ist, wurde bei vier Long-Evans-Ratten implantiert. Ergänzende Abbildung 3 zeigt das endgültige optoelektronische Gerät, das implantiert werden kann. Drei weitere Tiere erhielten Scheinoperationen, bei denen es sich um eine mediale Laminektomie bei C5 ohne Implantation handelte. Das optoelektronische Bauelement bestand aus einer flexiblen Sonde mit einer eingebetteten μLED an der Spitze, die durch einen integrierten LED-Treiber aktiviert wurde. Der LED-Treiber wird von einem Mikrocontroller mit programmierbarer Firmware gesteuert. Es bestand auch aus einem Gerätekörper, der unmittelbar unter der Haut mit der Muskelschicht vernäht wurde. Eine Schicht aus Parylene-C (~10 μm) wird mittels chemischer Gasphasenabscheidung (CVD) auf dem gesamten Gerät abgeschieden. Eine zweite Schicht aus Polydimethylsiloxan (PDMS) (~800 μm) bedeckte den optoelektronischen Bauelementkörper (Ergänzende Abbildung 3), um eine weiche Grenzfläche mit dem Gewebe zu bilden. Die Sondenspitze wurde bei C4 befestigt, wobei die μLED über C5 schwebte. Auf dem Gerät wurde eine μLED-Anzeige verwendet (deren Licht unter der Haut sichtbar ist), die sich gleichzeitig mit der μLED des optischen Schaftes einschaltete, um die Funktionalität des Geräts live zu überprüfen. Die Tiere wurden über einen Zeitraum von 7 Tagen nach der Operation überwacht, um die anhaltende Zuverlässigkeit ihrer Leistung über die Zeit zu bestätigen (Abbildung 4B).
Die motorischen Funktionen der Tiere wurden mit Hilfe der Martinez-Freifeld-Lokomotor-Bewertungsskala19 bewertet. Um das Verhalten im freien Feld zu beurteilen, führten zwei geschulte Beobachter, die die Behandlungsgruppen nicht kannten, die Tests vor den Operationen sowie an den Tagen drei, fünf und sieben nach der Operation durch. Nach der Datenerhebung wurde der Mann-Whitney U-Test durchgeführt, um zu jedem Zeitpunkt Unterschiede sowohl für die Werte der Vorder- als auch der Hintergliedmaßen zwischen der Implantat- und der Scheingruppe zu bestimmen. Unsere Analyse zeigt einen ähnlichen Score für die Funktion der Vordergliedmaßen in Implantat- und Scheingruppen am siebten Tag (Abbildung 5A). Ebenso gab es keine statistisch signifikanten Unterschiede zwischen den Gruppen für die Werte der Hintergliedmaßen über alle Zeitpunkte hinweg (Abbildung 5B).
Die Obduktion wurde 7 Tage nach der Implantation durchgeführt, um zu bestätigen, ob die Sonde und der Gerätekörper an Ort und Stelle geblieben waren. Es wurde keine sichtbare Ablösung der Naht oder des Geräts gefunden. Darüber hinaus führte das Ziehen am Gerätekörper nicht zu dessen Ablösung vom Gewebe (Ergänzende Abbildung 4A). Die zuvor präparierten und genähten Muskeln wurden dann über dem Rückenmark freigelegt, und es wurde bestätigt, dass die Sonden sicher über dem Rückenmark zementiert blieben (Ergänzende Abbildung 4B). Ähnlich wie der Gerätekörper wurde der Sondenkopf sukzessive gegen die Zementierungsstelle zurückgezogen, um seine Befestigung an der mechanischen Verbindung zwischen Sonde und Lamelle zu beurteilen.
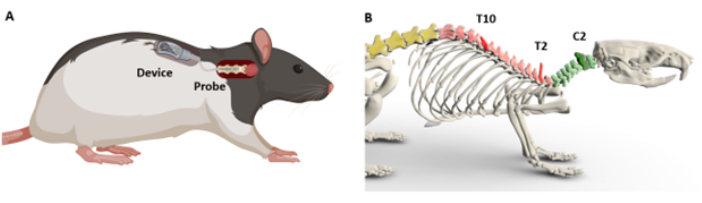
Abbildung 1: Schematische Übersicht über die Implantation des Geräts und die anatomischen Orientierungspunkte. (A) Demonstration der Platzierung der Sonde über dem Rückenmark und der subkutanen Platzierung des Geräts. (B) 3D-Modell mit den Orientierungspunkten, die zur Bestimmung der Rückenmarksniveaus verwendet werden. Die Dornfortsätze C2, T2 und T10 sind als Referenz dargestellt. Dunklere Farben zeigen die entsprechende Ebene an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
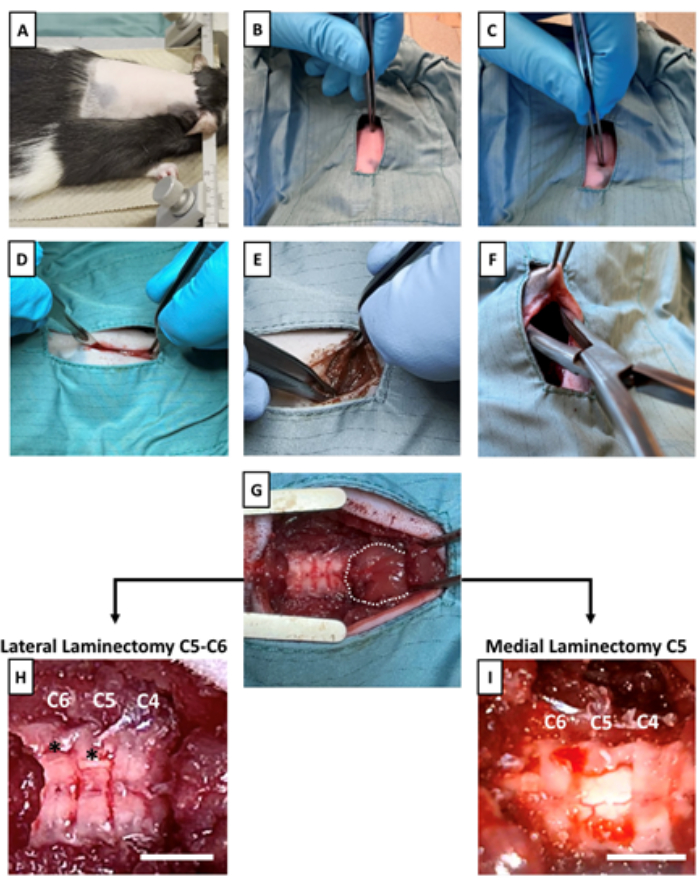
Abbildung 2: Freilegung des Rückenmarks und Präparation einer Unterhauttasche. (A) Das Stereotaxikum wird auf dem Tier positioniert. (B) Der Dornfortsatz C2 und (C) der Dornfortsatz T2 werden durch Palpation identifiziert. (D) Ein Schnitt durch die Haut und die subkutane Fettschicht wird vorgenommen, um die dorsale Muskulatur an der interessierenden Stelle auf zervikaler Ebene freizulegen. (E) Durch stumpfe Dissektion der Rückenmuskulatur werden die Halswirbel freigelegt. (F) Es wird eine subkutane Tasche angelegt, um das implantierbare Gerät kaudal an der Inzisionsstelle zu befestigen. (G) Nach ausreichender Dissektion wird ein Retraktor gelegt, um die Halswirbel und den kugelförmigen Muskel freizulegen, wobei C2 vollständig bedeckt und C3 teilweise verdeckt wird. Die gestrichelte Linie zeigt den kugelförmigen Muskel an. Sobald das zervikale Rückenmark freigelegt wurde, werden entweder (H) zwei laterale Laminektomien an C5 und C6 für die Sondenplatzierung unter den Wirbeln durchgeführt, oder (I) eine mediale Laminektomie an C5 für die Sondenplatzierung über den Wirbeln. Sternchen zeigen die Stelle der lateralen Laminektomie an. Maßstabsstäbe = 3 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
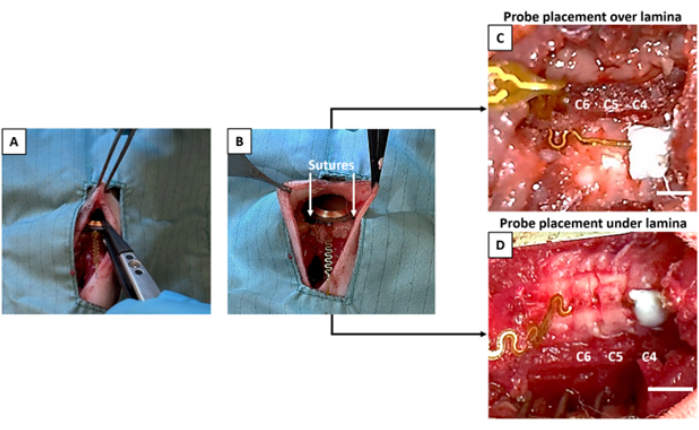
Abbildung 3: Implantation des Geräts und Platzierung der Sonde. (A) Das Gerät wird in die Unterhauttasche gelegt. (B) Das Gerät wird mit der Muskulatur vernäht. (C) Die Sonde wird auf der C5-Lamina befestigt, die eine mediale Laminektomie erhalten hat. (D) Das Gerät wird unter die Lamina C5 und C6 gelegt, die beide eine laterale Laminektomie erhalten haben. Sowohl bei (C) als auch bei (D) wird die Spitze der Sonde an einem intakten C4 zementiert. Maßstabsstäbe = 3 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
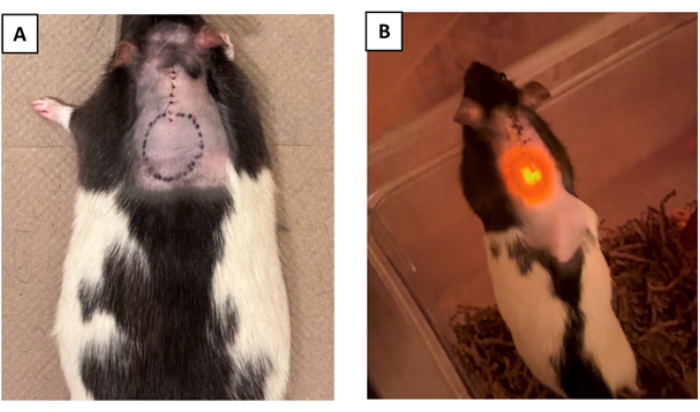
Abbildung 4: Markierung des Geräts und Überprüfung der Funktionalität nach der Operation. (A) Die Position des Geräts kann optional nach dem Nähen auf der Haut markiert werden, um die Identifizierung nach der Operation zu erleichtern. (B) Die Abbildung zeigt ein Tier nach der Implantation. Die Funktionalität des Geräts wurde durch die Beobachtung der unter der Haut sichtbaren μLED-Anzeige validiert, die den erfolgreichen Betrieb des Geräts bestätigt (die Beule auf der rechten Seite des Tieres ist die Stelle, an der der Gerätekörper implantiert ist). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
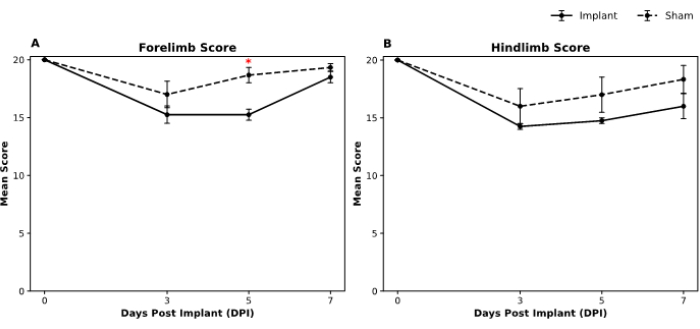
Abbildung 5: Martinez-Freifeld-Verhaltenswerte in Schein- und Implantatgruppen für die Leistung der Vorder- und Hintergliedmaßen im Zeitverlauf. Die Diagramme veranschaulichen die durchschnittlichen Verhaltenswerte für (A) die offenen Feldbewertungen der Vordergliedmaßen und (B) der Hintergliedmaßen über vier Zeitpunkte: 0 (Ausgangswert), 3 Tage, 5 Tage und 7 Tage nach der Implantation (DPI). Fehlerbalken stellen den Standardfehler des Mittelwerts (SEM) dar. Signifikante Unterschiede (p < 0,05) zwischen der Schein- und der Implantatgruppe sind zu bestimmten Zeitpunkten mit Sternchen (*) gekennzeichnet. Die Abbildungslegende zeigt die Scheingruppen, die durch die gestrichelte Linie dargestellt werden, während die Implantatgruppe durch die durchgezogene Linie dargestellt wird. Die Scheinstichprobengröße betrug n = 3 und das Implantat n = 4. Der nicht-parametrische Mann-Whitney-U-Test wurde verwendet, um die Signifikanz von Unterschieden zwischen den Gruppen zu jedem Zeitpunkt zu bewerten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Abbildung 1: Illustration der Laminektomie. Gestrichelte Linien zeigen die Regionen, die für (A) zwei laterale Laminektomien zur Sondenplatzierung unter den Wirbeln und (B) mediale Laminektomie zur Sondenplatzierung über den Wirbeln reseziert werden müssen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 2: Schematische Darstellung des optoelektronischen Bauelementes. Das detaillierte Blockdiagramm des Gerätes ist dargestellt. Der obere linke Block zeigt einen Wireless-Power-Empfänger, einen Antennen-Resonanz-LC-Tank. Die empfangene Leistung wird gleichgerichtet und in einen Low-Dropout-Spannungsregler (LDO) eingespeist. Eine Mikrocontroller-Einheit aktiviert das Gerät automatisch auf der Grundlage der programmierten Parameter, und ein LED-Treiber versorgt alle in die Sonde eingebetteten μLEDs mit Strom. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 3: Optoelektronisches Bauelement. Das endgültige optoelektronische Bauelement mit biokompatibler Verkapselung, das mit einem optischen Schaft verbunden ist, der an der Spitze 1 μLED umfasst. Das gestrichelte Rechteck stellt die Position der μLED dar. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 4: Postmortale Überprüfung der Gerätestabilität. Sieben Tage nach der Implantation blieb (A) der Gerätekörper in der gleichen Position, in der er implantiert worden war, mit der Muskulatur vernäht, und (B) die zementierte Sonde blieb auf der C4-Lamina befestigt. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Neuromodulation und therapeutische Eingriffe des Rückenmarks erfordern oft die Platzierung von Sonden in präzisen, zielgerichteten Segmenten 3,4,7,13. Aufgrund der inhärenten Beweglichkeit des Rückenmarks muss die Sonde zuverlässig gesichert werden, um chronische Untersuchungen zu ermöglichen. Abhängig von der spezifischen Anwendung kann es wichtig sein zu kontrollieren, ob die Sonde in physischem Kontakt mit dem Rückenmark steht oder ob der Kontakt reduziert werden kann, um die Entzündungsreaktion des Gewebes nach Möglichkeit zu verringern. Daher werden für jede der beiden Methoden chirurgische Schritte beschrieben. Das Protokoll beschreibt genau, wie eine Sonde im zervikalen Segment des Rückenmarks bei C5 platziert wird. Nichtsdestotrotz kann die Sonde unter Verwendung des beschriebenen Orientierungspunkts für T2 oder T10 des Rückenmarks in ähnlicher Weise an einer genauen Stelle über dem Brust- oder Lendenwirbelbereich platziert werden, indem die Wirbel von T2 bzw. T10 heruntergezählt werden, sobald sie freigelegt sind. Um die Schädigung des Rückenmarksgewebes zu minimieren, haben wir den Gerätekörper, der im Vergleich zur angeschlossenen Sonde oft größer und steifer ist, in einem subkutanen Raum vom Rückenmark entfernt befestigt.
Es gibt einige kritische Punkte bei der Implantation des Geräts, das mit der Sonde gekoppelt ist. Zunächst ist es wichtig, sich vor dem Zementieren der Sonde für die Position des Gerätekörpers zu entscheiden. Dadurch wird sichergestellt, dass der Abstand zwischen der Spitze der Sonde und dem Gerätekörper optimiert wird, um die Spannung auf der Sonde zu reduzieren und eine zusätzliche Sondenlänge zu vermeiden, die z. B. zu einer Verdrehung oder Verschiebung der Sonde führen kann. Im Wesentlichen besteht das Ziel darin, sicherzustellen, dass die Länge der Sonde dem Abstand vom subkutanen Raum, in dem der Gerätekörper platziert wird, bis zur Zielregion des Rückenmarks, in der die Sonde zementiert ist, ähnlich ist. Durch die Durchführung terminaler chirurgischer Eingriffe, bei denen verschiedene Sondenlängen getestet werden, kann die optimale Größe für ein Zielsegment bestimmt werden.
Um die Sterilität zu erhalten, sollte das Gerät vorsichtig gehandhabt werden, um einen Kontakt mit der äußeren Hautschicht während des Einführens in die Unterhauttasche zu vermeiden. Ein solcher Kontakt kann die Sterilität des Geräts beeinträchtigen und möglicherweise zu einer postoperativen Infektion führen. Darüber hinaus ist es wichtig, die Kraft, die auf die Vorrichtung ausgeübt wird, zu minimieren, wenn sie mit einer Pinzette gehalten wird, um eine Beschädigung ihrer Beschichtung zu verhindern, bei der es sich typischerweise um eine dünne schützende, isolierende und sterile Schichthandelt 20,21. Das Entfernen der Beschichtung kann die Lebensdauer des Geräts drastisch verkürzen, indem beispielsweise der Stromkreis kurzgeschlossen, das Tier einen elektrischen Schlag versetzt und/oder eine Entzündungsreaktion im Körper hervorgerufen wird. Die Handhabung des Geräts mit einer Pinzette mit Kunststoffspitze kann dazu beitragen, solche Komplikationen zu reduzieren.
Beim Nähen des Geräts an Weichgewebe ist es wichtig, das Nähen an subkutanem Fettgewebe zu vermeiden. Wie in Vorversuchen festgestellt, sind Fettschichten kein zuverlässiger Ankerpunkt für Nähte, da sie anfällig für Risse sind. Stattdessen wurde der Gerätekörper mit einer benachbarten Muskelschicht im Unterhautraum unter Verwendung von nicht resorbierbaren Nähten für die dauerhafte Platzierung der Vorrichtung im Körper vernäht. Andererseits ist es bei der Befestigung der Sonde an den Dornfortsätzen wichtig, sicherzustellen, dass die Stelle, an der die Sonde befestigt wird, trocken ist, bevor der Zement aufgetragen wird. Nasser Knochen/Sonde verlängert die Aushärtungszeit und kann zum vollständigen Versagen des Prozesses führen.
Es gibt einige kritische Überlegungen, die mit einem implantierbaren Gerät verbunden sind und die vor einer Implantationsoperation sorgfältig berücksichtigt werden müssen. (1) Elektrisch aktive Teile des Gerätes müssen durch eine isolierende Passivierungsschicht ummantelt sein. Jede Deprivation in der Passivierungsschicht kann zu Funktionsstörungen des Geräts führen. (2) Das Implantierbare muss gemäß dem Tierprotokoll der Einrichtung gründlich sterilisiert werden. (3) Die Verbindung zwischen dem Gerät und den neuralen Sonden oder den Stimulanzienschäften muss sicher geformt sein. Die Verbindung wird durch ständige Tierbewegungen einer wiederholbaren mechanischen Belastung unterzogen. (4) Die an der Vorrichtung befestigten neuralen Sonden oder stimulierenden Schäfte müssen flexibel und dehnbar genug sein, um ein Einrasten an verschiedenen Stellen zu vermeiden.
Das beschriebene Protokoll kann auf Implantate in Tiermodellen unterschiedlicher Größe ausgeweitet werden. Nach der Identifizierung der anatomischen Orientierungspunkte können die beschriebenen Operationsmethoden methodisch angepasst werden, um beliebige neurale Sonden oder stimulierende Schäfte an bestimmten Segmenten des Rückenmarks zu befestigen und die zugehörigen Kontrollmodule zu implantieren. Je nach Anwendung können verschiedene Geräte jedoch unterschiedliche Größen, Materialien und Dicken aufweisen als das in diesem Papier implantierte. Bei Geräten, die an ein externes Steuergerät angeschlossen sind, sind beispielsweise zusätzliche Überlegungen erforderlich. Darüber hinaus muss beachtet werden, dass dieses Protokoll zwar auf die optogenetische Stimulation zugeschnitten ist, andere neuromodulatorische Anwendungen, wie z. B. die Verabreichung von Medikamenten oder die elektrische Stimulation/Aufzeichnung, jedoch etwas andere chirurgische Verfahren erfordern. Konkret ist für diese Anwendungen eine subdurale Implantation erforderlich, um einen direkten Kontakt mit dem Rückenmark unter der Dura mater7 zu gewährleisten. Für die Optogenetik ist jedoch ein intimer Kontakt mit dem Gewebe in der Regel unnötig, da die Dura mater des Nagetiers den Lichteinfall nicht signifikant behindert, was eine epidurale Platzierung von Lichtquellen ermöglicht10.
Offenlegungen
Die Autoren haben keine Interessenkonflikte.
Danksagungen
S.S. wird teilweise durch ein vierjähriges Doktorandenstipendium der University of British Columbia finanziert. A.M. wird teilweise durch ein Canada Graduate Scholarship - Master des Canadian Institute of Health Research (CIHR) unterstützt. D.S. dankt für die Finanzierung durch den Michael Smith Health Research British Columbia Scholar Award. Diese Arbeit wurde teilweise durch den New Frontiers in Research Fund - Transformation der kanadischen Regierung (NFRFT-2020-00238) finanziert. Der Schaltplan in Abbildung 1 wurde mit Biorender.com erstellt, und das 3D-Modell wurde mit Genehmigung von sketchfab.com erstellt.
Materialien
| Name | Company | Catalog Number | Comments |
| Adson Forceps | Fine Science Tools | 11027-12 | |
| Alm 3 Point Retractor | Fine Science Tools | 17010-10 | |
| Buprenorphine / Vetergesic | CDMV | 124918 | Manufacturer provides at 0.3 mg/mL but must be diluted to 0.03 mg/kg for use in rats |
| Chlorhexidine 2% Solution | Partnar | PCH-020 | |
| Curved Long Hemostat Forceps | KaamKaaj Tools | 14.5 | Curved Long Hemostat Forceps with A Stainless Steel Ratchet Locking Tweezer |
| CVD Parylene Machine: SCS Labcoter 2 | Specialty Coating Systems | PDS 2010 | |
| Dental Cement - Catalyst | Parkell, Inc | S371 | |
| Dental Cement - Metabond | Parkell, Inc | S398 | |
| Dental Cement - Powder | Parkell, Inc | S396 | |
| Forceps with Replaceable Plastic Tips | Fine Science Tools | 11980-13 | |
| Friedman-Pearson Rongeurs | Fine Science Tools | 16121-14 | |
| Isoflurane USP | Fresenius Kabi | CP0406V2 | Provided at 5% for induction and 2% for mainentance through precision vaporizer |
| Isopropyl Alcohol 70% | McKesson | 350600 | |
| Lacri-Lube Sterile Eye Ointment | Refresh | ||
| Long Evans Rats | Charles River Laboratories | 6 | |
| Low temperature solder paste | Chip Quik Inc. | 11.38 | |
| Magnets | Radial Magnets, Inc. | 0.53 | Magnet Neodymium Iron Boron (NdFeB) N35 (3.00 mm x 1.00 mm) |
| Olsen-Hegar Needle Holders with Suture Cutters | Fine Science Tools | 12002-12 | |
| PDMS: SYLGARD 184 | Sigma Aldrich | 761036 | |
| Scalpel Blades - #15 | Fine Science Tools | 10015-00 | |
| Scalpel Handle - #3 | Fine Science Tools | 10003-12 | |
| Solder flux | Chip Quik Inc. | 14.25 | |
| Stereotaxic Frame | David Kopf Instruments | Model 900 | |
| Sterile Kwik-Sil Adhesive | World Precision Instruments | KWIK-SIL-S | |
| UV Flashlight | Vansky | 19.99 | |
| Wireless Charger | Nilkin | NKT06 | |
| Wireless Charging coil | TDK Corporation | WT202012-15F2-ID |
Referenzen
- Osseward, P. J., Pfaff, S. L. Cell type and circuit modules in the spinal cord. Curr Opin Neurobiol. 56, 175-184 (2019).
- Alilain, W. J., et al. Light-induced rescue of breathing after spinal cord injury. J Neurosci. 28 (46), 11862-11870 (2008).
- Geng, Y., et al. Advances in optogenetics applications for central nervous system injuries. J Neurotrauma. 40 (13-14), 1297-1316 (2023).
- Montgomery, K. L., Iyer, S. M., Christensen, A. J., Deisseroth, K., Delp, S. L. Beyond the brain: Optogenetic control in the spinal cord and peripheral nervous system. Sci Transl Med. 8 (337), 5 (2016).
- Tan, T., Watts, S. W., Davis, R. P. Drug delivery: Enabling technology for drug discovery and development. iPRECIO Micro infusion pump: Programmable, refillable, and implantable. Front Pharmacol. 2, 44 (2011).
- Suehiro, K., et al. Ecto-domain phosphorylation promotes functional recovery from spinal cord injury. Sci Rep. 4 (1), 4972 (2014).
- Harland, B., et al. A subdural bioelectronic implant to record electrical activity from the spinal cord in freely moving rats. Adv Sci (Weinh). 9 (20), 2105913 (2022).
- Wang, Y., et al. Flexible and fully implantable upconversion device for wireless optogenetic stimulation of the spinal cord in behaving animals. Nanoscale. 12 (4), 2406-2414 (2020).
- Grajales-Reyes, J. G., et al. Surgical implantation of wireless, battery-free optoelectronic epidural implants for optogenetic manipulation of spinal cord circuits in mice. Nat Protoc. 16 (6), 3072-3088 (2021).
- Kathe, C., et al. Wireless closed-loop optogenetics across the entire dorsoventral spinal cord in mice. Nat Biotechnol. 40 (2), 198-208 (2022).
- Hogan, M. K., et al. A wireless spinal stimulation system for ventral activation of the rat cervical spinal cord. Sci Rep. 11 (1), 14900 (2021).
- Lu, C., et al. Flexible and stretchable nanowire-coated fibers for optoelectronic probing of spinal cord circuits. Sci Adv. 3 (3), e1600955 (2017).
- Chen, Y., et al. How is flexible electronics advancing neuroscience research. Biomaterials. 268, 120559 (2021).
- Keomani, E., et al. A murine model of cervical spinal cord injury to study post-lesional respiratory neuroplasticity. J Vis Exp. (87), e51235 (2014).
- Chaterji, S., Barik, A., Sathyamurthy, A. Intraspinal injection of adeno-associated viruses into the adult mouse spinal cord. STAR Protoc. 2 (3), 100786 (2021).
- Agrawal, D. R., et al. Conformal phased surfaces for wireless powering of bioelectronic microdevices. Nat Biomed Eng. 1 (3), 0043 (2017).
- Park, S. I., et al. Stretchable multichannel antennas in soft wireless optoelectronic implants for optogenetics. Proc Natl Acad Sci. 113 (50), E8169-E8177 (2016).
- Manoufali, M., Bialkowski, K., Mohammed, B., Abbosh, A. Wireless power link based on inductive coupling for brain implantable medical devices. IEEE Antennas and Wirel Propaga Lett. 17 (1), 160-163 (2018).
- Martinez, M., Brezun, J. M., Bonnier, L., Xerri, C. A new rating scale for open-field evaluation of behavioral recovery after cervical spinal cord injury in rats. J Neurotrauma. 26 (7), 1043-1053 (2009).
- Yang, Y., et al. Preparation and use of wireless reprogrammable multilateral optogenetic devices for behavioral neuroscience. Nat Protoc. 17 (4), 1073-1096 (2022).
- Yang, Y., et al. Wireless multilateral devices for optogenetic studies of individual and social behaviors. Nat Neurosci. 24 (7), 1035-1045 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten