Method Article
嚢胞性線維症における抗菌薬試験のための多微生物コロニーバイオフィルムモデルの開発
要約
この方法論により、研究および臨床検査室での抗菌剤感受性試験のための嚢胞性線維症における多微生物バイオフィルムモデルの確立が可能になります。このモデルは、さまざまな出力に対して正確で信頼性の高い結果を提供します。
要約
抗生物質の試験には、さまざまな細菌バイオフィルムモデルが存在します。しかし、これらの多くは、コロニー形成単位や代謝活性など、単一の実験結果に限定されています。さらに、多くのバイオフィルムモデルは、人間の宿主環境の生物学的および物理化学的特性を反映していません。これは多くの疾患で重要な問題ですが、最も顕著なのは嚢胞性線維症(CF)です。CF患者の大部分は慢性感染症と間欠性感染症の両方に苦しんでおり、 in vitroでの抗生物質感受性試験は患者の治療結果とあまり相関していません。一部のバイオフィルムモデルには、合成喀痰模倣物を含むCF肺関連媒体が組み込まれていますが、バイオフィルムの構造、生理機能、および微生物が治療に反応する方法を変化させる環境の多微生物性は考慮されていません。ここで説明する固体-空気界面コロニーバイオフィルムモデルは、適応性が高く、CF関連培地と多微生物のコンテキストの両方を組み込んでいます。このモデルは、抗菌薬のミッドスループットスクリーニングや、抗菌薬がポリマイクロバイオリームダイナミクスに及ぼす影響の研究にも使用できます。モデルからの出力測定値は、コロニー形成単位、代謝活性、共焦点顕微鏡分析などです。このモデルは、さまざまな微生物、培地、温度、および変動する酸素条件に容易に適応でき、幅広い化学的、生物学的、および物理的処理の試験に使用できます。
概要
嚢胞性線維症(CF)は、英国で11,000人以上、世界で162,000人が罹患している遺伝性疾患です1,2。CFは多臓器疾患ですが、嚢胞性線維症(pwCF)の人々が経験する主要な症状は、気道内に異常に濃厚な脱水粘液が形成されることです3。これは、繊毛の鼓動の減少とともに、さまざまな細菌、真菌、ウイルス、および古細菌による肺のコロニー形成を促進することができます4,5。CF肺は微生物の成長と生存を制限する条件と選択圧を提供するにもかかわらず、緑膿菌のような細菌はこれらの過酷な環境に高度に適応しています6。これにより、コロニー形成と生存の両方が可能になり、持続的な慢性感染症が形成されます7。
これらの慢性感染症を引き起こす微生物の多くは、表面付着または凝集体7のいずれかで、初期のプランクトンからバイオフィルムスタイルの成長への表現型の変化を使用してそれを行います。これらのバイオフィルムは、多糖類、タンパク質、脂質、環境DNA(eDNA)8などのさまざまな成分からなるエキソ多糖(EPS)マトリックスに包まれた密集した細菌群集を特徴としています。このマトリックスは微生物間で共通の特徴です。ただし、その構成は異なる場合があります。例えば、細菌の緑膿菌マトリックスの主な多糖類成分はPsl、Pel、およびアルギン酸であり、真菌のCandida albicansでは、その主要な多糖マトリックス成分がマンナンとグルカンである9。単一種のバイオフィルムでは、このマトリックスは、バイオフィルムへの抗生物質の浸透を減らし、その有効性を低下させることにより、プランクトンと比較して抗生物質耐性に大きな影響を与える可能性があります10。バイオフィルムスタイルの増殖はまた、プランクトン性細胞と比較して代謝活性が低下した持続性細胞の形成を誘導し、したがって、抗生物質に対する感受性をさらに低下させる11。この成長スタイルは、排出ポンプや遺伝子の水平移動に必要なものなど、いくつかの抗生物質耐性メカニズムのアップレギュレーションによっても特徴付けられ、耐性遺伝子の交換を可能にする11,12,13。これらに加えて、宿主の疾患に関連する環境は、微生物の生理機能とそれらが抗生物質に応答する方法に非常に影響します。これには、濃厚な粘液内の微小好気性症の増加、およびアミノ酸やeDNAなどの非標準的な炭素源の利用可能性が含まれます。これは、宿主由来または肺産物の微生物分解によるものです14,15,16。
これらの特定の相互作用は、バイオフィルムの多微生物性によってさらに複雑になり、細菌間だけでなく、細菌と真菌の間の複雑な相互作用により、複雑さが増します。細菌のバイオフィルムと比較して、C. albicans が CF15 の人々の 75% 以上から分離されているにもかかわらず、細菌と真菌のバイオフィルムとの間の相互作用の一部についてはあまり知られていません。一般に、C.アルビカンスと緑膿菌のような細菌との間の相互作用は拮抗的ですが、より慢性的で重篤な感染症を引き起こす可能性があります18。病原性および共生性の微生物相互作用と、さまざまなCF関連の環境要因の組み合わせは、最終的に抗生物質耐性の増加をもたらす可能性があります19,20。これらの要因の多くは、既存のモデルにおける抗生物質耐性の増加に起因するにもかかわらず、前臨床の抗生物質試験ではあまり考慮されていない21。
これらの条件はin vitroで再現することも困難であり、その結果、多くのモデルでは、緑膿菌のβ-ラクタマーゼ産生を増加させる因子、黄色ブドウ球菌の小さなコロニー変異体の誘導、C.アルビカンスのハイフネーションの阻害など、pwCFに存在する特定の耐性誘導因子の存在を欠いています。これらはすべて、CF喀痰23,24で発生することが示されています。
したがって、ディスク拡散を用いたMueller-Hinton、Etest、CLSIブロス微量希釈アッセイなどの標準化された培地でのプランクトンまたは寒天プレート培養に基づく現在の抗生物質感受性試験法で使用される条件と、宿主環境で遭遇する条件との間には大きな違いがあります25。これは、抗生物質の感受性26を正確に判断できないことがよくあります。この問題は、抗菌バイオフィルム試験の標準化の欠如によってさらに複雑になり、抗菌薬の有効性を実験室から臨床に正確に変換することが困難になっています27,28。
ここで開発した多微生物モデルは、メロペネムやトブラマイシンなどのさまざまな抗菌薬に対する 緑膿菌 の耐性が向上することを示しています。これは、単一種バイオフィルムを使用した現在の抗菌試験と、この研究で開発された最小阻害濃度を決定するための多微生物バイオフィルムモデルとの間の大きな変動を示しています。また、このモデルは、抗菌試験に適した比較的高いスループットと低コストを維持します。また、このモデルは、抗菌薬治療が多微生物動態に及ぼす影響を研究し、特定の治療が特定の病原体を優勢にする可能性があるかどうかを立証するためにも使用でき、さらなる合併症の予測を可能にします。このモデルでは複雑なバイオフィルムの蓄積が可能ですが、そのセットアップには高度な実験装置を必要とせず、幅広い臨床および研究成果のためのプラットフォームを提供します。
プロトコル
1. 合成嚢胞性線維症培地-2(SCFM2)およびプレートの調製
- Palmer et al.16 に記載されているレシピに従って、500 mLのホウケイ酸ガラス瓶に2倍の濃度でSCFM2を作製し、いくつかの変更を加えます。
- 表1に示すように、ストックを計量して準備します。表2に従ってアミノ酸ストックを調製します。
- 5 gのムチン(ブタの胃(II型)から)と600 mgのeDNA(サケの精子から)を100 mLのdH2Oに200 mLのホウケイ酸ガラス瓶に入れて秤量します。オートクレーブ滅菌する前に、4°Cで一晩攪拌します。
- 滅菌した500mLのボトルに、グルコース0.54g、NaCl6.06g、KCl2.228gを加え、ステップ1.1.1で調製したストックをそれぞれ10mL加えます。1 M NaOHまたはHClを使用してpHを6.9に調整します。
- 10 mLのdH2Oを加え、続いて10 mLの0.175 M CaCl2 と0.0606 MのMgCl2を加えます。0.93 M L-乳酸10 mLを調製し、加えます。使用直前に、0.36 mM Fe(III)SO47H2O 10 mL を添加します
- フィルターユニットと真空ポンプを使用してSCFM2をフィルター滅菌し、オートクレーブ滅菌したムチンとeDNAを添加します。
注:調製したSCFM2は、4°Cで最大1ヶ月間保存できます。
- SCFM2寒天プレートは、以下の手順で調製します。
- 50 mLチューブに25 mLの2x SCFM2を55°Cのウォーターバスで予熱した後、あらかじめ溶融させた3%(w/v)の工業用寒天25 mLと混合すると、1x SCFM2と1.5%(w/v)の工業用寒天が混合されます。
- 血清ピペットを使用して、混合物の5 mLを6ウェルプレートの各ウェルに移します。
- 孔径0.2μmの13mmポリカーボネートディスクを同数、シャーレの底に置き、波長254nm、周波数60Hzで600秒間UV-Cを印加し、ディスクを裏返してUV-C手順を繰り返します。
- 1x SCFM2-1.5 % (w/v) テクニカル寒天が固まったら、滅菌鉗子を使用して、6ウェルプレートの各ウェルの表面に 1 枚のポリカーボネートディスクを追加します。
2.感染のための細菌の調製
- モデルを設定する前に、P. aeruginosa PAO1、S. aureus SH1000、C. albicans SC5314の研究室で使用されている標準的な寒天に従って、必要な細菌および真菌株用の寒天プレートを準備します(例:バクテリアには1.2%(w / v)寒天を含むLysogenyブロス、C.albicansにはSabouraudデキストロース寒天培地)。
注:モデルを確立するために、特定の実験室参照株が使用されました。しかし、このモデルは、臨床分離株を含む他の株にも使用されており、成長の遅い株の治療前にバイオフィルムの確立にかかる時間を短縮するなど、いくつかの変更が加えられています。 - 1 μLの接種ループを使用して各微生物の1つのコロニーを選択し、5 mLの標準的な実験室用液体培地(例: 緑膿菌、黄色ブドウ球菌 、 C.アルビカンスの場合は酵母ペプトンデキストロース(YPD))を接種します。これらの培養物を、200 rpm、バクテリアの場合は37 °C、C . albicansの場合は200 rpm、30 °Cで指数関数的な増殖段階に達するまでインキュベートします。
注:エアレーションは、振とうインキュベーターと回転半径によって異なります
3. 固体空気界面モデルの設定
注:モデルの全体的な概略図は、 補足図1で確認できます。
- 各液体培養物1 mLを別々の滅菌1.5 mLチューブに移し、8,000 x g で2分間遠心分離して、細菌/真菌をペレット化します。これと以下のすべての遠心分離ステップを室温で実行します。
- ピペットを使用して上清を吸引し、ペレットを1 mLのPBSに再懸濁してから、再度、8,000 x gで2分間遠心分離します。
- 前と同じように上清を取り除き、ペレットをPBS1mLに再懸濁します。再懸濁した 緑膿菌 と 黄色ブドウ球菌 の細胞をPBSで1:10に希釈し、分光光度計を用いて波長600nmの光学密度を測定します。
- 緑膿菌の OD 600 が 0.05、黄色ブドウ球菌の OD600 が 1 x 108 CFU/mL と同等であるという事前の検証に基づいて、洗浄したサンプルを 1 x 108 コロニー形成単位(CFU)/mL に調整します。
- C. albicansの場合は、洗浄したサンプルをPBSで1:100に希釈し、血球計算盤の2つのチャンバにそれぞれ10 μLを加え、チャンバの固定寸法とCFU/mLの計算に使用した希釈液を使用します。改良されたノイバウアー血球計算盤を使用すると、計算は次のようになります。
細胞数=平均細胞数×10,000個÷(希釈係数) - 計算されたCFUは、事前に希釈したサンプル中の C.アルビカンス CFU / mLを表します。 C. albicans サンプルを、細菌培養物と同様にPBSで1 x 108 CFU/mLに調整します。
- バイオフィルムに添加する接種材料を調製するには、 緑膿菌の 接種材料を 1 x 104 CFU/mL (2x 100倍希釈) に、 C. albicans を 1 x 105 CFU/mL (100 倍希釈に続いて 10 倍希釈) に調整し、最後に PBS を使用して黄色ブドウ球菌 を 1 x 106 CFU/mL (100 倍希釈) に調整します。
- 単一種バイオフィルムの場合、希釈した目的の微生物10 μLを、1x SCFM2-1.5 %テクニカル寒天6ウェルプレートにあらかじめ置いたポリカーボネートディスクの中心に添加し、処理または破壊する前に37°Cで24時間静的にインキュベートします。
- ポリマイクロバイオフィルムの場合は、 黄色ブドウ球菌 と C.アルビカン スをそれぞれ10 μLずつ同じディスク上に重ねて追加します。接種したディスクを37°Cで24時間静的にインキュベートします。
注: S. aureus と C. albicansの 接種物が追加される順序は、モデルの開発に影響を与えず、同じ結果を生成します。 - これに続いて、ポリカーボネートディスクを滅菌鉗子を備えた新鮮な1x SCFM2-1.5%工業用寒天プレートに移し、事前に確立された黄色ブドウ球菌-C.アルビカンスバイオフィルムの上に緑膿菌の1 x 104 CFU / mL希釈液10μLを追加します。さらに24時間、37°Cでインキュベートします。
注: 緑膿菌 は 、黄色ブドウ球菌 と C.アルビカンスの 24時間後に加えられ、これらの生物がCF患者の肺に頻繁にコロニーを形成する順序を反映しています。これにより、 緑膿菌が 他の2つの微生物よりも成長するのを防ぎます。 緑膿菌 を添加すると、バイオフィルムは24時間以上成長することができます。ただし、バイオフィルムを含むポリカーボネートディスクは、24時間ごとに新しいメディアに移す必要があります。ディスラプションが発生する前に、バイオフィルムは、蛍光タンパク質、蛍光色素、または株/微生物特異的抗体を発現する株を使用した顕微鏡検査に使用できます。ただし、一部の染料がポリカーボネートディスクを染色することは注目に値します。
4. バイオフィルムの破壊
- 直径2.8mmのセラミックビーズをプレートに加え、ステップ1.3で説明したようにプレートをUV架橋します。火炎滅菌鉗子を使用して、滅菌した2 mLホモジナイザーチューブに5つのセラミックビーズを加えます。次に、1 mLのリン酸緩衝生理食塩水(PBS)を2 mLの均質化チューブにピペットで移します。
- 少なくとも10秒間、または目視検査で決定されたバイオフィルムがポリカーボネートディスクから除去されるまでボルテックスチューブを留置し、その時点でポリカーボネートディスクを取り外します。
- ビーズを入れたチューブをホモジナイザーにセットし、10秒間隔で6 m/sで2回、10秒間叩きます。
注:ビーズ、叩き時間、およびホモジナイザーの使用のこの組み合わせは、顕微鏡検査およびコロニー形成ユニットによって決定される最小限の溶解でバイオフィルムの十分な破壊をもたらす。これは、使用するビードビーターによって異なる場合があります。 - ホモジナイザーチューブから破壊されたバイオフィルムを4 mLのPBSを含む7 mLのビジューに注ぎ、最終容量を5 mLにします。
- ホモジナイザーチューブからのすべての液体がビジューに移されたことを確認するには、チューブを8,000 x g で2分間遠心分離し、残りの液体を7 mLビジューに移します。
注:この5 mLの破壊されたバイオフィルムから、さまざまなアッセイを実施できますが、1 mLのバイオフィルムPBS希釈を最終容量の5 mLにすることを計算で覚えておくことが重要です。
5. 代謝活動検査
- 上記のステップ4で破壊したバイオフィルム200 μLを、底が透明な黒色の96ウェルプレートに加えます。次に、0.02%(w / v)レサズリン溶液10μLを加えます。
- レサズリン処理されたバイオフィルムをプレートリーダーでインキュベートし、代謝活性を読み取ります。プレートを37°Cでインキュベートし、蛍光測定値を取得する前に、200 rpmで10秒間、30分ごとにオービタル振とうを適用します。
- 540 nmの励起と590 nmの発光を使用して蛍光を測定します。プレートリーダーを使用して、この30分サイクルを4時間繰り返します。
注:4時間の時点は、処理されたサンプルと未処理のサンプル間、および抗生物質濃度が異なるサンプル間でより明確なバリエーションを提供するため、使用されます。
6. 抗菌薬感受性試験
- 標準的な抗生物質の抗菌耐性をテストするには、選択した抗生物質を関連する溶媒に可溶化し、これを液体のまま1x SCFM2-1.5%(w/v)テクニカル寒天培地に液体で加えてから、5 mLを6ウェルプレートの各ウェルに移します。固まったら、ポリカーボネートディスク上に成長させたバイオフィルムを滅菌鉗子を使用して抗生物質含有培地の上部に移し、対応する抗生物質濃度の10μL滴をバイオフィルムの上部に加えます。
注:この研究では、64μg/ mLから0.125μg/ mLのメロペネムとトブラマイシンの2log倍段階希釈を使用して、臨床的に関連する濃度を反映しました。.バイオフィルムの上にのみ抗生物質またはその他の抗菌/抗病原性治療を投与するだけで十分であり、培地とバイオフィルムの両方に加えられたときに同様の反応が観察されています。 - 処理を行い、37°Cで24時間インキュベートした後、バイオフィルムを画像化し、ステップ4で説明したように破壊します。
- 5mLの破壊培養液から、アリコートを採取し、PBSを用いて10倍段階希釈を行う。寒天上に10 μLのスポットを三重にプレートアウトし、Miles and Misra法30を使用してコロニー形成単位を決定します。
注:寒天プレートに追加される容量は検出限界に影響を与え、容量が大きいほど検出限界は減少しますが、より多くのサンプルプレートと寒天プレートが必要になります。 - 単一種のバイオフィルムの場合、 P. aeruginosa と S. aureus をLB寒天プレートに、 C. albicansを SDA寒天に縞模様にします。
- ポリマイクロバイオフィルムの場合は、抗生物質を含む3つの異なる選択培地にアリコートを配置して、3つの種のそれぞれを分離し、CFUの測定を可能にします。これには、緑膿菌と黄色ブドウ球菌をそれぞれ単離するための10 μg/mLのナイスタチンを含むシュードモナス単離寒天とマンニトール塩寒天、およびC. albicansを単離するための125 μg/mLのテトラサイクリンを含むSabouraudデキストロース寒天培地が含まれます。黄色ブドウ球菌プレートを37°Cで一晩インキュベートし、緑膿菌プレートとC.アルビカンスプレートを30°Cでインキュベートします。
注: 緑膿菌 プレートを30°Cでインキュベートして、コロニーの過成長を最小限に抑え、群れを減らします。
結果
固体-空気界面バイオフィルムモデルのシンプルさにより、さまざまな臨床的に関連する条件下で一度に多数の抗菌薬をスクリーニングすることができます。このモデルでは、モノマイクロフィルムとポリミクロンバイオフィルムの両方で、CFUカウントと代謝アッセイを使用して抗生物質の有効性を1週間で評価することができます。モデルの性質上、媒体の組成を変更したり、バイオフィルムを低酸素および嫌気性条件下で配置したりするなど、環境条件を簡単に操作することもできます。このモデルを使用して、pwCFで一般的に使用される2つの抗生物質に対する耐性の変化を、単一種で増殖させた緑 膿菌 と多微生物バイオフィルムの間で示しました(図1)。これと並行して、抗菌処理がポリマイクロバイオフィルム内の集団動態にどのように影響するかを決定することができました(図2)。
これらの実験を実施するために、最初の接種材料を上記のプロトコルで指定されているように調製し、再現性のあるCFU/mLと1元配置または双方向のANOVAによって決定される小さな標準偏差を持つ安定した単種および多微生物バイオフィルムの形成をもたらしました。このモデルは、一貫した増殖とCFUの回復も強調し、これらの古典的な微生物学技術を、高度な処理を必要とせずにこの研究で実施されなかった他の技術と組み合わせる可能性を可能にしました。これらには、生死、マトリックス可視化、分子解析などのイメージングが含まれ、他の3次元モデルではこのようなアクセス可能な方法では提供できない(図1)31。CFU/mL の期待標準偏差は、データを CFU/mL と比較した生存率として表示すると増加することに注意してください(図 1)。単一種と多微生物バイオフィルムの抗生物質治療の有効性を比較すると、50%の死滅を達成するために必要なすべての抗生物質濃度が大幅に増加しました。メロペネムとトブラマイシンのこのレベルの殺傷を達成するためには、抗生物質濃度を2log増加させる必要がありました(図1)。また、64 μg/mL のトブラマイシンで処理した場合、ポリミクロビカルバイオフィルム中の黄色ブドウ球菌およびアルビカンスの存在下での緑膿菌の生存率も全体的に増加しましたが、メロペネムではその逆が見られました。
代謝活性を決定するために使用される方法は、個々の寄与を各種から区別することができなくても、全体のポリ微生物バイオフィルムの全体的な活性を測定する。このため、このモデルに対する代謝活性アッセイの使用を実証するために、単一種の代謝変化のみが示されています。単一種のバイオフィルムでは、 緑膿菌の 生存とメロペネムとトブラマイシンの両方の代謝活性との間に強い関係がありました(図2)。同じサンプルからの代謝活性とCFUカウントの両方を利用することで、静菌効果と殺菌効果の両方を簡単に特定できます。ポリマイクロバイオフィルムの場合、代謝活性の測定は、1つの生物種を標的とすることでバイオフィルムの代謝活性が全体的に増加し、したがって、他の生物種の微生物増殖が増加する可能性があることを示している可能性があります。
CFUは抗菌薬感受性試験のゴールドスタンダードですが、ポリマイクロバイオフィルムでは、バイオフィルム内の種組成を評価することもできます。 緑膿菌 を多微生物バイオフィルムで処理することにより、この生物のMBEC50の増加を示すだけでなく、これが他の共単離種に及ぼす影響も確立できます(図3)。これは、例えば、緑 膿菌 の減少が 黄色ブドウ球菌 と C.アルビカンス CFUの増加を伴うメロペネム(抗シュードモナール)で見られ、その結果、黄色 ブドウ球菌 が特定の抗生物質濃度にさらされると最も一般的な生物になります(図3A)。このことは、特定の病原体を治療する際に、他の疾患の原因となる種の個体数が増加する可能性があるため、バイオフィルムの多微生物性を考慮することの重要性を浮き彫りにしています。
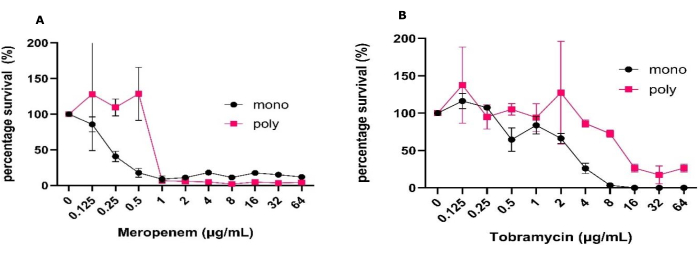
図1:固体-空気界面モデルで成長したモノとポリのバイオフィルム間での、メロペネムとトブラマイシンに対する緑膿菌の抗菌耐性の変動 黄色ブドウ球菌およびC.アルビカンスとモノまたはポリ微生物バイオフィルムで増殖した緑膿菌PAO1は、SCFM2上の固体-空気界面モデルを使用して24時間確立されました。バイオフィルムは、(A)メロペネムまたは(B)トブラマイシン濃度0.125μg/mLから64μg/mLの範囲で処理し、抗生物質なしのコントロールで処理しました。各バイオフィルムのCFU/mLを測定しました。緑膿菌CFUはPIAで決定され、ネガティブコントロールを100%生存率として使用して生存率に変換されました。エラーバーは標準偏差を示し、各データポイントは3つの生物学的リピートから導き出され、それぞれに3つのテクニカルリピートがあります。この図の拡大版を表示するには、ここをクリックしてください。

図2:固体-空気界面モデルで成長したメロペネムまたはトブラマイシンの存在下での 緑膿菌バイオ フィルムの代謝活性の変動。 緑膿菌 PAO1バイオフィルムは、固体-空気界面モデルのSCFM2上に成長させ、0.125 μg/mL から 64 μg/mL までの (A) メロペネムまたは (B) トブラマイシン濃度の範囲を、抗生物質なしのコントロールとともに添加しました。プレートは、30分ごとに540 nmの励起と590 nmの発光で蛍光的に読み取られました。代謝活性の割合は、抗生物質を含まない対照と比較して、各抗生物質で処理されたサンプルでのこの活性の割合を決定することによって計算されました。エラーバーは標準偏差を示し、各データポイントは3つの生物学的リピートから導き出され、それぞれに3つのテクニカルリピートがあります。 この図の拡大版を表示するには、ここをクリックしてください。
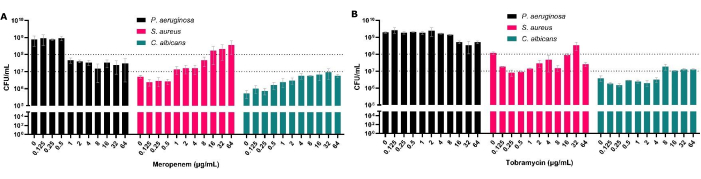
図3:抗菌処理後の多微生物固体界面モデルから回収された 緑膿菌、 黄色ブドウ球菌、 およびC.アルビカンス の総CFU数への影響。 黄色ブドウ球菌 と アルビカン ス菌は、固体-空気界面モデル上のSCFM2上で成長しました。 緑膿菌 を添加し、0.125 μg/mL から 64 μg/mL の範囲の濃度の (A) メロペネムまたは (B) トブラマイシンをバイオフィルムに添加し、抗生物質を使用しないコントロールと共にバイオフィルムに添加しました。各バイオフィルムのCFU/mLを測定しました。エラーバーは標準偏差を示し、各データポイントは3つの生物学的リピートから導き出され、それぞれに3つのテクニカルリピートがあります。 この図の拡大版を表示するには、ここをクリックしてください。
補足図1:固体-空気界面モデルの確立とワークフロー。 固体-空気界面モデルの確立、バイオフィルムの破壊、および出力のグラフ表現。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
ここで説明するバイオフィルムモデルにより、CDCリアクターやラボックバイオフィルムモデル31などの現在使用されているin vitro抗菌試験方法よりもアクセスしやすい方法で、さまざまな一般的な多微生物相互作用を組み込むことにより、CF肺感染環境のいくつかの側面を模倣することができます。これは、バイオフィルムの物理的特性、栄養素の利用可能性、バイオフィルム内の種間の分子相互作用など、さまざまな要因が抗菌剤の活性と抗菌剤に対する微生物の応答の両方に影響を与える可能性がある場合に重要です21。これらの要素を取り入れることで、前述の要素を考慮していない現行モデルよりも精度の高い抗菌薬治療のアウトカム予測が可能な汎用性の高いモデルを開発することができました。
P. aeruginosa、 S. aureus、および C. albicansは 、CF32で一般的に単離された代表的なグラム陽性菌、グラム陰性菌、および真菌として選択されました。しかし、このモデルは、 Burkholderia cenocepacia、 Burkholderia multivorans、Aspergillus fumigatus など、他のさまざまなCF関連微生物に使用できることを示すこともでき、現在、 Prevotella melaninogenicaなどの嫌気性細菌での使用に適応しています。これは、幅広い微生物を組み込むことができるため、このモデルの汎用性を示しており、このモデルの幅広い微生物病原体に対する抗菌試験への適応性が強調されています。また、このモデルは、SCFM2を患者の喀痰に置き換えるなど、よりパーソナライズされた抗菌感度試験のために、さまざまな環境条件に容易に適合させることができます。
また、新しい抗菌薬の試験のためのポリマイクロバイオフィルムモデルの検討も最も重要であり、これは、動物またはヒトの研究33,34で使用する前に、抗菌薬開発パイプラインの既存のギャップを埋めることができるからである。これに加えて、このモデルは比較的高いスループットを維持し、業界と研究の両方に関連するさまざまな出力を可能にします。
この手法の論文では、CFUと代謝活性を例示しただけですが、液体抽出表面分析質量分析(LESA)を使用したバイオフィルムエキソメタボロームの分析におけるモデルの有用性も実証しました。これにより、抗菌耐性を支える分子メカニズムの一部を調査することができる35。これらの他の出力に加えて、新しい抗菌薬送達システムの試験にこのモデルを使用することも実証しました。これらには、バイオフィルム内でのこの抗生物質の浸透を強化するためのポリマー-シプロフロキサシン複合体が含まれ、その活性を高め、耐性の発生を減少させる36。
重要な手順と考慮事項
特にSCFM2および培地を産生する際には、汚染により非天然に存在する種が導入され、結果が妨げられる可能性があるため、無菌性を維持することが重要です。同じ微生物の異なる菌株と異なる微生物は、成長に必要な環境条件が異なる場合や、成長特性が異なる場合があります。したがって、抗生物質感受性試験を実施する前に、モデルを最適化する必要があります。標準モデル条件下での増殖を評価するために、単一種およびポリマイクロバイオフィルムについて24時間および48時間の小規模なパイロット研究を実施することをお勧めします。私たちは、 緑膿菌 株と特定の抗生物質濃度が異なると、ポリカーボネートディスクからの群れを誘発する可能性があることを発見しました。これは、市販されているより大きなサイズのディスクを使用することで簡単に克服できます。バイオフィルムの破壊は、ビーズビーターや使用する微生物によっては、最適化が必要な場合もあります。ビーズビードのビーキング前後の既知のサンプルのCFU/mLを測定することにより、破壊法を最適化しました。また、顕微鏡を使用してビーズビートサンプルを視覚化し、バイオフィルムがどの程度破壊されているかを視覚化しました。
このCF模倣バイオフィルムモデルの限界の一つは、CF痰37 内の自由に浮遊する凝集体ではなく、CF肺には見られないポリカーボネートを含む固体表面への付着である。しかし、ここで紹介した固体寒天モデルは、プランクトン性微生物を除去するためにバイオフィルムを洗浄する必要がなく、混合プランクトン性バイオフィルム培養とは対照的に、バイオフィルム由来の微生物のみが結果に含まれることを保証します。また、このバイオフィルムモデルのより深い領域への一部の抗生物質の浸透を減らすことができ、細胞外マトリックスのレオロジーを変更し、eDNAとの静電相互作用を減らすためにDNaseの使用が必要になる可能性があることもわかりました。
このモデルは、その汎用性、適応性、および多くの既存のモデルが考慮していない環境要因の包含により、抗菌試験に非常に適していると考えています。基礎研究や前臨床の抗菌薬感受性試験に使用することで、臨床サンプルのASTや新規治療法の開発に、より臨床的に適切なアプローチを提供することができます。
開示事項
この作品には、利益相反または競合する金銭的利益は宣言されていません。
謝辞
この研究は、バイオテクノロジーおよび生物科学研究評議会、Innovate UK、Hartree Centre[BB/R012415/1およびBB/X002950/1]、およびUK CF TrustおよびUSA CF Foundation Strategic Research Centre: 'An evidence-based preclinical framework for the development of antimicrobial therapeutics in cystic fibrosis' (PIPE-CF) [Award SRC022]。
資料
| Name | Company | Catalog Number | Comments |
| 1 µL inoculation loops | |||
| 13 mm 0.2 µm pore size polycarbonate discs | Isopore | GTTP01300 | Larger discs are also available |
| 2 mL reinforced tubes | Thermofisher | 15545809 | |
| 2.5 mL ceramic beads | Qiagen | 13114-325 | |
| 500 mL borosilicate glass Duran bottle | Sigma Aldrich | Z305197 | larger bottles available in larger volumes are desired |
| 6-well culture plates | Greiner | 657165 | |
| 7 mL Bijou | Thermofisher | 129B | |
| 96-well plates | Thermofisher | 167008 | for serial dilutions in CFU assay |
| Agar plates for preparing plates of P. aerugnisa, S. aureus, and C. albicans | LB miller for P. aeruginosa and S. aureus and Sabouraud dextrose agar for C. albicans | ||
| Bead beater - suitable for 2 mL tubes | Fisherbrand | 15515799 | Thermofisher bead mill 24 |
| bench top centrifuge | must be capable of at least 8000 x g | ||
| Black clear bottom 96 well plates | Costar | 3603 | |
| Bunsen Burner | |||
| Containers for disposing of contaminated equipment and material according to the institutes health and safety regulations. | |||
| deionised water | |||
| eDNA | Sigma Aldrich | 31149 | |
| Filter unit | Fisherbrand | FB12566504 | Interchangeable depending on the vacuum pump used but must have a pore size of 0.2 µm |
| Haemocytometer and cover slip | Hawksley | HC001 | Haemocytometers may differ in size and volume. Double check and adjust CFU calculations accordingly |
| LB broth | oxoid | 1.46813 | |
| Mannitol salt agar | Oxoid | CM0085B | |
| meropenem | abcr | Ab243429 | |
| Mucin from porcine stomach Type II | Sigma Aldrich | M2378 | |
| Nystatin | Millipore | 1003352658 | |
| petri dishes | SLS | SLS2000 | |
| Phosphate buffered saline | |||
| Pseudomonas isolation agar | Millipore | 17208 | |
| Resazurin sodium salt | Sigma Aldrich | 199303 | |
| Sabouraud dextrose agar | Oxoid | CM0041 | |
| selection of forceps | fine tipped and tissue forceps with teeth for transferring ceramic beads | ||
| serological pipette | |||
| shaking and static incubators | must be temperature controlled | ||
| Sparks microtitre plate reader | Tecan | For Resazurin assay the microtitre plate reader must have the appropriate filters or be a monochromator for detecting flourescence. | |
| spectrophotometer | |||
| Technical agar (Agar Technical No.2 ) | Oxoid | LP0012B | |
| tetracycline | Sigma Aldrich | T7660 | |
| UV crosslinker | Spectroline | 11-992-89 | |
| vacuum pump/ flask | Fisherbrand | FB12566504 | |
| water bath | must be capable of maintaining 55 °C | ||
| YPD broth | Millipore | Y1375 | Can be bought pre-made or made using the base ingredients |
参考文献
- . 2021 Cf foundation patient registry highlights report Available from: https://cysticfibrosis.msu.edu/index.php/welcome/news-and-events/39-2021-cf-foundation-patient-registry-highlights-report (2022)
- Guo, J., Garratt, A., Hill, A. Worldwide rates of diagnosis and effective treatment for cystic fibrosis. J Cyst Fibros. 21 (3), 456-462 (2022).
- Mandal, V., Ghosh, N. N., Mitra, P. K., Mandal, S., Mandal, V. Production and characterization of a broad-spectrum antimicrobial 5-butyl-2-pyridine carboxylic acid from Aspergillus fumigatus nhf-01. Sci Rep. 12 (1), 6006 (2022).
- Françoise, A., Héry-Arnaud, G. The microbiome in cystic fibrosis pulmonary disease. Genes. 11 (5), 536 (2020).
- Grasemann, H., Ratjen, F. Cystic fibrosis. New Engl J Med. 389 (18), 1693-1707 (2023).
- Camus, L., Vandenesch, F., Moreau, K. From genotype to phenotype: Adaptations of pseudomonas aeruginosa to the cystic fibrosis environment. Microb Genom. 7 (3), mgen000513 (2021).
- Rossi, E., et al. Pseudomonas aeruginosa adaptation and evolution in patients with cystic fibrosis. Nat Rev Microbiol. 19 (5), 331-342 (2021).
- Flemming, H. -. C., Wingender, J. The biofilm matrix. Nat Rev Microbiol. 8 (9), 623-633 (2010).
- Grainha, T., Jorge, P., Alves, D., Lopes, S. P., Pereira, M. O. Unraveling pseudomonas aeruginosa and candida albicans communication in coinfection scenarios: Insights through network analysis. Front Cell Infect Microbiol. 10, 550505 (2020).
- Flemming, H. C., et al. Biofilms: An emergent form of bacterial life. Nat Rev Microbiol. 14 (9), 563-575 (2016).
- Høiby, N., Bjarnsholt, T., Givskov, M., Molin, S., Ciofu, O. Antibiotic resistance of bacterial biofilms. Int J Antimicrob Agents. 35 (4), 322-332 (2010).
- Lorusso, A. B., Carrara, J. A., Barroso, C. D. N., Tuon, F. F., Faoro, H. Role of efflux pumps on antimicrobial resistance in Pseudomonas aeruginosa. Int J Mol Sci. 23 (24), 15779 (2022).
- Michaelis, C., Grohmann, E. Horizontal gene transfer of antibiotic resistance genes in biofilms. Antibiotics .(Basel). 12 (2), 328 (2023).
- Worlitzsch, D., et al. Effects of reduced mucus oxygen concentration in airway pseudomonas infections of cystic fibrosis patients. J Clin Invest. 109 (3), 317-325 (2002).
- König, J., Schreiber, R., Voelcker, T., Mall, M., Kunzelmann, K. The cystic fibrosis transmembrane conductance regulator (CFTR) inhibits ENaC through an increase in the intracellular Cl- concentration. EMBO Reps. 2 (11), 1047-1051 (2001).
- Palmer, K. L., Mashburn, L. M., Singh, P. K., Whiteley, M. Cystic fibrosis sputum supports growth and cues key aspects of Pseudomonas aeruginosa physiology. J Bacteriol. 187 (15), 5267-5277 (2005).
- Valenza, G., et al. Prevalence and antimicrobial susceptibility of microorganisms isolated from sputa of patients with cystic fibrosis. J Cyst Fibros. 7 (2), 123-127 (2008).
- Alam, F., Catlow, D., Di Maio, A., Blair, J. M. A., Hall, R. A. Candida albicans enhances meropenem tolerance of Pseudomonas aeruginosa in a dual-species biofilm. J Antimicrob Chemother. 75 (4), 925-935 (2020).
- Burmølle, M., Ren, D., Bjarnsholt, T., Sørensen, S. J. Interactions in multispecies biofilms: Do they actually matter. Trends Microbiol. 22 (2), 84-91 (2014).
- Lories, B., Belpaire, T. E. R., Smeets, B., Steenackers, H. P. Competition quenching strategies reduce antibiotic tolerance in polymicrobial biofilms. NPJ Biofilms Microbiomes. 10 (1), 23 (2024).
- Nabb, D. L., et al. Polymicrobial interactions induce multidrug tolerance in Staphylococcus aureus through energy depletion. Front Microbiol. 10, 2803 (2019).
- Cornforth, D. M., et al. Pseudomonas aeruginosa transcriptome during human infection. Proc Natl Acad Sci U S A. 115 (22), E5125-E5134 (2018).
- Wolter, D. J., et al. Staphylococcus aureus small-colony variants are independently associated with worse lung disease in children with cystic fibrosis. Clin Infect Dis. 57 (3), 384-391 (2013).
- Takagi, J., et al. Mucin o-glycans are natural inhibitors of Candida albicans pathogenicity. Nat Chem Biol. 18 (7), 762-773 (2022).
- Cinical and Laboratory Standard Institute. . Methods for dilution susceptibility tests for bacteria that grow aerobically. 35 (2), (2015).
- Roberts, A. E., Kragh, K. N., Bjarnsholt, T., Diggle, S. P. The limitations of in vitro experimentation in understanding biofilms and chronic infection. J Mol Biol. 427 (23), 3646-3661 (2015).
- Macia, M. D., Rojo-Molinero, E., Oliver, A. Antimicrobial susceptibility testing in biofilm-growing bacteria. Clin Microbiol Infect. 20 (10), 981-990 (2014).
- Coenye, T., Goeres, D., Van Bambeke, F., Bjarnsholt, T. Should standardized susceptibility testing for microbial biofilms be introduced in clinical practice. Clin Microbiol Infect. 24 (6), 570-572 (2018).
- Turner, K. H., Wessel, A. K., Palmer, G. C., Murray, J. L., Whiteley, M. Essential genome of Pseudomonas aeruginosa in cystic fibrosis sputum. Proc Natl Acad Sci U S A. 112 (13), 4110-4115 (2015).
- Miles, A. A., Misra, S. S., Irwin, J. O. The estimation of the bactericidal power of the blood. J Hyg. 38 (6), 732-749 (1938).
- Robertson, S. N., Romero, M., Fenn, S., Kohler Riedi, P. L., Cámara, M. Development, characterization, and evaluation of a simple polymicrobial colony biofilm model for testing of antimicrobial wound dressings. J Appl Microbiol. 135 (3), lxae042 (2024).
- Rumpf, C., Lange, J., Schwartbeck, B., Kahl, B. C. Staphylococcus aureus and cystic fibrosis-a close relationship. What can we learn from sequencing studies. Pathogens. 10 (9), 1177 (2021).
- Tay, W. H., Chong, K. K. L., Kline, K. A. Polymicrobial-host interactions during infection. J Mol Biol. 428 (17), 3355-3371 (2016).
- Orazi, G., O'toole, G. A. "It takes a village": Mechanisms underlying antimicrobial recalcitrance of polymicrobial biofilms. J Bacteriol. 202 (1), e00530-e00519 (2019).
- Arjes, H. A., et al. Three-dimensional biofilm colony growth supports a mutualism involving matrix and nutrient sharing. eLife. 10, e64145 (2021).
- Kasza, K., et al. Ciprofloxacin poly(β-amino ester) conjugates enhance antibiofilm activity and slow the development of resistance. ACS Appl Mater Interf. 16 (5), 5412-5425 (2024).
- Martin, I., Waters, V., Grasemann, H. Approaches to targeting bacterial biofilms in cystic fibrosis airways. Int J Mol Sci. 22 (4), 2155 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved