Method Article
Kistik Fibrozisde Antimikrobiyalleri Test Etmek İçin Polimikrobiyal Koloni Biyofilm Modelinin Geliştirilmesi
Bu Makalede
Özet
Bu metodoloji, araştırma ve klinik laboratuvarlarda antimikrobiyal duyarlılık testi için kistik fibrozda bir polimikrobiyal biyofilm modelinin oluşturulmasına izin verir. Bu model, bir dizi çıktıda doğru ve güvenilir sonuçlar sağlar.
Özet
Antibiyotiklerin test edilmesi için bir dizi bakteri biyofilm modeli mevcuttur. Bununla birlikte, bunların çoğu, koloni oluşturan birimler veya metabolik aktivite gibi tek bir deneysel çıktı ile sınırlıdır. Ayrıca, birçok biyofilm modeli, insan konakçı ortamının biyolojik ve fizyokimyasal özelliklerini yansıtmamaktadır. Bu, birçok durumda önemli bir konudur, ancak en belirgin şekilde kistik fibrozda (KF) görülür. KF'li kişilerin büyük bir kısmı hem kronik hem de aralıklı enfeksiyonlardan muzdariptir ve in vitro, antibiyotik duyarlılık testi hasta tedavi sonuçları ile zayıf bir şekilde ilişkilidir. Bazı biyofilm modelleri, sentetik balgam taklitleri de dahil olmak üzere KF akciğerle ilgili ortamları içerir, ancak biyofilm mimarisini, fizyolojisini ve mikropların tedaviye yanıt verme şeklini değiştiren çevrenin polimikrobiyal doğasını dikkate almaz. Burada açıklanan katı hava arayüzü koloni biyofilm modeli son derece uyarlanabilir ve hem CF ile ilgili ortamı hem de polimikrobiyal bağlamı içerir. Bu model aynı zamanda antimikrobiyallerin orta verimli taraması ve polimikrobiyal dinamikler üzerindeki etkilerini incelemek için de kullanılabilir. Modelden elde edilen çıktı ölçümleri, koloni oluşturan birimler, metabolik aktivite ve konfokal mikroskopi analizi olabilir. Model, farklı mikroorganizmalara, ortamlara, sıcaklıklara ve değişken oksijen koşullarına kolayca uyarlanabilir ve çok çeşitli kimyasal, biyolojik ve fiziksel işlemleri test etmek için kullanılabilir.
Giriş
Kistik fibroz (KF), Birleşik Krallık'ta 11.000'den fazla kişiyi ve dünya çapında 162.000 kişiyi etkileyen genetik bir durumdur 1,2. KF çok organlı bir hastalık olmasına rağmen, kistik fibrozisli (pwCF) kişilerin yaşadığı önemli bir semptom, solunum yollarında anormal derecede kalın, susuz mukus oluşumudur3. Bu, kirpiklerin atılmasının azalmasıyla birlikte, çok çeşitli bakteri, mantar, virüs ve arkeler tarafından akciğerlerin kolonizasyonunu artırabilir 4,5. KF akciğerinin mikroorganizmaların büyümesini ve hayatta kalmasını sınırlamak için koşullar ve seçici baskılar sağlamasına rağmen, Pseudomonas aeruginosa gibi bakteriler bu zorlu ortamlara oldukça adapte olmuştur6. Bu, hem kolonizasyona hem de sağkalıma izin vererek kalıcı kronik enfeksiyonların oluşumuna neden olur7.
Bu kronik enfeksiyonlara neden olan mikropların çoğu, başlangıçtaki planktonikten biyofilm büyüme tarzına fenotipik bir kayma kullanarak, yüzeye bağlı veya agregalar halinde7 yapar. Bu biyofilmler, polisakkaritler, proteinler, lipitler ve çevresel DNA (eDNA) dahil olmak üzere çeşitli bileşenlerden oluşan bir ekzopolisakkarit (EPS) matrisi ile kaplanmış sıkıca paketlenmiş bakteri toplulukları ile karakterize edilir8. Bu matris, mikroorganizmalar arasında ortak bir özelliktir; Bununla birlikte, bileşimi farklı olabilir. Örneğin, bakteriyel P. aeruginosa matrisinin ana polisakkarit bileşenleri, ana polisakkarit matris bileşenleri mannanlar ve glukanlar9 olan Candida albicans mantarlarından farklı olarak Psl, Pel ve aljinattır. Tek tür biyofilmlerde, bu matris, antibiyotiklerin biyofilme nüfuzunu azaltarak ve etkinliklerini azaltarak planktonik ile karşılaştırıldığında antibiyotik toleransını büyük ölçüde etkileyebilir10. Biyofilm büyüme tarzı aynı zamanda planktonik muadillerine kıyasla azalmış metabolik aktiviteye sahip kalıcı hücrelerin oluşumunu indükler ve bu nedenle antibiyotiklere duyarlılığı daha da azaltır11. Bu büyüme tarzı aynı zamanda, akış pompaları ve yatay gen transferi için gerekli olanlar gibi bazı antibiyotik direnç mekanizmalarının yukarı regülasyonu ile karakterize edilir ve direnç genlerinin 11,12,13 değişimini sağlar. Bunlara ek olarak, konakçının hastalıkla ilgili ortamı, mikrobiyal fizyolojiyi ve antibiyotiklere yanıt verme şeklini çok etkiler. Bu, kalın mukus içindeki artan mikro-aerobiyozun yanı sıra, konakçıdan türetilen veya akciğer ürünlerinin mikrobiyal bozunmasından kaynaklanan amino asitler ve eDNA gibi standart olmayan karbon kaynaklarının mevcudiyetini içerir 14,15,16.
Bu spesifik etkileşimler, sadece bakteriler arasında değil, aynı zamanda bakteriler ve mantarlar arasında da karmaşık etkileşimlerle ek bir karmaşıklık katmanı oluşturan biyofilmlerin polimikrobiyal doğası ile daha da karmaşıklaşır. Bakteriyel biyofilmlerle karşılaştırıldığında, C. albicans'ın CF15'li kişilerin %75'inden fazlasından izole edilmesine rağmen, bakteri ve mantar biyofilmleri arasındaki bazı etkileşimler hakkında daha az şey bilinmektedir. Genel olarak, C. albicans ve P. aeruginosa gibi bakteriler arasındaki etkileşimler antagonistiktir, ancak daha kronik ve şiddetli enfeksiyonlara neden olabilir18. Hem patojenik hem de kommensal mikrobiyal etkileşimlerin yanı sıra KF ile ilişkili bir dizi çevresel faktörün kombinasyonu, sonuçta antibiyotik toleransının artmasına neden olabilir 19,20. Bu faktörlerin çoğu, mevcut modellerde artmış antibiyotik toleransına atfedilmesine rağmen, klinik öncesi antibiyotik testinde sıklıkla dikkate alınmamaktadır21.
Bu koşulların in vitro olarak özetlenmesi de zordur ve sonuç olarak, birçok model, P. aeruginosa22'de beta-laktamaz üretimini artıranlar, Staphylococcus aureus'ta küçük koloni varyantlarının indüksiyonu ve C. albicans'ta tirelemenin inhibisyonu; bunların tümünün KF balgamında meydana geldiği gösterilmiştir23,24.
Bu nedenle, disk difüzyonu, Etest ve CLSI et suyu mikrodilüsyon deneyleri ile Mueller-Hinton gibi standartlaştırılmış ortamlarda planktonik veya agar plakasında yetiştirilen kültürlere dayanan mevcut antibiyotik duyarlılık test yöntemlerinde kullanılan koşullar ile konakçı ortamda karşılaşılan koşullar arasında büyük bir eşitsizlik vardır25. Bu genellikle antibiyotik duyarlılığını doğru bir şekilde belirlemede başarısız olur26. Bu sorun, antimikrobiyal biyofilm testinde standardizasyon eksikliği nedeniyle daha da karmaşık hale gelmekte ve antimikrobiyal etkinliğin laboratuvardan kliniğe doğru bir şekilde aktarılmasını zorlaştırmaktadır27,28.
Burada geliştirdiğimiz polimikrobiyal model, Pseudomonas aeruginosa'nın meropenem ve tobramisin dahil olmak üzere bir dizi antimikrobiyale karşı gelişmiş toleransını göstermektedir. Bu, mono-tür biyofilmler kullanılarak yapılan mevcut antimikrobiyal testler ile minimum inhibitör konsantrasyonları belirlemek için bu çalışmada geliştirilen polimikrobiyal biyofilm modeli arasındaki büyük varyasyonu göstermektedir. Bu model aynı zamanda antimikrobiyal testler için arzu edilen nispeten yüksek bir verim ve düşük maliyet sağlar. Model ayrıca, antimikrobiyal tedavinin polimikrobiyal dinamikler üzerindeki etkisini incelemek ve belirli bir tedavinin belirli bir patojenin baskın hale gelmesine yol açıp açmayacağını belirlemek için de kullanılabilir ve bu da daha fazla komplikasyonun tahmin edilmesini sağlar. Bu model karmaşık biyofilmlerin oluşturulmasına izin vermesine rağmen, kurulumu karmaşık laboratuvar ekipmanı gerektirmez ve çok çeşitli klinik ve araştırma çıktıları için bir platform sağlar.
Protokol
1. Sentetik Kistik Fibrozis Ortamı-2 (SCFM2) ve plaklarının hazırlanması
- SCFM2'yi Palmer ve ark.16'da açıklanan tarife göre 500 mL'lik bir borosilikat cam şişede birkaç değişiklikle 2x konsantrasyonda yapın.
- Stokları Tablo 1'de belirtildiği gibi tartın ve hazırlayın. Amino asit stoklarını Tablo 2'ye göre hazırlayın.
- 200 mL borosilikat cam şişede 100 mL dH2O içinde 5 g müsin (Domuz midesinden (Tip II)) ve 600 mg eDNA (somon sperminden) tartın. Otoklavlama ile sterilizasyondan önce gece boyunca 4 °C'de karıştırın.
- 500 mL'lik sterilize edilmiş bir şişeye 0.54 g glikoz, 6.06 g NaCl ve 2.228 g KCl ekleyin. Adım 1.1.1'de hazırlanan stokların her birine 10 mL ekleyin. 1 M NaOH veya HCl kullanarak pH'ı 6,9'a ayarlayın.
- 10 mL dH2O ve ardından 10 mL 0.175 M CaCl2 ve 0.0606 M MgCl2 ekleyin. 10 mL 0.93 M L-laktik asit hazırlayın ve ekleyin. Kullanmadan hemen önce 10 mL 0.36 mM Fe(III)SO47H2Oekleyin
- Filtre: Bir filtre ünitesi ve vakum pompası kullanarak SCFM2'yi sterilize edin, ardından otoklavlanmış müsin ve eDNA'yı ekleyin.
NOT: Hazırlanan SCFM2 4 °C'de 1 aya kadar saklanabilir.
- SCFM2 agar plakalarını aşağıda açıklandığı gibi hazırlayın.
- 25 mL önceden eritilmiş %3 (a/h) teknik agar ile karıştırmadan önce 50 mL'lik bir tüpte 25 mL 2x SCFM2'yi 55 °C'lik bir su banyosunda önceden ısıtın, 1x SCFM2 ve %1,5 (a/h) teknik agar karışımı elde edin.
- Serolojik bir pipet kullanarak, karışımın 5 mL'sini 6 oyuklu bir plakanın her bir oyuğuna aktarın.
- Gözenek boyutu 0,2 μm olan aynı sayıda 13 mm polikarbonat diski, bir Petri kabının dibine yerleştirerek ve 254 nm dalga boyunda ve 60 Hz frekansta 600 s boyunca UV-C uygulayarak hazırlayın. Diskleri ters çevirin ve UV-C prosedürünü tekrarlayın.
- 1x SCFM2-1.5 % (a/h) teknik agar sertleştikten sonra, 6 oyuklu plakanın her bir oyuğunun yüzeyine tek bir polikarbonat disk eklemek için steril forseps kullanın.
2. Bakterilerin enfeksiyon için hazırlanması
- Modeli kurmadan önce, P. aeruginosa PAO1, S. aureus SH1000 ve C. albicans SC5314 için laboratuvarda kullanılan standart agar'a göre gerekli bakteri ve mantar suşları için agar plakaları hazırlayın (örneğin, bakteriler için %1,2 (a/h) agar içeren Lizojeni suyu ve C. albicans için Sabouraud dekstroz agar).
NOT: Modeli oluşturmak için özel laboratuvar referans suşları kullanılmıştır. Bununla birlikte, bu model, daha yavaş büyüyen suşlar için tedaviden önce biyofilm oluşturma süresinin arttırılması gibi bazı modifikasyonlarla klinik izolatlar da dahil olmak üzere diğer suşlarla da kullanılmıştır. - 5 mL standart laboratuvar sıvı ortamını aşılamak için her mikroorganizmadan tek bir koloniyi seçmek için 1 μL'lik bir aşılama döngüsü kullanın (ör., P. aeruginosa, S. aureus için Lizojeni suyu ve C. albicans için Maya pepton dekstroz (YPD)). Bu kültürleri, bakteriler için 37 ° C'de 200 rpm'de ve C. albicans için 200 rpm, 30 ° C'de üstel büyüme aşamasına ulaşana kadar inkübe edin.
NOT: Havalandırma, çalkalama inkübatörüne ve dönme yarıçapına bağlı olarak farklılık gösterecektir.
3. Katı hava arayüz modelinin kurulması
NOT: Modelin genel bir şematik gösterimi Ek Şekil 1'de görülebilir.
- Her sıvı kültürün 1 mL'sini ayrı bir steril 1.5 mL tüpe aktarın ve bakteri / mantarları peletlemek için 8.000 x g'da 2 dakika santrifüjleyin. Bunu ve sonraki tüm santrifüj adımlarını oda sıcaklığında gerçekleştirin.
- Süpernatanı bir pipet kullanarak aspire edin ve santrifüjlemeden önce peletleri 1 mL PBS'de bir kez daha 8.000 x g'da 2 dakika boyunca yeniden süspanse edin.
- Süpernatanı daha önce olduğu gibi çıkarın ve peletleri 1 mL PBS'de yeniden süspanse edin. Yeniden süspanse edilmiş P. aeruginosa ve S. aureus hücrelerini PBS'de 1:10 oranında seyreltin ve 600 nm dalga boyunda bir spektrofotometre kullanarak optik yoğunluğu ölçün.
- P. aeruginosa için 0,05 ve S. aureus için 0,1 olan bir OD600'ün 1 x 108 CFU/mL'ye eşdeğer olduğuna dair önceki doğrulamaya dayalı olarak yıkanmış numuneleri 1 x 108 koloni oluşturma birimi (CFU)/mL'ye ayarlayın.
- C. albicans için, yıkanmış numuneleri PBS'de 1:100 oranında seyreltin, bir hemositometrenin iki ayrı odasına her birinden 10 μL ekleyin ve odanın sabit boyutlarını ve CFU / mL'yi hesaplamak için kullanılan seyreltmeyi kullanın. Geliştirilmiş Neubauer hemositometre kullanılarak hesaplama aşağıdaki gibi olacaktır:
Hücre sayısı = ortalama hücre sayısı × 10.000 / (seyreltme faktörü) - Hesaplanan CFU'lar, önceden seyreltilmiş numunede C. albicans CFU/ mL'yi temsil eder. C. albicans örneğini bakteri kültürlerinde olduğu gibi PBS'de 1 x 108 CFU/mL'ye ayarlayın.
- İnokulumu biyofilme eklenmek üzere hazırlamak için, P. aeruginosa inoculum'u 1 x 104 CFU/mL'ye (2x 100 kat seyreltme), C. albicans'ı 1 x 105 CFU/mL'ye (100 kat seyreltme ve ardından 10 kat seyreltme) ve son olarak, S. aureus'u PBS kullanarak 1 x 106 CFU/mL'ye (100 kat seyreltme) ayarlayın.
- Tek tür biyofilmler için, daha önce 1x SCFM2-1.5 % teknik agar altı oyuklu plakalara yerleştirilmiş polikarbonat diskin merkezine 10 μL seyreltilmiş istenen mikrop ekleyin ve tedavi veya bozulmadan önce 24 saat boyunca 37 ° C'de statik olarak inkübe edin.
- Polimikrobiyal biyofilmler için, her birinden 10 μL'lik S. aureus ve C. albicans aynı disk üzerinde üst üste ekleyin. Aşılanmış diski 37 ° C'de 24 saat statik olarak inkübe edin.
NOT: S. aureus ve C. albicans aşılarının eklenme sırası, modelin gelişimini etkilemez ve aynı sonuçları verir. - Bunu takiben, polikarbonat diskleri steril forsepsli taze 1x SCFM2-1.5% teknik agar plakalarına aktarın ve önceden belirlenmiş S. aureus - C. albicans biyofilminin üzerine 1 x 104 CFU/mL P. aeruginosa seyreltmesinden 10 μL ekleyin. 37 °C'de 24 saat daha inkübe edin.
NOT: P. aeruginosa , S. aureus ve C. albicans'tan 24 saat sonra, bu organizmaların KF'li kişilerde KF akciğerini sıklıkla kolonize etme sırasını yansıtmak için eklenir. Bu aynı zamanda P. aeruginosa'nın diğer iki mikroorganizmayı aşmasını da önler. P. aeruginosa eklendikten sonra, biyofilm 24 saatten daha uzun süre büyütülebilir; Bununla birlikte, biyofilmli polikarbonat diskin her 24 saatte bir yeni ortama aktarılması gerekir. Bozulmadan önce, biyofilmler, floresan proteinleri, floresan boyaları veya suş / mikrop spesifik antikorları eksprese eden suşlar kullanılarak mikroskopi için kullanılabilir. Bununla birlikte, bazı boyaların polikarbonat diski lekelediğini belirtmekte fayda var.
4. Biyofilm bozulması
- Plakalara 2,8 mm çapında seramik boncuklar ekleyin ve plakaları adım 1.3'te açıklandığı gibi UV çapraz bağlayın. Alevle sterilize edilmiş forseps kullanarak steril 2 mL'lik bir homojenizatör tüpüne 5 seramik boncuk ekleyin. Ardından, 2 mL homojenizasyon tüpüne 1 mL fosfat tamponlu salin (PBS) pipetleyin.
- Vorteks tüpleri en az 10 saniye boyunca veya biyofilm polikarbonat diskten çıkarılana kadar, görsel inceleme ile belirlenir, bu noktada polikarbonat diski çıkarın.
- Boncuklu tüpleri homojenizatöre yerleştirin ve vuruşlar arasında 10 sn aralıklarla 6 m/s'de 10 sn boyunca 2x çırpın.
NOT: Boncuklar, çırpma süresi ve homojenizatör kullanımının bu kombinasyonu, mikroskopi ve koloni oluşturan birimler tarafından belirlendiği gibi minimum lizis ile biyofilmin yeterli şekilde bozulmasına neden olur. Bu, kullanılan özel boncuk çırpıcıya bağlı olarak değişebilir. - Bozulmuş biyofilmi homojenizatör tüpünden 4 mL PBS içeren 7 mL'lik bir bijou'ya dökün, böylece 5 mL'lik bir nihai hacim elde edin.
- Tüpleri 2 dakika boyunca 8.000 x g'da santrifüjleyerek ve kalan sıvıyı 7 mL bijou'ya aktararak homojenizatör tüplerindeki tüm sıvının bijou'ya aktarıldığından emin olun.
NOT: Bu 5 mL bozulmuş biyofilmden bir dizi test yapılabilir, ancak herhangi bir hesaplama için 1 mL biyofilm PBS seyreltmesini 5 mL'lik bir nihai hacme hatırlamak önemlidir.
5. Metabolik aktivite testi
- Yukarıdaki 4. adımdan itibaren 200 μL bozulmuş biyofilmi şeffaf tabanlı siyah 96 oyuklu bir plakaya ekleyin. Daha sonra 10 μL% 0.02 (a/h) resazurin çözeltisi ekleyin.
- Resazurinle muamele edilmiş biyofilmi bir plaka okuyucu ile inkübe edin ve metabolik aktiviteyi okuyun. Plakayı 37 °C'de inkübe edin, herhangi bir floresan okuması yapmadan önce 200 rpm'de 10 saniye boyunca her 30 dakikada bir yörünge sallama uygulayın.
- 540 nm'lik bir uyarma ve 590 nm'lik bir emisyon kullanarak floresansı ölçün. Bir plaka okuyucu kullanarak bu 30 dakikalık döngüyü 4 saat boyunca tekrarlayın.
NOT: 4 saatlik zaman noktası, tedavi edilmiş ve edilmemiş numuneler arasında ve değişen antibiyotik konsantrasyonlarına sahip numuneler arasında daha belirgin farklılıklar sağladığı için kullanılır.
6. Antimikrobiyal duyarlılık testi
- Standart antibiyotiklerin antimikrobiyal toleransını test etmek için, tercih edilen antibiyotikleri ilgili çözücülerinde çözündürün ve bunu, altı oyuklu bir plakanın her bir oyuğuna 5 mL aktarmadan önce hala sıvı iken 1x SCFM2-1.5% (a/h) teknik agar ortamına ekleyin. Sertleştikten sonra, polikarbonat disk üzerinde büyütülen biyofilmi steril forseps kullanarak antibiyotik içeren ortamın üstüne aktarın ve biyofilmin üstüne karşılık gelen antibiyotik konsantrasyonundan 10 μL'lik bir damla ekleyin.
NOT: Bu çalışma için, klinik olarak anlamlı konsantrasyonları yansıtmak için 64 μg / mL ile 0.125 μg / mL meropenem ve tobramisin arasında 2 log katlı seri seyreltme kullanılmıştır. Antibiyotiklerin veya diğer antimikrobiyal / anti-virülans tedavilerinin yalnızca biyofilmin üzerine uygulanması yeterlidir, çünkü hem ortama hem de biyofilm üzerine eklendiğinde benzer tepkiler gözlenmiştir. - Tedavi ile 37 ° C'de 24 saatlik inkübasyondan sonra, görüntü biyofilmleri ve adım 4'te anlatıldığı gibi bozun.
- 5 mL bozulmuş kültürden, bir alikot alın ve PBS kullanarak 10 kat seri seyreltme gerçekleştirin. Miles ve Misra yöntemini 30 kullanarak koloni oluşturan birimleri belirlemek için agar üzerinde üç kopya halinde10 μL'lik lekeler açın.
NOT: Agar plakalarına eklenen hacim algılama sınırını etkileyecektir, daha büyük hacimler algılama sınırını azaltacaktır ancak daha fazla numune ve agar plakası gerektirecektir. - Tek tür biyofilmler için, P. aeruginosa ve S. aureus'u LB agar plakalarına ve C. albicans'ı SDA agar üzerine sürün.
- Polimikrobiyal biyofilmler için, üç türün her birini izole etmek ve CFU'ların belirlenmesini sağlamak için alikotları antibiyotik içeren üç farklı seçici ortama yerleştirin. Bu, sırasıyla P. aeruginosa ve S. aureus'u izole etmek için 10 μg/mL'de nistatin içeren Pseudomonas izolasyon agar ve mannitol tuz agar ve C. albicans'ı izole etmek için 125 μg/mL'de tetrasiklin ile Sabouraud dekstroz agarını içerir. S. aureus plakalarını gece boyunca 37 °C'de ve P. aeruginosa ve C. albicans plakalarını 30 °C'de inkübe edin.
NOT: Koloni büyümesini en aza indirmek ve kaynamayı azaltmak için P. aeruginosa plakalarını 30 °C'de inkübe edin.
Sonuçlar
Katı hava arayüzü biyofilm modelinin basitliği, aynı anda klinik olarak ilgili farklı koşullar altında çok sayıda antimikrobiyalin taranmasını sağlar. Bu model, hem mono hem de polimikrobiyal biyofilmlerde CFU sayımları ve metabolik testler kullanılarak antibiyotiklerin etkinliğinin değerlendirilmesine bir hafta içinde gerçekleştirilmesine olanak tanır. Modelin doğası gereği, ortam bileşiminin değiştirilmesi ve biyofilmlerin düşük oksijen ve anaerobik koşullar altında yerleştirilmesi gibi çevresel koşulların kolayca manipüle edilmesine de izin verir. Bu modeli kullanarak, mono-türler ve polimikrobiyal biyofilmler halinde yetiştirilen P. aeruginosa arasında pwCF'de yaygın olarak kullanılan iki antibiyotiğe toleranstaki değişiklikleri gösterdik (Şekil 1). Bunun yanı sıra, antimikrobiyal tedavinin polimikrobiyal biyofilmler içindeki popülasyon dinamiklerini nasıl etkileyebileceğini belirleyebildik (Şekil 2).
Bu deneyleri gerçekleştirmek için, ilk aşılama yukarıdaki protokolde belirtildiği gibi hazırlandı, bu da tekrarlanabilir CFU/mL ve bir veya iki yönlü ANOVA ile belirlenen küçük standart sapmalara sahip stabil mono türlerin ve polimikrobiyal biyofilmlerin oluşumuna yol açtı. Bu model aynı zamanda tutarlı büyüme ve CFU geri kazanımını vurgulamanın yanı sıra, bu klasik mikrobiyoloji tekniklerini, karmaşık işlemlere ihtiyaç duymadan bu çalışmada gerçekleştirilmeyen diğer tekniklerle birleştirme olasılığına izin verdi. Bunlar, diğer üç boyutlu modellerin bu kadar erişilebilir bir şekilde sunamadığı canlı/ölü, matris görselleştirme ve moleküler analiz gibi görüntülemeyi içerir (Şekil 1)31. Veriler CFU/mL'ye kıyasla sağkalım yüzdesi olarak görüntülendiğinde CFU/mL için beklenen standart sapmanın arttığına dikkat edilmelidir (Şekil 1). Mono türler ve polimikrobiyal biyofilmler arasındaki antibiyotik tedavisinin etkinliği karşılaştırıldığında,% 50 öldürme elde etmek için gereken tüm antibiyotik konsantrasyonlarında önemli bir artış olmuştur. Meropenem ve tobramisin için bu öldürme seviyesini elde etmek için antibiyotik konsantrasyonunda 2 log'luk bir artışa ihtiyaç vardı (Şekil 1). 64 μg / mL tobramisin ile tedavi edildiğinde polimikrobiyal biyofilmde S. aureus ve C. albicans varlığında P. aeruginosa sağkalımında genel bir artış olmuştur, oysa bunun tersi meropenem için geçerliydi.
Metabolik aktiviteyi belirlemek için kullanılan yöntem, her bir türden bireysel katkıyı ayırt edemeden tüm polimikrobiyal biyofilmin genel aktivitesini ölçer. Bu nedenle, bu model için metabolik aktivite deneylerinin kullanımını göstermek için yalnızca tek tür metabolik değişiklikler gösterilmiştir. Mono tür biyofilmler için, P. aeruginosa sağkalımı ile hem meropenem hem de tobramisin için metabolik aktivite arasında güçlü bir ilişki vardı (Şekil 2). Aynı numunelerden hem metabolik aktivitenin hem de CFU sayımlarının kullanılması, hem bakteriyostatik hem de bakterisidal etkilerin kolayca tanımlanmasını sağlar. Polimikrobiyal biyofilmler için, metabolik aktivitenin belirlenmesi, bir türün hedeflenmesinin biyofilm metabolik aktivitesinde genel bir artışa neden olabileceğini ve dolayısıyla diğer türlerin mikrobiyal büyümesini potansiyel olarak nasıl artırabileceğini gösterebilir.
CFU'lar antimikrobiyal duyarlılık testi için altın standart olmasına rağmen, polimikrobiyal biyofilmlerde biyofilm içindeki tür kompozisyonunun değerlendirilmesine de izin verirler. P. aeruginosa'yı polimikrobiyal biyofilmlerde tedavi ederek, sadece bu organizma için artmış MBEC50'yi göstermekle kalmıyor, aynı zamanda bunun diğer birlikte izole edilmiş türler üzerindeki etkisini de ortaya koyuyoruz (Şekil 3). Bu, örneğin, P. aeruginosa'nın azalmasına S. aureus ve C. albicans CFU'da bir artış eşlik ettiği ve S. aureus'un belirli antibiyotik konsantrasyonlarına maruz kaldığında en yaygın organizma haline geldiği meropenem (antipseudomonal) ile görülür (Şekil 3A). Bu, belirli bir patojeni tedavi ederken hastalığa neden olan diğer türlerin popülasyon büyüklüğündeki potansiyel artış nedeniyle biyofilmin polimikrobiyal doğasının dikkate alınmasının önemini vurgulamaktadır.
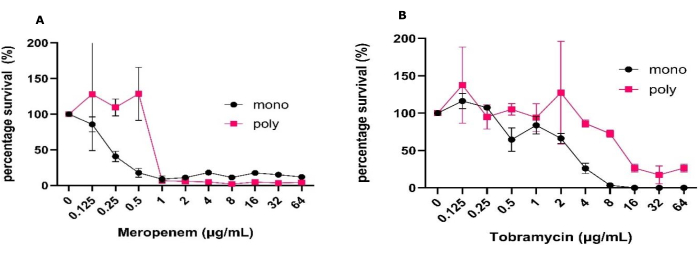
Şekil 1: Katı hava arayüz modelinde büyütülen mono ve polimikrobiyal biyofilmler arasında P. aeruginosa'nın meropenem ve tobramisine karşı antimikrobiyal toleransındaki değişim. S. aureus ve C. albicans ile mono veya polimikrobiyal biyofilmlerde büyütülen P. aeruginosa PAO1, SCFM2'de 24 saat boyunca katı hava arayüz modelleri kullanılarak kurulmuştur. Biyofilmler, antibiyotik kontrolü olmadan 0.125 μg/mL ila 64 μg/mL arasında (A) meropenem veya (B) tobramisin konsantrasyonları ile tedavi edildi. Her bir biyofilmin CFU/mL'si belirlendi. P. aeruginosa CFU'lar PIA'da belirlendi ve %100 sağkalım olarak negatif kontrol kullanılarak yüzde sağkalıma dönüştürüldü. Hata çubukları standart sapmayı gösterir ve her veri noktası, her biri üç teknik tekrara sahip 3 biyolojik tekrardan türetilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Katı hava arayüz modelinde büyütülen meropenem veya tobramisin varlığında P. aeruginosa biyofilmlerinin metabolik aktivitesindeki değişim. P. aeruginosa PAO1 biyofilmleri, katı hava arayüz modelinde SCFM2 üzerinde büyütüldü ve antibiyotik kontrolü ile birlikte 0.125 μg / mL ila 64 μg / mL arasında bir dizi (A) meropenem veya (B) tobramisin konsantrasyonu eklendi. Plaka, her 30 dakikada bir 540 nm'lik bir uyarılma ve 590 nm'lik bir emisyonda floresan olarak okundu. Metabolik aktivite yüzdesi, antibiyotik kontrolü yapılmayan her bir antibiyotik ile tedavi edilen numunede bu aktivitenin yüzdesi belirlenerek hesaplandı. Hata çubukları standart sapmayı gösterir ve her veri noktası, her biri üç teknik tekrara sahip 3 biyolojik tekrardan türetilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
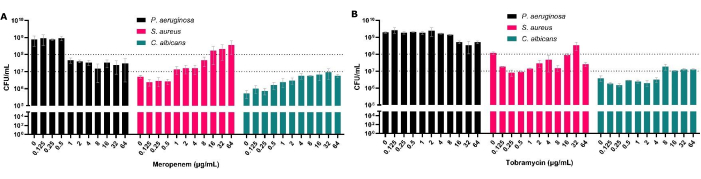
Şekil 3: Antimikrobiyal tedaviyi takiben polimikrobiyal katı-hava arayüz modelinden geri kazanılan P. aeruginosa, S. aureus ve C. albicans'ın toplam CFU sayıları üzerindeki etkisi. S. aureus ve C. albicans, katı hava arayüz modelinde SCFM2'de büyütüldü. P. aeruginosa ilave edildi ve antibiyotiksiz kontrolün yanı sıra biyofilmlere 0.125 μg/mL ila 64 μg/mL konsantrasyonlarda (A) meropenem veya (B) tobramisin eklendi. Her bir biyofilmin CFU/mL'si belirlendi. Hata çubukları standart sapmayı gösterir ve her veri noktası, her biri üç teknik tekrara sahip 3 biyolojik tekrardan türetilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Şekil 1: Katı hava arayüz modelinin kurulması ve iş akışı. Katı hava arayüz modelinin kurulması, biyofilm bozulması ve çıkışlarının grafiksel gösterimi. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Burada açıklanan biyofilm modeli, CDC reaktörü ve Lubbock biyofilm modeli31 gibi in vitro antimikrobiyal test yöntemlerinden daha erişilebilir bir şekilde bir dizi yaygın polimikrobiyal etkileşimi bir araya getirerek KF akciğer enfeksiyonu ortamının bazı yönlerini taklit etmemizi sağlar. Bu, biyofilmin fiziksel özellikleri, besin mevcudiyeti ve biyofilm içindeki türler arasındaki moleküler etkileşimler dahil olmak üzere bir dizi faktörün hem antimikrobiyal ajanın aktivitesini hem de mikropların antimikrobiyal21'e tepkisini etkileyebileceği durumlarda önemlidir. Bu faktörleri bir araya getirerek, yukarıda belirtilen faktörleri dikkate almayan mevcut modellere göre antimikrobiyal tedavi sonuçlarının tahmin edilmesini daha doğru bir şekilde sağlayabilecek çok yönlü bir model geliştirebildik.
P. aeruginosa, S. aureus ve C. albicans temsili Gram-pozitif, Gram-negatif ve CF32'de yaygın olarak izole edilen mantarlar olarak seçildi. Bununla birlikte, bu modelin Burkholderia cenocepacia, Burkholderia multivorans, Aspergillus fumigatus dahil olmak üzere bir dizi başka CF ile ilgili mikrop için kullanılabileceğini ve şu anda Prevotella melaninogenica gibi anaerobik bakterilerle kullanım için uyarlandığını da gösterebildik. Bu, çok çeşitli mikropların dahil edilebileceği için modelin çok yönlülüğünü gösterir ve bu modelin çok çeşitli mikrobiyal patojenlere karşı antimikrobiyal testler için uyarlanabilirliğini vurgular. Model ayrıca, SCFM2'nin hastadan alınan balgam ile değiştirilmesi de dahil olmak üzere daha kişiselleştirilmiş antimikrobiyal duyarlılık testi için bir dizi çevresel koşula kolayca uyarlanabilir.
Yeni antimikrobiyallerin test edilmesi için polimikrobiyal biyofilm modellerinin dikkate alınması da çok önemlidir, çünkü hayvan veya insan çalışmalarında kullanılmadan önce antimikrobiyal geliştirme hattındaki mevcut bir boşluğu kapatabilirler33,34. Bunun yanı sıra, model nispeten yüksek bir verim sağlar ve hem endüstri hem de araştırma ile ilgili bir dizi çıktıya izin verir.
Bu yöntem makalesinde sadece CFU'ları ve metabolik aktiviteyi örneklemiş olsak da, sıvı ekstraksiyon yüzey analizi kütle spektrometresi (LESA) kullanılarak biyofilm ekzo-metabolomunun analizinde modelin faydasını da gösterdik. Bu, antimikrobiyal toleransı destekleyen bazı moleküler mekanizmaların araştırılmasına izin verir35. Bu diğer çıktılara ek olarak, bu modelin yeni antimikrobiyal dağıtım sistemlerini test etmek için kullanımını da gösterdik. Bunlar, bu antibiyotiğin biyofilm içine penetrasyonunu arttırırken, aktivitesini arttırırken ve direnç gelişimini azaltırken polimer-siprofloksasin konjugatlarını içerir36.
Kritik adımlar ve dikkat edilmesi gerekenler
Kontaminasyon, doğal olarak oluşmayan türlerin ortaya çıkmasına neden olabileceğinden ve bu da sonuçlara müdahale edebileceğinden, özellikle SCFM2 ve besiyeri üretirken steriliteyi korumak önemlidir. Aynı mikrobun ve farklı mikropların farklı suşları, büyüme için farklı çevresel koşullar gerektirebilir veya farklı büyüme özelliklerine sahip olabilir. Bu nedenle, herhangi bir antibiyotik duyarlılık testi yapılmadan önce model optimize edilmelidir. Standart model koşulları altında büyümeyi değerlendirmek için mono türler ve polimikrobiyal biyofilm için 24 saat ve 48 saatlik küçük bir pilot çalışma yapılmasını öneririz. Farklı P. aeruginosa suşlarının ve belirli antibiyotik konsantrasyonlarının polikarbonat diskten kaynamaya neden olabileceğini bulduk. Bu, ticari olarak temin edilebilen daha büyük boyutlu diskler kullanılarak kolayca aşılabilir. Biyofilm bozulması, boncuk çırpıcıya ve kullanılan mikroplara bağlı olarak optimizasyon da gerektirebilir. Boncuk çırpma işleminden önce ve sonra bilinen bir numunenin CFU/mL'sini belirleyerek bozulma yöntemini optimize ettik. Biyofilmin ne kadar iyi bozulduğunu görselleştirmek için boncuk vuruş örneklerini görselleştirmek için mikroskopi de kullandık.
Bu CF'yi taklit eden biyofilm modelinin sınırlamalarından biri, CF balgamı37 içinde serbest yüzen agregalar olmaktan ziyade, CF akciğerinde bulunmayan polikarbonat içeren katı bir yüzeye bağlanmasıdır. Bununla birlikte, burada sunulan katı agar modeli, planktonik mikropları uzaklaştırmak için biyofilmlerin yıkanması ihtiyacını ortadan kaldırır ve sonuçların, karışık bir planktonik biyofilm kültürünün aksine, yalnızca biyofilmden türetilen mikropları içermesini sağlar. Ayrıca, bazı antibiyotiklerin bu biyofilm modelinin daha derin bölgelerine nüfuz etmesinin azaltılabileceğini ve hücre dışı matrisin reolojisini değiştirmek ve eDNA ile elektrostatik etkileşimleri azaltmak için DNaz kullanımının gerekli olabileceğini bulduk.
Modelin, çok yönlülüğü, uyarlanabilirliği ve mevcut birçok modelin hesaba katmadığı çevresel faktörleri içermesi nedeniyle antimikrobiyal test için son derece uygun olduğuna inanıyoruz. Temel araştırmalarda ve klinik öncesi antimikrobiyal duyarlılık testlerinde kullanımı, klinik örneklerin AST ve yeni terapötiklerin geliştirilmesi için klinik olarak daha ilgili bir yaklaşım sağlayabilir.
Açıklamalar
Bu çalışma için herhangi bir çıkar çatışması veya çatışan finansal çıkar beyan edilmemiştir.
Teşekkürler
Bu çalışma, Biyoteknoloji ve Biyolojik Bilimler Araştırma Konseyi, Innovate UK ve Hartree Merkezi [Ödüller BB/R012415/1 ve BB/X002950/1] tarafından finanse edilen bir İnovasyon ve Bilgi Merkezi olan Ulusal Biyofilm İnovasyon Merkezi (NBIC) ve UK CF Trust ve USA CF Foundation Stratejik Araştırma Merkezi tarafından finanse edilmiştir: 'Kistik fibrozda antimikrobiyal terapötiklerin geliştirilmesi için kanıta dayalı bir klinik öncesi çerçeve' (PIPE-CF) [Ödül SRC022].
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 µL inoculation loops | |||
| 13 mm 0.2 µm pore size polycarbonate discs | Isopore | GTTP01300 | Larger discs are also available |
| 2 mL reinforced tubes | Thermofisher | 15545809 | |
| 2.5 mL ceramic beads | Qiagen | 13114-325 | |
| 500 mL borosilicate glass Duran bottle | Sigma Aldrich | Z305197 | larger bottles available in larger volumes are desired |
| 6-well culture plates | Greiner | 657165 | |
| 7 mL Bijou | Thermofisher | 129B | |
| 96-well plates | Thermofisher | 167008 | for serial dilutions in CFU assay |
| Agar plates for preparing plates of P. aerugnisa, S. aureus, and C. albicans | LB miller for P. aeruginosa and S. aureus and Sabouraud dextrose agar for C. albicans | ||
| Bead beater - suitable for 2 mL tubes | Fisherbrand | 15515799 | Thermofisher bead mill 24 |
| bench top centrifuge | must be capable of at least 8000 x g | ||
| Black clear bottom 96 well plates | Costar | 3603 | |
| Bunsen Burner | |||
| Containers for disposing of contaminated equipment and material according to the institutes health and safety regulations. | |||
| deionised water | |||
| eDNA | Sigma Aldrich | 31149 | |
| Filter unit | Fisherbrand | FB12566504 | Interchangeable depending on the vacuum pump used but must have a pore size of 0.2 µm |
| Haemocytometer and cover slip | Hawksley | HC001 | Haemocytometers may differ in size and volume. Double check and adjust CFU calculations accordingly |
| LB broth | oxoid | 1.46813 | |
| Mannitol salt agar | Oxoid | CM0085B | |
| meropenem | abcr | Ab243429 | |
| Mucin from porcine stomach Type II | Sigma Aldrich | M2378 | |
| Nystatin | Millipore | 1003352658 | |
| petri dishes | SLS | SLS2000 | |
| Phosphate buffered saline | |||
| Pseudomonas isolation agar | Millipore | 17208 | |
| Resazurin sodium salt | Sigma Aldrich | 199303 | |
| Sabouraud dextrose agar | Oxoid | CM0041 | |
| selection of forceps | fine tipped and tissue forceps with teeth for transferring ceramic beads | ||
| serological pipette | |||
| shaking and static incubators | must be temperature controlled | ||
| Sparks microtitre plate reader | Tecan | For Resazurin assay the microtitre plate reader must have the appropriate filters or be a monochromator for detecting flourescence. | |
| spectrophotometer | |||
| Technical agar (Agar Technical No.2 ) | Oxoid | LP0012B | |
| tetracycline | Sigma Aldrich | T7660 | |
| UV crosslinker | Spectroline | 11-992-89 | |
| vacuum pump/ flask | Fisherbrand | FB12566504 | |
| water bath | must be capable of maintaining 55 °C | ||
| YPD broth | Millipore | Y1375 | Can be bought pre-made or made using the base ingredients |
Referanslar
- . 2021 Cf foundation patient registry highlights report Available from: https://cysticfibrosis.msu.edu/index.php/welcome/news-and-events/39-2021-cf-foundation-patient-registry-highlights-report (2022)
- Guo, J., Garratt, A., Hill, A. Worldwide rates of diagnosis and effective treatment for cystic fibrosis. J Cyst Fibros. 21 (3), 456-462 (2022).
- Mandal, V., Ghosh, N. N., Mitra, P. K., Mandal, S., Mandal, V. Production and characterization of a broad-spectrum antimicrobial 5-butyl-2-pyridine carboxylic acid from Aspergillus fumigatus nhf-01. Sci Rep. 12 (1), 6006 (2022).
- Françoise, A., Héry-Arnaud, G. The microbiome in cystic fibrosis pulmonary disease. Genes. 11 (5), 536 (2020).
- Grasemann, H., Ratjen, F. Cystic fibrosis. New Engl J Med. 389 (18), 1693-1707 (2023).
- Camus, L., Vandenesch, F., Moreau, K. From genotype to phenotype: Adaptations of pseudomonas aeruginosa to the cystic fibrosis environment. Microb Genom. 7 (3), mgen000513 (2021).
- Rossi, E., et al. Pseudomonas aeruginosa adaptation and evolution in patients with cystic fibrosis. Nat Rev Microbiol. 19 (5), 331-342 (2021).
- Flemming, H. -. C., Wingender, J. The biofilm matrix. Nat Rev Microbiol. 8 (9), 623-633 (2010).
- Grainha, T., Jorge, P., Alves, D., Lopes, S. P., Pereira, M. O. Unraveling pseudomonas aeruginosa and candida albicans communication in coinfection scenarios: Insights through network analysis. Front Cell Infect Microbiol. 10, 550505 (2020).
- Flemming, H. C., et al. Biofilms: An emergent form of bacterial life. Nat Rev Microbiol. 14 (9), 563-575 (2016).
- Høiby, N., Bjarnsholt, T., Givskov, M., Molin, S., Ciofu, O. Antibiotic resistance of bacterial biofilms. Int J Antimicrob Agents. 35 (4), 322-332 (2010).
- Lorusso, A. B., Carrara, J. A., Barroso, C. D. N., Tuon, F. F., Faoro, H. Role of efflux pumps on antimicrobial resistance in Pseudomonas aeruginosa. Int J Mol Sci. 23 (24), 15779 (2022).
- Michaelis, C., Grohmann, E. Horizontal gene transfer of antibiotic resistance genes in biofilms. Antibiotics .(Basel). 12 (2), 328 (2023).
- Worlitzsch, D., et al. Effects of reduced mucus oxygen concentration in airway pseudomonas infections of cystic fibrosis patients. J Clin Invest. 109 (3), 317-325 (2002).
- König, J., Schreiber, R., Voelcker, T., Mall, M., Kunzelmann, K. The cystic fibrosis transmembrane conductance regulator (CFTR) inhibits ENaC through an increase in the intracellular Cl- concentration. EMBO Reps. 2 (11), 1047-1051 (2001).
- Palmer, K. L., Mashburn, L. M., Singh, P. K., Whiteley, M. Cystic fibrosis sputum supports growth and cues key aspects of Pseudomonas aeruginosa physiology. J Bacteriol. 187 (15), 5267-5277 (2005).
- Valenza, G., et al. Prevalence and antimicrobial susceptibility of microorganisms isolated from sputa of patients with cystic fibrosis. J Cyst Fibros. 7 (2), 123-127 (2008).
- Alam, F., Catlow, D., Di Maio, A., Blair, J. M. A., Hall, R. A. Candida albicans enhances meropenem tolerance of Pseudomonas aeruginosa in a dual-species biofilm. J Antimicrob Chemother. 75 (4), 925-935 (2020).
- Burmølle, M., Ren, D., Bjarnsholt, T., Sørensen, S. J. Interactions in multispecies biofilms: Do they actually matter. Trends Microbiol. 22 (2), 84-91 (2014).
- Lories, B., Belpaire, T. E. R., Smeets, B., Steenackers, H. P. Competition quenching strategies reduce antibiotic tolerance in polymicrobial biofilms. NPJ Biofilms Microbiomes. 10 (1), 23 (2024).
- Nabb, D. L., et al. Polymicrobial interactions induce multidrug tolerance in Staphylococcus aureus through energy depletion. Front Microbiol. 10, 2803 (2019).
- Cornforth, D. M., et al. Pseudomonas aeruginosa transcriptome during human infection. Proc Natl Acad Sci U S A. 115 (22), E5125-E5134 (2018).
- Wolter, D. J., et al. Staphylococcus aureus small-colony variants are independently associated with worse lung disease in children with cystic fibrosis. Clin Infect Dis. 57 (3), 384-391 (2013).
- Takagi, J., et al. Mucin o-glycans are natural inhibitors of Candida albicans pathogenicity. Nat Chem Biol. 18 (7), 762-773 (2022).
- Cinical and Laboratory Standard Institute. . Methods for dilution susceptibility tests for bacteria that grow aerobically. 35 (2), (2015).
- Roberts, A. E., Kragh, K. N., Bjarnsholt, T., Diggle, S. P. The limitations of in vitro experimentation in understanding biofilms and chronic infection. J Mol Biol. 427 (23), 3646-3661 (2015).
- Macia, M. D., Rojo-Molinero, E., Oliver, A. Antimicrobial susceptibility testing in biofilm-growing bacteria. Clin Microbiol Infect. 20 (10), 981-990 (2014).
- Coenye, T., Goeres, D., Van Bambeke, F., Bjarnsholt, T. Should standardized susceptibility testing for microbial biofilms be introduced in clinical practice. Clin Microbiol Infect. 24 (6), 570-572 (2018).
- Turner, K. H., Wessel, A. K., Palmer, G. C., Murray, J. L., Whiteley, M. Essential genome of Pseudomonas aeruginosa in cystic fibrosis sputum. Proc Natl Acad Sci U S A. 112 (13), 4110-4115 (2015).
- Miles, A. A., Misra, S. S., Irwin, J. O. The estimation of the bactericidal power of the blood. J Hyg. 38 (6), 732-749 (1938).
- Robertson, S. N., Romero, M., Fenn, S., Kohler Riedi, P. L., Cámara, M. Development, characterization, and evaluation of a simple polymicrobial colony biofilm model for testing of antimicrobial wound dressings. J Appl Microbiol. 135 (3), lxae042 (2024).
- Rumpf, C., Lange, J., Schwartbeck, B., Kahl, B. C. Staphylococcus aureus and cystic fibrosis-a close relationship. What can we learn from sequencing studies. Pathogens. 10 (9), 1177 (2021).
- Tay, W. H., Chong, K. K. L., Kline, K. A. Polymicrobial-host interactions during infection. J Mol Biol. 428 (17), 3355-3371 (2016).
- Orazi, G., O'toole, G. A. "It takes a village": Mechanisms underlying antimicrobial recalcitrance of polymicrobial biofilms. J Bacteriol. 202 (1), e00530-e00519 (2019).
- Arjes, H. A., et al. Three-dimensional biofilm colony growth supports a mutualism involving matrix and nutrient sharing. eLife. 10, e64145 (2021).
- Kasza, K., et al. Ciprofloxacin poly(β-amino ester) conjugates enhance antibiofilm activity and slow the development of resistance. ACS Appl Mater Interf. 16 (5), 5412-5425 (2024).
- Martin, I., Waters, V., Grasemann, H. Approaches to targeting bacterial biofilms in cystic fibrosis airways. Int J Mol Sci. 22 (4), 2155 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır