Method Article
낭포성 섬유증에서 항균제를 테스트하기 위한 다미생물 집락 생물막 모델 개발
요약
이 방법론을 통해 연구 및 임상 실험실에서 항균성 감수성 테스트를 위해 낭포성 섬유증에서 다미생물 생물막 모델을 구축할 수 있습니다. 이 모델은 다양한 출력에 걸쳐 정확하고 신뢰할 수 있는 결과를 제공합니다.
초록
항생제 검사를 위한 다양한 박테리아 생물막 모델이 존재합니다. 그러나 이들 중 다수는 군체 형성 단위 또는 대사 활동과 같은 단일 실험 결과물로 제한됩니다. 더욱이, 많은 생물막 모델은 인간 숙주 환경의 생물학적, 물리화학적 특성을 반영하지 않습니다. 이것은 많은 조건에서 중요한 문제이지만 낭포성 섬유증(CF)에서 가장 두드러집니다. 낭포성 섬유증을 앓고 있는 많은 사람들이 만성 감염과 간헐적 감염을 모두 앓고 있으며, 체외 항생제 감수성 검사는 환자의 치료 결과와 상관관계가 낮습니다. 일부 생물막 모델은 합성 객담 모방을 포함한 CF 폐 관련 배지를 통합하지만, 생물막 구조, 생리학 및 미생물이 치료에 반응하는 방식을 변경하는 환경의 다미생물 특성을 고려하지 않습니다. 여기에 설명된 고체-공기 계면 집락 생물막 모델은 적응성이 뛰어나며 CF 관련 배지와 다미생물 컨텍스트를 모두 통합합니다. 이 모델은 또한 항균제의 중간 처리량 스크리닝 및 다미생물 역학에 대한 효과를 연구하는 데 사용할 수 있습니다. 모델의 출력 측정은 집락 형성 단위, 대사 활동 및 공초점 현미경 분석이 될 수 있습니다. 이 모델은 다양한 미생물, 매체, 온도 및 다양한 산소 조건에 쉽게 적용할 수 있으며 광범위한 화학적, 생물학적, 물리적 처리를 테스트하는 데 사용할 수 있습니다.
서문
낭포성 섬유증(CF)은 영국에서 11,000명 이상, 전 세계적으로 162,000명 이상에게 영향을 미치는 유전 질환입니다 1,2. 낭포성 섬유증은 다장기 질환이지만, 낭포성 섬유증(pwCF) 환자가 경험하는 주요 증상은 호흡기 내에 비정상적으로 두껍고 탈수된 점액이 형성되는 것입니다3. 이는 섬모 박동 감소와 함께 다양한 박테리아, 곰팡이, 바이러스 및 고세균에 의한 폐의 집락화를 향상시킬 수 있습니다 4,5. CF 폐가 미생물의 성장과 생존을 제한하는 조건과 선택적 압력을 제공함에도 불구하고 녹농균(Pseudomonas aeruginosa)과 같은 박테리아는 이러한 가혹한 환경에 매우 잘 적응합니다6. 이는 집락화와 생존을 모두 가능하게 하여 지속적인 만성 감염을 형성하게 한다7.
이러한 만성 감염을 일으키는 많은 미생물은 초기 플랑크톤에서 표면이 부착되거나 응집체에서 생물막 스타일의 성장으로 표현형 변화를 사용하여 감염을 일으킵니다7. 이러한 생물막은 다당류, 단백질, 지질 및 환경 DNA(eDNA)를 포함한 다양한 구성 요소로 구성된 외다당류(EPS) 매트릭스로 둘러싸인 단단히 채워진 박테리아 군집이 특징입니다8. 이 매트릭스는 미생물 간의 일반적인 특징입니다. 그러나 그 구성은 다를 수 있습니다. 예를 들어, 박테리아 녹농균 기질의 주요 다당류 성분은 Psl, Pel 및 alginate이며, 주요 다당류 기질 성분이 mannans와 glucans9인 곰팡이 Candida albicans와 다릅니다. 단일종 생물막에서 이 매트릭스는 항생제의 생물막 침투를 감소시켜 항생제의 효과를 감소시킴으로써 플랑크톤에 비해 항생제 내성에 큰 영향을 미칠 수 있습니다10. 생물막 스타일의 성장은 또한 플랑크톤 세포에 비해 대사 활성이 감소된 지속세포 형성을 유도하여 항생제에 대한 감수성을 더욱 감소시킵니다11. 이러한 성장 스타일은 또한 유출 펌프와 같은 일부 항생제 내성 메커니즘 및 수평 유전자 전달에 필요한 항생제 내성 메커니즘의 상향 조절을 특징으로 하여 내성 유전자 11,12,13의 교환을 가능하게 합니다. 이 외에도 숙주의 질병 관련 환경은 미생물 생리학과 항생제에 반응하는 방식에 큰 영향을 미칩니다. 여기에는 두꺼운 점액 내에서 증가된 미세 공기역학뿐만 아니라 숙주 유래 또는 폐 산물의 미생물 분해로 인한 아미노산 및 eDNA와 같은 비표준 탄소원의 가용성이 포함됩니다 14,15,16.
이러한 특정 상호 작용은 생물막의 다미생물 특성으로 인해 더욱 복잡하며, 이는 박테리아 사이뿐만 아니라 박테리아와 곰팡이 사이에도 복잡한 상호 작용으로 복잡성을 가중시킵니다. 세균 생물막과 비교했을 때, C. albicans가 CF15 환자의 75% 이상으로부터 분리되었음에도 불구하고 박테리아와 진균 생물막 사이의 일부 상호 작용에 대해서는 알려진 바가 적습니다. 일반적으로 녹농균(C. albicans)과 녹농균(P. aeruginosa)과 같은 박테리아 간의 상호작용은 적대적이지만 더 만성적이고 심각한 감염을 유발할 수 있다18. 다양한 CF 관련 환경 요인과 함께 병원성 및 공생성 미생물 상호 작용의 조합은 궁극적으로 항생제 내성을 증가시킬 수 있습니다19,20. 이러한 요인 중 다수는 기존 모델에서 항생제 내성 증가에 기인함에도 불구하고 전임상 항생제 검사에서 자주 고려되지 않습니다21.
이러한 조건은 또한 in vitro에서 재현하기 어렵기 때문에 결과적으로 많은 모델에는 P. aeruginosa22에서 베타-락타마제 생산 증가, 황색포도상구균에서 작은 집락 변이체 유도 및 C. albicans에서 하이픈 넣기 억제와 같은 pwCF에 존재하는 특정 내성 유도 요인의 존재가 부족합니다. 이 모든 것은 CF 가래23,24에서 발생하는 것으로 나타났습니다.
그러므로, 디스크 확산을 이용한 Mueller-Hinton, Etest 및 CLSI 브로스 미세희석 분석법과 같은 표준화된 배지에서 플랑크톤 또는 한천 플레이트 배양 배양물을 기반으로 하는 현재의 항생제 감수성 검사 방법에 사용되는 조건과 숙주 환경에서 발생하는 조건 사이에는 큰 차이가 있습니다25. 이는 항생제 감수성을 정확하게 측정하지 못하는 경우가 많다26. 이 문제는 항균제 생물막 검사의 표준화 부족으로 인해 더욱 복잡해졌으며, 이로 인해 실험실에서 임상으로 항균 효능을 정확하게 변환하기가 어렵습니다27,28.
여기에서 개발한 다균 모델은 메로페넴 및 토브라마이신을 포함한 다양한 항균제에 대한 녹농 균의 내성이 향상되었음을 보여줍니다. 이는 단일종 생물막을 사용하는 현재의 항균 테스트와 최소 억제 농도를 결정하기 위해 이 연구에서 개발된 다미생물 생물막 모델 사이의 큰 차이를 보여줍니다. 이 모델은 또한 상대적으로 높은 처리량과 저렴한 비용으로 항미생물 테스트에 바람직합니다. 이 모델은 또한 항균 요법이 다균 역학에 미치는 영향을 연구하고 특정 치료법이 특정 병원체가 우세하게 되어 추가 합병증을 예측할 수 있는지 여부를 확인하는 데 사용할 수 있습니다. 이 모델은 복잡한 생물막의 형성을 허용하지만, 그 설정에는 정교한 실험실 장비가 필요하지 않으며 광범위한 임상 및 연구 결과물을 위한 플랫폼을 제공합니다.
프로토콜
1. 합성 낭포성 섬유증 매체-2(SCFM2) 및 플레이트의 제조
- Palmer et al.16 에 설명된 레시피에 따라 500mL 붕규산 유리병에 몇 가지 수정을 가하여 2배 농도로 SCFM2를 만듭니다.
- 표 1에 표시된 대로 무게를 측정하고 재고를 준비합니다. 표 2에 따라 아미노산 스톡을 준비한다.
- 200mL 붕규산 유리병에 100mL의 dH2O에 포함된 뮤신(돼지 위(II형)에서 추출한 뮤신) 5g과 600mg eDNA(연어 정자에서 추출)의 무게를 잰다. 오토클레이브로 멸균하기 전에 4°C에서 밤새 저어줍니다.
- 500mL 멸균 병에 포도당 0.54g, NaCl 6.06g 및 KCl 2.228g을 추가합니다. 1.1.1단계에서 준비한 각 10mL를 추가합니다. 1M NaOH 또는 HCl을 사용하여 pH를 6.9로 조정합니다.
- 10mL의 dH2O를 첨가 한 다음 10mL의 0.175 M CaCl2 및 0.0606 M의 MgCl2를 추가합니다. 0.93M L-젖산 10mL를 준비하고 추가합니다. 사용 직전에 10mL의 0.36mM Fe(III)SO47H2O를 추가합니다.
- 필터 장치와 진공 펌프를 사용하여 SCFM2를 필터 멸균한 다음 오토클레이브 뮤신과 eDNA를 추가합니다.
참고: 준비된 SCFM2는 최대 1개월 동안 4°C에서 보관할 수 있습니다.
- 아래 설명된 대로 SCFM2 한천 플레이트를 준비합니다.
- 55°C 수조에서 50mL 튜브에 2x SCFM2 25mL를 예열한 후 미리 용융된 3%(w/v) 테크니컬 한천 25mL와 혼합하여 1x SCFM2 및 1.5%(w/v) 테크니컬 한천을 혼합합니다.
- 혈청학적 피펫을 사용하여 혼합물 5mL를 6웰 플레이트의 각 웰로 옮깁니다.
- 기공 크기가 0.2μm인 13mm 폴리카보네이트 디스크를 페트리 접시 바닥에 놓고 254nm의 파장과 60Hz의 주파수에서 UV-C를 600초 동안 도포하여 동일한 수의 준비를 합니다. 디스크를 뒤집고 UV-C 절차를 반복합니다.
- 1x SCFM2-1.5 % (w/v) 테크니컬 한천이 설정되면 멸균 집게를 사용하여 6웰 플레이트의 각 웰 표면에 단일 폴리카보네이트 디스크를 추가합니다.
2. 감염을 위한 박테리아의 준비
- 모델을 설정하기 전에 P. aeruginosa PAO1, S. aureus SH1000 및 C. albicans SC5314에 대해 실험실에서 사용하는 표준 한천(예: 박테리아의 경우 1.2%(w/v) 한천 및 C. albicans의 경우 Sabouraud 포도당 한천이 함유된 용혈 육물)에 따라 필요한 박테리아 및 곰팡이 균주에 대한 한천 플레이트를 준비합니다.
참고: 모델을 확립하기 위해 특정 실험실 참조 균주가 사용되었습니다. 그러나, 이 모델은 또한 느리게 성장하는 균주를 치료하기 전에 생물막 형성 시간을 늘리는 것과 같은 일부 수정과 함께 임상 분리물을 포함한 다른 균주와 함께 사용되었습니다. - 1μL 접종 루프를 사용하여 각 미생물의 단일 콜로니를 선택하여 5mL의 표준 실험실 액체 배지(예: 녹농균, S. 아우레우스 의 경우 용융성 육수 및 C. 알비칸스의 경우 효모 펩톤 포도당(YPD))를 접종합니다. 박테리아의 경우 200rpm, 37°C, C . albicans의 경우 200rpm, 30°C에서 기하급수적 성장 단계에 도달할 때까지 이러한 배양물을 배양합니다.
알림: 폭기는 진탕 인큐베이터와 회전 반경에 따라 다릅니다.
3. 고체 공기 인터페이스 모델 설정
참고: 모델의 전체 개략도는 보충 그림 1에서 볼 수 있습니다.
- 각 액체 배양액 1mL를 별도의 멸균 1.5mL 튜브에 옮기고 8,000 x g 에서 2분 동안 원심분리하여 박테리아/곰팡이를 펠릿화합니다. 이 단계와 다음의 모든 원심분리 단계를 실온에서 수행합니다.
- 피펫을 사용하여 상층액을 흡입하고 원심분리 전에 1mL의 PBS에 펠릿을 다시 한 번 8,000 x g에서 2분 동안 재현탁합니다.
- 이전과 같이 상층액을 제거하고 1mL의 PBS에 펠릿을 재현탁합니다. 재현탁된 녹농균(P. aeruginosa ) 및 황색포도상구균(S. aureus cells)을 PBS에서 1:10으로 희석하고 600nm 파장에서 분광광도계를 사용하여 광학 밀도를 측정합니다.
- 녹농균(P. aeruginosa)의 경우 0.05, 황색포도상구균(S. aureus)의 경우 0.1의 OD600이 1 x 108 CFU/mL와 동일하다는 사전 검증을 기반으로 세척된 샘플을 1 x 108 집락 형성 단위(CFU)/mL로 조정합니다.
- C. albicans의 경우, 세척된 샘플을 PBS에서 1:100으로 희석하고, 혈구계의 개별 챔버 2개에 각각 10μL를 첨가하고, 챔버의 고정 치수와 CFU/mL를 계산하는 데 사용되는 희석액을 사용합니다. 개선된 Neubauer 혈구계를 사용하여 계산은 다음과 같습니다.
세포 수 = 평균 세포 수 × 10,000 / (희석 계수) - 계산된 CFU는 사전 희석된 샘플에서 C. albicans CFU/mL를 나타냅니다. C. albicans 샘플을 박테리아 배양과 마찬가지로 PBS에서 1 x 108 CFU/mL로 조정합니다.
- 생물막에 추가할 접종물을 준비하기 위해 P. aeruginosa inoculum을 1 x 104 CFU/mL(2x 100배 희석)로, C. albicans를 1 x 105 CFU/mL(100배 희석 후 10배 희석)로, 마지막으로 S. aureus 를 PBS를 사용하여 1 x 106 CFU/mL(100배 희석)로 조정합니다.
- 단일종 생물막의 경우, 1x SCFM2-1.5 % 기술 한천 6웰 플레이트에 이전에 배치된 폴리카보네이트 디스크의 중앙에 희석된 원하는 미생물 10μL를 추가하고 처리 또는 중단 전 24시간 동안 37°C에서 정적으로 배양합니다.
- 다미생물 생물막의 경우, 동일한 디스크에서 각 S. aureus 및 C. albicans 를 각각 10μL씩 추가합니다. 접종된 디스크를 37°C에서 24시간 동안 정적으로 배양합니다.
참고: S. aureus 및 C. albicans 접종물이 추가되는 순서는 모델 개발에 영향을 미치지 않으며 동일한 결과를 생성합니다. - 그런 다음 폴리카보네이트 디스크를 멸균 집게를 사용하여 새로운 1x SCFM2-1.5% 기술 한천 플레이트로 옮기고 사전 설정된 S. aureus - C. albicans 생물막 위에 녹농균의 1 x 104 CFU/mL 희석 10μL를 추가합니다. 37 °C에서 24 시간 더 배양하십시오.
참고: P. aeruginosa 는 S. aureus 및 C. albicans 24시간 후에 추가되어 이러한 유기체가 CF를 가진 사람에서 CF 폐에 자주 군집하는 순서를 반영합니다. 이것은 또한 P. aeruginosa가 다른 두 미생물보다 더 많이 자라는 것을 방지합니다. 녹농균(P. aeruginosa )이 첨가되면 생물막은 24시간 이상 성장할 수 있습니다. 그러나 생물막이 있는 폴리카보네이트 디스크는 24시간마다 새로운 매체로 옮겨야 합니다. 파괴되기 전에 생물막은 형광 단백질, 형광 염료 또는 균주/미생물 특이적 항체를 발현하는 균주를 사용하여 현미경 검사에 사용할 수 있습니다. 그러나 일부 염료가 폴리 카보네이트 디스크를 염색한다는 점은 주목할 가치가 있습니다.
4. 생물막 파괴
- 플레이트에 직경 2.8mm의 세라믹 비드를 추가하고 1.3단계에서 설명한 대로 플레이트를 UV 가교합니다. 화염 멸균 겸자를 사용하여 멸균 2mL 균질화 튜브에 5개의 세라믹 비드를 추가합니다. 그런 다음 1mL의 인산염 완충 식염수(PBS)를 2mL 균질화 튜브에 피펫팅합니다.
- 최소 10초 동안 또는 육안 검사에 의해 결정된 폴리카보네이트 디스크에서 생물막이 제거될 때까지 와류 튜브를 사용하여 폴리카보네이트 디스크를 제거합니다.
- 구슬이 든 튜브를 균질화기에 넣고 비트 사이에 10초 간격으로 6m/s에서 10초 동안 2번 치십시오.
참고: 이러한 비드, 박동 시간 및 균질화 사용의 조합은 현미경 및 콜로니 형성 단위에 의해 결정된 바와 같이 최소한의 용해로 생물막을 충분히 파괴합니다. 이것은 사용된 특정 비드 비터에 따라 다를 수 있습니다. - 균질화 튜브의 파쇄된 바이오필름을 PBS 4mL가 포함된 7mL 옥수에 붓습니다.
- 8,000 x g 에서 튜브를 2분 동안 원심분리하고 나머지 액체를 7mL 이중주로 옮겨 균질화 튜브의 모든 액체가 이중주로 옮겨졌는지 확인합니다.
참고: 이 5mL의 파쇄된 생물막에서 다양한 분석을 수행할 수 있지만, 모든 계산을 위해 1mL 생물막 PBS를 5mL의 최종 부피로 희석하는 것을 기억하는 것이 중요합니다.
5. 대사 활성 테스트
- 위의 4단계에서 파괴된 생물막 200μL를 바닥이 투명한 검은색 96웰 플레이트에 추가합니다. 그런 다음 10μL의 0.02%(w/v) 레사주린 용액을 추가합니다.
- 레사주린으로 처리된 생물막을 플레이트 리더로 배양하고 대사 활동을 판독합니다. 플레이트를 37°C에서 배양하고 형광 판독값을 측정하기 전에 200rpm에서 10초 동안 30분마다 궤도 쉐이킹을 적용합니다.
- 540 nm의 여기(excitation)와 590 nm의 방출을 사용하여 형광을 측정합니다. 플레이트 리더를 사용하여 30시간 동안 이 4분 주기를 반복합니다.
참고: 4시간 시점은 처리된 샘플과 처리되지 않은 샘플 사이, 그리고 다양한 항생제 농도를 가진 샘플 간에 더 뚜렷한 차이를 제공하기 때문에 사용됩니다.
6. 항균 감도 테스트
- 표준 항생제의 항균 내성을 테스트하려면 선택한 항생제를 관련 용매에 용해시키고 이를 6웰 플레이트의 각 웰로 5mL를 이동하기 전에 액체 상태의 1x SCFM2-1.5%(w/v) 기술 한천 배지에 추가합니다. 설정이 완료되면 멸균 집게를 사용하여 폴리카보네이트 디스크에서 성장한 생물막을 항생제 함유 배지 상단으로 옮기고 해당 항생제 농도의 10μL 방울을 생물막 상단에 추가합니다.
참고: 이 연구에서는 임상적으로 관련된 농도를 반영하기 위해 64μg/mL와 0.125μg/mL 사이의 2로그 연속 희석을 사용하여 메로페넴과 토브라마이신을 사용했습니다. 항생제 또는 기타 항균/항독성 처리제를 생물막 위에만 투여하는 것만으로도 충분하며, 배지와 생물막에 첨가할 때 유사한 반응이 관찰되었습니다. - 처리와 함께 37°C에서 24시간 배양 후 4단계에서 설명한 대로 생물막을 이미지화하고 파쇄합니다.
- 파괴된 배양액 5mL에서 부분 표본을 취하고 PBS를 사용하여 10배 연속 희석을 수행합니다. Miles and Misra 방법30을 사용하여 집락 형성 단위를 결정하기 위해 한천에서 10μL 스폿을 3배로 플레이트아웃합니다.
알림: 한천 플레이트에 추가된 부피는 검출 한계에 영향을 미치고 부피가 클수록 검출 한계가 줄어들지만 더 많은 샘플과 한천 플레이트가 필요합니다. - 단일종 생물막의 경우 P. aeruginosa 및 S. aureus 를 LB 한천 플레이트에, C. albicans를 SDA 한천에 줄무늬를 표시합니다.
- 다미생물 생물막의 경우, 항생제를 함유한 3개의 서로 다른 선택적 배지에 부분 표본을 배치하여 3가지 종 각각을 분리하고 CFU를 측정할 수 있도록 합니다. 여기에는 녹농균(P. aeruginosa)과 황색포도상(S. aureus)을 각각 분리하기 위해 10μg/mL의 니스타틴(nystatin)을 함유하는 슈도모나스(Pseudomonas) 분리 한천 및 만니톨 염 한천(mannitol salt agar)과 C. 알비칸스(C. albicans)를 분리하기 위해 125μg/mL의 테트라사이클린(tetracycline)과 함께 사부로 덱스트로오스 한천(Sabouraud dextrose agar)을 사용하는 것이 포함됩니다. S. aureus plates를 37°C에서 하룻밤 동안 배양하고 P. aeruginosa 및 C. albicans plate를 30°C에서 배양합니다.
참고: P. aeruginosa 플레이트를 30°C에서 배양하여 군집 과잉 증식을 최소화하고 군집을 줄입니다.
결과
고체-공기 계면 생물막 모델의 단순성으로 인해 임상적으로 관련된 다양한 조건에서 한 번에 많은 수의 항균제를 스크리닝할 수 있습니다. 이 모델을 사용하면 CFU 계수 및 단일균 및 다미생물 생물막에서 대사 분석을 사용하여 항생제의 효과를 일주일 내에 평가할 수 있습니다. 모델의 특성으로 인해 매체 조성을 변경하고 생물막을 감소된 산소 및 혐기성 조건에서 배치하는 것과 같은 환경 조건을 쉽게 조작할 수도 있습니다. 이 모델을 사용하여 단일종에서 자란 녹농균 과 다미생물 생물막 사이에서 pwCF에 일반적으로 사용되는 두 가지 항생제에 대한 내성 변화를 보여주었습니다(그림 1). 이와 함께 항균 처리가 다미생물 생물막 내의 개체군 역학에 어떤 영향을 미칠 수 있는지 확인할 수 있었습니다(그림 2).
이러한 실험을 수행하기 위해 위 프로토콜에 명시된 대로 초기 접종물을 준비하여 재현 가능한 CFU/mL 및 1원 또는 양방향 ANOVA에 의해 결정된 작은 표준 편차를 가진 안정적인 단일종 및 다미생물 생물막을 형성했습니다. 이 모델은 또한 일관된 성장과 CFU 회수를 강조했을 뿐만 아니라 정교한 처리 없이 이러한 고전적인 미생물학 기술을 이 연구에서 수행하지 않은 다른 기술과 결합할 수 있는 가능성을 허용했습니다. 여기에는 살아있는/죽은 자, 매트릭스 시각화 및 분자 분석과 같은 이미징이 포함되며, 다른 3차원 모델로는 액세스할 수 없는 방식으로 제공할 수 없습니다(그림 1)31. CFU/mL에 대해 예상되는 표준 편차는 데이터가 CFU/mL에 비해 생존율로 표시될 때 증가한다는 점에 유의해야 합니다(그림 1). 단일종(mono species)과 다미생물 생물막(polymicrobial biofilms) 간의 항생제 처리 효과를 비교할 때, 50%의 사멸을 달성하는 데 필요한 모든 항생제 농도가 크게 증가했습니다. 메로페넴과 토브라마이신에 대한 이러한 수준의 사멸을 달성하기 위해서는 항생제 농도의 2log 증가가 필요했습니다(그림 1). 또한 64μg/mL 토브라마이신으로 처리했을 때 다미생물 생물막에 S. aureus 및 C. albicans가 존재할 때 P. aeruginosa 생존율이 전반적으로 증가한 반면, 메로페넴의 경우 그 반대였습니다.
대사 활성을 결정하는 데 사용되는 방법은 각 종의 개별 기여도를 구별할 수 없는 상태에서 전체 다미생물 생물막의 전반적인 활성을 측정합니다. 이러한 이유로, 이 모델에 대한 대사 활성 분석의 사용을 입증하기 위해 단일종 대사 변화만이 표시되는 것으로 나타났습니다. mono species biofilms의 경우, 메로페넴과 토브라마이신 모두에 대한 P. aeruginosa 생존과 대사 활동 사이에 강한 관계가 있었습니다(그림 2). 동일한 샘플에서 대사 활성과 CFU 수치를 모두 활용하면 정균 효과와 살균 효과를 모두 쉽게 식별할 수 있습니다. 다미생물 생물막의 경우, 대사 활성의 측정은 한 종의 표적화가 어떻게 생물막 대사 활성의 전반적인 증가를 유도할 수 있는지, 따라서 잠재적으로 다른 종의 미생물 성장을 증가시킬 수 있는지를 나타낼 수 있습니다.
CFU는 항미생물 감수성 검사의 황금 표준이지만, 다미생물 생물막에서는 생물막 내 종 구성을 평가할 수도 있습니다. 다미생물 생물막에서 녹농 균을 처리함으로써 이 유기체에 대한 증가된 MBEC50을 보여줄 수 있을 뿐만 아니라 이것이 다른 공동 고립된 종에 미치는 영향을 확인할 수 있습니다(그림 3). 예를 들어, 메로페넴(antipseudomonal)에서 이러한 현상이 나타나는데, 녹농균 의 감소는 S. aureus 및 C. albicans의 증가를 동반하여 특정 항생제 농도에 노출되면 S. aureus 가 가장 널리 퍼진 유기체가 되는 결과를 낳습니다(그림 3A). 이는 특정 병원체를 치료할 때 다른 질병을 유발하는 종의 개체군 크기가 증가할 가능성이 있기 때문에 생물막의 다미생물 특성을 고려하는 것이 중요하다는 점을 강조합니다.
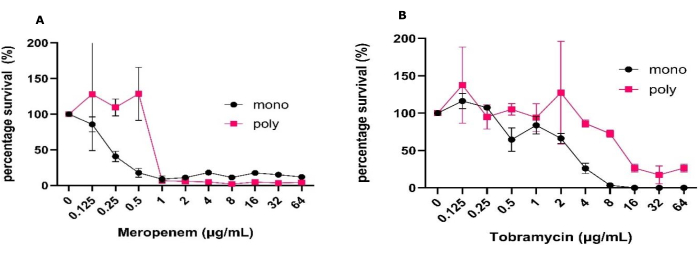
그림 1: 고체-공기 계면 모델에서 성장한 단일미생물 및 다미생물 생물막 사이에서 메로페넴 및 토브라마이신에 대한 P. aeruginosa의 항균 내성 변화.S. aureus 및 C. albicans와 함께 단일 또는 폴리 미생물 생물막에서 성장한 P. aeruginosa PAO1은 SCFM2에서 24시간 동안 고체-공기 계면 모델을 사용하여 확립되었습니다. 바이오필름은 항생제 대조군이 없는 상태에서 0.125μg/mL에서 64μg/mL까지의 (A) 메로페넴 또는 (B) 토브라마이신 농도 범위로 처리되었습니다. 각 생물막의 CFU/mL를 측정했습니다. 녹농균 CFU는 PIA에서 측정되었으며 음성 대조군을 100% 생존율로 사용하여 생존율로 변환되었습니다. 오차 막대는 표준 편차를 나타내며 각 데이터 포인트는 각각 3개의 기술 반복이 있는 3개의 생물학적 반복에서 파생됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 고체-공기 계면 모델에서 성장한 메로페넴 또는 토브라마이신의 존재 하에서 P. aeruginosa 생물막의 대사 활성 변화. 녹농균 PAO1 생물막은 고체-공기 계면 모델에서 SCFM2에서 성장시켰고, 항생제 대조군이 없는 상태에서 0.125μg/mL에서 64μg/mL까지의 (A) 메로페넴 또는 (B) 토브라마이신 농도를 첨가했습니다. 플레이트는 540nm의 여기와 30분마다 590nm의 방출에서 형광으로 판독되었습니다. 대사 활성도의 백분율은 항생제를 투여하지 않은 대조군과 비교하여 항생제를 투여한 각 샘플에서 이러한 활성의 백분율을 결정하여 계산하였다. 오차 막대는 표준 편차를 나타내며 각 데이터 포인트는 각각 3개의 기술 반복이 있는 3개의 생물학적 반복에서 파생됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
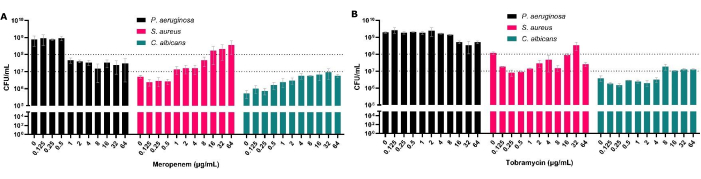
그림 3: 항균 처리 후 다미생물 고체-공기 계면 모델에서 회수된 녹농균(P. aeruginosa), S. 아우레우스(S. aureus) 및 C. 알비칸스(C. albicans) 의 총 CFU 수에 미치는 영향. S. aureus 및 C. albicans는 고체-공기 계면 모델의 SCFM2에서 성장했습니다. 녹농균(P. aeruginosa) 을 첨가하고, 0.125μg/mL - 64μg/mL 농도의 (A) 메로페넴 또는 (B) 토브라마이신을 무항생제 대조군과 함께 생물막에 첨가했습니다. 각 생물막의 CFU/mL를 측정했습니다. 오차 막대는 표준 편차를 나타내며, 각 데이터 포인트는 각각 3개의 기술적 반복이 있는 3개의 생물학적 반복에서 파생되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 그림 1: solid-air interface model의 설정 및 작업 흐름. Solid-Air Interface Model Establishment, Biofilm disruption 및 outputs를 그래픽으로 표현합니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
여기에 설명된 생물막 모델을 통해 CDC 반응기 및 Lubbock 생물막 모델31과 같이 현재 사용되는 체외 항균 검사 방법보다 더 접근하기 쉬운 방식으로 다양한 일반적인 다미생물 상호 작용을 통합함으로써 CF 폐 감염 환경의 일부 측면을 모방할 수 있습니다. 이는 생물막의 물리적 특성, 영양소 가용성 및 생물막 내 종 간의 분자 상호 작용을 포함한 다양한 요인이 항균제의 활성과 항균제에 대한 미생물의 반응 모두에 영향을 미칠 수 있는 경우에 중요합니다21. 이러한 요인을 통합함으로써 앞서 언급한 요인을 고려하지 않은 현재 모델보다 항균 치료 결과를 더 정확하게 예측할 수 있는 매우 다재다능한 모델을 개발할 수 있었습니다.
P. aeruginosa, S. aureus 및 C. albicans는 CF32에서 일반적으로 분리된 그람 양성, 그람 음성 및 곰팡이를 대표하는 것으로 선택되었습니다. 그러나 우리는 또한 이 모델이 Burkholderia cenocepacia, Burkholderia multivorans, Aspergillus fumigatus 를 포함한 다양한 다른 CF 관련 미생물에 사용될 수 있음을 보여줄 수 있었으며 현재 Prevotella melaninogenica와 같은 혐기성 박테리아와 함께 사용하도록 조정되고 있습니다. 이는 광범위한 미생물을 통합할 수 있기 때문에 모델의 다양성을 보여주며, 광범위한 미생물 병원체에 대한 항균 테스트에 대한 이 모델의 적응성을 강조합니다. 또한 이 모델은 SCFM2를 환자의 객담으로 대체하는 것을 포함하여 보다 개인화된 항생제 감수성 테스트를 위해 다양한 환경 조건에 쉽게 적용할 수 있습니다.
새로운 항생제 테스트를 위한 다미생물 생물막 모델을 고려하는 것도 매우 중요한데, 이는 동물 또는 인간 연구에 사용하기 전에 항미생물 개발 파이프라인의 기존 격차를 메울 수 있기 때문입니다33,34. 이와 함께 이 모델은 상대적으로 높은 처리량을 유지하고 산업 및 연구 모두와 관련된 다양한 출력을 허용합니다.
이 방법 논문에서는 CFU와 대사 활성을 예시했을 뿐이지만, 액체 추출 표면 분석 질량 분석법(LESA)을 사용한 생물막 엑소 대사체 분석에서 모델의 유용성도 입증했습니다. 이를 통해 항생제 내성을 뒷받침하는 분자 메커니즘 중 일부를 조사할 수 있습니다35. 이러한 다른 결과물 외에도 새로운 항균제 전달 시스템을 테스트하기 위해 이 모델을 사용하는 것을 입증했습니다. 여기에는 폴리머-시프로플록사신 접합체(polymer-ciprofloxacin conjugate)가 포함되어 있어 생물막 내 항생제의 침투를 향상시키는 동시에 항생제의 활성을 증가시키고 내성 발병을 감소시킵니다36.
중요한 단계 및 고려 사항
특히 SCFM2 및 배지를 생산할 때 오염으로 인해 자연적으로 발생하지 않는 종이 도입되어 결과를 방해할 수 있으므로 무균 상태를 유지하는 것이 중요합니다. 동일한 미생물과 다른 미생물의 다른 균주는 성장을 위해 다른 환경 조건을 필요로 하거나 다른 성장 특성을 가질 수 있습니다. 따라서 항생제 감수성 검사를 수행하기 전에 모델을 최적화해야 합니다. 표준 모델 조건에서 성장을 평가하기 위해 단일 종 및 다미생물 생물막에 대해 24시간 및 48시간의 소규모 파일럿 연구를 수행하는 것이 좋습니다. 우리는 다양한 녹농 균 균주와 특정 항생제 농도가 폴리카보네이트 디스크에서 떼지어 나오도록 유도할 수 있음을 발견했습니다. 이것은 상업적으로 이용 가능한 더 큰 크기의 디스크를 사용하여 쉽게 극복할 수 있습니다. 생물막 파괴는 비드 비터와 사용된 미생물에 따라 최적화가 필요할 수도 있습니다. 당사는 비드 비팅 전후에 알려진 샘플의 CFU/mL를 측정하여 파괴 방법을 최적화했습니다. 또한 현미경을 사용하여 비드 비트 샘플을 시각화하여 생물막이 얼마나 잘 파괴되었는지 시각화했습니다.
이 CF 모방 생물막 모델의 한계 중 하나는 CF 가래 내에서 자유 부유 응집체가 아니라 CF 폐에서 발견되지 않는 폴리카보네이트를 포함하는 고체 표면에 부착된다는 것입니다37 . 그러나, 여기에 제시된 고체 한천 모델은 플랑크톤 미생물을 제거하기 위해 생물막을 세척할 필요성을 배제하고 결과에 혼합된 플랑크톤 생물막 배양과 대조적으로 생물막에서 유래한 미생물만 포함되도록 합니다. 우리는 또한 이 생물막 모델의 더 깊은 영역으로의 일부 항생제의 침투를 줄일 수 있으며, 세포외 기질의 유변학을 변경하고 eDNA와의 정전기 상호 작용을 줄이기 위해 DNase의 사용이 필요할 수 있음을 발견했습니다.
우리는 이 모델이 다용성, 적응성 및 많은 기존 모델이 고려하지 못하는 환경 요인의 포함으로 인해 항균 테스트에 매우 적합하다고 믿습니다. 기초 연구 및 전임상 항균제 감수성 검사에 사용하면 임상 샘플의 AST 및 새로운 치료제 개발에 임상적으로 보다 관련성이 높은 접근 방식을 제공할 수 있습니다.
공개
이 작업에 대한 이해 상충 또는 경쟁 재정적 이해관계는 선언되지 않습니다.
감사의 말
이 연구는 생명공학 및 생명과학 연구 위원회(Biotechnology and Biological Sciences Research Council), Innovate UK 및 Hartree Centre[Awards BB/R012415/1 및 BB/X002950/1]와 UK CF Trust 및 USA CF Foundation Strategic Research Centre: 'An evidence-based preclinical framework for the development of antimicrobial therapeutics in cystic fibrosis' (PIPE-CF) [Award SRC022]의 자금 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1 µL inoculation loops | |||
| 13 mm 0.2 µm pore size polycarbonate discs | Isopore | GTTP01300 | Larger discs are also available |
| 2 mL reinforced tubes | Thermofisher | 15545809 | |
| 2.5 mL ceramic beads | Qiagen | 13114-325 | |
| 500 mL borosilicate glass Duran bottle | Sigma Aldrich | Z305197 | larger bottles available in larger volumes are desired |
| 6-well culture plates | Greiner | 657165 | |
| 7 mL Bijou | Thermofisher | 129B | |
| 96-well plates | Thermofisher | 167008 | for serial dilutions in CFU assay |
| Agar plates for preparing plates of P. aerugnisa, S. aureus, and C. albicans | LB miller for P. aeruginosa and S. aureus and Sabouraud dextrose agar for C. albicans | ||
| Bead beater - suitable for 2 mL tubes | Fisherbrand | 15515799 | Thermofisher bead mill 24 |
| bench top centrifuge | must be capable of at least 8000 x g | ||
| Black clear bottom 96 well plates | Costar | 3603 | |
| Bunsen Burner | |||
| Containers for disposing of contaminated equipment and material according to the institutes health and safety regulations. | |||
| deionised water | |||
| eDNA | Sigma Aldrich | 31149 | |
| Filter unit | Fisherbrand | FB12566504 | Interchangeable depending on the vacuum pump used but must have a pore size of 0.2 µm |
| Haemocytometer and cover slip | Hawksley | HC001 | Haemocytometers may differ in size and volume. Double check and adjust CFU calculations accordingly |
| LB broth | oxoid | 1.46813 | |
| Mannitol salt agar | Oxoid | CM0085B | |
| meropenem | abcr | Ab243429 | |
| Mucin from porcine stomach Type II | Sigma Aldrich | M2378 | |
| Nystatin | Millipore | 1003352658 | |
| petri dishes | SLS | SLS2000 | |
| Phosphate buffered saline | |||
| Pseudomonas isolation agar | Millipore | 17208 | |
| Resazurin sodium salt | Sigma Aldrich | 199303 | |
| Sabouraud dextrose agar | Oxoid | CM0041 | |
| selection of forceps | fine tipped and tissue forceps with teeth for transferring ceramic beads | ||
| serological pipette | |||
| shaking and static incubators | must be temperature controlled | ||
| Sparks microtitre plate reader | Tecan | For Resazurin assay the microtitre plate reader must have the appropriate filters or be a monochromator for detecting flourescence. | |
| spectrophotometer | |||
| Technical agar (Agar Technical No.2 ) | Oxoid | LP0012B | |
| tetracycline | Sigma Aldrich | T7660 | |
| UV crosslinker | Spectroline | 11-992-89 | |
| vacuum pump/ flask | Fisherbrand | FB12566504 | |
| water bath | must be capable of maintaining 55 °C | ||
| YPD broth | Millipore | Y1375 | Can be bought pre-made or made using the base ingredients |
참고문헌
- . 2021 Cf foundation patient registry highlights report Available from: https://cysticfibrosis.msu.edu/index.php/welcome/news-and-events/39-2021-cf-foundation-patient-registry-highlights-report (2022)
- Guo, J., Garratt, A., Hill, A. Worldwide rates of diagnosis and effective treatment for cystic fibrosis. J Cyst Fibros. 21 (3), 456-462 (2022).
- Mandal, V., Ghosh, N. N., Mitra, P. K., Mandal, S., Mandal, V. Production and characterization of a broad-spectrum antimicrobial 5-butyl-2-pyridine carboxylic acid from Aspergillus fumigatus nhf-01. Sci Rep. 12 (1), 6006 (2022).
- Françoise, A., Héry-Arnaud, G. The microbiome in cystic fibrosis pulmonary disease. Genes. 11 (5), 536 (2020).
- Grasemann, H., Ratjen, F. Cystic fibrosis. New Engl J Med. 389 (18), 1693-1707 (2023).
- Camus, L., Vandenesch, F., Moreau, K. From genotype to phenotype: Adaptations of pseudomonas aeruginosa to the cystic fibrosis environment. Microb Genom. 7 (3), mgen000513 (2021).
- Rossi, E., et al. Pseudomonas aeruginosa adaptation and evolution in patients with cystic fibrosis. Nat Rev Microbiol. 19 (5), 331-342 (2021).
- Flemming, H. -. C., Wingender, J. The biofilm matrix. Nat Rev Microbiol. 8 (9), 623-633 (2010).
- Grainha, T., Jorge, P., Alves, D., Lopes, S. P., Pereira, M. O. Unraveling pseudomonas aeruginosa and candida albicans communication in coinfection scenarios: Insights through network analysis. Front Cell Infect Microbiol. 10, 550505 (2020).
- Flemming, H. C., et al. Biofilms: An emergent form of bacterial life. Nat Rev Microbiol. 14 (9), 563-575 (2016).
- Høiby, N., Bjarnsholt, T., Givskov, M., Molin, S., Ciofu, O. Antibiotic resistance of bacterial biofilms. Int J Antimicrob Agents. 35 (4), 322-332 (2010).
- Lorusso, A. B., Carrara, J. A., Barroso, C. D. N., Tuon, F. F., Faoro, H. Role of efflux pumps on antimicrobial resistance in Pseudomonas aeruginosa. Int J Mol Sci. 23 (24), 15779 (2022).
- Michaelis, C., Grohmann, E. Horizontal gene transfer of antibiotic resistance genes in biofilms. Antibiotics .(Basel). 12 (2), 328 (2023).
- Worlitzsch, D., et al. Effects of reduced mucus oxygen concentration in airway pseudomonas infections of cystic fibrosis patients. J Clin Invest. 109 (3), 317-325 (2002).
- König, J., Schreiber, R., Voelcker, T., Mall, M., Kunzelmann, K. The cystic fibrosis transmembrane conductance regulator (CFTR) inhibits ENaC through an increase in the intracellular Cl- concentration. EMBO Reps. 2 (11), 1047-1051 (2001).
- Palmer, K. L., Mashburn, L. M., Singh, P. K., Whiteley, M. Cystic fibrosis sputum supports growth and cues key aspects of Pseudomonas aeruginosa physiology. J Bacteriol. 187 (15), 5267-5277 (2005).
- Valenza, G., et al. Prevalence and antimicrobial susceptibility of microorganisms isolated from sputa of patients with cystic fibrosis. J Cyst Fibros. 7 (2), 123-127 (2008).
- Alam, F., Catlow, D., Di Maio, A., Blair, J. M. A., Hall, R. A. Candida albicans enhances meropenem tolerance of Pseudomonas aeruginosa in a dual-species biofilm. J Antimicrob Chemother. 75 (4), 925-935 (2020).
- Burmølle, M., Ren, D., Bjarnsholt, T., Sørensen, S. J. Interactions in multispecies biofilms: Do they actually matter. Trends Microbiol. 22 (2), 84-91 (2014).
- Lories, B., Belpaire, T. E. R., Smeets, B., Steenackers, H. P. Competition quenching strategies reduce antibiotic tolerance in polymicrobial biofilms. NPJ Biofilms Microbiomes. 10 (1), 23 (2024).
- Nabb, D. L., et al. Polymicrobial interactions induce multidrug tolerance in Staphylococcus aureus through energy depletion. Front Microbiol. 10, 2803 (2019).
- Cornforth, D. M., et al. Pseudomonas aeruginosa transcriptome during human infection. Proc Natl Acad Sci U S A. 115 (22), E5125-E5134 (2018).
- Wolter, D. J., et al. Staphylococcus aureus small-colony variants are independently associated with worse lung disease in children with cystic fibrosis. Clin Infect Dis. 57 (3), 384-391 (2013).
- Takagi, J., et al. Mucin o-glycans are natural inhibitors of Candida albicans pathogenicity. Nat Chem Biol. 18 (7), 762-773 (2022).
- Cinical and Laboratory Standard Institute. . Methods for dilution susceptibility tests for bacteria that grow aerobically. 35 (2), (2015).
- Roberts, A. E., Kragh, K. N., Bjarnsholt, T., Diggle, S. P. The limitations of in vitro experimentation in understanding biofilms and chronic infection. J Mol Biol. 427 (23), 3646-3661 (2015).
- Macia, M. D., Rojo-Molinero, E., Oliver, A. Antimicrobial susceptibility testing in biofilm-growing bacteria. Clin Microbiol Infect. 20 (10), 981-990 (2014).
- Coenye, T., Goeres, D., Van Bambeke, F., Bjarnsholt, T. Should standardized susceptibility testing for microbial biofilms be introduced in clinical practice. Clin Microbiol Infect. 24 (6), 570-572 (2018).
- Turner, K. H., Wessel, A. K., Palmer, G. C., Murray, J. L., Whiteley, M. Essential genome of Pseudomonas aeruginosa in cystic fibrosis sputum. Proc Natl Acad Sci U S A. 112 (13), 4110-4115 (2015).
- Miles, A. A., Misra, S. S., Irwin, J. O. The estimation of the bactericidal power of the blood. J Hyg. 38 (6), 732-749 (1938).
- Robertson, S. N., Romero, M., Fenn, S., Kohler Riedi, P. L., Cámara, M. Development, characterization, and evaluation of a simple polymicrobial colony biofilm model for testing of antimicrobial wound dressings. J Appl Microbiol. 135 (3), lxae042 (2024).
- Rumpf, C., Lange, J., Schwartbeck, B., Kahl, B. C. Staphylococcus aureus and cystic fibrosis-a close relationship. What can we learn from sequencing studies. Pathogens. 10 (9), 1177 (2021).
- Tay, W. H., Chong, K. K. L., Kline, K. A. Polymicrobial-host interactions during infection. J Mol Biol. 428 (17), 3355-3371 (2016).
- Orazi, G., O'toole, G. A. "It takes a village": Mechanisms underlying antimicrobial recalcitrance of polymicrobial biofilms. J Bacteriol. 202 (1), e00530-e00519 (2019).
- Arjes, H. A., et al. Three-dimensional biofilm colony growth supports a mutualism involving matrix and nutrient sharing. eLife. 10, e64145 (2021).
- Kasza, K., et al. Ciprofloxacin poly(β-amino ester) conjugates enhance antibiofilm activity and slow the development of resistance. ACS Appl Mater Interf. 16 (5), 5412-5425 (2024).
- Martin, I., Waters, V., Grasemann, H. Approaches to targeting bacterial biofilms in cystic fibrosis airways. Int J Mol Sci. 22 (4), 2155 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유