מבוא לתמצית
Overview
מקור: המעבדה של ד"ר יי ני טאן — הסוכנות למדע, טכנולוגיה ומחקר
טיטציה היא טכניקה נפוצה המשמשת לקביעת הריכוז הלא ידוע של ניתוח מזוהה. 1-4 זה נקרא גם ניתוח נפחי, כמו מדידת כרכים הוא קריטי טיטציה. ישנם סוגים רבים של טייטציות המבוססות על סוגי התגובות שהם מנצלים. הסוגים הנפוצים ביותר הם טיטריוציות בסיס חומצה ו titrations redox. 5-11
בתהליך טיטרציה טיפוסי, פתרון סטנדרטי של titrant בבורט מוחל בהדרגה להגיב עם ניתוח עם ריכוז לא ידוע בבקבוק Erlenmeyer. עבור titration בסיס חומצה, מחוון pH מתווסף בדרך כלל פתרון ניתוח כדי לציין את נקודת הקצה של טיטרציה. 12 במקום להוסיף מחווני pH, pH יכול להיות מנוטר גם באמצעות מד pH במהלך תהליך טיטרציה ונקודת הקצה נקבעת באופן גרפי מעקומת טיטרציה pH. ניתן להשתמש בנפח הצמיגים שנרשמו בנקודת הקצה כדי לחשב את ריכוז הניתוח בהתבסס על סטויצ'יומטריית התגובה.
עבור titration בסיס חומצה המוצג בסרטון זה, titrant הוא פתרון נתרן הידרוקסיד מתוקננת ואת הניתוח הוא חומץ ביתי. חומץ הוא נוזל חומצי המשמש לעתים קרובות כתבלין קולינרי או חומרי טעם. חומץ מורכב בעיקר מחומצה אצטית (CH3COOH) ומים. תכולת החומצה האצטית של חומץ מסחרי יכולה להשתנות במידה רבה ומטרת הניסוי הזה היא לקבוע את תכולת החומצה האצטית של חומץ מסחרי על ידי טיטציה.
Principles
הקביעה של חומצה אצטית בחומץ מבוססת על העיקרון של שיטת טיטריון בסיס חומצה. התגובה בין NaOH ו- CH3COOH מוצגת במשוואה 1:
CH3COOH(aq) + NaOH(aq) → H2O(l) + NaCH3CO2(aq) (1)
פתרון NaOH מתוקנן מתווסף בהדרגה לחומץ עם ריכוז חומצה אצטית לא ידוע עד לנקודת הסיום. במהלך טיטרציה בסיס חומצה, pH יכול להיות שרטט כפונקציה של נפח של titrant הוסיף. נקודת ההטיה בעקומה, הנקודה שבה יש כמות סטויצ'יומטרית שווה של חומצה ובסיס בתמיסה, נקראת נקודת השתוות. רוב החומצות והבסיסים הם חסרי צבע, ללא תגובה נראית לעין המתרחשת בנקודת השווי. כדי לבחון מתי נקודת השתוות הגיעה, נוסף מחוון pH. נקודת הקצה אינה נקודת שקישות אלא נקודה שבה מחוון ה- pH משנה צבע. חשוב לבחור מחוון pH מתאים, כך שנקודת הסיום קרובה לנקודת שקינות של טיטציה ככל האפשר.
בנקודת הסיום של תגובה זו, בסיס מצומד NaCH3CO2 הוא מעט בסיסי. מחוון פנולפתלין יש טווח pH עובד של 8.3-10.0, שהוא חסר צבע פתרון חומצי ומגנטה מעל pH 8.2. לכן, פנולפתלין הוא אינדיקטור מועדף כפי שהוא ישתנה חסר צבע לוורוד במצב זה. בעת ביצוע הניסוי, עדיף לשמור על ריכוז של אינדיקטור pH נמוך כי אינדיקטורים pH עצמם הם בדרך כלל חומצות חלשות המגיבות עם בסיס.
הנפח של פתרון NaOH מתוקנן הוסיף בנקודת הקצה אז ניתן להשתמש כדי לחשב את ריכוזי הטוחנת של חומצה אצטית בהתבסס על סטואיומטריה של המשוואה לעיל. בניסוי זה, NaOH titrant הוא אלקליין חזק ואת חומצה אצטית אנליט היא חומצה חלשה.
לפני ביצוע הניסוי, חשוב לשקול את האופי ההיגרוסקופי של NaOH. מאפיין זה דורש את הפתרון שלו להיות סטנדרטי עם סטנדרט ראשוני יציב כגון אשלגן מימן פתלט (KHC8H4O4). ריכוז הטוחנת המדויק של פתרון NaOH יכול להיקבע במדויק לאחר התקינה. התגובה בין תקן החומצה הראשי לבין NaOH מוצגת במשוואה 2:
KHC8H4O4(aq) + NaOH(aq) → H2O(l) + NaKC8H4O4(aq) (2)
בסעיף הבא מוצג פרוטוקול טירוט מפורט שלב אחר שלב.
Procedure
1. תקינה של NaOH עם אשלגן מימןפתלט (KHC8H4O4)
- בתור התחלה, טיטרנט, נתרן הידרוקסיד, חייב להיות מתוקנן. הכן פתרון NaOH מלאי על ידי המסת כ 4 גרם של כדורי NaOH ב 100 מ"ל של מים deionized. שים לב כי NaOH הוא כימיקל מסוכן אשר מאכל לעור ומרגיז לעין, להיות זהיר ללבוש ציוד הגנה אישי מתאים (PPE) כדי למנוע מגע עם העור או העין.
- הפוך דילול 1:10 של תמיסה נתרן הידרוקסיד על ידי הוספת 25 מ"ל של תמיסה נתרן הידרוקסיד מלאי לבקבוק 500 מ"ל. נתרן הידרוקסיד סופג פחמן דו חמצני. חשוב למנוע זאת על ידי הקפדה על שימוש במים מבושלים, deionized, בקבוק מיובש בתנור, כדי לכסות את הבקבוק במהירות. הפוך את הפתרון עד 250 מ"ל עם מים deionized ולנער לערבב.
- יבש 4-5 גרם של חומצה סטנדרטית ראשונית, KHC8H4O4 ב 110 °C (4 שעות בתנור ייבוש ולאחר מכן לקרר את מוצק בייבוש במשך 1 שעה.
- להמיס כ 4 גרם של מיובש KHC8H4O4 ב 250 מ"ל של מים deionized. הקלט את המסה במדויק. חשב את הריכוז הטוחן של פתרון KHC8H4O4.
- פיפטה 25 מ"ל של KHC8H4O4 לתוך בקבוק ארלנמאייר נקי ויבש. מוסיפים 2 טיפות של פנולפתלין, ומערבבים בעדינות כדי לערבב היטב. שים לב כי פנולפתלין הוא רעיל ומרגיז, להיות זהיר כדי למנוע מגע עור או עין.
- נקו בורטה של 50 מ"ל ומשפך ביסודיות עם חומר ניקוי ומים. לשטוף את burette עם מים ולשטוף 3x עם מים deionized. יש לשטוף את הבורט בתמיסת NaOH מדוללת 3x, ולוודא שה-NaOH מוקסם מכל המשטח הפנימי ומנקז את הפסולת דרך הקצה. הר את הבורט השטף על הבמה עם מהדק ולוודא שהוא עומד אנכית.
- מלאו את הבורט הנקי בתמיסת NaOH מדוללת. יש לציין כי כמות NaOH מדולל לא צריך להיות בדיוק בסימן אפס אבל צריך להיות בתוך הסולם מספיק עבור טיטציה אחת לפחות. בועות אוויר עשויות להשפיע על הדיוק של קריאת נפח. בדוק בזהירות את burette עבור בועות אוויר, בעדינות הקש על burette כדי לשחרר אותם ולפתוח את stopcock לתת כמה mL של titrant לזרום דרך באותו זמן שחרור כל אוויר לכוד. קרא את הכרך על ידי צפייה בתחתית המניסקוס לאחר 10s. הקלט אמצעי אחסון התחלתי זה. שים לב לנתונים המשמעותיים של הקריאה. הקלט את הערך לשני מקומות עשרוניים ב- mL.
- מניחים את בקבוקון ארלנמייר המכיל אשלגן מימן פתלט (KHC8H4O4) מתחת לבורט ולהתאים את גובה הבורט כראוי. טיטראט הפתרון KHC8H4O4 על ידי הוספה איטית של פתרון NaOH במרווחים של 1-2 מ"ל באמצעות יד אחת כדי לשלוט בקצב הזרימה על ידי התאמת הסטופקוק, והשני מערבולת את הבקבוקון.
- כאשר אתה קרוב לנקודת הקצה, התחל להוסיף את הירידה המלוטטת טיפה אחר טיפה. נקודת הקצה מגיעה כאשר הפתרון הופך צבע ורוד חלש ומתמשך. הקלט את הנפח הסופי של NaOH מדולל בבורט.
- חזור על התשובות לפחות פעמיים נוספות כדי להשיג נתונים עקביים. חשב את הריכוז הטוחן של פתרון NaOH מדולל.
2. טיטרציה של חומץ עם פתרון נתרן הידרוקסיד מתוקנן
- תמיסת נתרן הידרוקסיד מתוקננת כעת וניתן להשתמש בה כטיטרנט לניתוח חומץ. כדי להפחית את הניחוח החריף של חומץ, לדלל 10 מ"ל של פתרון חומץ להיבדק 1:10 הקצבה לנפח כולל של 100 מ"ל.
- פיפטה 25 מ"ל של אנליזה, לבקבוק ארלנמאייר נקי ויבש (ציין כ- VA). מוסיפים 2 טיפות של פנולפתלין.
- מלא את הבורט בפתרון NaOH מתוקנן מהחלק הראשון של ההליך. הקלט את אמצעי האחסון ההתחלתי של titrant (V1).
- מוסיפים בהדרגה את תמיסת NaOH מתוקננת לחומץ. כאשר נפח הצמיגים מתקרב לערך הצפוי, התאם את הסטופקוק כדי להוסיף את הירידה הרודנית אחר טיפה. ממשיכים לסובב את הבקבוק ביד אחת ולשמור על היד השנייה מוכנה לסגור את stopcock. לאחר פתרון הניתוח משתנה לצבע ורוד בהיר, מערבול במשך כמה שניות כדי לראות אם הצבע יתפוגג. אם הצבע נמשך, התמצית מגיעה לנקודת הסיום. הקלט את הכרך הסופי של titrant (V1'). אם צבע הפתרון דועך, הוסף טיפה אחת נוספת של titrant. לשטוף את הקצה התחתון של burette באמצעות בקבוק לשטוף. לאסוף את התערובת שטף ולצפות בשינוי הצבע של פתרון הניתוח. המשך את ההטיה עד לנקודת הסיום. רשום את כמות הצמיגים הדרושה (Vt1 = V1' V1).
- חזור על טיטציה לפחות פעמיים עד שלושה ערכי קונקורדנט הנמצאים בטווח של 0.1 מ"ל זה מזה מתקבל (Vt2 ו- Vt3).
- חשב את הערך הממוצע של אמצעי אחסון titrant באמצעות שלושת הערכים שהושגו בשלושה titrations שונים: Vt = (Vt1 + Vt2 + Vt3)/3. הריכוז הטוחן של חומצה אצטית בחומץ ניתן לחשב כך באמצעות משוואה 3.
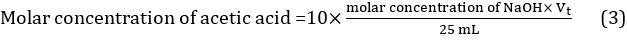
Results
| יחידה | משפט 1 | משפט 2 | משפט 3 | |||
| נפח של חומצת חומץ מדולל (VA) | מ"ל | 25.00 | ||||
| ריכוז טחון של NaOH (cNaOH) | מול/ל | 0.09928 | ||||
| קריאת בורט ראשונית של NaOH | מ"ל | 0.10 | 0. 05 | 1.20 | ||
| קריאת בורט סופית של NaOH | מ"ל | 18.75 | 18.60 | 19.80 | ||
| נפח NaOH חולק | מ"ל | 18.65 | 18.55 | 18.60 | ||
| נפח ממוצע של NaOH מחולק (Vt) | מ"ל | 18.60 | ||||
טבלה 1. תוצאות טיטריון.
חישובים לדוגמה:
מסה של KC8H5O4 = 4.0754 גרם
מסה מולארית של KC8H5O4 = 204.22 גרם / מול
מספר מולים של KC8H5O4 בפתרון סטנדרטי 25.00 מ"ל = 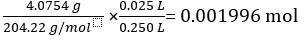
לפי משוואה 2,
ריכוז פתרון NaOH מדולל = 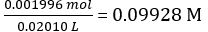
מולים של NaOH מחולק = ריכוז של NaOH × נפח ממוצע של NaOH מחולק = 0.09928 מול / L × 18.60 מ"ל = 1.847 × 10-3 מול
לפי משוואה 1,
מספר מולים של CH3COOH ב 25.00 מ"ל של חומץ מדולל = 1.847 × 10-3 מול
ריכוז של חומץ מדולל = 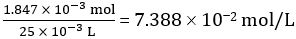
מכאן ריכוז של חומץ לא מדולל = 10 × 7.388 102 מול / L = 0.7388 מול / L
השלבים לעיל מוצגים כדי להמחיש את הליך החישוב; אנחנו יכולים פשוט ליישם משוואה 3 כדי להשיג את הריכוז של חומץ לא דלוק בשלב אחד.
לכן 1.000 ליטר של חומץ לא מדולל מכיל 0.7388 מול של CH3COOH.
נפח של COOH CH3=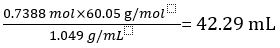
אחוז נפח של חומץ =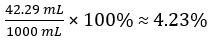
Application and Summary
טיטציה היא שיטה כימית חשובה המיושמת לעתים קרובות במחקר הכימיה הנוכחי. לדוגמה, titration בסיס חומצה מוחל כדי לקבוע אמין או ערך הידרוקסיל של מדגם. ערך האמין מוגדר כמספר מיליגרם של KOH שווה ערך לתוכן האמין גרם אחד של מדגם. כדי לקבוע את ערך ההידרוקסיל, האנליט הוא תחילה אצטילאט באמצעות anhydride אצטית ולאחר מכן titrated עם KOH. המסה במיליגרם של KOH אז מתאים לקבוצות הידרוקסיל גרם אחד של מדגם. 13 דוגמה נוספת היא מבחן וינקלר, סוג מסוים של טיטציה אדומה המשמשת לקביעת הריכוז של חמצן מומס במים למחקרי איכות מים. חמצן מומס מופחת באמצעות סולפט מנגן(II), אשר לאחר מכן מגיב עם אשלגן יודיד לייצר יוד. מאז יוד שוחרר הוא פרופורציונלי ישירות לתוכן החמצן, ריכוז החמצן נקבע על ידי יוד titrating עם thiosulfate באמצעות מחוון עמילן. 14
מלבד יישומים במחקר כימי בסיסי, titration אומץ גם בשימוש תעשייתי ויומיומי. בתעשיית הביודיזל, שמן צמחי פסולת (WVO) יש לנטרל תחילה כדי להסיר חומצות שומן חינם כי בדרך כלל להגיב לעשות סבון לא רצוי. חלק של WVO הוא titrated עם בסיס כדי לקבוע את חומציות המדגם, כך שאר האצווה יכול להיות מנוטרל כראוי. 15 השיטה של בנדיקט, בדיקה לכימות רמת הגלוקוז בשתן, היא דוגמה נוספת המציגה את החשיבות של טיטציה בתחום הבריאות. בטיטרציה זו, יונים קופריים מופחתים ליונים קופרוסים על ידי גלוקוז, אשר מגיבים לאחר מכן עם אשלגן תיוצינאט כדי ליצור משקעים לבנים, המציין את נקודת הקצה. 16
References
- Llc, B. Titration: Ph Indicator, Thermometric Titration, Nonaqueous Titration, Equivalence Point, Acid-Base Titration, Amperometric Titration. General Books LLC, (2010).
- Jacobsen, J. J., Jetzer, K. H., Patani, N., Zweerink, G. & Zimmerman, J. Titration Techniques. J. Chem. Educ. 72, 612, doi:10.1021/ed072p612 (1995).
- Harris, D. C. Quantitative Chemical Analysis. 8th edn, W. H. Freeman, (2010).
- Mattock, G., Taylor, G. R. & Paul, M. A. pH Measurement and Titration. J. Electrochem. Soc. 110, 31C, doi:10.1149/1.2425702 (1963).
- De Levie, R. Aqueous Acid-base Equilibria and Titrations. Oxford University Press, (1999).
- Cannan, R. K. The Acid-Base Titration of Proteins. Chem. Rev. 30, 395-412, doi:10.1021/cr60097a005 (1942).
- Michalowski, T. & Lesiak, A. Acid-Base Titration Curves in Disproportionating Redox Systems. J. Chem. Educ. 71, 632, doi:10.1021/ed071p632 (1994).
- Waser, J. Acid-base Titration and Distribution Curves. J. Chem. Educ. 44, 274, doi:10.1021/ed044p274 (1967).
- Gorbikova, E. A., Vuorilehto, K., Wikström, M. & Verkhovsky, M. I. Redox Titration of All Electron Carriers of Cytochrome c Oxidase by Fourier Transform Infrared Spectroscopy. Biochemistry 45, 5641-5649, doi:10.1021/bi060257v (2006).
- Silverstein, T., Cheng, L. & Allen, J. F. Redox Titration of Multiple Protein Phosphorylations in Pea Chloroplast Thylakoids. Biochim. Biophys. Acta (BBA)-Bioenerg. 1183, 215-220, doi:10.1016/0005-2728(93)90022-8 (1993).
- Lenghor, N., Jakmunee, J., Vilen, M., Sara, R., Christian, G. D. & Grudpan, K. Sequential Injection Redox or Acid-Base Titration for Determination of Ascorbic Acid or Acetic Acid. Talanta 58, 1139-1144, doi:10.1016/S0039-9140(02)00444-7 (2002).
- Mitchell, P., Moyle, J. & Smith, L. Bromthymol Blue as a pH Indicator in Mitochondrial Suspensions. Eur. J. Biochem. 4, 9-19, doi:10.1111/j.1432-1033.1968.tb00166.x (1968).
- Perkins, E. G. Analyses of Fats, Oils and Derivatives. AOCS press, (1993).
- Spellman, F. R. Handbook of Water and Wastewater Treatment Plant Operations. 2 edn, CRC Press, (2009).
- Purcella, G. Do It Yourself Guide to Biodiesel: Your Alternative Fuel Solution for Saving Money, Reducing Oil Dependency, Helping the Planet. Ulysses Press, (2007).
- Nigam. Lab Manual Of Biochemistry. Tata McGraw-Hill Education (2007).
Tags
Skip to...
Videos from this collection:

Now Playing
מבוא לתמצית
General Chemistry
424.0K Views

כלי זכוכית ושימושים נפוצים במעבדה
General Chemistry
655.3K Views

פתרונות וריכוזים
General Chemistry
273.7K Views

קביעת הצפיפות של מוצק ונוזל
General Chemistry
555.7K Views

קביעת הרכב אחוז המסה בפתרון מימי
General Chemistry
383.3K Views

קביעת הנוסחה האמפירית
General Chemistry
180.7K Views

קביעת כללי המסיסות של תרכובות יוניות
General Chemistry
141.3K Views

שימוש במד pH
General Chemistry
345.2K Views

חוק הגז האידיאלי
General Chemistry
78.3K Views

קביעת ספקטרופוטומטריה של קבוע שיווי משקל
General Chemistry
158.3K Views

עקרון לה שאטלייה
General Chemistry
264.9K Views

דיכאון נקודת הקפאה כדי לקבוע תרכובת לא ידועה
General Chemistry
160.6K Views

קביעת חוקי התעריפים וסדר התגובה
General Chemistry
195.9K Views

שימוש בסריקה דיפרנציאלית קלורימטריה למדידת שינויים באנטלפיה
General Chemistry
44.4K Views

מתחמי כימיה של תיאום
General Chemistry
91.3K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved