Method Article
자원 제한 설정에 대한 경제적 인 HIV-1 약제 내성 모니터링 방법
요약
항 레트로 바이러스 치료 (ART)를 실패한 HIV-1에 감염된 개인에 대한 약제 내성 검사는 미래의 치료법을 안내하고 치료 결과를 향상시킬 수 있습니다. 높은 HIV의 유행하지만 자원 제한 설정에서 최적화 개인과 집단의 건강 결과는 궁극적으로 저렴하고 접근 약제 내성 유전자형과 해석 방법이 필요합니다.
초록
HIV-1 약 저항은 심각 항 레트로 바이러스 치료 (ART)의 효과 및 영향을 손상시킬 가능성이있다. 사하라 사막 이남의 아프리카에있는 예술 프로그램을 계속 확장으로, 예술에 개인은 밀접하게 약제 내성의 출현을 감시해야한다. ART에 이미 내성 바이러스 균주의 전송을 추적 할 수있는 전송 약물 저항의 감시도 중요합니다. 유전자형이 비싸고 정교한 실험 및 데이터 관리 인프라를 필요로하기 때문에 불행하게도, 약제 내성 검사는 여전히 자원 제한 설정에 쉽게 액세스 할 수 없습니다. 개인 관리 및 전송 약제 내성을 평가하기 위해 오픈 프리 유전형 약제 내성 모니터링 방법을 설명한다. 이 방법은 약제 내성 패턴의 해석과 개별 환자 보고서의 생성을위한 무료 오픈 소스 소프트웨어를 사용합니다. 유전자형 프로토콜은 AV와 혈장보다 큰 95 %의 증폭 율이iral로드> 1000 HIV-1 RNA에 복사 / ㎖. 감도는 바이러스 부하 <1000 HIV-1 RNA에 복사 / ㎖에서 상당히 감소한다. 여기에 설명 된 방법은 미국 식품의 약국 (FDA), Viroseq 유전자형 방법에 의해 승인 된 테스팅을 HIV-1 약물 저항의 방법에 대하여 검증 하였다. 여기에 기술 된 방법의 제한은 자동화하고 동일한 패널 아형 및 B를 증폭 있지만 그것은 또한, 샘플의 유효성 패널 순환 재조합 형태 CRF02_AG를 증폭 실패한되지 않는다는 사실을 포함한다.
서문
남부 아프리카에서 HIV 전염병은 특히 남아프리카 공화국 2, 3, 항 레트로 바이러스 치료 (ART)에 개인의 동반 지수 증가와 함께 급속 한 발전하고있다. 발생 4를 줄이고 자원 제한 설정에서 기대 수명 (RLS)을 5 증가에 큰 규모의 치료 프로그램의 역학적 영향에 대한 증거로 축적 계속, 예술의 범위를 확대하기위한 노력이 강화 될 것이다. 검사 및 치료 프로그램에 따라 예방 도구 6, 7과 같은 치료의 사용으로 가이드 라인의 진화는 치료에 대한 개인의 절대 수는 더욱 증가 할 것을 의미합니다. 개인의 큰 숫자는 예술에 대한 개인의 평균 수명은 HIV에 감염되지 않은 인구 8의 가까워지면서 오랜 시간 동안 예술에있을 것입니다. HIV의 약제 내성의 발달 및 전송 ALWA 마련되어YS ART 9-12의 성과에 대한 위협으로 간주되었다. 따라서, 많은 개인은 ART에 개시 될 때보다 엄격한 감시 및 약물 저항의 모니터링을위한 필요성이 존재한다.
유전형 약제 내성 (GRT) 테스트는 감시뿐만 아니라 예술을받는 개인의 HIV-1 약제 내성 모니터링 모두 선진국에서 성공적으로 사용되어왔다. 이 설정에서, GRT는 HIV-1에 감염된 사람들을위한 치료의 연속성에 통합되었습니다. 대부분의 국제 가이드 라인은 성인이나 ART (첫 번째 줄과 두 번째 줄) 13-15 실패 소아 환자에 대한 GRT를 추천, 소아의 어머니에 아이 전송 (PMTCT)식이 요법의 예방에 노출 된 환자 만, 이후 16 감염과 함께 설정에서 심하게 감염된 개인 13 ~ 15 사이에서 전송 약물 저항의 높은 수준. 그러나, 비용, 기술 및 인프라 요구 사항은 implemen을 제한RLS의 약제 내성 감시와 유사한 접근 방법 테이션.
남아프리카 공화국 에이즈 치료 및 모니터링 가이드 라인은 현재 첫 선 17식이 요법 실패하는 사람들을위한 예술의 안내 선택에 GRT의 사용을 권장하지 않습니다. 개인은 주로 한 바이러스 (HIV-1 RNA 바이러스 부하) 매개 변수를 기반으로 전환됩니다. 그러나 2012 년, 남부 아프리카의 HIV 임상의 사회는 최초의 남부 아프리카의 ARV 약물 저항 테스트 가이드 라인 (18)을 발표했다. 이 지침은 첫 번째 줄과 두 번째 줄 ART 실패한 모든 성인과 PMTCT (18)에 노출 감염된 유아와 어린이를위한 GRT 테스트를 권장합니다. 남부 아프리카 19-29로 전송 약물 저항의 높은 수준에 대한 현재의 증거가 없기 때문에 그러나, GRT 심하게 감염된 개인에 대해 18을 사용하지 않는 것이 좋습니다. 그것은 이러한 추천 몇몇 국가 트레으로 시간이 지남에 따라 통합 될 것으로 기대된다지역의 다양한 국가의 atment 및 모니터링 지침. 이미 2013 년 남아프리카 공화국의 치료 지침에 성인을위한 두 번째 라인 실패의 시간과 아이들 (30)에 대한 첫 번째 또는 두 번째 라인 PI 기반 요법의 실패시에 GRT의 추천은 지금있다.
그것은 남아 프리카 공화국에서 치료 지침에 GRT를 도입하는 것은 잠재적으로 비용 중립 될 것으로 나타났습니다. 진정으로 두 번째 라인 치료로 전환 할 필요가 환자를 식별하는 GRT를 사용하여, 상대적으로 고가의 첫 번째 줄의 약물보다 두 번째 라인 요법 약물의 비용을 고려하면 프로그램에 대한 추가 비용을 발생하지 않습니다. 또, GRT 또한, 실패 다른 이유를 식별 치료 옵션을 보존하고 신흥 저항 패턴 (31)에 대한 정보를 생성 할 수있다. 따라서, 더욱 프리, 케어의 질을 향상시키기 위해 약물 저항 모니터링 방법의 비용을 감소시킬 필요가D 결과.
여기서, 우리는 역전사 중합 효소 연쇄 반응 (PCR) 및 시퀀싱 (표 1)뿐만 아니라 약제 내성 해석 대부분 오픈 소스 소프트웨어 일반 (오픈 소스) 프라이머를 사용하도록 설계 GRT 방법을 제시한다. 임상 관리의 경우, 프로토콜은 국가의 치료 지침에 밀착성을 가진 실험실 약제 내성 보고서의 전문 해석과 함께 종합적인 검토 및보고 방법에 의해 칭찬. 프로토콜은 네 가지 구성 요소로 나누어 져 1) HIV 리보 핵산 (RNA) 추출, 2) 역전사 중합 효소 연쇄 반응 (PCR) 바이러스 성 대상의 확대, 3) 시퀀싱 및 크로마토 그램, 정렬의 분석을위한 4) 생물 정보학 방법, 큐 레이션 및 시퀀스 데이터의 해석.
프로토콜
1. 에틸렌 디아민 테트라 아세트산 (EDTA) 전체 혈액 처리
참고 : 혈액은 즉시 수집은 더 이상 24 이상의 시간 동안 4 ° C에 저장할 수 있습니다 후 처리 할 수 있습니다.
- 생물 안전 캐비닛에서 작업, EDTA 전혈 샘플은 실내 온도에 도달 할 수 있습니다.
- 각 샘플의 경우, 샘플 식별 (ID), 저장 물질 (플라즈마), 날짜와 충분히 cryovials 레이블.
- 1,000 X g에서 10 분 동안 원심 분리. 원심 분리기를 중지 브레이크를 사용하지 마십시오. 혈소판을 포함하고 적혈구, - 매우 얇은 층 - 혈장, 백혈구 (버피 코트) :이 세 가지 층 (위에서 아래로)을 얻을 것입니다.
- 조심스럽게 각 cryovial에 뜨는 (플라즈마)와 나누어지는 500 ㎖를 대기음. 셀 층 (버피 코트를) 중단 또는 세포를 전송하지 않도록주의하십시오.
- RNA 추출을 위해 필요할 때까지 -80 ° C에 저장하거나 바로 RNA 추출을 진행합니다.
- 긍정과 부정 플라즈마 컨트롤을 포함하여 추출 할 수있는 샘플의 ID와 추출 워크 시트를 준비합니다.
- 각 샘플을 추출 할 경우, 샘플 ID 추출 일시 "RNA"와 1.5 ㎖의 멸균 microcentrifuge 관 레이블. 또한 조립 된 열 및 수집 관뿐만 아니라 추출 워크 시트에서 해당 번호와 함께 작업 용해 액을 포함하는 2 ML의 microcentrifuge 관 레이블.
- 바이오 안전 캐비넷에서의 작업, 작업 용해 액의 대응 2 ML의 microcentrifuge 관에 200 ㎕의 샘플을 추가합니다.
- 와동 웰, 실온에서 10 분 동안 배양한다.
- 10 분 후, 간단히 튜브를 원심 분리기.
- 튜브의 각에 무수 에탄올 800 ML을 추가합니다.
- 펄스 소용돌이로 교반 짧게 원심 분리기로 섞는다.
- 해당 열 / 수집 튜브 어셈블리에이 솔루션을 600 μl를 전송합니다. 6,000 X에서 원심 분리기1 분 g.
- 새 컬렉션 튜브에 열을 전송하고 여과 액을 포함하는 이전 수집 튜브를 폐기합니다. 두 번 더 위의 단계 2.8 (위)를 반복합니다.
- 1 분 6,000 XG에 각 열 및 원심 분리기 500 μL 세척 버퍼 AW1를 추가합니다.
- 여과 및 수집 튜브를 폐기하고 새로운 컬렉션 튜브에 열을 전송합니다.
- 추가 500 μl의 3 분 20,000 XG에서 버퍼 AW2 원심 분리했다. 2.11 단계를 반복합니다.
- 추가로 2 분 동안 20,000 XG에서 새 컬렉션 튜브에 원심 분리기.
- 1.5 ML microcentrifuge 관에 여과 액과 장소 열을 버리십시오.
- 만약 컬럼의 측면에 액체를 분배하지 않는 것을 보장 열의 중간에 60 μL 버퍼 AVE (의 RNase없는 물)를 첨가.
- 1 분 동안 실온에서 배양한다.
- 2 분 6,000 XG에 원심 분리기.
- 열을 삭제하고 1.5 ML의 microcentrifuge 튜브를 모자.
- 샘플은 현재 되돌리기위한 준비SE 전사.
- 시험은 최대 6 시간 동안 4 ° C에서 즉시 저장을 수행해야하는 경우. 시험이 지연 될 경우에는, 즉시 -80 ° C에서 배치. NB : 동결하지 않는 / 3 배 이상의 샘플을 해동.
3. 역전사를위한 시약 준비
- 시작하기 전에, 양 및 음의 플라즈마 컨트롤 등으로 처리되는 샘플의 수에 필요한 시약의 각각의 양을 계산한다. 또한 시약 컨트롤을 추가합니다.
- 3.1 단계에서 계산 된 볼륨을 사용하면 (위), 간단히 펄스 소용돌이로 교반 한 다음 깨끗하고 살균 200 μL PCR 튜브에 데 옥시 리보 뉴클레오티드 인산 (의 dNTP) 프라이머 믹스를 준비합니다. 각 샘플은, 역방향 프라이머 RT21 0.5 μL와의 dNTP의 0.5 μl를 가지고 표 2를 참조한다.
- 200 μL의 PCR 튜브에의 dNTP-프라이머 믹스의 나누어지는 1.0 μL.
- 1 μ을 추가하여 역전사 효소를 준비 (RT) 효소의 혼합; 10 배 역전사 버퍼의 L, 0.1M DTT의 1 μL와 소용돌이로 교반 간단히 원심 분리 한 다음 멸균 튜브에 25MM MgCl2를 2 μL는 표 3을 참조하십시오.
- 0.5 ㎕의 RNAseOUT 및 첨자 III 효소 혼합 튜브에 역전사 효소의 각을 추가 한 후 혼합 부드럽게 튜브를 누릅니다.
- 감기 블록의 dNTP-프라이머 믹스 및 효소 혼합 튜브를 유지하고 RNA 역으로 이동합니다.
4. 역전사
- 간단히 혼합 텍싱 다음의 dNTP-프라이머 혼합 튜브에 RNA 샘플의 10 μl를 추가합니다.
- RNA의 첨가 한 후,의 dNTP / 프라이머 / RNA 믹스와 RT 효소 감기 블록 또는 얼음에 튜브를 혼합 모두와 PCR의 방으로 이동합니다.
- 간단히 (단계 4.2)의 dNTP / 프라이머 / RNA 혼합 튜브를 원심 분리기와 열 순환기에 배치합니다.
- RNA를 변성하는 5 분 동안 65 ° C에서 가열한다.
- 4 ° C로 급속 냉각, 2 개최분.
- 4 ° C에서 여전히 동안 열 순환기를 일시 정지, 튜브를 꺼냅니다.
- 감기 블록에 튜브를 유지하면서 신속하게 효소 믹스의 5 μl를 추가합니다.
- 튜브를 눌러 부드럽게 혼합 살짝 누른 후 튜브를 원심 분리기와 열 순환기로 돌아갑니다.
- 역전사를 중지 5 분 동안 85 ° C에서 효소의 변성 다음에 RNA를 표기 반대하는 60 분 동안 50 ° C에서 튜브를 잡습니다.
- 37 ℃로 냉각 즉시 온도가 37 ° C에 도달, 일시 정지 및 열 순환기 밖으로 관을.
- 신속하게 튜브에 RNAse가 H의 0.5 μl를 추가하고 열 순환기로 돌아갑니다.
- 20 분, 4 ℃로 냉각 한 후 37 ° C에서 개최
- 보완 DNA (cDNA를) 즉시 사용하거나 필요할 때까지 -20 ° C 또는 추운에 저장할 수 있습니다. 그러나,의 cDNA의 장기 보관은 -80 ° C.에 있어야합니다
5. PCR 용 시약 준비
- Befo시작에 재 처리되는 샘플 및 컨트롤 수에 필요한 시약의 각각의 양을 계산한다. 세 개의 컨트롤 (긍정적, 부정적, 및 시약) 이외에, 당신은 또한 PCR 제어 (HIV DNA)를 추가 할 수 있습니다. 제 1 및 제 2 라운드 PCR 믹스를 동시에 제조 할 수 있으며, 필요할 때까지 제 마스터 믹스는 -20 ° C에서 저장. 혼합물은 약 8 시간 동안 저장 될 수있다.
- 표 4와 소용돌이에 같이 18.4 ㎕의 물, 2.5 ㎕의 10 배 버퍼, 1.0 ㎕의 MgCl2를 0.5 μL의 dNTPs를, 그리고 프라이머 각각 0.25 μl를 추가합니다.
- 플래티넘 DNA 형성 촉매 효소 (5U/μl)의 0.1 μl를 추가하고 부드럽게 눌러 튜브를 혼합.
- 200 μL의 PCR 튜브에 마스터 믹스의 나누어지는 23 μL.
- 감기 블록 또는 PCR 방에 얼음 이동의 마스터 믹스 튜브.
6. 중첩 된 PCR
- 1 차 PCR의 maste 23 μL로의 cDNA 2 μl를 추가R 섞는다.
- , 튜브를 닫고 열 순환기에 시료를 넣고 다음 PCR 순환 사용 조건 : 2 분 동안 2 분, 30 초 동안 95 ° C의 30주기, 20 초 동안 58 ° C, 72 ° C, 94 ° C를, 그림 1과 같이 10 분 동안 72 ° C에서 최종 확장자 하였다.
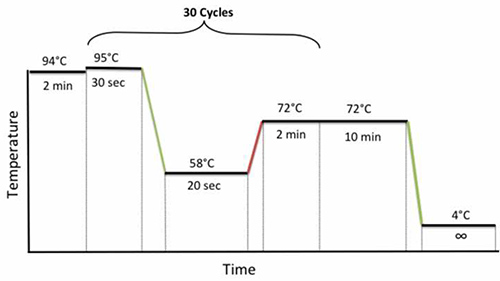
그림 1. 중첩 된 PCR 순환 상태. 더 큰 이미지를 보려면 여기를 클릭하십시오.
- 2 라운드 PCR 단계로 계속 또는 이후 단계에서 필요한 때까지 -20 ° C 또는 추운 1 라운드 PCR 제품을 저장합니다.
- 2 차 PCR의 경우, 2 차 PCR 마스터 믹스 23 μL에 1 라운드 PCR 제품의 2 μl를 추가도 1에서 동일한 PCR 프로그램을 사용 ㄹ.
7. 젤 전기
- 젤 준비
- 250 ㎖의 유리 플라스크에 아가로 오스 태블릿의 0.5 g을 추가하고 플라스크에 1X TBE 버퍼의 50 ML을 추가합니다.
- 끓는 전자 레인지에서 가열, 완전히 용해 될 때까지 자주 (대략 매 30 초)을 소용돌이 친다. 실리콘 그립이나 실리콘을 사용하여 오븐 뜨거운 플라스크를 파악하는 장갑. 아가로 오스 용액이 프로세스를 모니터링 밀접 쉽게 플라스크 비등 수있다.
- 약 10 분 동안 실온에서 냉각한다.
- 적절한 크기의 빗을 포함하는 겔 캐스팅 트레이에 아가로 오스 부어 겔은 약 20 ~ 30 분을 사용할 수 있습니다.
- 전기 챔버에 젤을 놓고 제조업체에서 권장하는 실행합니다.
- 겔 전기 영동 및 시각화.
- 10 초 동안 소용돌이 소설 주스 사용하기 전에.
- D의 5 μL와 소설 주스 1 μl를 희석NA 샘플 및 혼합.
- 분자량 마커의 3 μL와 소설 주스의 3 μl를 희석 혼합.
- 섹션 (위) 7.2.2과 7.2.3에서 믹스를 넣고 PCR 증폭을 평가하기 위해 40 분 동안 100 V 및 400mA에서 젤을 실행합니다.
- 긍정적 증폭은 1,315 bp의 조각, 그림 2와 UV 빛에서 시각화 할 수 있습니다.
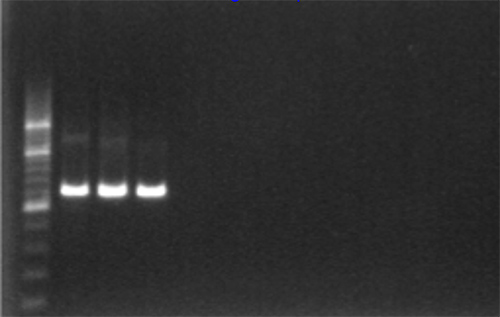
그림 2. 1 % 아가로 오스 겔 전기 영동 및 200 bp의 사다리를 사용하여 PCR 증폭 젤 확인. 더 큰 이미지를 보려면 여기를 클릭하십시오.- 따라서 오염의 부재를 나타내는 부정적인 및 시약 컨트롤에 증폭이 없어야합니다.
8. PCR 제품 정리
- 시퀀싱 반응에 대비하여, 양의 두 번째 라운드 PCR 제품은 PureLink의 PCR 정제 키트를 사용하여 청소합니다.
- PCR 제품과 피펫 믹스 20 ㎕에 바인딩 버퍼 높은 컷오프 (B3)를 작업의 80 μl를 추가합니다.
- 컬렉션 관에서 스핀 컬럼에 바인딩 버퍼와 혼합 샘플을 추가합니다.
- 1 분 동안 10,000 XG에서 열을 원심 분리기. 새 컬렉션 튜브에 열을 전송합니다.
- 에탄올로 세척 버퍼 650 μL와 컬럼을 씻으십시오.
- 1 분 동안 10,000 XG에서 열을 원심 분리기. 새 컬렉션 튜브에 열을 전송합니다.
- 잔여 세척 버퍼를 제거하기 위해 2 ~ 3 분 동안 최대 속도로 열을 원심 분리기.
- 키트와 함께 제공되는 깨끗한 1.7 ㎖의 용출 튜브에 스핀 열을 놓습니다.
- 칼럼의 중심에 용출 버퍼의 40 μl를 추가 룸 temperatur를에 열을 품어1 분 동안 전자.
- 2 분 (> 10,000 ×)에 대해 최대 속도로 열을 원심 분리기.
- 용출 관은 순서를위한 당신의 정제 된 PCR 제품이 준비가 포함되어 있습니다. 열을 폐기하십시오.
- Nanodrop를 사용하여 DNA의 농도와 품질을 확인합니다.
- 제공된 실내 시퀀싱 설비를 사용할 수없는 경우에, 정제 된 PCR 제품이 단계에서 시판 시퀀싱 실험실로 보내질 수있다.
9. 시퀀싱 반응
- PCR 제품은 큰 염료 종료 키트 버전 3.1 및 각 샘플에 대한 4 프라이머 (앞으로이 두 역)를 사용하여 순서가됩니다. 프라이머 서열은 표 2에 나타낸다. 따라서, 연속 실행 후, 각 샘플은 인접에 조립되는 네 개의 시퀀스를해야합니다.
- 네 개의 프라이머 각각에 대해 표 5에 표시된대로 시퀀싱 반응을 설정합니다.
- 사용하기 전에 소용돌이로 교반하여 시퀀싱 버퍼와 프라이머를 혼합.
- 혼합큰 염료 순서를 추가하기 전에 물, 버퍼와 프라이머. 소용돌이로 교반하여 혼합.
- 부드럽게 튜브를 반전 또는 가볍게 터치하여 큰 염료 시퀀싱 믹스를 추가 한 후 마스터 믹스를 섞는다.
- 96 - 웰 광학 플레이트에 마스터 믹스의 나누어지는 10 μL.
- 그림 3 아래에 표시된대로 판을 설정 24 샘플 / 플레이트를 실행하기 위해.
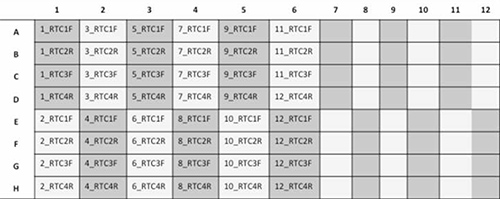
그림 3. 12 환자의 샘플이 4 프라이머 각 (RTC1F, RTC2R, RTC3F 및 RTC4R)과 염기 서열되고있는 96 - 웰 플레이트의 계획 표현입니다. 더 큰 이미지를 보려면 여기를 클릭하십시오.
- DNA 샘플 (~ 20-40 NG)의 1.0 μl를 추가, 접시를 커버N 알루미늄 커버를 접착 한 후 가볍게 섞는다.
- 1 분 3,000 XG에 원심 분리기. 알루미늄 커버를 제거하고 고무 씰링 매트를 추가합니다.
- 열 순환기에 접시를 놓고 그림 4와 같이 다음과 같은 순환 프로그램을 실행합니다.
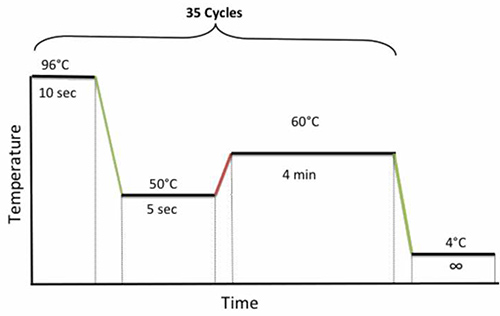
그림 4. 시퀀싱을위한 PCR 순환 상태. 더 큰 이미지를 보려면 여기를 클릭하십시오.
- PCR이 완료되면 즉시 시퀀싱 제품을 청소하십시오.
10. 서열 정리
- 각각의 시퀀싱 반응의 경우, 50 ㎕의 절대 에탄올과 5 ㎕의 3 M 아세트산 나트륨을 혼합한다.
- 멀티 채널 피펫을 사용하여, 55을 추가 및# 956]을 각 웰에 아세트산 나트륨 /의 EtOH 용액의 리터.
- 각이 잘 적절하게 밀봉 된 것을 보장, 접착 알루미늄 커버와 우물을 봉인.
- 20 분 3,000 XG에 원심 분리기.
- 20 분 후, 덮개를 분리하고 (이것은 펠렛을 제거하므로 상층 액을 제거하는 쾅하지 마십시오!) 접힌 실험실 조직에, 한 번의 부드러운 동작, 접시를 반전.
- 2 분 150 XG에서 같은 조직에 반전 플레이트를 원심 분리기.
- 즉시 EtOH로 150 ㎕의 차가운 70 %를 추가합니다. 이 단계에서 에탄올의 추가를 지연하지 마십시오.
- 같은 접착제 알루미늄 커버와 소용돌이와 함께 인감.
- 5 분 3,000 XG에 원심 분리기.
- 1 분 150 XG에 반전 새 접힌 조직과 원심 분리기에 플레이트를 반전.
- 원심 분리 후, 열 순환기에서 발견 배치하고 2 분 동안 50 ℃에서 건조.
- 플레이트가 건조되면, 접착 호일 커버로 밀봉 준비가 위스콘신을 진행 할 때까지 -20 ˚ C에서 박과 가게에서 포장시퀀싱 전기를 토륨.
- 일련의 준비, 10 ㎖ 하이 디 포름 아미드에 청소 시퀀싱 제품을 분해 할 때, 변성 및 전기에 대한 부하.
11. 생물 정보학
- 시퀀스 어셈블리
- 프로그램 Geneious를 시작합니다.
- 시퀀스를 저장하는 작업 폴더를 만듭니다.
- 가져 오기 툴을 사용하여 작업 폴더로 시퀀싱 기계에 의해 생성 된 ABI 파일을 가져. Geneious 수입 각 시퀀스에 대한 비율의 품질 평가 점수를 할당합니다.
- 이를 더블 클릭하여 품질 평가 점수> 70 %로 열기 시퀀스.
- 각 파일은 새 창에서 열립니다. 소프트웨어는 하늘색 막대를 사용하여 시퀀스의 품질의 크로마토 그램의 각각의 뉴클레오티드 위치에서 품질을 나타낼 것이다. 바 높을 기본 통화 품질 나은.
- 커서를 사용하여 품질이 좋지 보통이다 끝을 떠나 시퀀스의 중간 부분을 선택합니다.
- 좋은 품질의 순서로 영역을 추출하는 추출 버튼을 클릭합니다.
- 각 샘플에 대한 네 개의 추출 된 시퀀스를 선택하고 참조 순서에 그들을 조립.
- 올바른 독서 프레임 보장하기 위해 조립 순서를 검사합니다. PQITLW : 올바른 독서 프레임에있는 경우, 프로테아제의 시작은 다음과 같은 아미노산으로 시작해야합니다. RT의 시작은 PISPIE와 함께 시작됩니다.
- 제 300 RT 코돈에 PR의 시작 부분을 덮고있는 인접 지역의 압축을 풉니 다. 이 과정에서, 또한 삽입이나 삭제를 확인합니다.
- 추출 된 인접의 합의 순서를 통해 이동하는 모호성을 식별하고 기본 통화 품질 (대칭, 높이, 배경과의 측면에 위치하고있는 지역의 어깨를) 검사하여 혼합 기지와 위치를 확인합니다.
- 합의의 순서를 선택하고 네 개의 프라이머에서 합의 시퀀스의 별도의 파일을 생성하고 라베에 추출 버튼을 클릭합니다내가 그것을 적절하게.
- 컴퓨터 또는 네트워크 폴더에 백업 저장 폴더에 순서를 보냅니다.
- 시퀀스 품질 평가 (HIVDB)
- 에서 HIVDB 프로그램을 사용하여 서열을 분석 http://hivdb.stanford.edu .
- 요약 데이터 삭제 및 삽입을 확인하고 순서가 모두 99 프로테아제 (PR) 코돈과 1 300 RT 코돈을 포함하는지 확인하십시오.
- 어떤는 정지 코돈, 프레임 변화, 모호한 위치와 특별한 잔류 물로 모두 PR 및 RT 지역에서 품질 보증 (QA) 문제를 강조 표시를 확인합니다.
- 시퀀싱 품질 관리
- 이전 실행에서 로컬 시퀀스 데이터베이스에 대해 새 시퀀스를 폭발.
- 새로운 시퀀스는 데이터베이스의 모든 시퀀스 유사한> 97 % 인 경우, 프로토콜의 모든 단계는 서열 분석으로 시작하고 뒤 ensur에 RNA 추출 예정 검토되어야전자 더 믹스 업 (샘플 전환, mislabeling) 또는 오염이 없었다고.
- 아무런 문제가 발견되지 않으면, RNA 추출 단계에서 두 신구 샘플의 분석을 반복한다.
- 시퀀스가 계속> 97 % 유사한 경우, 개인 사이의 역학적 연결에 대해 평가하기 위해 환자 기록을 검토.
- 계통 발생 학적 분석
- Geneious에 CLUSTALW 프로그램을 사용하여 데이터베이스의 모든 순서를 맞 춥니 다.
- 수동으로 잘못 정렬 순서, 삭제 및 삽입에 대한 정렬을 확인하고 그에 따라 편집 할 수 있습니다.
- 계통 발생 PHYML를 사용하여 나무, Geneious 트리 빌더 또는 Geneious의 다른 트리 빌더를 구축합니다.
- 짧은 가지의 길이를 샘플에 대한 트리를 검사합니다.
- 오염 가능성에 대한 짧은 가지의 길이와 샘플을 검토합니다.
12. REGA DB 정보학
- 시퀀스 업로드
- RegaD에 로그인고유 한 사용자 이름과 암호를 사용하여 B.
- 드롭 다운 메뉴에서, 환자 ID에서 "로 시작합니다"를 선택합니다.
- 환자 ID를 추가하고 그 유전자형을 업로드 할 수있는 개인을 선택합니다.
- 왼쪽에있는 메뉴에서 "바이러스 분리"를 선택합니다.
- 바이러스 분리 아래의 옵션에서 "추가"를 선택합니다.
- 샘플 날짜, 샘플 ID, 시퀀스 ID 및 시퀀스 날짜를 입력합니다.
- "파일을 선택"다음 업로드 할 시퀀스의 FASTA 파일로 이동을 선택합니다.
- 업로드 할 FASTA 파일을 선택한 후 업로드를 클릭합니다.
- 업로드 순서가 순서를 식별하고 날짜에 따라 염기 상자에 표시되면, 윈도우의 오른쪽 하단에있는 확인 버튼을 클릭합니다.
- 버튼 단백질을 클릭 PR 또는 RT를 선택하여 PR 및 RT 단백질의 정렬을 확인합니다.
- 저항 버튼을 클릭하여 약제 내성 돌연변이를 확인합니다. 이것은 제공당신이 세 가지 알고리즘에서 저항 프로파일 : ANRS, 스탠포드 HIVDB 및 RegaDB.
- REGA를 사용하여 보고서 생성
- 고유 한 사용자 이름과 암호를 사용하여 RegaDB에 로그인합니다.
- 드롭 다운 메뉴에서, 환자 ID에서 "로 시작합니다"를 선택합니다.
- 환자 ID를 추가하고 그 보고서를 생성 할 수있는 개인을 선택합니다.
- 오른쪽에있는 메뉴에서 바이러스 분리를 선택합니다.
- 바이러스 분리 아래의 옵션에서 "보기"를 클릭합니다.
- 보고서를 만들려는 바이러스 분리를 더블 클릭합니다.
- 바이러스 분리 창에서 바이러스 분리의 보고서 탭을 클릭합니다.
- 드롭 다운 메뉴에서 유전자형의 해석하고 사용하는 선택 보고서 템플릿에 대한 알고리즘을 선택합니다.
- 알고리즘과 템플릿을 선택한 후, 버튼 "생성"을 클릭합니다.
- 생성 된 RTF 문서를 다운로드합니다.
- RTF 할여워드 문서로 cument.
- 치료 기록 차트의 크기를 조정합니다.
- 차트 후에는 '임상 차트와 저항의 해석 "을 추가합니다.
- 저항 테이블 및 임상 차트의 데이터를 사용하여 환자의 치료 이력으로 시작 환자의 내성 프로파일의 설명을 추가하고, 약물이되는 바이러스 분리는 내성하도록. 또한 환자의 바이러스 부하의 설명과 차트에서 CD4 + 세포 수의 프로파일을 추가합니다.
- 전염병 검토 (ID) 전문가와 미래의 환자 관리에 대한 권장 사항에 보고서를 보냅니다. 이 과정은 또한 매우 중요한 품질 보증 단계이다. 최종 보고서는 환자를 관리하는 임상의, 모든 권고와 함께 전송되기 전에 치료의 역사에서 유전자형 또는 inconsistences에 오류가 적, 바이러스 및 면역 학적 프로파일을 확인하고 검토 할 수 있습니다.
결과
검증 방법은 이전에보고 된 방법 (20)의 변형이었다. FDA에 의해 승인되었습니다 Viroseq의 유전자형 방법은 유효성 검사의 기준 방법으로 사용되었다. AIDS에 대한 연구 및 바이러스 성 간염 (ANRS)에 대한 프랑스의 국립 기관에서 얻은 숙련도 시험 샘플의 패널은 두 가지 방법 사이의 주요 비교에 사용되었다. 두 유전자형 방법은 성공적으로 두 가지 방법에 의해 증폭 된 샘플 HIVDB 프로그램에 의해 해석 등 모든 임상 적으로 중요한 약제 내성 관련 돌연변이를 식별하는 100 % 조화 된이었다. 표 6에 나타낸 바와 같이, 3 켤레 염기 서열은 99.5 % 동일 하였다. 예측 된 아미노산 서열은 100 % 동일 하였다. 다섯 중 하나의 샘플을 성공적으로 Viroseq에 의해 증폭 될 수 없습니다. Viroseq 의해 증폭되지 샘플 이외에, 사내 방법이 도시 된 두 번째 샘플을 증폭하는데 실패Viroseq에 의해 순환 재조합 바이러스 (CRF02_AG)이 될 수 있습니다. 두 방법으로 증폭 된 3 개의 시료는 서브 타입 B (2 개 샘플)과 서브 타입 A (하나의 샘플)이었다.
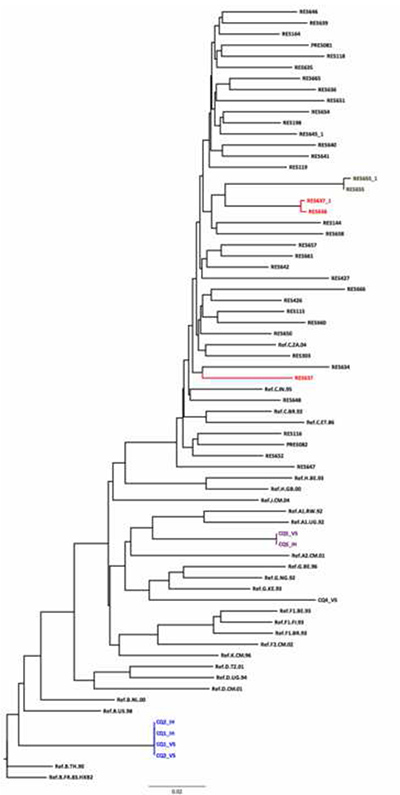
그림 5. 시퀀스 품질 보증의 한 부분으로 수행 HKY 이웃 가입 나무의 사용은. 매우 짧은 유전자 거리와 순서 네 쌍 / 클러스터가 있습니다. RES655과 RES655_1 사이의 유전 적 거리 (같은 샘플을 다른 일에 순서가) 0.003이다. 유전 적 거리가 다른 역학적으로 연결되지 않은 개인의 샘플 (0.075) 너무 짧로는 RES637_1/RES638 쌍과 잠재적 인 오류입니다. RES638_1에 비해 0.075의 거리와 나무의 다른 RES637 있습니다. CQ01/CQ02 클러스터가 제안하는 두 개의 샘플패널에서 동일한 샘플의 중복입니다. 그들은 REGA 하위 유형의 도구에 의해 할당 된 하위 유형을 확인하는 서브 타입 B의 레퍼런스 시퀀스와 함께 클러스터. REGA의 하위 유형의 도구는 각각 A와 CRF02_AG로 분류 된 반면, CQ05 및 CQ04은 각각 서브 타입과 G로 클러스터. HIV의 하위 유형과 재결합에 대한 또 다른 유용한 도구 http://www.datamonkey.org에서 확인할 수 있습니다 SCUEL입니다. 더 큰 이미지를 보려면 여기를 클릭하십시오.
5 개의 샘플의 패널은 자체 방식의 정밀도를 평가하기 위해 사용되었다. 텐 복제 유전자형은 5 개 샘플의 각각에 대해 생성되었다. 16 모세관 3130xl 유전 분석기를 사용하여, 50 유전자형의 48, 24에서 실행 생성 당일 제조 하였다. 모든 5 개의 샘플의 경우, 예측 된 아미노산 서열은 복제물 사이에 100 % 일치율되었습니다. 핵산 서열, 회의용감수는> 99 % 페어 유사했다.
이 방법의 사용의 제 2 년 동안, 육십 샘플 시퀀싱 RNA 추출로부터 무작위로 반복 하였다. 시퀀스의 품질 평가 점수와 반복 실험 간의 혼합 기지의 수 사이에 통계적으로 유의 한 차이가 없었다. 육십쌍 대한 뉴클레오티드 및 아미노산 두 쌍 비교는 99 % 이상의 동일 하였다. 따라서 모든 쌍에 대한 약제 내성 돌연변이는 100 % 조화 된이었다.
비용 절감
RT, PCR 및 시퀀싱 반응 볼륨 생성 시퀀스의 품질의 저하없이, 적어도 절반, 일본어 제 20, 32을 기준으로 감소 하였다. 이것은 RT와 PCR 단계를 위해 50 %의 비용 절감을 가능하게했다.
새로운 방법은 원래 순서로 여섯 시퀀싱 프라이머와 함께 작동하도록 설계되었습니다 프로테아제 유전자 및 역전사 효소 유전자 (20), (32)의 제 300 코돈 99 코돈. 비슷한 방법으로는 6 ~ 8 프라이머 33, 34을 사용합니다. 때로는 seprately 35, 36 프로테아제와 RT 유전자 시퀀싱하지만 일부 최근에 출판 된 방법은, 6 개 이하의 프라이머를 사용했습니다. 우리는 6-4 시퀀싱 프라이머의 수를 줄이기 위해 모색 (도 6)
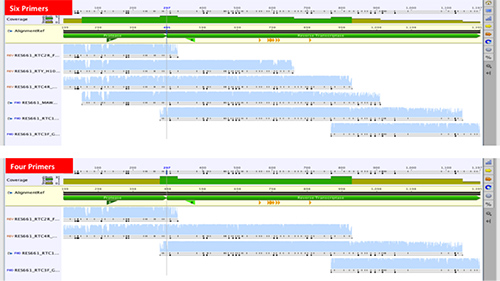
그림 6. 99 HIV-1 프로테아제 코돈 및 역전사 효소 유전자의 첫 코돈 300을 덮고 1197 염기쌍의 POL 시퀀스의 생성을위한 여섯 개의 VS 시퀀싱 프라이머에서 연속 서열 비교.242/51242fig6highres.jpg "대상 ="_blank "> 큰 이미지를 보려면 여기를 클릭하십시오.
여섯 프라이머 (17)에서 생성 된 샘플들의 집합에서 서열이 프라이머 (MAW46 및 RTY) 배제 후 생성 된 서열과 비교 하였다. 하위 시퀀스 품질 평가 점수에 유의 한 차이는 없었다 (14) 서브 타입 C, 두 개의 하위 유형 B, 하나의 하위 유형 A.했다. 다시, 핵산 (17) 쌍 사이의 평균 페어 신원은 아미노산 수준에서 99 % 및 100 %이었다. 따라서, 6-4 시퀀싱 프라이머를 감소 거의 세 번째로 시퀀싱 비용의 감소 결과.
이 프로토콜에서 사용하는 유일한 독점 소프트웨어 도구는 시퀀스 어셈블리 Geneious했다. 약제 내성 해석 도구뿐만 아니라, 보고서 도구를 생성하는 모든 무료 오픈 액세스 도구입니다. 이 독점 소프트웨어의 사용과 관련된 비용을 제거함으로써 더욱 비용을 감소시킨다. 또한, collectivE 협상이 프로토콜에 대한 시약은 생활 기술에서 쉽게 액세스 할 수 있도록 키트에 패키지 및 토성 / 생활 기술은 방법 37 유전형으로 사용할 수있었습니다. 또한, 토성 회원은 할인 된 가격에 시약에 액세스 할 수 있습니다.
임상 설정
설명 프로토콜 크와 줄루 나탈 (주)의 농촌 지역 사회의 모니터링 및 약제 내성 감시에 구현되었습니다. (604) 유전자형의 총> 1,000 RNA에 복사 / ml의 바이러스 부하 샘플 95 %의 증폭률 2010 년 12 월 월 ~ 2013 임상 샘플로부터 생성되었습니다. 이 임상 HIV 약제 내성 연구는 크와 줄루 나탈 (주)의 대학 (참조 BF052/10)의 생물 의학 연구 윤리위원회와 건강의 크와 줄루 나탈 (주) 부 (참조 HRKM 10분의 176)의 건강 연구위원회에 의해 승인되었습니다. 개별 환자의 보고서를 생성하고 병원으로 다시 보내졌다환자 관리를위한.
일흔 두 (72) 유전자형은, 전송 약제 내성 연구의 감시의 일환으로 발생하는 많은 잠재 인구 기반 HIV 감시 연구에 중첩되었다. 기본 샘플은 EDTA의 마이크로 튜브에 수집 바늘 찌르기 전혈했다. 유전자형에서 79 % (19)의 증폭률이 있었다. 감시 연구 샘플의 유전자형에 대한 윤리 승인 크와 줄루 나탈 (주) 바이오 메디컬 연구 윤리위원회의 대학 (참조 BE066107)에서 얻었다.
| 프라이머 이름 | 순서 | 길이 | 방향 | HXB2 위치 | |
| MAW-26 | TTGGAAATGTGGAAA GGAAGGAC | 23 | 앞으로 | 2028년에서 2050년까지 | 1 차 PCR |
| RT-21 | CTGTATTTCAGCTATC AAGTCCTTTGATGGG | 31 | 역 | 3539-3509 | 1 차 PCR |
| 프로 - 1 | TAGAGCCAACAGCCC CACCA | (20) | 앞으로 | 2147년부터 2166년까지 | 2 차 PCR |
| RT-20 | CTGCCAATTCTAATTC TGCTTC | 22 | 역 | 3462-3441 | 2 차 PCR |
| RTC1F | ACCTACACCTGTCAA CATAATTG | 23 | 앞으로 | 2486년부터 2508년까지 | 시퀀싱 |
| RTC2R | TGTCAATGGCCATTG TTTAACCTTTGG | 27 | 역 | 2630년부터 2604년까지 | 시퀀싱 |
| RTC3F | CACCAGGGATTAGAT ATCAATATAATGTGC | (30) | 앞으로 | 2956년부터 2994년까지 | 시퀀싱 |
| RTC4R | CTAAATCAGATCCTAC ATACAAGTCATCC | 29 | 역 | 3129-3101 | 시퀀싱 |
| RT-Y | GTGTCTCATTGTTTAT ACTAGG | 22 | 역 | 2967년부터 2946년까지 | 시퀀싱 |
| MAW-46 | TCCCTCAGATCACTC TTTGGCAACGAC | 27 | 앞으로 | 2251년에서 2277년까지 | 시퀀싱 |
표 1. 전사, PCR, 및 모든 99 HIV-1 프로테아제 코돈 및 역방향 trascriptase 유전자의 첫 코돈 300을 덮고 1197 염기쌍 POL 단편의 생성에 사용 시퀀싱 커스텀 역방향 프라이머.
| RT21 (5pmol/ml) | 0.5 | 0.2 |
| 의 dNTP (10 ㎜) | 0.5 | 0.4 |
| 합계 | 1 |
표 2. 의 dNTP / 프라이머는 역전사 반응 동안 혼합한다.
| 시약 | 볼륨 (ML) / 반응 | 농도 / 반응 |
| 먼저 스트랜드 버퍼 (10 배) | 1 | 1 |
| MgCl2를 (25 밀리미터) | 2 | 4 |
| DTT (0.1 M) | 1 | 0.008 |
| RNaseOUT (40 U / ㎖) | 0.5 | 16 |
| 첨자 III 역전사 (200U/ml) | 0.5 | 8 |
| 합계 | 5 |
표 3. 효소는 역전사 반응 동안 혼합한다.
| 시약 | 볼륨 (ML) / 반응 | 최종 농도 / 반응 |
| DEPC 처리 수 | 18.4 | - |
| PCR 버퍼 (10 배) | 2.5 | 1 |
| MgCI 2 (50 MM) | 1 | 2 |
| 의 dNTP 혼합 (10 ㎜) | 0.5 | 0.2 |
| 비뚤어진 프라이머 (5 pmol의 / ㎖) | 0.25 | 0.05 |
| 역방향 프라이머 (5 pmol의 / ㎖) | 0.25 | 0.05 |
| 백금의 Taq 중합 효소 (5 U / ㎖) | 0.1 | 0.02 |
| 소계 | 23 | - |
표 4. 중첩 된 PCR을위한 마스터 믹스.
| 시약 | 볼륨 (ML) / 반응 | 농도 / 반응 |
| DEPC 처리 수 | 6.1 | |
| 시퀀싱 버퍼 (배) | 2 | 1 |
| 프라이머 (3.2 pmol의 / ㎖) | 0.5 | 0.16 |
| 큰 염료 종료 시퀀싱 믹스 | 0.4 | - |
| 합계 | 9 |
표 5. 시퀀싱 반응에 대한 마스터 믹스.
| Viroseq | 실내 | % NA 비슷한 | |||||||
| 샘플 ID | 하위 유형 | 품질 평가 점수 | PR 돌연변이 | RT 돌연변이 | 하위 유형 | 품질 평가 점수 | PR 돌연변이 | RT 돌연변이 | |
| CQ01 | B | 99.9 | M46L, I54L, V82A, L90M | D67N, T69D, K70R, M184V, T215V, K219Q | B | 99.2 | M46L, I54L, V82A, L90M | D67N, T69D, K70R, M184V, T215V, K219Q | (100) |
| CQ02 | B | 99.5 | M46L, I54L, V82A, L90M | D67N, T69D, K70R, M184V, T215V, K219Q | B | 99.5 | M46L, I54L, V82A, L90M | D67N, T69D, K70R, M184V, T215V, K219Q | (100) |
| CQ03 | NA | NA | NA | NA | NA | NA | |||
| CQ04 | CRF02_AG | 98.4 | I54V, V82F, I84V | M41L, L74I, L210W, T215Y, V108I, Y181C | NA | NA | NA | NA | NA |
| CQ05 | 99.7 | K103N | 93 | K103N | (100) | ||||
표 6. 비교 resulViroseq 유전형 방법 및 ANRS 의해 제공된 샘플의 패널을 사용하여 내부 메소드 간의 병렬 분석 TS.
토론
여러 저렴한 비용으로 사내 방법은 33, 34, 36 HIV 약제 내성 유전자형이 더 저렴한 만들려고하는 노력에 설명되어있다. 자원 제한 설정에서 항 레트로 바이러스 치료에 대한 개인에 대한 치료의 연속체에 약물 저항 테스트를 통합 할 필요성 의심의 여지가 없다. 그러나,보고 된 방법 중 대부분은 집단 수준에서 약제 내성의 감시에 약제 내성 유전자형의 적용에 초점을 맞춘다. 토성 / 생활 기술의 유전자형 방법은 감시 및 약제 내성 감시를위한 완벽하게 통합 된 프로토콜입니다. 이 방법은 임상 관리에 대한 보고서의 약제 내성과 세대의 해석에 대부분 오픈 소스와 오픈 액세스 생물 정보학 자원을 구현하는 저렴한 프로토콜 될 수 있도록 설계되었습니다.
그것은 될 수있는 FDA 승인 Viroseq 유전자형 방법에 비교하여 나타내었다성공적으로 증폭 된 실험실 패널 샘플을 100 % ANRS 숙련도 시험 샘플의 패널에서 약제 내성 변이를 식별하는 정확한. 정확도는 또한 서브 타입 C 바이러스, 남부 아프리카에서 가장 지배적 인 하위 유형의 임상 샘플을 평가 하였다. 방법 CRF02_AG가 유행이다 세계의 다른 부분에 사용되는 경우에있어서 그것이 그러나 아형 및 B.에 있었던 것에 아형 C 샘플 최저 정확, 방법시기 프라이머의 변형이 필요하다 CRF02_AG을 표시했다 패널 샘플을 증폭하는 데 실패했습니다. 서브 타입의 분포가 38 이질적이고 또는 M (33)를 바이러스 모든 그룹에 민감 프라이머의 타락한 세트, 36 지역에서 사용할 수 있습니다.
역전사 및 PCR의 감도는 500 ㎖ 같은 플라즈마의 높은 볼륨에서 RNA를 추출함으로써 증가 될 수있다. 혈장은 원심 수QIAamp 바이러스 RNA 추출 미니 키트가 설명 된대로 프로토콜을 진행하기 전에 바이러스 입자를 집중하는 90 분 동안 21,000 XG에서 uged.
도시 된 바와 같이, 새로운 방법은 개별 환자 관리를위한 포괄적 인 보고서를 생성하는 추가적인 장점이 있습니다. 이 보고서는 RegaDB에서 유전자형의 통합, 면역 학적 및 바이러스 학적 모니터링 데이터뿐만 아니라 임상 치료의 역사입니다. 이것은 동일하게 상세한 환자의 임상 기록의 검토뿐만 아니라 치료 권장 다음에 저항 프로파일에 대한 자세한 실험 해석을 동반한다. 보고서를 검토하고 환자에 대한 치료 권장 사항을 제공하는 전문 의사의 사용은 간호사 실무자뿐만 아니라 점점 작업의 이동에 대한 WHO 권장 사항의 일환으로 남아프리카 공화국에있는 예술을 제공하고 경험이 임상에 대한 많이 필요한 멘토링을 제공한다. 이러한 임상보고서는 약제 내성 관리에 거의 또는 전혀 경험이있는 임상의를위한 효과적인 교재로 표시되었습니다. 환자 관점에서, 우리의 방법은 전문 HIV 서비스에 액세스하는 중앙 사이트에 여행 할 필요가 줄어 듭니다.
따라서, 전체적으로 촬영 기술 프로토콜은 HIV 약제 내성 관리는 HIV 감염자 실패 예술에 대한 치료의 연속체로, 저렴한 비용으로 통합 될 수있는 좋은 플랫폼을 제공합니다. 생성 된 데이터는 여행자의 약제 내성의 진화 및 전송을 평가하기 위해 역학적 목적을 위해 사용될 수있다. 생성 된 폴 조각의 크기는 인구 수준에서 전염병의 더 나은 이해를 만들어 더 복잡한 계통 발생 학적 분석에 충분합니다.
공개
건강 시스템을 강화하고 HIV 치료 실패 (HIV-:이 작품은 웰컴 트러스트 (Wellcome Trust) (082384/Z/07/Z), 유럽 연합 (SANTE 2007 147-790), 질병에 대한 미국 센터에 의해 지원되었다가 CAPRISA (프로젝트 제목을 통해 제어 TFC)), 그리고 스위스 남아프리카 공화국 공동 연구 프로그램 (SSJRP)라는 제목의 연구 보조금 "스위스 보호 해주는 / 남아프리카 공화국 : 단백질 생물 정보학 자원 개발이 중요한 건강 관련 병원균에 대한". RL은 웰컴 트러스트 (Wellcome Trust)에 의해 지원됩니다 (허가 번호 090999 / Z / 09 / Z). 출자자는 연구 설계, 데이터 수집 및 분석, 게시 할 수있는 의사 결정, 또는 원고의 준비에 역할을했다. 저자는 더 경쟁 재정적 이익을 선언하지 않습니다.
감사의 말
저자는이 작품은 가능한 한 모든 동료, 특히 마야 Balamane, 엘리자베스 존스턴 화이트, 샤론 Sjoblom, 그렉 오르 딩 Zakhona Gumede, Xolile Kineri, Phindile Mabaso, Lungisa Ndwandwe, 제임스 가비, 개빈 콥, Senzo Maphanga, Terusha Chetty을 인정하고 싶습니다 , Kevi Naidoo, 앤드류 Skingsley, 캐서린 스토트, 그리고 Lungani Ndwandwe. 저자는 또한 건강의 부와 Hlabisa HIV 치료 및 관리 프로그램을 작동 아프리카 센터 직원의 모든 직원에게 감사의 말씀을 전합니다.
자료
| Name | Company | Catalog Number | Comments |
| Superscript III 1st strand Synthesis kit | Life Technologies | 18080051 | Reverse Transcription |
| SATURN/LiFE Technologies Custom Primers | Life Technologies | 4473517 | PCR |
| Platinum Taq | Life Technologies | 10966026 | PCR |
| PureLink QUICK PCR Purification Kit | Life Technologies | K310002 | PCR |
| Viroseq | ABBOTT | 4J94-20 | Reverse Transcription and PCR |
| Agarose Tablets (Dnase/Rnase free) | BIOLINE | BIO-41027 | PCR |
| TBE Buffer | MERCK | 1.06177.2500 | PCR |
| O'Range Ruler 200 bp DNA Ladder | Fermentas | FE SM0633 | PCR |
| Novel Juice | GeneDireX | LD001-1000 | PCR |
| MiniBis Bioimaging System | DNR Bioimaging Systems Ltd | Gel Documentation | |
| Power Pac 300 | BIORAD | Gel Electrophoresis | |
| Big Dye Terminator Kit version 3.1 | Life Technologies | 4337456 | Sequencing |
| Arrays | Life Technolgies | 4319899 | Sequencing |
| PoP | Life Technologies | 4363785 | Sequencing |
| 10x EDTA Buffer | Life Technologies | 402824 | Sequencing |
| Formamide | Life Technologies | 4311320 | Sequencing |
| 5x Sequencing Buffer | Life Tecgnologies | 4336697 | Sequencing |
| 3130 xl Genetic Analyzer | Life Technologies | Sequencing | |
| GeneAmp PCR System 9700 | Life Technologies | RT/PCR/Sequencing | |
| Centrifuge 5804 | EPPENDORF | Sample Processing | |
| Centrifuge 5415R | EPPENDORF | RNA Extraction | |
| Centrifuge 5415R | EPPENDORF | RT and PCR | |
| Centrifuge 5415D | EPPENDORF | PCR Product Clean up | |
| Centrifuge 5810 | EPPENDORF | Sequencing Clean up | |
| Picofuge | BIORAD | C1301-230V | RT and PCR |
| Vortex Genius 3 | IKA | RNA extraction and reagent preparation | |
| Vortex mixer | IKA | Sequencing Cleanup | |
| NanoDrop 2000 UV/VIS spectrophotometer | ThermoScientific | DNA quantification | |
| 3 M Sodium Acetate | MERCK | 567422 | Sequencing Clean up |
| Absolute Ethanol | MERCK | SAAR2233540LP | Sequencing Cleanup |
| 1.5 ml SARSTEDT Tubes | BIODEX | 72.692.005 | RNA Extraction |
| 2 ml SARSTEDT Tubes | BIODEX | 72.693.005 | RNA Extraction |
| 2 ml Collection tubes | SCIENTIFIC GROUP | MCT-200-NC/S | RNA Extraction |
| Optical MicroAmp 96-well reaction plates | Life Technologies | N8010560 | Sequencing |
| 200 µl 8 Strip StarPCR Tubes with attached flat caps | STAR Lab - supplied by CELTIC | A1402-3700 | RT and PCR |
| 200 µl PCR individual tubes | Scientific Group | CR/3745 | RT and PCR |
| Geneious | Biomatters | Sequence analysis | |
| Internet Access | Preferrably high speed | ||
| Web resources | |||
| hivdb.stanford.edu | Stanford University | Drug reistance analysis | |
| http://bioafrica.mrc.ac.za:8080/regadb-ui/RegaDB | SATuRN | database | |
| http://bioafrica.mrc.ac.za/tools/pppweb.html | SATuRN | Sequence quality tool | |
참고문헌
- Shao, Y., Williamson, C. The HIV-1 epidemic: low- to middle-income countries. Cold Spring Harbor Persp. Med. 2, (2012).
- Mutevedzi, P. C., et al. Scale-up of a decentralized HIV treatment programme in rural KwaZulu-Natal, South Africa: does rapid expansion affect patient outcomes. Bull. World Health Organ. 88, 593-600 (2010).
- Houlihan, C. F., et al. Cohort profile: Hlabisa HIV treatment and care programme. Int. J. Epidemiol. 40, 318-326 (2011).
- Tanser, F., Barnighausen, T., Grapsa, E., Zaidi, J., Newell, M. L. High coverage of ART associated with decline in risk of HIV acquisition in rural KwaZulu-Natal. South Africa. Science. 339, 966-971 (2013).
- Bor, J., Herbst, A. J., Newell, M. L., Barnighausen, T. Increases in adult life expectancy in rural South Africa: valuing the scale-up of HIV treatment. Science. 339, 961-965 (2013).
- Montaner, J. S., et al. The case for expanding access to highly active antiretroviral therapy to curb the growth of the HIV epidemic. Lancet. 368, 531-536 (2006).
- Granich, R. M., Gilks, C. F., Dye, C., De Cock, K. M., Williams, B. G. Universal voluntary HIV testing with immediate antiretroviral therapy as a strategy for elimination of HIV transmission: a mathematical model. Lancet. 373, 48-57 (2009).
- Johnson, L. F., et al. Life expectancies of South african adults starting antiretroviral treatment: collaborative analysis of cohort studies. PLoS Med. 10, (2013).
- Blower, S., Ma, L., Farmer, P., Koenig, S. Predicting the impact of antiretrovirals in resource-poor settings: preventing HIV infections whilst controlling drug resistance. Curr. Drug Targets. 3, 345-353 (2003).
- Geretti, A. M. Epidemiology of antiretroviral drug resistance in drug-naive persons. Curr. Opin. Infect. Dis. 20, 22-32 (2007).
- Larder, B. A., Darby, G., Richman, D. D. HIV with reduced sensitivity to zidovudine (AZT) isolated during prolonged therapy. Science. 243, 1731-1734 (1989).
- Erice, A., et al. Brief report: primary infection with zidovudine-resistant human immunodeficiency virus type 1. N. Engl. J. Med. 328, 1163-1165 (1993).
- Williams, I., et al. British HIV Association guidelines for the treatment of HIV-1-positive adults with antiretroviral therapy. HIV Med. 13 Suppl 2, 1-85 (2012).
- DHHS, . US Panel on Antiretroviral Guidelines for Adults and Adolescents. Guidelines for the use of antiretroviral agents in HIV-1-infected adults and adolescents. , (2012).
- Vandamme, A. M., et al. European recommendations for the clinical use of HIV drug resistance testing: 2011 update. AIDS Rev. 13, 77-108 (2011).
- DHHS, . US Panel on Antiretroviral Therapy and Medical Management of HIV-Infected Children. Guidelines for the Use of Antiretroviral Agents in Pediatric HIV Infection. , (2012).
- . Department of Health. Clinical guidelines for the management of HIV & AIDS in adults and adolescents. , (2010).
- Conradie, F., et al. The 2012 southern African ARV drug resistance testing guidelines. S. Afr. J.HIV Med. 13, 162-167 (2012).
- Manasa, J., et al. Primary Drug Resistance in South Africa: Data from 10 Years of Surveys. AIDS Res. Hum. Retroviruses. 28, 558-565 (2012).
- Tshabalala, M., et al. Surveillance of transmitted antiretroviral drug resistance among HIV-1 infected women attending antenatal clinics in Chitungwiza, Zimbabwe. PLoS ONE. 6, (2011).
- Bartolo, I., et al. Antiretroviral drug resistance surveillance among treatment-naive human immunodeficiency virus type 1-infected individuals in Angola: evidence for low level of transmitted drug resistance. Antimicrob. Agents Chemother. 53, 3156-3158 (2009).
- Bartolo, I., et al. HIV-1 genetic diversity and transmitted drug resistance in health care settings in Maputo, Mozambique. J. Acquir. Immune Defic. Syndr. 51, 323-331 (2009).
- Hamers, R. L., et al. HIV-1 drug resistance in antiretroviral-naive individuals in sub-Saharan Africa after rollout of antiretroviral therapy: a multicentre observational study. Lancet Infect. Dis. 11, 750-759 (2011).
- Hamers, R. L., et al. HIV-1 Drug Resistance Mutations Are Present in Six Percent of Persons Initiating Antiretroviral Therapy in Lusaka, Zambia. J. Acquir. Immune Defic. Syndr. , (2010).
- Nwobegahay, J., Selabe, G., Ndjeka, N. O., Manhaeve, C., Bessong, P. O. Low prevalence of transmitted genetic drug resistance in a cohort of HIV infected naive patients entering antiretroviral treatment programs at two sites in northern South Africa. J. Med. Virol. 84, 1839-1843 (2012).
- Iweriebor, B. C., et al. Molecular epidemiology of HIV in two highly endemic areas of northeastern South Africa. Arch. Virol. 157, 455-465 (2012).
- Parboosing, R., Naidoo, A., Gordon, M., Taylor, M., Vella, V. Resistance to antiretroviral drugs in newly diagnosed, young treatment-naive HIV-positive pregnant women in the province of KwaZulu-Natal South Africa. J. Med. Virol. 83, 1508-1513 (2011).
- Nwobegahay, J. M., et al. Prevalence of antiretroviral drug resistance mutations and HIV-I subtypes among newly-diagnosed drug-naive persons visiting a voluntary testing and counselling centre in northeastern South Africa. J. Health Popul. Nutr. 29, 303-309 (2011).
- Nwobegahay, J., et al. Prevalence of drug-resistant mutations in newly diagnosed drug-naive HIV-1-infected individuals in a treatment site in the waterberg district, limpopo province). S. Afr. Med. J. 101 (2011), 335-337 (2011).
- Rosen, S., Long, L., Sanne, I., Stevens, W. S., Fox, M. P. The net cost of incorporating resistance testing into HIV/AIDS treatment in South Africa: a Markov model with primary data. J. Int. AIDS Soc. 14, 24 (2011).
- Dalai, S. C., et al. Evolution and molecular epidemiology of subtype C HIV-1 in Zimbabwe. AIDS. 23, 2523-2532 (2009).
- Chen, J. H., et al. In-house human immunodeficiency virus-1 genotype resistance testing to determine highly active antiretroviral therapy resistance mutations in Hong Kong. Hong Kong Med. 18, 20-24 (2012).
- Lee, C. K., et al. An in-house HIV genotyping assay for the detection of drug resistance mutations in Southeast Asian patients infected with HIV-1. J. Med. Virol. 84, 394-401 (2012).
- Aitken, S. C., et al. A Pragmatic Approach to HIV-1 Drug Resistance Determination in Resource-Limited Settings by Use of a Novel Genotyping Assay Targeting the Reverse Transcriptase-Encoding Region Only. J. Clin. Microbiol. 51, 1757-1761 (2013).
- Zhou, Z., et al. Optimization of a low cost and broadly sensitive genotyping assay for HIV-1 drug resistance surveillance and monitoring in resource-limited settings. PLoS One. 6, (2011).
- , Life Technologies. Life Technologies and SATuRN Collaborate to Increase Access to HIV Testing in Africa. , (2012).
- Lihana, R. W., Ssemwanga, D., Abimiku, A., Ndembi, N. Update on HIV-1 diversity in Africa: a decade in review. AIDS Rev. 14, 83-100 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유