JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
살충제 내성 집 파리, 파리 자리 부채 에 Carboxylesterases의 기능 특성
요약
여기, 우리 제시 집 플라이 carboxylesterase 단백질에서 생체 외에서 잠재 중재 곤충 세포 표현 시스템으로 생산 하 고 나중 기능 metabolizing permethrin에 그들의 역할을, 특성화를 프로토콜 pyrethroid 부여 셀 기반 MTT 분석 결과 및 체 외에서 대사 연구를 실시 하 여 저항.
초록
Carboxylesterase 중재 대사는 다양 한 곤충의 살충제 저항에 중요 한 역할을 생각입니다. 몇몇 carboxylesterase 유전자 살충제 저항을 부여에 있는 그들의 역할 탐구 될 남아 반면 내성 집 비행 긴장에서 최대 통제 발견 됐다. 여기, 우리는 carboxylesterases의 기능 특성에 대 한 프로토콜 설계 되었습니다. 3 예제 실험 제공 됩니다: (1) 식과 잠재 중재 곤충 Spodoptera frugiperda (Sf9) 셀 식 시스템을 통해 carboxylesterase 단백질의 격리 (2) 셀 기반 MTT (3-[4, 5-dimethykthiazol-2-yl]-2, 5-diphenyltetrazolium 브 로마 이드) 세포 독성 분석 결과 다른 permethrin 치료; 곤충 세포의 허용 오차를 측정 하 (3) 생체 외에서 대사 연구를 permethrin로 carboxylesterases의 대사 기능을 탐구 하 고. MdαE7 저항 하는 집에서 복제는 carboxylesterase 유전자 변형 ALHF 조종 하 고 Sf9 세포 감염에 대 한 재조합 잠재를 구성 하는 데 사용. 셀 viabilities 다른 permethrin 치료에 대 한 MTT 분석 결과와 측정 되었다. Permethrin 제어 그룹 (고양이 재조합 잠재 감염 세포와 GFP 재조합 잠재 감염 세포)의 그들과 비교 된 실험 그룹 (MdαE7-재조합 잠재 감염 세포)의 향상 된 셀 허용 치료는 살충제, 화학 손상에서 세포를 보호 함으로써 metabolizing에서 MdαE7의 기능을 제안 했다. 게다가, carboxylesterase 단백질 곤충 Sf9 세포에 표현 되었고 고립 생체 외에서 대사 연구를 실시. 우리의 결과 중요 한 생체 외에서 대사 효율을 MdαE7의 향해 permethrin, 직접 살충제를 metabolizing에서 carboxylesterases의 개입을 나타내는 표시를 따라서 집에서 살충제 저항을 부여 있습니다.
서문
살충제 저항은 현재 하우스 비행 제어 전세계1,2의 주요 문제 이다. 살충제 저항 메커니즘을 결정 하는 노력이 문제의 더 나은 이해를 용이 하 게 하 고 따라서 새로운 전략을 효과적으로 방지 하거나 저항 개발3의 확산을 최소화를 제공 합니다. Carboxylesterases, 주요 해독 효소 중 하나로 격리 및 다양 한 곤충4,,56에 살충제를 metabolizing에서 그들의 역할에 대 한 관심을 많이 받고 있다. 우리의 이전 연구는 집 파리에 여러 carboxylesterases를 발견 했다와 그들의 식 레벨만 constitutively 최대 저항 하는 ALHF 긴장에 규제 있었지만 또한 높은 유발된 수준 permethrin 치료7에 대 한에서 일 수 있다 . 그러나, 살충제를 metabolizing에서이 carboxylesterase 유전자의 기능 characterizations 탐험 남아 있다.
초기 1980 년대8에서 첫 번째 보고서 이후 외국 유전자 잠재 중재 식 시스템은 널리 고용 높은 단백질 생산 효율성 및 기능9를 처리 하는 진 핵 단백질. 이 이진 시스템은 두 개의 필수 요소 구성: 생성 된 재조합 잠재 호스트 세포와 세포 재조합 잠재 감염 하 여 관심된 단백질의 대규모 식으로 외국 유전자를 제공. 지난 수 십년 동안 잠재 중재 셀 식 시스템 곤충에 막 도약 단백질을 cytosolic 효소에서 배열 하는 재조합 단백질의 수천을 생산 하기 위해 널리 이용 되는 고 포유동물 세포10. 우리의 이전 연구는 성공적으로이 시스템11곤충 Sf9 세포에 여러 CYP450 효소를 표현 했다. 이 연구에서 우리 곤충 Sf9 세포를 감염 하는 carboxylesterase 재조합 잠재 건설, 셀 공차를 다른 permethrin 처리 및 대규모 표현된 carboxylesterase 단백질에서 체 외에 대 한 탐구 기능 탐구입니다. 이전 연구12,13로 채택 곤충 homogenates에서 여러 carboxylesterase isozyme 혼합물을 조사, 대신이 잠재 중재 곤충 세포 표현 시스템 특정 식 수 및 그들의 생 화 학적 및 구조적 특성의 더 나은 특성에 대 한 타겟된 단백질의 격리.
Tetrazolium 소금 기반 시험 (MTT)은 높은 처리량 색도계 방법 개발 및 세포 생존 능력을 측정 하도록 최적화입니다. 이 분석 결과 살아있는 세포만 분석 될 수 있다 colorimetrically 유기 용 매14에에서 용 해 한 후, 어두운 자주색 색깔된 formazan 침전에 노란색 색 MTT 시 약을 물질 대사로 변화 시키기의 수 있는 메커니즘에 따라 15. Trypan 블루 제외 등 티 미 딘 적정 분석 결과16,17시간이 걸리는 방법, 그러나 더 정확 하 게 몇몇 최근 몇 년 동안에서 개발 되었습니다. 그러나, 셀 기반 MTT 분석 결과 여전히 현재 인식 가장 신속 하 고 쉽게 운영 방법으로 신속 하 게 세포 생존 능력을 감지 하. 여기, MTT 분석 결과 사용 하 여 살충제 처리에 대 한 셀 공차를 탐험. 셀 때 강하게 carboxylesterase 재조합 잠재 감염의 향상 된 공차에 살충제 저항에 그들의 관련을 건의 하는 살충제에 carboxylesterases의 대사 역할을 지원 합니다.
또한, 생체 외에서 대사 분석 결과 또한이 연구에서 실시 되었다. 생체 외에서 대사 연구는 정확한 방법으로 여겨진다 carboxylesterases의 가수분해 활동을 반영 하기 위해 일반적인 기판 α-napthyl 아세테이트 (α-나) 등 β naphthyl 아세테이트 (β-없음)를 사용 하는 일반적인 carboxylesterase 분석 실험에 비해, 직접 carboxylesterases 살충제18대의 활동을 측정 합니다. 이 방법은 성공적으로 다양 한 곤충에 살충제 저항11,,1920와 협회에서 여러 시 토 크롬 P450s 하를 고용 하고있다. 그러나,이 방법은 하지 아직 적용 되었습니다 carboxylesterase 연구에서. 잠재 중재 식 시스템에 의해 생산 하는 carboxylesterase 단백질의 가용성, 우리는 체 외에서 대사 연구 permethrin, 더는 참여의 강력한 증거를 제공할 수 있는 방향으로 carboxylesterases의 실행할 수 있다 집에서 pyrethroid 저항을 부여에 carboxylesterases의 파리.
프로토콜
1. 식 및 곤충 세포 잠재 중재 식 시스템 대상 단백질의 격리
- 으로 집에서 파리에서 대상 단백질의 무뚝뚝한 끝난 PCR 제품을 복제.
- 녹색 형광 단백질 (GFP)의 PCR 뇌관과 집 플라이 MdαE7 유전자 그들의 순서 및 선택한 벡터 (표 1)의 특별 한 요구에 따라 디자인.
- 내, 교정 DNA 중 합 효소 및 단계 1.1.1에서에서 프라이 머를 사용 하 여 수행 (30 µ L의 반응 버퍼, 10mm dNTPs, DNA 중 합 효소의 1.5 µ L, 하우스 비행 템플릿 DNA, 앞으로 뇌관의 7.5 µ L의 6 µ L의 3 µ L 150 µ L PCR 반응 최종 볼륨 150 µ L 물으로 역 뇌관의 7.5 µ L). 30에 대 한 98 ° C에 PCR 반응 열 10 98 ° C의 35 주기 다음 s s, 53 ° C 30에 대 한 s, 및 60 72 ° C s, 그리고 2 분 동안 72 ° C에서 최종 확장).
- PCR 제품의 150 µ L로 1 %agarose 젤을 실행 합니다.
- 소비 세는 agarose에서 대상 DNA 조각을 선명 하 고 깨끗 한 메스로 젤: MdαE7 및 858 1317 혈압 혈압 GFP에 대 한. 상업적으로 사용 가능한 젤 추출 키트 다음 제조 업체의 프로토콜 (자료 테이블)를 사용 하 여 DNA를 정화. 15 µ L의 증류수에 순화 된 DNA를 분해.
- 무결성 검사를 순화 된 DNA의 1 µ L와 1 %agarose 젤을 실행 합니다. 순화 된 DNA의 또 다른 1 µ L를 사용 하 여 측정 농도 분 광 광도 계.
- 구성 대상 단백질에 대 한 항목 플라스 미드
- 복제 반응을 설정 합니다. 믹스 갓 정화 단계 1.1.3에서에서 DNA 제품 및 상용 항목 1: 1의 몰 비에 포함 at & tL-사이트 (자료 테이블)를 벡터 (0.5-2 µ L 70-200 ng / µ L 농도에서 신선한 PCR 제품의: 0.5 µ L 벡터). 다음 상용 소금 솔루션 (1.2 M NaCl2 와 0.06 M MgCl2)의 1 µ L를 더하고 물 6 µ L의 최종 볼륨을 부드럽게 혼합 하 고 1 시간에 대 한 실 온에서 품 어.
- 전송 단계 1.2.1 화학적 유능한 대장균 의 50 µ L에서에서 반응 제품을 복제의 4 µ L 셀. 30에 대 한 셀 30 분 열-충격에 대 한 얼음에 품 어 동요 없이 42 ° C 물 욕조에 s.
- 실내 온도 S.O.C. 매체 (2 %tryptone; 0.5% 효 모 추출 물; 10 mM NaCl; 2.5 m m KCl; 10 m m MgCl2, 10 m m MgSO4, 20 mM 포도 당)의 또 다른 2 분 추가 250 µ L에 대 한 얼음에 다시 튜브를 넣어. 부드럽게 떨고와 1 시간 동안 37 ° C에서 품 어.
- 50-200 µ L 세균성 문화 선택적 파운드 플레이트 (tryptone의 1 g, NaCl의 1 g; 효 모 추출 물 0.5 g; 천 증류수 100 mL에 용 해의 1.5 g에 1.2.3 단계에서의 확산. 고압 대 50 mg/mL의 0.1% 추가). 식민지 성장 위한 37 ° C에서 16 h에 대 한 파운드 플레이트를 품 어.
- 5-10 식민지를 선택 하 고 다시 개별적으로 5 µ L의 증류수로 그들을 중단.
- 반응 버퍼의 5 µ L, 0.5 µ L 10 mM dNTPs의 DNA 중 합 효소, 일시 중단 된 식민지의 1 µ L, 10 µ M M13 앞으로 뇌관의 1.25 µ L의 0.25 µ L을 추가 하 여 PCR을 수행, 대상 유전자와 25 µ L의 최종 볼륨을 물 10 µ M 역 뇌관의 1.25 µ L 열 PCR 30에 대 한 98 ° C에 반응 10 98 ° C의 35 주기 다음 s s, 53 ° C 30에 대 한 s, 및 60 72 ° C s, 그리고 2 분 (표 1)에 대 한 72 ° C에서 최종 확장.
- 다시 3 µ L 단계 1.2.5 TB 미디어 (0.17 M KH2포4 와 0.72 M K2HPO4 tryptone, 효 고의 2 개 mL 12 g 6 g를 포함 하는 기본 국물 매체의 450 mL를 포함 하는 인산 염 버퍼의 100 mL에서에서 일시 중단 된 식민지의 문화 글리세롤, 소독, 0.1 %50 mg/mL 대 포함) 16 헤에 대 한 제조 업체의 프로토콜을 따르고 울트라 순수 플라스 미드 DNA 추출.
- 단계 1.2.7 상업 Sanger에서에서 사용 200 ng / µ L 울트라 순수 플라스 미드 시퀀싱 M13 정방향 및 역방향 뇌관으로. 제조업체에서 제공 하는 순서에 따라 벡터에 대상 유전자의 정확한 삽입을 확인 합니다.
- -20 ° c.에 MdαE7 그리고 GFP의 시퀀스 확인 매우 순수한 플라스 미드 DNA 샘플을 저장
참고: 이것은 GFP와 항목 플라스 미드 DNA의 MdαE7입니다.
- 재조합 잠재 람다 재결합 (LR) 반응을 수행 하 여 구성 합니다.
- 각각 300 ng / µ L 항목 플라스 미드 DNA의 GFP, 단계 1.2.7에서에서 MdαE7 또는 페니 acetyltransferase 유전자 (고양이) 상용 (포함 at & tL 사이트)의 5 µ L로 세포 transfection 키트에 의해 제공의 항목 플라스 미드 DNA의 1 µ L를 혼합 C-기간 선형 DNA ( at & tR 사이트 포함) 250 µ L에서 PCR 튜브 합니다. TE 버퍼 8 µ L의 총 볼륨을 추가 합니다.
참고: GFP와 고양이의 반응은 제어 그룹으로 사용 되었다. - 상업적으로 이용 가능한 람다 재결합 (LR) 효소 혼합 (자료 테이블) LR 반응 촉매를 1.3.1 단계의 각 혼합물으로의 2 µ L를 추가 합니다. 부드럽게 혼합 하 고 25 ° C에서 하룻밤 (≈16 h) 품 어.
참고: LR 반응은 at & tL 포함 항목 플라스 미드 DNA는 at & t는 at & tB 포함 된 표현 바이러스를 생성 하 C 기간 선형 DNA 포함 하는 R와의 재결합을 촉진 한다. 이 단계는 각 대상 단백질에 대 한 재조합 잠재를 생성합니다. - 희석 단계 1.3.2에서에서 LR 반응 제품의 1 µ L 20 X. Polyhedrin 앞으로 뇌관을 사용 하 여 PCR을 수행 하 고 V5 반전 뇌관 (표 1). PCR 제품의 5 µ L를 사용 하 여 품질을 확인 하려면 1 %agarose 젤을 실행. 그림 1 MdαE7 유전자에서 LR 반응 제품의 한 예를 보여 줍니다.
- 각각 300 ng / µ L 항목 플라스 미드 DNA의 GFP, 단계 1.2.7에서에서 MdαE7 또는 페니 acetyltransferase 유전자 (고양이) 상용 (포함 at & tL 사이트)의 5 µ L로 세포 transfection 키트에 의해 제공의 항목 플라스 미드 DNA의 1 µ L를 혼합 C-기간 선형 DNA ( at & tR 사이트 포함) 250 µ L에서 PCR 튜브 합니다. TE 버퍼 8 µ L의 총 볼륨을 추가 합니다.
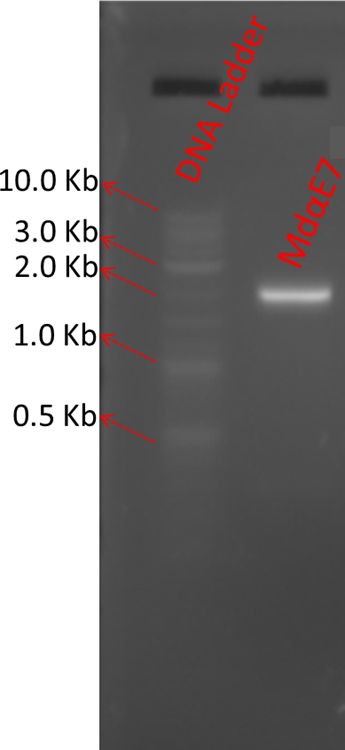
그림 1: PCR 분석에 의해 MdαE7 LR 반응의 결과 예. 200-fold LR 반응의 2 µ L를 희석 하 고 희석 Polyhedrin 앞으로 뇌관 및 V5 역방향 뇌관의 2 µ L 25 µ L PCR를 사용 하 여. PCR 제품의 5 µ L를 사용 하 여 1 %agarose 젤 LR 반응의 품질을 확인 하기 위해서. 는
- 곤충 Sf9 셀 transfect
- T25에 완전 한 세포 성장 매체 (10% 태아 둔감 한 혈 청 (FBS)와 혈 청 자유로운 매체)의 5 mL와 함께 문화 곤충 Sf9 셀 27 ˚C에서 플라스 크 취급.
- 상쾌한을 제거 하 고 신선한 완전 한 세포 성장 매체의 3 mL와 함께 하단에 연결 된 셀을 플러시. 새로운 치료 T25 플라스 크에 다시 중단된 셀의 0.5 mL를 전송 합니다. 완전 한 성장 매체의 4.5 mL를 추가 합니다. 다음 전송까지 3-4 일 동안 27 ° C에서 품 어.
- 씨 로그 단계 성장 곤충 Sf9의 2 개 mL 세포 문화 (≈3.0-5.0 × 106 셀) 잘 세포 배양에 균등 하 게. 셀 후드에서 실내 온도에 적어도 3 h에 대 한 연결을 허용 합니다.
- 250 X에서 거꾸로 위상 현미경으로 관찰 하 여 셀 첨부 파일을 확인 합니다. 세포 배양 매체를 제거 하 고 품위의 곤충 매체의 2 개 mL를 바꿉니다.
- Transfection 혼합물 A 솔루션 (8 µ L 상용 세포 감염 시 약 (자료 테이블)의 그레이스의 곤충 매체의 100 µ L로) 및 각 대상 유전자 (9 µ L 단계 1.3에서에서 LR 반응 제품의 transfection 혼합물 B 솔루션 준비 unsupplemented 그레이스의 곤충 매체의 100 µ L)으로 1.5 ml에서 원심 튜브, 각각.
- 부드럽게 함께 튜브를 활용 하 여 transfection 혼합물 A와 B를 혼합. 후드에서 35 분 실 온에서 품 어.
- 균등 하 게 단계 1.4.4에서에서 시드 셀에 dropwise 1.4.6 단계에서 혼합물을 추가 합니다. 밀봉 테이프와 웰 스 하 고 하룻밤 27 ° C에서 품 어.
- 완전 한 성장 매체의 2 mL에 그레이스의 곤충 매체의 2 mL 바꿉니다. 각 잘 비 재조합 잠재에 대 한 부정적인 선택에 100 µ M ganciclovir를 추가 합니다. 밀봉 테이프와 웰 스 하 고 72 h 27 ° C에서 품 어.
- 각 우물에서 72 h 포스트 감염 세포 배양 매체를 수집 하 고 1.5 mL 원심 관에 전송. 셀 또는 큰 파편을 제거 하 4 ° C에서 5 분 동안 1500 x g에서 원심.
- 새로운 1.5 mL 원심 분리기 튜브는 상쾌한을 전송 합니다. 빛 으로부터 보호와 4 ° C에서 그들을 저장 합니다.
참고: 이들은 각 대상 유전자에 대 한 P1 바이러스 재고 솔루션입니다. - 높은 titer P2 바이러스 성 주식 (5 × 107-1 × 108 pfu/mL)을 낮은 titer P1 바이러스 성 주식 (1 × 105-1 × 106 pfu/mL)를 증폭.
- 씨 로그 단계 성장 곤충 Sf9의 2 개 mL 세포 문화 (≈3.0-5.0 × 106 셀) 잘 세포 배양에 균등 하 게. 셀 후드에서 실내 온도에 적어도 3 h에 대 한 연결을 허용 합니다.
- P1 바이러스 재고 단계 셀에서 1.4.10 시드 단계 1.4.12의 각각에서 얻은 5 µ L 예방 그런 다음, 각 잘을 100 µ M ganciclovir를 추가 합니다. 우물을 밀봉 하 고 72 h 27 ° C에서 품 어.
- P2 바이러스 72 h 게시물 감염의 재고 솔루션을 수집 합니다. 빛 으로부터 보호와 4 ° C에서 저장 합니다.
참고: 이들은 각 대상 유전자에 대 한 P2 바이러스 재고 솔루션입니다. - (선택 사항) P3 바이러스 재고 솔루션을 수집 하 P2 바이러스 주식의 5 µ L로 단계 1.4.12-1.4.14를 반복 합니다.
참고: 이들은 각 대상 유전자에 대 한 P3 바이러스 재고 솔루션입니다. - 빛 으로부터 보호와 4 ° C에서 생성 된 모든 잠재를 저장 합니다.
참고: GFP와 고양이 유전자 제어 그룹으로 역임 했다. 그림 2 는 셀 때 다른 증폭 단계에서 GFP 재조합 잠재 감염의 징후를 보여주었다.
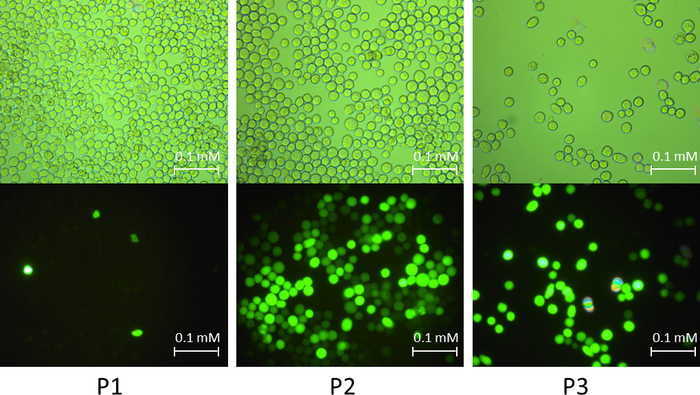
그림 2: 다른 잠재 증폭 단계에서 세포 Sf9의 감염된 징후의 예. 그림은 빛 자연광과 형광등 아래 GFP 재조합 잠재 세포를 보여줍니다. P1 감염 단계에서 감염 비율이 낮습니다. P2 감염 단계에서 감염 비율 크게 향상 되었습니다. P3 감염 단계에서 세포 성장 중단 셀 직경의 증가 거의 모든 세포 세포 배양 접시에서 초연의 증상을 보였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
- 곤충 Sf9 셀에 대상 단백질의 대규모 식
- 문화 로그 단계 성장 곤충 Sf9 셀 T25 치료 비 플라스 크에 완전 한 성장 매체의 10 mL.
- 세포 배양 단계 1.5.1 72 h에서에서 감염을 P2 바이러스 재고 솔루션 (단계 1.4.14에서에서 얻은)의 200 µ L를 추가 합니다.
- 72 시간 게시물 감염 세포 배양 매체를 수집 합니다. 4 ° c.에서 5 분 동안 1500 x g에서 원심 분리기
- 1 mL의 0.1 M PBS 버퍼 (pH 7.5)로 두 번 세척 하 고 표면에 뜨는 펠 릿을 삭제 합니다.
- 완전히 분해 곤충 세포 단백질 추출 및 세포의 용 해 버퍼 (자료 테이블)의 1 mL와 함께 셀 펠 릿. 세포 세포의 용 해에 10% 글리세롤을 추가 합니다. -80 ° c.에 즉시 저장
- 컨트롤 그룹으로 고양이 단백질의 P2 바이러스 재고 솔루션 단계 1.5.1-1.5.5를 반복 합니다.
참고: 다른 단백질 준비에 대 한 3 중에 1.5 단계를 반복 합니다.
2. 셀 기반 MTT 세포 독성 분석 실험
- 문화 로그 단계 성장 (1.5-2.5 × 106 셀/mL) 곤충 Sf9 셀 T25 치료 비 플라스 크에 완전 한 성장 매체의 5 mL.
- 27 ˚C에서 부드러운 떨고와 48 h 2.1 단계에서 세포 배양을 감염 P1 바이러스 재고 솔루션 (단계 1.4.14에서에서 얻은)의 25 µ L를 추가 합니다.
- 100mm 이기에 permethrin 표준 재고 솔루션을 준비 합니다. 이기를 사용 하 여 1000 µ L의 총 볼륨에서 62.5 µ L permethrin 재고 솔루션, 125 µ L, 250 µ L, 500 µ L를 각각 추가 하 여 6.25 m m, 12.5 m m, 25mm, 50mm를 희석.
- 균등 하 게 단계 2.2 완전 한 성장 매체의 300 µ L 2 × 105 셀/mL의 조밀도에 24-잘 접시에 보충에서 감염 된 세포 배양의 200 µ L 씨.
- 최종 농도 50 µ M, 100 µ M, 200 µ M 및 400 µ M를 각각 있도록 각 우물에 permethrin 표준 솔루션 (6.25 m m, 12.5 m m, 25 m m 50 m m)의 4 µ L를 추가 합니다. 만 셀 생존 능력 계산 (그림 3)에 대 한 웰 스에 이기의 4 µ L를 추가 합니다.
- 테이프와 플레이트를 봉인 하 고 빛 으로부터 보호 48 h 27 ° C에서 품 어.
- 버퍼에 녹아 5 mg/mL MTT (Thiazolyl 블루 Tetrazolium 브롬) 시 약 준비 (NaCl, KCl, 0.05 g의 2.0 g 0.36 g NaH2포4∙2H2O, NaH2포4, 0.05 g의 0.28 g KH2PO4 200 mL에 녹의 증 류 물, pH 7.5)입니다.
- 아래 연결 된 셀 레이어를 건드리지 않고 후 48 h 인큐베이션 단계 2.6에서에서 세포 배양 매체를 제거 합니다. 각 잘 2.7 단계에서의 MTT 시 약 200 µ L를 추가 합니다. 각 잘 (그림 3)에서 어두운 자주색 formazan 침전 형성 될 때까지 4 h 37 ° C에서 품 어.
- 어두운 자주색 formazan 각 우물에서 침전 될 때까지 4 h 37 ° C에서 품 어. DMSO 완전히 침전 (그림 3) 해산의 500 µ L를 추가 합니다.
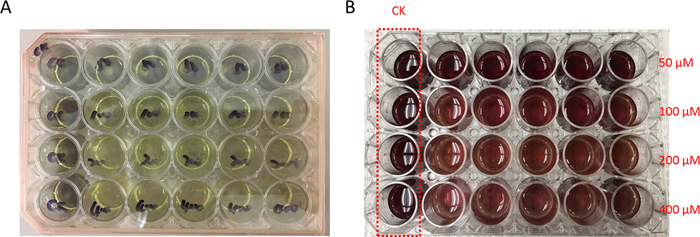
그림 3: MTT 결과의 예. 48 h 후 고양이 재조합 잠재 솔루션의 P1 바이러스 재고 솔루션 감염을 균등 하 게 씨앗 500 µ L 셀 24-잘 셀 문화 접시에 고양이 유전자 표현 게시. 각각 400 µ M, 200 µ M, 100 µ M, 50 µ M 최종 농도 만들기 위해 각 행에는 다른 복용량 (6.25 m m, 12.5 m m, 25mm, 50mm)에서 4 µ L permethrin를 추가 합니다. 컨트롤 행 이기만 치료 하 고 접시에 CK로 표시 했다. (A) 후 27 ° C에 외피의 48 h, 상위 층에 세포 배양 매체를 삭제 하 고 노란색 색된 MTT 시 약의 200 µ L를 바꿉니다. 그 후 품 어 48 h. 어두운 자주색 착 색된 감소 각 잘 나타내는 생존 세포는 노란 색을 물질 대사로 변화 시키기의 형태로 침전 물에 대 한 37 ° C에서 MTT 시 약 어두운 자주색 착 색된 침전으로. (DMSO 용 매 B) 500 µ L 각 잘 형성된 된 침전을 해산에 추가 되었습니다. 각각의 흡 광도 값은 잘 분 광 광도 계 540에 의해 발견 되었다 nm. Permethrin 농도 증가, 색 것으로 점차 변경 진한 빨간색에서 빛 빨강, 제안 셀 viabilities 점차적으로 감소 했다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
- 96 잘 접시에 녹은 솔루션의 200 µ L를 전송 합니다. 흡 광도 값에서 540 nm microplate 리더 (테이블의 재료)를 사용 하 여.
- 그 취급 이기 셀만 permethrin 처리 셀의 흡 광도 값을 비교 하 여 세포 생존 능력을 계산 합니다.
- 컨트롤 그룹에 대 한 솔루션과 P2 바이러스 주식 페니 acetyltransferase (고양이) 재조합 잠재 단계 1.4에서에서 얻은의 모든 단계를 반복 합니다.
- 다른 바이러스 준비에 대 한 4 번 반복 합니다.
3. 대사 분석 결과 생체 외에서
- 100mm 이기에 permethrin 표준 재고 솔루션을 준비 합니다. 이기를 사용 하 여 6.25 m m, 12.5 m m, 25mm, 50mm를 희석. HPLC를 사용 하 여 각 농도에서 해당 피크 지역 검색. 만들고 permethrin 다른 permethrin 농도와 피크 지역에 따라 표준 곡선을 계산 합니다.
- 브래드 퍼 드 방법21단계 1.5에서에서 단백질 농도 측정 합니다.
- 40 µ M permethrin 표준 대사 반응의 700 µ L와 단계 1.5 0.2 M Tris HCl 버퍼 (pH 7.4)에 용 해에서 얻은 단백질의 1 밀리 그램 준비 합니다. 부드러운 진동으로 2 h 30 ° C에서 품 어. 빛 으로부터 보호 합니다.
- 얼음 처럼 차가운 이기의 700 µ L을 추가 하 여 반응을 끄다. 부드러운 진동으로 또 다른 30 분 30 ˚C에서 품 어. 빛 으로부터 보호 합니다.
- 실 온에서 2 분 동안 16000 x g에서 반응 혼합물 원심 상쾌한와 0.45 μ 막 통해 필터를 수집 합니다. 여 HPLC 분석에 대 한 깨끗 갈색 유리 튜브로 전송 합니다.
- 최적의 크로마 조건 (모바일 단계 a: 90% 이기와 10% 물; HPLC를 실행 모바일 단계 b: 5% 이기 조정 85% 인산으로 pH 2.3). 그라데이션 1 mL/min과 232의 파장에서 측정의 유량과 elute nm.
- 단백질 견본 추가 없이 반응 비교 하 여 permethrin의 소모 비율을 계산 합니다.
- 1.5.6 단계에서 얻은 고양이 단백질을 사용 하 여 컨트롤 역할.
- 다른 단백질 준비 단계 1.5.7에서에서 모든 단계를 반복 합니다.
결과
다른 permethrin 치료 (MTT assay)으로 세포 생존 능력
Permethrin의 세포 독성 MdαE7 재조합 잠재 감염 Sf9 셀 (실험 그룹)과 고양이 재조합 잠재 감염 (잠재 감염 키트에 의해 제공) 셀 (제어 그룹)에서 시험 되었다. 향상 된 셀 공차 세포를 강하게 표현 하는 MdαE7에 permethrin 살충제와 화학 손상에서 따라서 보호 셀이이 carboxylesterase의 대사 역...
토론
최근 수십 년간, 분리 식 시스템 널리 표현 하 고 많은 양의 단백질, 생화학 및 기능 확인 및 체 외에서효소의 특성화 되므로 격리 사용 되었습니다. 날짜 하려면, 대장균, Pichia pastoris, Sacccharomyces cerevisiae및 Spodoptera frugiperda 를 포함 하 여 여러 다른 모델 시스템은 재조합 형 단백질 표정, 그리고의 선택에 대 한 적응 되었습니다는 생체 외에서 시스템 관심된 ...
자료
| Name | Company | Catalog Number | Comments |
| Q5 High-Fidelity DNA Polymerase | New England Biolabs inc. | M0491L | |
| QIAquick Gel Extraction Kit | QIAGEN | 28704 | |
| pENTR/D-TOPO Cloning Kit, with One Shot TOP10 Chemically Competent E. coli | Invitrogen by life technology | K240020 | S.O.C medium and universal M13 sequence primers were included in this kit. |
| PureLink HiPure Plasmid Miniprep Kit | Invitrogen by life technology | K210002 | |
| Gateway LR Clonase II Enzyme mix for BaculoDirectTM Kits | Invitrogen by life technology | 11791-023 | |
| BaculoDirect C-Term Linear DNA Transfection Kit | Invitrogen by life technology | 12562-019 | Cellfectin transfection reagent and ganciclovir were included in this kit |
| pENTR-CAT plasmid | Invitrogen by life technology | Included in BaculoDirect C-Term Linear DNA Transfection Kit, concentration: 0.5 ug/uL | |
| Heat inactivated Fetal Bovine Serum, Certified | Gibco by Life Technologies | 10082-139 | |
| Sf9 cells in Sf-900 III SFM | Gibco by Life Technologies | 12659017 | |
| Insect Cell-PE LB Insect Cell Protein Extraction & Lysis Buffer | G Biosciences by A Geno Technology Inc | 786-411 | |
| Sf-900 III SFM (1×) Serum Free Medium Complete | Gibco by Life Technologies | 12658-019 | |
| Grace's Insect Medium, unsupplemented | Gibco by Life Technologies | 11595030 | |
| Permethrin (isomers) analytical standard | SUPELCO by Solutions WithinTM | 442748 | |
| Methanol (analytical graded) | Sigma-Aldrich | 67-56-1 | |
| Acetonitrile (analytical graded) | Sigma-Aldrich | 75-05-8 | |
| GHP Acrodisc 25 mm Syringe Filters with 0.45 μm GHP Membrane (HPLC Certified) | Pall Life Sciences | 21890388 | |
| Alliance Waters 2695 HPLC System | Waters | ||
| T100 Thermal Cycle | Bio-Rad Laboratories Inc. | 1861096 | |
| Nanodrop 2000/2000c Spectrophotometers | ThermoFisher Scientific | ND2000CLAPTOP | |
| Cytation 5 Cell Imaging Multi-Mode Reader | BioTek |
참고문헌
- Scott, J. G., et al. Insecticide resistance in house flies from the United States: Resistance levels and frequency of pyrethroid resistance alleles. Pesticide Biochemistry and Physiology. 107 (3), 377-384 (2013).
- Li, M., et al. A whole transcriptomal linkage analysis of gene co-regulation in insecticide resistant house flies, Musca domestica. BMC Genomics. 14, 803 (2013).
- Liu, N. Insecticide resistance in mosquitoes: impact, mechanisms, and research directions. Annual Review of Entomology. 60, 537-559 (2015).
- Grigoraki, L., et al. Transcriptome profiling and genetic study reveal amplified carboxylesterase genes implicated in temephos resistance, in the Asian tiger mosquito Aedes albopictus. e0003771. 9, e0003771 (2015).
- Grigoraki, L., et al. Carboxylesterase gene amplifications associated with insecticide resistance in Aedes albopictus: Geographical distribution and evolutionary origin. PLOS Neglected Tropical Diseases. 11, e0005533 (2017).
- Wheelock, C., Shan, G., Ottea, J. Overview of carboxylesterases and their role in the metabolism of insecticides. Journal of Pesticide Science. 30, 75-83 (2005).
- Feng, X., Li, M., Liu, N. Carboxylesterase genes in pyrethroid resistant house flies, Musca domestica. Insect Biochemistry and Molecular Biology. 92, 30-39 (2018).
- Mosmann, T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J Immunol Methods. 65 (1-2), 55-63 (1983).
- Jarvis, D. L. Baculovirus-insect cell expression systems. Methods in Enzymology. 463, 191-222 (2009).
- Berger, I., Fitzgerald, D. J., Richmond, T. J. Baculovirus expression system for heterologous multiprotein complexes. Nature Biotechnology. 22 (12), 1583 (2004).
- Gong, Y., Li, T., Feng, Y., Liu, N. The function of two P450s, CYP9M10 and CYP6AA7, in the permethrin resistance of Culex quinquefasciatus. Scientific Reports. 7 (1), 587 (2017).
- Cao, C. W., Zhang, J., Gao, X. W., Liang, P., Guo, H. L. Overexpression of carboxylesterase gene associated with organophosphorous insecticide resistance in cotton aphids, Aphis gossypii (Glover). Pesticide Biochemistry and Physiology. 90 (3), 175-180 (2008).
- Zhang, L., Gao, X., Liang, P. Beta-cypermethrin resistance associated with high carboxylesterase activities in a strain of house fly, Musca domestica (Diptera: Muscidae). Pesticide Biochemistry and Physiology. 89, 65-72 (2007).
- Van Meerloo, J., Kaspers, G. J., Cloos, J. Cell sensitivity assays: the MTT assay. Cancer cell culture. , 237-245 (2011).
- Stockert, J. C., Blázquez-Castro, A., Cañete, M., Horobin, R. W., Villanueva, &. #. 1. 9. 3. ;. MTT assay for cell viability: Intracellular localization of the formazan product is in lipid droplets. Acta Histochemica. 114 (8), 785-796 (2012).
- Strober, W. Trypan blue exclusion test of cell viability. Current Protocols in Immunology. , (2001).
- Riss, T. L., Moravec, R. A., Niles, A. L., Duellman, S., Benink, H. A., Worzella, T. J., Minor, L. Cell viability assays. Assay Guidance Manual. , (2013).
- Wheelock, C. E., Shan, G., Ottea, J. Overview of carboxylesterases and their role in the metabolism of insecticides. Journal of Pesticide Science. 30 (2), 75-83 (2005).
- Li, X., Schuler, M. A., Berenbaum, M. R. Molecular mechanisms of metabolic resistance to synthetic and natural xenobiotics. Annual Review of Entomology. 52, 231-253 (2007).
- Nakamura, Y., et al. The in vitro metabolism of a pyrethroid insecticide, permethrin, and its hydrolysis products in rats. Toxicology. 235 (3), 176-184 (2007).
- Kruger, N. J. The Bradford method for protein quantitation. The protein protocols handbook. , 15-21 (2002).
- Macauley-Patrick, S., Fazenda, M. L., McNeil, B., Harvey, L. M. Heterologous protein production using the Pichia pastoris expression system. Yeast. 22 (4), 249-270 (2005).
- Berger, I., Fitzgerald, D. J., Richmond, T. J. Baculovirus expression system for heterologous multiprotein complexes. Nature Biotechnology. 22 (12), 1583 (2004).
- Terpe, K. Overview of bacterial expression systems for heterologous protein production: from molecular and biochemical fundamentals to commercial systems. Applied Microbiology and Biotechnology. 72 (2), 211 (2006).
- Bulter, T., et al. Functional expression of a fungal laccase in Saccharomyces cerevisiae by directed evolution. Applied Microbiology and Biotechnology. 69 (2), 987-995 (2003).
- Stepanenko, A. A., Dmitrenko, V. V. Pitfalls of the MTT assay: Direct and off-target effects of inhibitors can result in over/underestimation of cell viability. Gene. 574 (2), 193-203 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유