Method Article
생산, 정화, 및 Adeno 관련 바이러스 기반 벡터에 대 한 품질 관리
요약
여기, 우리가 생산 하는 효율적이 고 재현 가능한 전략, titer, 및 품질 관리 일괄 adeno 관련 바이러스 벡터의 설명 합니다. 그것은 높은 titer로 벡터 준비를 하면 (13 벡터 게놈/10ml x ≥1)와 고 순도, 생체 외에서 또는 vivo에서 사용에 대 한 준비.
초록
Adeno 관련 바이러스 (AAVs)에 따라 유전자 전달 도구는 유전자 치료 응용 프로그램을 포함 하 여 중앙 신경 시스템 (CNS)에 transgenes의 배달에 대 한 인기 있는 선택입니다. AAV 벡터는 비 복제, 분열 및 비 분열 세포를 감염 하 고 장기 transgene 식을 제공할 수 있습니다. 중요 한 것은, 일부 serotypes, 새로 설명된 PHP 같은. B, 수는 혈액-뇌-장벽 (BBB) 동물 모델에서 교차 조직 배달 다음. AAV 벡터는 실험실에서 효율적으로 생산 수 있습니다. 그러나, 강력 하 고 재현할 수 프로토콜은 충분 한 레벨을 순도 및 생체 내에서 응용 프로그램에 대 한 충분히 높은 titer 값 AAV 벡터를 얻기 위해 필요 합니다. 이 프로토콜 AAV 벡터 생산, iodixanol 그라데이션 정화 전략에 따라 효율적이 고 재현 가능한 전략을 설명 합니다. Iodixanol 정화 방법 다른 정화 방법에 비해 높은 순도의 높은 titer AAV 벡터의 일괄 처리를 얻기 위해 적당 하다. 또한, 프로토콜은 일반적으로 현재 설명 하는 다른 방법 보다 빠릅니다. 또한, 정량적 중 합 효소 연쇄 반응 (정량)-기반된 전략은 신속 하 고 정확한 결정 방법 얼룩은 벡터 titer의 벡터 일괄 처리의 순도 확인에 대 한 설명. 마지막으로, CNS, AAV-PHP의 체계적 관리를 다음에 유전자 배달의 대표적인 결과. B, 제공 됩니다. 이러한 결과이 문서에서 설명 하는 프로토콜을 사용 하 여 모든 실험실에서 가능 해야 합니다.
서문
지난 30 년 동안 야생-타입 AAVs 입증 CNS1,2,,34로 유전자 전송 위한 매우 유용한 도구, 재조합 형 AAV 벡터를 만드는 설계 되었습니다. 5,6 , 유전자 치료 접근 (를 포함 하 여 FDA 및 EMA 승인 요법) 질병4,7. CNS에 사용 하기 위해 그들의 적합성은 크게 비 나눈, 포스트 mitotic 세포 감염, CNS8에서 일반적으로 발견에 그들의 능력에서 파생 됩니다. 그러나, AAV 근거한 벡터는 또한 다른 바이러스 성 벡터7에 비해 온화한 면역 응답을 도출 하는 동안 어떤 주어진된 치료 transgene4,9 장기 표현의 허용의 이점이 있다 8,10,,1112.
어떤 AAV 벡터의 주요 요소는 게놈과는 capsid. 야생-타입 AAVs는 단일 가닥 (ss) 약 5 kilobases (kb)13의 게놈 DNA 바이러스. 재조합 형 AAV 벡터의 생산에 대 한 (게놈 복제 및 바이러스 성 capsid의 조립에 필요한) 담당자 와 모자 유전자는 강포한 유형 AAV 게놈에서 삭제 하 고 트랜스에위해 제공 된 식 카세트 transgene14,15를 포함 하. 원래 바이러스 성 게놈의 거꾸로 단말기 반복 시퀀스 (ITRs) 복제 및3,,1014포장을 위해 필수적으로 AAV 벡터에 유일한 유지 요소입니다. AAV 벡터는 transgene 식;을 향상 시키기 위해 설계 될 수 있다 하나는 ITRs의 돌연변이 효과적으로 보완 DNA 가닥3,,715의 생성을 허용 하는 머리 핀 루프의 형성에 지도 한다. 자체 보완 (sc) 게놈 불리는이 구성의 주요 장점은 AAVs transgene 식 의 수준과 속도 상당히 증가의 전통적인 라이프 사이클에 전형적인 2 가닥 합성에 대 한 필요를 무시 1. 그럼에도 불구 하 고, 약 2.4 kb 벡터의 화물 용량 감소 scAAV 게놈을 사용 하 여. 발기인 또는 예측에 관한 바인딩 사이트, 특정 세포 유형16식 제한 등 규제 어떤 순서 뿐만 아니라 transgene 시퀀스 포함 됩니다.
AAV capsid 벡터 호스트 세포 상호 작용을 결정 하 고 세포 유형 또는 조직 차 있는 굴곡 운동 transgene 식 특정 위치로 제한 하도 개발 될 수 있는 AAV serotype에 대 한 학위를 수 여. 반면 다른 재조합 방법 (즉, PHP 통해 실험실에서 생산 된 여러 AAV serotypes 자연에서 찾을 수 있습니다. B). 또한, 일부 capsids 또한 조직의 관리 후 transgenes는 CNS에 걸쳐 배달 결과 BBB를 교차 하는 기능 등 다른 유용한 특성을 수 여. 이 AAV9, 뿐만 아니라 최근 설명된 PHP에 대 한 표시 되었습니다. B capsid17. 결과적으로, 이러한 serotypes는 특히 신경 질환1,,1718에 대 한 새로운 유전자 치료 접근에 대 한 관련성이 증명 하 고 있다.
이 프로토콜의 목적은 높은 titer와 순도 AAV 벡터의 소규모 생산을 위한 비용 효율적인 방법을 설명입니다. 비록 결과 여기에 제시 된 PHP를 사용 합니다. B capsid 그리고 scAAV 식 카세트, 프로토콜은 여러 AAV 벡터 serotypes 및 게놈 구성, 최대 실험 유연성을 허용의 생산에 적합. 그러나, 벡터 수율과 최종 순도 선택한 serotype에 따라서 달라질 수 있습니다.
프로토콜 자체 생산 바이러스 성 벡터에 대 한 고전적인 트라이-transfection 방법의 변형 이며 벡터 정리는, 세 슘 염화 물 (CsCl) 그라디언트를 사용 하 여 클래식 비교에 대 한 iodixanol 그라디언트를 사용 하 여 통합 생산 시간 효율적인 방식으로19,20,21에서 높은 순도의 AAV 벡터에 보고.
Transfection, 정화 및 농도 단계 바이러스 성 벡터 작업에 대 한 평가 조직 배양 실험실에서 좋은 연구실 관행 (GLP)에 따라 수행을 위한 것입니다. 각 작업 바이러스 성 벡터 생산에 관한 관련 지역 및 국가의 법률에 따라 수행 하 여 사용 해야 합니다. 일 층 흐름 후드와 살 균 조건에서 밖으로 실행 되어야 한다. 벡터 시설 내 일반 조직 배양 실험실 코트 뿐만 아니라 랩 앞치마를 착용 하는 것이 좋습니다. 또한, 장갑, 플라스틱 overshoes의 두 배 쌍 항상 착용 되어야 한다.
모든 필요한 장비 확인 벡터 생산을 시작 하기 전에 플라스 미드를 사용할 수 있습니다. 1) pCapsid 플라스 미드 복제, 즉 Rep78, Rep68, Rep52, 및 Rep40, 필요한 4 개의 비 구조 단백질을 인코딩합니다 rep 유전자와 3 구조 capsid 단백질, 즉 VP1, VP2, 및 VP3 인코딩합니다 모자 유전자 포함 되어 있습니다. 2) pHelper 플라스 미드 유전자를 E4, E2A, 및 버지니아 에서 아 데 노 바이러스, HEK293T 세포에서 AAV 생산을 용이 하 게 포함 되어 있습니다. 3) pTransgene 플라스 미드에는 두 ITRs에 의해 형벌 transgene 식 카세트를 포함 되어 있습니다. 이 플라스 미드는 시퀀스 사용 가능한 온라인22를 사용 하 여 실험실에서 합성된 드 노 보 될 수 있습니다. 플라스 드 노 보를 만든에 대 한 특히 그들 포함 하는 소설 transgenes 시퀀싱은 transgene 및 ITRs 올바른지 있는지 확인 하는 데 필요한. 또는, premade 플라스 미드 플라스 미드 온라인 저장소를 통해 직접 취득 될 수 있다. 필요한 경우, 플라스 미드 증폭 될 수 있다 하 고 제조업체의 지침23에 따라 표준 키트를 사용 하 여 정화.
벡터 titer 고 순도의 벡터 변환 능력을 저하 수 있습니다. 추가 프로토콜 생산된 벡터의 품질을 평가 하기 위해 제공 됩니다. 마지막 벡터의 생체 외에서 그리고 vivo에서 응용 프로그램에 CNS 세포 기능 연구에 대 한 유용할 것 이다.
프로토콜
| 솔루션 | 구성 | |
| 세포 배양과 transfection | ||
| DMEM1 | DMEM 1 x | |
| 1 %FBS (v/v) | ||
| 1% (v/v) GlutaMAX | ||
| DMEM10 | DMEM 1 x | |
| 10 %FBS (v/v) | ||
| 1% (v/v) GlutaMAX | ||
| 150 mM NaCl | NaCl 4.380 g | |
| 최대 500 mL 초순 | ||
| AAV 정화 및 담 | ||
| 5 M NaCl | 146.1 g NaCl | |
| 최대 500 mL 초순 | ||
| 1 M Tris HCl (pH 8.5) | 12.11 g 트리 스 베이스 | 주의 |
| 최대 100 mL 초순 | ||
| 1 M HCl을 pH 8.5를 줄이기 위해 파스퇴르 피 펫을 사용 하 여 추가 | ||
| 세포의 용 해 버퍼 | 5 M NaCl의 15 mL | |
| 1 M Tris HCl (pH 8.5) 25 mL | 주의 | |
| 최대 500 mL 초순 | ||
| 인산 염 버퍼 식 염 수 (PBS) x 10 | 80 g NaCl | |
| 2 세대 KCl | 주의 | |
| 14.4 g Na2HPO4 | ||
| 2.4 g KH2포4 | ||
| 최대 1 L dd물 | ||
| 1 M MgCl2 | 20.33 g MgCl2-6 H2O | |
| 최대 100 mL 초순 | ||
| 1 개 M KCl | 7.45 g KCl | 주의 |
| 최대 100 mL 초순 | ||
| PBS 마그네슘 칼륨 (PBS-MK) 재고 솔루션 x 5 | 10 x PBS의 250 mL | |
| 2.5 mL의 1 M MgCl2 | ||
| 1 개 M KCl의 6.25 mL | 주의 | |
| 최대 500 mL Ultrapure 물 H2O | ||
| 15 %Iodixanol | Optiprep 밀도 그라데이션 매체의 12.5 mL | 주의 |
| 5 M NaCl의 10 mL | ||
| 5의 10 mL PBS-MK x | ||
| 초순의 17.5 mL | ||
| 25 %Iodixanol | Optiprep 밀도 그라데이션 매체의 20.8 mL | 주의 |
| 5의 10 mL PBS-MK x | ||
| 초순의 19.2 mL | ||
| 페 놀 레드의 100 µ L | ||
| 40 %Iodixanol | Optiprep 밀도 그라데이션 매체의 33.3 mL | 주의 |
| 5의 10 mL PBS-MK x | ||
| 초순의 6.7 mL | ||
| 60 %Iodixanol | Optiprep 밀도 그라데이션 매체의 50 mL | 주의 |
| 페 놀 레드의 100 µ L | 주의 | |
| AAV 순도 제어 | ||
| 트리 아세테이트 EDTA (차) 버퍼 x 10 | 44.8 g 트리 스 베이스 | 주의 |
| 11.4 mL 빙 초 산 (17.4M) | ||
| 3.7 g EDTA | ||
| 최대 1 L 초순 | ||
| Agarose 젤 | 0.8 g 초순 agarose | |
| 최대 100 mL x 1 차 버퍼 | ||
| 젤 버퍼 | 181.7 g 트리 스 베이스 | 주의 |
| 1.5 g SDS | 주의 | |
| 1 M HCl으로 8.45 pH 조정 | 주의 | |
| 최대 500 mL 초순 | ||
| 음극 액 10 배 | 121.14 g 트리 스 베이스 | 주의 |
| 179.2 g Tricine | 주의 | |
| 1 %SDS (w/w) | 주의 | |
| 최대 1 L 초순 | ||
| 양극 액 10 배 | 242.3 g 트리 스 베이스 | 주의 |
| 최대 1 L 초순 | ||
| 1 M HCl와 8.9에 pH를 조정 | 주의 | |
| 샘플 버퍼 5 배 | 20 ml: | |
| 605 mg 트리 스 베이스 | 주의 | |
| 4 g SDS | 주의 | |
| 10 mg Serva 블루 G | ||
| 12 g 글리세롤 | ||
| 1 M HCl, aliquot와 6.8에 pH를 조정 하 고-20 ° C에서 저장 | 주의 | |
| 겹쳐 쌓이는 젤 | 2 젤에 대 한: | |
| 400 µ L 아크릴 | 주의 | |
| 750 µ L 젤 버퍼 | ||
| 1.85 mL 초순 | ||
| 4 Μ L TEMED | 주의 | |
| 20 µ L 10 %APS (v/v) | 주의 | |
| 추가 10%와 TEMED AP 젤 쏟아져 직전. 화학 후드 두 화학 물질을 사용 합니다. | ||
| 결심 젤 | 2 젤에 대 한: | |
| 3.32 mL 아크릴 | 주의 | |
| 3.35 mL 젤 버퍼 | ||
| 1.14 mL 초순 | ||
| 2.12 mL 50% 글리세롤 | ||
| 6 Μ L TEMED | 주의 | |
| 50 µ L 10 %APS (w/v) | 주의 | |
| 추가 10%와 TEMED AP 젤 쏟아져 직전. 화학 후드 두 화학 물질을 사용 합니다. | ||
| 물 포화 butanol | 10 mL n butanol | 주의 |
| 1 mL 초순 | ||
| 주의: 위험한 화학 물질의 사용에 대 한 지침은 자료 표를 참조 하십시오. | ||
표 1: 필요한 솔루션의 구성입니다.
1. 트라이-HEK293T 세포의 transfection
참고: 버퍼 및 프로토콜에 사용 되는 솔루션의 구성은 표 1 을 참조 하십시오.
참고: 이 섹션은 프로토콜의 성능을 약 4 일 소요 됩니다.
- 37 ° c.에 설정 물 욕조에 인간 미 발달 신장 (HEK) 293T 세포의 유리병을 녹여
참고: 만 셀 passaged 되었습니다 미만 20 x를 사용 하 여 최적의 transfection 효율을 보장 하. - 2 x 103 6 x 103 셀/cm2 DMEM10에 15 cm 직경에서의 조밀도에 씨 HEK293T 세포 세포 문화 요리.
- 37 ° C, 95% 습도, 5% CO2에서 설정 하는 표준 인큐베이터에서 70-80% 합류 세포 성장.
참고: 이 프로토콜을 사용 하 여 AAV 벡터에의 한 일괄 처리의 생산 18 셀 문화 요리를 (15 cm 직경)이 필요 합니다. 셀 합류 70%-80%의 6 x 103 7 x 103 셀/cm2, 17-20 ml DMEM10 문화 매체의 유지 관리에 해당 합니다. -
Polyethylenimine (페이) 준비 / DNA 믹스 1/3.5 (w/w)의 농도 비에.
- PΔF6, pCapsid의 180 µ g 및 18 ml 150 mM NaCl의 pTransgene의 180 µ g의 360 µ g을 혼합 하 여 18 셀 문화 요리 한 50 mL 원뿔 튜브에 대 한 DNA 믹스를 준비 합니다.
- 3 50 mL 원뿔 튜브 (DNA의 6 mL 원뿔 튜브 당 혼합) 이상의 DNA 믹스를 배포 합니다.
- 6 PEI의 840 µ g을 혼합 하 여 새로운 50 mL 원뿔 튜브에 문화 요리 셀 페이 믹스 준비 (1 µ g / µ L) 150 mM NaCl의 6 ml에서.
- 의해 드롭 페이 믹스 (1.4.3 단계에서 준비)의 6 mL을 추가 하 여 PEI/DNA 믹스를 준비 하 고 원뿔 튜브 중 하나에 포함 된 DNA 혼합 (단계 1.4.2에서에서 준비) 실 온에서 20 분 동안 품 어.
참고: 보육의 20 분 후 PEI/DNA 혼합은 약간 탁 한 될 것입니다.
- 인큐베이터에서 6 셀 문화 요리 하 고 층 류 두건에 각 문화 접시에서 매체를 완전히 발음. Prewarmed Dulbecco의 인산 염 버퍼 식 염 수 (DPBS)의 5 mL와 함께 요리를 rinsing 하 여 매체의 흔적을 제거 합니다.
- 부드럽게 요리를 기울이기로 전체 표면 DPBS의 배포를 확인 합니다.
- 부드럽게는 DPBS 발음 하 고 각 요리에 DMEM1의 12 mL를 추가 합니다.
참고: 천천히, 접시의 가장자리에 위치 하는 피 펫에서 매체를 추가 하 여 셀을 분리 하지 마십시오. - 3 배-5 배 아래로 pipetting으로 PEI/DNA를 혼합. 신중 하 게 전체 표면에 걸쳐 배포 의해 드롭 방식에서 6 셀 문화 요리의 각 PEI/DNA 혼합의 2 개 mL를 추가 합니다. 믹스는 각 접시에 추가 됩니다, 일단 인큐베이터에서 다시 요리를 놓습니다. 1.4.3– 단계를 반복 하 여 나머지 문화 요리에 대 한 1.8.
- 37 ° C, 습도 95%와 5%에 5 h transfected 세포를 품 어 공동2.
- 기존의 매체를 제거 하지 않고 각 문화 접시에 DMEM10의 추가 12 mL을 추가 (전체 중간 용량 25 mL =).
- 최대 95% 습도, 5% CO2와 37 ℃에서 72 h 후 transfection transfected 세포를 품 어.
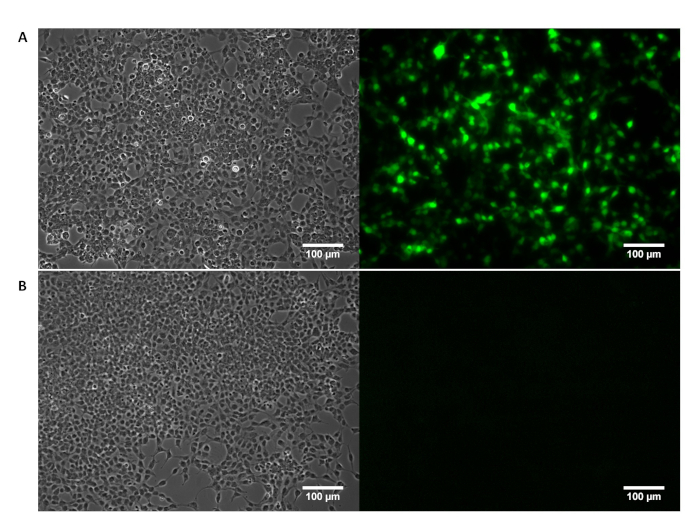
보충 그림 1: 단계 대조 현미경 검사 법 (왼쪽) GFP 식 형광 이미징 (오른쪽)에 의해 시각의 확인에 의해 시각 HEK 293T 세포 형태학. GFP 인코딩 pTransgene HEK293T 셀의 (A) 성공적인 transfection 형광 영상에 의해 확인 됩니다. (B) HEK293T 세포 transfection 시 약 으로만 치료 표시 없음 GFP 식. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
- 매체와 셀 72 h 후 transfection 수확. 셀 스 크레이 퍼를 사용 하 여 신중 하 게 문화 접시에서 세포를 분리. 매체와 얼음에 보관 50 mL 원뿔 튜브에 세포를 수집 합니다.
참고: 두 개의 셀 문화 요리의 내용은 단일 50 mL 원뿔 관으로 수집할 수 있습니다. 이 단계의 끝에, 9 개의 튜브의 각 매체의 약 50 mL를 포함 됩니다. - 가속도와 감속 최대로 설정 하는 원심 분리기의 4 ° C에서 10 분 동안 420 x g 에서 원뿔 튜브 원심
- 신중 하 게 각 관에서 상쾌한을 삭제 합니다. 자료의 손실을 방지 하기 위해 펫을 사용 하지 마십시오. 대신, 부드럽게는 상쾌한 폐기물 처리 용기에 부 어 하 고 다시 얼음에 셀 펠 릿을 포함 하는 튜브를 배치.
- 5-10 x 위아래로 pipetting으로 각 셀 펠 릿 2 ml 50 mL 원뿔 튜브에 직접 세포의 용 해 버퍼의 resuspend. 와 동 하지 마십시오. 3 튜브 함께에서 lysates 풀.
참고: 이 시점에서, 3 50 mL 원뿔 튜브, resuspended 세포 세포의 용 해 버퍼에서의 각 1 개 포함 6 mL 있을 것입니다.
2. AAV 벡터 정화
참고: 이 프로토콜 섹션의 성능을 약 1 일 소요 됩니다. 세포 세포의 용 해 버퍼에서 resuspended 포함 된 3 개의 50 mL 원뿔 관의 각각에 다음 단계를 동시에 수행 하는 방법 (이전 참고 참조).
- 동결 및 해 동 resuspended 셀 3 그들을 lyse AAV 입자를 해제 하는 x. 드라이 아이스 에탄올과 혼합을 포함 하는 물통에 튜브를 배치 하 여 동결 단계를 수행 합니다. 녹고 즉시 37 ° c.에 설정 물 욕조에 셀을 배치 하 여 수행
- 세 번째 녹고 단계 후 4 ° c.에 15 분 동안 1,167 x g 에서 원심
참고: 눈에 띄는 펠 릿 세포 파편의 구성 형성 됩니다. 튜브를 처리할 때는 이러한 마지막 벡터의 순수성을 손상 것입니다 상쾌한에 펠 릿의 분리를 일으킬 수 있습니다 갑자기 운동을 피하십시오. - 신중 하 게 50 mL 원뿔 튜브 청소 supernatants 전송 하 고 표면에 뜨는 50 U/mL의 최종 농도를 각 튜브를 nuclease 추가.
- 37 ° c.에 30 분 동안 품 어 소용돌이 친다 50 mL 원뿔 튜브를 손으로 10 분 마다는 nuclease는 상쾌한와 철저 하 게 혼합 되도록.
- 4 ° c.에 20 분 동안 13,490 x g 에서 원심 분리 하 여는 상쾌한을 명확히
- 10 mL 주사기를 0.45 μ m 필터를 부착 하 고 깨끗 한 50 mL 원뿔 튜브 위에 그것을 배치. 조심 스럽게 플런저를 제거 하 고 단계 2.5에서에서 상쾌한 주사기를 채우십시오.
- 플런저를 사용 하 여 필터를 통해 lysate를 강제로. 2.5 단계에서 얻은 상쾌한의 각 관에 대 한 새로운 필터와 주사기를 사용 합니다.
참고: 얻은 분수 'lysate 원유'로 알려져 있다. - 표 1의 지침에 따라 각 4 개의 별도 50 mL 원뿔 관, 15%, 25%, 40%와 60 %iodixanol 분수를 준비 합니다.
-
Iodixanol 분수의 다음 순서를 사용 하 여 3 개의 ultracentrifugation 튜브에 iodixanol 그라디언트 준비: 15% iodixanol 8 mL, 25 %iodixanol 5.5 mL, 40 %iodixanol 5 mL 및 60 %iodixanol 4.5 mL.
주의: Iodixanol 눈, 피부, 위장 및 호흡기 책자를 자극을 일으킬 수 있습니다. Iodixanol 그라디언트를 처리할 때는 장갑을 착용 하 고 층 류 후드 작동.- 각 ultracentrifugation 튜브에 15% iodixanol 8 mL를 플라스틱.
- 깨끗 한 50 mL 원뿔 튜브 (그림 1A)로 25 %iodixanol 솔루션의 5.5 mL를 플라스틱.
- 사용 비 졸업 파스퇴르 피 펫 (ultracentrifugation 튜브의 목은 기존의 졸업된 펫에 대 한 너무 좁은) 신중 하 게 5.5 mL 15 %iodixanol 솔루션 (그림 1B) 아래 25 %iodixanol 솔루션의 레이어.
참고: 이 이후 파스퇴르 피 펫만 약 2 mL를 가질 수 있습니다 3 단계에는 iodixanol를 추가 하 여 성공적으로 달성 될 수 있다. - 40%와 60 %iodixanol 솔루션 단계 2.9.3에에서 설명 된 대로 추가 합니다. 레이어 링 하는 동안 다른 iodixanol 인터페이스를 방해 하지 마십시오.
참고: 다른 iodixanol 분수의 적절 한 준비 iodixanol 분수에 추가 페 놀 레드 덕분에 시각적 확인 ( 표 1에 지침을 참조 하십시오)에 의해 보장 될 수 있습니다. 이후 각 분수 특정 밀도, 그들은 것입니다 하지 혼합할 레이어 링 단계에서 제대로 수행 하는 경우 ( 그림 1C확인).
- 원유는 파스퇴르 피 펫과 15 %iodixanol 그라데이션 위에 lysate 레이어. 드롭 드롭 lysate 원유와 iodixanol 솔루션 간의 인터페이스를 방해 하지 않도록 하 여 진행 합니다.
- 기입 ultracentrifugation 관 세포의 용 해 버퍼는 초승달 모양의 튜브 목 튜브 ultracentrifugation (그림 1C) 동안 생성 된 매우 높은 세력 축소 되지 않습니다 보장 하기 위해 베이스에 도달할 때까지.
- Ultracentrifugation 튜브를 사용 하 여 적절 한 뚜껑을 닫습니다. 디지털 스케일을 사용 하 여 모든 3 개의 ultracentrifugation 튜브 같은 무게를가지고 있는지 확인 하십시오. '원유 lysate' 위에 더 많은 세포의 용 해 버퍼를 추가 하 여 무게, 필요한 경우 조정 합니다.
참고: Ultracentrifugation 튜브의 무게 차이 ultracentrifuge의 안전한 작동을 보장 하기 위해 0.1 g 미만 이어야 합니다. Ultracentrifuges는 잠재적으로 위험한 장비의 조각의 이며 제대로 훈련 된 직원에 의해 사용 해야 합니다. - 301,580 x g, 가속 및 감속의 최대 속도 사용 하 여 12 ° C에서 1 시간 40 분에 대 한 고정 각도 티타늄으로 터를 사용 하 여에서 튜브 원심
-
신중 하 게 40%와 60 %iodixanol 인터페이스에서 스테인리스 무딘 바늘을 삽입 합니다.
- (그림 1E) 5 mL 주사기를 바늘을 연결 합니다.
- 만 벡터 입자를 포함 하는 명확한 분수 발음
참고: 수집 된 전체 볼륨은 약 2.5-3 mL. 이 아닌 바람직한 단백질의 존재로 인해 최종 벡터 일괄 처리에서 오염 수준을 증가 이후 25-40% 인터페이스에서 자료의 수집을 하지 마십시오. - 수집 된 분수 (담 및 농도)를 처리 하거나 하룻밤 4 ° c.에 그것을 저장합니다

그림 1: iodixanol 그라데이션 정화 및 후속 벡터 컬렉션 설치. (A) ultracentrifugation 관으로 다른 iodixanol 그라디언트를 pipetting 하기 전에 별도 원뿔 관으로 각 iodixanol 솔루션의 적절 한 볼륨을 플라스틱. 파스퇴르 (B) 다음 사용 하 여 순차적으로 각 iodixanol 솔루션 ultracentrifugation 관을 전송 플라스틱: 이전 도면층 아래 튜브의 하단에는 점점 더 높은 iodixanol의 레이어를 추가 합니다. (C) 레이어 위에 한 번 그라데이션 lysate 원유 벡터 준비가 되었습니다. 이 벡터 컬렉션 시스템 'needlestick' 상해의 위험을 제시 날카로운 바늘을 사용 하지 않습니다. (D) A 스테인리스 316-주사기 바늘은 최대 40%/60 %iodixanol 인터페이스 iodixanol 그라디언트를 통해 삽입 됩니다. (E) 벡터 입자 40 %iodixanol 단계에서 발견 되 고 수집 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
3. 담 AAV 벡터의 농도
참고: 이 섹션에서는 프로토콜의 성능을 약 2 시간 걸립니다.
- 4000 x g에서 PBS-MK와 5 분 동안 원심 분리기 x 1의 5 mL을 추가 하 여 원심 필터의 필터 멤브레인을 prerinse.
- 1 x의 5 mL을 추가 PBS-MK 수집된 AAV 벡터 분수를 혼합 하 고 총 볼륨 필터에 추가. 1 x의 추가 시 PBS-MK, 탁도 관찰 됩니다. 원뿔 모양의 필터에 볼륨까지 4000 x g 에서 원심 분리기 1 mL로 감소 했습니다. 폐기는 흐름을 통해 외부 컬렉션 튜브에 축적.
- (최소 3 배) 필요한 만큼 여러 번 13 mL PBS-MK 원뿔 모양 필터 하는 원심 분리를 반복 단계 1 x의 추가, 거기까지 더 더 탁도 관찰 때 신선한 1 x PBS-MK 추가 됩니다.
- 마지막에서 세척 단계를 볼륨 300-350 µ L로 감소 될 때까지 4000 x g 에서 PBS + 0.01% (v/v) 비 이온 계면 활성 제 및 원심 분리기 13 mL를 추가 합니다.
- 살 균 치마를 입은 microcentrifuge 튜브로 전체 볼륨 pipetting으로 필터에 현재 남은 분수를 수집 합니다.
참고: 이 분수는 desalted 및 집중 AAV 벡터를 포함 되어 있습니다. 이 프로토콜의 다음 단계에서이 분수는 '기본' 분수 라고 합니다. 후드 아래 튜브를 처리 하 고 4 ° c.에 그것을 저장할 수 있는지 확인 - 린스와 200 µ L 1의 필터 필터에 잔여 벡터 입자 수집 PBS-MK x. 살 균 microcentrifuge 튜브에 수집 합니다.
참고: 이것은 희석된 벡터 재고, 낮은 벡터 titers를 요구 하는 일부 응용 프로그램에 대 한 적합 한 수 있습니다. 이후 단계에서이 분수는 '보조' 분수 라고 합니다. - 단기 저장을 위해 벡터 fraction(s) 4 ° C (2 주 미만)에 저장 합니다. 약 수 고가 ‑20 ° C 장기 보관이 필요한 경우에 벡터.
- 섹션 4에서에서 설명한 대로 품질 관리를 수행 합니다.
4. 정량적 중 합 효소 연쇄 반응에 의해 벡터의 적정
참고: 이 섹션에서는 프로토콜의 성능을 약 3 h 걸립니다.
-
표준 곡선
- 제 1 HEK 293T 세포의 transfection 사용 transgene 표현 플라스 (pTransgene) 선형화
- 0.5 mL microcentrifuge 튜브에서 제한 다이제스트 믹스를 준비 (제한 다이제스트 믹스의 구성에 대 한 표 2 참조).
참고: 사용 효소 및 제조 업체에서 관련된 지침에 따라 제한 다이제스트 믹스의 구성을 조정 합니다. - 1 시간 37 ° c.에 대 한 제한 다이제스트 믹스를 품 어
- 플라스 미드의 1 h. 완전 한 소화를 위한 100 V에서 0.8% (w/v) agarose 젤에 선형화 플라스 미드를 실행 하 여 제한 소화의 효율성이 정의 된 크기의 단일 조각 생성 해야 확인 하십시오.
- 선형 플라스 미드 DNA PCR 정화 키트를 사용 하 여 다음 제조업체의 지침24, 정화 하 고 260에서 흡수를 측정 하 여 분 광 광도 계는 DNA 농도 측정 nm. 적정, 후 추가 사용에 대 한 ‑20 ° C에 선형 플라스 미드의 나머지 약 수를 저장 합니다.
- 다음과 같이 microliter 당 플라스 미드의 분자 (예: DNA 복사본)를 계산 합니다.
- 첫째, 플라스 미드의 분자량을 계산 합니다. DNA 기본적인 쌍 (bp)의 평균 무게는 650 Daltons (Da) 하 고 그 한 두더지는 bp의 무게 650 g, 어떤 이중 가닥 DNA 템플렛의 분자량의 길이 (bp)와 기본적인 쌍 당 무게의 제품을 복용 하 여 추정 될 수 있습니다.
플라스 미드 분자 무게 [g/mol] 플라스 미드의 크기 [bp] x 650 [검사/혈압] = - 다음, microliter 당 플라스 미드의 두더지의 수를 계산 합니다.
Microliter 당 플라스 미드의 두더지 = 플라스 미드 농도 [g / µ L] / 플라스 미드 분자 무게 [g/mol]
참고: 분자 무게의 역 자료의 1 g에 플라스 미드의 두더지의 수입니다. - 그런 다음, 아보가드로 수 (6.022 × 1023 분자/두더지)를 사용 하 여, microliter 당 플라스 미드 분자의 수를 계산 합니다.
Microliter 당 플라스 미드의 분자 당 microliter [두더지 / µ L] x 아보가드로 수 [분자/두더지] 플라스 미드의 두더지 = - 마지막으로, 플라스 미드 주식 (분자 / µ L) 100 µ L 솔루션 1 x 109 분자 (벡터 게놈 (vg) microliter 당)의 원하는 농도 희석.
플라스 미드 주식 (100 µ L) = (원하는 농도 100 µ L x [분자 / µ L]) / 플라스 미드 분자 [분자 / µ L]
- 첫째, 플라스 미드의 분자량을 계산 합니다. DNA 기본적인 쌍 (bp)의 평균 무게는 650 Daltons (Da) 하 고 그 한 두더지는 bp의 무게 650 g, 어떤 이중 가닥 DNA 템플렛의 분자량의 길이 (bp)와 기본적인 쌍 당 무게의 제품을 복용 하 여 추정 될 수 있습니다.
- Triplicates 플라스 미드 주식 (1 x 109 vg / µ L)의 직렬 희석을 만들:
1 x 109 vg / µ L 플라스 미드 주식 + H2O의 90 µ L 10 µ L = 1 x 108 vg / µ L 솔루션
1 x 108 vg / µ L 희석 + H2O의 90 µ L 10 µ L = 1 x 107 vg / µ L 솔루션
1 x 107 vg / µ L 희석 + H2O의 90 µ L 10 µ L = 1 x 106 vg / µ L 솔루션
1 x 106 vg / µ L 희석 + H2O의 90 µ L 10 µ L = 1 × 105 vg / µ L 솔루션
1 x 101 vg / µ L 솔루션을 얻기 위해 계속 합니다. - 얼음에 표준 플라스 미드의 직렬 희석 정량 접시 (단원 4.3)에 로드 될 때까지 유지.
| 구성 요소 | 금액 |
| 제한 효소 버퍼 x 10 | 5 Μ L |
| 제한 효소 | 2, 5 Μ L |
| 플라스 미드 | 5 µ g |
| H2O | 최대 50 µ L |
표 2: 제한 다이제스트 믹스 구성입니다.
표 3: 주식 플라스 미드 볼륨 계산기. 이 테이블을 다운로드 하려면 여기를 클릭 하십시오.
-
AAV 벡터에서 DNA 추출
- 믹스 2 µ L는 AAV의 주식 (3.5 단계에서 기본 분수) 벡터 DNase의 198 µ L 나 스트립 튜브 (PCR 관) (1 배속)의 버퍼와 DNase의 2 µ L 추가 나.
참고: DNase (어느 것이 정량 결과 왜곡) 벡터 capsid 안에 포함 되지 않은 모든 유전 물질을 저하 됩니다. 이 솔루션을 희석 'dil1 x 10-2' 라고 합니다. - 95 ° c.에서 10 분 뒤 37 ° C에서 30 분 동안 품 어
참고: 프로토콜을이 시점에서 중지 할 수 있습니다 그리고 자료 저장할 수 무기한 4 ° C에서 제품 품질 저하를 방지 하려면. - 10-2 x dil1 솔루션 (단계 4.2.1) 가수분해 K의 2 µ L을 추가 하 고 50 ℃, 95 ° c.에 20 분 뒤에 60 분 동안 품 어
참고: 이 단계는 AAV 벡터 capsid를 분해 하 고 솔루션으로 AAV 벡터 게놈을 풀어 것입니다. 로 단백질 (capsid) 샘플의 콘텐츠를 알 수 없는 초과에서 가수분해 K를 추가 합니다. Note, 최종 결과 영향을 미치는 (부분) 중 합 효소 저하 문제를 방지 하려면 모든 성분을 K 활동 변성, 정량, 이전에 의해 제거 되도록 하는 것이 필수적입니다. - 다음과 같이 1시 10분 1.5 mL microcentrifuge 튜브에 성분 취급 하는 K x 10-2 dil1 솔루션 (4.2.3 단계)의 직렬 희석 준비:
10-2 x dil1 + H2O의 90 µ L 10 µ L = dil1 x 10-3 희석
10-3 x dil1 + H2O의 90 µ L 10 µ L = dil1 x 10-4희석
10 µ L of dil1 x 10-4 + H2O의 90 µ L = dil1 x 10-5 희석 - 정량 접시 (단원 4.3)에 그들을 로드까지 얼음에 벡터에서 추출한 DNA의 직렬 희석 하십시오.
- 믹스 2 µ L는 AAV의 주식 (3.5 단계에서 기본 분수) 벡터 DNase의 198 µ L 나 스트립 튜브 (PCR 관) (1 배속)의 버퍼와 DNase의 2 µ L 추가 나.
-
SYBR 녹색 탐지 기반 정량 하 여 적정
- 샘플을 표준 1.5 mL microcentrifuge 튜브에 정량 마스터 믹스를 준비 합니다. SYBR 녹색 마스터 믹스, 앞으로 뇌관 (10 µ M 주식), 역방향 뇌관 (10 µ M 주식)의 1 µ L 및 H2O 반응 당 3 µ L의 1 µ L의 10 µ L을 사용 합니다. 뇌관 시퀀스에 대 한 표 4 에 있는 프로토콜을 참조 하십시오.
- 위쪽 및 아래쪽, 정량 마스터 믹스를 플라스틱 하지만 소용돌이 하지 마십시오.
- 4.1 절의 준비 표준 곡선의 어느 5 µ L 또는 각 우물에 섹션 4.2, AAV 벡터에서 추출한 DNA 정량 마스터 믹스의 15 µ L를 추가 합니다. 만 정량 마스터 믹스, 부정적인 컨트롤을 포함 하는 3 개의 우물을 포함 합니다. 플레이트 레이아웃 그림 2 를 참조 하십시오.
- 씰링 필름으로 접시를 봉인 하 고 짧게 원심 1500 x g 30에 정량 플레이트 4 ° c.에 s
- 악기에 대 한 접시 기반 실시간 PCR 증폭 및 탐지, 표 5에 제시 하는 조건을 사용 하 여 정량 반응을 실행 합니다.
| 뇌관 이름 | 시퀀스 |
| 앞으로 뇌관 | 5'-CCCACTTGGCAGTACATCAA-3' |
| 반전 뇌관 | 5'-GCCAAGTAGGAAAGTCCCAT-3' |
표 4: 뇌관 시퀀스 CBA 발기인에 대 한 설계 되었습니다.
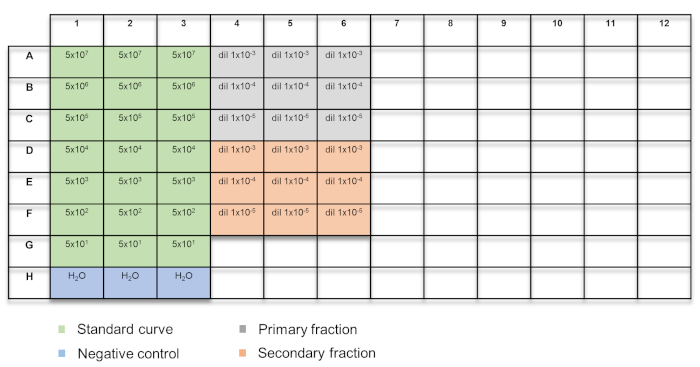
그림 2: 정량 기반 벡터 적정 플레이트 레이아웃. 예제는 색상으로 구분: 녹색 = 표준 곡선; 블루 H2O 컨트롤; = 회색 = 기본 분수; 오렌지 = 보조 분수. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
| 단계 | 시간 | 온도 | 사이클 | 목표 |
| 사전 부 화 | 5 분 | 95 ° C | x1 | DNA 변성 및 중 합 효소 활성화 (핫 스타트 반응). |
| 증폭 | 10 분 | 95 ° C | x1 | DNA 증폭 설정 다른 어 닐 링 온도와 대체 뇌관을 사용 하는 경우 최적화 될 수 있습니다. |
| 10 s | 95 ° C | x40 | ||
| 40 s | 60 ° C | |||
| 1 s | 72 ° C | |||
| 냉각 | 10 s | 40 ° C | x1 | 플레이트 냉각입니다. PCR의 끝입니다. |
표 5: SYBR 녹색 기반 정량 적정에 대 한 열 순환 프로토콜.
-
AAV 벡터 titer를 결정 하기 위해 데이터 분석
- 스프레드시트 데이터 셀 (테이블 6A) 표준 샘플 표준 곡선을 생성 하는 섹션 4.1에서에서 준비의 다른 희석에 대 한 가져온 Ct 값을 채우십시오.
참고: 표준 곡선의 방정식 표시 됩니다 (y = ln (x) + b) R2 효율 (표 6B) 함께. 정량 100% 효율과 R2 1.0 (≥ 0.96) 가까이 있어야 합니다. - (표 6 c) 스프레드시트에서 해당 데이터 셀에 채우기 위해 a 와 b 의 계산 된 값을 사용 합니다.
- AAV 샘플 섹션 4.2에에서 준비의 다른 희석에 대 한 가져온 Ct 값으로 스프레드시트를 완료 한다.
- 다음 수식을 사용 하 여 '기본 분수'의 microliter 당 벡터 게놈에서 평균 AAV 벡터 titer를 계산.
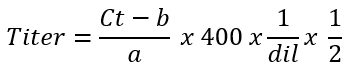
참고: 200의 곱셈 요소를 사용 하는 사우스 캐롤라이나 게놈 400 요소는 단일 좌초 게놈에 대 한 사용25. 실제로 각 정량 주기 동안 이중 DNA 수량 DNA는 sc ss 게놈에 비해 2 배 검출. 적정 목표 microliter 당 벡터 게놈에서 농도 계산 하는 것입니다. 정정은 시작 물자 (단계 4.2.1)의 2 µ L를 사용 하는 경우는 정량 실행 필요 합니다. dil 단계의 4.2.4 희석 요소를 나타냅니다. '보조' AAV 벡터 분수 (단계 3.6)의 titer는 동시에 계산할 수 있습니다.
- 스프레드시트 데이터 셀 (테이블 6A) 표준 샘플 표준 곡선을 생성 하는 섹션 4.1에서에서 준비의 다른 희석에 대 한 가져온 Ct 값을 채우십시오.
표 6: 정량 데이터 분석에 대 한 서식 파일. 이 파일을 다운로드 하려면 여기를 클릭 하십시오.
5. SDS 페이지와 실버 얼룩 순도 제어
참고: 이 섹션은 프로토콜의 성능을 약 5 시간 걸립니다.
- 70% (v/v) 에탄올을 사용 하 여 철저 하 게 청소는 젤을 주조에 사용 되는 유리 접시.
- 젤 캐스팅 시스템을 조립. 젤을 캐스팅할 때 아크릴 혼합물의 누설을 방지 하기 위해 하지 유리 접시의 바닥 빠는 확인 하십시오.
- 준비는 스태킹 및 두 개의 별도 50 mL 원뿔 튜브에 해결 젤 솔루션. 그들은 젤의 중 합에 대 한 책임 (TEMED) tetramethylethylenediamine 및 10% (w/v) 암모늄 persulfate (AP)를 생략 합니다. 바로 젤을 캐스팅 하기 전에 그들을 추가 합니다.
참고: 아크릴 아 미드 젤에서의 최종 비율 영향 단백질의 분리 프로필: 일반적으로, 아크릴의 10% (v/v) 최종 농도 AAV 벡터 준비의 순수성을 테스트 하기에 충분 한 될 것입니다. - 소용돌이 관 젤 구성 요소를 포함 하 여 부드럽게 혼합. 때문에 과도 한 산소 중 합을 손상 할 수 있다 소용돌이 하지 마십시오.
- TEMED 및 10% (w/v) APS 해결 젤 솔루션에 추가 합니다. 혼합 하 고 1-2 cm 작은 유리 접시의 맨 아래에 도달할 때까지 다음 젤 홀더에 붓는 다.
- 아크릴 혼합 정상 butanol 물 포화의 레이어를 배치 합니다. 이렇게 하면 합 동안 평평한 표면 형성. 이 젤을 탈수 하 고 그것의 기능을 손상으로 30 분 이상 알코올에서 젤을 두지 마십시오.
주의: Butanol은 피부 접촉 위험. 그것은 또한 화재 위험을 선물 한다. 관심을가지고 처리 합니다. - 유해 하 고 다음 부는 butanol 어 젤을 기다립니다. 팁: 튜브에 초과 젤 믹스는 경화 여부를 확인 합니다. 중 합 H2O와 젤의 미만 20 분 세척 표면에에서 발생 하 고 젤의 표면을 방해 하지 않도록 주의 복용 종이 타 올을 사용 하 여 그것을 건조.
- TEMED 및 10% (w/v) AP 겹쳐 쌓이는 젤을 추가 하 고 분리 젤 위에 젤 홀더에 젤을 붓는 다.
- 젤에 제공 된 빗을 놓습니다. 우물 안에 공기 방울의 형성을 피하기 위해 하나의 꾸준한 운동으로이 작업을 수행 합니다.
- 유해를 젤에 대 일 분 이상 기다립니다. 팁: 원뿔 튜브는 경화 초과 젤 혼합 하는 경우 확인 합니다.
- 기본 및 보조 AAV 벡터 분수 2 믹스 (표 7) 준비 (단계 3.5과 3.6, 각각).
| 높은 금액 | 낮은 금액 | |
| AAV 벡터 소재 | 5 Μ L | 1 Μ L |
| 샘플 버퍼 x 5 | 3 Μ L | 3 Μ L |
| H2O | 7 Μ L | 11 Μ L |
표 7: 실버 얼룩에 필요한 샘플 혼합의 구성.
- 95 ° c.에 5 분 동안 그들을 열 하 여 완전히 샘플 믹스를 변성 전극 방향에 주의 기울이고 전기 탱크를 조립 한다.
- 1 x 전극 어셈블리의 내부에 음극 버퍼와 외부에 양극 버퍼 x 1 탱크를 채우십시오.
참고: 양극 버퍼 실행-실행에서 재활용 될 수 있습니다. 항상 신선한 음극 버퍼를 사용 해야 합니다. - 젤에서 빗을 제거 하 고 1 x 음극 버퍼와 젤의 우물을 청소.
- 잘에서 단백질 사다리의 1 µ L을 로드 합니다. 다른 웰 스 같은 젤 (그림 3)에 있는 샘플 믹스를 로드 합니다. 샘플 입력 해결 젤 때까지 50 V에서 젤을 실행 합니다. 염료 전면 젤의 낮은 한도 도달할 때까지 다음 100 V 전압을 증가.
- 유리 접시에서 신중 하 게 젤을 추출 하 고 바이러스 성 단백질 (VP1, VP2, 및 VP3 subunits) 뿐만 아니라 AAV capsid를 구성 하는 가능한에 대 한 확인으로 시각화 하기 위해 키트 (제조 업체의 지침26)에 따라 얼룩은 사용 하 여 단백질 오염 (그림 3)입니다.

그림 3: SDS 페이지와 실버 얼룩을 사용 하 여 벡터 순도의 평가. Tricine-SDS 젤을 사용 하 여, 다양 한 벡터 준비의 5 µ L 분리 되었다. 단백질은 이후 실버 얼룩에 의해 감지 됩니다. 벡터 간주 됩니다 순수한 때 VP1 (82 kDa), VP2 (67 kDa), 그리고 VP3 (60 kDa)는 1: 1에서 볼 수 있습니다: 과도 한 배경 (2 레인) 또는 일반적인 밴드 (3 차선) 없이 10 비율 (1 차선). 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
결과
AAV9 고려 되었고, 최근까지 가장 효과적인 AAV 벡터 serotype BBB를 건너와 주변 관리를 다음 CNS의 세포를 시험 하. Capsid 디자인에서 중요 한 사전 달성 했다 때 Deverman 그 외 여러분 보고 Cre AAV 대상 진화 재결합 기반 (만들기)17라는 capsid 선택 메서드를 사용 하 여. 이 방법을 사용 하 여, 그들은 PHP 라는 새로운 capsid를 식별 합니다. B 그들은 조직의 주입17다음 이다와 여러 CNS 영역에 있는 뉴런의 대부분 transduce 수로 보고. 이 시점에서, 그것은 해야 비록 주의 PHP. B C57/Bl6 마우스 (이 초기 격리 실험에 사용 된 변형)에 긍정적인 결과 제공, 예비 보고서 제안 효율성 스트레인 종속 방식으로 다를 수 있습니다. 추가 실험, 의심의 여지가, 더 많은 빛이 문제31에 창.
그러나, 불구 하 고 이러한 문제에는 PHP. B-의 증거-개념 유전자 치료 실험을 포함 하 여 질병 모델에서 생쥐의 CNS에 비 침 투 적인 유전자 조작에 대 한 흥미 진 진한 가능성을 제공 합니다. 따라서, 우리는 PHP를 사용 하 여 transgene 식의 효율성을 평가 하기로 결정 했습니다. B 대 AAV9, CNS 변환 다음 20092이후 주변 관리에 대 한 ' 금 표준 ' 벡터 되었습니다. 두 serotypes transgene 식에 대 한 최적의 조건 하에서 직접적인 비교를 수행 하려면 우리는 sc 게놈 구성32를 사용 합니다. 두 벡터의 유비 쿼터 스 치킨 β-걸 (CBA) 발기인 통제 transgene 녹색 형광 단백질 (GFP)에 대 한 수행. 출생 후 하루 42 (무게에서 약 20 g)에서 여성 C57/Bl6 마우스 마우스 중 scAAV2/PHP의 당 1 x 1012 vg의 복용량을 받았다. B-CBA-GFP 또는 scAAV2/9-CBA-GFP. 벡터 행정 수행 통해 꼬리 정 맥 주입 했다. 실험 구 루벤의 윤리 위원회에 의해 승인 되었다.
3 주 postinjection, 쥐 4% (w/v) 얼음 처럼 차가운 paraformaldehyde (PFA) 다음 얼음 처럼 차가운 PBS 가진 transcardial 관류를 받았다. 그들의 두뇌는 수확 했다 하 고 0.01% (w/v) 나-아 지 드/PBS 저장에 대 한 추가 분석까지 전송 하기 전에 동일한 정착 액에 하룻밤 외피에 의해 postfixation를 더 받았다. 그 후, 두뇌 진동 톰을 사용 하 여 구분 했다 그리고 immunohistochemistry 50 µ m 두께 섹션에서 수행 되었다.
Transgene 식의 수준을 평가 하기 위해 섹션 형광 염료 (안티 토끼 알 렉 사 Fluor 488)에 활용 된 이차 항 체를 사용 하 여 검출 GFP (토끼 안티-GFP)에 대 한 1 차 항 체로 얼룩진 했다 (그림 4A, B ). (임의의 단위 [au])에 형광 강도 측정 확인 GFP 식 때는 사우스 캐롤라이나에서에서 크게 증가 게놈 및 PHP. B capsid는 AAV9 기준으로 사용 되었다. GFP 증가 (2105 ± 161 대 1441 ± 99 au; 뇌에서 관찰 되었다 p = 0.0032), 소 뇌 (2601 ± 196 대 1737 ± 135 au; p = 0.0032), 그리고 brainstem (3082 ± 319 대 2485 ± 88 노 소; p = 0.0038) (그림 4C).
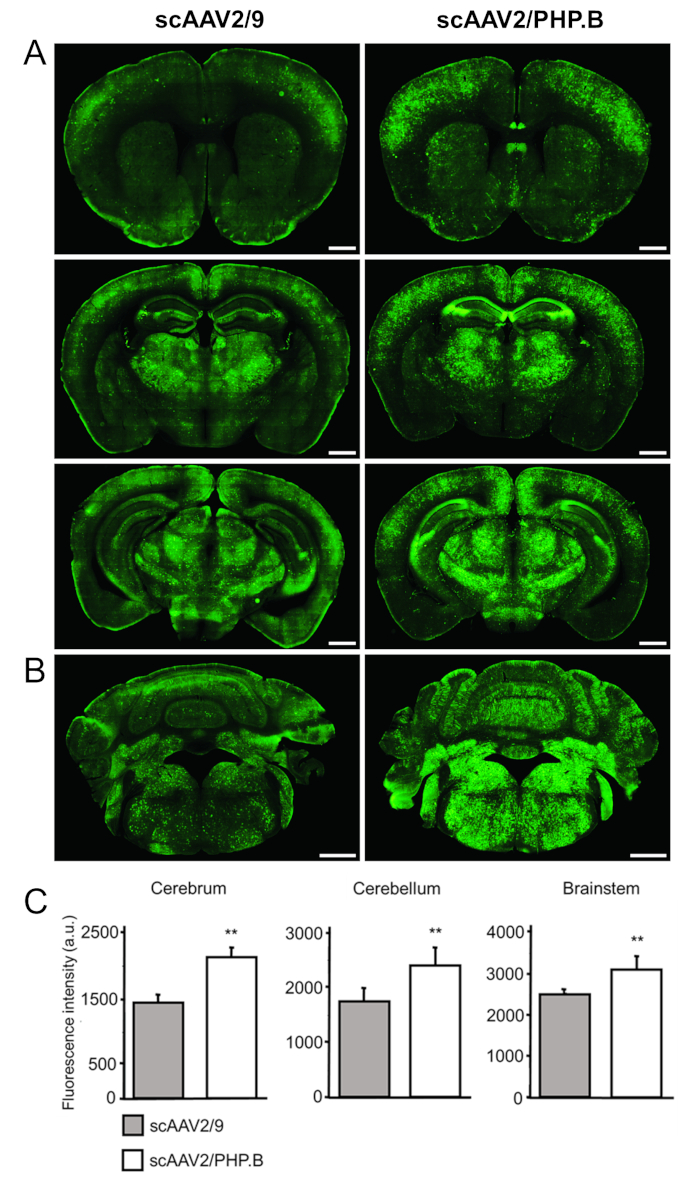
그림 4: scAAV2/PHP의 조직 배달. B-CBA-GFP는 CNS에 높은 GFP 식으로 이어집니다. scAAV2/PHP. B-CBA-GFP 또는 scAAV2/9-CBA-GFP (1 x 1012 vg/마우스) 6 주 된 C57/Bl6 마우스 꼬리 정 맥 주입을 통해 관리 되었다. GFP은 immunohistochemistry 코로나 뇌 섹션 3 주 postinjection에 사용 하 여 검색 되었습니다. (A) 뇌 및 소 뇌와 brainstem 표시 됩니다 (B). 스케일 바 = 1 m m. (C) 상대 형광 농도의 정량화 GFP 신호 (마우스 당 10 섹션, 벡터 그룹 당 3 쥐) 각 벡터와 달성 수준을 결정 위해 수행 되었습니다. 일방통행 ANOVA 테스트 수행, 뒤에 양측 스튜던트 t-테스트; 데이터는 평균 ± 표준 편차;으로 표현 p < 0.01; au입니다. 임의 단위입니다. AAV 벡터 생산을 위해 사용 하는 pCapsid serotype 2에서에서 유전자 담당자 및 serotype PHP에서에서 유전자 모자 포함 되어 있습니다. B 또는 AAV9, 그에 따라. 이 그림에서 링 콘 수정 되었습니다 외.32. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
재조합 형 AAV 벡터의 생산 여기 사용 재료와 장비 대부분의 분자 생물학 실험실 및 셀 문화 시설에 공통을 설명합니다. 그것은 사용자를 생체 외에서 그리고 vivo에서 응용 프로그램의 범위에 걸쳐 여러 세포 및 조직 유형을 대상으로 사용할 수 있는 순수 하 고, 전 임상 등급 AAV 벡터를 얻을 수 있습니다. (즉, CsCl 기반 정화), 다른 사람에 비해이 프로토콜의 가장 큰 장점 중 하나는 필요한 짧은 작업 시간입니다. 준비-사용 AAV 벡터 HEK293T 셀의 초기 transfection 후 6 작업 일의 최대에서 얻을 수 있습니다.
여러 가지 요인 부정적인 최종 수확량 또는 AAV 벡터의 품질에 영향을 미칠 수 있습니다. 불 쌍 한 transfection 효율 낮은 바이러스 수익률33에 대 한 주요 이유 중 하나입니다. 주요 추천이 20 배 이상 passaged 하지 transfection21시간 90% 보다 큰 셀 합류 하지 않은 HEK293T 셀의 사용 이다. 또한, transfection 방법 선택 결과에 큰 영향을 있다. 이 프로토콜은 PEI의 사용을 기반으로 합니다. 페이 폴리머와 핵 산, 셀 및 매매 를 통해 endosomes34에 의해 촬영 되는 polyplexes로 알려진의 단지의 세대를 통해 세포 핵에 외 인 DNA를 제공 하는 능력으로 양이온 중합체 이다. 페이 기초를 둔 transfection은 쉽고 빠르게 다른 널리 사용 되는 방법, 칼슘 인산 염35와 DNA의 공동 강수량 등 달리 수행 하. 또한, 페이 기초를 둔 transfection는 양이온 지질과 자석 중재 transfection36의 사용 등 새로 도입된 된 다른 방법에 비해 훨씬 저렴 합니다.
정화 전략 프로토콜에 핵심 역할을 한다. 다른 방법에 비해, iodixanol 기반 담긴 빈 바이러스 성 입자 (20%)20의 더 높은 백분율을 포함 하는 경향이 있다. 이것은 오프셋, 정도, iodixanol 기반 정화 100의 입자 infectivity 비율 AAV 벡터 준비에 정기적으로 발생 하는 사실에 의해. 이는 입자 infectivity의 상당한 손실을 보고37은 기존의 CsCl 기반 절차에 비해 상당한 개선을 나타냅니다. 또 다른 일반적인 대체 AAV 벡터 정화 방법은 크로마토그래피 기반 정화입니다. 그러나,이 메서드는 특정 열이 사용 하는 각 벡터 capsid에 필요한 주요 단점: 예를 들어 AAV2 고전적인 덤플링을 열을 사용 하 여 격리 하는 동안이 방법을 작동 하지 않습니다 AAV4와 AAV5, 헤 파 린 바인딩을가지고 하지 않습니다 그들의 capsids38에 사이트입니다. 크로마토그래피 정화는 또한 비싼 고려 하 고, iodixanol 기반 정화는 일반적으로 더 작은 규모33,39, , AAV 벡터의 높은 품질 일괄 처리를 생성 하고자 하는 실험실에 적합 그러나 40. 최종 수율 및 순도 벡터의 극대화, 주의 필요 iodixanol 그라디언트를 만들 때. 다양 한 iodixanol 분수 누구의 팁 튜브의 벽에 닿아 살 균 파스퇴르 피 펫을 사용 하 여 ultracentrifugation 튜브에 전송 해야 합니다: 천천히 그리고 지속적으로 iodixanol는 피 펫에서 추방 되어야 한다. 40 %iodixanol 레이어, 벡터 입자 축적으로 케어 그라데이션 인터페이스20을 혼합 하지 않도록 주의가 필요 합니다. 마지막으로, 포함 하는 벡터 분수 하지 20 g. 보다 더 큰 계기와 스테인리스 무딘 바늘의 삽입으로 복구할 수 한다 벡터 복구를 최대화 하기 위해 분명 분수 전체에서 검색 해야 합니다. 이 단계 동안 타이밍이 중요 합니다. 준비의 순수성을 손상 시 키 지 않으려면 그라데이션 (오염) 다른 단계는 수집 하기 전에 컬렉션을 막으려고 필수적 이다.
가져온된 벡터 titer에 차이 포장된 입자를 생산 하는 벡터의 본질적인 기능을 또한 지정할 수 있습니다. 다른 AAV serotypes 비교 일부 AAV 벡터 더 어려운 다른 사람 (예를 들어, AAV2) 보다 더 높은 titer에서 생산 하는 보여주었다41. 강 수는 벡터의 염 단계 낮은 titer에 대 한 가능한 이유 고 쉽게 overconcentration33를 피 함으로써 막을 수 있습니다. 또한, 그것은 또한 iodixanol 그라데이션 기반 정화의 효율성은 serotypes 약간 다릅니다 있으며 따라서, 다른 serotypes 얻은 titer 불일치41관찰 될 수 있다.
마지막으로, 그것은 정량 Pcr는 DNA 정량화에 대 한 매우 정확한 방법 이지만 기술에서 몇 가지 고유의 가변성 관찰 될 수 있다 밖으로 지적 될 필요가 있다. 정확도 적정에 주로 정확한 pipetting 모든 솔루션의 적절 한 vortexing에 따라 다릅니다. 읽고 가장 정확한 titer를 보장 하는 정량 수 독립적으로 반복 하지, 그리고 얻은 값 평균. 이 프로토콜에서 제시 하는 뇌관의 선택 우리의 실험실에 사용 된 pTransgene 플라스 미드에 있는 CBA 발기인의 순서를 기반으로 합니다. CBA 발기인은 여러 세포 유형에 걸쳐 드라이브 식 벡터 필드에서 널리 이용 되는 강한 합성 발기인이 이다.입니다. 그것은 세포 (CMV) 초기 증강 요소;를 포함 하 여 여러 요소를 통합 발기인, 첫번째 exon 그리고 CBA 유전자;의 첫 번째 intron 그리고 토끼 β-globin 유전자의 결합 수락자. 그러나, 뇌관 식 카세트 (발기인, transgene, 및 규정 요소를 포함 하 여) 내에 있는 거의 모든 요소에 대 한 디자인할 수 있습니다. 일괄 처리를 통해 titer의 비교 뇌관에 벡터에 공통 영역에 대해 사용 되는 제공 가능, 이기도 합니다.
결론적으로,이 프로토콜 AAV 벡터 capsids, 게놈 구성, 발기인 유형 및 transgene 화물의 다양 한 생산에 사용할 수 있습니다. 이것은 쉽게 가장 실험적인 요구에 맞게 그들의 벡터의 마지막 특성에 맞게 사용자가 있게 됩니다. 예제 대표 결과는 PHP 사용 하 여 합니다. 효율적으로 BBB를 교차, B capsid CNS, 다음 꼬리 정 맥 주입32고효율 유전자 발현을 했다. CNS 침투 벡터의 체계적 관리 가능한 부작용2,,1732측면에서 상당한 장점이 있습니다. 침략 적 기법의 주의 피하고 있는 동안 주변 주입에 대 한 가능한 대안 intrathecal 배달, 배달 AAV 벡터의 중추 신 경계는으로 구성 된입니다. 이 배달 경로 효과적일, 주변 장기와 면역 응답42의 낮은 수준에 더 적은 오프 대상 효과 CNS에 걸쳐 transgene의 광범위 한 표현을 보여주는 입증 된다. 그러나, intrathecal 주사는 더 많은 도전, 그들은 꼬리 정 맥 주입 보다 높은 기술을 필요로.
이 기술은 수정 capsid 발전 AAV 벡터 사용 유전자 치료 응용 프로그램에 대 한 기회에 의해 구동 된다. 이러한 접근 등 루 경화 증, Charcot Marie이 질병, 파 킨 슨 병 알 츠 하이 머 병18현재 불 치 CNS 질환 치료에 매력적인 가능성을 제공.
공개
저자는 공개 없다.
감사의 말
M.R.는 Fonds voor Wetenschappelijk Onderzoek 삼기엔 (FWO) 박사 친목 (133722/1204517N)에 의해 지원 되 고 인정 Fundación 심혈 관 드 콜롬비아 및 과학의 관리 부의 지속적인 지원 기술 및 혁신 (그랜트 CT-FP44842-307-2016, 프로젝트 코드 656671250485) Mm은 FWO 박사 친목 (1S48018N)에 의해 지원 됩니다. M.G.H.는 VIB 기관 그랜트와 외부 지원 티에리 Latran 재단 (잔디-VIP), 재단에서 알 츠 하이 연구 (상-FRA) (P #14006), FWO (그랜트 1513616N), 유럽 연구 회의 (ERC) (시작 그랜트에 의해 지원 되었다 281961-AstroFunc; 개념 그랜트 713755-광고-VIP의 증거). 저자는 Jeason Haughton 마우스 축산으로 그의 도움, 꼬리 정 맥 주사를 수행 그녀의 도움에 대 한 스테파니 Castaldo transfected HEK293T 셀의 이미지를 제공 하기 위한 캐롤라인 Eykens을 인정 합니다. M.G.H.는 마이클 던 롭, 피터 Hickman, 그리고 딘 해리슨을 인정 한다.
자료
| Name | Company | Catalog Number | Comments |
| Plasmid production | |||
| pTransgene plasmid | De novo design or obtained from a plasmid repository | N/A | See step 1 of main protocol for further details |
| pCapsid | De novo design or obtained from a plasmid repository | N/A | See step 1 of main protocol for further details |
| pHelper | Agilent | 240071 | |
| Plasmid Plus maxi kit | Qiagen | 12963 | |
| QIAquick PCR purification Kit | Qiagen | 28104 | |
| AAV Helper-Free System | Agilent | 240071 | |
| Cell culture and transfection | |||
| Dulbecco’s Modified Eagle Medium (DMEM), high glucose, no glutamine | Life technologies | 11960-044 | Supplement DMEM with FBS (1% or 10% v/v) and GlutaMAX 200 mM (1% v/v) then filter sterilize the medium using a 0.22 µm filter |
| Fetal bovine serum (FBS) | GIBCO | 10500-064 | |
| GlutaMAX supplement | GIBCO | 35050038 | |
| (200 mM) | |||
| Corning bottle-top vacuum filter system | Sigma-Aldrich | CLS430769 | |
| Dulbecco’s Phosphate Buffered Saline (DPBS) with no calcium and no magnesium | GIBCO | 14190094 | |
| HEK293T cells | American Tissue Culture Collection | CRL3216 | Upon receipt, thaw the cells and culture as described in the protocol. After a minimal number of passages, freeze a subfraction for future in aliquots. Always use cells below passage number 20. Once cultured cells have been passaged more than 20 times, restart a culture from the stored aliquots |
| Cell culture dishes | Greiner Cellstar | 639160 | 15 cm diameter culture dishes |
| Cell scrapers | VWR | 10062-904 | |
| Polyethylenimine (PEI) | Polyscience | 23966-2 | PEI in powder form is dissolved at 1 µg/µL in deionized water (ddwater) at pH=2 (use HCl). Prepare in a beaker and stir for 2-3 h. When dissolved, bring the pH back to 7 with NaOH. Filter sterilize and store the resuspended stock solution in 1 ml aliquots at -20 °C. PEI aliquots can be freeze/thawed multiple times. |
| Virkon solution | Fisher Scientific | NC9821357 | Disinfect any material that has been in contact with assembled vector particles with Virkon solution |
| Mutexi long-sleeve aprons | Fisher Scientific | 11735423 | Wear an apron over the top of a regular lab coat |
| Fisherbrand maximum protection disposable overshoes | Fisher Scientific | 15401952 | |
| AAV Purification and desalting | |||
| Optiprep density gradient medium | Sigma-Aldrich | D1556 | Optiprep is a 60% (w/v) solution of iodixanol in water (sterile). CAUTION. Use under a laminar flow hood. Wear gloves |
| Phenol red | Sigma-Aldrich | P0290 | CAUTION. Use under a laminar flow hood |
| Pasteur pipette | Sigma-Aldrich | Z627992 | Sterilize before use |
| OptiSeal Polypropylene tubes | Beckman | 361625 | |
| Benzonase (250 U/µL) | Sigma-Aldrich | E1014 | Supplied as a ready-to-use solution |
| Acrodisc syringe filter | Pall corporation | 4614 | |
| Omnifix syringe (5 mL) | Braun | 4617053V | |
| Blunt syringe needle | Sigma Aldrich | Z261378 | Stainless steel 316 syringe needle, pipetting blunt 90° tip gauge 16, L 4 in. Referred to in the text as a blunt-end needle |
| Aqua Ecotainer | B. Braun | 0082479E | Sterile endotoxin-free water. Referred to as 'Ultrapure water' |
| Amicon ultra-15 centrifugal filter unit | Millipore | UFC910024 | These filters concentrate the final product by collecting the vector particles in consecutive centrifugation steps |
| Pluronic F68 (100x) | Thermo Fisher | 24040032 | Non-ionic surfactant. Dilute in sterile PBS to use at 0.01% (v/v) |
| Fisherbrand Sterile Microcentrifuge Tubes with Screw Caps (2 mL) | Fisher Scientific | 02-681-374 | Use skirted tubes for easy handling |
| AAV Titration | |||
| Restriction enzyme: StuI (10 U/µL) | Promega | R6421 | |
| DNAse I (1 U/µL) | Fisher Scientific | EN0521 | |
| Proteinase K | Sigma-Aldrich | 3115852001 | Reconstitute in ultrapure water and use at a final concentration of 10 mg/mL. Solution can be stored at -20 °C |
| EasyStrip Plus Tube Strips (with attached caps) | Fisher Scientific | AB2000 | |
| Eppendorf microtube 3810x | Sigma-Aldrich | Z606340-1000EA | |
| LightCycler 480 SYBR Green I Master Mix | Roche | 4707516001 | |
| LightCycler Multiwell Plates, 96 wells | Roche | 4729692001 | White polypropylene plate (with unique identifying barcode) |
| Microseal 'A' PCR plate and PCR Plate Sealing Film | Bio-Rad | msa5001 | |
| AAV Purity control | |||
| Ammonium persulfate (APS) | Sigma-Aldrich | A3678 | Reconstitute in ultrapure water to 10% (v/v). CAUTION. Use under a laminar flow hood. Wear gloves |
| Tetramethylethylenediamine (TEMED) | Sigma-Aldrich | T9281 | CAUTION. Use under a laminar flow hood. Wear gloves |
| Tris Base ULTROL Grade | Merck | 648311 | CAUTION: Use under a laminar flow hood. Wear gloves |
| UltraPure Agarose | Thermo Fisher | 16500-500 | |
| Rotiphorese® Gel 30 (37,5:1) | Carl Roth | 3029.3 | Aqueous 30% acrylamide and bisacrylamide stock solution at a ratio of 37.5:1. CAUTION: Use under a laminar flow hood. Wear gloves |
| Serva Blue G | Sigma-Aldrich | 6104-58-1 | |
| Precision Plus prestained marker | Bio-Rad | 1610374edu | |
| 1-Butanol | Sigma-Aldrich | B7906 | CAUTION: Use under a laminar flow hood. Wear gloves |
| Immunohistochemistry | |||
| Rabbit anti-GFP | Synaptic Systems | 132002 | 1:300 dilution |
| Anti-rabbit Alexa Fluor 488 | Invitrogen | A21206 | 1:1,000 dilution |
| Equipment | Company | Catalog number | Comments |
| Vector production lab | |||
| Rotina 380 bench-top centrifuge * | Hettich | 1701 | |
| Optima XPN 80 ultracentrifuge * | Beckmann Coulter | A95765 | |
| Type 50.2 Ti fixed-angle titanium rotor * | Beckmann Coulter | 337901 | |
| Entris digital scale * | Sartorius | 2202-1S | |
| Warm water bath * | Set at 37 °C | ||
| Ice bucket * | VWR | 10146-290 | Keep material used in the vector production lab separate from that used in standard lab areas |
| Pipetboy pro * | Integra | 156,400 | |
| Graduated pipettes: Cell star * | Greiner bio-one | 606180 | Capacity of 5 mL |
| Graduated pipettes: Cell star * | Greiner bio-one | 607180 | Capacity of 10 mL |
| Graduated pipettes: Cell star * | Greiner bio-one | 760180 | Capacity of 25 mL |
| CO2 incubator CB150 * | Binder | 9040-0038 | Set at 37 °C, 5% CO2 and 95% humidity |
| Nuaire safety cabinet NU 437-400E * | Labexchange | 31324 | Clean all the surfaces with 70% ethanol and Virkon before and after use |
| Conventional lab | |||
| T100 thermal cycler * | Bio-Rad | 1861096 | |
| LightCycler 480 Instrument II * | Roche | 5015278001 | |
| ThermoMixer * | Eppendorf | C 5382000015 | |
| Nanodrop * | ThermoFisher Scientific | ND 2000 | |
| Mini-Protean Tetra Cell* | Bio-Rad | 1658001FC | For use with handmade or precast gels |
| ProteoSilver silver stain kit | Sigma-Aldrich | PROTSIL1 | High sensitivity protein detection with low background |
| Centrifuge 5804 R * | Eppendorf | B1_022628045 | High speed centrifuge for medium capacity needs (up to 250 mL) |
| Graduated pipettes Cell star * | Greiner bio-one | 606180 | 5 mL |
| Graduated pipettes Cell star * | Greiner bio-one | 607180 | 25 mL |
| Graduated pipettes Cell star * | Greiner bio-one | 760180 | 25 mL |
| Filter tips * | Greiner bio-one | 750257 | 1250 µL |
| Filter tips * | Greiner bio-one | 738257 | 300 µL |
| Filter tips * | Greiner bio-one | 771257 | 10 µL |
| Ice bucket with lid * | VWR | 10146-290 | |
| Mini diaphragm vacuum pump, VP 86 * | VWR | 181-0065 | |
| Pipetman P2 | Gilson | F144801 | |
| Pipetman P20 | Gilson | F123600 | |
| Pipetman P100 | Gilson | F123615 | |
| Pipetman P200 | Gilson | F123601 | |
| Pipetman P1000 | Gilson | F123602 | |
| * Materials marked with an asterisk are expensive pieces of equipment and are usually central infrastructure items shared between multiple labs. These items can also be replaced by equivalents if available. Note, when a different ultracentrifuge is used, care must be taken to select the correct rotor and centrifuge tubes. |
참고문헌
- Daya, S., Berns, K. I. Gene Therapy Using Adeno-Associated Virus Vectors. Clinical Microbiology Reviews. 21 (4), 583-593 (2008).
- Duque, S., et al. Intravenous Administration of Self-complementary AAV9 Enables Transgene Delivery to Adult Motor Neurons. Molecular Therapy. 17 (7), 1187-1196 (2009).
- Bourdenx, M., Dutheil, N., Bezard, E., Dehay, B. Systemic gene delivery to the central nervous system using Adeno-associated virus. Frontiers in Molecular Neuroscience. 7, (2014).
- Kantor, B., McCown, T., Leone, P., Gray, S. J. Clinical Applications Involving CNS Gene Transfer. Advances in Genetics. 87, 71-124 (2014).
- Crystal, R. G. Adenovirus: The First Effective In Vivo Gene Delivery Vector. Human Gene Therapy. 25 (1), 3-11 (2014).
- Weinberg, M. S., Samulski, R. J., McCown, T. J. Adeno-associated virus (AAV) gene therapy for neurological disease. Neuropharmacology. 69, 82-88 (2013).
- Henckaerts, E., Linden, R. M. Adeno-associated virus: a key to the human genome?. Future Virology. 5 (5), 555-574 (2010).
- Howarth, J. L., Lee, Y. B., Uney, J. B. Using viral vectors as gene transfer tools (Cell Biology and Toxicology Special Issue: ETCS-UK 1 day meeting on genetic manipulation of cells). Cell Biology and Toxicology. 26 (1), 1-20 (2010).
- Nathwani, A. C., et al. Adenovirus-Associated Virus Vector-Mediated Gene Transfer in Hemophilia B. The New England Journal of Medicine. 365 (25), 2357-2365 (2011).
- Carter, B. J. Adeno-associated virus and the development of adeno-associated virus vectors: a historical perspective. Molecular Therapy. 10 (6), 981-989 (2004).
- Schambach, A., Zychlinski, D., Ehrnstroem, B., Baum, C. Biosafety Features of Lentiviral Vectors. Human Gene Therapy. 24 (2), 132-142 (2013).
- Van Vliet, K. M., Blouin, V., Brument, N., Agbandje-McKenna, M., Snyder, R. O. The Role of the Adeno-Associated Virus Capsid in Gene Transfer. Methods in Molecular Biology. 437, 51-91 (2008).
- Rincon, M. Y., VandenDriessche, T., Chuah, M. K. Gene therapy for cardiovascular disease: advances in vector development, targeting, and delivery for clinical translation. Cardiovascular Research. 108 (1), 4-20 (2015).
- Samulski, R. J., Muzyczka, N. AAV-Mediated Gene Therapy for Research and Therapeutic Purposes. Annual Review of Virology. 1 (1), 427-451 (2014).
- McCarty, D. M. Self-complementary AAV Vectors; Advances and Applications. Molecular Therapy. 16 (10), 1648-1656 (2008).
- Choi, J. H., et al. Optimization of AAV expression cassettes to improve packaging capacity and transgene expression in neurons. Molecular Brain. 7, 17 (2014).
- Deverman, B. E., et al. Cre-dependent selection yields AAV variants for widespread gene transfer to the adult brain. Nature Biotechnology. 34 (2), 204-209 (2016).
- Jackson, K. L., Dayton, R. D., Deverman, B. E., Klein, R. L. Better Targeting, Better Efficiency for Wide-Scale Neuronal Transduction with the Synapsin Promoter and AAV-PHP.B. Frontiers in Molecular Neuroscience. 9, (2016).
- Lock, M., et al. Versatile Manufacturing of Recombinant Adeno-Associated Viral Vectors at Scale. Human Gene Therapy. 21 (10), 1259-1271 (2010).
- Strobel, B., Miller, F. D., Rist, W., LamLa, T. Comparative Analysis of Cesium Chloride- and Iodixanol-Based Purification of Recombinant Adeno-Associated Viral Vectors for Preclinical Applications. Human Gene Therapy Methods. 26 (4), 147-157 (2015).
- Jungmann, A., Leuchs, B., Katus, H. A., Rommelaere, J., Müller, O. J. Protocol for efficient generation and characterization of adeno-associated viral (AAV) vectors. Human Gene Therapy Methods. , (2017).
- Tolmachov, O. Designing Plasmid Vectors. Methods in Molecular Biology. 542, 117-129 (2009).
- . QIAGEN Plasmid Purification Handbook Available from: https://www.qiagen.com/us/resources/download.aspx?id=46205595-0440-459e-9d93-50eb02e5707e&lang=en (2018)
- Lock, M., Alvira, M. R., Chen, S. J., Wilson, J. M. Absolute Determination of Single-Stranded and Self-Complementary Adeno-Associated Viral Vector Genome Titers by Droplet Digital PCR. Human Gene Therapy Methods. 25 (2), 115-125 (2014).
- . ProteoSilver Silver Stain Kit (PROTSIL1) - Bulletin, ProteoSilver Available from: https://www.sigmaaldrich.com/content/dam/sigma-aldrich/docs/Sigma/Bulletin/protsil1bul.pdf (2018)
- Machholz, E., et al. Manual Restraint and Common Compound Administration Routes in Mice and Rats. Journal of Visualized Experiments. (67), e2771 (2012).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Puntel, M., et al. Gene transfer into rat brain using adenoviral vectors. Current Protocols in Neuroscience. 50 (1), (2010).
- Bachman, J. Immunohistochemistry on Freely Floating Fixed Tissue Sections. Methods in Enzymology. 533, 207-215 (2013).
- Hordeaux, J., et al. The Neurotropic Properties of AAV-PHP.B Are Limited to C57BL/6J Mice. Molecular Therapy. 26 (3), 664-669 (2018).
- Rincon, M. Y., et al. Widespread transduction of astrocytes and neurons in the mouse central nervous system after systemic delivery of a self-complementary AAV-PHP.B vector. Gene Therapy. 25 (2), 83-92 (2018).
- Crosson, S. M., Dib, P., Smith, J. K., Zolotukhin, S. Helper-free Production of Laboratory Grade AAV and Purification by Iodixanol Density Gradient Centrifugation. Molecular Therapy. Methods & Clinical Development. 10, 1-7 (2018).
- Merdan, T., Kunath, K., Fischer, D., Kopecek, J., Kissel, T. Intracellular processing of poly(ethylene imine)/ribozyme complexes can be observed in living cells by using confocal laser scanning microscopy and inhibitor experiments. Pharmaceutical Research. 19 (2), 140-146 (2002).
- Meissner, P., et al. Transient gene expression: recombinant protein production with suspension-adapted HEK293-EBNA cells. Biotechnology and Bioengineering. 75 (2), 197-203 (2001).
- Reed, S. E., Staley, E. M., Mayginnes, J. P., Pintel, D. J., Tullis, G. E. Transfection of mammalian cells using linear polyethylenimine is a simple and effective means of producing recombinant adeno-associated virus vectors. Journal of Virological Methods. 138 (1-2), 85-98 (2006).
- Zolotukhin, S., et al. Recombinant adeno-associated virus purification using novel methods improves infectious titer and yield. Gene Therapy. 6 (6), 973-985 (1999).
- Kaludov, N., Handelman, B., Chiorini, J. A. Scalable Purification of Adeno-Associated Virus Type 2, 4, or 5 Using Ion-Exchange Chromatography. Human Gene Therapy. 13 (10), 1235-1243 (2002).
- Nass, S. A., et al. Universal Method for the Purification of Recombinant AAV Vectors of Differing Serotypes. Molecular Therapy. Methods & Clinical Development. 9, 33-46 (2017).
- Qu, G., et al. Separation of adeno-associated virus type 2 empty particles from genome containing vectors by anion-exchange column chromatography. Journal of Virological Methods. 140 (1-2), 183-192 (2007).
- Holehonnur, R., et al. Adeno-associated viral serotypes produce differing titers and differentially transduce neurons within the rat basal and lateral amygdala. BMC Neuroscience. 15, 28 (2014).
- Wang, H., et al. Widespread spinal cord transduction by intrathecal injection of rAAV delivers efficacious RNAi therapy for amyotrophic lateral sclerosis. Human Molecular Genetics. 23 (3), 668-681 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유