JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
루시퍼라제 기반 성장 분석을 사용하여 세포내 톡소플라즈마 곤디성장에 대한 화학적 억제제 효율 결정
요약
여기서 제시된 프로토콜은 루시퍼라제 기반 성장 분석을 사용하여 톡소플라즈마 곤디의 시험관내 세포내 성장에 대한 화학화합물의 억제 효능을 평가하는 프로토콜이다. 이 기술은 해당 표적 유전자의 유전적 결실에 의한 억제 특이성을 확인하는 데 사용된다. TgCPL 프로테아제에 대한 LHVS의 억제는 예로 평가된다.
초록
톡소플라즈마 곤디는 인간 인구에 널리 영향을 미치는 원생동물 병원체입니다. 임상 톡소플라즈마증 치료에 사용되는 현재 항생제는 제한적입니다. 또한, 그들은 사람들의 특정 그룹에 불리 한 부작용을 전시. 따라서 임상 톡소 플라즈마 증에 대한 새로운 치료법의 발견이 필수적입니다. 새로운 항생제 개발의 첫 번째 단계는 높은 처리량 선별 전략을 사용하여 기생충 성장억제에 높은 효능을 보이는 화학 화합물을 식별하는 것입니다. 의무적인 세포내 병원균으로서 Toxoplasma는 숙주 세포 내에서만 복제할 수 있으며, 이는 성장의 빠른 지표로서 광학 흡광도 측정의 사용을 금지합니다. 여기서 제시된 루시퍼라제 기반 성장 분석에 대한 상세한 프로토콜이다. 일례로, 이 방법은 야생형 톡소플라즈마 기생충의 두 배 시간을 계산하고 기생충 세포내 성장억제에 관한 모르폴리누레아-류필-호모페닐-비닐 설폰 페닐(LHVS, 시스테인 프로테아제 표적화합물)의 효능을 측정하는데 사용된다. 또한, 상동성 의존적 재조합(HDR)을 위한 50 bp 상동 영역을 사용하는 톡소플라즈마에서 CRISPR-Cas9 기반 유전자 결실 프로토콜이 기술된다. 야생형 및 TgCPL(톡소플라즈마 카테신 L-like protease)-결핍 기생충에서 LHVS의 억제 효능을 정량화함으로써, LHVS가 Δcpl 성장보다 야생형 기생충 성장을 보다 효율적으로 억제하는 것으로 나타났으며, 이는 TgCPL이 LHVS가 톡소플라즈마에결합하는 표적임을 시사한다.Toxoplasma 이 루시퍼라제 기반 성장 분석법의 높은 감도와 쉬운 작동은 톡소플라즈마 증식을 모니터링하고 높은 처리량 방식으로 약물 효능을 평가하는 데 적합합니다.
서문
톡소 플라즈마 곤디는 인간 인구의 약 1/3을 감염시키는 매우 성공적인 세포 내 기생충입니다. 그것의 높은 전송 속도는 주로 전염의 그것의 다양 한 경로 에 기인, undercooked 된 고기의 소비를 포함 하 여, 포유류 저수지에 노출, 그리고 출생 시 선천성 전송. T. gondii는 주로 면역 손상된개별에있는 가혹한 이환율 그리고 사망으로 이끌어 낼 수 있는 기회 감염을 일으키는 원인이 됩니다1,2,,3,,4,5,6.,6 현재 급성 톡소플라즈마증 치료에 사용되는 항생제는 선천성 및 잠복성 감염 치료에 특히 비효율적이며 일부3개인3,7,,8에서심각한 반응을 일으킨다. 따라서 새로운 치료법을 식별할 긴급한 필요성이 존재합니다. Toxoplasma 및 그 숙주 내의 세포내 과정의 차이를 이해하면 잠재적인 약물 표적을 식별하는 데 도움이 됩니다. 따라서, 효율적이고 편리한 게놈 조작 기술은 Toxoplasma내의 개별 적인 유전자의 역할을 공부하는 것을 요구됩니다. 또한, 톡소플라즈마는 플라스모듐 종과 크립토스포리듐 종과 같은 다른 중요한 인간 병원균을 포함하는 물리 균 Apicomplexa에 속한다. 따라서, Toxoplasma는 다른 양봉체 기생충에 있는 기본적인 생물학을 공부하는 것을 돕기 위하여 모형 유기체로 이용될 수 있습니다.
미생물 병원체에 대하여 새로운 항생제를 확인하기 위하여는, 화학 화합물의 도서관의 높은 처리량 검열은 미생물 성장의 억압에 있는 그들의 효험을 결정하기 위하여 처음에 수행됩니다. 지금까지, 몇몇 마이크로플레이트 기지를 둔 성장 측정은 T의 세포내 성장을 측정하기 위해 개발되었습니다. 곤디(즉, 방사성 3H-우라실 혼입 기반 정량화9, T. gondii-specific항체10,,11,β-갈락토시다아제 또는 YFP 발현 독소플라즈마 균주12,,13,및 최근 개발된 고함량을 이용한 단백질 기반 측정을 이용한 정량적 ELISA 기반 기생충 검출).14
이러한 개별 전략은 모두 고유한 장점을 가지고 있습니다. 그러나 특정 제한 사항도 응용 프로그램을 제한합니다. 예를 들어, Toxoplasma는 핵화 된 동물 세포 내에서만 복제 할 수 있기 때문에,항-T. gondii 항체의 자가 형광 및 비특이적 결합은 형광 기반 측정에서 간섭을 유발합니다. 또한 방사성 동위원소의 사용에는 특별한 안전 준수 및 잠재적안전 문제가 필요합니다. 이러한 검소 중 일부는 성장을 지속적으로 모니터링하기보다는 단일 시점에서 성장을 평가하는 데 더 적합합니다.
여기서 제시된 것은 세포내 톡소플라즈마 성장의 정량화를 위한 루시퍼라제 기반 프로토콜이다. 이전 연구에서, 나노루크 루시퍼라제 유전자는 톡소플라즈마 튜불린 프로모터하에 복제되었고, 이러한 루시퍼라제 발현 구조는 RHΔku80Δhxg를생성하기 위해 야생형(RHΔku80Δhxg 균주)으로 형질전환되었다::NLuc 균주(이하 RHΔku80::NLuc)는 15. 이 균주는 이 연구 결과에 있는 세포내 성장 결정 및 유전자 삭제를 위한 부모 긴장으로 봉사했습니다. RHΔku80을사용하여 ::NLuc 균주, 인간 포피 섬유아세포에서의 기생충 성장(HFFs)은 기생충 을 두 배로 계산하기 위해 감염 후 96시간 동안 모니터링하였다.
또한, 기생충 성장에 대한 LHVS의 억제 효능은 IC50 값을 식별하기 위해 직렬 LHVS 농도에 대하여 톡소플라즈마 성장 속도를 플로팅함으로써 결정될 수 있다. 이전 문헌은 TgCPL이 기생충에서 LHVS의 주요 표적이며 LHVS로 치료하는 것이 급성 및 만성 톡소플라즈마 감염의 발병을 감소시키고 있다고 보고했으며,16,,17,,18,,19. 추가적으로, RHΔku80::NLuc는 TgCPL-결핍균주를 생성하기 위한 게놈 변형을 위한 부모 균주로서 사용하였다(RHΔku80Δcpl::NLuc),및 LHVS의 억제는 이 돌연변이체에 대하여 측정되었다. TgCPL균주에 비해 TgCPL-결핍 기생충에서 LHVS에 대한 IC50 값의 상승 변화를 관찰함으로써, TgCPL이 생체 내 LHVS에 의해 표적화된다는 것이 입증되었다.
이 프로토콜에서, RHΔku80::NLuc는 효율적인 비 상동성 최종 결합 경로 (NHEJ)가 결여된 부모 변형으로 사용되어 이중 크로스 오버 상동성 의존 재결합 (HDR)20,,21을촉진합니다. 추가적으로, 50 bp 상동 영역은 PCR에 의한 약물 내성 카세트의 양단에 측면화된다. PCR 제품은 CRISPR-Cas9 기반 게놈 편집 도구를 사용하여 HDR을 통해 전체 유전자 궤적을 제거하는 수리 템플릿역할을 합니다. 이러한 짧은 상동 영역은 쉽게 수리 템플릿의 생산을위한 편리한 전략을 제공 프라이머에 통합 할 수 있습니다. 이 프로토콜은 보편적인 유전자 결실 및 내인성 유전자 태깅을 수행하도록 변형될 수 있다.
예를 들어, 가장 최근의 간행물에서, 3개의 프로테아제 유전자, TgCPL, TgCPB (톡소플라즈마 카테신 B-like 프로테아제), 및 TgSUB1 (톡소플라즈마 서브틸리신 유사 프로테아제 1), 이 방법을 사용하여 TgCRT(톡소플라즈마 클로로퀸-내성 수송기)-결핍 파라소에 유전적으로 절제되었다15.Toxoplasma 또한, TgAMN TgAMN(아미노펩티다아제 N[TgAMN, TGGT1_221310])은내인성 태그(15)를태그하였다. Lourido lab은 또한 유사한 방법22를사용하여 톡소플라즈마 게놈에서 사이트 지향 유전자 돌연변이 및 내인성 유전자 태깅의 도입을 위해 40-43 bp의 범위에서 짧은 상동 영역을 사용하여 보고하였다. 이러한 성공적인 게놈 변형은 40-50 bp 상동 영역이 Toxoplasma 곤디에서게놈 조작을 크게 단순화하는 TgKU80-결핍균주에서 효율적인 DNA 재조합을 위해 충분하다는 것을 시사한다.
프로토콜
톡소플라즈마 곤디는 위험 군 2로 분류되며 생물안전성 수준 2(BSL-2)에서 처리해야 합니다. 이 프로토콜은 클렘슨 대학의 기관 생물 안전위원회에 의해 검토되고 승인되었습니다.
1. 루시퍼라제 기반 톡소플라즈마 성장 분석
- 종자 인간 포피 섬유아세포 (HFFs) 기생충 접종 1 주일 전에 숙주 세포가 완전히 결합되도록합니다. 시험 기간 내내 기생충이 세포 내상태로 남아 있도록 투명 플레이트에서 모의 분석기를 수행합니다.
참고 : 여기서, 분석은 96 웰 마이크로 플레이트에서 수행됩니다. 실험적 필요에 따라, 384 또는 1536 웰 마이크로 플레이트까지 확장 될 수있다. - 완전히 용해된 기생충의 ~0.3-0.4 mL를 T25 플라스크로 이송하여 사용 2일 전에 톡소플라즈마 기생충을 동류 HF에 넣습니다. 37°C에서 감염된 숙주 세포를 2일 동안 5%CO2로 배양한다.
- 주사기 5 mL의 갓 용해된 기생충을 21 G 안전 바늘 5x를 통해 세포 내 기생충을 해방한 다음 3 μm 필터를 통과하여 숙주 세포 파편을 제거합니다. 페놀 무첨가 D10 배지 7 mL를 사용하여 플라스크에서 잔류 기생충을 헹구고 다시 필터를 통과시다.
- 실온 (RT)에서 10 분 동안 1000 x g의 원심 분리기 기생충. 상급체를 붓고 페놀 이물질이 없는 D10 용지 10 mL에 펠릿을 다시 놓습니다.
- 혈독계를 사용하여 기생충을 세어 농도를 결정합니다.
- 야생 형 (WT) 변형에 대한 1 x 104 기생충 / mL에 기생충을 희석. 성장 결핍 기생충 긴장에 대 한, 그에 따라 농도 증가 luciferase 신호에 상당한 증가 관찰.
- HfFs를 미리 시드한 96개의 웰 마이크로플레이트에서 조심스럽게 흡인 매체를 접종하고 3개의 기둥과 5개의 행의 형태로 우물에 기생충 재서스펜션150 μL을 접종하여 3개의 기술적 복제와 5개의 타임포인트를 나타냅니다.
- 마이크로플레이트를 37°C 및 5%CO2에서 4시간 동안 배양한다.
- 비 침략 기생충을 제거하기 위해 우물에서 조심스럽게 미디어를 흡인 한 다음 각 행의 RT 페놀 적색 매개 로 우물을 채웁니다 (첫 번째 행 제외).
- 동일한 부량의 PBS 및 2x 루시퍼라제 분석 버퍼를 혼합하고 루시퍼라아제 기판을 12.5 μM으로 희석합니다.
- 100 μL의 희석 루시퍼라아제 기판을 상단 행의 각 웰에 넣습니다. 세포가 완전히 용해 될 수 있도록 10 분 동안 RT에서 마이크로 플레이트를 배양.
- 마이크로플레이트 리더를 사용하여 루시퍼라제 활성을 측정하였다. 플레이트 판독기 설정은 표 1에나열되어 있습니다. 각 독서는 감염 후 4 시간에서 침략 된 기생충의 초기 수를 나타냅니다.
- 매번 24시간마다 매 번 매 24시간마다 매번 1.9-1.12단계를 반복하여 매체를 변경하지 않고 4일 동안 반복합니다. 이 수치는 24 h, 48 h, 72 h 및 96 h 사후 감염에서 복제된 기생충의 총 수를 반영합니다.
- 각 시점에서 평균 수치를 계산하고 시간 지남에 따라 기생충 성장의 배 변화를 결정하기 위해 4 h의 평균 판독값으로 나눕니다.
- 그래프 소프트웨어를 사용하여 데이터를 플로팅합니다. RHΔku80의대표적인 성장 독서표 및 플롯 ::NLuc 기생충은 그림 1A, B에도시되어 있습니다.
- 두 배의 시간을 계산하려면 인큐베이션 시간 동안 개별 타임포인트에서 배변화의 log2 값을 플로팅합니다. 선형 회귀 함수를 사용하여 각 변형의 두 배 시간을 나타내는 경사를 계산합니다(그림1A, C).
2. 톡소플라즈마 성장에 대한 화학적 화합물 억제 효능 평가
참고: 여기서, 톡소플라즈마 성장에서의 LHVS의 억제에 대한 평가가 예로 제시된다. 8개의 상이한 농도의 LHVS가 시험되고, RHΔku80모두에 대한 3개의 생물학적 복제에 대해 3개의 기술적 복제가 수행된다::NLuc 및 RHΔku80Δcpl::NLuc 균주.
- 기생충 감염 에 앞서, 종자 HFs 96 잘 마이크로 플레이트의 형식으로 3 행과 균주 당 화합물 당 하나의 생물학적 복제에 대한 아홉 열. 숙주 세포는 사용하기 전에 적어도 7 일 동안 성장할 수 있습니다.
- RHΔku80통과 ::NLuc 및 RHΔku80Δcpl::NLuc 기생충을 사용하기 전 2 일 동안. 기생충 정화 및 정량화를 위한 1.2-1.6 단계를 따르십시오. 1 x 104 기생충 / mL에서 페놀 적색이없는 미디어에서 기생충을 다시 중단하십시오.
- 동시 HHFFs를 포함하는 플레이트로부터 매질 을 흡기하고 각각의 우물을 150 μL의 기생충 재서스펜션으로 접종한다. 마이크로플레이트를 37°C 및 5%CO2에서 4시간 동안 배양한다.
- 직렬 희석에 의해 12웰 저수지에서 8개의 다른 농도로 LHVS를 준비한다. 일반적으로, 농도는 직렬 희석 방식으로 3배 씩 감소된다.
참고: 가장 낮은 농도는 가장 높은 농도에 비해 6,561배 감소합니다. 희석의 접이식 변화는 개별 화합물의 상이한 특성에 기초하여 그에 따라 조절될 수 있다. - 감염 후 4시간에서, 흡인 매체는 침입되지 않은 기생충을 제거하고 다른 농도에서 LHVS로 보충된 150 μL의 열 2-9에서 각각 잘 채웁니다. 첫 번째 열을 일반 매체로 채워진 상태로 두어 처리되지 않은 컨트롤로 역할을 합니다.
- 마이크로플레이트를 37°C 및 5%CO2에서 추가로 96시간 동안 배양한다.
- 1.9-1.11 단계를 수행하고 개별 우물의 루시퍼라아제 활성을 측정합니다.
- 각 개별 LHVS 농도의 우물에서 3개의 기술적 복제물의 루시퍼라아제 활동을 평균화한다.
- 각 LHVS 농도에 대한 평균 루시퍼라아제 활성을 비처리 된 기생충으로부터 유래 된 평균 루시퍼라아활성으로 나누어 정규화된 루시퍼라아제 활성을 백분율로 계산한다.
- 그래프 소프트웨어를 사용하여 개별 LHVS 농도에 대해 정규화된 루시퍼라아제 활동을 플로팅합니다(그림2). 기생충 성장에 대 한 피리메타민의 억제는 또한 대조군으로 측정. 피리메타민은 톡소플라즈마에서엽산 대사를 억제하여 급성 톡소플라즈마증을 치료하는 데 사용되는 임상 항생제이다.
- "투여량-반응 억제" 회귀 프로그램 하에서 그래프 소프트웨어, 정규화된 반응 대 [억제제]에 포함된 방법을 사용하여 개별 화합물에 대한 IC50 값을 계산합니다. IC50은 다음 수식을 사용하여 계산됩니다.
Y = 100/(1 + X/IC50)
어디에: Y는 억제제의 다른 농도의 밑에 감염된 세포의 정규화된 luciferase 활동을 나타내고, X는 억제제의 개별적인 사격량을 나타냅니다.
3. 톡소플라즈마 기생충의 CRISPR-Cas9 기반 유전자 삭제
- 관심 있는 유전자를 삭제하기 위한 가이드 RNA(sgRNA) 및 Cas9를 발현하는 플라스미드 구조의 생성
- www.ToxoDB.org 가서 1.5 kb 5'-UTRs 및 3'-UTR (번역되지 않은 지역)와 함께 인트론 및 엑손을 포함한 전체 유전자 코딩 서열을 검색합니다.
참고: 여기서 TgCPL(TGGT1_321530)은 대표적인 예로 타겟팅됩니다. - 검색된 TgCPL 시퀀스를 시퀀스 분석 소프트웨어에 복사하고(이름 및 버전에 대한 재료 표 참조) 5'- 및 3'-UTR 영역에 레이블을 지정합니다.
- 상단 메뉴 모음에서 도구 아이콘을 선택한 다음 복제 | CRISPR 사이트 찾기.
- PAM 부위 위치에 대해 3'(Cas9)'을 선택하고 특이성 채점 섹션에서 톡소플라즈마 게놈 서열을 포함하는 폴더를 선택한다. 나머지 설정을 기본값으로 둡니다.
- 다음 두 가지 기준을 가진 sgRNA를 선택한다: 1) 높은 특이성 점수를 나타내고, 일반적으로 >98%, 및 2) NGG, 프로토스페이서 인접 모티프(PAM) 서열에 따른 G가 결여된다. 선택된 sgRNA는 일반적으로 관심 있는 유전자의 시작 및 정지 코돈에 가까운 사이트에 위치한다.
- 선택한 sgRNA의 시퀀스를 복사하여 다음 프라이머 템플릿에 붙여넣습니다.

빨간색의 부분은 선택된 TgCPL sgRNA 서열을 나타낸다. 그것은 관심의 다양한 유전자에 대한 다른 sgRNAs로 대체 될 수있다.
참고: 선택한 sgRNA가 G로 시작하지 않는 경우, sgRNA의 시작 부분에 G를 추가하여 발현을 향상시킵니다. - PCR 반응을 수행하여 독소플라즈마 우라실 포스포리보실트랜스퍼라제(TgUPRT)유전자(23)를 표적화하는TgUPRT기존의 플라스미드 발현 sgRNA(도3A)를수정하여 PCR 프리믹스를 이용하여 표 2에제공된 설정을 사용한다.
- 아가로즈 젤에 PCR 제품을 실행하여 성공적인 증폭을 확인합니다. 10kb PCR 제품이 증폭될 것으로 예상됩니다(그림3B).
- DNA 겔 추출 키트를 사용하여 PCR 생성물을 추출하고 사이트 지시 돌연변이 키트를 사용하여 원형화합니다. 레시피는 표 3을 참조하십시오. RT에서 10-20 분 동안 반응을 배양하십시오.
- 원형화된 PCR 제품을 대장균으로 변환하고 10개의 클론을 선택하여 설계된 sgRNA의 통합을 추가로 검증합니다.
- 두 개의 클론을 성장하고 플라스미드를 추출합니다. BamHI 및 EcoRV로 정제 된 플라스미드를 잘라냅니다. 후보 플라스미드는 2.4 kb및 7.2 kb(그림 3C)에서두 개의 밴드를 산출합니다.
- M13 역프라이머를 사용하여 Sanger 시퀀싱용 플라스미드를 보내 TgUPRT sgRNA를 설계된 sgRNA로 성공적으로 교체하는 것을 확인합니다(도3D).
- www.ToxoDB.org 가서 1.5 kb 5'-UTRs 및 3'-UTR (번역되지 않은 지역)와 함께 인트론 및 엑손을 포함한 전체 유전자 코딩 서열을 검색합니다.
- HDR 메커니즘을 통한 유전자 삭제를 위한 수리 템플릿 생성
- 선택된 sgRNA의 표적부위에 따르면, 5'-UTR 또는 3'-UTR의 50 bp를 찾아 상동성 의존재결합을 위한 표적 유전자(HDR, 토론 섹션 참조). 영역의 선택은 sgRNA 가 표적으로 하는 위치에 따라 아래에 나열된 기준을 따릅니다.
- Cas9에 의한 절단 부위가 시작 코돈으로부터 상류에 위치하는 경우, 다음을 선택한다: 좌측 HDR 영역으로서 골짜기 부위로부터 50 bp DNA 서열 상류, 및 오른쪽 HDR 영역으로서 정지 코돈으로부터 50 bp DNA 서열 하류.
- Cas9에 의한 절단 부위가 코돈 시작과 정지 사이에 있는 경우, 다음을 선택한다: 50 bp DNA 서열은 왼쪽 HDR 영역으로서 시작 코돈으로부터 상류로, 및 50 bp DNA 서열은 오른쪽 HDR 영역으로서 정지 코돈으로부터 다운스트림.
- Cas9에 의한 절단 부위가 스톱 코돈으로부터 하류에 위치하는 경우, 다음을 선택한다: 좌측 HDR 영역으로서 시작 코돈으로부터 50 bp DNA 서열 상류, 및 50 bp DNA 서열 하류에서 오른쪽 HDR 영역으로 절단 부위로부터 의한 하류.
참고: TgCPL 유전자의 경우, 절단 부위는 코돈 시작과 정지 사이에 위치한다. 따라서, 다음 의 프라이머는 피리메타민 저항 카세트를 인코딩하는 템플릿으로서 pMDC64를 사용하여 수리 템플릿을 증폭하도록 설계된다. PCR 증폭을 위한 pMDC64 플라스미드에 대한 블랙 어닐로의 서열. 빨간색으로 표시된 영역은 상동 재조합에 대한 TgCPL-특이적시퀀스입니다.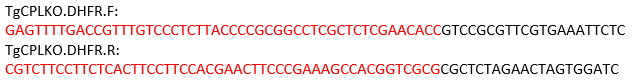
- 표 4에설명된 PCR 조건하에서 PCR 프리믹스를 사용하여 PCR을 수행합니다.
- 아가로즈겔(그림 3E)에서PCR 제품을 실행한 다음 젤 추출 및 표준 핵산 정량화 절차를 수행합니다.
참고: 예상되는 대역을 성공적으로 증폭할 수 없는 경우 PCR 조건을 최적화및/또는 프라이머 쌍을 전환합니다.
- 선택된 sgRNA의 표적부위에 따르면, 5'-UTR 또는 3'-UTR의 50 bp를 찾아 상동성 의존재결합을 위한 표적 유전자(HDR, 토론 섹션 참조). 영역의 선택은 sgRNA 가 표적으로 하는 위치에 따라 아래에 나열된 기준을 따릅니다.
- 톡소플라즈마 감염
- RHΔku80통과 ::NLuc 기생충은 Confluent HHF를 함유하는 T25 플라스크에서 2일 동안. 완전히 용해된 기생충의 T25 플라스크는 2-3개의 형질전환에 충분합니다.
- 주사기 및 필터-1.2단계에서 기재된 바와 같이 기생충을 정화한다. 시토믹스 버퍼에서 기생충을 다시 일시 중단하고 RT에서 10분 동안 1,000 x g으로 회전합니다.
- 10 mL의 세포 혼합 버퍼로 펠릿 기생충을 씻고 RT에서 10 분 동안 1,000 x g에서 기생충을 회전시다.
- 조심스럽게 상류물을 붓고 1 x 108 기생충 / mL의 농도로 동일한 버퍼에서 기생충을 다시 일시 중단하십시오.
- sgRNA/Cas9 발현 플라스미드의 20 μg(질량 비 = 1:5, 1:3 몰 비에 해당)와 2 μg의 수리 템플릿 DNA를 혼합합니다. 수리 템플릿의 증폭 수율이 낮은 경우, 그에 따라 두 DNA 조각의 입력을 감소. 최소 0.5 μg의 수리 템플릿을 사용할 수 있습니다.
- 400 μL의 기생충 재서스펜션, DNA 및 200 mM ATP/500 mM의 5 μL을 1.5 mL 원심분리기 튜브에 글루타티온(GSH)을 섞는다. 필요한 경우 시토믹스 버퍼로 총 부피를 500 μL로 가져옵니다.
- 기생충과 DNA의 혼합물을 전기 개화 큐벳(4mm 갭 폭)으로 옮기고 전기 천공 장치를 사용하여 전기 천공 (2 kV 전압, 50 Ω 저항)을 수행합니다.
- 신선한 D10 배지에 동시 HF를 포함하는 T25 플라스크에 전기 포이션 기생충을 전송합니다. 24 시간 후에 약물 선택에 적절한 항생제를 적용하십시오.
- 형질전환 기생충의 성장이 안정될 때까지 약물 선택적 압력을 유지한다.
- 녹아웃 집단으로부터 게놈 DNA를 정화하고 PCR에 의해 TgCPL 궤적에 피리메타민 저항 카세트의 통합을 확인한다. 확인된 후 섹션 3.4로 진행합니다. 그렇지 않은 경우, 기생충 형질 감염 및 약물 선택의 또 다른 라운드를 수행. 약물 내성 카세트의 정확한 통합을 검출할 수 없는 것은 일반적으로 표적 유전자가 필수적이거나 유전자 궤적이 접근할 수 없다는 것을 시사한다.
- 녹아웃 기생충의 복제
- 종자 296 웰 마이크로플레이트와 HFF 세포를 사용하여 기생충을 복제하기 1주동안 37°C 및 5%CO2에서 배양한다.
- 융합된 HF를 함유한 T25 플라스크에서 형질전환 기생충 의 인구의 ~0.3-0.4 mL를 통과하고 2 일 동안 성장시다. 돌연변이가 성장 결함을 보여주는 경우에 더 많은 기생충을 통과하는 것을 고려하십시오.
참고 : 최상의 수율과 생존력을 달성하기 위해 숙주 세포는 기생충에 의해 심하게 감염되며 대부분의 기생충은 세포 내 단계에서 유지됩니다. - 주사기 감염 숙주 세포 및 필터-1.3단계에서 언급한 바와 같이 갓 용해된 기생충을 정화한다. D10 배지에서 기생충을 다시 일시 중단하고 RT에서 10 분 동안 1,000 x g에서 회전시십시오.
- D10 배지의 10 mL에서 펠릿 기생충을 다시 중단하십시오.
- 기생충 농도를 결정하기 위해 혈청계를 사용하여 기생충을 계산합니다.
- 적절한 항생제로 보충된 D10 배지에서 10개의 기생충/mL에 농도를 가져오기 위해 2단계 희석을 실시한다. 일반적으로, 초기 기생충 재현탁액은 1,000 배에 의해 희석되고, 10 개의 기생충 /mL에 두 번째 희석이 뒤따릅니다.
- 96개의 웰 마이크로플레이트로부터 의 매립매이 매물을 흡입하여 HF를 함유하고 각 우물 내로 희석된 기생충의 150 μL을 접종하였다.
- 플라크 형성을 허용하기 위해 방해없이 7 일 동안 5 %CO2로 37 °C에서 플레이트를 배양하십시오. 형질전환 기생충이 성장 결함을 전시하는 경우에 잠복기는 더 길수 있습니다.
- 상 대비 현미경을 사용하여 플레이트를 스크리닝하고 단일 플라크를 포함하는 웰만 표시합니다.
- 콜로니 PCR을 수행하여 올바른 클론을 식별합니다.
- 파이펫 팁을 사용하여 각 우물의 바닥을 긁어 감염된 HFF 단층을 들어 올립니다.
- 1.5 mL 미세 원심 분리튜브로 잘 표시된 각 셀 재현탁액의 피펫 75 μL.
- RT에서 최대 속도로 10 분 동안 원심 분리 튜브. 조심스럽게 상퍼니제를 흡인하고 키트에 제공된 희석 완충제 및 DNA 방출 첨가제를 함유하는 용해 완충제의 10.25 μL에서 펠릿을 다시 일시중단한다(재료 표).
- RT에서 4 분 동안 샘플을 인큐베이션 한 다음 98 °C에서 2 분 동안 배양하십시오. 그 후, 샘플은 PCR용으로 사용하거나 사용 될 때까지 -20 °C에서 보관할 수 있습니다. 3세트의 PCR 반응은 약물 내성 카세트의 통합 및 관심 유전자의 손실을 테스트하기 위해 사용된다(도4A). PCR 반응 설정은 표 5를 참조하고 열전자전거 설정은 표 6을 참조하십시오.
- 올바른 클론을 식별하고 4개의 클론을 Confluent HF를 포함하는 T25 플라스크로 전송합니다.
- 개별 클론 이 숙주 세포를 용해 한 후, 추가 PCR 검증을 위해 게놈 DNA를 정화.
- 관심 있는 단백질을 인식하는 항체가 유효하다면, 표준 면역블롯팅 절차를 따라 올바른 톡소플라즈마 녹아웃에서 표적 단백질의 손실을 확인한다. TgCPL-결실돌연변이체를 스크리닝하기 위한 대표적인 이미지는 도 4B,C에도시되어 있다.
결과
그림 1은 RHΔku80::NLuc 변형률 및 두 배 시간에 대한 파생 계산에 대한 성장 곡선의 예를 나타낸다. 일반적으로, 분석은 루시퍼라아제 활성 판독값의 변이를 설명하기 위해 3개의 생물학적 복제각각에 대해 3개의 기술적 복제물에서 수행된다. 기생충 성장의 정규화된 배 변화를 계산하기 위해, 감염 후 24-96h에서 각 판독값은 4시간 후 감염 ?...
토론
++이 프로토콜은 세포내 톡소플라즈마 성장을 평가하고 기생충 성장에 대한 화학 화합물의 억제 효능을 평가하기 위한 루시퍼라제 기반 프로토콜을 설명합니다. 세포내 톡소플라즈마 성장을 측정하는 데 사용할 수 있는 기존 전략에 비해 이 방법은 높은 감도와 특이성을 나타낸다. 기생충 성장을 모니터링하는 동안, 명확한 96 웰 마이크로플레이트에서 모의 분석실험은 시험된 균주?...
공개
저자는 공개 할 것이 없다.
감사의 말
저자는 pSAG1-Cas9-sgRNA-TgUPRT 플라스미드 및 항 TgCPL 및 TgActin 항체를 공유해 준 시블리 박사와 카루더에게 감사를 표하고 싶습니다. 이 작품은 클렘슨 스타트업 기금 (Z.D.), 기사 기사단 눈 재단 소아 안과 경력 - 스타터 연구 보조금 (Z.D.), NIH COBRE 교부금 P20GM109094 (Z.D.에), 그리고 NIH R01AI143707 (Z.D.)의 파일럿 보조금에 의해 지원되었다. 기금 모금자는 연구 설계, 데이터 수집 및 분석, 출판 결정 또는 원고 준비에 아무런 역할을 하지 않았습니다.
자료
| Name | Company | Catalog Number | Comments |
| Agarose gel extraction kit | New England BioLabs | T1020L | |
| BamHI | New England BioLabs | R0316S | |
| Biotek Synergy H1 Hybrid Multi-Mode Microplate Reader | BioTek Instuments | ||
| BTX Gemini Twin Waveform Electroporation System | Harvard Apparatus | ||
| Chemically competent E. coli cells | New England BioLabs | C29871 | |
| CloneAmp HiFi PCR premix | Takara Bio | 639298 | |
| Coelenterazine h | Prolume | 301-10 hCTZ | |
| EcoRV | New England BioLabs | R3195S | |
| Phire Tissue Direct PCR Master Mix | Thermo Scientific | F170L | |
| Plasmid miniprep kit | Zymo Research | D4054 | |
| Q5 Site-Directed Mutagenesis kit | New England BioLabs | E0554S | |
| Software | |||
| Geneious software for sgRNA design (version: R11) | |||
| GraphPad Prism software (8th version) | |||
| SnapGene for molecular cloning (version: 4.2.11) |
참고문헌
- Blader, I. J., Coleman, B. I., Chen, C. T., Gubbels, M. J. Lytic Cycle of Toxoplasma gondii: 15 Years Later. Annual Review of Microbiology. 69 (1), 1-23 (2014).
- Jones, J. L., Kruszon-Moran, D., Rivera, H., Price, C., Wilkins, P. P. Toxoplasma gondii Seroprevalence in the United States 2009-2010 and Comparison with the Past Two Decades. The American Journal of Tropical Medicine and Hygiene. 90 (6), (2014).
- Kieffer, F., Wallon, M. Congenital toxoplasmosis. Handbook of Clinical Neurology. 112, 1099-1101 (2013).
- Hoffmann, S., Batz, M. B., Morris, G. J. Annual cost of illness and quality-adjusted life year losses in the United States due to 14 foodborne pathogens. Journal of Food Protection. 75 (7), 1292-1302 (2012).
- Dubey, J. Toxoplasmosis. Journal of the American Veterinary Medical Association. 205 (11), 1593-1598 (1994).
- Lindsay, D., Dubey, J. Toxoplasma gondii: the changing paradigm of congenital toxoplasmosis. Parasitology. 138 (14), 1-3 (2011).
- Deng, Y., Wu, T., Zhai, S., Li, C. Recent progress on anti-Toxoplasma drugs discovery: Design, synthesis and screening. European Journal of Medicinal Chemistry. 183, 111711 (2019).
- Butler, N. J., Furtado, J. M., Winthrop, K. L., Smith, J. R. Ocular toxoplasmosis II: clinical features, pathology and management. Clinical & Experimental Ophthalmology. 41 (1), 95-108 (2013).
- Pfefferko, E., Pfefferko, L. C. Specific Labeling of Intracellular Toxoplasma gondii with Uracil. Journal of Eukaryotic Microbiology. 24 (3), 449-453 (1977).
- Merli, A., Canessa, A., Melioli, G. Enzyme immunoassay for evaluation of Toxoplasma gondii growth in tissue culture. Journal of Clinical Microbiology. 21 (1), 88-91 (1985).
- Derouin, F., Chastang, C. Enzyme immunoassay to assess effect of antimicrobial agents on Toxoplasma gondii in tissue culture. Antimicrobial Agents and Chemotherapy. 32 (3), 303-307 (1988).
- McFadden, D., Seeber, F., Boothroyd, J. Use of Toxoplasma gondii expressing beta-galactosidase for colorimetric assessment of drug activity in vitro. Antimicrobial Agents and Chemotherapy. 41 (9), 1849-1853 (1997).
- Gubbels, M. J., Li, C., Striepen, B. High-Throughput Growth Assay for Toxoplasma gondii Using Yellow Fluorescent Protein. Antimicrobial Agents and Chemotherapy. 47 (1), 309-316 (2003).
- Touquet, B., et al. High-content imaging assay to evaluate Toxoplasma gondii infection and proliferation: A multiparametric assay to screen new compounds. PLoS ONE. 13 (8), e0201678 (2018).
- Thornton, L. B., et al. An ortholog of Plasmodium falciparum chloroquine resistance transporter (PfCRT) plays a key role in maintaining the integrity of the endolysosomal system in Toxoplasma gondii to facilitate host invasion. PLOS Pathogens. 15 (6), e1007775 (2019).
- Larson, E. T., et al. Toxoplasma gondii cathepsin L is the primary target of the invasion-inhibitory compound morpholinurea-leucyl-homophenyl-vinyl sulfone phenyl. The Journal of Biological Chemistry. 284 (39), 26839-26850 (2009).
- Dou, Z., McGovern, O. L., Cristina, M., Carruthers, V. B. Toxoplasma gondii Ingests and Digests Host Cytosolic Proteins. mBio. 5 (4), e01188-14 (2014).
- Cristina, M., et al. Toxoplasma depends on lysosomal consumption of autophagosomes for persistent infection. Nature Microbiology. 2, 17096 (2017).
- Parussini, F., Coppens, I., Shah, P. P., Diamond, S. L., Carruthers, V. B. Cathepsin L occupies a vacuolar compartment and is a protein maturase within the endo/exocytic system of Toxoplasma gondii. Molecular Microbiology. 76 (6), 1340-1357 (2010).
- Huynh, M. H., Carruthers, V. B. Tagging of endogenous genes in a Toxoplasma gondii strain lacking Ku80. Eukaryotic cell. 8 (4), 530-539 (2009).
- Fox, B. A., Ristuccia, J. G., Gigley, J. P., Bzik, D. J. Efficient gene replacements in Toxoplasma gondii strains deficient for nonhomologous end joining. Eukaryotic Cell. 8 (4), 520-529 (2009).
- Sidik, S. M., Hackett, C. G., Tran, F., Westwood, N. J., Lourido, S. Efficient Genome Engineering of Toxoplasma gondii Using CRISPR/Cas9. PLoS ONE. 9 (6), e100450 (2014).
- Shen, B., Brown, K. M., Lee, T. D., Sibley, D. L. Efficient Gene Disruption in Diverse Strains of Toxoplasma gondii Using CRISPR/CAS9. mBio. 5 (3), e01114-14 (2014).
- Radke, J. R., et al. Defining the cell cycle for the tachyzoite stage of Toxoplasma gondii. Molecular and Biochemical Parasitology. 115 (2), 165-175 (2001).
- Ran, A. F., et al. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8 (11), 2281-2308 (2013).
- Labun, K., Montague, T. G., Gagnon, J. A., Thyme, S. B., Valen, E. CHOPCHOP v2: a web tool for the next generation of CRISPR genome engineering. Nucleic Acids Research. 44 (W1), W272-W276 (2016).
- Heigwer, F., Kerr, G., Boutros, M. E-CRISP: fast CRISPR target site identification. Nature Methods. 11 (2), 2812 (2014).
- Peng, D., Tarleton, R. EuPaGDT: a web tool tailored to design CRISPR guide RNAs for eukaryotic pathogens. Microbial Genomics. 1 (4), e000033 (2015).
- Doench, J. G., et al. Rational design of highly active sgRNAs for CRISPR-Cas9-mediated gene inactivation. Nature Biotechnology. 32 (12), 1262-1267 (2014).
- Sidik, S. M., et al. A Genome-wide CRISPR Screen in Toxoplasma Identifies Essential Apicomplexan Genes. Cell. 166 (6), 1423-1435 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유